Typisch für Alkalimetalle. Welche Eigenschaften haben alkalische Elemente?
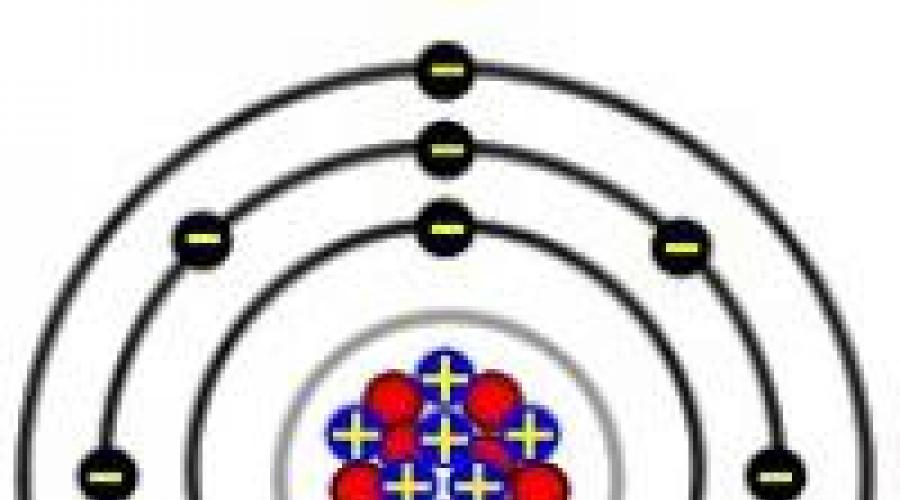
Alkali Metalle - gemeinsamen Namen Elemente der Gruppe 1 Periodensystem chemische Elemente. Seine Zusammensetzung ist: Lithium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Cäsium (Cs), Francium (Fr) und ein hypothetisches Element – Ununennium (Uue). Der Name der Gruppe leitet sich vom Namen löslicher Natrium- und Kaliumhydroxide ab, die alkalisch reagieren und schmecken. Lassen Sie uns überlegen Gemeinsamkeiten Struktur der Atome der Elemente, Eigenschaften, Herstellung und Verwendung einfacher Stoffe.
Veraltete und neue Gruppennummerierung
Nach dem veralteten Nummerierungssystem gehören die Alkalimetalle, die sich in der linken vertikalen Spalte des Periodensystems befinden, zur Gruppe I-A. Im Jahr 1989 schlug die Internationale Chemieunion (IUPAC) eine andere Option (Langzeitzeitraum) als Hauptoption vor. Alkalimetalle gehören gemäß der neuen Klassifizierung und fortlaufenden Nummerierung zur Gruppe 1. Dieser Komplex wird durch einen Vertreter der 2. Periode – Lithium – eröffnet und durch das radioaktive Element der 7. Periode – Francium – vervollständigt. Alle Metalle der Gruppe 1 enthalten ein s-Elektron in der äußeren Hülle ihrer Atome, das sie leicht abgeben (wiedergewinnen) können.
Struktur von Alkalimetallatomen
Elemente der Gruppe 1 zeichnen sich durch das Vorhandensein eines zweiten Energieniveaus aus, das die Struktur des vorherigen Inertgases wiederholt. Lithium hat in der vorletzten Schicht zwei Elektronen und in der übrigen Schicht acht Elektronen. IN chemische Reaktionen Atome geben ihr äußeres Elektron leicht ab und nehmen eine energetisch günstigere Edelgaskonfiguration an. Elemente der Gruppe 1 haben niedrige Ionisierungsenergien und Elektronegativität (EO). Sie bilden leicht einfach geladene positive Ionen. Beim Übergang von Lithium zu Francium nehmen die Anzahl der Protonen und Elektronen sowie der Radius des Atoms zu. Rubidium, Cäsium und Francium geben ihr äußeres Elektron leichter ab als die ihnen in der Gruppe vorangehenden Elemente. Folglich nimmt in der Gruppe von oben nach unten die Regenerationsfähigkeit zu.

Die leichte Oxidation von Alkalimetallen führt dazu, dass Elemente der Gruppe 1 in der Natur in Form von Verbindungen ihrer einfach geladenen Kationen vorkommen. Inhalt in Erdkruste Natrium – 2,0 %, Kalium – 1,1 %. Andere Elemente kommen in geringen Mengen vor, beispielsweise Franciumreserven - 340 g. Natriumchlorid wird in Meerwasser, Salzlake von Salzseen und Flussmündungen gelöst und bildet Ablagerungen von Stein- oder Speisesalz. Neben Halit kommt auch Sylvinit NaCl vor. KCl und Sylvit-KCl. Feldspat wird durch Kaliumaluminosilikat K2 gebildet. Natriumcarbonat ist im Wasser einer Reihe von Seen gelöst, und die Sulfatreserven des Elements sind in den Gewässern des Kaspischen Meeres (Kara-Bogaz-Gol) konzentriert. In Chile gibt es Vorkommen von Natriumnitrat (chilenischer Salpeter). Es gibt eine begrenzte Anzahl natürlich vorkommender Lithiumverbindungen. Rubidium und Cäsium kommen als Verunreinigungen in Verbindungen von Elementen der Gruppe 1 vor, Francium kommt in Uranerzen vor.
Reihenfolge der Entdeckung von Alkalimetallen
Der britische Chemiker und Physiker G. Davy führte 1807 die Elektrolyse von Alkalischmelzen durch und gewann dabei erstmals Natrium und Kalium in freier Form. 1817 entdeckte der schwedische Wissenschaftler Johann Arfvedson das Element Lithium in Mineralien und 1825 isolierte G. Davy das reine Metall. Rubidium wurde erstmals 1861 von R. Bunsen und G. Kirchhoff entdeckt. Deutsche Forscher analysierten die Zusammensetzung von Alumosilikaten und stellten im Spektrum eine rote Linie fest, die dem neuen Element entspricht. Im Jahr 1939 stellte Margarita Pere, eine Mitarbeiterin des Pariser Instituts für Radioaktivität, die Existenz des Francium-Isotops fest. Sie benannte das Element zu Ehren ihrer Heimat. Ununennium (eka-francium) ist der vorläufige Name einer neuen Atomart mit Seriennummer 119. Das chemische Symbol Uue wird vorübergehend verwendet. Seit 1985 versuchen Forscher, ein neues Element zu synthetisieren, das das erste in der 8. Periode und das siebte in der 1. Gruppe sein wird.
Physikalische Eigenschaften von Alkalimetallen

Fast alle Alkalimetalle haben im frischen Zustand eine silbrig-weiße Farbe und einen metallischen Glanz (Cäsium hat eine goldgelbe Farbe). An der Luft verblasst der Glanz und es bildet sich ein grauer Film; auf Lithium verfärbt er sich grünlich-schwarz. Dieses Metall weist unter seinen Nachbarn in der Gruppe die größte Härte auf, ist jedoch schlechter als Talk, dem weichsten Mineral auf der Mohs-Skala. Natrium und Kalium lassen sich leicht biegen und schneiden. Rubidium, Cäsium und Francium in reiner Form stellen eine teigartige Masse dar. Das Schmelzen von Alkalimetallen erfolgt bei relativ niedrigen Temperaturen. Für Lithium beträgt sie 180,54 °C. Natrium schmilzt bei einer Temperatur von 97,86 °C, Kalium – bei 63,51 °C, Rubidium – bei 39,32 °C, Cäsium – bei 28,44 °C. Die Dichte von Alkalimetallen ist geringer als die ihrer verwandten Stoffe. Lithium schwimmt im Kerosin, steigt an die Wasseroberfläche, auch Kalium und Natrium schwimmen darin.
Kristalliner Zustand
Die Kristallisation von Alkalimetallen erfolgt im kubischen System (raumzentriert). Die Atome in seiner Zusammensetzung verfügen über ein Leitungsband, zu dessen freien Ebenen sich Elektronen bewegen können. Es sind diese aktiven Partikel, die eine besondere chemische Bindung – metallisch – eingehen. Die gemeinsame Struktur der Energieniveaus und die Beschaffenheit der Kristallgitter erklären die Ähnlichkeit der Elemente der Gruppe 1. Beim Übergang von Lithium zu Cäsium nehmen die Atommassen der Elemente zu, was zu einer natürlichen Dichtezunahme sowie zu einer Änderung anderer Eigenschaften führt.
Chemische Eigenschaften von Alkalimetallen
Das einzige äußere Elektron in Alkalimetallatomen wird nur schwach vom Kern angezogen, daher zeichnen sie sich durch eine niedrige Ionisierungsenergie und eine negative oder nahezu Null-Elektronenaffinität aus. Elemente der Gruppe 1, die eine reduzierende Wirkung haben, sind praktisch nicht in der Lage zu oxidieren. In der Gruppe von oben nach unten nimmt die Aktivität bei chemischen Reaktionen zu:

Herstellung und Verwendung von Alkalimetallen
Metalle der Gruppe 1 werden industriell durch Elektrolyse von Schmelzen ihrer Halogenide und anderer natürlicher Verbindungen hergestellt. Bei der Zersetzung durch elektrischen Strom nehmen positive Ionen an der Kathode Elektronen auf und werden zu freiem Metall reduziert. An der Gegenelektrode wird das Anion oxidiert.

Bei der Elektrolyse schmilzt Hydroxid an der Anode, OH-Partikel werden oxidiert, Sauerstoff wird freigesetzt und Wasser entsteht. Eine weitere Methode ist die thermische Reduktion von Alkalimetallen aus Salzschmelzen mit Calcium. Einfache Stoffe und Verbindungen von Elementen der Gruppe 1 haben praktische Bedeutung. Lithium dient als Rohstoff in Kernenergie, verwendet in der Raketentechnik. In der Metallurgie wird es zur Entfernung von restlichem Wasserstoff, Stickstoff, Sauerstoff und Schwefel verwendet. Hydroxid wird zur Ergänzung des Elektrolyten in Alkalibatterien verwendet.

Natrium ist für Kernenergie, Metallurgie und organische Synthese notwendig. Bei der Herstellung von Solarzellen werden Cäsium und Rubidium verwendet. Hydroxide und Salze werden häufig verwendet, insbesondere Chloride, Nitrate, Sulfate und Carbonate von Alkalimetallen. Kationen haben biologische Aktivität Besonders wichtig für den menschlichen Körper sind Natrium- und Kaliumionen.
Alkalimetalle sind S-Elemente. In der äußeren Elektronenschicht hat jeder von ihnen ein Elektron (ns1). Die Radien der Atome von oben nach unten in der Untergruppe nehmen zu, die Ionisierungsenergie nimmt ab und die Reduktionsaktivität sowie die Fähigkeit, Valenzelektronen aus der äußeren Schicht abzugeben, nehmen zu.
Die betreffenden Metalle sind sehr aktiv und kommen daher in der Natur nicht in freiem Zustand vor. Sie kommen in Form von Verbindungen in Mineralien (Kochsalz NaCl, Sylvinit NaCl∙KCl, Glaubersalz NaSO4∙10H2O u. a.) oder als Ionen im Meerwasser vor.
Physikalische Eigenschaften von Alkalimetallen
Alle Alkalimetalle bei normale Bedingungen sind silberweiß kristalline Substanzen, mit hoher thermischer und elektrischer Leitfähigkeit. Sie verfügen über eine kubisch-raumzentrierte Packung (BCCP). Die Dichten, Siede- und Schmelzpunkte von Metallen der Gruppe I sind relativ niedrig. Von oben nach unten in der Untergruppe nehmen die Dichten zu und die Schmelztemperaturen ab.
Herstellung von Alkalimetallen
Alkalimetalle werden üblicherweise durch Elektrolyse geschmolzener Salze (meist Chloride) oder Alkalien gewonnen. Bei der Elektrolyse von NaCl-Schmelze wird beispielsweise an der Kathode reines Natrium und an der Anode Chlorgas freigesetzt: 2NaCl(Schmelze)=2Na+Cl2.
Chemische Eigenschaften von Alkalimetallen
In Bezug auf die chemischen Eigenschaften sind Lithium, Natrium, Kalium, Rubidium, Cäsium und Francium die aktivsten Metalle und eines der stärksten Reduktionsmittel. Bei Reaktionen geben sie leicht Elektronen aus der äußeren Schicht ab und verwandeln sich in positiv geladene Ionen. In durch Alkalimetalle gebildeten Verbindungen überwiegt die ionische Bindung.
Bei der Wechselwirkung von Alkalimetallen mit Sauerstoff entstehen als Hauptprodukt Peroxide und als Nebenprodukt Oxide:
4Na+O2=2Na2O (Natriumoxid).
Mit Halogenen ergeben sie Halogenide, mit Schwefel Sulfide, mit Wasserstoff Hydride:
2Na+Cl2=2NaCl (Natriumchlorid),
2Na+S=Na2S (Natriumsulfid),
2Na+H2=2NaH (Natriumhydrid).
Natriumhydrid ist eine instabile Verbindung. Es zersetzt sich mit Wasser unter Bildung von Alkali und freiem Wasserstoff:
NaH+H2O=NaOH+H2.
Freier Wasserstoff entsteht auch, wenn Alkalimetalle selbst mit Wasser interagieren:
2Na+2H2O=2NaOH+H2.
Diese Metalle reagieren auch mit verdünnten Säuren und verdrängen dabei Wasserstoff:
2Na+2HCl=2NaCl+H2.
Alkalimetalle reagieren mit organischen Halogeniden mithilfe der Wurtz-Reaktion.
Spezial (Korrektur)
allgemein bildende Schule– Internat für Blinde
und sehbehinderte Kinder in Perm
Zusammenfassung abgeschlossen
Schüler der 10. Klasse
Ponomarev Oleg,
Korschunow Artem
Aufsicht:
L. Yu. Sacharowa,
Chemielehrer
Dauerwelle
Einführung
Allgemeine Eigenschaften von Elementen der Gruppe I A-Gruppe
4 – 10
1.1. Geschichte der Entdeckung und Verbreitung von Alkalimetallen in der Natur
4 – 5
5 - 6
6 – 8
8 – 9
9 – 10
Biologische Rolle von Elementen der Gruppe I A-Gruppe. Ihre Verwendung in der Medizin
11 – 17
Eintrittswege von Alkalimetallen in den menschlichen Körper
18 – 21
22 – 23
Schlussfolgerungen
24 – 25
Gebrauchte Bücher
Einführung
Die Zeit ist längst gekommen, in der jeder an seine Gesundheit denken sollte und nicht nur an seine eigene. Das in der Schule erworbene Wissen, beispielsweise in der Chemie, nutzen wir nicht sehr oft. Alltagsleben. Dieses spezielle Thema kann jedoch zu einer Quelle des Wissens über unsere Gesundheit werden. Dank der Chemie erfahren wir, wie sich die Stoffe unseres Planeten auf die lebenswichtigen Prozesse des Körpers und allgemein des menschlichen Lebens selbst auswirken, was für uns in welchen Mengen nützlich ist und schließlich, was in welchem Ausmaß schädlich ist.
Der menschliche Körper ist ein komplexes chemisches System, das ohne Verbindung zur Umwelt nicht unabhängig funktionieren kann. Es ist erwiesen, dass fast alle chemischen Elemente in einem lebenden Organismus vorhanden sind: Einige sind Makroelemente, während der Gehalt anderer vernachlässigbar ist, das sind Mikroelemente. Die Art und Weise, wie Elemente in den Körper gelangen, ist unterschiedlich und ihr Einfluss auf den Körper ist unterschiedlich, aber jedes hat seine eigene Wirkung biologische Rolle.
Es ist unmöglich, die Bedeutung jedes Elements im Rahmen einer einzigen Arbeit zu untersuchen. Wir haben die allererste Gruppe chemischer Elemente des Periodensystems von D. I. Mendelejew ausgewählt.
Ziel dieser Studie – Untersuchen Sie die biologische Rolle von Alkalimetallen für den menschlichen Körper.
In diesem Zusammenhang haben wir uns entschieden, für jedes Metall der Gruppe IA folgende Fragen zu klären:
allgemeine Eigenschaften und Strukturmerkmale der Atome jedes Elements sowie die Eigenschaften der von ihnen gebildeten Stoffe;
Vorhandensein des Elements im Körper;
die Bedürfnisse des Körpers danach;
die Auswirkung von Überschuss und Mangel des Elements auf die menschliche Gesundheit;
natürliche Quellen;
Methoden zum Erkennen eines Elements.
1. Allgemeine Eigenschaften von Elementen der Gruppe I A-Gruppe
Zeitraum
Gruppe
IN Zur A-Gruppe gehören S-Elemente – Alkalimetalle, die für das normale Leben von Tieren und Menschen äußerst wichtig sind. Höchster Wert Denn Lebewesen verfügen über die Makroelemente Natrium und Kalium.
3Li
11 Na
19K
37 Rubel
55 Cs
87 Fr
1.1. Entdeckungs- und Verbreitungsgeschichte in der Natur
Alkali Metalle
Der Name „Alkalimetalle“ ist darauf zurückzuführen, dass die Hydroxide der beiden Hauptvertreter dieser Gruppe – Natrium und Kalium – seit langem als Alkalien bezeichnet werden. G. Davy stellte diese Alkalien 1807 her, indem er sie in geschmolzenem Zustand einer Elektrolyse unterzog zum ersten Mal kostenloses Kalium und Natrium erhalten. J. Berzelius schlug vor, das Element Nr. 11 Natrium (aus dem Arabischen) zu nennen Natrun- Soda) und Element Nr. 19 wurde auf Gilberts Vorschlag Kalium genannt (aus dem Arabischen). Alkali– Alkali).
Die restlichen Metalle wurden später von Wissenschaftlern aus den Verbindungen isoliert. Lithium wurde 1817 vom schwedischen Chemiker I. Arfvedson entdeckt und auf Vorschlag von J. Berzelius Lithium (aus dem Griechischen) genannt litos- Stein), weil Im Gegensatz zu Kalium, das bis dahin nur in Pflanzenaschen zu finden war, wurde es in Stein gefunden.
Rubidium wurde 1861 isoliert, Cäsium 1860. Francium wurde 1939 künstlich gewonnen. Der französische Forscher M. Pere entdeckte beim Zerfall von Aktinium ein radioaktives Element.
Aufgrund ihrer sehr leichten Oxidation kommen Alkalimetalle in der Natur ausschließlich in Form von Verbindungen vor. Einige ihrer natürlichen Verbindungen, insbesondere Natrium- und Kaliumsalze, sind weit verbreitet und kommen in vielen Mineralien, Pflanzen und natürlichen Gewässern vor.
Natrium und Kalium sind gemeinsame Elemente: Der Gehalt jedes dieser Elemente in der Erdkruste beträgt etwa 2 Gew.-%. Beide Metalle kommen in verschiedenen Mineralien und silikatartigen Baugesteinen vor.
Natriumchlorid NaCl kommt im Meerwasser vor und bildet an vielen Orten auf der Welt auch dicke Steinsalzablagerungen. IN obere Schichten Diese Lagerstätten enthalten teilweise recht erhebliche Mengen Kalium, hauptsächlich in Form von Chlorid KCl oder Doppelsalzen mit Natrium und Magnesium KCl ∙MgCl 2. Große Ansammlungen von Kaliumsalzen von industrieller Bedeutung sind jedoch selten. Die wichtigsten davon sind die Solikamsker Lagerstätten (Sylvinit) in Russland, die Straßfurter Lagerstätten in Deutschland und die elsässischen Lagerstätten in Frankreich.
Vorkommen von Natriumnitrat NaNO 3 befinden sich in Chile. Das Wasser vieler Seen enthält Na 2 CO 3 Soda. Schließlich findet man in der Kara-Bogaz-Gol-Bucht des Kaspischen Meeres große Mengen Natriumsulfat Na 2 SO 4, wo sich dieses Salz in den Wintermonaten in einer dicken Schicht am Boden ablagert.
Lithium, Rubidium und Cäsium kommen deutlich seltener vor als Natrium und Kalium. Lithium kommt am häufigsten vor, Mineralien, die es enthalten, bilden jedoch selten große Ansammlungen. Rubidium und Cäsium kommen in geringen Mengen in einigen Lithiummineralien vor.
Francium kommt in der Natur in unbedeutenden Mengen vor (es gibt kaum 500 g davon auf der ganzen Welt); es wird künstlich gewonnen.
1.2. Struktur und Eigenschaften von Alkalimetallatomen
Die elektronische Formel der Valenzschale von Alkalimetallatomen lautet ns 1, d.h. Die Atome dieser Elemente besitzen jeweils ein Valenzelektron in der s-Unterebene des äußeren Energieniveaus. Dementsprechend beträgt die stabile Oxidationsstufe von Alkalimetallen +1.
Alle Elemente der IA-Gruppe sind in ihren Eigenschaften sehr ähnlich, was durch die ähnliche Struktur nicht nur der Valenzelektronenhülle, sondern auch der äußeren (mit Ausnahme von Lithium) erklärt wird.
Wenn der Radius eines Atoms in der Gruppe Li – Na – K – Rb – Cs – Fr zunimmt, wird die Bindung zwischen dem Valenzelektron und dem Kern schwächer. Dementsprechend nimmt in dieser Reihe die Ionisierungsenergie der Alkalimetallatome ab.
Mit einem Elektron in ihrer Valenzschale, die sich in großer Entfernung vom Kern befindet, geben Alkalimetallatome leicht ein Elektron ab. Dies führt zu einer geringen Ionisierungsenergie. Durch die Ionisation entstehen E+-Kationen, die eine stabile elektronische Konfiguration von Edelgasatomen aufweisen.
Die Tabelle zeigt einige Eigenschaften von Alkalimetallatomen.
Charakteristisch
3 Li
11 N / A
1 9K
37 Rubel
55 Cs
87 Fr
Valenzelektronen
2s 1
3s 1
4s 1
5s 1
6s 1
7s 1
Molmasse, g/mol
23,0
39,1
85,5
132,9
Metallischer Radius eines Atoms, pm
Kristallradius eines Atoms, pm
Ionisationsenergie,
kJ/mol
Alkalimetalle sind die typischsten Vertreter der Metalle: Ihre metallischen Eigenschaften sind besonders ausgeprägt.
1.3. Alkalimetalle sind einfache Stoffe
Silbrig-weiße Weichsubstanzen (mit einem Messer geschnitten), mit charakteristischem Glanz auf der frisch geschnittenen Oberfläche. An der Luft wird die glänzende Oberfläche des Metalls durch Oxidation sofort matt.
Alle von ihnen sind leicht und schmelzbar, und in der Regel nimmt ihre Dichte von Li zu Cs zu, während der Schmelzpunkt im Gegenteil abnimmt.
Charakteristisch
Li
N / A
K
Rb
Cs
Fr
Dichte, g/cm 3
0,53
0,97
0,86
1,53
Härte (Diamant = 10)
Elektrische Leitfähigkeit (Hg = 1)
11,2
13,6
Schmelzpunkt, C
Siedepunkt, C
1350
Standardelektrodenpotential, V
3,05
2,71
2,92
2,93
2,92
Koordinationsnummer
4, 6
4, 6
6, 8
Alle Alkalimetalle haben negative Standard-Redoxpotentiale, die groß sind Absolutwert. Dies zeichnet sie als sehr starke Reduktionsmittel aus. Lediglich Lithium ist vielen Metallen in der chemischen Aktivität etwas unterlegen.
Trotz der Ähnlichkeit der Eigenschaften unterscheiden sich Natrium und insbesondere Lithium von anderen Alkalimetallen. Letzteres ist vor allem auf den deutlichen Unterschied in den Radien ihrer Atome und der Struktur der Elektronenhüllen zurückzuführen.
Alkalimetalle gehören zu den chemisch aktivsten Elementen. Die chemische Aktivität von Alkalimetallen nimmt natürlicherweise mit zunehmendem Atomradius zu.
Li Na K Rb Cs Fr
Die chemische Aktivität nimmt zu
Der Radius des Atoms vergrößert sich
Alkalimetalle interagieren aktiv mit fast allen Nichtmetallen.
Bei der Interaktion mit Sauerstoff Lithium bildet das Oxid Li 2 O und die restlichen Alkalimetalle bilden Peroxide Na 2 O 2 und Superoxide KO 2, RbO 2, CsO 2. Zum Beispiel:
4Li (t) + O 2 (g) = 2Li 2 O (t)
2Na (t) + O 2 (g) = Na 2 O 2 (t)
K (t) + O 2 (g) = KO 2 (t)
Alkalimetalle reagieren aktiv mit Halogenen, Bildung von EG-Halogeniden; mit Schwefel- unter Bildung von E 2 S-Sulfiden. Alkalimetalle, mit Ausnahme von Lithium, reagieren nicht direkt mit Stickstoff.
2E(t) + Cl 2 (g) = 2ECl (t)
2E(t) + S (t) = E 2 S (t)
Alle Alkalimetalle reagieren direkt mit Wasser, Bildung von EON-Hydroxiden - Alkalien und Reduktion von Wasser zu Wasserstoff:
2E (t) + 2H 2 O (l) = 2EON (r) + H 2 (g)
Die Intensität der Wechselwirkung mit Wasser nimmt in der Li-Cs-Reihe deutlich zu.
Die Reduktionskraft von Alkalimetallen ist so groß, dass sie sogar Wasserstoffatome reduzieren und sie in negativ geladene H-Ionen umwandeln können. So beim Erhitzen von Alkalimetallen im Strahl Wasserstoff ihre Hydride werden beispielsweise erhalten:
2E(t) + N 2 (g) = 2EN
1.4. Anwendung von Alkalimetallen
Alkalimetalle und ihre Verbindungen werden in der Technik häufig eingesetzt.
Lithium wird verwendet in Kernenergie. Insbesondere das 6-Li-Isotop dient als industrielle Quelle für die Produktion von Tritium und das 7-Li-Isotop wird als Kühlmittel in Uranreaktoren verwendet. Aufgrund der Fähigkeit von Lithium, sich leicht mit Wasserstoff, Stickstoff, Sauerstoff und Schwefel zu verbinden, wird es in der Metallurgie verwendet, um Spuren dieser Elemente aus Metallen und Legierungen zu entfernen.
Lithium und seine Verbindungen werden auch als Treibstoff für Raketen verwendet. Schmierstoffe, die Lithiumverbindungen enthalten, behalten ihre Eigenschaften über einen weiten Temperaturbereich. Lithium wird in der Keramik-, Glas- und anderen chemischen Industrie verwendet. Im Allgemeinen in Bezug auf die Bedeutung in Moderne Technologie Dieses Metall ist eines der wichtigsten seltenen Elemente.
Cäsium und Rubidium werden zur Herstellung von Solarzellen verwendet. Diese Geräte, die Strahlungsenergie in elektrische Stromenergie umwandeln und auf dem Phänomen des photoelektrischen Effekts basieren, nutzen die Fähigkeit von Cäsium- und Rubidiumatomen, Valenzelektronen abzuspalten, wenn sie Strahlungsenergie auf dem Metall ausgesetzt werden.
Die wichtigsten Anwendungsgebiete von Natrium sind die Kernenergie, die Metallurgie und die organische Syntheseindustrie.
In der Kernenergie werden Natrium und seine Legierung mit Kalium als flüssige Metallkühlmittel verwendet. Die Natrium-Kalium-Legierung, die 77,2 % Kalium enthält, liegt über einen weiten Temperaturbereich in flüssigem Zustand vor, hat einen hohen Wärmeübergangskoeffizienten und interagiert nicht mit den meisten Strukturmaterialien.
In der Metallurgie werden zahlreiche Refraktärmetalle mit dem Natriumthermoverfahren gewonnen. Darüber hinaus wird Natrium als Zusatz zur Verstärkung von Bleilegierungen verwendet.
In der organischen Syntheseindustrie wird Natrium zur Herstellung vieler Stoffe verwendet. Es dient auch als Katalysator bei der Herstellung einiger organischer Polymere.
Kalium ist eines der Elemente, die in erheblichen Mengen für die Pflanzenernährung benötigt werden. Obwohl sich im Boden recht viele Kaliumsalze befinden, werden einige davon auch mitgerissen Kulturpflanzen auch viel. Besonders viel Kalium transportieren Flachs, Hanf und Tabak. Um den Kaliumverlust aus dem Boden auszugleichen, ist es notwendig, dem Boden Kaliumdünger zuzusetzen.
1.5. Alkalimetallverbindungen
Oxide E 2 UM- Feststoffe. Sie haben ausgeprägte basische Eigenschaften: Sie interagieren mit Wasser, Säuren und Säureoxiden. Zum Beispiel:
E 2 O(t) + H 2 O(l) = 2EON (p)
Peroxide und Superoxide E 2 UM 2 und EO 2 Alkalimetalle sind starke Oxidationsmittel. Natriumperoxid und Kaliumsuperoxid werden in geschlossenen Objekten (U-Boote, Raumschiffe), um Kohlendioxid zu absorbieren und Sauerstoff zu regenerieren:
2Na 2 O 2 (t) + 2CO 2 (g) = 2Na 2 CO 3 (t) + O 2 (g)
4KO 2 (t) + 2CO 2 (g) = 2K 2 CO 3 (t) + 3O 2 (g)
Natriumperoxid wird auch zum Bleichen von Stoffen, Wolle, Seide usw. verwendet.
Alkalien– feste, weiße, sehr hygroskopische kristalline Substanzen, relativ schmelzbar und gut wasserlöslich (mit Ausnahme von LiOH). Feste Laugen und ihre konzentrierten Lösungen wirken aufgrund der Dehydrierung und alkalischen Hydrolyse von Proteinen korrosiv auf Stoffe, Papier und lebendes Gewebe. Daher sind bei der Arbeit mit ihnen Schutzmaßnahmen erforderlich. Aufgrund ihrer stark ätzenden Wirkung werden diese Alkalien als Laugen bezeichnet (NaOH – Natronlauge, Ätznatron, KOH – Ätzkalium).
Alkalien lösen sich gut in Wasser unter Freisetzung großer Wärmemengen und weisen ausgeprägte Eigenschaften stark löslicher Basen auf: Sie interagieren mit Säuren, Säureoxiden, Salzen, amphoteren Oxiden und Hydroxiden.
Natronlauge wird in großen Mengen zur Reinigung von Erdölprodukten verwendet. in der Papier- und Textilindustrie, zur Herstellung von Seife und Fasern.
Ätzkalium ist teurer und wird seltener verwendet. Sein Haupteinsatzgebiet ist die Produktion Flüssigseife.
Alkalimetallsalze– feste kristalline Substanzen mit ionischer Struktur. Die wichtigsten davon sind Carbonate, Sulfate und Chloride.
Die meisten Alkalimetallsalze sind in Wasser gut löslich (mit Ausnahme der Lithiumsalze: Li 2 CO 3, LiF, Li 3 PO 4).
Mit mehrbasigen Säuren bilden Alkalimetalle sowohl mittlere (E 2 SO 4, E 3 PO 4, E 2 CO 3, E 2 SO 3 usw.) als auch saure (ENSO 4, EN 2 PO 4, E 2 NPO 4, ENSO). 3 usw.) Salze.
Na 2 CO 3 – Natriumcarbonat, bildet das kristalline Hydrat Na 2 CO 3 ∙10H 2 CO 3, bekannt als kristallines Soda, das bei der Herstellung von Glas, Papier und Seife verwendet wird. Das ist mittleres Salz.
Das im Alltag bekanntere saure Salz ist Natriumbicarbonat NaHCO 3; es wird in der Lebensmittelindustrie (Backpulver) und in der Medizin (Backpulver) verwendet.
K 2 CO 3 – Kaliumcarbonat, technischer Name – Kali, wird zur Herstellung von Flüssigseife und zur Herstellung von feuerfestem Glas sowie als Düngemittel verwendet.
Na 2 SO 4 ∙10H 2 O – kristallines Natriumsulfathydrat, technischer Name Glaubersalz, wird zur Herstellung von Soda und Glas sowie als Abführmittel verwendet.
NaCl – Natriumchlorid oder Speisesalz ist der wichtigste Rohstoff der chemischen Industrie und wird im Alltag häufig verwendet.

2. Biologische Rolle von S-Elementen der Gruppe IA. Ihre Verwendung in der Medizin
Chemisches Element, E
10 -4 %
0,08%
0,23%
10 -5 %
10 -4 %
Alkalimetalle sind in Form verschiedener Verbindungen Bestandteil menschlicher und tierischer Gewebe.
Natrium und Kalium sind lebenswichtige Elemente, die ständig im Körper vorhanden sind und am Stoffwechsel beteiligt sind. Lithium, Rubidium und Cäsium sind ebenfalls ständig im Körper enthalten, ihre physiologische und biochemische Rolle ist jedoch kaum bekannt. Sie können den Spurenelementen zugerechnet werden.
Im menschlichen Körper kommen Alkalimetalle in Form des E+-Kations vor.
Ähnlichkeiten elektronische Struktur Alkalimetallionen und folglich physikalische und chemische Eigenschaften Verbindungen werden auch durch die Nähe ihrer Wirkung auf biologische Prozesse bestimmt. Unterschiede in der elektronischen Struktur bestimmen ihre unterschiedlichen biologischen Rollen. Auf dieser Grundlage ist es möglich, das Verhalten von Alkalimetallen in lebenden Organismen vorherzusagen.
So reichern sich Natrium und Lithium in der extrazellulären Flüssigkeit an und Kalium, Rubidium und Cäsium reichern sich in der intrazellulären Flüssigkeit an. Lithium und Natrium liegen in ihrer biologischen Wirkung besonders nahe beieinander. Beispielsweise sind sie sich in ihren enzymaktivierenden Eigenschaften sehr ähnlich.
Die Ähnlichkeit der Eigenschaften von Natrium und Lithium bestimmt ihre Austauschbarkeit im Körper. In dieser Hinsicht können sie sich bei übermäßiger Einführung von Natrium- oder Lithiumionen in den Körper gegenseitig gleichwertig ersetzen. Dies ist die Grundlage für die Gabe von Natriumchlorid bei einer Lithiumsalzvergiftung. Nach dem Prinzip von Le Chatelier verschiebt sich das Gleichgewicht zwischen Natrium- und Lithiumionen im Körper in Richtung der Ausscheidung von Li+-Ionen, was zu einer Verringerung ihrer Konzentration und dem Erreichen einer therapeutischen Wirkung führt.
Rubidium und Cäsium ähneln in ihren physikalischen und chemischen Eigenschaften den Kaliumionen und verhalten sich daher in lebenden Organismen ähnlich. In den untersuchten Systemen sind Kalium, Rubidium und Cäsium Synergisten und mit Lithium Antagonisten. Die Ähnlichkeit von Rubidium und Kalium ist die Grundlage für die Einführung von Kaliumsalzen in den Körper bei einer Vergiftung mit Rubidiumsalzen.
Natrium und Kalium sind in der Regel Antagonisten, aber in einigen Fällen bestimmt die Ähnlichkeit vieler physikalisch-chemischer Eigenschaften ihren Austausch in lebenden Organismen. Wenn beispielsweise die Natriummenge im Körper zunimmt, nimmt die Ausscheidung von Kalium über die Nieren zu, d. h. es kommt zu einer Hypokaliämie.
Lithium. Der Lithiumgehalt im menschlichen Körper beträgt etwa 70 mg (10 mmol). Lithium ist eines der wertvollsten Mikroelemente oder, wie man es auch nennt, Minimetalle. Lithium wurde einst zur Behandlung von Gicht und Ekzemen eingesetzt. Und im Jahr 1971 In der Zeitschrift „Medical News“ erschien eine interessante Meldung: In den Bereichen, in denen in Wasser trinken enthalten große Menge Lithium, die Menschen sind freundlicher und ruhiger, unter ihnen gibt es weniger unhöfliche Menschen und Streitereien, deutlich weniger Geisteskrankheit. Die psychotropen Eigenschaften dieses Metalls wurden enthüllt. Lithium wurde erstmals gegen Depressionen, Hypochondrie, Aggressivität und sogar Drogenabhängigkeit eingesetzt.
Allerdings kann Lithium sowohl „gut“ als auch „böse“ sein. Es gab Fälle, in denen während der Injektionsbehandlung mit Lithium eine schwere Stoffwechselstörung auftrat, deren schwerwiegende Folgen unvermeidlich waren.
Lithiumverbindungen sind bei höheren Tieren in Leber, Nieren, Milz, Lunge, Blut und Milch konzentriert. Die maximale Menge an Lithium kommt in den menschlichen Muskeln vor. Die biologische Rolle von Lithium als Spurenelement ist noch nicht vollständig geklärt.
Das ist auf der Ebene bewiesen Zellmembranen Lithiumionen konkurrieren mit Natriumionen darum, in Zellen einzudringen. Offensichtlich ist der Ersatz von Natriumionen in Zellen durch Lithiumionen mit einer größeren Kovalenz von Lithiumverbindungen verbunden, wodurch diese besser in Phospholipiden löslich sind.
Es wurde festgestellt, dass einige Lithiumverbindungen eine positive Wirkung auf Patienten mit manischer Depression haben. Aussaugen Magen-Darmtrakt, reichern sich Lithiumionen im Blut an. Wenn die Lithiumionenkonzentration 0,6 mmol/l und mehr erreicht, kommt es zu einem Rückgang der emotionalen Spannung und einer Abschwächung der manischen Erregung. Allerdings muss der Gehalt an Lithiumionen im Blutplasma streng kontrolliert werden. In Fällen, in denen die Konzentration von Lithiumionen 1,6 mmol/l übersteigt, sind negative Phänomene möglich.
Mittlerweile ist bekannt, dass Lithium neben seiner psychotropen Wirkung auch Eigenschaften zur Vorbeugung von Sklerose, Herzerkrankungen und in gewissem Maße auch Diabetes und Bluthochdruck besitzt. Es „hilft“ Magnesium bei seinem antisklerotischen Schutz.
Ende 1977 Die Ergebnisse der an der Krakauer Hämatologieklinik durchgeführten Studien wurden veröffentlicht. Die Studien widmeten sich dem Einfluss von Lithium auf das hämatopoetische System. Es stellte sich heraus, dass dieses Mikroelement die Wirkung noch nicht abgestorbener Knochenmarkszellen aktiviert. Die gemachte Entdeckung kann spielen wichtige Rolle im Kampf gegen Blutkrebs. Die Forschung ist noch im Gange. Ich möchte glauben, dass ihre Ergebnisse den Menschen unschätzbare Hilfe bringen werden.
Natrium. Der Natriumgehalt im menschlichen Körper mit einem Gewicht von 70 kg beträgt etwa 60 g (2610 mmol). Davon befinden sich 44 % des Natriums in der extrazellulären Flüssigkeit und 9 % in der intrazellulären Flüssigkeit.
Die verbleibende Natriummenge befindet sich im Knochengewebe, wo sich die Na+-Ionen im Körper ablagern. Etwa 40 % des im Knochengewebe enthaltenen Natriums sind an Stoffwechselprozessen beteiligt. Aus diesem Grund ist das Skelett entweder ein Spender oder ein Empfänger von Natriumionen, was dazu beiträgt, eine konstante Konzentration von Natriumionen in der extrazellulären Flüssigkeit aufrechtzuerhalten.
Natrium ist das wichtigste extrazelluläre Ion. Der menschliche Körper enthält Natrium in Form seiner löslichen Salze, hauptsächlich NaCl-Chlorid, Na 3 PO 4 Phosphat und NaHCO 3 Bicarbonat.
Natrium verteilt sich im ganzen Körper: im Blutserum, in der Liquor cerebrospinalis, Augenflüssigkeit, Verdauungssäfte, Galle, Nieren, Haut, Knochengewebe, Lunge, Gehirn.
Natriumionen spielen eine wichtige Rolle bei der Konsistenzsicherung interne Umgebung des menschlichen Körpers, beteiligt sich an der Aufrechterhaltung eines konstanten osmotischen Drucks der Bioflüssigkeit und sorgt für das Säure-Basen-Gleichgewicht des Körpers. Natriumionen sind an der Regulierung des Ionenaustauschs beteiligt und beeinflussen die Funktion von Enzymen. Zusammen mit Kalium-, Magnesium-, Kalzium- und Chlorionen sind Natriumionen an der Übertragung von Nervenimpulsen durch Membranen beteiligt Nervenzellen und erhält die normale Erregbarkeit der Muskelzellen aufrecht.
Wenn sich der Natriumgehalt im Körper ändert, kommt es zu Funktionsstörungen des Nerven-, Herz-Kreislauf- und anderen Systems, glatt und Skelettmuskeln. Natriumchlorid NaCl dient als Hauptquelle für Salzsäure für den Magensaft.
Natrium gelangt hauptsächlich in Form von Kochsalz NaCl in den menschlichen Körper. Der tatsächliche tägliche Bedarf des Körpers an Natrium beträgt 1 g, obwohl der durchschnittliche Verbrauch dieses Elements 4 bis 7 g beträgt.
Ein kontinuierlicher übermäßiger Konsum von NaCl trägt zum Auftreten von Bluthochdruck bei. Im Organismus gesunde Person Es wird ein Gleichgewicht zwischen aufgenommener und ausgeschiedener Natriummenge aufrechterhalten. Etwa 90 % des aufgenommenen Natriums werden über den Urin ausgeschieden, der Rest über Schweiß und Kot.
Zusammenfassend lässt sich sagen: Natriumionen spielen eine wichtige Rolle:
um die osmotische Homöostase sicherzustellen
um das Säure-Basen-Gleichgewicht des Körpers sicherzustellen
bei der Regulierung des Wasserstoffwechsels
bei der Arbeit von Enzymen
bei der Übertragung von Nervenimpulsen
bei der Arbeit der Muskelzellen
Isotonische LösungNaCI (0,9%) Zur Injektion wird es subkutan, intravenös und in Einläufen bei Dehydrierung und Vergiftung verabreicht und wird auch zum Waschen von Wunden, Augen, Nasenschleimhäuten sowie zum Auflösen verschiedener Medikamente verwendet.
Hypertonische LösungenNaCI (3-5-10%) Äußerlich in Form von Kompressen und Lotionen zur Behandlung eitriger Wunden eingesetzt. Die Verwendung solcher Kompressen fördert durch das Osmosegesetz die Absonderung von Eiter aus Wunden und die Plasmolyse von Bakterien (antimikrobielle Wirkung). Bei einer AgNO 3 -Vergiftung wird zur Magenspülung eine 2-5 %ige NaCl-Lösung oral verordnet, die in schwerlösliches und ungiftiges Silberchlorid umgewandelt wird:
Ag + + CI - = AgCI (t)
Soda trinken(Natriumbicarbonat, Natron) NaHCO 3 wird verwendet für verschiedene Krankheiten begleitet von erhöhtem Säuregehalt - Azidose (Diabetes usw.). Der Mechanismus zur Reduzierung des Säuregehalts ist die Wechselwirkung von NaHCO 3 mit sauren Produkten. Dabei entstehen Natriumsalze organischer Säuren, die größtenteils mit dem Urin ausgeschieden werden Kohlendioxid Verlassen des Körpers mit der ausgeatmeten Luft:
NaHCO3 (p) + RCOOH (p) → RCOONa(p) + H 2 O(l) + CO 2 (g)
NaHCO 3 wird auch bei erhöhtem Säuregehalt des Magensaftes sowie bei Magen- und Zwölffingerdarmgeschwüren eingesetzt. Bei der Einnahme von NaHCO 3 kommt es zu einer Neutralisationsreaktion überschüssiger Salzsäure:
NaHCO 3 (s) + HCl (s) = NaCl (s) + H 2 O (l) + CO 2 (g)
Es ist zu beachten, dass bei der Verwendung von Backpulver Vorsicht geboten ist, denn... kann eine Reihe von Nebenwirkungen verursachen.
Natronlösungen werden als Spülungen und Spülungen bei entzündlichen Erkrankungen der Augen und der Schleimhäute der oberen Atemwege eingesetzt. Die Wirkung von NaHCO 3 als Antiseptikum beruht darauf, dass eine wässrige Sodalösung durch Hydrolyse leicht alkalische Eigenschaften aufweist:
NaHCO 3 + H 2 O ↔ NaOH + H 2 CO 3
Wenn mikrobielle Zellen Alkalien ausgesetzt werden, kommt es zur Ausfällung zellulärer Proteine und in der Folge zum Absterben von Mikroorganismen.
Glaubersalz(Natriumsulfat) Na 2 SO 4 ∙10H 2 O wird als Abführmittel verwendet. Dieses Salz wird langsam aus dem Darm absorbiert, was zur Aufrechterhaltung eines erhöhten osmotischen Drucks in der Darmhöhle über einen langen Zeitraum führt. Durch die Osmose sammelt sich Wasser im Darm an, sein Inhalt verflüssigt sich, die Darmkontraktionen verstärken sich und der Kot wird schneller ausgeschieden.
Borax(Natriumtetraborat) Na 2 B 4 O 7 ∙10H 2 O wird äußerlich als Antiseptikum zum Spülen, Duschen und Schmieren verwendet. Die antiseptische Wirkung von Borax ähnelt der Wirkung von Backpulver und ist mit der alkalischen Reaktion der wässrigen Lösung dieses Salzes sowie mit der Bildung verbunden Borsäure:
Na 2 B 4 O 7 + 7H 2 O ↔ 4H 3 BO 3 + 2NaOH
Natriumhydroxid In Form einer 10 %igen NaOH-Lösung ist es in der Zusammensetzung von Silan enthalten, das in der orthopädischen Praxis zum Gießen feuerbeständiger Modelle bei der Herstellung fester Prothesen aus einer Kobalt-Chrom-Legierung verwendet wird.
Radioaktives Isotop 24 Na wird als Tracer zur Bestimmung der Blutflussgeschwindigkeit verwendet und wird auch zur Behandlung einiger Formen von Leukämie eingesetzt.
Kalium. Der Kaliumgehalt im menschlichen Körper mit einem Gewicht von 70 kg beträgt etwa 160 g (4090 mmol). Kalium ist das wichtigste intrazelluläre Kation und macht 2/3 der gesamten aktiven zellulären Kationen aus. In den meisten Fällen ist Kalium ein Antagonist von Natrium.
Von der gesamten im Körper enthaltenen Kaliummenge befinden sich 98 % in den Zellen und nur etwa 2 % in der extrazellulären Flüssigkeit. Kalium verteilt sich im ganzen Körper. Seine Topographie: Leber, Nieren, Herz, Knochengewebe, Muskeln, Blut, Gehirn usw.
Kaliumionen K+ spielen dabei eine wichtige Rolle physiologische Prozesse:
Muskelkontraktion
bei der normalen Funktion des Herzens
ist an der Übertragung von Nervenimpulsen beteiligt
in Austauschreaktionen
aktiviert die Arbeit einer Reihe von Enzymen im Inneren der Zelle
reguliert den Säure-Basen-Haushalt
Es hat schützende Eigenschaften gegen die unerwünschten Auswirkungen von überschüssigem Natrium und normalisiert den Blutdruck. Im Körper von Menschen, die viel kaliumreiches Gemüse essen – Vegetarier – sind die Mengen an Kalium und Natrium im Gleichgewicht. Diese Menschen haben am häufigsten einen niedrigeren Blutdruck als ihre fleischliebenden Mitbürger.
Hat eine antisklerotische Wirkung
Kalium hat die Fähigkeit, die Urinbildung zu fördern
Ein Erwachsener nimmt normalerweise 2–3 g Kalium pro Tag mit der Nahrung auf. Die Konzentration von Kaliumionen in extrazellulärer Flüssigkeit, einschließlich Plasma, beträgt normalerweise 3,5–5,5 mmol/l und die Konzentration von intrazellulärem Kalium beträgt 115–125 mmol/l.
Rubidium und Cäsium. Aufgrund ihres Gehalts im menschlichen Körper werden Rubidium und Cäsium als Mikroelemente eingestuft. Sie sind ständig im Körper enthalten, ihre biologische Rolle ist jedoch noch nicht geklärt.
Rubidium und Cäsium kommen in allen untersuchten Organen von Säugetieren und Menschen vor. Wenn sie mit der Nahrung in den Körper gelangen, werden sie schnell vom Magen-Darm-Trakt ins Blut aufgenommen. Durchschnittsniveau Rubidium im Blut beträgt 2,3-2,7 mg/l und seine Konzentration in Erythrozyten ist fast dreimal höher als im Plasma. Rubidium und Cäsium verteilen sich sehr gleichmäßig in Organen und Geweben, Rubidium reichert sich hauptsächlich in den Muskeln an und Cäsium gelangt in den Darm und wird in dessen absteigenden Abschnitten wieder resorbiert.
Die Rolle von Rubidium und Cäsium bei einigen physiologischen Prozessen ist bekannt. Derzeit wurde die stimulierende Wirkung dieser Elemente auf die Kreislauffunktionen und die Wirksamkeit der Verwendung ihrer Salze bei Hypotonie unterschiedlicher Herkunft nachgewiesen. Im Labor von I.P. Pavlov, S.S. Botkin fand heraus, dass Cäsium- und Rubidiumchloride einen Anstieg des Blutdrucks verursachen lange Zeit und dass diese Wirkung hauptsächlich mit einer erhöhten Herz-Kreislauf-Aktivität und einer Verengung peripherer Gefäße verbunden ist.
Als vollständiges Analogon von Kalium reichert sich Rubidium auch in der intrazellulären Flüssigkeit an und kann in verschiedenen Prozessen eine äquivalente Menge Kalium ersetzen. Synergismus (chemisch) ist die gleichzeitige kombinierte Wirkung von zwei (oder mehr) Faktoren, die dadurch gekennzeichnet ist, dass eine solche kombinierte Wirkung die Wirkung jeder einzelnen Komponente deutlich übersteigt. Rubidium ist ein Kaliumsynergist und aktiviert viele der gleichen Enzyme wie Kalium.
Die radioaktiven Isotope 137 Cs und 87 Rb werden in der Strahlentherapie bösartiger Tumoren sowie bei der Untersuchung des Kaliumstoffwechsels eingesetzt. Aufgrund ihres schnellen Abbaus können sie sogar in den Körper eingeschleust werden, ohne dass langfristige schädliche Auswirkungen zu befürchten sind.
Franc. Es handelt sich um ein künstlich gewonnenes radioaktives chemisches Element. Es gibt Hinweise darauf, dass sich Francium in den frühesten Stadien seiner Entwicklung selektiv in Tumoren anreichern kann. Diese Beobachtungen können bei der Diagnose von Krebs hilfreich sein.
Auf diese Weise, Von den Elementen der IA-Gruppe sind Li, Rb, Cs physiologisch aktiv und Na und K lebenswichtig. Die Ähnlichkeit der physikalisch-chemischen Eigenschaften von Li und Na aufgrund der Ähnlichkeit der elektronischen Struktur ihrer Atome zeigt sich auch in der biologischen Wirkung von Kationen (Anreicherung in extrazellulärer Flüssigkeit, Austauschbarkeit). Die ähnliche Art der biologischen Wirkung von Kationen langperiodischer Elemente - K +, Rb +, Cs + (Anreicherung in intrazellulärer Flüssigkeit, Austauschbarkeit) beruht auch auf der Ähnlichkeit ihrer elektronischen Struktur und physikalisch-chemischen Eigenschaften. Dies ist die Grundlage für den Einsatz von Natrium- und Kaliumpräparaten bei Vergiftungen mit Lithium- und Rubidiumsalzen.
3. Eintragswege von Alkalimetallen
in den menschlichen Körper
Die Art und Weise, wie chemische Elemente in den menschlichen Körper gelangen, ist vielfältig und in der Abbildung dargestellt:

Menschlich
Im Prozess der Evolution von organische Substanz Für bioorganisch ist die Grundlage für die Verwendung bestimmter chemischer Elemente bei der Schaffung von Biosystemen die natürliche Selektion.
Die Tabelle zeigt Daten zum Gehalt an Elementen der Gruppe I A – Alkalimetalle – in der Erdkruste, im Meerwasser, in pflanzlichen und tierischen Organismen sowie im menschlichen Körper (Massenanteil in %).
Die Tabelle zeigt, dass ein Element im menschlichen Körper umso häufiger vorkommt, je häufiger es in der Erdkruste vorkommt.
Li
N / A
K
Rb
Cs
Erdkruste
6,5∙10 -3
0,03
genaue Daten
Nein
Die Erde
3∙10 -3
0,63
1,36
5∙10 -3
Meerwasser
1,5∙10 -5
1,06
0,038
2∙10 -5
Pflanzen
1∙10 -5
0,02
5∙10 -4
Tiere
10 -4
0,27
10 -5
Menschlich
10 -4
0,08
0,23
10 -5
10 -4
Die für den menschlichen Körper am meisten benötigten Alkalimetalle sind Natrium und Kalium. Fast alle Elemente gelangen hauptsächlich über die Nahrung in den menschlichen Körper.
Lithiumquellen.
In einigen ist Lithium enthalten Mineralwässer sowie in Meer- und Steinsalz. Es kommt auch in Pflanzen vor, aber seine Konzentration hängt wie bei allen Mikroelementen nicht nur von der Art und dem Teil der Pflanze ab, sondern auch von der Jahreszeit und sogar vom Tag, von den Sammelbedingungen und dem Wetter sowie vom Gebiet wo diese Pflanze wächst.
In unserem Land wurde Lithium von Mitarbeitern des nach Acad benannten Instituts für Geochemie untersucht. V. I. Wernadski in Moskau. Es wurde festgestellt, dass die oberirdischen Pflanzenteile reicher an Lithium sind als die Wurzeln. Das meiste Lithium kommt in Pflanzen der Rosenfamilie, Nelken und Nachtschattengewächsen vor, zu denen auch Tomaten und Kartoffeln gehören. Allerdings kann der inhaltliche Unterschied innerhalb einer Familie enorm sein – mehrere Dutzend Mal. Es hängt davon ab geografische Position und Lithiumgehalt im Boden.
Natriumquellen.
Natrium ist in verschiedenen Lebensmittelzusatzstoffen in Form von Mononatriumglutamat (Aroma), Natriumsaccharin (Süßstoff), Natriumnitrat (Konservierungsmittel), Natriumascorbat (Antioxidans) und Natriumbicarbonat (Backpulver) sowie in einigen enthalten Medikamente(Antazida). Der größte Teil des Natriums in der Nahrung stammt jedoch aus Salz.
Der NaCl-Gehalt ist insgesamt relativ niedrig Lebensmittel, die keiner besonderen Verarbeitung unterzogen wurden. Salz wird jedoch bereits seit mehreren Jahrhunderten als Konservierungs- und Aromastoff verwendet. Es wird auch als Farbstoff, Füllstoff und zur Steuerung des Fermentationsprozesses (z. B. beim Brotbacken) verwendet. Aus diesem Grund wird es Lebensmitteln wie Schinken, Wurst, Speck und anderen Fleischprodukten, geräuchertem Fisch und Fleisch zugesetzt. Dosen Gemüse, die meisten Buttersorten, Margarine, Käse, ungesüßte Lebensmittel, Snacks und die Müsli, die wir zum Frühstück essen.
Die empfohlene Natriumzufuhr beträgt 1,5 Gramm am Tag. Überschüssiges Salz in der Ernährung wird mit einem erhöhten Risiko für Magenkrebs in Verbindung gebracht und ist schädlich für die Nieren, insbesondere wenn diese Probleme mit dem Harnsystem haben. Überschüssiges Salz ist einer der Hauptfaktoren des Lebensstils, der zu Bluthochdruck führt. Wenn Bluthochdruck asymptomatisch verläuft, erhöht sich das Risiko für Herz-Kreislauf-Erkrankungen und Schlaganfälle. Aktuelle Leitlinien zur Vorbeugung von Bluthochdruck haben gezeigt, dass die wirksamste Ernährung zur Vorbeugung und Behandlung von Bluthochdruck natrium- und fettarm sein und große Mengen fettarmer Milchprodukte (eine Kalziumquelle) sowie Obst und Gemüse enthalten sollte (eine Kaliumquelle). Daher ist es wichtig, die Ernährung als Ganzes umzustellen, anstatt sich auf einen einzelnen Bestandteil der Ernährung zu konzentrieren. Weitere wichtige positive Faktoren sind körperliche Aktivität und ein normales Körpergewicht.
Menschen mit Nierenerkrankungen und sehr kleine Kinder können große Mengen Natrium nicht vertragen, da ihre Nieren es nicht ausscheiden können. Aus diesem Grund sollten Sie der Nahrung von Kleinkindern kein Salz hinzufügen.
Laut Gesetz muss auf den Lebensmitteletiketten der Natriumgehalt angegeben werden, einige Hersteller ignorieren diese Regel jedoch und geben die Salzmenge an.
Wir erinnern: " Speisesalz kann lästig sein unsere Gesundheit!»
Kaliumquellen.
Die beste Kaliumquelle sind pflanzliche Lebensmittel. Dies sind Wassermelonen, Melonen, Orangen, Mandarinen, Bananen, Trockenfrüchte (Feigen, Aprikosen, Hagebutten). Zu den kaliumreichen Beeren zählen Preiselbeeren, Erdbeeren, schwarze und rote Johannisbeeren. Viel Kalium steckt in Gemüse (vor allem Kartoffeln), Hülsenfrüchten, Vollkornprodukten und Reis.
Die Reaktion des Körpers auf Kaliummangel.
Bei einem Mangel an Kalium im Körper werden Muskelschwäche, Darmlethargie und Herzfunktionsstörungen beobachtet.
„Ich bin noch nicht aufgestanden, ich bin schon müde“ – so charakterisiert der Arzt bildlich und anschaulich den Kaliummangel im Körper. Ein niedriger Kaliumgehalt im Körper führt in der Regel zu Asthenie (geistige und körperliche Erschöpfung, Müdigkeit), eingeschränkter Nierenfunktion und einer Erschöpfung der Nebennierenrinde. Es besteht die Gefahr einer Störung der Stoffwechselprozesse und der Leitfähigkeit im Myokard.
Kaliummangel verringert die Leistungsfähigkeit, verlangsamt die Wundheilung und führt zu einer Beeinträchtigung der neuromuskulären Leitung. Es werden trockene Haut, glanzloses und schwaches Haar festgestellt (dies ist vor allem für Frauen und Mädchen ein Grund zur Sorge).
Könnte kommen plötzlicher Tod mit zunehmender Belastung. Die Übertragung von Nervenimpulsen ist schlecht. Diuretika (Diuretika) reduzieren die Kaliumaufnahme. Bei der Zubereitung von Speisen ist darauf zu achten, dass Kaliumverbindungen wasserlöslich sind. Dieser Umstand erfordert, dass Sie Produkte, die dieses Produkt enthalten, vor dem Zerkleinern waschen und in einer kleinen Menge Wasser kochen.
Übrigens, Ethnowissenschaft glaubt, dass der leidenschaftliche Wunsch, Alkohol zu trinken, mit einem Kaliummangel im Körper verbunden ist.
Zur Kaliumreduzierung verwenden Kaliumchlorid KCl 4 - 5 mal täglich, 1 g.
Die Reaktion des Körpers auf überschüssiges Kalium.
Bei einem Überschuss an Kalium im Körper werden die Hauptfunktionen des Herzens gehemmt: eine Abnahme der Erregbarkeit des Herzmuskels, eine Verlangsamung der Herzfrequenz, eine Verschlechterung der Leitfähigkeit und eine Abschwächung der Herzkontraktionskraft. In hohen Konzentrationen verursachen Kaliumionen einen Herzstillstand in der Diastole (der Kontraktionsphase der Herzkammern). Die toxische Dosis von Kalium beträgt 6 g. Die tödliche Dosis beträgt 14 g. Kaliumsalze können aufgrund des mit dem Kaliumion verbundenen Anions, beispielsweise KCN (Kaliumcyanid), für den Körper giftig sein.
Um den Gehalt dieser Nährstoffe zu regulieren, können Sie die in der folgenden Tabelle aufgeführten Daten berücksichtigen.

4. Praktischer Teil
Erleben Sie 1.Flammfärbung mit Compounds.
Eine der Methoden zum qualitativen Nachweis von Alkalimetallverbindungen basiert auf ihrer Fähigkeit, die Brennerflamme zu färben.
Lösungen von Alkalimetallsalzen müssen in Reagenzgläser gegossen werden. Waschen Sie den Eisendraht ein Salzsäure, und dann in der Flamme des Brenners entzünden.
Anschließend müssen Sie den Draht mit einer Lösung des zu testenden Salzes befeuchten und in die Flamme geben.
Salze, die Lithiumkationen enthalten, sowie Lithium Färbe die Flammen Rot Farbe, Natriumkationen und Metall Natrium- V Gelb, Kaliumkationen und Metall Kalium Färbe die Flammen violett Farbe. Für bessere Beobachtung Sie können die Farbe durch blaues Glas sehen.
So wurden Li+-, Na+- und K+-Ionen in Lösungen der Salze LiCl, NaCl, Na 2 CO 3, Na 2 SO 4, NaNO 3, KCl, KNO 3, K 2 CO 3 entdeckt.
Erfahrung 2.Wechselwirkung von Alkalimetallen mit Wasser.
Geben Sie ein Stück Metall, das gründlich von der Oxidschicht gereinigt wurde, in ein Glas Wasser. Nach dem Auflösen des Metalls wurde das Lösungsmedium mit Phenolphthalein untersucht.
Führen Sie dieses Experiment mit Lithium-, Natrium- und Kaliumstücken durch. Am aktivsten war die Reaktion mit Kalium, sie ging mit der Verbrennung von Kalium einher, es wurden violette Funken und Gasentwicklung beobachtet. Natrium reagierte mit Wasser und erzeugte gelbe Funken, und Lithium reagierte am ruhigsten.
Die resultierenden Lösungen mit Phenolphthalein verfärbten sich purpurrot, was auf das Vorhandensein von Alkali in der Lösung hinweist.
2Li + 2H 2 O = 2LiOH + H 2
2Na + 2H 2 O = 2NaOH + H 2
2K + 2H 2 O = 2KOH + H 2
Erfahrung 3. Hydrolyse von Natrium- und Kaliumsalzen.
Die Beschaffenheit der Salzlösungsumgebung wird mithilfe von Säure-Base-Indikatoren untersucht.
Universelle Indikatorpapiere, eingetaucht in Lösungen von Alkalimetallsalzen, die durch schwache Säuren Na 2 CO 3 und K 2 CO 3 gebildet werden, werden rot blaue Farbe, was auf eine alkalische Reaktion von Lösungen hinweist. In Lösungen trat Hydrolyse auf – die Wechselwirkung von Salzen mit Wassermolekülen:
Na 2 CO 3 ↔ 2Na + + CO 3 2-
CO 3 2- + H 2 O ↔ HCO 3 - + OH -
Na 2 CO 3 + H 2 O ↔ NaHCO 3 + NaOH
Lösungen von Salzen starker Säuren NaNO 3, KNO 3, NaCl, KCl, LiCl zeigten eine neutrale Umgebung (die Farbe des Indikatorpapiers änderte sich nicht), was bedeutet, dass keine Hydrolyse dieser Salze auftritt

Schlussfolgerungen
Warum ist es so wichtig, den Gehalt an chemischen Elementen im Körper zu kennen?
Chemische Elemente werden im Gegensatz zu vielen organischen Substanzen nicht im Körper synthetisiert, sondern gelangen von außen mit der Nahrung, der Luft, über die Haut und die Schleimhäute. Daher ermöglicht die Bestimmung chemischer Elemente Folgendes herauszufinden:
Wie sehr entspricht Ihr Körper dem Ideal (übrigens haben etwa 20 % der Menschen keine Abweichungen und leben daher im Einklang mit der Natur);
Ernähren Sie sich richtig, liefert Ihre Ernährung die notwendigen Nährstoffe?
Schädigen schlechte Gewohnheiten den Körper?
Wie sicher ist die Umgebung, in der Sie leben? das Essen, das du isst; Ihr Arbeitsplatz;
Funktionieren Ihr Magen, Ihr Darm, Ihre Leber, Ihre Nieren und Ihre Haut gut und regulieren Sie die Prozesse der Aufnahme und Ausscheidung von Nährstoffen?
Leiden Sie unter chronischen Erkrankungen oder einer Veranlagung dazu?
Werden Sie richtig behandelt?
Welche Krankheiten hängen am engsten mit einem elementaren Ungleichgewicht zusammen?
Das ist zunächst einmal:
verminderte Immunität;
Erkrankungen der Haut, Haare, Nägel;
Skoliose, Osteoporose, Osteochondrose;
Hypertonie;
Allergien, einschließlich Asthma bronchiale;
Diabetes, Fettleibigkeit;
Erkrankungen des Herz-Kreislauf-Systems;
Blutkrankheiten (Anämie);
Darmdysbiose, chronische Gastritis, Kolitis;
Unfruchtbarkeit, verminderte Potenz bei Männern;
beeinträchtigtes Wachstum und Entwicklung bei Kindern.
Langjährige Erfahrungen von Ärzten zeigen, dass mehr als 80 % der Bevölkerung ein mehr oder weniger ausgeprägtes Ungleichgewicht der Mikroelemente haben. Deshalb, wenn Sie welche haben , darauf sollten Sie achten!
Viele Wissenschaftler glauben, dass nicht nur alle chemischen Elemente in einem lebenden Organismus vorhanden sind, sondern dass jedes von ihnen eine spezifische biologische Funktion erfüllt.
Wir haben die biologische Rolle nur einer Gruppe chemischer Elemente geklärt. Alkalimetalle sind, wie die meisten anderen auch, für die menschliche Gesundheit äußerst wichtig. Für die menschliche Gesundheit ist es sehr wichtig, die optimale Konzentration jedes Elements aufrechtzuerhalten: Sowohl ein Mangel als auch ein Überschuss eines Elements sind schädlich.
Stabilität chemische Zusammensetzung Der Körper ist einer der wichtigsten und zwingende Bedingungen seine normale Funktion .
Es besteht eine irrige, wenn auch weit verbreitete Meinung über die Möglichkeit, ein Ungleichgewicht in der Elementarzusammensetzung des menschlichen Körpers durch die Anreicherung der Ernährung mit bestimmten Produkten, die die notwendigen Mineralstoffe enthalten, zu korrigieren. Es sollte jedoch berücksichtigt werden, dass das Vorhandensein notwendiger Makro- und Mikroelemente in Nahrungsmitteln und Wasser (was besonders für Bewohner ländlicher Gebiete offensichtlich ist) in hohem Maße vom sogenannten „lokalen biogeochemischen Kreislauf“ der Elemente abhängt. die den Gehalt an Makro- und Mikroelementen in Nahrungspflanzen und -tieren bestimmt.
Ein Mangel oder Überschuss an bestimmten Elementen im menschlichen Körper ist in der Regel eine Folge eines Mangels oder Überschusses dieser Elemente die Nahrungskette: vom Boden – über Pflanzen und Tiere – bis zum Menschen. Wenn ein Mangel an einem Element auftritt, reicht eine Ernährungskorrektur nicht aus, selbst wenn zu diesem Zweck Produkte aus anderen Regionen verwendet werden, deren Böden mit dem notwendigen Mikroelement angereichert sind.
Nur eine individuelle Auswahl spezieller Mineralstoff- und anderer Präparate zur Normalisierung des Mikroelementhaushalts des Körpers kann eine echte und wirksame Hilfe bei der Entwicklung eines pathologischen Zustands sein.
Abschließend stellen wir die Gebote der traditionellen und wissenschaftlichen Medizin vor, die jeder kennen sollte:
Alles ist mit allem verbunden.
Alles muss irgendwohin.
Die Natur weiß es am besten.
Nichts ist umsonst.
Gebrauchte Bücher
1. Gabrielyan O.S. Chemie, 9. Klasse, Lehrbuch für Bildungseinrichtungen. - M. „Trappe“, 2001
2. Glinka N.L. Allgemeine Chemie, Lehrbuch für Universitäten. - L. „Chemie“, 1983
3. Allgemeine Chemie. Chemie biogener Elemente. Lehrbuch für Honig. Spezialist. Anruf. Yu.A. Ershov und andere - M. " Handelshochschule", 1993
4. Sychev A.P., Fadeev G.N. Chemie der Metalle. Lernprogramm. – M. „Aufklärung“, 1984
5. MHTML. Tun kument. integrierte Lektion „Alkalimetalle“. Festival „Offene Lektion“, 2003
6.
7.
Dies sind Elemente der Gruppe I des Periodensystems: Lithium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Cäsium (Cs), Francium (Fr); sehr weich, dehnbar, schmelzbar und leicht, meist silberweiß gefärbt; chemisch sehr aktiv; reagieren heftig mit Wasser und bilden sich Alkalien(daher der Name).
 Alle Alkalimetalle sind äußerst aktiv, zeigen bei allen chemischen Reaktionen reduzierende Eigenschaften, geben ihr einziges Valenzelektron ab, verwandeln sich in ein positiv geladenes Kation und weisen eine einzige Oxidationsstufe von +1 auf.
Alle Alkalimetalle sind äußerst aktiv, zeigen bei allen chemischen Reaktionen reduzierende Eigenschaften, geben ihr einziges Valenzelektron ab, verwandeln sich in ein positiv geladenes Kation und weisen eine einzige Oxidationsstufe von +1 auf.
Die Reduktionsfähigkeit nimmt in der Reihe ––Li–Na–K–Rb–Cs zu.
Alle Alkalimetallverbindungen sind ionischer Natur.
Fast alle Salze sind wasserlöslich.
Niedrige Schmelztemperaturen,
Geringe Dichten,
Weich, mit einem Messer schneiden
Aufgrund ihrer Aktivität werden Alkalimetalle unter einer Kerosinschicht gespeichert, um den Zugang von Luft und Feuchtigkeit zu blockieren. Lithium ist sehr leicht und schwimmt in Kerosin an die Oberfläche, daher wird es unter einer Vaselineschicht gelagert.
Chemische Eigenschaften von Alkalimetallen
1. Alkalimetalle interagieren aktiv mit Wasser:

2Na + 2H 2 O → 2NaOH + H 2
2Li + 2H 2 O → 2LiOH + H 2
2. Reaktion von Alkalimetallen mit Sauerstoff:
4Li + O 2 → 2Li 2 O (Lithiumoxid)
2Na + O 2 → Na 2 O 2 (Natriumperoxid)
K + O 2 → KO 2 (Kaliumsuperoxid)
An der Luft oxidieren Alkalimetalle sofort. Daher werden sie unter einer Schicht organischer Lösungsmittel (Kerosin usw.) gelagert.
3. Bei Reaktionen von Alkalimetallen mit anderen Nichtmetallen entstehen binäre Verbindungen:
2Li + Cl 2 → 2LiCl (Halogenide)
2Na + S → Na 2 S (Sulfide)
2Na + H 2 → 2NaH (Hydride)
6Li + N 2 → 2Li 3 N (Nitride)
2Li + 2C → Li 2 C 2 (Carbide)
4. Reaktion von Alkalimetallen mit Säuren
(wird selten durchgeführt, es gibt eine Konkurrenzreaktion mit Wasser):
2Na + 2HCl → 2NaCl + H2
5. Wechselwirkung von Alkalimetallen mit Ammoniak
(Es entsteht Natriumamid):
2Li + 2NH 3 = 2LiNH 2 + H 2
6. Wechselwirkung von Alkalimetallen mit Alkoholen und Phenolen, die in diesem Fall saure Eigenschaften aufweisen:
2Na + 2C 2 H 5 OH = 2C 2 H 5 ONa + H 2;
2K + 2C 6 H 5 OH = 2C 6 H 5 OK + H 2 ;
7. Qualitative Reaktion auf Alkalimetallkationen – Färbung der Flamme in folgenden Farben:
Li+ – Karminrot 
Na+ – gelb
K + , Rb + und Cs + – lila
Herstellung von Alkalimetallen
Metallisches Lithium, Natrium und Kalium erhalten durch Elektrolyse von geschmolzenen Salzen (Chloriden) und Rubidium und Cäsium durch Reduktion im Vakuum, wenn ihre Chloride mit Calcium erhitzt werden: 2CsCl+Ca=2Cs+CaCl 2
IN kleiner Maßstab Vakuumthermische Produktion von Natrium und Kalium wird auch verwendet:
2NaCl+CaC 2 =2Na+CaCl 2 +2C;
4KCl+4CaO+Si=4K+2CaCl 2 +Ca 2 SiO 4.
Aktive Alkalimetalle werden bei vakuumthermischen Prozessen aufgrund ihrer hohen Flüchtigkeit freigesetzt (ihre Dämpfe werden aus der Reaktionszone entfernt).

 Merkmale der chemischen Eigenschaften von S-Elementen der Gruppe I und ihrer physiologischen Wirkungen
Merkmale der chemischen Eigenschaften von S-Elementen der Gruppe I und ihrer physiologischen Wirkungen
Die elektronische Konfiguration des Lithiumatoms ist 1s 2 2s 1. Es hat den größten Atomradius in der 2. Periode, was die Entfernung eines Valenzelektrons und das Auftreten eines Li+-Ions mit einer stabilen Konfiguration eines Inertgases (Helium) erleichtert. Folglich entstehen seine Verbindungen durch die Übertragung eines Elektrons von Lithium auf ein anderes Atom und die Bildung einer Ionenbindung mit einer geringen Kovalenz. Lithium ist ein typisches Metallelement. In Form einer Substanz ist es ein Alkalimetall. Es unterscheidet sich von anderen Mitgliedern der Gruppe I durch seine geringe Größe und die geringste Aktivität im Vergleich zu ihnen. In dieser Hinsicht ähnelt es dem diagonal von Li gelegenen Gruppe-II-Element Magnesium. In Lösungen ist das Li+-Ion stark solvatisiert; es ist von mehreren Dutzend Wassermolekülen umgeben. In Bezug auf die Solvatationsenergie – die Addition von Lösungsmittelmolekülen – liegt Lithium näher an einem Proton als an Alkalimetallkationen.
Die geringe Größe des Li + -Ions, die hohe Ladung des Kerns und nur zwei Elektronen schaffen Bedingungen für das Auftreten eines ziemlich signifikanten Feldes positiver Ladung um dieses Teilchen, daher gibt es in Lösungen eine beträchtliche Anzahl von Molekülen polarer Lösungsmittel Da das Metall von ihm angezogen wird und seine Koordinationszahl hoch ist, ist es in der Lage, eine beträchtliche Anzahl Organolithiumverbindungen zu bilden.
Natrium beginnt mit der 3. Periode, daher hat es auf der äußeren Ebene nur 1e - , besetzt das 3s-Orbital. Der Radius des Na-Atoms ist in der 3. Periode am größten. Diese beiden Merkmale bestimmen den Charakter des Elements. Seine elektronische Konfiguration ist 1s 2 2s 2 2p 6 3s 1 . Die einzige Oxidationsstufe von Natrium ist +1. Seine Elektronegativität ist sehr gering, daher liegt Natrium in Verbindungen nur in Form eines positiv geladenen Ions vor und verleiht der chemischen Bindung einen ionischen Charakter. Das Na + -Ion ist viel größer als Li + und seine Solvatation ist nicht so groß. Allerdings kommt es in Lösung nicht in freier Form vor.
Die physiologische Bedeutung von K+- und Na+-Ionen hängt mit ihrer unterschiedlichen Adsorbierbarkeit an der Oberfläche der Bestandteile der Erdkruste zusammen. Natriumverbindungen sind nur wenig anfällig für Adsorption, während Kaliumverbindungen fest von Ton und anderen Substanzen festgehalten werden. Zellmembranen als Grenzfläche zwischen Zelle und Umwelt sind für K+-Ionen durchlässig, wodurch die intrazelluläre Konzentration von K+ deutlich höher ist als die von Na+-Ionen. Gleichzeitig übersteigt die Konzentration von Na + im Blutplasma den darin enthaltenen Kaliumgehalt. Mit diesem Umstand ist die Entstehung des Zellmembranpotentials verbunden. K+- und Na+-Ionen sind einer der Hauptbestandteile der flüssigen Phase des Körpers. Ihre Beziehung zu Ca 2+ -Ionen ist streng definiert und ihre Verletzung führt zu einer Pathologie. Die Einführung von Na+-Ionen in den Körper hat keine spürbare schädliche Wirkung. Eine Erhöhung des Gehalts an K+-Ionen ist schädlich, aber unter normalen Bedingungen erreicht die Erhöhung ihrer Konzentration nie gefährliche Werte. Der Einfluss von Rb + , Cs + , Li + -Ionen ist noch nicht ausreichend untersucht.
Von den verschiedenen Verletzungen, die mit der Verwendung von Alkalimetallverbindungen einhergehen, sind Verbrennungen durch Hydroxidlösungen am häufigsten. Die Wirkung von Alkalien ist mit der Auflösung von Hautproteinen in ihnen und der Bildung alkalischer Albuminate verbunden. Durch die Hydrolyse wird das Alkali wieder freigesetzt und wirkt auf die tieferen Körperschichten, wodurch Geschwüre entstehen. Nägel werden unter dem Einfluss von Alkalien stumpf und brüchig. Eine Schädigung der Augen, selbst bei stark verdünnten Alkalilösungen, geht nicht nur mit oberflächlichen Zerstörungen einher, sondern auch mit einer Schädigung der tieferen Augenpartien (Iris) und führt zur Erblindung. Bei der Hydrolyse von Alkaliamiden entstehen gleichzeitig Alkali und Ammoniak, was zu fibrinöser Tracheobronchitis und Lungenentzündung führt.
Kalium wurde 1807 von G. Davy fast gleichzeitig mit Natrium durch Elektrolyse von feuchtem Kaliumhydroxid gewonnen. Das Element erhielt seinen Namen vom Namen dieser Verbindung – „Ätzkalium“. Die Eigenschaften von Kalium unterscheiden sich deutlich von denen von Natrium, was auf die unterschiedlichen Radien ihrer Atome und Ionen zurückzuführen ist. In Kaliumverbindungen ist die Bindung stärker ionisch und hat in Form des K+-Ions aufgrund seiner Größe eine weniger polarisierende Wirkung als Natrium. Die natürliche Mischung besteht aus drei Isotopen 39 K, 40 K, 41 K. Eines davon ist 40 K ‑ ist radioaktiv und ein gewisser Anteil der Radioaktivität von Mineralien und Boden ist mit der Anwesenheit dieses Isotops verbunden. Seine Halbwertszeit ist lang – 1,32 Milliarden Jahre. Das Vorhandensein von Kalium in einer Probe lässt sich ganz einfach feststellen: Dämpfe des Metalls und seiner Verbindungen färben die Flamme violett-rot. Das Spektrum des Elements ist recht einfach und beweist die Anwesenheit von 1e – im 4s-Orbital. Seine Untersuchung diente als eine der Grundlagen für die Suche nach allgemeinen Mustern in der Struktur von Spektren.
Im Jahr 1861 entdeckte Robert Bunsen ein neues Element, als er das Salz von Mineralquellen mittels Spektralanalyse untersuchte. Seine Anwesenheit wurde durch dunkelrote Linien im Spektrum nachgewiesen, die nicht von anderen Elementen erzeugt wurden. Aufgrund der Farbe dieser Linien erhielt das Element den Namen Rubidium (rubidus – dunkelrot). Im Jahr 1863 erhielt R. Bunsen dieses Metall in seiner reinen Form durch Reduktion von Rubidiumtartrat (Tartrat) mit Ruß. Ein Merkmal des Elements ist die leichte Erregbarkeit seiner Atome. Seine Elektronenemission erscheint unter dem Einfluss roter Strahlen des sichtbaren Spektrums. Dies ist auf den geringfügigen Unterschied in den Energien der atomaren 4d- und 5s-Orbitale zurückzuführen. Von allen Alkalielementen mit stabilen Isotopen hat Rubidium (wie Cäsium) einen der größten Atomradien und ein kleines Ionisierungspotential. Solche Parameter bestimmen die Natur des Elements: hohe Elektropositivität, extreme chemische Aktivität, niedriger Schmelzpunkt (39 0 C) und geringe Beständigkeit gegen äußere Einflüsse.
Die Entdeckung von Cäsium ist wie Rubidium mit der Spektralanalyse verbunden. Im Jahr 1860 entdeckte R. Bunsen zwei leuchtend blaue Linien im Spektrum, die zu keinem damals bekannten Element gehörten. Daher kommt auch der Name „caesius“, was „Himmelblau“ bedeutet. Es ist das letzte Element der Alkalimetall-Untergruppe, das noch in messbaren Mengen vorkommt. Der größte Atomradius und die kleinsten ersten Ionisationspotentiale bestimmen den Charakter und das Verhalten dieses Elements. Es weist ausgeprägte Elektropositivität und ausgeprägte metallische Eigenschaften auf. Der Wunsch, das äußere 6s-Elektron abzugeben, führt dazu, dass alle seine Reaktionen äußerst heftig ablaufen. Der geringe Unterschied in den Energien der atomaren 5d- und 6s-Orbitale führt zu einer geringen Erregbarkeit der Atome. Die Elektronenemission von Cäsium wird unter dem Einfluss unsichtbarer Infrarotstrahlen (Wärme) beobachtet. Spezifizierte Funktion Die Atomstruktur bestimmt die gute elektrische Leitfähigkeit des Stroms. All dies macht Cäsium unverzichtbar in elektronische Geräte. In letzter Zeit wird Cäsiumplasma als Brennstoff der Zukunft und im Zusammenhang mit der Lösung des Problems der Kernfusion immer mehr Aufmerksamkeit geschenkt.
An der Luft reagiert Lithium nicht nur aktiv mit Sauerstoff, sondern auch mit Stickstoff und wird mit einem Film bestehend aus Li 3 N (bis zu 75 %) und Li 2 O überzogen. Die restlichen Alkalimetalle bilden Peroxide (Na 2 O 2) und Superoxide (K 2 O 4 oder KO 2).
Folgende Stoffe reagieren mit Wasser:
Li 3 N + 3 H 2 O = 3 LiOH + NH 3;
Na 2 O 2 + 2 H 2 O = 2 NaOH + H 2 O 2;
K 2 O 4 + 2 H 2 O = 2 KOH + H 2 O 2 + O 2.
Zur Luftregeneration in U-Booten und Raumschiffen, zur Isolierung von Gasmasken und Atemgeräten von Kampfschwimmern (Unterwassersaboteuren) wurde die Oxon-Mischung verwendet:
Na 2 O 2 +CO 2 =Na 2 CO 3 +0,5O 2;
K 2 O 4 + CO 2 = K 2 CO 3 + 1,5 O 2.
Dies ist derzeit die Standardfüllung für regenerierende Gasmaskenkartuschen für die Feuerwehr.
Alkalimetalle reagieren beim Erhitzen mit Wasserstoff und bilden Hydride:
Als starkes Reduktionsmittel wird Lithiumhydrid verwendet.
Hydroxide Alkalimetalle korrodieren Glas- und Porzellangeschirr; in Quarzgeschirr können sie nicht erhitzt werden:
SiO 2 +2NaOH=Na 2 SiO 3 +H 2 O.
Natrium- und Kaliumhydroxide spalten beim Erhitzen auf ihre Siedetemperatur (über 1300 0 C) kein Wasser ab. Einige Natriumverbindungen werden genannt Limonade:
A) Soda, wasserfreies Soda, Waschsoda oder einfach nur Soda – Natriumcarbonat Na 2 CO 3;
b) kristallines Soda – kristallines Hydrat von Natriumcarbonat Na 2 CO 3. 10H 2 O;
c) Bikarbonat oder Trinken – Natriumbikarbonat NaHCO 3;
d) Natriumhydroxid NaOH wird Natronlauge oder Ätznatron genannt.
ALKALI METALLE
UNTERGRUPPE IA. ALKALI METALLE
LITHIUM, NATRIUM, KALIUM, RUBIDIUM, CÄSIUM, FRANKREICH
Die elektronische Struktur von Alkalimetallen ist durch das Vorhandensein eines Elektrons in der äußeren Elektronenhülle gekennzeichnet, das relativ schwach an den Kern gebunden ist. Mit jedem Alkalimetall beginnt eine neue Periode im Periodensystem. Das Alkalimetall kann sein äußeres Elektron leichter abgeben als jedes andere Element dieser Zeit. Ein Schnitt eines Alkalimetalls in einer inerten Umgebung hat einen hellen silbrigen Glanz. Alkalimetalle zeichnen sich durch eine geringe Dichte, eine gute elektrische Leitfähigkeit und einen relativ geringen Schmelzpunkt aus niedrige Temperaturen(Tabelle 2).
Aufgrund ihrer hohen Aktivität kommen Alkalimetalle nicht in reiner Form vor, sondern kommen in der Natur nur in Form von Verbindungen (ausgenommen Francium) vor, beispielsweise mit Sauerstoff (Tone und Silikate) oder mit Halogenen (Natriumchlorid). Chloride sind Rohstoffe zur Herstellung von Alkalimetallen in freiem Zustand. Meerwasser enthält ALKALIMETALLE, 3 % NaCl und Spuren anderer Salze. Es ist offensichtlich, dass Seen und Binnenmeere sowie unterirdische Salzlagerstätten und Solen Alkalihalogenide in höheren Konzentrationen enthalten als Meerwasser. Beispielsweise beträgt der Salzgehalt im Wasser des Großen Salzsees (Utah, USA) 13.827,7 %, im Toten Meer (Israel) bis zu 31 %, je nach Fläche der Wasseroberfläche, die sich mit ändert die Jahreszeit. Es kann davon ausgegangen werden, dass der im Vergleich zu NaCl unbedeutende Gehalt an KCl im Meerwasser auf die Aufnahme des K+-Ions durch Meerespflanzen zurückzuführen ist.
In ihrer freien Form werden Alkalimetalle durch Elektrolyse von geschmolzenen Salzen wie NaCl, CaCl2, CaF2 oder Hydroxiden (NaOH) gewonnen, da kein aktives Metall mehr vorhanden ist, das das Alkalimetall aus dem Halogenid verdrängen kann. Bei der Elektrolyse von Halogeniden ist es notwendig, das an der Kathode freigesetzte Metall zu isolieren, da gleichzeitig an der Anode ein gasförmiges Halogen freigesetzt wird, das aktiv mit dem freigesetzten Metall reagiert.
Siehe auch ALKALI-PRODUKTION
Da Alkalimetalle nur ein Elektron in ihrer Außenschicht haben, ist jedes von ihnen das aktivste in seiner Periode, daher ist Li das aktivste Metall in der ersten Periode von acht Elementen, Na jeweils in der zweiten und K das aktivste Metall in der ersten Periode aktivstes Metall in der dritten Periode mit 18 Elementen (erste Übergangsperiode). In der Untergruppe der Alkalimetalle (IA) nimmt die Fähigkeit zur Elektronenabgabe von oben nach unten zu.
Chemische Eigenschaften. Alle Alkalimetalle reagieren aktiv mit Sauerstoff und bilden Oxide oder Peroxide, die sich darin unterscheiden: Li wird zu Li2O und andere Alkalimetalle zu einer Mischung aus M2O2 und MO2, und Rb und Cs entzünden sich. Alle Alkalimetalle bilden mit Wasserstoff salzartige Hydride der Zusammensetzung M+H, die bei hohen Temperaturen thermisch stabil sind und aktive Reduktionsmittel sind; Hydride zersetzen sich mit Wasser zu Alkalien und Wasserstoff und setzen Wärme frei, wodurch sich das Gas entzündet. Die Geschwindigkeit dieser Reaktion ist bei Lithium höher als bei Na und K.
Siehe auch WASSERSTOFF; SAUERSTOFF.
In flüssigem Ammoniak lösen sich Alkalimetalle unter Bildung blauer Lösungen und können (anders als bei der Reaktion mit Wasser) durch Verdampfen des Ammoniaks oder Zugabe eines geeigneten Salzes (z. B. NaCl aus seiner Ammoniaklösung) wieder freigesetzt werden. Bei der Reaktion mit Ammoniakgas verläuft die Reaktion ähnlich wie die Reaktion mit Wasser:
Alkalimetallamide weisen ähnliche Grundeigenschaften wie Hydroxide auf. Die meisten Alkalimetallverbindungen, mit Ausnahme einiger Lithiumverbindungen, sind in Wasser gut löslich. In Bezug auf Atomgröße und Ladungsdichte ist Lithium dem Magnesium ähnlich, daher sind die Eigenschaften der Verbindungen dieser Elemente ähnlich. In der Löslichkeit und thermischen Stabilität ähnelt Lithiumcarbonat den Magnesium- und Berylliumcarbonaten der Elemente der Untergruppe IIA; Diese Carbonate zersetzen sich aufgrund stärkerer MO-Bindungen bei relativ niedrigen Temperaturen. Lithiumsalze sind in organischen Lösungsmitteln (Alkohole, Ether, Erdöllösungsmittel) besser löslich als Salze anderer Alkalimetalle. Lithium (wie Magnesium) reagiert direkt mit Stickstoff zu Li3N (Magnesium bildet Mg3N2), während Natrium und andere Alkalimetalle nur unter rauen Bedingungen Nitride bilden können. Metalle der Untergruppe IA reagieren mit Kohlenstoff, die Wechselwirkung erfolgt jedoch am leichtesten mit Lithium (offensichtlich aufgrund seines kleinen Radius) und am wenigsten leicht mit Cäsium. Umgekehrt reagieren aktive Alkalimetalle direkt mit CO unter Bildung von Carbonylen (z. B. K(CO)x) und weniger aktives Li und Na nur unter bestimmten Bedingungen.
Anwendung. Alkalimetalle werden sowohl in der Industrie als auch in chemischen Laboratorien beispielsweise für Synthesen verwendet. Aus Lithium werden harte Leichtmetalllegierungen hergestellt, die allerdings spröde sind. Zur Herstellung der Na4Pb-Legierung werden große Mengen Natrium verbraucht, aus der Tetraethylblei Pb(C2H5)4, ein Antiklopfmittel für Ottokraftstoff, gewonnen wird. Als Bestandteile weicher Lagerlegierungen werden Lithium, Natrium und Kalzium verwendet. Das einzelne und damit bewegliche Elektron in der äußeren Schicht macht Alkalimetalle zu hervorragenden Wärme- und Stromleitern. Legierungen aus Kalium und Natrium, die über einen weiten Temperaturbereich einen flüssigen Zustand behalten, werden aufgrund der hohen Temperaturen in einigen Kernreaktortypen als Wärmeaustauschflüssigkeit verwendet Kernreaktor zur Dampferzeugung verwendet. Metallisches Natrium in Form von Versorgungsschienen wird in der elektrochemischen Technik zur Übertragung von Hochleistungsströmen eingesetzt. Lithiumhydrid LiH ist eine praktische Quelle für Wasserstoff, der freigesetzt wird, wenn das Hydrid mit Wasser reagiert. Lithiumaluminiumhydrid LiAlH4 und Lithiumhydrid werden als Reduktionsmittel in der organischen und anorganischen Synthese eingesetzt. Aufgrund seines kleinen Ionenradius und der entsprechend hohen Ladungsdichte reagiert Lithium aktiv mit Wasser, daher sind Lithiumverbindungen stark hygroskopisch und Lithiumchlorid LiCl wird zur Lufttrocknung beim Betrieb von Geräten verwendet. Alkalimetallhydroxide sind starke Basen und gut wasserlöslich; Sie werden zum Erstellen verwendet alkalische Umgebung. Natriumhydroxid ist als günstigstes Alkali weit verbreitet (allein in den USA werden jährlich mehr als 2,26 Millionen Tonnen verbraucht).
Lithium. Das leichteste Metall weist zwei stabile Isotope auf Atommasse 6 und 7; Das schwere Isotop kommt häufiger vor, sein Gehalt beträgt 92,6 % aller Lithiumatome. Lithium wurde 1817 von A. Arfvedson entdeckt und 1855 von R. Bunsen und A. Mathiesen isoliert. Es wird zur Herstellung thermonuklearer Waffen verwendet ( H-Bombe), zur Erhöhung der Härte von Legierungen und in Arzneimitteln. Lithiumsalze werden in der alkalischen Technologie zur Erhöhung der Härte und chemischen Beständigkeit von Glas eingesetzt Batterien, zum Binden von Sauerstoff beim Schweißen.
Natrium. Es ist seit der Antike bekannt und wurde 1807 von H. Davy isoliert. Es ist ein weiches Metall, dessen Verbindungen wie Alkali (Natriumhydroxid NaOH), Backpulver (Natriumbicarbonat NaHCO3) und Soda (Natriumcarbonat Na2CO3) weit verbreitet sind. Metall wird in Form von Dämpfen auch in gedämpften Gasentladungslampen für die Straßenbeleuchtung eingesetzt.
Kalium. Es ist seit der Antike bekannt und wurde 1807 auch von H. Davy isoliert. Kaliumsalze sind bekannt: Kaliumnitrat (Kaliumnitrat KNO3), Kali (Kaliumcarbonat K2CO3), Kalilauge (Kaliumhydroxid KOH) usw. Auch Kaliummetall findet vielfältige Anwendung in der Wärmeübertragungslegierungstechnologie.
Rubidium wurde 1861 von R. Bunsen spektroskopisch entdeckt; enthält 27,85 % radioaktives Rubidium Rb-87. Rubidium ist wie andere Metalle der Untergruppe IA chemisch hochreaktiv und muss unter einer Öl- oder Kerosinschicht gelagert werden, um eine Oxidation durch Luftsauerstoff zu vermeiden. Rubidium hat vielfältige Einsatzmöglichkeiten, darunter Solarzellentechnologie, Radiovakuumgeräte und Pharmazeutika.
Cäsium. Cäsiumverbindungen sind in der Natur weit verbreitet, meist in geringen Mengen zusammen mit Verbindungen anderer Alkalimetalle. Das Mineral Pollucitsilikat enthält 34 % Cäsiumoxid Cs2O. Das Element wurde 1860 von R. Bunsen mittels Spektroskopie entdeckt. Die Hauptverwendung von Cäsium ist die Herstellung von Solarzellen und Elektronenröhren; eines der radioaktiven Isotope von Cäsium, Cs-137, wird in der Strahlentherapie und in der wissenschaftlichen Forschung verwendet.
Franc. Das letzte Mitglied der Alkalimetallfamilie, Francium, ist so radioaktiv, dass es in der Erdkruste nur in Spuren vorkommt. Informationen über Francium und seine Verbindungen basieren auf der Untersuchung einer unbedeutenden Menge davon, die künstlich (in einem Hochenergiebeschleuniger) während des a-Zerfalls von Actinium-227 gewonnen wurde. Das langlebigste Isotop 22387Fr zerfällt in 21 Minuten in 22388Ra und b-Teilchen. Als grobe Schätzung beträgt der Metallradius von Francium 2,7. Francium weist die meisten für andere Alkalimetalle charakteristischen Eigenschaften auf und zeichnet sich durch eine hohe elektronenspendende Aktivität aus. Es bildet lösliche Salze und Hydroxide. In allen Verbindungen weist Francium die Oxidationsstufe I auf.
Colliers Enzyklopädie. - Offene Gesellschaft. 2000 .