Struktur der Materie. Arten von Kristallgittern
Die meisten Feststoffe haben Kristallstruktur, in dem die Partikel, aus denen es „aufgebaut“ ist, in einer bestimmten Reihenfolge sind und dadurch entstehen Kristallgitter. Es ist aus sich wiederholenden identischen Struktureinheiten aufgebaut - Elementarzellen, das mit benachbarten Zellen kommuniziert und zusätzliche Knoten bildet. Dadurch gibt es 14 verschiedene Kristallgitter.
Arten von Kristallgittern.
Abhängig von den Partikeln, die an den Gitterknoten stehen, werden unterschieden:
- Metallkristallgitter;
- ionisches Kristallgitter;
- molekulares Kristallgitter;
- makromolekulares (atomares) Kristallgitter.
Metallische Bindung in Kristallgittern.
Ionenkristalle haben eine erhöhte Zerbrechlichkeit, weil Eine (auch geringfügige) Verschiebung des Kristallgitters führt dazu, dass gleich geladene Ionen beginnen, sich gegenseitig abzustoßen, die Bindungen aufbrechen, Risse und Spaltungen entstehen.
Molekulare Bindung von Kristallgittern.
Das Hauptmerkmal der intermolekularen Bindung ist ihre „Schwäche“ (van der Waals, Wasserstoff).

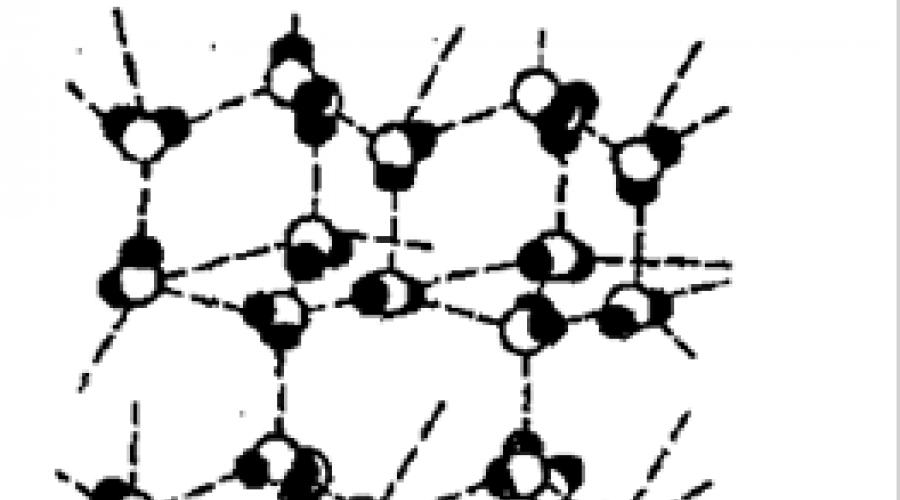
Dies ist die Struktur von Eis. Jedes Wassermolekül ist durch Wasserstoffbrückenbindungen mit vier es umgebenden Molekülen verbunden, wodurch eine tetraedrische Struktur entsteht.
Wasserstoffbrückenbindungen erklären den hohen Siedepunkt, Schmelzpunkt und die niedrige Dichte;
Makromolekulare Verbindung von Kristallgittern.
An den Knotenpunkten eines Kristallgitters befinden sich Atome. Diese Kristalle sind unterteilt in 3 Typen:
- rahmen;
- Kette;
- Schichtstrukturen.
Rahmenstruktur Diamant ist einer der härtesten Stoffe der Natur. Das Kohlenstoffatom bildet 4 identische kovalente Bindungen, was auf die Form eines regelmäßigen Tetraeders hinweist ( sp 3 - Hybridisierung). Jedes Atom verfügt über ein einzelnes Elektronenpaar, das sich auch mit benachbarten Atomen verbinden kann. Dadurch entsteht ein dreidimensionales Gitter, in dessen Knoten sich ausschließlich Kohlenstoffatome befinden.
Die Zerstörung einer solchen Struktur erfordert viel Energie; der Schmelzpunkt solcher Verbindungen ist hoch (bei Diamant liegt er bei 3500 °C).
Schichtstrukturen sprechen vom Vorhandensein kovalenter Bindungen innerhalb jeder Schicht und schwacher Van-der-Waals-Bindungen zwischen den Schichten.
Schauen wir uns ein Beispiel an: Graphit. Jedes Kohlenstoffatom ist drin sp 2 - Hybridisierung. Das vierte ungepaarte Elektron bildet eine Van-der-Waals-Bindung zwischen den Schichten. Daher ist die 4. Schicht sehr mobil:

Die Bindungen sind schwach und daher leicht zu brechen, was bei einem Bleistift zu beobachten ist – „Schreibeigenschaft“ – die 4. Schicht bleibt auf dem Papier.
Graphit ist ein ausgezeichneter Leiter für elektrischen Strom (Elektronen können sich entlang der Schichtebene bewegen).
Kettenstrukturen Oxide haben (z. B. ALSO 3 ), das in Form von glänzenden Nadeln, Polymeren, einigen amorphen Substanzen und Silikaten (Asbest) kristallisiert.
Themen des Einheitlichen Staatsexamen-Kodifizierers: Stoffe molekularer und nichtmolekularer Struktur. Art des Kristallgitters. Abhängigkeit der Eigenschaften von Stoffen von ihrer Zusammensetzung und Struktur.
Molekularkinetische Theorie
Alle Moleküle bestehen aus winzige Partikel– Atome. Alle aktuell entdeckten Atome sind im Periodensystem zusammengefasst.
Atom- ist das kleinste, chemisch unteilbare Teilchen eines Stoffes, das ihn konserviert Chemische Eigenschaften. Atome verbinden sich miteinander chemische Bindungen. Wir haben uns bereits einen angeschaut. Studieren Sie unbedingt die Theorie zum Thema: Arten chemischer Bindungen, bevor Sie diesen Artikel lesen!
Schauen wir uns nun an, wie sich Teilchen in Materie verbinden können.
Abhängig von der Lage der Partikel zueinander können die Eigenschaften der von ihnen gebildeten Stoffe stark variieren. Also, wenn die Teilchen voneinander entfernt sind weit(Der Abstand zwischen den Partikeln ist viel größer als die Größe der Partikel selbst), interagieren praktisch nicht miteinander, bewegen sich chaotisch und kontinuierlich im Raum, dann haben wir es zu tun Gas .
Wenn die Partikel lokalisiert sind schließen zueinander, aber chaotisch, mehr miteinander interagieren Wenn Sie in einer Position intensive oszillierende Bewegungen ausführen, aber in eine andere Position springen können, handelt es sich hierbei um ein Modell der Struktur Flüssigkeiten .
Wenn die Partikel lokalisiert sind schließen zueinander, aber mehr in geordneter Weise, Und mehr interagieren untereinander, bewegen sich aber nur innerhalb einer Gleichgewichtslage, praktisch ohne sich in andere zu bewegen Situation, dann haben wir es zu tun solide .

Die meisten bekannten chemischen Substanzen und Gemische können in festem, flüssigem und gasförmigem Zustand vorliegen. Das einfachste Beispiel ist Wasser. Bei normale Bedingungen sie flüssig, bei 0 o C gefriert es – geht von einem flüssigen Zustand in über hart, und bei 100 o C kocht es - verwandelt sich in Gasphase- Wasserdampf. Darüber hinaus sind viele Stoffe unter normalen Bedingungen Gase, Flüssigkeiten oder Feststoffe. Beispielsweise ist Luft – ein Gemisch aus Stickstoff und Sauerstoff – unter normalen Bedingungen ein Gas. Aber wenn Bluthochdruck Bei niedrigen Temperaturen kondensieren Stickstoff und Sauerstoff und gehen in die flüssige Phase über. Flüssiger Stickstoff wird in der Industrie aktiv eingesetzt. Manchmal isoliert Plasma, und auch Flüssigkristalle, als separate Phasen.

Viele Eigenschaften einzelner Stoffe und Gemische werden erklärt relative Position Teilchen im Raum relativ zueinander!
Dieser Artikel untersucht Eigenschaften von Festkörpern, abhängig von ihrer Struktur. Basic physikalische Eigenschaften Feststoffe: Schmelzpunkt, elektrische Leitfähigkeit, Wärmeleitfähigkeit, mechanische Festigkeit, Duktilität usw.
Schmelztemperatur - Dies ist die Temperatur, bei der ein Stoff von der festen Phase in die flüssige Phase übergeht und umgekehrt.

ist die Fähigkeit eines Stoffes, sich ohne Zerstörung zu verformen.

Elektrische Leitfähigkeit ist die Fähigkeit eines Stoffes, Strom zu leiten.
Strom ist die geordnete Bewegung geladener Teilchen. Somit kann Strom nur von Stoffen durchgeführt werden, die enthalten bewegliche geladene Teilchen. Aufgrund ihrer Fähigkeit, Strom zu leiten, werden Stoffe in Leiter und Dielektrika unterteilt. Leiter sind Stoffe, die Strom leiten können (d. h. bewegliche geladene Teilchen enthalten). Dielektrika sind Stoffe, die praktisch keinen Strom leiten.

In einem festen Stoff können sich Partikel eines Stoffes befinden chaotisch, oder geordneterÖ. Wenn sich die Teilchen eines festen Stoffes im Raum befinden chaotisch, heißt der Stoff amorph. Beispiele für amorphe Stoffe – Kohle, Glimmerglas.

Sind die Teilchen eines festen Stoffes geordnet im Raum angeordnet, d.h. Sich wiederholende dreidimensionale geometrische Strukturen bilden, nennt man einen solchen Stoff Kristall, und die Struktur selbst – Kristallgitter . Die meisten Substanzen, die wir kennen, sind Kristalle. Die Partikel selbst befinden sich darin Knoten Kristallgitter.
Kristalline Stoffe zeichnen sich insbesondere aus durch Art der chemischen Bindung zwischen Partikeln in einem Kristall – atomar, molekular, metallisch, ionisch; entsprechend der geometrischen Form der einfachsten Zelle eines Kristallgitters - kubisch, sechseckig usw.
Abhängig von Art von Teilchen, die ein Kristallgitter bilden , unterscheiden Atom-, Molekül-, Ionen- und Metallkristallstruktur .
Atomares Kristallgitter

Ein atomares Kristallgitter entsteht, wenn die Knoten des Kristalls lokalisiert werden Atome. Die Atome sind stark miteinander verbunden kovalente chemische Bindungen. Dementsprechend wird ein solches Kristallgitter sehr sein dauerhaft, es ist nicht leicht, es zu zerstören. Ein atomares Kristallgitter kann durch Atome mit hoher Wertigkeit gebildet werden, d. h. mit einer großen Anzahl von Bindungen zu benachbarten Atomen (4 oder mehr). In der Regel handelt es sich dabei um Nichtmetalle: einfache Stoffe - Silizium, Bor, Kohlenstoff (allotrope Modifikationen Diamant, Graphit) und deren Verbindungen (Borkohlenstoff, Siliziumoxid (IV) usw..). Da zwischen Nichtmetallen überwiegend kovalente chemische Bindungen auftreten, freie Elektronen(wie andere geladene Teilchen) in Stoffen mit einem atomaren Kristallgitter in den meisten Fällen nein. Daher sind solche Substanzen in der Regel sehr schlecht durchgeführt elektrischer Strom, d.h. sind Dielektrika. Dabei handelt es sich um allgemeine Muster, von denen es eine Reihe von Ausnahmen gibt.

Kommunikation zwischen Teilchen in Atomkristallen: .
An den Knoten des Kristalls mit einer atomaren Kristallstruktur lokalisiert Atome.
Phasenzustand Atomkristalle unter Normalbedingungen: in der Regel Feststoffe.
Substanzen, Bildung von Atomkristallen im festen Zustand:
- Einfache Substanzen hohe Wertigkeit (in der Mitte des Periodensystems): Bor, Kohlenstoff, Silizium usw.
- Komplexe Stoffe, die aus diesen Nichtmetallen bestehen: Kieselsäure (Siliziumoxid, Quarzsand) SiO 2; Siliziumkarbid (Korund) SiC; Borcarbid, Bornitrid usw.
Physikalische Eigenschaften von Stoffen mit einem atomaren Kristallgitter:
— Stärke;
— Feuerfestigkeit (hoher Schmelzpunkt);
— geringe elektrische Leitfähigkeit;
— geringe Wärmeleitfähigkeit;
— chemische Inertheit (inaktive Substanzen);
- Unlöslichkeit in Lösungsmitteln.

Molekulares Kristallgitter- Dies ist ein Gitter, an dessen Knoten sich befinden Moleküle. Hält Moleküle im Kristall schwache Kräfte der intermolekularen Anziehung (Van-der-Waals-Kräfte, Wasserstoffbrückenbindungen oder elektrostatische Anziehung). Dementsprechend ist ein solches Kristallgitter in der Regel ziemlich leicht zu zerstören. Stoffe mit molekularem Kristallgitter – schmelzbar, zerbrechlich. Je größer die Anziehungskraft zwischen Molekülen ist, desto höher ist der Schmelzpunkt der Substanz. In der Regel liegen die Schmelztemperaturen von Stoffen mit molekularem Kristallgitter nicht über 200-300K. Daher liegen unter normalen Bedingungen die meisten Substanzen mit einem molekularen Kristallgitter in der Form vor Gase oder Flüssigkeiten. Ein molekulares Kristallgitter wird in der Regel in fester Form durch Säuren, Nichtmetalloxide, andere binäre Verbindungen von Nichtmetallen, einfache Stoffe, die stabile Moleküle bilden (Sauerstoff O 2, Stickstoff N 2, Wasser H 2 O, usw.), organische Substanzen. In der Regel handelt es sich dabei um Stoffe mit einer kovalenten polaren (seltener unpolaren) Bindung. Weil Elektronen sind an chemischen Bindungen beteiligt, Stoffe mit einem molekularen Kristallgitter - Dielektrika leiten die Wärme nicht gut.

Kommunikation zwischen Teilchen in Molekülkristallen: m intermolekulare, elektrostatische oder intermolekulare Anziehungskräfte.
An den Knoten des Kristalls mit einer molekularen Kristallstruktur gelegen Moleküle.
Phasenzustand Molekülkristalle unter normalen Bedingungen: Gase, Flüssigkeiten und Feststoffe.
Substanzen, bildet sich im festen Zustand molekulare Kristalle:
- Einfache nichtmetallische Substanzen, die kleine, starke Moleküle bilden (O 2, N 2, H 2, S 8 usw.);
- Komplexe Stoffe (Nichtmetallverbindungen) mit polaren kovalenten Bindungen (außer Silizium- und Boroxide, Silizium- und Kohlenstoffverbindungen) - Wasser H 2 O, Schwefeloxid SO 3 usw.
- Einatomige Edelgase (Helium, Neon, Argon, Krypton usw.);
- Mehrheitlich organische Substanz, in dem es keine Ionenbindungen gibt — Methan CH 4, Benzol C 6 H 6 usw.
Physikalische Eigenschaften Stoffe mit molekularem Kristallgitter:
— Schmelzbarkeit (niedriger Schmelzpunkt):
— hohe Kompressibilität;
— Molekülkristalle in fester Form sowie in Lösungen und Schmelzen leiten keinen Strom;
- Phasenzustand unter Normalbedingungen – Gase, Flüssigkeiten, Feststoffe;
— hohe Volatilität;
- geringe Härte.
Ionenkristallgitter

Wenn sich an den Kristallknoten geladene Teilchen befinden – Ionen, darüber können wir reden Ionenkristallgitter . Typischerweise wechseln sich Ionenkristalle ab positive Ionen(Kationen) und negative Ionen(Anionen), sodass die Partikel im Kristall festgehalten werden Kräfte der elektrostatischen Anziehung . Abhängig von der Art des Kristalls und der Art der Ionen, die den Kristall bilden, können solche Substanzen sein ziemlich langlebig und feuerfest. Im festen Zustand gibt es in Ionenkristallen normalerweise keine beweglichen geladenen Teilchen. Wenn sich der Kristall jedoch auflöst oder schmilzt, werden die Ionen freigesetzt und können sich unter dem Einfluss eines externen elektrischen Feldes bewegen. Diese. Nur Lösungen oder Schmelzen leiten Strom Ionenkristalle. Das ionische Kristallgitter ist charakteristisch für Stoffe mit ionische chemische Bindung. Beispiele solche Substanzen - Salz NaCl, Kalziumkarbonat– CaCO 3 usw. In der festen Phase bildet sich in der Regel ein ionisches Kristallgitter Salze, Basen sowie Metalloxide und binäre Verbindungen von Metallen und Nichtmetallen.

Kommunikation zwischen Teilchen in Ionenkristallen: .
An den Knoten des Kristalls mit einem ionischen Gitter lokalisiert Ionen.
Phasenzustand Ionenkristalle unter normalen Bedingungen: in der Regel Feststoffe.
Chemikalien mit Ionenkristallgitter:
- Salze (organisch und anorganisch), einschließlich Ammoniumsalze (Zum Beispiel, Ammoniumchlorid NH 4 Cl);
- Basen;
- Metalloxide;
- Binäre Verbindungen, die Metalle und Nichtmetalle enthalten.
Physikalische Eigenschaften von Stoffen mit ionischer Kristallstruktur:
— hoher Schmelzpunkt (Feuerfestigkeit);
— Lösungen und Schmelzen von Ionenkristallen sind Stromleiter;
— Die meisten Verbindungen sind in polaren Lösungsmitteln (Wasser) löslich.
– Festphasenzustand für die meisten Verbindungen unter normalen Bedingungen.

Und schließlich zeichnen sich Metalle durch eine besondere Art der räumlichen Struktur aus – Metallkristallgitter, was fällig ist Chemische Metallbindung . Metallatome halten Valenzelektronen eher schwach. In einem aus einem Metall gebildeten Kristall laufen folgende Prozesse gleichzeitig ab: Manche Atome geben Elektronen ab und werden zu positiv geladenen Ionen; diese Elektronen bewegen sich zufällig im Kristall; Einige Elektronen werden von Ionen angezogen. Diese Prozesse laufen gleichzeitig und chaotisch ab. Auf diese Weise, Es entstehen Ionen , wie bei der Bildung einer Ionenbindung, und Es entstehen gemeinsame Elektronen , wie bei der Bildung einer kovalenten Bindung. Freie Elektronen bewegen sich wie ein Gas zufällig und kontinuierlich durch das gesamte Volumen des Kristalls. Deshalb werden sie manchmal auch „ Elektronengas " Aufgrund der Verfügbarkeit große Zahl bewegliche geladene Metallteilchen Leiten Strom und Wärme. Der Schmelzpunkt von Metallen variiert stark. Auch Metalle werden charakterisiert ein eigenartiger metallischer Glanz, Formbarkeit, d.h. die Fähigkeit, unter starker mechanischer Belastung zerstörungsfrei ihre Form zu verändern, weil chemische Bindungen werden nicht zerstört.

Kommunikation zwischen Teilchen : .
An den Knoten des Kristalls mit Metallgitter angebracht Metallionen und Atome.
Phasenzustand Metalle bei normale Bedingungen: normalerweise Feststoffe(Ausnahme ist Quecksilber, das unter normalen Bedingungen flüssig ist).
Chemikalien mit einem Metallkristallgitter - einfache Stoffe - Metalle.
Physikalische Eigenschaften von Stoffen mit einem Metallkristallgitter:
— hohe thermische und elektrische Leitfähigkeit;
— Formbarkeit und Plastizität;
- metallischer Schimmer;
- Metalle sind normalerweise in Lösungsmitteln unlöslich;
- Die meisten Metalle sind unter normalen Bedingungen Feststoffe.
Vergleich der Eigenschaften von Stoffen mit unterschiedlichen Kristallgittern
Die Art des Kristallgitters (oder das Fehlen eines Kristallgitters) ermöglicht die Beurteilung der grundlegenden physikalischen Eigenschaften einer Substanz. Um die typischen physikalischen Eigenschaften von Verbindungen mit unterschiedlichen Kristallgittern grob zu vergleichen, ist es sehr praktisch, Chemikalien zu verwenden charakteristische Eigenschaften . Für ein Molekülgitter ist dies beispielsweise Kohlendioxid , für ein atomares Kristallgitter - Diamant, für Metall - Kupfer und für das Ionenkristallgitter - Salz, Natriumchlorid NaCl.

Übersichtstabelle zu den Strukturen einfacher Stoffe, die durch chemische Elemente der Hauptuntergruppen des Periodensystems gebildet werden (Elemente der Nebenuntergruppen sind Metalle und haben daher ein metallisches Kristallgitter).

Die letzte Tabelle zum Zusammenhang zwischen den Eigenschaften von Stoffen und ihrer Struktur:

Wie wir wissen, können alle materiellen Stoffe in drei Grundzuständen existieren: flüssig, fest und gasförmig. Es gibt zwar auch einen Zustand von Plasma, den Wissenschaftler als nicht weniger als den vierten Zustand der Materie betrachten, aber in unserem Artikel geht es nicht um Plasma. Der feste Zustand eines Stoffes ist daher fest, weil er eine besondere kristalline Struktur aufweist, deren Teilchen in einer bestimmten und klar definierten Reihenfolge angeordnet sind und so ein Kristallgitter entstehen. Die Struktur des Kristallgitters besteht aus sich wiederholenden identischen Elementarzellen: Atomen, Molekülen, Ionen usw. Elementarteilchen, durch verschiedene Knoten miteinander verbunden.
Arten von Kristallgittern
Abhängig von den Partikeln des Kristallgitters gibt es vierzehn Arten davon, hier sind die beliebtesten davon:
- Ionenkristallgitter.
- Atomares Kristallgitter.
- Molekulares Kristallgitter.
- Kristallzelle.

Ionenkristallgitter
Das Hauptmerkmal der Struktur des Kristallgitters von Ionen sind die entgegengesetzten elektrischen Ladungen der Ionen selbst, wodurch ein elektromagnetisches Feld entsteht, das die Eigenschaften von Substanzen mit einem ionischen Kristallgitter bestimmt. Und das sind Feuerfestigkeit, Härte, Dichte und die Fähigkeit, elektrischen Strom zu leiten. Ein typisches Beispiel für ein ionisches Kristallgitter ist Speisesalz.
Atomares Kristallgitter
Stoffe mit einem atomaren Kristallgitter haben in der Regel starke Atome in ihren Knoten. Eine kovalente Bindung entsteht, wenn zwei identische Atome brüderliche Elektronen miteinander teilen und so ein gemeinsames Elektronenpaar für benachbarte Atome bilden. Aus diesem Grund binden kovalente Bindungen Atome fest und gleichmäßig in einer strengen Reihenfolge – vielleicht ist dies das Beste charakteristisch Struktur des atomaren Kristallgitters. Chemische Elemente mit ähnlichen Bindungen können sich ihrer Härte und ihres hohen Schmelzpunkts rühmen. Das Atomkristallgitter hat solche chemische Elemente wie Diamant, Silizium, Germanium, Bor.
Molekulares Kristallgitter
Der molekulare Typ des Kristallgitters ist durch das Vorhandensein stabiler und dicht gepackter Moleküle gekennzeichnet. Sie befinden sich an den Knotenpunkten des Kristallgitters. In diesen Knoten werden sie von Van-der-Waltz-Kräften gehalten, die zehnmal schwächer sind als die Kräfte der ionischen Wechselwirkung. Ein markantes Beispiel Das molekulare Kristallgitter ist Eis – ein fester Stoff, der jedoch die Eigenschaft hat, sich in eine Flüssigkeit umzuwandeln – die Bindungen zwischen den Molekülen des Kristallgitters sind sehr schwach.
Metallkristallgitter
Die Bindungsart eines Metallkristallgitters ist flexibler und duktiler als die ionische, obwohl sie optisch sehr ähnlich sind. Besonderheit Dabei handelt es sich um das Vorhandensein positiv geladener Kationen (Metallionen) an Gitterplätzen. Zwischen den Knoten leben Elektronen, die an der Entstehung des elektrischen Feldes beteiligt sind; diese Elektronen werden auch elektrisches Gas genannt. Das Vorhandensein einer solchen Struktur eines Metallkristallgitters erklärt seine Eigenschaften: mechanische Festigkeit, Wärme- und elektrische Leitfähigkeit, Schmelzbarkeit.
Kristallgitter, Video
Und zum Schluss noch eine ausführliche Video-Erklärung zu den Eigenschaften von Kristallgittern.
Bei der Durchführung vieler körperlicher und chemische Reaktionen der Stoff geht in einen festen Aggregatszustand über. In diesem Fall neigen Moleküle und Atome dazu, sich in einer solchen räumlichen Reihenfolge anzuordnen, in der die Wechselwirkungskräfte zwischen Materieteilchen maximal ausgeglichen wären. Dadurch wird die Festigkeit der festen Substanz erreicht. Sobald Atome eine bestimmte Position einnehmen, führen sie kleine Schwingbewegungen aus, deren Amplitude von der Temperatur abhängt, ihre Position im Raum bleibt jedoch fest. Die Anziehungs- und Abstoßungskräfte gleichen sich in einem bestimmten Abstand aus.
Moderne Vorstellungen über die Struktur der Materie
Die moderne Wissenschaft besagt, dass ein Atom aus einem geladenen Kern besteht, der eine positive Ladung trägt, und Elektronen, die negative Ladungen tragen. Mit einer Geschwindigkeit von mehreren tausend Billionen Umdrehungen pro Sekunde rotieren Elektronen auf ihren Bahnen und erzeugen dabei eine Elektronenwolke um den Kern. Die positive Ladung des Kerns ist numerisch gleich der negativen Ladung der Elektronen. Somit bleibt das Atom der Substanz elektrisch neutral. Mögliche Wechselwirkungen mit anderen Atomen entstehen, wenn sich Elektronen von ihrem Mutteratom lösen und so das elektrische Gleichgewicht stören. In einem Fall sind die Atome in einer bestimmten Reihenfolge angeordnet, die als Kristallgitter bezeichnet wird. In einem anderen Fall verbinden sich Kerne und Elektronen aufgrund der komplexen Wechselwirkung zu Molekülen verschiedene Arten und Komplexität.
Definition von Kristallgitter
In Summe Verschiedene Arten Kristallgitter von Stoffen sind Netzwerke mit unterschiedlicher räumlicher Ausrichtung, an deren Knotenpunkten sich Ionen, Moleküle oder Atome befinden. Diese stabile geometrische Raumlage wird als Kristallgitter der Substanz bezeichnet. Der Abstand zwischen den Knoten einer Kristallzelle wird Identitätsperiode genannt. Die Raumwinkel, in denen sich die Zellknoten befinden, werden Parameter genannt. Je nach der Methode zum Aufbau von Bindungen können Kristallgitter einfach, basiszentriert, flächenzentriert und körperzentriert sein. Befinden sich die Materieteilchen nur in den Ecken des Parallelepipeds, nennt man ein solches Gitter einfach. Ein Beispiel für ein solches Gitter ist unten dargestellt:

Befinden sich neben den Knotenpunkten auch die Teilchen des Stoffes in der Mitte der Raumdiagonalen, so nennt man diese Anordnung der Teilchen im Stoff ein raumzentriertes Kristallgitter. Dieser Typ ist in der Abbildung deutlich dargestellt.

Wenn es zusätzlich zu den Knoten an den Eckpunkten des Gitters einen Knoten an der Stelle gibt, an der sich die imaginären Diagonalen des Parallelepipeds schneiden, dann handelt es sich um einen flächenzentrierten Gittertyp.

Arten von Kristallgittern
Die verschiedenen Mikropartikel, aus denen ein Stoff besteht, bestimmen die unterschiedlichen Arten von Kristallgittern. Sie können das Prinzip des Verbindungsaufbaus zwischen Mikropartikeln im Inneren eines Kristalls bestimmen. Die physikalischen Arten von Kristallgittern sind ionisch, atomar und molekular. Dazu gehören auch verschiedene Arten von Metallkristallgittern. Studieren der Prinzipien Interne Struktur Die Chemie beschäftigt sich mit Elementen. Im Folgenden werden die Arten von Kristallgittern näher vorgestellt.
Ionenkristallgitter
Solche Kristallgitter kommen in Verbindungen mit ionischer Bindung vor. In diesem Fall befinden sich auf den Gitterplätzen Ionen mit entgegengesetzter elektrischer Ladung. Dank an elektromagnetisches Feld, erweisen sich die Kräfte der interionischen Wechselwirkung als recht stark, was die physikalischen Eigenschaften der Substanz bestimmt. Gemeinsame Eigenschaften sind Feuerfestigkeit, Dichte, Härte und die Fähigkeit, elektrischen Strom zu leiten. Ionische Typen Kristallgitter kommen in Stoffen wie Speisesalz, Kaliumnitrat und anderen vor.

Atomare Kristallgitter
Diese Art der Struktur der Materie ist Elementen inhärent, deren Struktur durch kovalente chemische Bindungen bestimmt wird. Solche Kristallgitter enthalten an den Knotenpunkten einzelne Atome, die durch starke kovalente Bindungen miteinander verbunden sind. Diese Art der Bindung entsteht, wenn zwei identische Atome Elektronen „teilen“ und so ein gemeinsames Elektronenpaar für benachbarte Atome bilden. Dank dieser Wechselwirkung binden kovalente Bindungen Atome gleichmäßig und fest in einer bestimmten Reihenfolge. Chemische Elemente, die atomare Kristallgitter enthalten, sind hart, haben einen hohen Schmelzpunkt, sind schlechte Stromleiter und chemisch inaktiv. Klassische Beispiele für Elemente mit einer ähnlichen inneren Struktur sind Diamant, Silizium, Germanium und Bor.
Molekulare Kristallgitter
Substanzen mit einem molekularen Kristallgitter sind ein System stabiler, interagierender, dicht gepackter Moleküle, die sich an den Knoten des Kristallgitters befinden. In solchen Verbindungen behalten die Moleküle ihre räumliche Position in der gasförmigen, flüssigen und festen Phase. An den Knotenpunkten des Kristalls werden die Moleküle durch schwache Van-der-Waals-Kräfte zusammengehalten, die um ein Vielfaches schwächer sind als die ionischen Wechselwirkungskräfte.

Die Moleküle, die einen Kristall bilden, können entweder polar oder unpolar sein. Durch die spontane Bewegung von Elektronen und Schwingungen von Kernen in Molekülen kann sich das elektrische Gleichgewicht verschieben – so entsteht ein momentanes elektrisches Dipolmoment. Entsprechend ausgerichtete Dipole erzeugen Anziehungskräfte im Gitter. Kohlendioxid und Paraffin sind typische Beispiele für Elemente mit einem molekularen Kristallgitter.
Metallkristallgitter
Eine Metallbindung ist flexibler und duktiler als eine Ionenbindung, obwohl es den Anschein haben könnte, dass beide auf dem gleichen Prinzip basieren. Arten von Kristallgittern von Metallen erklären sie typische Eigenschaften- wie zum Beispiel mechanische Festigkeit, thermische und elektrische Leitfähigkeit, Schmelzbarkeit.
Ein charakteristisches Merkmal eines Metallkristallgitters ist das Vorhandensein positiv geladener Metallionen (Kationen) an den Stellen dieses Gitters. Zwischen den Knoten befinden sich Elektronen, die direkt an der Erzeugung eines elektrischen Feldes um das Gitter beteiligt sind. Die Anzahl der Elektronen, die sich innerhalb dieses Kristallgitters bewegen, wird Elektronengas genannt.

In Abwesenheit eines elektrischen Feldes führen freie Elektronen eine chaotische Bewegung durch und interagieren zufällig mit Gitterionen. Jede dieser Wechselwirkungen verändert den Impuls und die Bewegungsrichtung des negativ geladenen Teilchens. Mit ihrem elektrischen Feld ziehen Elektronen Kationen an und gleichen so ihre gegenseitige Abstoßung aus. Obwohl Elektronen als frei gelten, reicht ihre Energie nicht aus, um das Kristallgitter zu verlassen, sodass sich diese geladenen Teilchen ständig innerhalb seiner Grenzen befinden.
Das Vorhandensein eines elektrischen Feldes verleiht dem Elektronengas zusätzliche Energie. Die Verbindung mit Ionen im Kristallgitter von Metallen ist nicht stark, daher verlassen Elektronen leicht ihre Grenzen. Elektronen bewegen sich entlang von Kraftlinien und hinterlassen positiv geladene Ionen.
Schlussfolgerungen
Die Chemie legt großen Wert auf die Erforschung der inneren Struktur der Materie. Die Arten der Kristallgitter verschiedener Elemente bestimmen nahezu das gesamte Spektrum ihrer Eigenschaften. Durch die Beeinflussung von Kristallen und die Veränderung ihrer inneren Struktur ist es möglich, die gewünschten Eigenschaften eines Stoffes zu verbessern, unerwünschte zu entfernen und chemische Elemente umzuwandeln. Daher kann das Studium der inneren Struktur der umgebenden Welt dazu beitragen, das Wesen und die Prinzipien der Struktur des Universums zu verstehen.
Die meisten Feststoffe haben kristallin Struktur, die charakterisiert ist streng definierte Anordnung der Teilchen. Verbindet man die Teilchen mit herkömmlichen Linien, erhält man ein räumliches Gerüst namens Kristallgitter. Die Punkte, an denen sich Kristallteilchen befinden, werden Gitterknoten genannt. Die Knoten eines imaginären Gitters können Atome, Ionen oder Moleküle enthalten.
Abhängig von der Art der an den Knoten befindlichen Partikel und der Art der Verbindung zwischen ihnen werden vier Arten von Kristallgittern unterschieden: ionische, metallische, atomare und molekulare.
Ionisch werden Gitter genannt, in deren Knoten sich Ionen befinden.
Sie werden von Stoffen mit ionischen Bindungen gebildet. An den Knoten eines solchen Gitters befinden sich positive und negative Ionen, die durch elektrostatische Wechselwirkung miteinander verbunden sind.
Ionenkristallgitter enthalten Salze, Alkalien, aktive Metalloxide. Ionen können einfach oder komplex sein. Beispielsweise befinden sich auf den Gitterplätzen von Natriumchlorid einfache Natriumionen Na und Chlor Cl − , und auf den Gitterplätzen von Kaliumsulfat wechseln sich einfache Kaliumionen K und komplexe Sulfationen S O 4 2 − ab.
Die Bindungen zwischen den Ionen in solchen Kristallen sind stark. Daher sind ionische Stoffe fest, feuerfest und nichtflüchtig. Solche Substanzen sind gut in Wasser auflösen.
Kristallgitter aus Natriumchlorid

Natriumchloridkristall
Metall sogenannte Gitter, die aus positiven Ionen und Metallatomen sowie freien Elektronen bestehen.
Sie werden durch Stoffe mit metallischen Bindungen gebildet. An den Knoten eines Metallgitters befinden sich Atome und Ionen (entweder Atome oder Ionen, in die sich Atome leicht verwandeln und ihre äußeren Elektronen zur gemeinsamen Verwendung abgeben).
Solche Kristallgitter sind charakteristisch für einfache Stoffe aus Metallen und Legierungen.
Die Schmelzpunkte von Metallen können unterschiedlich sein (von (–37) °C für Quecksilber bis zu zwei- bis dreitausend Grad). Aber alle Metalle haben eine Eigenschaft metallischer Glanz, Formbarkeit, Duktilität, Strom gut leiten und Wärme.

Metall Kristallzelle

Hardware
Als Kristallgitter werden Atomgitter bezeichnet, an deren Knotenpunkten einzelne Atome durch kovalente Bindungen verbunden sind.
Diamant hat diesen Gittertyp – eine der allotropen Modifikationen von Kohlenstoff. Zu den Stoffen mit einem atomaren Kristallgitter gehören Graphit, Silizium, Bor und Germanium sowie komplexe Stoffe, zum Beispiel Carborundum SiC und Kieselsäure, Quarz, Bergkristall, Sand, zu denen Siliziumoxid (\(IV\)) Si O 2 gehört.
Solche Stoffe werden charakterisiert hohe Festigkeit und Härte. Somit ist Diamant der härteste Naturstoff. Stoffe mit einem atomaren Kristallgitter haben sehr hohe Schmelzpunkte und kochend. Beispielsweise liegt der Schmelzpunkt von Siliciumdioxid bei \(1728\) °C, während er bei Graphit höher liegt - \(4000\) °C. Atomkristalle sind praktisch unlöslich.

Diamantkristallgitter

Diamant
Molekular werden Gitter genannt, an deren Knoten sich Moleküle befinden, die durch schwache intermolekulare Wechselwirkungen verbunden sind.
Obwohl die Atome innerhalb der Moleküle durch sehr starke kovalente Bindungen verbunden sind, wirken zwischen den Molekülen selbst schwache intermolekulare Anziehungskräfte. Daher haben Molekülkristalle geringe Festigkeit und Härte, niedrige Temperaturen schmelzen und kochend. Viele molekulare Substanzen Zimmertemperatur sind Flüssigkeiten und Gase. Solche Stoffe sind flüchtig. Beispielsweise verdampfen kristallines Jod und festes Kohlenmonoxid (\(IV\)) („Trockeneis“), ohne in einen flüssigen Zustand überzugehen. Einige molekulare Substanzen haben Geruch .
Dieser Gittertyp enthält einfache Substanzen in Festkörpern. Aggregatzustand: Edelgase mit einatomigen Molekülen (He, Ne, Ar, Kr, Xe, Rn ) sowie Nichtmetalle mit zwei- und mehratomige Moleküle (H 2, O 2, N 2, Cl 2, I 2, O 3, P 4, S 8).
Sie haben ein molekulares Kristallgitter auch Stoffe mit kovalenten polaren Bindungen: Wasser - Eis, festes Ammoniak, Säuren, Nichtmetalloxide. Mehrheitlich organische Verbindungen sind auch molekulare Kristalle (Naphthalin, Zucker, Glucose).