Wo wird Silizium in der Industrie eingesetzt? Silizium: Anwendung, chemische und physikalische Eigenschaften
Lesen Sie auch
Silizium (Si) - steht in Periode 3, Gruppe IV der Hauptuntergruppe des Periodensystems. Physikalische Eigenschaften: Silizium existiert in zwei Modifikationen: amorph und kristallin. Amorphes Silizium ist ein braunes Pulver mit einer Dichte von 2,33 g/cm3, das sich in Metallschmelzen auflöst. Kristallines Silizium sind dunkle Kristalle graue Farbe, mit einem Stahlglanz, hart und spröde, mit einer Dichte von 2,4 g / cm3. Silizium besteht aus drei Isotopen: Si (28), Si (29), Si (30).
Chemische Eigenschaften: elektronische Konfiguration: 1s22s22p63 s23p2 . Silizium ist ein Nichtmetall. Auf der externen Energieebene hat Silizium 4 Elektronen, die seine Oxidationsstufen bestimmen: +4, -4, -2. Wertigkeit - 2, 4. Amorphes Silizium hat eine größere Reaktivität als kristallines. Unter normalen Bedingungen interagiert es mit Fluor: Si + 2F2 = SiF4. Bei 1000 °C reagiert Si mit Nichtmetallen: mit CL2, N2, C, S.
Von den Säuren interagiert Silizium nur mit einer Mischung aus Salpeter- und Flusssäure:
Gegenüber Metallen verhält es sich anders: es löst sich gut in geschmolzenem Zn, Al, Sn, Pb, reagiert aber nicht mit ihnen; mit anderen Metallschmelzen - mit Mg, Cu, Fe interagiert Silizium mit der Bildung von Siliziden: Si + 2Mg = Mg2Si. Silizium brennt in Sauerstoff: Si + O2 = SiO2 (Sand).
Siliziumdioxid oder Kieselerde- stabile Verbindung Si, ist in der Natur weit verbreitet. Es reagiert mit seiner Fusion mit Alkalien, basischen Oxiden und bildet Kieselsäuresalze - Silikate. Erhalt: in der Siliziumindustrie rein erhalten durch Reduktion von Siliziumdioxid mit Koks in Elektroöfen: SiO2 + 2С = Si + 2СO?.
Im Labor wird Silizium durch Kalzinieren von weißem Sand mit Magnesium oder Aluminium gewonnen:
SiO2 + 2Mg = 2MgO + Si.
3SiO2 + 4Al = Al2O3 + 3Si.
Silizium bildet Säuren: H2 SiO3 - Metakieselsäure; H2 Si2O5 ist zwei Metakieselsäure.
In der Natur finden: Quarzmineral - SiO2. Quarzkristalle haben die Form eines sechseckigen Prismas, farblos und transparent, Bergkristall genannt. Amethyst - Bergkristall, lila gefärbt mit Verunreinigungen; Rauchtopas ist bräunlich bemalt; Achat und Jaspis sind kristalline Sorten von Quarz. Amorphes Siliziumdioxid ist weniger verbreitet und existiert in Form des Minerals Opal, SiO2 nH2O. Diatomeenerde, Tripol oder Kieselgur (Diatomeenerde) sind erdige Formen von amorphem Silizium.
42. Das Konzept kolloidaler Lösungen
Kolloidale Lösungen– hochdisperse Zweiphasensysteme bestehend aus einem Dispersionsmedium und einer dispergierten Phase. Die Teilchengrößen liegen zwischen echten Lösungen, Suspensionen und Emulsionen. Bei Kolloidale Teilchen molekulare oder ionische Zusammensetzung.
Es gibt drei Arten der inneren Struktur von Primärteilchen.
1. Suspensoide (oder irreversible Kolloide)– heterogene Systeme, deren Eigenschaften durch eine entwickelte Grenzfläche bestimmt werden können. Im Vergleich zu Suspensionen sind sie höher dispergiert. Ohne einen Dispersionsstabilisator können sie nicht lange bestehen. Sie heißen irreversible Kolloide aufgrund der Tatsache, dass ihre Ausfällung nach dem Verdampfen wieder keine Sole bildet. Ihre Konzentration ist niedrig - 0,1%. Sie weichen geringfügig von der Viskosität des dispergierten Mediums ab.
Suspensoide sind erhältlich:
1) Dispersionsverfahren (Mahlen großer Körper);
2) Kondensationsmethoden (Erhalt unlöslicher Verbindungen durch Austauschreaktionen, Hydrolyse usw.).
Die spontane Abnahme der Dispersion in Suspensoiden hängt von der freien Oberflächenenergie ab. Um eine lang anhaltende Suspension zu erhalten, sind Bedingungen für ihre Stabilisierung erforderlich.
Stabile disperse Systeme:
1) Dispersionsmedium;
2) dispergierte Phase;
3) Stabilisator des dispersen Systems.
Der Stabilisator kann ionisch, molekular, aber meistens hochmolekular sein.
Schutzkolloide- makromolekulare Verbindungen, die zur Stabilisierung zugesetzt werden (Proteine, Peptide, Polyvinylalkohol etc.).
2. Assoziative (oder mizellare Kolloide) - Halbkolloide, die bei ausreichender Konzentration von Molekülen entstehen, die aus Kohlenwasserstoffresten (amphiphilen Molekülen) niedermolekularer Substanzen bestehen, während sie sich zu Molekülaggregaten (Micellen) verbinden. Mizellen entstehen in wässrigen Lösungen von Waschmitteln (Seifen), organischen Farbstoffen.
3. Molekulare Kolloide (reversible oder lyophile Kolloide) - natürliche und synthetische Substanzen mit hohem Molekulargewicht. Ihre Moleküle haben die Größe kolloidaler Teilchen (Makromoleküle).
Verdünnte Lösungen von Kolloiden makromolekularer Verbindungen sind homogene Lösungen. Bei starker Verdünnung gehorchen diese Lösungen den Gesetzen verdünnter Lösungen.
Unpolare Makromoleküle lösen sich in Kohlenwasserstoffen, polare - in polaren Lösungsmitteln.
Reversible Kolloide- Stoffe, deren Trockenrückstand bei Zugabe einer neuen Portion Lösungsmittel wieder in Lösung geht.
Elementcharakteristik
14 Si 1s 2 2s 2 2p 6 3s 2 3p 2
Isotope: 28 Si (92,27 %); 29Si (4,68 %); 30 Si (3,05 %)
Silizium ist nach Sauerstoff (27,6 Masse-%) das zweithäufigste Element in der Erdkruste. Es kommt in der Natur nicht in freier Form vor, sondern hauptsächlich in Form von SiO 2 oder Silikaten.
Si-Verbindungen sind giftig; Inhalation kleinste Teilchen SiO 2 und andere Siliziumverbindungen (zB Asbest) verursacht gefährliche Krankheit- Silikose
Das Siliziumatom hat im Grundzustand die Wertigkeit = II und im angeregten Zustand = IV.
Die stabilste Oxidationsstufe von Si ist +4. In Verbindungen mit Metallen (Siliciden), S.O. -4.
Verfahren zur Gewinnung von Silizium
Die häufigste natürliche Siliziumverbindung ist Kieselsäure (Siliziumdioxid) SiO 2 . Es ist der wichtigste Rohstoff für die Herstellung von Silizium.
1) Rückgewinnung von SiO 2 mit Kohlenstoff in Lichtbogenöfen bei 1800 "C: SiO 2 + 2C \u003d Si + 2CO
2) Hochreines Si aus einem technischen Produkt wird nach folgendem Schema gewonnen:
a) Si → SiCl 2 → Si
b) Si → Mg 2 Si → SiH 4 → Si
Physikalische Eigenschaften von Silizium. Allotrope Modifikationen von Silizium
1) Kristallines Silizium - eine silbergraue Substanz mit metallischem Glanz, ein diamantartiges Kristallgitter; Schmelzpunkt 1415 "C, Sdp. 3249" C, Dichte 2,33 g/cm³; ist ein Halbleiter.
2) Amorphes Silizium – braunes Pulver.
Chemische Eigenschaften von Silizium
Bei den meisten Reaktionen wirkt Si als Reduktionsmittel:
Bei niedrige Temperaturen Silizium ist chemisch inert, beim Erhitzen steigt seine Reaktivität stark an.
1. Es interagiert mit Sauerstoff bei T über 400 °C:
Si + O 2 \u003d SiO 2 Siliziumoxid
2. Reagiert bereits bei Raumtemperatur mit Fluor:
Si + 2F 2 = SiF 4 Siliziumtetrafluorid
3. Reaktionen mit anderen Halogenen laufen bei einer Temperatur von = 300 - 500 ° C ab
Si + 2 Hal 2 = Si Hal 4
4. Mit Schwefeldampf bei 600 ° C bildet sich ein Disulfid:
5. Reaktion mit Stickstoff erfolgt über 1000 °C:
3Si + 2N 2 = Si 3 N 4 Siliziumnitrid
6. Bei einer Temperatur = 1150°С reagiert es mit Kohlenstoff:
SiO 2 + 3C \u003d SiC + 2CO
Carborundum hat eine ähnliche Härte wie Diamant.
7. Silizium reagiert nicht direkt mit Wasserstoff.
8. Silizium ist säurebeständig. Interagiert nur mit einer Mischung aus Salpetersäure und Flusssäure (Flusssäure):
3Si + 12HF + 4HNO 3 = 3SiF 4 + 4NO + 8H 2 O
9. reagiert mit Alkalilösungen unter Bildung von Silikaten und Freisetzung von Wasserstoff:
Si + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 2H 2
10. Die reduzierenden Eigenschaften von Silizium werden genutzt, um Metalle von ihren Oxiden zu isolieren:
2MgO \u003d Si \u003d 2Mg + SiO 2
Bei Reaktionen mit Metallen ist Si ein Oxidationsmittel:
Silizium bildet mit S-Metallen und den meisten D-Metallen Silizide.
Zusammensetzung von Siliziden Metall gegeben kann anders sein. (Zum Beispiel FeSi und FeSi 2; Ni 2 Si und NiSi 2.) Eines der bekanntesten Silizide ist Magnesiumsilizid, das durch direkte Wechselwirkung einfacher Substanzen erhalten werden kann:
2Mg + Si = Mg 2 Si
Silan (Monosilan) SiH 4
Silane (Siliciumwasserstoffe) Si n H 2n + 2, (vergleiche mit Alkanen), wobei n \u003d 1-8. Silane - Analoga von Alkanen, unterscheiden sich von ihnen durch die Instabilität von -Si-Si-Ketten.
Monosilan SiH 4 ist ein farbloses Gas mit schlechter Geruch; löslich in Ethanol, Benzin.
Wege zu bekommen:
1. Zersetzung von Magnesiumsilizid mit Salzsäure: Mg 2 Si + 4HCI = 2MgCI 2 + SiH 4
2. Reduktion von Si-Halogeniden mit Lithiumaluminiumhydrid: SiCl 4 + LiAlH 4 = SiH 4 + LiCl + AlCl 3
Chemische Eigenschaften.
Silan ist ein starkes Reduktionsmittel.
1.SiH 4 wird bereits bei sehr niedrigen Temperaturen durch Sauerstoff oxidiert:
SiH 4 + 2O 2 \u003d SiO 2 + 2H 2 O
2. SiH 4 wird leicht hydrolysiert, insbesondere in alkalischem Milieu:
SiH 4 + 2H 2 O \u003d SiO 2 + 4H 2
SiH 4 + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 4H 2
Silizium(IV)oxid (Silica) SiO 2
Silica existiert in der Form verschiedene Formen: kristallin, amorph und glasig. Die häufigste kristalline Form ist Quarz. Wenn Quarzgestein zerstört wird, entsteht Quarzsand. Quarz-Einkristalle sind transparent, farblos (Bergkristall) oder mit Verunreinigungen in verschiedenen Farben (Amethyst, Achat, Jaspis etc.) eingefärbt.
Amorphes SiO 2 kommt in Form des Minerals Opal vor: Kieselgel wird künstlich gewonnen, besteht aus kolloidalen SiO 2 -Partikeln und ist ein sehr gutes Adsorptionsmittel. Glasartiges SiO 2 ist als Quarzglas bekannt.
Physikalische Eigenschaften
In Wasser löst sich SiO 2 sehr wenig, in organischen Lösungsmitteln löst es sich ebenfalls praktisch nicht. Silizium ist ein Dielektrikum.
Chemische Eigenschaften
1. SiO 2 ist ein saures Oxid, daher löst sich amorphes Siliziumdioxid langsam in wässrigen Lösungen von Alkalien:
SiO 2 + 2NaOH \u003d Na 2 SiO 3 + H 2 O
2. SiO 2 wechselwirkt auch beim Erhitzen mit basische Oxide:
SiO 2 + K 2 O \u003d K 2 SiO 3;
SiO 2 + CaO \u003d CaSiO 3
3. Als nichtflüchtiges Oxid verdrängt SiO 2 Kohlendioxid aus Na 2 CO 3 (während der Fusion):
SiO 2 + Na 2 CO 3 \u003d Na 2 SiO 3 + CO 2
4. Kieselsäure reagiert mit Flusssäure zu Fluorwasserstoffkieselsäure H 2 SiF 6:
SiO 2 + 6HF \u003d H 2 SiF 6 + 2H 2 O
5. Bei 250 - 400 ° C interagiert SiO 2 mit gasförmigem HF und F 2 und bildet Tetrafluorsilan (Siliciumtetrafluorid):
SiO 2 + 4HF (gas.) \u003d SiF 4 + 2H 2 O
SiO 2 + 2F 2 \u003d SiF 4 + O 2
Kieselsäuren
Bekannt:
Orthokieselsäure H 4 SiO 4 ;
Metakieselsäure H 2 SiO 3 ;
Di- und Polykieselsäuren.
Alle Kieselsäuren sind in Wasser schwer löslich und bilden leicht kolloidale Lösungen.
Wege zu empfangen
1. Fällung durch Säuren aus Lösungen von Alkalimetallsilikaten:
Na 2 SiO 3 + 2 HCl \u003d H 2 SiO 3 ↓ + 2 NaCl
2. Hydrolyse von Chlorsilanen: SiCl 4 + 4H 2 O \u003d H 4 SiO 4 + 4HCl
Chemische Eigenschaften
Kieselsäuren sind sehr schwache Säuren (schwächer als Kohlensäure).
Beim Erhitzen dehydrieren sie und bilden als Endprodukt Kieselsäure.
H 4 SiO 4 → H 2 SiO 3 → SiO 2
Silikate - Salze von Kieselsäuren
Da Kieselsäuren extrem schwach sind, werden ihre Salze in wässrigen Lösungen stark hydrolysiert:
Na 2 SiO 3 + H 2 O \u003d NaHSiO 3 + NaOH
SiO 3 2- + H 2 O \u003d HSiO 3 - + OH - (alkalisches Medium)
Aus dem gleichen Grund beim Vorbeigehen Kohlendioxid Kieselsäure wird aus ihnen durch Silikatlösungen verdrängt:
K 2 SiO 3 + CO 2 + H 2 O \u003d H 2 SiO 3 ↓ + K 2 CO 3
SiO 3 + CO 2 + H 2 O \u003d H 2 SiO 3 ↓ + CO 3
Diese Reaktion kann als qualitative Reaktion für Silikat-Ionen angesehen werden.
Unter den Silikaten sind nur Na 2 SiO 3 und K 2 SiO 3 gut löslich, die als lösliches Glas bezeichnet werden, und ihre wässrigen Lösungen sind es flüssiges Glas.
Glas
Gewöhnliches Fensterglas hat die Zusammensetzung Na 2 O CaO 6SiO 2 , ist also eine Mischung aus Natrium- und Calciumsilikaten. Es wird durch Schmelzen von Soda Na 2 CO 3 , CaCO 3 Kalkstein und SiO 2 Sand erhalten;
Na 2 CO 3 + CaCO 3 + 6SiO 2 \u003d Na 2 O CaO 6SiO 2 + 2CO 2
Zement
Ein pulverförmiges Bindemittel, das bei Wechselwirkung mit Wasser eine plastische Masse bildet, die sich schließlich in einen festen steinähnlichen Körper verwandelt; Hauptbaustoff.
Die chemische Zusammensetzung des gebräuchlichsten Portlandzements (in Gew.-%) - 20 - 23% SiO 2; 62–76 % CaO; 4–7 % Al203; 2–5 % Fe 2 O 3 ; 1-5 % MgO.
Silizium. Physikalische und chemische Eigenschaften von Silizium
Silizium ist ein Element der Hauptuntergruppe der vierten Gruppe der dritten Periode des Periodensystems der chemischen Elemente D.I. Mendelejew, mit der Ordnungszahl 14. Bezeichnet mit dem Symbol Si (lat. Silizium), Nichtmetall. Physikalische Eigenschaften: Kristallines Silizium hat einen metallischen Glanz, feuerfest, sehr hart, Halbleiter. 2. Chemische Eigenschaften: Silizium ist inaktiv: a) bei erhöhten Temperaturen (400-600
- b) aus komplexen Stoffen reagiert Silizium mit Alkalien
- c) reagiert mit Metallen unter Bildung von Siliziden
Kieselsäure, ihre Eigenschaften und Anwendungen. Natürliche und industrielle Silikate. Ihre Verwendung im Bauwesen
Silizium(IV)oxid (Siliziumdioxid, Kieselerde SiO2) - farblose Kristalle, Schmp. 1713 - 1728 ° C, haben eine hohe Härte und Festigkeit.
Siliziumdioxid wird bei der Herstellung von Glas, Keramik, Schleifmitteln, Betonprodukten, zur Gewinnung von Silizium, als Füllstoff bei der Gummiherstellung, bei der Herstellung von feuerfesten Kieselsäuren, in der Chromatographie usw. verwendet. Quarzkristalle haben piezoelektrische Eigenschaften und sind daher Einsatz in der Funktechnik, Ultraschallanlagen, in Feuerzeugen. Siliziumdioxid ist der Hauptbestandteil fast aller terrestrischen Gesteine, insbesondere der Diatomeenerde. Kieselsäure und Silikate machen 87 % der Masse der Lithosphäre aus. Amorphes nichtporöses Siliziumdioxid wird in der Lebensmittelindustrie als Trennmittel und Trennhilfsstoff E551, in Parapharmazeutika (Zahnpasten), in der pharmazeutischen Industrie als Hilfsstoff (in den meisten Arzneibüchern aufgeführt) sowie als Lebensmittelzusatzstoff verwendet oder medizinisches Produkt als Enterosorbens. Künstlich gewonnene Schichten aus Siliziumdioxid werden als Isolator bei der Herstellung von Mikroschaltkreisen und anderen elektronischen Bauteilen verwendet. Wird auch zur Herstellung von Glasfaserkabeln verwendet. Es wird reines Quarzglas unter Zugabe einiger spezieller Inhaltsstoffe verwendet. Silica-Filament wird auch in den Heizelementen von elektronischen Zigaretten verwendet, da es Flüssigkeit gut aufnimmt und unter der Erwärmung der Spule nicht kollabiert. Als Halbedelsteine werden große transparente Quarzkristalle verwendet; farblose Kristalle heißen Bergkristall, violett - Amethyste, gelb - Citrin. In der Mikroelektronik ist Siliziumdioxid eines der Hauptmaterialien. Es wird als Isolierschicht sowie als Schutzbeschichtung verwendet. Erhalten in Form von dünnen Filmen durch thermische Oxidation von Silizium, chemische Gasphasenabscheidung, Magnetron-Sputtern. Siliziumdioxid SiO2 ist ein saures Oxid, das nicht mit Wasser reagiert. Chemisch beständig gegen Säuren, reagiert aber mit Fluorwasserstoffgas
und Flusssäure:
Diese beiden Reaktionen werden häufig zum Ätzen von Glas verwendet. Beim Schmelzen von SiO2 mit Alkalien und basischen Oxiden sowie mit Carbonaten aktiver Metalle entstehen Silikate - Salze sehr schwacher, wasserunlöslicher Kieselsäuren der allgemeinen Formel xH2O ySiO2, die keine konstante Zusammensetzung haben (ziemlich häufig werden in der Literatur nicht Kieselsäuren genannt, sondern Kieselsäure, obwohl wir eigentlich von der gleichen Substanz sprechen).
Beispielsweise kann Natriumorthosilikat erhalten werden:
Calciummetasilikat:
oder gemischtes Calcium- und Natriumsilikat:
aus Silikat
Na2CaSi6O14 (Na2O CaO 6SiO2)
Fensterglas herstellen. Die meisten Silikate haben keine dauerhafte Zusammensetzung. Von allen Silikaten sind nur Natrium- und Kaliumsilikate wasserlöslich. Lösungen dieser Silikate in Wasser werden als Flüssigglas bezeichnet. Bedingt durch Hydrolyse sind diese Lösungen stark durchgeprägt alkalische Umgebung. Hydrolysierte Silikate zeichnen sich durch die Bildung nicht echter, sondern kolloidaler Lösungen aus. Beim Ansäuern von Lösungen von Natrium- oder Kaliumsilikaten fällt ein gallertartiger weißer Niederschlag von Kieselsäurehydraten aus. Das Hauptstrukturelement sowohl von festem Siliziumdioxid als auch von allen Silikaten ist die Gruppe, in der das Siliziumatom Si von einem Tetraeder aus vier Sauerstoffatomen O umgeben ist. Dabei ist jedes Sauerstoffatom mit zwei Siliziumatomen verbunden. Fragmente können auf unterschiedliche Weise miteinander verknüpft werden. Unter den Silicaten werden die Fragmente entsprechend der Art der Bindungen in ihnen in Insel-, Ketten-, Band-, Schicht-, Gerüst- und andere unterteilt. Silikate sind eine umfangreiche Klasse von Verbindungen, die aus Siliziumdioxid (Kieselsäure) und Oxiden anderer Elemente gebildet werden. SILIKATE IN DER NATUR. Um die Rolle der Silikate im menschlichen Leben zu verstehen, lassen Sie uns zunächst auf die Struktur der Erde eingehen. Nach modernen Vorstellungen besteht der Globus aus mehreren Schalen. Die äußere Hülle der Erde, die Erdkruste oder Lithosphäre, wird von Granit- und Basaltschalen und einer dünnen Sedimentschicht gebildet. Die Granitschale besteht hauptsächlich aus Granit - dichten Verwachsungen von Feldspäten, Glimmer, Amphibolen und Pyroxenen, und die Basaltschale besteht aus granitähnlichen, aber schwereren Silikatgesteinen wie Gabbro, Diabase und Basalt. Sedimentgesteine entstehen durch die Zerstörung anderer Gesteine unter dem Einfluss von Bedingungen, die für die Erdoberfläche charakteristisch sind. Ein wesentlicher Bestandteil der Sedimentschicht sind insbesondere Tone, deren Basis das Silikatmineral Kaolinit ist. Lithosphäre bei 95 Gew. % wird von Silikaten gebildet. Seine durchschnittliche Dicke in der Region der Kontinente beträgt 30-40 km. Dann gibt es die Simatic-Schale oder den oberen Mantel, unter deren Mineralien wahrscheinlich Silikate von Eisen und Magnesium vorherrschen. Diese Schale bedeckt den gesamten Globus und reicht bis in eine Tiefe von 1200 km. Außerdem gibt es von 1200 bis 2900 km eine Zwischenschale. Seine Zusammensetzung ist umstritten, aber auch die Existenz von Silikaten wird darin vermutet. Unter dieser Schale in einer Tiefe von 2900 bis 6370 km befindet sich der Kern. IN In letzter Zeit es wurde vorgeschlagen, dass der Kern auch eine Silikatzusammensetzung hat. Bei der Bewegung von der Erdoberfläche zu ihrem Zentrum nehmen die Dichte und Basizität der Gesteine zu (das Verhältnis zwischen dem Gehalt an Metalloxiden und Kieselsäure nimmt zu), Druck und Temperatur. Die ältesten Werkzeuge wurden vom Menschen aus Feuerstein hergestellt - einem dichten Aggregat aus Chalzedon, Quarz und Opal (800-60.000 Jahre v. Chr.). Später wurden dafür Jaspis, Bergkristall, Achat, Obsidian (vulkanisches Silikatglas), Jade verwendet.Es gibt keine allgemein akzeptierte Taxonomie (mineralogische Nomenklatur) für Silikatmineralien, ihre Namen stammen meistens aus dem Aussehen von Kristallen, ihren physikalischen Eigenschaften, Standort oder Namen des Wissenschaftlers, der sie entdeckt hat. Plagioklas bedeutet im Griechischen schräg gespalten und Pyroxen bedeutet feuerfest, was den Eigenschaften dieser Mineralien entspricht. Quarzmineralien haben je nach Art der Verunreinigungen eine breite Palette von Farben, die ihre Namen bestimmen: Amethyst - Purpur, Citrin - Gelb, Bergkristall - Eis. Modifikationen von Stishovit und Coesit-Kieselerde und Biotit-Mineral stammen von den Namen der Wissenschaftler, die sie entdeckt haben, S.M. Stishov, L. Coes und J.B. Bio, und das Mineral Kaolinit hat seinen Namen vom Berg Kaoling in China, wo seit langem Ton für die Porzellanherstellung abgebaut wird. Natürliche Silikate und Kieselsäure selbst spielen als Rohstoffe und Endprodukte in industriellen Prozessen eine wichtige Rolle. Alumosilikate - Plagioklas, Kalifeldspat und Kieselerde werden als Rohstoffe in der Keramik-, Glas- und Zementindustrie verwendet. Für die Herstellung von feuerfesten und elektrisch isolierenden Textilprodukten (Stoffe, Schnüre, Seile) wird Asbest, verwandt mit Hydrosilikaten - Amphibolen, weit verbreitet. Einige Asbestarten sind sehr säurebeständig und werden in der chemischen Industrie verwendet. Biotites, Mitglieder der Glimmergruppe, werden als elektrische und verwendet Materialien zur Wärmedämmung in Konstruktion und Instrumentierung. Pyroxene werden in der Metallurgie und in der Steingussindustrie verwendet, und LiAl-Pyroxen wird verwendet, um metallisches Lithium zu erhalten. Pyroxene sind Bestandteil Hochofenschlacken und NE-Metallurgieschlacken, die wiederum auch in der nationale Wirtschaft. Gesteine wie Granite, Basalte, Gabbro, Diabas sind hervorragende Baumaterialien. SILIKATE KÜNSTLICHEN URSPRUNGS. Ohne Silikatstoffe - verschiedene Sorten Zement, Beton, Hüttenbeton, Keramik, Glas, Beschichtungen in Form von Emails und Glasuren, kann man sich kaum vorstellen Alltagsleben. Der Umfang der Produktion von Silikatmaterialien scheint beeindruckende Zahlen zu sein. In dem Artikel werden wir nicht auf die Art und Anwendung von Brillen eingehen. Diese Fragen wurden bereits in berücksichtigt. Die ältesten Silikatmaterialien sind Keramiken, die aus Tonen und deren Mischungen mit verschiedenen mineralischen Zusätzen gewonnen und zu einem steinähnlichen Zustand gebrannt werden. IN antike Welt Keramikprodukte wurden auf der ganzen Erde verbreitet. Ab dem zweiten Hälfte XIX Jahrhunderts und bis heute hat die industrielle Keramikindustrie die Produktion und das Sortiment von Keramik unermesslich erweitert. Ein Beispiel für ein künstliches Silikatmaterial ist Portlandzement, eine der gebräuchlichsten Arten von mineralischen Bindemitteln. Zement wird zum Binden von Bauteilen verwendet, um massive Bausteine, Platten, Rohre und Ziegel herzustellen. Zement ist die Grundlage für solche weit verbreitet Baumaterial wie Beton, Hüttenbeton, Stahlbeton. Konstruktionen jeglicher Größenordnung können ohne Zement nicht existieren. Im Schulkurs Chemie werden grundlegende Vorstellungen über die chemische Zusammensetzung und Technologie von Zement vermittelt, so dass wir uns nur auf einige klärende Details beschränken. Zunächst einmal ist Zementklinker das Brennprodukt einer Mischung aus Ton und Kalkstein, und Zement ist fein gemahlener Klinker mit mineralischen Zusätzen, die seine Eigenschaften regulieren. Zement wird mit Sand und Wasser gemischt verwendet. Seine adstringierenden Eigenschaften sind auf die Fähigkeit von Zementmineralien zurückzuführen, mit H2O und SiO2 zu interagieren und so zu härten und eine starke steinähnliche Struktur zu bilden. Beim Abbinden von Zement treten komplexe Prozesse auf: Hydratation von Mineralien mit der Bildung von Hydrosilikaten und Hydroaluminaten, Hydrolyse, Bildung von kolloidalen Lösungen und deren Kristallisation. Erforschung von Härteprozessen Zementmörtel und Zementklinkermineralien spielten eine große Rolle bei der Entwicklung der Silikatwissenschaft und ihrer Technologie. Unsere Baustellen verbrauchen große Mengen an Zement, Ziegeln, Fassadenplatten, Fliesen, Abwasserrohren, Glas und diversen Naturbaustoffen.
Silikonmineral Silizium Eine Vielzahl von Kieselsäuren - schwarz, dunkelgrau oder hell - ist in der Natur weit verbreitet, und eine Person ist damit gut vertraut. Aber ach heilenden Eigenschaften Silizium wurde erst vor kurzem bekannt: in den späten 70er Jahren des 20. Jahrhunderts. Obwohl die Menschheit Silizium sehr lange kennengelernt hat.
Feuerstein ist der Stein, der den Beginn der menschlichen Zivilisation markierte. Während der gesamten Steinzeit diente Feuerstein als Material für die Herstellung von Werkzeugen und die Jagd, mit seiner Hilfe wurde Feuer abgebaut. Die heilenden Eigenschaften von Feuerstein werden in den Abhandlungen antiker Philosophen erwähnt. Es wurde zum Schneiden von Warzen verwendet, zum Dekorieren von Wänden in Räumen, in denen Fleisch gelagert wurde, zum Pudern von Wunden in Form eines Pulvers, das Wundbrand verhinderte, Mühlsteine aus Feuerstein in Mühlen ermöglichten es, Mehl mit hervorragenden Back- und Geschmackseigenschaften zu erhalten. Seit der Antike wurden der Boden und die Innenfläche der Brunnen mit Feuerstein ausgekleidet, da festgestellt wurde, dass Menschen, die Wasser aus solchen Brunnen trinken, weniger krank werden und dieses Wasser ungewöhnlich klar, wohlschmeckend und heilend ist.
In der Natur kommt Silizium in Form von weit verbreiteten Mineralien vor - Quarz, Chalcedon, Opal und andere.Die Gruppe dieser Mineralien umfasst Karneol, Und Jaspis, Bergkristall, Achat, Opal, Amethyst und viele andere Steine. Die Basis dieser Mineralien ist Siliziumdioxid oder Kieselsäure, aber die Dichte, Farbe und einige andere Eigenschaften sind unterschiedlich. Die Zusammensetzung von Feuersteinen umfasst neben Kieselsäure etwa 20 chemische Elemente, von denen die wichtigsten Mg, Ca, P, Sr, Mn, Cu, Zn usw. sind. Daher die vielen Namen. Aber der berühmteste unter den Vertretern dieser Familie ist zweifellos Feuerstein. Der größte Teil der Erdkruste besteht aus organische Verbindungen Silizium (28 Vol.-%).
Silizium (Silicium - lat.) chemisches Element, Ordnungszahl 14, IV Gruppe des Periodensystems. Siliziumatome bilden die Grundlage von Ton, Sand und Gestein. Wir können sagen, dass die gesamte anorganische Welt mit Silizium verbunden ist. IN natürliche Bedingungen Siliziummineralien sind in Calcit und Kreide enthalten.
Silizium ist nach Sauerstoff das zweithäufigste Element in der Erdkruste und macht etwa ein Drittel ihres Gesamtgewichts aus. Jedes 6. Atom in der Erdkruste ist ein Siliziumatom. Meerwasser enthält sogar mehr Silizium als Phosphor, das für das Leben auf der Erde so wichtig ist.
In unserem Körper kommt Silizium vor Schilddrüse, Nebennieren, Hypophyse. Die höchste Konzentration findet sich in Haaren und Nägeln.
Silizium ist auch Bestandteil von Kollagen, dem Hauptprotein im Bindegewebe. Seine Hauptaufgabe ist die Teilnahme an einer chemischen Reaktion, die einzelne Kollagen- und Elastinfasern zusammenhält und dem Bindegewebe Festigkeit und Elastizität verleiht. Silizium ist auch Bestandteil des Kollagens von Haaren und Nägeln und spielt eine wichtige Rolle bei der Knochenfusion bei Frakturen.
Silizium spielt eine besondere Rolle für das Leben und die Gesundheit des Menschen sowie für Flora und Fauna. Silizium wird von Pflanzen in Form von gelösten Kieselsäuren, Silikaten und kolloidaler Kieselsäure aufgenommen. Der Mangel an Silizium beeinträchtigt die Keimung, das Wachstum und den Ertrag von Getreide, hauptsächlich Reis, sowie Zuckerrohr, Sonnenblume, Feldfrüchten wie Kartoffeln, Rüben, Karotten, Gurken und Tomaten. Mit Gemüse, Obst, Milch, Fleisch und anderen Produkten sollte eine Person täglich 10-20 mg Silizium zu sich nehmen. Diese Menge ist für das normale Leben, Wachstum und die Entwicklung des Körpers notwendig.
Wissenschaftliche Forschungüber die Rolle von Silizium für die menschliche Gesundheit sind in den Monographien von V. Krivenko und anderen "Lithotherapie", M., 1994, E. Mikheeva "Heilende Eigenschaften von Silizium", S-P, 2002, den Arbeiten von M. Voronkov und I B. Kuznetsov (AS UdSSR, Sib. otd., 1984), A. Panicheva, L. Zardashvili, N. Semenova usw. Es wird gezeigt, dass Silizium am Austausch von Fluor, Magnesium, Aluminium und anderen Mineralverbindungen beteiligt ist, interagiert aber besonders eng mit Strontium und Calcium. Einer der Wirkungsmechanismen von Silizium ist das aufgrund seiner chemische Eigenschaften es erzeugt elektrisch geladene kolloidale Systeme, die in der Lage sind, für den Menschen ungewöhnliche Viren und Krankheitserreger zu adsorbieren.
Einige Pflanzen sind in der Lage, Silizium zu konzentrieren. Das Topinambur, Rettich, Olive A, Johannisbeere, Schachtelhalm usw. Viel Silizium reichert sich in Getreide an, besonders in der Samenschale (Kleie): Reis, Hafer, Hirse, Gerste, Sojabohnen. Beim Mahlen von Getreide in einer Mühle werden diese von der Schale befreit, was ihnen Silizium entzieht und sie dadurch entwertet.
reich an Silizium u Mineralwasser. Aber raffinierter Zucker ist praktisch frei von Silizium. Nur unraffinierter gelber Zucker hat Silizium und stellt daher dar großer Wert.
Schachtelhalme zeichnen sich durch einen hohen Gehalt an Silizium aus - weit verbreitete Pflanzen der heimischen Flora, die in den letzten Jahren immer häufiger verwendet werden. Volksmedizin. In dieser Hinsicht haben sich Klettenölextrakt, Schachtelhalmextrakt, organische Siliziumverbindungen (Ceramide), die Bestandteil eines Arzneimittels namens Klettenöl mit Schachtelhalmextrakt (mit Ceramiden) sind, bewährt. Spezielle Studien haben gezeigt, dass dieses Arzneimittel:
Empfehlungen für die Verwendung: Verletzung der Haarstruktur, durch äußere oder interne Faktoren, sowie dünner werdendes und stumpfes Aussehen der Haare.
Art der Anwendung: Tragen Sie warmes Öl auf Haar und Kopfhaut auf, reiben Sie es mindestens 15 Minuten lang sanft und gründlich ein (vermeiden Sie plötzliche und intensive Bewegungen, da dies das Haar bricht und ausreißt), und verteilen Sie das Öl dann gleichmäßig über die gesamte Länge des Haares. 1 Stunde auftragen, dann mit einem milden Shampoo auswaschen.
Silizium ist auch für die Bereitstellung von Schutzfunktionen, Stoffwechselprozessen und Entgiftung verantwortlich. Es wirkt als biologisches „Vernetzungsmittel“, das an der Bildung der molekularen „Architektur“ von Polysacchariden und ihren Komplexen mit Proteinen beteiligt ist, verleiht dem Bindegewebe Elastizität, ist Teil des Elastins von Blutgefäßen, verleiht Festigkeit, Elastizität und Undurchlässigkeit an ihre Wände und verhindert das Eindringen von Lipiden in das Blutplasma.
Studien haben gezeigt, dass Silizium im Wasser Bakterien unterdrückt, die Gärung und Fäulnis verursachen, Schwermetalle ausfällen, Chlor neutralisieren und Radionuklide absorbieren. In einem lebenden Organismus tragen biologisch aktive Substanzen des Siliziums zusammen mit Proteinstrukturen zur Bildung von Enzymen, Aminosäuren und Hormonen bei. Silizium wird vor allem im Bindegewebe benötigt, es kommt in der Schilddrüse, den Nebennieren und der Hypophyse vor. Viel Silizium im Haar. Die höchste Konzentration findet sich in Haaren und Nägeln.
Silizium:
Mangel an Silizium im Körper führt zu:
Es wurde ein Zusammenhang zwischen der Konzentration von Silizium in gefunden Wasser trinken und Herz-Kreislauf-Erkrankungen. Tuberkulose, Diabetes, Lepra, Hepatitis, Bluthochdruck, grauer Star, Arthritis, Krebs werden von einer Abnahme der Siliziumkonzentration in Geweben und Organen oder Störungen im Stoffwechsel begleitet.
Währenddessen verliert unser Körper täglich Silizium – im Durchschnitt nehmen wir täglich 3,5 mg Silizium mit Nahrung und Wasser zu uns und verlieren etwa 9 mg!
Ursachen für Siliziummangel im Körper:
Normalerweise tritt eine Abnahme des Siliziumgehalts vor dem Hintergrund eines allgemeinen Mineralstoffmangels auf und wird von einem Mangel an Magnesium und Kalzium begleitet.
Anzeichen von Siliziummangel:
Es ist bekannt, dass das biologische Alter einer Person durch die Geschwindigkeit von Stoffwechselprozessen bestimmt wird, d.h. Erneuerungsrate als einzelne Zellen. Und wenn viele kosmetische Präparate das Problem der Feuchtigkeitsversorgung und des Schutzes einigermaßen lösen können, dann erfordert das Problem der Stoffwechselbeschleunigung eine intensivere Veränderung der äußeren Hautschicht.
Die Verlangsamung der Regenerationsprozesse der Haut beginnt etwa im Alter von 30 Jahren. Zu diesem Zeitpunkt beginnt der Körper bereits den Mangel an Silizium zu spüren. Unser Körper kann einen Siliziummangel nicht alleine ausgleichen, da die uns umgebenden natürlichen Siliziumverbindungen größtenteils biologisch inaktiv sind und nicht an biochemischen Reaktionen innerhalb der Zelle teilnehmen können.
Silizium ist schön kosmetisches Produkt. Es reinigt die Haut von Pustelbildungen. Es ist besonders nützlich, mit Silikonwasser zu waschen und es bei jugendlicher Akne nach innen zu bringen. Im Rahmen der Forschung haben Wissenschaftler eine neue Klasse organischer Siliziumverbindungen geschaffen, die Stoffwechselprozesse in der Haut beschleunigen und durch die Beteiligung an der Synthese von Elastin- und Kollagen-Bindegewebsproteinen die Hautelastizität erhöhen und Falten beseitigen können.
Von WGN patentierte siliziumhaltige Verbindungen beschleunigen Stoffwechselvorgänge in Zellen, regenerieren Elastin- und Kollagenfasern. Die Ergebnisse der Herstellung aktiver Nanosiliciumverbindungen bildeten die Grundlage für die Entwicklung der NewAge-Linie von sogenannten "Nanosilicium" -Kosmetikpräparaten.
Bioaktives Nanosilizium dringt in die tiefen Hautschichten ein, reinigt diese und bietet einen Schutz, der die natürliche Durchlässigkeit und Atmungsaktivität der Haut bewahrt. Nonosilizium, das die Proliferations- und Regenerationsprozesse stimuliert, beschleunigt die Erneuerung der Epidermis und stellt die Funktionen der Hautzellen - Fibroblasten - wieder her.
Die Vorteile der Silikonkosmetik sind die dermatologische Verträglichkeit der Komponenten; die Möglichkeit der Verwendung für jeden Hauttyp, einschließlich empfindlicher Haut; hohe Wirkungseffizienz, sanfte Stimulation natürlicher biochemischer Mechanismen des Funktionszustands der Haut.
Bei der Interaktion mit Wasser verändert Feuerstein seine Eigenschaften. Durch Feuerstein aktiviertes Wasser wirkt sich nachteilig auf Mikroorganismen aus, unterdrückt Bakterien, die Fäulnis und Gärung verursachen, es tritt eine aktive Ausfällung von Schwermetallverbindungen auf, Wasser wird sauber im Aussehen und angenehm im Geschmack, es verschlechtert sich nicht lange und nimmt viele an andere heilende Eigenschaften.
Flint gehört zu den Mineralien aus der Familie der Quarze oder Chalcedone. Die Gruppe dieser Mineralien umfasst Karneol, Jaspis, Bergkristall, Achat, Opal, Amethyst und viele andere Steine. Die Basis dieser Mineralien ist Siliziumdioxid SiO2 oder Kieselsäure, aber die Dichte, Farbe und einige andere Eigenschaften sind unterschiedlich. Die Zusammensetzung von Feuersteinen umfasst neben Kieselsäure etwa 20 chemische Elemente, von denen die wichtigsten Mg, Ca, P, Sr, Mn, Cu, Zn usw. sind. Daher die vielen Namen. Aber der berühmteste unter den Vertretern dieser Familie ist zweifellos Feuerstein.
Die Ursachen und Mechanismen der Wechselwirkung von Feuerstein mit Wasser sind noch nicht vollständig aufgeklärt. Vielleicht erklärt sich die heilende Wirkung von Silizium durch seine Fähigkeit, mit Wasser spezielle Verbindungen zu bilden - Kolloide, die Schmutz und fremde Mikroflora aus der Umgebung aufnehmen.
Wenn wir über die wohltuenden Eigenschaften von Silizium für den Körper sprechen, erinnern wir uns zunächst an Wasser. Der menschliche Körper besteht zu etwa 70 % aus Wasser und ist daher kaum wegzudenken. Und wenn wir bedenken, dass alle Arten von Stoffwechsel durchgeführt werden aquatische Umgebung dass es Wasser ist, das der Leiter der überwiegenden Mehrheit der physiologischen ist Lebensprozesse dass ohne ihn kein Leben möglich ist - Kohlenstoff, Silizium oder was auch immer, wird deutlich, dass durch Silizium aktiviertes Wasser von besonderer Bedeutung ist.
"...im System Feuerstein - wässrige Lösungen anorganischer Salze kommt es zu einer intensiven Abscheidung einer Reihe von Metallen: Aluminium, Eisen, Cadmium, Cäsium, Zink, Blei, Strontium."- P. Aladovsky, Leiter des Labors des Zentralen Forschungsinstituts für die Nutzung der Wasserressourcen, Doktor der Chemiewissenschaften. Mit anderen Worten, Feuerstein verdrängt schädliche Metalle aus dem Wasser und reinigt es. Sie bleiben unten, aber oben stellt sich heraus reines Wasser.
„Mit Feuerstein behandeltes Wasser beeinträchtigt die Adsorptionskapazität von Radionukliden. Dies wird es vielleicht ermöglichen, damit einige radiochemische Probleme auf dem mit Radionukliden kontaminierten Territorium von Belarus zu lösen.“- Doktor der Chemie Yu. Davydov - Leiter des Labors des Instituts für radiologische Probleme der Nationalen Akademie der Wissenschaften der Republik Belarus.
„Silikonwasser hat ab dem fünften Tag der Lagerung die Fähigkeit, die hämostatischen Fähigkeiten des Blutes zu stärken und seine Gerinnungsfähigkeit zu erhöhen.“ E. Ivanov - Direktor des Instituts für Hämatologie und Bluttransfusion des Gesundheitsministeriums der Republik Belarus, MD. Da fällt einem sofort Hämophilie ein – eine Krankheit, bei der das Blut nicht gut gerinnt. Und das bedeutet, dass eine Person, die auch nur einen kleinen Kratzer abbekommen hat, an Blutverlust sterben kann.
„Seit mehreren Jahren habe ich bei vielen Patienten, die siliziumaktiviertes Wasser (ACB) konsumierten, keinen Krebs mehr beobachtet. Wir haben festgestellt, dass am 5.-6. Tag der Batterieeinnahme (6-8 mal täglich) bei Patienten mit zahlreichen trophischen Geschwüren der unteren Extremitäten die Anzahl der T- und B-Lymphozyten ansteigt. Und dies weist auf die Fähigkeit hin, verlorene und geschwächte Immunität zu erneuern. Darüber hinaus senkt AKB die Menge an Cholesterin im Blut, insbesondere bei Fettleibigkeit. Somit dient die Batterie der Vorbeugung von Arteriosklerose“- M. Sinyavsky Professor der Abteilung für medizinische Ausbildung von Mogilevsky staatliche Universität ihnen. AA Kuleschova.
Was ist es - Silikonwasser? Silikonwasser ist eine dunkelbraune Feuersteintinktur, die innerlich und äußerlich angewendet wird. Das Verfahren zur Herstellung von Feuersteinwasser ist recht einfach. Geben Sie in einen 2-3-Liter-Behälter, vorzugsweise Glas, 40-50 g kleine Kieselsteine, vorzugsweise intensiv hellbraun (aber nicht schwarz), gießen Sie Wasser aus dem Wasserversorgungsnetz, aber besser nach normaler Filtration, und geben Sie es in a geschützt vor direkter Sonneneinstrahlung und außerhalb der terrestrischen pathogenen Strahlung.
Solches Wasser zum Trinken ist in 2-3 Tagen fertig. Vorbehaltlich der gleichen Technologie, aber wenn Sie den Hals mit 2-3 Lagen Gaze binden und Wasser 5-7 Tage lang an einem hellen Ort bei einer Temperatur über 5 ° C aufbewahren, kann dieses Wasser aufgrund seiner Eigenschaften verwendet werden nicht nur als Trinkwasser, sondern auch für medizinische Zwecke präventive Zwecke. Es ist nützlich, es zum Kochen zu verwenden - Tee, Suppen usw. Sie können Silikonwasser ohne Einschränkungen trinken (normalerweise 1,5-2 Liter pro Tag). Wenn es nicht geht, dann mindestens 3-5 mal täglich für ein halbes Glas und immer in kleinen Schlucken und am besten in kühler Form.
Verwenden Sie Feuerstein, wie bereits erwähnt, nur hellbraune (nicht schwarze) Farbe.
Es sollten nur natürliche Mineralien verwendet werden. Tatsache ist, dass Feuerstein die Überreste von Mikroorganismen enthält, die einst Feuerstein aus dem Schlick der Kreidezeit und älterer Epochen bildeten.
Nach ein oder zwei Anwendungen sollte der Stein mit kaltem Wasser gewaschen und 2 Stunden lang gelüftet werden. frische Luft. Wenn Ablagerungen oder Ablagerungen auf der Oberfläche der Steine auftreten, müssen sie in eine 2% ige Lösung getaucht werden Essigsäure oder Salzwasser für 2 Stunden; dann 2-3 mal mit normalem Wasser spülen und 2 Stunden in eine Backpulverlösung tauchen und erneut spülen.
Die spezifischen Eigenschaften von Siliziumwasser ermöglichen es Ihnen, viele Krankheiten vorzubeugen. Siliziumwasser wirkt sich positiv auf das Allgemeinbefinden des gesamten Körpers aus.
Wenn Sie Feuerstein-aktiviertes Wasser trinken oder Essen darauf kochen, passiert Folgendes:
- Stärkung Immunsystem, die Zahl der T- und B-Blut-Lymphozyten nimmt zu;
Der Zustand von Menschen mit Lebererkrankungen verbessert sich, weil. wasser hilft beim Abfluss von Galle;
Schnelle Heilung von Verbrennungen, Schnitten, Prellungen, trophischen Geschwüren;
Hilft bei Verdauungsstörungen, lindert Entzündungen im Verdauungstrakt und Gastritis;
Verringerter Blutzuckerspiegel sowie Gewicht, prädisponiert für übergewichtige Diabetiker;
Senkung des Cholesterinspiegels im Blut, insbesondere bei Fettleibigkeit, Vorbeugung von Arteriosklerose und Verbesserung der Nierenfunktion;
Normalisiert den Zustand von Patienten mit Bluthochdruck;
Normalisiert den Stoffwechsel;
Der allgemeine Ton wird erhöht.
Bei Outdoor-Anwendung Siliziumwasser regt die Erholungsprozesse des Körpers an bei:
- Behandlung von Mandelentzündung, laufender Nase, Zahnfleischentzündung (Gurgeln von Hals und Mund nach dem Essen);
Bei Viruserkrankungen der Mundhöhle, Stomatitis und Gingivitis;
Behandlung von Allergien, Furunkeln, Diathese, Dermatitis, verschiedenen Hautirritationen (Lotionen und Waschen);
Bei Bindehautentzündung lindert Juckreiz und Entzündungen;
Das Waschen mit solchem Wasser hilft, den Zustand der Haut zu verbessern, die Anzahl der Falten zu reduzieren und das Auftreten neuer Falten zu verhindern, hilft, Beulen, Mitesser und Akne zu beseitigen.
Das Spülen des Kopfes und der Haare, das Einreiben in die Kopfhaut hilft, das Haar zu stärken und wachsen zu lassen;
Bei manchen Hauterkrankungen (einfache Bläschenbildung, Herpes zoster und Rosenentzug).
- Im Falle von Haarausfall und "Spliss", spülen Sie Ihren Kopf mit "Flint" -Wasser;
Um Irritationen nach der Rasur zu lindern, spülen Sie Ihr Gesicht mit demselben Wasser ab;
Mit "jugendlicher Akne" waschen und im "Wasser" auftragen;
Wischen Sie die Gesichtshaut mit gefrorenem "Feuerstein" -Wasser mit Eisstücken ab;
Um Paradanthosen vorzubeugen, spülen Sie das Zahnfleisch beim Zähneputzen mit „Wasser“.
Die Verwendung von „Flint“-Wasser zu therapeutischen und prophylaktischen Zwecken trägt dazu bei schnelle Heilung Wunden, Verhinderung der Bildung von Tumoren bei regelmäßiger Wasseraufnahme, Verbesserung der Blutzusammensetzung, Wiederherstellung der Funktion der Nebennieren, Beseitigung entzündlicher Prozesse in Magen-Darmtrakt und bei Gastritis, Normalisierung des Blutzuckers, Gewichtsverlust, Heilung von Frakturen (Knochen wachsen schneller und ohne Komplikationen zusammen), Verbesserung der Nierenfunktion und des Stoffwechsels, Trennung und Ausscheidung von Galle. Silikonwasser tötet Viren ab; Zur Vorbeugung bei Atemwegsepidemien wird empfohlen, "Wasser" in die Nase zu geben. Das hilft bei Schlaflosigkeit.
IN Haushalt es wird empfohlen, die Blumen zu gießen, was die Blütezeit verlängert; beschleunigt die Fruchtbildung Obstbäume Und Gemüsekulturen; erhöht den Ertrag um 10 %. Tötet Schimmel, Grauschimmel, insbesondere an Erdbeeren, und andere Pilze. Das Einweichen von Samen in solchem Wasser erhöht die Keimung. Blumen werden am besten in einem Behälter mit Silikonkies aufbewahrt, ihre Haltbarkeit verlängert sich dramatisch. Im Aquarium verhindert Feuerstein das Aufblühen des Wassers. Silizium hilft, Wasser auf einer Wanderung zu reinigen, was für Touristen wichtig zu wissen ist.
Auch bei Arteriosklerose (Gefäße werden von sklerotischen Ablagerungen befreit), diversen Stoffwechselstörungen, Mandelentzündungen, Grippe, Pharyngitis (das Spülen mit Silikonwasser verkürzt die Dauer dieser Erkrankungen erheblich – Silikonwasser wirkt hier schließlich als Antibiotikum) ist es sinnvoll, Siliziumwasser zu trinken ), Rheuma, Botkin-Krankheit (Silizium tötet pathogene Viren), Erkrankungen der Zähne und Gelenke (weil Silizium die Integrität des Knochengewebes wiederherstellt).
Und jetzt das meiste wichtiger Punkt- Kontraindikationen. Silikonwasser hat Kontraindikationen und muss sehr vorsichtig gehandhabt werden. Ärzte haben festgestellt, dass diejenigen, die eine Prädisposition für Krebs haben, es besser ist, es vollständig aufzugeben.
- Bezeichnung - Si (Silizium);
- Zeitraum - III;
- Gruppe - 14 (IVa);
- Atommasse - 28,0855;
- Ordnungszahl - 14;
- Radius eines Atoms = 132 pm;
- Kovalenter Radius = 111 pm;
- Elektronenverteilung - 1s 2 2s 2 2p 6 3s 2 3p 2 ;
- t Schmelzen = 1412°C;
- Siedepunkt = 2355°C;
- Elektronegativität (nach Pauling / nach Alpred und Rochov) = 1,90 / 1,74;
- Oxidationszustand: +4, +2, 0, -4;
- Dichte (n.a.) \u003d 2,33 g / cm 3;
- Molvolumen = 12,1 cm 3 /mol.
Siliziumverbindungen:
Silizium wurde erstmals 1811 in seiner reinen Form isoliert (Franzosen J. L. Gay-Lussac und L. J. Tenard). Reines elementares Silizium wurde 1825 erhalten (der Schwede J. Ya. Berzelius). Das chemische Element erhielt 1834 seinen Namen "Silizium" (übersetzt aus dem Altgriechischen - Berg) (russischer Chemiker G. I. Hess).
Silizium ist am häufigsten (nach Sauerstoff) Chemisches Element auf der Erde (Gehalt in der Erdkruste 28-29 Gew.-%). In der Natur kommt Silizium am häufigsten in Form von Kieselsäure (Sand, Quarz, Feuerstein, Feldspäte) sowie in Silikaten und Alumosilikaten vor. Silizium ist in reiner Form äußerst selten. Viele natürliche Silikate in ihrer reinen Form sind Edelsteine: Smaragd, Topas, Aquamarin - alles Silizium. Reines kristallines Silizium(IV)oxid kommt als Bergkristall und Quarz vor. Siliziumoxid, in dem verschiedene Verunreinigungen vorhanden sind, bildet Edelsteine und Halbedelsteine - Amethyst, Achat, Jaspis.

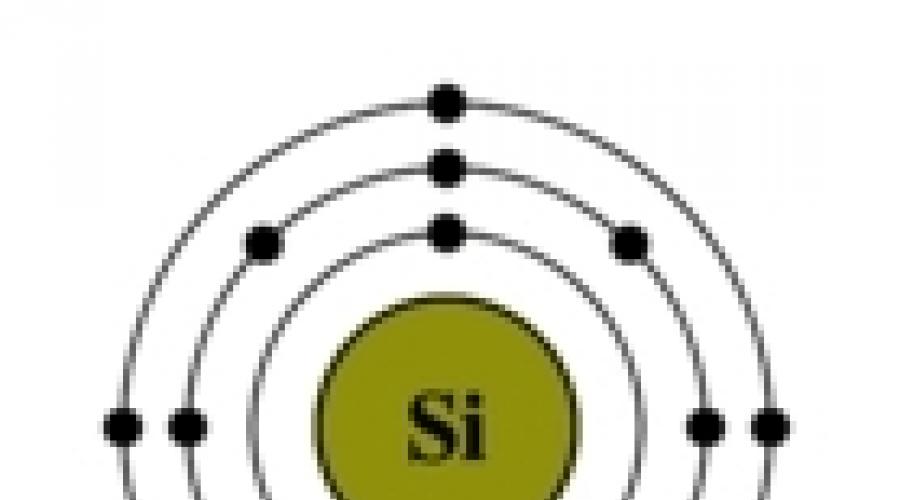
Reis. Die Struktur des Siliziumatoms.
Die elektronische Konfiguration von Silizium ist 1s 2 2s 2 2p 6 3s 2 3p 2 (siehe Elektronische Struktur von Atomen). Draußen Energielevel Silizium hat 4 Elektronen: 2 gepaart auf der 3s-Unterebene + 2 ungepaart auf den p-Orbitalen. Wenn ein Siliziumatom in einen angeregten Zustand übergeht, "verlässt" ein Elektron aus der s-Unterebene sein Paar und geht zur p-Unterebene, wo es ein freies Orbital gibt. Somit nimmt die elektronische Konfiguration des Siliziumatoms im angeregten Zustand die folgende Form an: 1s 2 2s 2 2p 6 3s 1 3p 3 .

Reis. Der Übergang des Siliziumatoms in einen angeregten Zustand.
So kann Silizium in Verbindungen die Wertigkeit 4 (meistens) oder 2 (siehe Wertigkeit) aufweisen. Silizium (wie auch Kohlenstoff) bildet bei der Reaktion mit anderen Elementen chemische Bindungen, in denen es seine Elektronen sowohl abgeben als auch aufnehmen kann, aber die Fähigkeit, Elektronen von Siliziumatomen aufzunehmen, ist aufgrund größerer weniger ausgeprägt als die von Kohlenstoffatomen Siliziumatom.
Oxidationsstufen von Silizium:
- -4 : SiH 4 (Silan), Ca 2 Si, Mg 2 Si (Metallsilikate);
- +4 - am stabilsten: SiO 2 (Siliziumoxid), H 2 SiO 3 (Kieselsäure), Silikate und Siliziumhalogenide;
- 0 : Si (einfache Substanz)
Silizium als einfache Substanz
Silikon ist dunkelgrau kristalline Substanz mit metallischem Glanz. Kristallines Silizium ist ein Halbleiter.
Silizium bildet nur eine allotrope Modifikation, ähnlich wie Diamant, aber nicht so stark, weil die Si-Si-Bindungen nicht so stark sind wie im Diamant-Kohlenstoffmolekül (siehe Diamant).
Amorphes Silizium- braunes Pulver, Schmelzpunkt 1420°C.
Kristallines Silizium wird aus amorphem Silizium durch dessen Umkristallisation gewonnen. Im Gegensatz zu amorphem Silizium, das eine eher aktive chemische Substanz ist, ist kristallines Silizium inerter in Bezug auf Wechselwirkungen mit anderen Substanzen.
Die Struktur des Kristallgitters von Silizium wiederholt die Struktur von Diamant - jedes Atom ist von vier anderen Atomen umgeben, die sich an den Ecken des Tetraeders befinden. Die Atome binden durch kovalente Bindungen aneinander, die nicht so stark sind wie die Kohlenstoffbindungen in Diamant. Aus diesem Grund sind auch bei n.o.s. Einige der kovalenten Bindungen in kristallinem Silizium werden aufgebrochen, wodurch einige Elektronen freigesetzt werden, wodurch Silizium eine geringe elektrische Leitfähigkeit aufweist. Beim Erhitzen von Silizium, im Licht oder bei Zugabe einiger Verunreinigungen nimmt die Anzahl der zerstörten kovalenten Bindungen zu, wodurch die Anzahl der freien Elektronen zunimmt und daher auch die elektrische Leitfähigkeit von Silizium zunimmt.
Chemische Eigenschaften von Silizium
Silizium kann wie Kohlenstoff sowohl Reduktionsmittel als auch Oxidationsmittel sein, je nachdem mit welchem Stoff es reagiert.
Bei n.o. Silizium interagiert nur mit Fluor, was durch das ziemlich starke Siliziumkristallgitter erklärt wird.
Silizium reagiert mit Chlor und Brom bei Temperaturen über 400 °C.
Silizium interagiert nur bei sehr hohen Temperaturen mit Kohlenstoff und Stickstoff.
- Bei Reaktionen mit Nichtmetallen wirkt Silizium als Reduktionsmittel:
- Unter normalen Bedingungen reagiert Silizium aus Nichtmetallen nur mit Fluor und bildet Siliziumhalogenid:
Si + 2F 2 = SiF 4 - Bei hohen Temperaturen reagiert Silizium mit Chlor (400 °C), Sauerstoff (600 °C), Stickstoff (1000 °C), Kohlenstoff (2000 °C):
- Si + 2Cl 2 = SiCl 4 – Siliziumhalogenid;
- Si + O 2 \u003d SiO 2 - Siliziumoxid;
- 3Si + 2N 2 = Si 3 N 4 – Siliziumnitrid;
- Si + C \u003d SiC - Karborund (Siliciumcarbid)
- Unter normalen Bedingungen reagiert Silizium aus Nichtmetallen nur mit Fluor und bildet Siliziumhalogenid:
- Bei Reaktionen mit Metallen ist Silizium Oxidationsmittel(gebildet Salizide:
Si + 2Mg = Mg2Si - Bei Reaktionen mit konzentrierten Lösungen von Alkalien reagiert Silizium unter Freisetzung von Wasserstoff und bildet lösliche Salze der Kieselsäure, genannt Silikate:
Si + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 2H 2 - Silizium reagiert nicht mit Säuren (mit Ausnahme von HF).
Gewinnung und Verwendung von Silizium
Silizium bekommen:
- im Labor - aus Kieselsäure (Aluminiumtherapie):
3SiO 2 + 4Al = 3Si + 2Al 2 O 3 - in der Industrie - durch die Reduktion von Siliziumoxid mit Koks (kommerziell reines Silizium) bei hoher Temperatur:
SiO 2 + 2C \u003d Si + 2CO - Das reinste Silizium wird durch Reduktion von Siliziumtetrachlorid mit Wasserstoff (Zink) bei hoher Temperatur erhalten:
SiCl 4 + 2H 2 \u003d Si + 4HCl
Anwendung von Silikon:
- Herstellung von Halbleiter-Funkelementen;
- als metallurgische Zusatzstoffe bei der Herstellung von hitzebeständigen und säurebeständigen Verbindungen;
- bei der Herstellung von Fotozellen für Solarbatterien;
- als Wechselspannungsgleichrichter.