Ionenkristallgitter. Arten von Kristallgittern
Lesen Sie auch
Die meisten Stoffe zeichnen sich dadurch aus, dass sie je nach Bedingungen in einem von drei Aggregatzuständen vorliegen können: fest, flüssig oder gasförmig.
Beispielsweise ist Wasser bei Normaldruck im Temperaturbereich von 0–100 °C eine Flüssigkeit, bei Temperaturen über 100 °C kann es nur in gasförmigem Zustand vorliegen und bei Temperaturen unter 0 °C ist es ein Feststoff.
Stoffe im festen Zustand werden in amorphe und kristalline Stoffe unterteilt.
Ein charakteristisches Merkmal amorpher Substanzen ist das Fehlen eines klaren Schmelzpunkts: Ihre Fließfähigkeit nimmt mit zunehmender Temperatur allmählich zu. Zu den amorphen Substanzen zählen Verbindungen wie Wachs, Paraffin, die meisten Kunststoffe, Glas usw.
Dennoch haben kristalline Substanzen einen bestimmten Schmelzpunkt, d. h. Ein Stoff mit kristalliner Struktur geht beim Erreichen einer bestimmten Temperatur nicht allmählich, sondern abrupt vom festen in den flüssigen Zustand über. Beispiele für kristalline Substanzen sind Speisesalz, Zucker und Eis.
Der Unterschied in den physikalischen Eigenschaften amorpher und kristalliner Feststoffe ist in erster Linie auf die Strukturmerkmale dieser Stoffe zurückzuführen. Was der Unterschied zwischen einem Stoff im amorphen und kristallinen Zustand ist, lässt sich am einfachsten anhand der folgenden Abbildung verstehen:
Wie Sie sehen, gibt es in einer amorphen Substanz im Gegensatz zu einer kristallinen Substanz keine Ordnung in der Anordnung der Partikel. Wenn Sie in einer kristallinen Substanz gedanklich zwei nahe beieinander liegende Atome durch eine gerade Linie verbinden, können Sie feststellen, dass auf dieser Linie in genau definierten Abständen dieselben Teilchen liegen:
Bei kristallinen Substanzen können wir daher von einem Konzept wie einem Kristallgitter sprechen.
Kristallgitter bezeichnet ein räumliches Gerüst, das die Punkte im Raum verbindet, in denen sich die Teilchen befinden, die den Kristall bilden.
Die Punkte im Raum, an denen sich die den Kristall bildenden Teilchen befinden, werden genannt Kristallgitterknoten .
Je nachdem, welche Partikel sich an den Knotenpunkten des Kristallgitters befinden, werden sie unterschieden: molekular, atomar, ionisch Und Metallkristallgitter .
In Knoten molekulares Kristallgitter
Eiskristallgitter als Beispiel für ein MolekülgitterEs gibt Moleküle, in denen die Atome durch starke kovalente Bindungen verbunden sind, die Moleküle selbst jedoch durch schwache intermolekulare Kräfte nahe beieinander gehalten werden. Aufgrund dieser schwachen intermolekularen Wechselwirkungen sind Kristalle mit Molekülgitter zerbrechlich. Solche Stoffe unterscheiden sich von Stoffen anderer Struktur durch deutlich niedrigere Schmelz- und Siedepunkte; sie sind nicht leitend elektrischer Strom, kann in verschiedenen Lösungsmitteln löslich sein oder auch nicht. Lösungen solcher Verbindungen können je nach Klasse der Verbindung elektrischen Strom leiten oder auch nicht. Zu den Verbindungen mit einem molekularen Kristallgitter gehören viele einfache Stoffe – Nichtmetalle (gehärtet mit H 2, O 2, Cl 2, rhombischer Schwefel S 8, weißer Phosphor P 4) sowie viele komplexe Substanzen - Wasserstoffverbindungen von Nichtmetallen, Säuren, Oxide von Nichtmetallen usw organische Substanz. Es ist zu beachten, dass es unangemessen ist, von einem molekularen Kristallgitter zu sprechen, wenn sich ein Stoff in einem gasförmigen oder flüssigen Zustand befindet. Es ist korrekter, den Begriff molekularer Strukturtyp zu verwenden.
Diamantkristallgitter als Beispiel für ein AtomgitterIn Knoten Atomkristallgitter
Es gibt Atome. Darüber hinaus sind alle Knoten eines solchen Kristallgitters durch starke kovalente Bindungen zu einem Einkristall „verknüpft“. Tatsächlich ist ein solcher Kristall ein riesiges Molekül. Aufgrund ihrer Strukturmerkmale sind alle Stoffe mit einem atomaren Kristallgitter fest, haben einen hohen Schmelzpunkt, sind chemisch inaktiv, weder in Wasser noch in organischen Lösungsmitteln löslich und ihre Schmelzen leiten keinen elektrischen Strom. Es ist zu bedenken, dass zu den Stoffen mit atomarer Struktur Bor B, Kohlenstoff C (Diamant und Graphit), Silizium Si aus einfachen Stoffen und Siliziumdioxid SiO 2 (Quarz), Siliziumkarbid SiC und Bornitrid BN aus komplexen Stoffen gehören.
Für Stoffe mit Ionenkristallgitter
Gitterplätze enthalten Ionen, die durch Ionenbindungen miteinander verbunden sind.
Da die Ionenbindung recht stark ist, weisen Stoffe mit einem Ionengitter eine relativ hohe Härte und Feuerfestigkeit auf. Meistens sind sie wasserlöslich und ihre Lösungen leiten wie Schmelzen elektrischen Strom.
Zu den Substanzen mit einem ionischen Kristallgitter gehören Metall- und Ammoniumsalze (NH 4 +), Basen und Metalloxide. Ein sicheres Zeichen für die ionische Struktur einer Substanz ist das Vorhandensein beider Atome eines typischen Metalls und eines Nichtmetalls in ihrer Zusammensetzung.
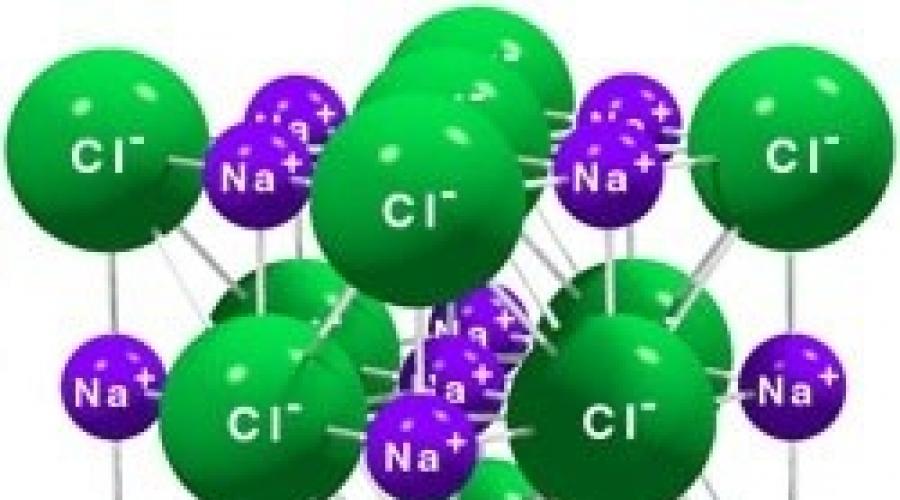
 Kristallgitter von Natriumchlorid als Beispiel für ein Ionengitter
Kristallgitter von Natriumchlorid als Beispiel für ein Ionengitter
beobachtet in Kristallen freier Metalle, zum Beispiel Natrium Na, Eisen Fe, Magnesium Mg usw. Im Falle eines Metallkristallgitters enthalten seine Knoten Kationen und Metallatome, zwischen denen sich Elektronen bewegen. In diesem Fall lagern sich bewegte Elektronen periodisch an Kationen an und neutralisieren so deren Ladung, und einzelne neutrale Metallatome „geben“ im Gegenzug einen Teil ihrer Elektronen ab und verwandeln sich so wiederum in Kationen. Tatsächlich gehören „freie“ Elektronen nicht zu einzelnen Atomen, sondern zum gesamten Kristall.
Solche Strukturmerkmale führen dazu, dass Metalle Wärme und elektrischen Strom gut leiten und oft eine hohe Duktilität (Formbarkeit) aufweisen.
Die Streuung der Schmelztemperaturen von Metallen ist sehr groß. Beispielsweise liegt der Schmelzpunkt von Quecksilber bei etwa minus 39 °C (flüssig in normale Bedingungen) und Wolfram – 3422 °C. Es ist zu beachten, dass unter normalen Bedingungen alle Metalle außer Quecksilber Feststoffe sind.
Wie Sie wissen, kann Materie in drei Aggregatzuständen existieren: gasförmig, flüssig und fest (Abb. 70). Beispielsweise wird Sauerstoff, der unter normalen Bedingungen ein Gas ist, bei einer Temperatur von -194 °C flüssig blaue Farbe Bei einer Temperatur von -218,8 °C verfestigt es sich zu einer schneeähnlichen Masse aus blauen Kristallen.
Reis. 70.
Physikalische Zustände von Wasser
Feststoffe werden in kristalline und amorphe unterteilt.
Amorphe Substanzen haben keinen klaren Schmelzpunkt – beim Erhitzen erweichen sie allmählich und gehen in einen flüssigen Zustand über. Zu den amorphen Stoffen zählen die meisten Kunststoffe (zum Beispiel Polyethylen), Wachs, Schokolade, Plastilin, verschiedene Harze und Kaugummis (Abb. 71).

Reis. 71.
Amorphe Stoffe und Materialien
Kristalline Substanzen werden charakterisiert richtigen Ort ihre konstituierenden Teilchen an genau definierten Punkten im Raum. Wenn diese Punkte durch gerade Linien verbunden werden, entsteht ein räumliches Gerüst, ein sogenanntes Kristallgitter. Die Punkte, an denen sich Kristallteilchen befinden, werden Gitterknoten genannt.
Die Knoten eines imaginären Kristallgitters können einatomige Ionen, Atome und Moleküle enthalten. Diese Teilchen führen oszillierende Bewegungen aus. Mit zunehmender Temperatur nimmt die Reichweite dieser Schwingungen zu, was in der Regel zu einer Wärmeausdehnung von Körpern führt.
Abhängig von der Art der Partikel, die sich an den Knoten des Kristallgitters befinden, und der Art der Verbindung zwischen ihnen werden vier Arten von Kristallgittern unterschieden: ionische, atomare, molekulare und metallische (Tabelle 6).
Tabelle 6
Position der Elemente im Periodensystem von D. I. Mendeleev und Arten von Kristallgittern ihrer einfachen Substanzen

Einfache Stoffe, die aus in der Tabelle nicht aufgeführten Elementen bestehen, haben ein Metallgitter.
Als Ionengitter werden Kristallgitter bezeichnet, deren Knoten Ionen enthalten. Sie werden durch Stoffe mit ionischen Bindungen gebildet, die sowohl einfache Ionen Na +, Cl – als auch komplexe Ionen OH – binden können. Folglich enthalten ionische Kristallgitter Salze, Basen (Alkalien) und einige Oxide. Beispielsweise besteht ein Natriumchloridkristall aus abwechselnd positiven Na + - und negativen Cl - -Ionen, die ein würfelförmiges Gitter bilden (Abb. 72). Die Bindungen zwischen den Ionen in einem solchen Kristall sind sehr stark. Daher weisen Stoffe mit Ionengitter eine relativ hohe Härte und Festigkeit auf, sie sind feuerfest und nichtflüchtig.

Reis. 72.
Ionenkristallgitter (Natriumchlorid)
Als Kristallgitter werden Atomgitter bezeichnet, deren Knoten einzelne Atome enthalten. In solchen Gittern sind die Atome durch sehr starke kovalente Bindungen miteinander verbunden.

Reis. 73.
Atomares Kristallgitter (Diamant)
Diamant hat diese Art von Kristallgitter (Abb. 73) – eine der allotropen Modifikationen von Kohlenstoff. Geschliffene und polierte Diamanten werden Brillanten genannt. Sie werden häufig in Schmuck verwendet (Abb. 74).

Reis. 74.
Zwei Kaiserkronen mit Diamanten:
a - Krone des britischen Empire; b – Große Kaiserkrone des Russischen Reiches
Zu den Stoffen mit einem atomaren Kristallgitter zählen kristallines Bor, Silizium und Germanium sowie komplexe Stoffe, zum Beispiel Kieselsäure, Quarz, Sand, Bergkristall, zu denen Silizium(IV)-oxid SiO 2 gehört (Abb. 75).

Reis. 75.
Atomares Kristallgitter (Silizium(IV)-oxid)
Die meisten Stoffe mit einem atomaren Kristallgitter haben sehr hohe Schmelzpunkte (z. B. für Diamant über 3500 °C, für Silizium – 1415 °C, für Silizium – 1728 °C), sie sind fest und hart, praktisch unlöslich.
Molekular sind Kristallgitter, in deren Knotenpunkten sich Moleküle befinden. Die chemischen Bindungen in diesen Molekülen können sowohl kovalent polar (Chlorwasserstoff HCl, Wasser H20) als auch kovalent unpolar (Stickstoff N2, Ozon 03) sein. Obwohl die Atome innerhalb der Moleküle durch sehr starke kovalente Bindungen verbunden sind, wirken zwischen den Molekülen selbst schwache intermolekulare Anziehungskräfte. Daher haben Substanzen mit molekularen Kristallgittern eine geringe Härte, niedrige Schmelzpunkte und sind flüchtig.
Beispiele für Stoffe mit molekularen Kristallgittern sind festes Wasser - Eis, festes Kohlenmonoxid (IV) C) 2 - „Trockeneis“ (Abb. 76), fester Chlorwasserstoff HCl und Schwefelwasserstoff H 2 S, feste einfache Stoffe, die durch Mono gebildet werden - (Edelgase: Helium, Neon, Argon, Krypton), zwei- (Wasserstoff H 2, Sauerstoff O 2, Chlor Cl 2, Stickstoff N 2, Jod 1 2), drei- (Ozon O 3), vier- (weiß Phosphor P 4 ), achtatomige (Schwefel S 7) Moleküle. Die meisten festen organischen Verbindungen haben molekulare Kristallgitter (Naphthalin, Glucose, Zucker).

Reis. 76.
Molekulares Kristallgitter ( Kohlendioxid)
Stoffe mit metallischer Bindung besitzen metallische Kristallgitter (Abb. 77). An den Stellen solcher Gitter befinden sich Atome und Ionen (entweder Atome oder Ionen, in die sich Metallatome leicht verwandeln und ihre äußeren Elektronen zur gemeinsamen Verwendung abgeben). Das Interne Struktur Metalle bestimmen ihre Eigenschaften physikalische Eigenschaften: Formbarkeit, Duktilität, elektrische und thermische Leitfähigkeit, metallischer Glanz.

Reis. 77.
Metallkristallgitter (Eisen)
Laborexperiment Nr. 13
Kennenlernen einer Sammlung von Stoffen mit unterschiedlichen Kristallgittertypen. Herstellung von Modellen aus Kristallgittern
- Überprüfen Sie die Ihnen zur Verfügung gestellte Stoffprobensammlung. Schreiben Sie ihre Formeln auf, charakterisieren Sie die physikalischen Eigenschaften und bestimmen Sie darauf basierend die Art des Kristallgitters.
Bauen Sie ein Modell eines der Kristallgitter.
Für Stoffe mit molekularer Struktur gilt das vom französischen Chemiker J. L. Proust (1799-1803) entdeckte Gesetz der Konstanz der Zusammensetzung. Derzeit ist dieses Gesetz wie folgt formuliert:
Das Proustsche Gesetz ist eines der Grundgesetze der Chemie. Für Substanzen mit nichtmolekularer Struktur, beispielsweise ionische, gilt dieses Gesetz jedoch nicht immer.
Schlüsselwörter und Phrasen
- Feste, flüssige und gasförmige Aggregatzustände.
- Feststoffe: amorph und kristallin.
- Kristallgitter: ionisch, atomar, molekular und metallisch.
- Physikalische Eigenschaften von Stoffen mit verschiedene Arten Kristallgitter.
- Gesetz der Konstanz der Zusammensetzung.
Arbeiten Sie mit dem Computer
- Beachten Sie die elektronische Bewerbung. Studieren Sie den Unterrichtsstoff und erledigen Sie die gestellten Aufgaben.
- Suchen Sie im Internet nach E-Mail-Adressen, die als zusätzliche Quellen dienen können, die den Inhalt von Schlüsselwörtern und Phrasen im Absatz offenbaren. Bieten Sie dem Lehrer Ihre Hilfe bei der Vorbereitung einer neuen Unterrichtsstunde an – erstellen Sie einen Bericht über die Schlüsselwörter und Phrasen des nächsten Absatzes.
Fragen und Aufgaben
- Welchen Aggregatzustand hat Sauerstoff bei -205 °C?
- Erinnern Sie sich an die Arbeit von A. Belyaev „The Air Seller“ und charakterisieren Sie die Eigenschaften von festem Sauerstoff anhand der im Buch enthaltenen Beschreibung.
- Welche Stoffe (kristallin oder amorph) sind Kunststoffe? Welche Eigenschaften von Kunststoffen liegen ihren industriellen Anwendungen zugrunde?
- Um welche Art von Diamantkristallgitter handelt es sich? Listen Sie die physikalischen Eigenschaften auf, die für Diamant charakteristisch sind.
- Um welche Art von Jodkristallgitter handelt es sich? Listen Sie die physikalischen Eigenschaften auf, die für Jod charakteristisch sind.
- Warum schwankt der Schmelzpunkt von Metallen in einem sehr großen Bereich? Um eine Antwort auf diese Frage vorzubereiten, nutzen Sie zusätzliche Literatur.
- Warum zerbricht ein Silikonprodukt beim Aufprall in Stücke, während ein Bleiprodukt nur flach wird? In welchem dieser Fälle bricht die chemische Bindung zusammen und in welchem nicht? Warum?
Die meisten Feststoffe haben eine kristalline Struktur. Kristallzelle aufgebaut aus sich wiederholenden identischen Struktureinheiten, die für jeden Kristall individuell sind. Diese Struktureinheit wird „Elementarzelle“ genannt. Mit anderen Worten: Das Kristallgitter dient als Spiegelbild der räumlichen Struktur eines Festkörpers.
Kristallgitter können auf unterschiedliche Weise klassifiziert werden.
ICH. Entsprechend der Symmetrie der Kristalle Gitter werden in kubische, tetragonale, rhombische und hexagonale Gitter eingeteilt.
Diese Klassifizierung eignet sich zur Beurteilung der optischen Eigenschaften von Kristallen sowie ihrer katalytischen Aktivität.
II. Aufgrund der Beschaffenheit der Partikel, an Gitterknoten gelegen und nach Art der chemischen Bindung es gibt einen Unterschied zwischen ihnen Atom-, Molekül-, Ionen- und Metallkristallgitter. Die Art der Bindung in einem Kristall bestimmt den Unterschied in der Härte, der Löslichkeit in Wasser, der Lösungs- und Schmelzwärme sowie der elektrischen Leitfähigkeit.
Wichtiges Merkmal Kristall ist Kristallgitterenergie, kJ/mol – die Energie, die aufgewendet werden muss, um einen bestimmten Kristall zu zerstören.
Molekulares Gitter
Molekulare Kristalle bestehen aus Molekülen, die durch schwache intermolekulare Bindungen (Van-der-Waals-Kräfte) oder Wasserstoffbrückenbindungen an bestimmten Positionen des Kristallgitters gehalten werden. Diese Gitter sind charakteristisch für Stoffe mit kovalenten Bindungen.
Es gibt viele Stoffe mit einem Molekülgitter. Dabei handelt es sich um eine Vielzahl organischer Verbindungen (Zucker, Naphthalin etc.), kristallines Wasser (Eis), festes Kohlendioxid („Trockeneis“), feste Halogenwasserstoffe, Jod, feste Gase, auch Edelgase,
Bei Stoffen mit unpolaren und niedrigpolaren Molekülen (CH 4, CO 2 etc.) ist die Energie des Kristallgitters minimal.
Gitter, die aus polareren Molekülen bestehen, haben auch eine höhere Kristallgitterenergie. Die Gitter mit Stoffen, die Wasserstoffbrückenbindungen bilden (H 2 O, NH 3), haben die höchste Energie.
Aufgrund der schwachen Wechselwirkung zwischen Molekülen sind diese Stoffe flüchtig, schmelzbar, haben eine geringe Härte, leiten keinen elektrischen Strom (Dielektrika) und haben eine geringe Wärmeleitfähigkeit.
Atomgitter
In Knoten Atomkristallgitter Es gibt Atome eines oder verschiedener Elemente, die entlang aller drei Achsen durch kovalente Bindungen miteinander verbunden sind. Solch Kristalle die auch genannt werden kovalent sind relativ wenige.
Beispiele für Kristalle dieser Art sind Diamant, Silizium, Germanium, Zinn sowie Kristalle komplexer Stoffe wie Bornitrid, Aluminiumnitrid, Quarz und Siliziumkarbid. Alle diese Stoffe haben ein diamantartiges Gitter.
Die Energie des Kristallgitters in solchen Stoffen stimmt praktisch mit der Energie der chemischen Bindung überein (200 – 500 kJ/mol). Dies bestimmt ihre physikalischen Eigenschaften: hohe Härte, Schmelzpunkt und Siedepunkt.
Die elektrisch leitenden Eigenschaften dieser Kristalle sind vielfältig: Diamant, Quarz, Bornitrid sind Dielektrika; Silizium, Germanium – Halbleiter; Metallisch graues Zinn leitet Elektrizität gut.
Bei Kristallen mit einem atomaren Kristallgitter ist es unmöglich, eine separate Struktureinheit zu unterscheiden. Der gesamte Einkristall ist ein riesiges Molekül.
Ionengitter
In Knoten Ionengitter positive und negative Ionen wechseln sich ab, zwischen denen elektrostatische Kräfte wirken. Ionische Kristalle bilden Verbindungen mit ionischen Bindungen, beispielsweise Natriumchlorid NaCl, Kaliumfluorid und KF usw. Zu den ionischen Verbindungen können auch komplexe Ionen gehören, beispielsweise NO 3 -, SO 4 2 -.
Auch Ionenkristalle sind Riesenmoleküle, bei denen jedes Ion maßgeblich von allen anderen Ionen beeinflusst wird.
Die Energie des Ionenkristallgitters kann erhebliche Werte erreichen. Also, E (NaCl) = 770 kJ/mol und E (BeO) = 4530 kJ/mol.
Ionenkristalle haben hohe Schmelz- und Siedepunkte und eine hohe Festigkeit, sind aber spröde. Viele von ihnen leiten den Strom schlecht, wenn Zimmertemperatur(etwa zwanzig Größenordnungen niedriger als bei Metallen), aber mit zunehmender Temperatur wird ein Anstieg der elektrischen Leitfähigkeit beobachtet.
Metallgitter
Metallkristalle Geben Sie Beispiele für die einfachsten Kristallstrukturen.
Metallionen im Gitter eines Metallkristalls können näherungsweise in Form von Kugeln betrachtet werden. In festen Metallen sind diese Kugeln mit maximaler Dichte gepackt, wie die signifikante Dichte der meisten Metalle zeigt (von 0,97 g/cm 3 für Natrium, 8,92 g/cm 3 für Kupfer bis 19,30 g/cm 3 für Wolfram und Gold). Die dichteste Kugelpackung in einer Schicht ist eine hexagonale Packung, bei der jede Kugel von sechs anderen Kugeln (in derselben Ebene) umgeben ist. Die Mittelpunkte dreier benachbarter Kugeln bilden ein gleichseitiges Dreieck.
Eigenschaften von Metallen wie hohe Duktilität und Formbarkeit weisen auf einen Mangel an Steifigkeit bei Metallgittern hin: Ihre Ebenen bewegen sich recht leicht relativ zueinander.
Valenzelektronen sind an der Bildung von Bindungen mit allen Atomen beteiligt und bewegen sich frei im gesamten Volumen eines Metallstücks. Dies wird durch hohe Werte der elektrischen Leitfähigkeit und Wärmeleitfähigkeit angezeigt.
Bezüglich der Kristallgitterenergie nehmen Metalle eine Zwischenstellung zwischen molekularen und kovalenten Kristallen ein. Die Energie des Kristallgitters beträgt:
Somit hängen die physikalischen Eigenschaften von Festkörpern maßgeblich von der Art der chemischen Bindung und Struktur ab.
Struktur und Eigenschaften von Festkörpern
| Eigenschaften | Kristalle | |||
| Metall | Ionisch | Molekular | Atomar | |
| Beispiele | K, Al, Cr, Fe | NaCl, KNO3 | I 2, Naphthalin | Diamant, Quarz |
| Strukturpartikel | Positive Ionen und mobile Elektronen | Kationen und Anionen | Moleküle | Atome |
| Art der chemischen Bindung | Metall | Ionisch | In Molekülen – kovalent; zwischen Molekülen - Van-der-Waals-Kräfte und Wasserstoffbrückenbindungen | Zwischen Atomen - kovalent |
| t schmilzt | Hoch | Hoch | Niedrig | Sehr hoch |
| Siedepunkt | Hoch | Hoch | Niedrig | Sehr hoch |
| Mechanische Eigenschaften | Hart, formbar, zähflüssig | Hart, spröde | Weich | Sehr schwer |
| Elektrische Leitfähigkeit | Gute Führer | In fester Form - Dielektrika; in einer Schmelze oder Lösung - Leiter | Dielektrika | Dielektrika (außer Graphit) |
| Löslichkeit | ||||
| im Wasser | Unlöslich | Löslich | Unlöslich | Unlöslich |
| in unpolaren Lösungsmitteln | Unlöslich | Unlöslich | Löslich | Unlöslich |
(Alle Definitionen, Formeln, Diagramme und Reaktionsgleichungen werden protokolliert.)
Themen des Einheitlichen Staatsexamen-Kodifikators: Stoffe molekularer und nichtmolekularer Struktur. Art des Kristallgitters. Abhängigkeit der Eigenschaften von Stoffen von ihrer Zusammensetzung und Struktur.
Molekularkinetische Theorie
Alle Moleküle bestehen aus winzige Partikel– Atome. Alle aktuell entdeckten Atome sind im Periodensystem zusammengefasst.
Atom- ist das kleinste, chemisch unteilbare Teilchen eines Stoffes, das ihn konserviert Chemische Eigenschaften. Atome verbinden sich miteinander chemische Bindungen. Wir haben uns bereits einen angeschaut. Studieren Sie unbedingt die Theorie zum Thema: Arten chemischer Bindungen, bevor Sie diesen Artikel lesen!
Schauen wir uns nun an, wie sich Teilchen in Materie verbinden können.
Abhängig von der Lage der Partikel zueinander können die Eigenschaften der von ihnen gebildeten Stoffe stark variieren. Also, wenn die Teilchen voneinander entfernt sind weit(Der Abstand zwischen den Partikeln ist viel größer als die Größe der Partikel selbst), interagieren praktisch nicht miteinander, bewegen sich chaotisch und kontinuierlich im Raum, dann haben wir es zu tun Gas .
Wenn die Partikel lokalisiert sind schließen zueinander, aber chaotisch, mehr miteinander interagieren Wenn Sie in einer Position intensive oszillierende Bewegungen ausführen, aber in eine andere Position springen können, handelt es sich hierbei um ein Modell der Struktur Flüssigkeiten .
Wenn die Partikel lokalisiert sind schließen zueinander, aber mehr in geordneter Weise, Und mehr interagieren untereinander, bewegen sich aber nur innerhalb einer Gleichgewichtslage, praktisch ohne sich in andere zu bewegen Situation, dann haben wir es zu tun solide .

Die meisten bekannten chemischen Substanzen und Gemische können in festem, flüssigem und gasförmigem Zustand vorliegen. Das einfachste Beispiel ist Wasser. Bei normale Bedingungen sie flüssig, bei 0 o C gefriert es – geht von einem flüssigen Zustand in über hart, und bei 100 o C kocht es - verwandelt sich in Gasphase- Wasserdampf. Darüber hinaus sind viele Stoffe unter normalen Bedingungen Gase, Flüssigkeiten oder Feststoffe. Beispielsweise ist Luft – ein Gemisch aus Stickstoff und Sauerstoff – unter normalen Bedingungen ein Gas. Aber wenn Bluthochdruck Bei niedrigen Temperaturen kondensieren Stickstoff und Sauerstoff und gehen in die flüssige Phase über. Flüssiger Stickstoff wird in der Industrie aktiv eingesetzt. Manchmal isoliert Plasma, und auch Flüssigkristalle, als separate Phasen.

Viele Eigenschaften einzelner Stoffe und Gemische werden erläutert relative Position Teilchen im Raum relativ zueinander!
Dieser Artikel untersucht Eigenschaften von Festkörpern, abhängig von ihrer Struktur. Grundlegende physikalische Eigenschaften von Festkörpern: Schmelzpunkt, elektrische Leitfähigkeit, Wärmeleitfähigkeit, mechanische Festigkeit, Duktilität usw.
Schmelztemperatur - Dies ist die Temperatur, bei der ein Stoff von der festen Phase in die flüssige Phase übergeht und umgekehrt.

ist die Fähigkeit eines Stoffes, sich ohne Zerstörung zu verformen.

Elektrische Leitfähigkeit ist die Fähigkeit eines Stoffes, Strom zu leiten.
Strom ist die geordnete Bewegung geladener Teilchen. Somit kann Strom nur von Stoffen durchgeführt werden, die enthalten bewegliche geladene Teilchen. Aufgrund ihrer Fähigkeit, Strom zu leiten, werden Stoffe in Leiter und Dielektrika unterteilt. Leiter sind Stoffe, die Strom leiten können (d. h. bewegliche geladene Teilchen enthalten). Dielektrika sind Stoffe, die praktisch keinen Strom leiten.

In einem festen Stoff können sich Partikel eines Stoffes befinden chaotisch, oder geordneterÖ. Wenn sich die Teilchen eines festen Stoffes im Raum befinden chaotisch, heißt der Stoff amorph. Beispiele für amorphe Stoffe – Kohle, Glimmerglas.

Sind die Teilchen eines festen Stoffes geordnet im Raum angeordnet, d.h. Sich wiederholende dreidimensionale geometrische Strukturen bilden, nennt man einen solchen Stoff Kristall, und die Struktur selbst – Kristallgitter . Die meisten Substanzen, die wir kennen, sind Kristalle. Die Partikel selbst befinden sich darin Knoten Kristallgitter.
Kristalline Stoffe zeichnen sich insbesondere aus durch Art der chemischen Bindung zwischen Partikeln in einem Kristall – atomar, molekular, metallisch, ionisch; entsprechend der geometrischen Form der einfachsten Zelle eines Kristallgitters - kubisch, sechseckig usw.
Abhängig von Art von Teilchen, die ein Kristallgitter bilden , unterscheiden Atom-, Molekül-, Ionen- und Metallkristallstruktur .
Atomares Kristallgitter

Ein atomares Kristallgitter entsteht, wenn die Knoten des Kristalls lokalisiert werden Atome. Die Atome sind stark miteinander verbunden kovalente chemische Bindungen. Dementsprechend wird ein solches Kristallgitter sehr sein dauerhaft, es ist nicht leicht, es zu zerstören. Ein atomares Kristallgitter kann durch Atome mit hoher Wertigkeit gebildet werden, d. h. mit einer großen Anzahl von Bindungen zu benachbarten Atomen (4 oder mehr). In der Regel handelt es sich dabei um Nichtmetalle: einfache Stoffe - Silizium, Bor, Kohlenstoff (allotrope Modifikationen Diamant, Graphit) und deren Verbindungen (Borkohlenstoff, Siliziumoxid (IV) usw..). Da zwischen Nichtmetallen überwiegend kovalente chemische Bindungen auftreten, freie Elektronen(wie andere geladene Teilchen) in Stoffen mit einem atomaren Kristallgitter in den meisten Fällen nein. Daher sind solche Substanzen in der Regel leiten den Strom sehr schlecht, d.h. sind Dielektrika. Dabei handelt es sich um allgemeine Muster, von denen es eine Reihe von Ausnahmen gibt.

Kommunikation zwischen Teilchen in Atomkristallen: .
An den Knoten des Kristalls mit einer atomaren Kristallstruktur lokalisiert Atome.
Phasenzustand Atomkristalle unter Normalbedingungen: in der Regel Feststoffe.
Substanzen, Bildung von Atomkristallen im festen Zustand:
- Einfache Substanzen hohe Wertigkeit (in der Mitte des Periodensystems): Bor, Kohlenstoff, Silizium usw.
- Komplexe Stoffe, die aus diesen Nichtmetallen bestehen: Kieselsäure (Siliziumoxid, Quarzsand) SiO 2; Siliziumkarbid (Korund) SiC; Borcarbid, Bornitrid usw.
Physikalische Eigenschaften von Stoffen mit einem atomaren Kristallgitter:
— Stärke;
— Feuerfestigkeit (hoher Schmelzpunkt);
— geringe elektrische Leitfähigkeit;
— geringe Wärmeleitfähigkeit;
— chemische Inertheit (inaktive Substanzen);
- Unlöslichkeit in Lösungsmitteln.

Molekulares Kristallgitter- Dies ist ein Gitter, an dessen Knoten sich befinden Moleküle. Hält Moleküle im Kristall schwache Kräfte der intermolekularen Anziehung (Van-der-Waals-Kräfte, Wasserstoffbrückenbindungen oder elektrostatische Anziehung). Dementsprechend ist ein solches Kristallgitter in der Regel ziemlich leicht zu zerstören. Stoffe mit molekularem Kristallgitter – schmelzbar, zerbrechlich. Je größer die Anziehungskraft zwischen Molekülen ist, desto höher ist der Schmelzpunkt der Substanz. In der Regel liegen die Schmelztemperaturen von Stoffen mit molekularem Kristallgitter nicht über 200-300K. Daher liegen unter normalen Bedingungen die meisten Substanzen mit einem molekularen Kristallgitter in der Form vor Gase oder Flüssigkeiten. Ein molekulares Kristallgitter wird in der Regel in fester Form durch Säuren, Nichtmetalloxide, andere binäre Verbindungen von Nichtmetallen, einfache Stoffe, die stabile Moleküle bilden (Sauerstoff O 2, Stickstoff N 2, Wasser H 2 O, usw.), organische Substanzen. In der Regel handelt es sich dabei um Stoffe mit einer kovalenten polaren (seltener unpolaren) Bindung. Weil Elektronen sind an chemischen Bindungen beteiligt, Stoffe mit einem molekularen Kristallgitter - Dielektrika leiten die Wärme nicht gut.

Kommunikation zwischen Teilchen in Molekülkristallen: m intermolekulare, elektrostatische oder intermolekulare Anziehungskräfte.
An den Knoten des Kristalls mit einer molekularen Kristallstruktur gelegen Moleküle.
Phasenzustand Molekülkristalle unter normalen Bedingungen: Gase, Flüssigkeiten und Feststoffe.
Substanzen, bildet sich im festen Zustand molekulare Kristalle:
- Einfache nichtmetallische Substanzen, die kleine, starke Moleküle bilden (O 2, N 2, H 2, S 8 usw.);
- Komplexe Stoffe (Nichtmetallverbindungen) mit polaren kovalenten Bindungen (außer Silizium- und Boroxide, Silizium- und Kohlenstoffverbindungen) - Wasser H 2 O, Schwefeloxid SO 3 usw.
- Einatomige Edelgase (Helium, Neon, Argon, Krypton usw.);
- Die meisten organischen Substanzen besitzen keine ionischen Bindungen — Methan CH 4, Benzol C 6 H 6 usw.
Physikalische Eigenschaften Stoffe mit molekularem Kristallgitter:
— Schmelzbarkeit (niedriger Schmelzpunkt):
— hohe Kompressibilität;
— Molekülkristalle in fester Form sowie in Lösungen und Schmelzen leiten keinen Strom;
- Phasenzustand unter Normalbedingungen – Gase, Flüssigkeiten, Feststoffe;
— hohe Volatilität;
- geringe Härte.
Ionenkristallgitter

Wenn sich an den Kristallknoten geladene Teilchen befinden – Ionen, darüber können wir reden Ionenkristallgitter . Typischerweise wechseln sich Ionenkristalle ab positive Ionen(Kationen) und negative Ionen(Anionen), sodass die Partikel im Kristall festgehalten werden Kräfte der elektrostatischen Anziehung . Abhängig von der Art des Kristalls und der Art der Ionen, die den Kristall bilden, können solche Substanzen sein ziemlich langlebig und feuerfest. Im festen Zustand gibt es in Ionenkristallen normalerweise keine beweglichen geladenen Teilchen. Wenn sich der Kristall jedoch auflöst oder schmilzt, werden die Ionen freigesetzt und können sich unter dem Einfluss eines externen elektrischen Feldes bewegen. Diese. Nur Lösungen oder Schmelzen leiten Strom Ionenkristalle. Das ionische Kristallgitter ist charakteristisch für Stoffe mit ionische chemische Bindung. Beispiele solche Substanzen - Salz NaCl, Kalziumkarbonat– CaCO 3 usw. In der festen Phase bildet sich in der Regel ein ionisches Kristallgitter Salze, Basen sowie Metalloxide und binäre Verbindungen von Metallen und Nichtmetallen.

Kommunikation zwischen Teilchen in Ionenkristallen: .
An den Knoten des Kristalls mit einem ionischen Gitter lokalisiert Ionen.
Phasenzustand Ionenkristalle unter normalen Bedingungen: in der Regel Feststoffe.
Chemikalien mit Ionenkristallgitter:
- Salze (organisch und anorganisch), einschließlich Ammoniumsalze (Zum Beispiel, Ammoniumchlorid NH 4 Cl);
- Gründe;
- Metalloxide;
- Binäre Verbindungen, die Metalle und Nichtmetalle enthalten.
Physikalische Eigenschaften von Stoffen mit ionischer Kristallstruktur:
— hoher Schmelzpunkt (Feuerfestigkeit);
— Lösungen und Schmelzen von Ionenkristallen sind Stromleiter;
— Die meisten Verbindungen sind in polaren Lösungsmitteln (Wasser) löslich.
– Festphasenzustand für die meisten Verbindungen unter normalen Bedingungen.

Und schließlich zeichnen sich Metalle durch eine besondere Art der räumlichen Struktur aus – Metallkristallgitter, was fällig ist Chemische Metallbindung . Metallatome halten Valenzelektronen eher schwach. In einem aus einem Metall gebildeten Kristall laufen folgende Prozesse gleichzeitig ab: Manche Atome geben Elektronen ab und werden zu positiv geladenen Ionen; diese Elektronen bewegen sich zufällig im Kristall; Einige Elektronen werden von Ionen angezogen. Diese Prozesse laufen gleichzeitig und chaotisch ab. Auf diese Weise, Es entstehen Ionen , wie bei der Bildung einer Ionenbindung, und Es entstehen gemeinsame Elektronen , wie bei der Bildung einer kovalenten Bindung. Freie Elektronen bewegen sich wie ein Gas zufällig und kontinuierlich durch das gesamte Volumen des Kristalls. Deshalb werden sie manchmal auch „ Elektronengas " Aufgrund der Verfügbarkeit große Zahl bewegliche geladene Metallteilchen Leiten Strom und Wärme. Der Schmelzpunkt von Metallen variiert stark. Auch Metalle werden charakterisiert ein eigenartiger metallischer Glanz, Formbarkeit, d.h. die Fähigkeit, unter starker mechanischer Belastung zerstörungsfrei ihre Form zu verändern, weil chemische Bindungen werden nicht zerstört.

Kommunikation zwischen Teilchen : .
An den Knoten des Kristalls mit Metallgitter angebracht Metallionen und Atome.
Phasenzustand Metalle unter normalen Bedingungen: normalerweise Feststoffe(Ausnahme ist Quecksilber, das unter normalen Bedingungen flüssig ist).
Chemikalien mit einem Metallkristallgitter - einfache Stoffe - Metalle.
Physikalische Eigenschaften von Stoffen mit einem Metallkristallgitter:
— hohe thermische und elektrische Leitfähigkeit;
— Formbarkeit und Plastizität;
- metallischer Schimmer;
- Metalle sind normalerweise in Lösungsmitteln unlöslich;
- Die meisten Metalle sind unter normalen Bedingungen Feststoffe.
Vergleich der Eigenschaften von Stoffen mit unterschiedlichen Kristallgittern
Die Art des Kristallgitters (oder das Fehlen eines Kristallgitters) ermöglicht die Beurteilung der grundlegenden physikalischen Eigenschaften einer Substanz. Um die typischen physikalischen Eigenschaften von Verbindungen mit unterschiedlichen Kristallgittern grob zu vergleichen, ist es sehr praktisch, Chemikalien zu verwenden charakteristische Eigenschaften . Für ein Molekülgitter ist dies beispielsweise Kohlendioxid, für ein atomares Kristallgitter - Diamant, für Metall - Kupfer und für das Ionenkristallgitter - Salz, Natriumchlorid NaCl.

Übersichtstabelle der gebildeten Strukturen einfacher Substanzen chemische Elemente aus den Hauptnebengruppen des Periodensystems (Elemente der Nebennebengruppen sind Metalle, haben daher ein metallisches Kristallgitter).

Die letzte Tabelle zum Zusammenhang zwischen den Eigenschaften von Stoffen und ihrer Struktur:

Struktur der Materie.
Es sind nicht einzelne Atome oder Moleküle, die chemische Wechselwirkungen eingehen, sondern Stoffe.
Unsere Aufgabe ist es, die Struktur der Materie kennenzulernen.
Bei niedrige Temperaturen Für Stoffe ist der stabile feste Zustand stabil.
☼ Der härteste Stoff der Natur ist Diamant. Er gilt als König aller Edelsteine und Edelsteine. Und sein Name selbst bedeutet auf Griechisch „unzerstörbar“. Diamanten galten schon lange als Wundersteine. Es wurde angenommen, dass eine Person, die Diamanten trägt, keine Magenkrankheiten kennt, nicht von Giften angegriffen wird, ihr Gedächtnis und ihre fröhliche Stimmung bis ins hohe Alter behält und sich der königlichen Gunst erfreut.
☼ Ein Diamant, der einer Schmuckbearbeitung – Schneiden, Polieren – unterzogen wurde, wird Diamant genannt.
Beim Schmelzen durch thermische Schwingungen wird die Ordnung der Partikel gestört, sie werden beweglich, während die Art der chemischen Bindung nicht gestört wird. Somit gibt es keine grundsätzlichen Unterschiede zwischen festen und flüssigen Zuständen.
Die Flüssigkeit erhält Fließfähigkeit (d. h. die Fähigkeit, die Form eines Gefäßes anzunehmen).
Flüssigkristalle.
Flüssigkristalle sind offen Ende des 19. Jahrhunderts Jahrhunderte, wurden aber erst in den letzten 20–25 Jahren untersucht. Viele Anzeigegeräte Moderne Technologie, zum Beispiel einige Digitaluhr, Minicomputer, die mit Flüssigkristallen betrieben werden.
Im Allgemeinen klingen die Worte „Flüssigkristalle“ nicht weniger ungewöhnlich als „heißes Eis“. Allerdings kann Eis in Wirklichkeit auch heiß sein, denn... bei einem Druck von mehr als 10.000 atm. Wassereis schmilzt bei Temperaturen über 2000 °C. Das Ungewöhnliche an der Kombination „Flüssigkristalle“ besteht darin, dass der flüssige Zustand die Beweglichkeit der Struktur anzeigt und der Kristall eine strenge Ordnung impliziert.
Besteht ein Stoff aus mehratomigen Molekülen mit länglicher oder lamellenförmiger Form und asymmetrischer Struktur, so orientieren sich diese Moleküle beim Schmelzen in einer bestimmten Weise zueinander (ihre Längsachsen sind parallel). In diesem Fall können sich die Moleküle frei parallel zu sich selbst bewegen, d.h. Das System erhält die für eine Flüssigkeit charakteristische Eigenschaft der Fließfähigkeit. Gleichzeitig behält das System eine geordnete Struktur bei, die die für Kristalle charakteristischen Eigenschaften bestimmt.
Die hohe Beweglichkeit einer solchen Struktur ermöglicht es, sie durch sehr schwache Einflüsse (thermisch, elektrisch usw.) zu steuern, d. h. Mit sehr geringem Energieaufwand, wie er in der modernen Technik zum Einsatz kommt, gezielt die Eigenschaften eines Stoffes, auch optisch, verändern.
Arten von Kristallgittern.
Jede chemische Substanz besteht aus einer großen Anzahl identischer Partikel, die miteinander verbunden sind.
Bei niedrigen Temperaturen, wenn die thermische Bewegung schwierig ist, sind die Partikel streng im Raum ausgerichtet und bilden ein Kristallgitter.
Kristallzelle ist eine Struktur mit geometrisch korrekter Anordnung der Teilchen im Raum.
Im Kristallgitter selbst werden Knoten und Internodenraum unterschieden.
Derselbe Stoff existiert je nach Bedingungen (p, t,...) in verschiedenen kristallinen Formen (d. h. sie haben unterschiedliche Kristallgitter) – allotrope Modifikationen, die sich in ihren Eigenschaften unterscheiden.
Beispielsweise sind vier Modifikationen von Kohlenstoff bekannt: Graphit, Diamant, Carbin und Lonsdaleit.
☼ Die vierte Art von kristallinem Kohlenstoff, „lonsdaleit“, ist wenig bekannt. Es wurde in Meteoriten entdeckt und künstlich gewonnen, seine Struktur wird noch untersucht.
☼ Ruß, Koks, Holzkohle werden als amorphe Kohlenstoffpolymere klassifiziert. Mittlerweile wurde jedoch bekannt, dass es sich dabei ebenfalls um kristalline Stoffe handelt.
☼ Im Ruß wurden übrigens glänzend schwarze Partikel gefunden, die man „Spiegelkohlenstoff“ nannte. Spiegelkohlenstoff ist chemisch inert, hitzebeständig, undurchlässig für Gase und Flüssigkeiten, hat eine glatte Oberfläche und ist absolut verträglich mit lebendem Gewebe.
☼ Der Name Graphit kommt vom italienischen „graffito“ – ich schreibe, ich zeichne. Graphit ist ein dunkelgrauer Kristall mit schwachem metallischem Glanz und einem Schichtgitter. Einzelne Atomschichten in einem Graphitkristall, die relativ schwach miteinander verbunden sind, lassen sich leicht voneinander trennen.
Arten von Kristallgittern



Eigenschaften von Stoffen mit unterschiedlichen Kristallgittern (Tabelle)
Wenn die Kristallwachstumsrate beim Abkühlen niedrig ist, entsteht ein glasiger Zustand (amorph).
Die Beziehung zwischen der Position eines Elements im Periodensystem und dem Kristallgitter seiner einfachen Substanz.
Zwischen der Position des Elements in Periodensystem und dem Kristallgitter der entsprechenden einfachen Substanz besteht eine enge Beziehung.

Die einfachen Stoffe der übrigen Elemente besitzen ein metallisches Kristallgitter.
FESTSETZUNG
Studieren Sie den Vorlesungsstoff und beantworten Sie die folgenden Fragen schriftlich in Ihrem Notizbuch:
- Was ist ein Kristallgitter?
- Welche Arten von Kristallgittern gibt es?
- Beschreiben Sie jede Art von Kristallgitter gemäß dem Plan:
Was sich in den Knoten des Kristallgitters befindet, Struktureinheit → Art der chemischen Bindung zwischen den Partikeln des Knotens → Wechselwirkungskräfte zwischen den Partikeln des Kristalls → Durch das Kristallgitter bestimmte physikalische Eigenschaften → Aggregatzustand Stoffe unter Normalbedingungen → Beispiele
Erledigen Sie Aufgaben zu diesem Thema:
- Welche Art von Kristallgitter haben die folgenden im Alltag häufig verwendeten Stoffe: Wasser, Essigsäure(CH3 COOH), Zucker (C12 H22 O11), Kaliumdünger (KCl), Flusssand (SiO2) - Schmelzpunkt 1710 0C, Ammoniak (NH3), Speisesalz? Machen Sie eine allgemeine Schlussfolgerung: Anhand welcher Eigenschaften eines Stoffes lässt sich die Art seines Kristallgitters bestimmen?
Bestimmen Sie anhand der Formeln der angegebenen Stoffe: SiC, CS2, NaBr, C2 H2 die Art des Kristallgitters (ionisch, molekular) jeder Verbindung und beschreiben Sie darauf basierend die physikalischen Eigenschaften jedes der vier Stoffe.
Trainer Nr. 1. „Kristallgitter“
Trainer Nr. 2. „Testaufgaben“
Test (Selbstkontrolle):
1) Stoffe, die in der Regel ein molekulares Kristallgitter besitzen:
A). feuerfest und gut wasserlöslich
B). schmelzbar und flüchtig
V). Fest und elektrisch leitfähig
G). Wärmeleitfähig und plastisch
2) Der Begriff „Molekül“ ist nicht auf die Struktureinheit eines Stoffes anwendbar:
B). Sauerstoff
V). Diamant
3) Das atomare Kristallgitter ist charakteristisch für:
A). Aluminium und Graphit
B). Schwefel und Jod
V). Siliziumoxid und Natriumchlorid
G). Diamant und Bor
4) Wenn ein Stoff in Wasser gut löslich ist, einen hohen Schmelzpunkt hat und elektrisch leitfähig ist, dann ist sein Kristallgitter:
A). molekular
B). atomar
V). ionisch
G). Metall