Plan de cours de chimie (11e année) sur le thème : Plan de cours de chimie "Représentants des acides carboxyliques insaturés. Relation entre les hydrocarbures, les alcools, les acides aldéhydiques"
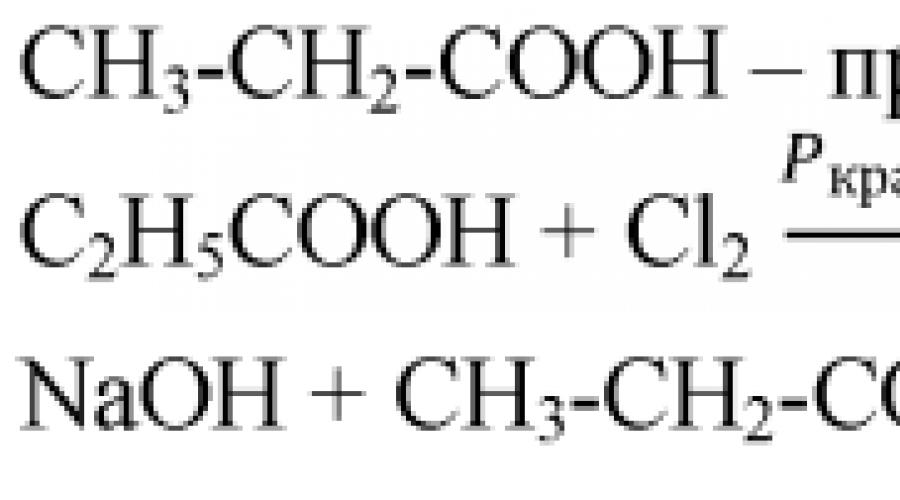
Option 1
1. Écrivez les équations de réaction qui permettent d'effectuer les transformations suivantes : méthane → chlore-méthane → méthanol → formaldéhyde → acide formique. Préciser les conditions de réaction.
2. Écrivez la formule développée d'une substance de composition C₃H₆O₂, si l'on sait que sa solution aqueuse change la couleur du méthylorange en rouge, avec le chlore cette substance forme le composé C₃H₅ClO₂, et lorsque son sel de sodium est chauffé avec de l'hydroxyde de sodium , de l'éthane se forme. Nommez la substance. 
3. Calculez la masse de substance (en grammes) et la quantité de substance (en moles) de chaque produit en effectuant les transformations suivantes : bromoéthane → éthanol → acide éthanoïque. Le bromoéthane a été pris avec une masse de 218 g. 
Option 2
1. Écrivez les équations de réaction qui peuvent être utilisées pour effectuer les transformations suivantes : acétylène → éthylène → éthanol → acétaldéhyde → acide acétique. Préciser les conditions de réaction. 
2. Écrivez la formule développée d'une substance de composition C₄H₈O, si l'on sait qu'elle réagit avec l'hydroxyde de cuivre (II) et forme lors de l'oxydation de l'acide 2-méthylpropanoïque. Nommez cette substance. 
3. Calculez la masse de substance (en grammes) et la quantité de substance (en moles) de chaque produit lors des transformations suivantes : propane → 2-chloropropane → 2-propanol. Le propane a été pris avec une masse de 22 g. 
Option 3
1. Écrivez les équations de réaction qui peuvent être utilisées pour effectuer les transformations suivantes : méthane → acétylène → acétaldéhyde → alcool éthylique → acide éthanoïque. Préciser les conditions de réaction. 
2. Écrivez la formule développée d'une substance de composition C₅H₁₀O, si l'on sait qu'elle ajoute de l'hydrogène en présence d'un catalyseur, et lorsqu'elle est chauffée avec de l'hydroxyde de cuivre (II) fraîchement préparé, elle forme un précipité rouge. Nommez cette substance. 
3. Calculez la masse de substance (en grammes) et la quantité de substance (en moles) de chaque produit lors des transformations suivantes : benzène → chlorobenzène → phénol. Le benzène a été prélevé avec une masse de 156 g. 
Option 4
1. Écrivez les équations de réaction qui peuvent être utilisées pour effectuer les transformations suivantes : méthane → formaldéhyde → méthanol → acide formique → acide carbonique. Préciser les conditions de réaction. 
2. Écrivez la formule développée d'une substance de composition C₂H₆O₂, si l'on sait qu'elle réagit avec le sodium pour libérer de l'hydrogène et qu'avec l'hydroxyde de cuivre (II), elle forme une substance bleu vif. Nommez cette substance. 
3. Calculez la masse de substance (en grammes) et la quantité de substance (en moles) de chaque produit en effectuant les transformations suivantes : chlorométhane → méthanol → acide méthanoïque. Le chlorométhane a été prélevé avec une masse de 202 g. 
Sujet de cours « Relation génétique entre les hydrocarbures, les alcools, les aldéhydes et les cétones » Objectif Développer la capacité de compiler des formules développées à partir de ces informations. Développer la compétence de mise en œuvre de chaînes de transformations de substances organiques. Améliorer la connaissance de la classification et de la nomenclature des substances organiques.
Programme d'activités « Élaboration d'une formule développée d'une substance à partir de ces informations » 1) Traduire cette information dans le langage des diagrammes. 2) Devinez la classe de connexion. 3) Établir la classe du composé et sa formule développée. 4) Écrivez les équations des réactions qui se produisent.


Programme d'activités : « Mise en œuvre de chaînes de transformations » 1). Numérotez les réactions chimiques. 2).Déterminer et étiqueter la classe de chaque substance dans la chaîne de transformations. 3).Analyser la chaîne : A) Écrire les formules des réactifs et les conditions de réaction au-dessus de la flèche ; B) Sous la flèche, écrivez les formules des produits complémentaires avec un signe moins. 4).Écrivez les équations de réaction : A) Disposez les coefficients ; B) Nommez les produits de la réaction.



Classification composés organiques selon la structure de la chaîne carbonée 1. Selon la nature du squelette carboné, on distingue les composés acycliques (linéaires et ramifiés et cycliques). Composés acycliques (aliphatiques, non cycliques) - composés qui ont un carbone ouvert linéaire ou ramifié Les chaînes sont souvent appelées normales. Composés cycliques - composés contenant des molécules fermées dans un cycle


Classification des atomes de carbone individuels Dans les squelettes carbonés eux-mêmes, il est d'usage de classer les atomes de carbone individuels en fonction du nombre d'atomes de carbone qui y sont chimiquement liés. Si un atome de carbone donné est connecté à un atome de carbone, il est alors appelé primaire, avec deux - secondaire, trois - tertiaire et quatre - quaternaire. Dans les squelettes carbonés eux-mêmes, il est d'usage de classer les atomes de carbone individuels en fonction du nombre d'atomes de carbone qui leur sont chimiquement liés. Si un atome de carbone donné est connecté à un atome de carbone, il est alors appelé primaire, avec deux - secondaire, trois - tertiaire et quatre - quaternaire. Quel est le nom de l'atome de carbone indiqué : Quel est le nom de l'atome de carbone indiqué : a) à l'intérieur du cercle _________________ ; b) à l'intérieur du carré __________________ ; c) à l'intérieur du cœur __________________ ; d) à l'intérieur du triangle _________________ ;

Leçon : Nomenclature et isomérie des alcools. Propriétés chimiques des alcools. Relation génétique entre alcools et hydrocarbures.
Le but de la leçon. Approfondir les connaissances des étudiants sur la nomenclature systématique et l'isomérie. Montrer les propriétés communes des alcools monohydriques saturés en raison de leur structure similaire. Développer le concept de l'influence mutuelle des atomes dans une molécule, le lien génétique entre composés organiques en utilisant l'exemple de la transformation d'hydrocarbures saturés en alcools (par réactions de substitution, d'échange, d'addition).
Matériel : Sur la table de démonstration : échantillons d'alcools monohydriques saturés (méthyle, éthyle (abs.), butyle (amyle), sodium métallique, chlorure de sodium (calciné), acide sulfurique (conc.), 3 verres,
La leçon commence par des questions sur la matière abordée :
1) Qu'est-ce qui cause les différences dans les propriétés physiques des homologues dans la série des alcools monohydriques saturés ?
2) Qu'est-ce qu'une liaison hydrogène et comment affecte-t-elle les propriétés des alcools ?
Nouveau matériel nous étudions par méthode travail indépendantétudiants. Puisqu'ils connaissent la nomenclature et l'isomérie des hydrocarbures et de leurs dérivés halogénés, cette section s'apprend au cours de l'exercice (au tableau et dans des cahiers). Les élèves lisent d'abord le manuel, puis effectuent les tâches suivantes :
1) Composer les formules développées des alcools : a) 2,2-méthyléthylbutanol-1, b) 3,3-diméthylpentanol-2. Quelles sont ces substances les unes par rapport aux autres ?
2) Écrivez les formules développées de tous les alcools isomères correspondant à la formule C 5 H 11 OH.
3) Créer des formules pour les éthers isomères des alcools propyliques.
Conversation avec la classe sur la composition des alcools, la présence en eux d'un groupe fonctionnel qui détermine leurs propriétés chimiques. En utilisant l'alcool éthylique comme exemple, plusieurs réactions sont nommées qui se produisent avec la participation de l'hydrogène du groupe hydroxo et de l'ensemble du groupe hydroxo.
Sachant que les propriétés des homologues doivent être similaires, les étudiants dé- ; tirer une conclusion sur les propriétés chimiques générales des alcools de cette série. Pour confirmer la conclusion, nous démontrons des expériences d'obtention de chlorométhane à partir de alcool méthylique; interaction de l'alcool propylique avec le sodium.
Afin de tester les connaissances des élèves sur l'influence mutuelle des atomes dans une molécule, nous leur posons une question : comment le radical hydrocarboné d'un alcool devrait-il affecter la vitesse de la réaction de substitution ? Nous suggérons qu’à mesure que le radical hydrocarboné augmente, la vitesse de réaction de l’alcool avec le sodium devrait diminuer. Nous confirmons l'hypothèse en démontrant l'expérience : versez 10 ml d'alcool éthylique (abs.), butylique et amylique dans 3 béchers et déposez-y des morceaux de sodium purifiés de taille égale (couvrez les béchers avec des entonnoirs). ), Les élèves comparent les taux de libération des bulles d’hydrogène dans chaque cas.
Nous écrivons sélectivement plusieurs équations de réactions se produisant au cours d'expériences.
2C 2 H 5 OH + 2 Na = 2 C 2 H 5 ONa + H 2
2C 4 H 9 OH + 2 N / A= 2 C 4 H 9 Sur un+ H 2
Pour développer le concept d'influence mutuelle, nous considérons la capacité de dissociation du 2-chloroéthanol.
D'autres propriétés générales sont théoriquement fixées au cours de la tâche : par quelles réactions le propanol-1 peut-il être transformé en propanol-2 ? Écrivez les équations de réaction correspondantes et expliquez le mécanisme de l’une d’elles. Pour réaliser la tâche, les étudiants utilisent leurs connaissances sur la déshydratation intramoléculaire des alcools :
1)CH3-CH2-CH2OH (H2SO4 à t(-H2O))=CH3-CH=CH2
CH3-CH=CH2+HCl =CH3-CHCl-CH3
CH3-CHCl-CH3+KOH=CH3-CHOH-CH3+ KCl
Nous invitons ensuite les étudiants à analyser la réaction d’hydratation du propylène afin de consolider leurs connaissances sur la règle de Markovnikov et le mécanisme ionique. Ils doivent expliquer que sous l’influence d’un radical méthyle, la densité du nuage électronique de la liaison π se déplace vers l’atome de carbone opposé.
Nous soulignons ici que par la réaction d'hydratation, les hydrocarbures insaturés sont directement liés aux alcools, et passons à la dernière question de la leçon - sur le lien génétique entre les alcools et les hydrocarbures. Nous proposons aux étudiants la tâche d'écrire des équations de réaction qui peuvent être utilisées pour obtenir de l'alcool méthylique à partir du méthane. Ils travaillent d'abord à partir du manuel, puis terminent les devoirs , Nous formulons une conclusion sur l'existence d'un lien génétique entre les hydrocarbures (saturés et insaturés), les dérivés halogénés des hydrocarbures et les alcools.
EXPÉRIENCES DE LABORATOIRE SUR LE THÈME : « RELATION GÉNÉTIQUE ENTRE LES HYDROCARBURES, LES ALCOOLS, LES ALDÉHYDES ET LES ACIDES »
Hydrocarbures saturés
Parmi les hydrocarbures saturés, l'école étudie en détail le méthane en tant que substance la plus simple en termes de composition et de structure, la plus accessible à la connaissance pratique et qui revêt une grande importance économique en tant que matière première chimique et carburant.
Les expériences avec la première substance étudiée en chimie organique doivent être réalisées en quantité suffisante et avec un soin particulier en termes méthodologiques, car elles doivent montrer de nouveaux aspects de l'expérience dans l'étude de la chimie organique. Il sera ici possible d'établir expérimentalement la composition et formule moléculaire substances, qui constitue la première étape dans la détermination des formules développées des composés organiques.
MÉTHANE.
L'ordre des expériences avec le méthane peut être différent. Fondamentalement, cela dépendra si l'enseignant commencera le sujet en obtenant du méthane, puis mènera des expériences pour étudier ses propriétés, en utilisant la substance obtenue dans la leçon, ou utilisera du méthane pré-préparé afin de suivre clairement la séquence d'étude du questions - réfléchissez d'abord propriétés physiques substance, puis ses propriétés chimiques, son application et enfin sa production. Dans ce dernier cas, l'expérience de production de méthane ne sera présentée qu'à la fin du sujet.
La première façon d’étudier un sujet et donc de construire une expérience est plus complexe sur le plan méthodologique, mais plus rapide. La deuxième méthode demandera plus de temps, mais elle est méthodologiquement plus simple et est également précieuse dans la mesure où elle permettra enfin de répéter et de consolider les connaissances des expériences de base avec une substance lorsqu'elles sont acquises en classe.
Lors de l’étude du méthane, des expériences en laboratoire ne sont pas particulièrement nécessaires. Pour l’essentiel, elles pourraient se réduire ici uniquement à la production de méthane et à sa combustion. Mais la production de méthane à partir de l'acétate de sodium et sa combustion peuvent facilement être démontrées sur une table de démonstration.
Il serait plus judicieux de réaliser un cours pratique spécial après avoir étudié l'ensemble du thème « Hydrocarbures ». Dans cette leçon, les élèves reproduiront l'expérience de production de méthane et pourront vérifier que le méthane ne décolore pas l'eau bromée et la solution de permanganate de potassium.
Produire du méthane en laboratoire. La méthode de laboratoire la plus pratique pour produire du méthane est l’interaction de l’acétate de sodium avec la chaux sodée.
Interaction du sel acides carboxyliques avec un alcali est d'une manière générale obtenir des hydrocarbures. Réaction dans vue générale représenté par l'équation :
si R = CH 3, alors du méthane se forme.
Étant donné que la soude caustique est une substance hygroscopique et que la présence d'humidité interfère avec la réussite de la réaction, de l'oxyde de calcium y est ajouté. Un mélange d’hydroxyde de sodium et d’oxyde de calcium est appelé chaux sodée.
Pour que la réaction se déroule avec succès, un chauffage assez élevé est nécessaire, cependant, une surchauffe excessive du mélange entraîne des processus secondaires et la production de produits indésirables, tels que l'acétone :
L'acétate de sodium doit être déshydraté avant l'expérience. La chaux sodée doit également être calcinée avant de préparer le mélange. S'il n'y a pas de chaux sodée prête à l'emploi, elle est préparée de la manière suivante. Dans une tasse en fer ou en porcelaine, versez de la chaux concassée bien calcinée CaO avec la moitié de la quantité d'une solution aqueuse saturée d'alcali NaOH. Le mélange est évaporé à sec, calciné et broyé. Les substances sont stockées dans un dessiccateur.
Pour démontrer la production de méthane, il est préférable d'utiliser un petit flacon muni d'un tube de sortie et de leçon pratique-- tube à essai (Fig. 1 et 2).
Assemblez l'appareil comme indiqué sur la Fig. 1 ou 2. Une solution alcaline est versée dans une bouteille de lavage pour capturer les impuretés (Fig. I). Un mélange d'acétate de sodium et de chaux sodée est placé dans un ballon de réaction ou un tube à essai. Pour ce faire, les substances finement broyées sont soigneusement mélangées dans un rapport volumique de 1:3, c'est-à-dire avec un excès important de chaux pour forcer l'acétate de sodium à réagir le plus complètement possible.

Riz.

Le ballon est chauffé avec un brûleur à travers un treillis en amiante et le tube à essai est chauffé sur une flamme nue. Le méthane est collecté dans un tube à essai en déplaçant l'eau. Pour vérifier la pureté du gaz obtenu, retirez le tube à essai de l'eau et enflammez le gaz sans le retourner.
Puisqu'il n'est pas pratique d'interrompre le processus de production de méthane et qu'il est impossible de terminer toutes les autres expériences pendant que la réaction est en cours, il est recommandé de collecter le gaz pour des expériences ultérieures dans plusieurs cylindres (tubes à essai) ou dans un gazomètre.
Les cylindres remplis sont laissés un moment dans le bain ou recouverts d'eau avec une plaque de verre (bouchon) et posés à l'envers sur la table.
Le méthane est plus léger que l'air. Pour vous familiariser avec les propriétés physiques du méthane, l'enseignant fait la démonstration d'une bouteille contenant du gaz collecté. Les élèves observent que le méthane est un gaz incolore. La collecte du méthane par déplacement de l’eau suggère que ce gaz est apparemment insoluble dans l’eau. L'enseignant confirme cette conclusion.
Deux flacons identiques de la plus grande capacité possible sont équilibrés sur la balance. L'un des flacons est suspendu à l'envers (Fig. 3). Le méthane provenant de l'appareil passe dans ce ballon pendant un certain temps. La balance monte. Pour que les élèves ne pensent pas que le changement de poids est dû à la pression du flux de gaz au fond du ballon, faites attention au fait que le déséquilibre persiste même après l'arrêt du passage du méthane.
Une fois la balance rééquilibrée (pour ce faire, retournez la bouteille de méthane pendant un moment), à des fins de comparaison et de conclusions plus convaincantes, le méthane est introduit dans un flacon normalement placé sur la balance. L'équilibre de la balance n'est pas perturbé.

Après avoir montré que le méthane est plus léger que l'air, l'enseignant indique combien il pèse conditions normales litre de méthane. Cette information sera nécessaire plus tard pour dériver la formule moléculaire d’une substance.
Combustion du méthane. Après avoir examiné les propriétés physiques du méthane, la question peut se poser de savoir quelle est la formule moléculaire du méthane. L'enseignant rapporte que pour clarifier cette question, il faudra d'abord se familiariser avec l'une des propriétés chimiques du méthane : la combustion.
La combustion du méthane peut être illustrée de deux manières.
1. Cylindre en verre(d'une capacité par exemple de 250 ml), rempli de méthane, posez-le sur la table, retirez-en l'assiette ou ouvrez le bouchon et enflammez immédiatement le gaz avec un éclat. Lorsque le méthane brûle, la flamme descend dans le cylindre.

Pour que la flamme reste tout le temps au-dessus du cylindre et soit clairement visible pour les étudiants, de l'eau peut être progressivement versée dans le cylindre avec du méthane brûlant, chassant ainsi le gaz (Fig. 4).
2. Le méthane est enflammé directement au niveau du tube de sortie de l'appareil pour produire du gaz ou un compteur de gaz (dans les deux cas, un contrôle de pureté s'impose !). La taille de la flamme est contrôlée par l'intensité du chauffage dans le premier cas et par la hauteur de la colonne de liquide de déplacement dans le second cas. Si le méthane est exempt d’impuretés, il brûle avec une flamme presque incolore. Pour éliminer une partie de la luminosité de la flamme (couleur jaune) provoquée par les sels de sodium présents dans le verre du tube, un embout métallique peut être fixé à l'extrémité du tube.
ALDÉHYDES ET CÉTONES
Lors de l'étude des aldéhydes, les étudiants, grâce à des expériences, se familiarisent avec la nature progressive de l'oxydation des substances organiques, avec la chimie des substances importantes processus de production et avec le principe d'obtention de résines synthétiques.
Pour que les étudiants comprennent clairement la place des aldéhydes dans la série des produits d'oxydation des hydrocarbures, lors de l'élaboration d'équations chimiques, il ne faut pas éviter d'utiliser les noms et les formules des acides dans lesquels les aldéhydes sont convertis. Les formules des acides peuvent être données dogmatiquement d’avance ; À l'avenir, les étudiants recevront une justification expérimentale pour eux.
Lors de l'étude des aldéhydes, la plupart des expériences sont réalisées avec le formaldéhyde, la substance la plus accessible aux écoles et d'une grande importance industrielle. C’est dans cette optique que le formaldéhyde occupe une place majeure dans ce chapitre. Pour l'acétaldéhyde, seules les réactions de préparation sont prises en compte. Les cétones ne sont pas spécifiquement enseignées à l’école ; par conséquent, un seul représentant d'entre eux est pris ici - l'acétone, et des expériences avec celle-ci sont données principalement pour activités extra-scolairesétudiants.
FORMALDÉHYDE (MÉTHANAL)
Il est conseillé d'élaborer un plan d'étude de cette substance de telle sorte qu'immédiatement après s'être familiarisés avec les propriétés physiques des aldéhydes, les étudiants étudient les méthodes d'obtention, puis les propriétés chimiques, etc. Une connaissance un peu plus précoce des méthodes de production de l'aldéhyde permettra plus loin, lors de l'étude des propriétés chimiques (réactions d'oxydation), de considérer les aldéhydes comme un maillon de la chaîne d'oxydation des hydrocarbures.
Lorsque vous vous familiarisez avec les propriétés du formaldéhyde, vous pouvez utiliser le formaldéhyde comme échantillon. Dans ce cas, vous devez immédiatement vous assurer que les élèves comprennent clairement la différence entre le formaldéhyde et le formaldéhyde.
Odeur de formaldéhyde. Parmi les propriétés physiques du formaldéhyde, la plus accessible en pratique est l'odeur. A cet effet, des tubes à essai contenant 0,5 à 1 ml de formaldéhyde sont distribués aux étudiants. Une fois que les élèves se sont familiarisés avec l’odeur, le formaldéhyde peut être collecté et utilisé pour d’autres expériences. La familiarisation avec l'odeur du formaldéhyde permettra aux étudiants de détecter cette substance dans d'autres expériences.
Inflammabilité du formaldéhyde. Chauffer le formaldéhyde dans un tube à essai et enflammer les vapeurs dégagées ; ils brûlent avec une flamme presque incolore. La flamme peut être vue si vous y allumez un éclat ou un morceau de papier. L'expérience est réalisée sous une sorbonne.
Obtention de formaldéhyde. Étant donné que le formaldéhyde ne peut être détecté que par l'odorat avant de se familiariser avec ses propriétés chimiques, la première expérience d'obtention doit être réalisée sous forme de travail en laboratoire.
1. Quelques gouttes de méthanol sont versées dans un tube à essai. Dans la flamme du brûleur, un petit morceau de treillis de cuivre ou une spirale de fil de cuivre enroulé en tube est chauffé et rapidement plongé dans le méthanol.
Lorsqu'il est calciné, le cuivre s'oxyde et se couvre d'une couche noire d'oxyde de cuivre ; dans l'alcool, il est à nouveau réduit et devient rouge :

Une odeur âcre d'aldéhyde est détectée. Si le processus d'oxydation est répété 2 à 3 fois, une concentration significative de formaldéhyde peut être obtenue et la solution peut être utilisée pour des expériences ultérieures.
2. En plus de l'oxyde de cuivre, d'autres agents oxydants familiers aux étudiants peuvent être utilisés pour produire du formaldéhyde.
0,5 ml de méthanol sont ajoutés à une solution faible de permanganate de potassium dans un tube de démonstration et le mélange est chauffé jusqu'à ébullition. L'odeur de formaldéhyde apparaît et la couleur violette du permanganate disparaît.
2-3 ml d'une solution saturée de bichromate de potassium K 2 Cr 2 O 7 et le même volume d'acide sulfurique concentré sont versés dans un tube à essai. Ajoutez du méthanol goutte à goutte et chauffez très soigneusement le mélange (le trou du tube à essai est dirigé sur le côté !). La réaction se déroule ensuite avec dégagement de chaleur. La couleur jaune du mélange de chrome disparaît et la couleur verte du sulfate de chrome apparaît

Il n’est pas nécessaire de discuter de l’équation de réaction avec les élèves. Comme dans le cas précédent, ils sont seulement informés que le dichromate de potassium oxyde l'alcool méthylique en aldéhyde, se transformant ainsi en sel de chrome trivalent Cr 2 (SO 4) 3.
Réaction du formaldéhyde avec l'oxyde d'argent(réaction miroir argenté). Cette expérience doit être démontrée aux étudiants de telle manière qu'elle serve simultanément d'enseignement pour la leçon pratique ultérieure.
Préparation de résines phénol-formaldéhyde. La majeure partie du formaldéhyde produit dans l'industrie est utilisée pour la synthèse du phénol-formaldéhyde et d'autres résines nécessaires à la production de plastiques. La production de résines phénol-formaldéhyde est basée sur la réaction de polycondensation.
La synthèse de résine phénol-formaldéhyde est la plus accessible dans les conditions scolaires. À cette époque, les étudiants connaissent déjà les deux substances initiales pour la production de résine - le phénol et le formaldéhyde ; l'expérience est relativement simple et se déroule sans problème ; la chimie du procédé ne présente pas de difficulté particulière pour les étudiants si elle est décrite comme suit :

En fonction du rapport quantitatif de phénol et de formaldéhyde, ainsi que du catalyseur utilisé (acide ou alcalin), une résine novolaque ou résol peut être obtenue. Le premier d'entre eux est thermoplastique et possède structure linéaire, donnée ci-dessus. La seconde est thermoréactive, car ses molécules linéaires contiennent des groupes alcool libres - CH 2 OH, qui peuvent réagir avec les atomes d'hydrogène mobiles d'autres molécules, entraînant la formation d'une structure tridimensionnelle.
ACÉTALDÉHYDE (ÉTHANAL)
Après une introduction détaillée aux propriétés du formaldéhyde dans cette section du sujet, les expériences liées à la production d'acétaldéhyde deviennent de la plus haute importance. Ces expériences peuvent être réalisées dans le but de : a) montrer que tous les aldéhydes peuvent être obtenus par oxydation des alcools monohydriques correspondants, b) montrer comment la structure des aldéhydes peut être justifiée expérimentalement, c) introduire la chimie de la méthode industrielle pour produire de l'acétaldéhyde selon Kuchsrov.
Préparation d'acétaldéhyde par oxydation d'éthanol. L'oxyde de cuivre (II) peut être utilisé comme agent oxydant pour l'alcool. La réaction se déroule de la même manière que l’oxydation du méthanol :
- 1. Pas plus de 0,5 ml d'alcool éthylique sont versés dans un tube à essai et un fil de cuivre chaud est immergé. Une odeur fruitée d'acétaldéhyde est détectée et une réduction du cuivre est observée. Si l'oxydation de l'alcool est effectuée 2 à 3 fois, en chauffant à chaque fois le cuivre jusqu'à formation d'oxyde de cuivre, alors, après avoir collecté les solutions obtenues par les étudiants dans des tubes à essai, il sera possible d'utiliser l'aldéhyde pour des expériences avec celui-ci. .
- 2. Placer 5 g de bichromate de potassium broyé K2Cr2O7 dans un petit ballon muni d'un tube de sortie, verser 20 ml d'acide sulfurique dilué (1:5) puis 4 ml d'alcool éthylique. Un réfrigérateur est connecté au ballon et chauffé sur une petite flamme à travers un grillage en amiante. Le récepteur de distillat est placé dans de l'eau glacée ou de la neige. Un peu d'eau est versée dans le récipient et l'extrémité du réfrigérateur est plongée dans l'eau. Ceci est fait afin de réduire la volatilisation des vapeurs d'acétaldéhyde (point d'ébullition 21°C). Avec l'éthanal, une certaine quantité d'eau et d'alcool formé n'ayant pas réagi est distillée dans le récepteur. acide acétique et d'autres sous-produits de réaction. Cependant, il n'est pas nécessaire d'isoler l'acétaldéhyde pur, puisque le produit résultant réagit bien avec les réactions ordinaires des aldéhydes. La présence d'aldéhyde est déterminée par l'odeur et par la réaction d'un miroir d'argent.
L'attention des élèves est attirée sur le changement de couleur dans le flacon. La couleur verte du sulfate de chrome (III) Cr 2 (SO 4) 3 obtenu devient particulièrement distincte si le contenu du ballon est dilué avec de l'eau après l'expérience. Il est à noter que le changement de couleur du bichromate de potassium est dû à son oxydation par l'alcool.
Préparation d'acétaldéhyde par hydratation de l'acétylène. La découverte remarquable du chimiste russe M.G. Kucherov - l'ajout d'eau à l'acétylène en présence de sels de mercure a constitué la base d'une méthode industrielle largement répandue pour produire de l'acétaldéhyde.
Malgré grande importance et d'accessibilité pour l'école, cette méthode est rarement démontrée dans les cours de chimie.
Dans l'industrie, le processus est réalisé en faisant passer de l'acétylène dans de l'eau contenant des sels de mercure divalent et acide sulfurique, à une température de 70°C. L'acétaldéhyde résultant dans ces conditions est distillé et condensé, après quoi il entre dans des tours spéciales pour être oxydé en acide acétique. L'acétylène est obtenu à partir de carbure de calcium de la manière habituelle et purifié des impuretés.
La nécessité de purifier l'acétylène et de maintenir la température dans le réacteur, d'une part, et l'incertitude d'obtention le produit souhaité- en revanche, ils diminuent généralement l'intérêt pour cette expérience. En attendant, l'expérience peut être réalisée de manière assez simple et fiable à la fois sous une forme simplifiée et dans des conditions proches des conditions industrielles.
1. Une expérience qui reflète dans une certaine mesure les conditions de la réaction en production et permet d'obtenir une solution d'aldéhyde suffisamment concentrée peut être réalisée dans le dispositif représenté sur la Fig. 29.

La première étape est la production d'acétylène. Des morceaux de carbure de calcium sont placés dans le ballon et de l'eau ou une solution saturée de sel de table est ajoutée lentement à partir d'un entonnoir à gouttes. La vitesse de fixation est ajustée de manière à ce qu’un flux régulier d’acétylène soit établi, environ une bulle toutes les 1 à 2 s. L'acétylène est purifié en machine à laver avec une solution de sulfate de cuivre :
CuSO 4 + H 2 S H 2 SO 4
Après purification, le gaz est passé dans un ballon avec une solution de catalyseur (15-20 ml d'eau, 6-7 ml d'acide sulfurique concentré et environ 0,5 g d'oxyde de mercure (II). Le ballon, où s'effectue l'hydratation de l'acétylène, est chauffé avec un brûleur (lampe à alcool) et l'acétaldéhyde résultant sous forme gazeuse pénètre dans des tubes à essai avec de l'eau, où il est absorbé.
Après 5 à 7 minutes dans un tube à essai, il est possible d'obtenir une solution d'éthanal de concentration significative. Pour terminer l'expérience, arrêtez d'abord l'alimentation en eau du carbure de calcium, puis débranchez l'appareil et, sans distillation supplémentaire de l'aldéhyde du ballon de réaction, utilisez les solutions obtenues dans des tubes à essai pour les expériences correspondantes.
2. Dans sa forme la plus simplifiée, la réaction de M.G. Kucherov peut être réalisée comme suit.
Versez 30 ml d'eau et 15 ml de concentré dans une petite fiole à fond rond. acide sulfurique. Le mélange est refroidi et un peu d'oxyde de mercure (II) y est ajouté (au bout d'une spatule). Chauffez soigneusement le mélange à travers un grillage en amiante jusqu'à ébullition et l'oxyde de mercure se transforme en sulfate de mercure (II).
Tazhibaeva Asemgul Isintaevna
Enseignant à l'école secondaire de Kamennobrod
Cours de chimie en 11e année
Sujet de cours : Relations génétiques entre hydrocarbures, alcools, aldéhydes, alcools, acides carboxyliques.
Type de cours : leçon de généralisation des connaissances.
Objectifs de la leçon: consolider, généraliser et systématiser les connaissances sur les composés organiques contenant de l'oxygène, y compris sur la base de connexions génétiques entre les classes de ces substances. Renforcer la capacité de prédire les propriétés chimiques de substances organiques inconnues sur la base de la connaissance des groupes fonctionnels. Développer chez les élèves un discours démonstratif, la capacité d'utiliser la terminologie chimique, de mener, d'observer et de décrire une expérience chimique. Cultiver le besoin de connaissance sur les substances avec lesquelles nous entrons en contact dans la vie.
Méthodes : verbal, visuel, pratique, recherche de problèmes, contrôle des connaissances.
Réactifs : acide acétylsalicylique (aspirine), eau, chlorure ferrique (III), solution de glucose, indicateur universel, solution de sulfate de cuivre (II), solution d'hydroxyde de sodium, blanc d'œuf, éthanol, 1-butanol, acide acétique, acide stéarique.
Équipement: ordinateur, écran, projecteur, tableau « Classification des substances organiques contenant de l'oxygène », notice explicative « Le groupe fonctionnel détermine les propriétés d'une substance », mortier et pilon, tige de verre, lampe à alcool, porte-éprouvette, entonnoir, filtre, verres, support avec tubes à essai, pipette, éprouvette graduée de 10 ml.
I. Moment organisationnel.
Aujourd'hui en classe :
1) Vous renforcerez la capacité de prédire les propriétés chimiques de substances organiques inconnues sur la base de la connaissance des groupes fonctionnels.
2) Vous découvrirez quels groupes fonctionnels vous connaissez sont inclus dans le médicament antipyrétique le plus connu.
3) Vous trouverez des groupes fonctionnels dans une substance au goût sucré, utilisée en médecine comme nutritif et un composant de liquides de remplacement du sang.
4) Vous verrez comment obtenir de l’argent pur.
5) Nous en parlerons effets physiologiques alcool éthylique.
6) Nous discuterons des conséquences de l'utilisation boissons alcoolisées femmes enceintes.
7) Vous serez agréablement surpris : il s’avère que vous en savez déjà beaucoup !
II. Répétition et généralisation des connaissances acquises par les étudiants.
1. Classification des composés organiques contenant de l'oxygène.
Nous commençons la généralisation du matériau par la classification des substances organiques contenant de l'oxygène. Pour ce faire, nous utiliserons le tableau « Classification des composés organiques contenant de l'oxygène ». Lors du travail frontal, nous répéterons les groupes fonctionnels contenant de l'oxygène.
En chimie organique, il existe trois groupes fonctionnels les plus importants, parmi lesquels les atomes d'oxygène :hydroxyle, carbonyle Etcarboxyle. Cette dernière peut être considérée comme une combinaison des deux précédentes. Selon les atomes ou groupes d'atomes auxquels ces groupes fonctionnels sont associés, les substances contenant de l'oxygène sont divisées en alcools, phénols, aldéhydes, cétones et acides carboxyliques.
Considérons ces groupes fonctionnels et leur effet sur les propriétés physiques et chimiques des substances.
Visionnage d'un clip vidéo.
Vous savez déjà que ce n'est pas le seul signe de classification possible. Il peut y avoir plusieurs groupes fonctionnels identiques dans une molécule, et faites attention à la ligne correspondante du tableau.
La ligne suivante reflète la classification des substances selon le type de radical associé au groupe fonctionnel. Je voudrais attirer l'attention sur le fait que, contrairement aux alcools, aldéhydes, cétones et acides carboxyliques, les hydroxyarènes sont classés dans une classe distincte de composés - les phénols.
Le nombre de groupes fonctionnels et la structure du radical déterminent la formule moléculaire générale des substances. Dans ce tableau, ils ne sont donnés que pour les représentants limites des classes à un groupe fonctionnel.
Toutes les classes de composés qui « rentrent » dans le tableau sontmonofonctionnel, c'est-à-dire qu'ils n'ont qu'une seule fonction contenant de l'oxygène.
Pour consolider le matériel sur la classification et la nomenclature des substances contenant de l'oxygène, je donne plusieurs formules de composés et demande aux élèves de déterminer « leur place » dans la classification donnée et de donner un nom.
Nom | Classe de substances | |
Acide propinique | Acide monobasique insaturé |
|
| Butanediol-1,4 | Limite, alcool dihydrique |
| 1,3-Dihydroxybenzène | Phénol diatomique |
| 3-méthylbutanal | Aldéhyde saturé |
| Butène-3-one-2 | Cétone insaturée |
| 2-méthylbutanol-2 | Limite, alcool monohydrique |
Relation entre la structure et les propriétés des composés contenant de l'oxygène.
La nature du groupe fonctionnel a un impact significatif sur les propriétés physiques des substances de cette classe et détermine en grande partie ses propriétés chimiques.
Le concept de « propriétés physiques » comprend état d'agrégation substances.
État agrégé des connexions linéaires de différentes classes :
Alcools | Aldéhydes | Acides carboxyliques | |
1 | et. | G. | et. |
2 | et. | et. | et. |
3 | et. | et. | et. |
4 | et. | et. | et. |
5 | et. | et. | et. |
La série homologue des aldéhydes commence par les gaz température ambiante substances - formaldéhyde, et parmi les alcools monohydriques et les acides carboxyliques, il n'y a pas de gaz. A quoi est-ce lié ?
Les molécules d'alcools et d'acides sont en outre reliées entre elles par des liaisons hydrogène.
L’enseignant demande aux élèves de formuler la définition de « liaison hydrogène »(il s'agit d'une liaison intermoléculaire entre l'oxygène d'une molécule et l'hydrogène hydroxyle d'une autre molécule) , le corrige et, si nécessaire, dicte pour l'écriture : une liaison chimique entre un atome d'hydrogène déficient en électrons et un atome riche en électrons d'un élément à forte électronégativité (F , Ô , N ) est appeléhydrogène.
Comparez maintenant les points d’ébullition (°C) des cinq premiers homologues de substances de trois classes.
Alcools | Aldéhydes | Acides carboxyliques | |
1 | +64,7 | -19 | +101 |
2 | +78,3 | +21 | +118 |
3 | +97,2 | +50 | +141 |
4 | +117,7 | +75 | +163 |
5 | +137,8 | +120 | +186 |
Que pouvez-vous dire après avoir regardé les tableaux ?
Dans la série homologue des alcools et des acides carboxyliques, il n'y a pas de substances gazeuses et les points d'ébullition des substances sont élevés. Cela est dû à la présence de liaisons hydrogène entre les molécules. En raison des liaisons hydrogène, les molécules s'associent (comme si elles étaient réticulées). Par conséquent, pour que les molécules se libèrent et acquièrent de la volatilité, il est nécessaire de dépenser de l'énergie supplémentaire pour rompre ces liaisons.
Que peut-on dire de la solubilité des alcools, des aldéhydes et des acides carboxyliques dans l’eau ? (Démonstration de la solubilité dans l'eau des alcools - éthyle, propyle, butyle et acides - formique, acétique, propionique, butyrique et stéarique. Une solution d'aldéhyde formique dans l'eau est également démontrée.)
Pour répondre, le schéma de formation de liaisons hydrogène entre les molécules d'acide et d'eau, les alcools et les acides est utilisé.


Il convient de noter qu'avec l'augmentation du poids moléculaire, la solubilité des alcools et des acides dans l'eau diminue. Plus le radical hydrocarboné dans une molécule d'alcool ou d'acide est gros, plus il est difficile pour le groupe OH de maintenir la molécule en solution en raison de la formation de liaisons hydrogène faibles.
3. Relation génétique entre les différentes classes de composés contenant de l'oxygène.
Je dessine au tableau les formules de plusieurs composés contenant un atome de carbone :
CH 4 →CH 3 OH → HCOH → HCOOH → CO 2
Pourquoi sont-ils étudiés dans cet ordre dans le cours de chimie organique ?
Comment change l’état d’oxydation d’un atome de carbone ?
Les élèves dictent la droite : -4, -2, 0, +2, +4
Il apparaît désormais clairement que chaque composé ultérieur est une forme de plus en plus oxydée du précédent. A partir de là, il est évident qu'il faut se déplacer le long de la série génétique de gauche à droite en utilisant des réactions d'oxydation, et dans le sens inverse en utilisant des processus de réduction.
Les corps cétoniques sortent-ils de ce « cercle familial » ? Bien sûr que non. Leurs prédécesseurs sont des alcools secondaires.
Propriétés chimiques Chaque classe de substances a été abordée en détail dans les leçons correspondantes. Pour résumer ce matériel, j'ai proposé comme devoirs tâches sur les transformations mutuelles sous une forme quelque peu inhabituelle.
1. Composé de formule moléculaireC 3 H 8 Ô soumis à une déshydrogénation, ce qui donne un produit ayant la compositionC 3 H 6 Ô . Cette substance subit une réaction de « miroir d’argent », formant le composéC 3 H 6 Ô 2 . Lorsque cette dernière substance a été traitée avec de l'hydroxyde de calcium, on a obtenu une substance utilisée comme additif alimentaire sous le code E 282. Elle empêche la croissance de moisissures dans les boulangeries et confiserie et on le trouve également dans des aliments tels que le fromage suisse. Déterminez la formule de l'additif E 282, écrivez les équations des réactions mentionnées et nommez toutes les substances organiques.
Solution :
CH 3 –CH 2 –CH 2 –OH → CH 3 –CH 2 – COH + H 2 ( chat. – Cu, 200-300 °C)
CH 3 –CH 2 – COH + Ag 2 O → CH 3 –CH 2 – COOH + 2Ag (équation simplifiée, solution ammoniacale d'oxyde d'argent)
2CH 3 –CH 2 –COOH+AVECune(OH) 2 → (CH 3 –CH 2 – Directeur des opérations) 2 Ca+2H 2 O.
Réponse : propionate de calcium.
2. Composition du composéC 4 H 8 Cl 2 avec un squelette carboné droit chauffé avec une solution aqueuseNaOH et obtenu une substance organique qui, lors de l'oxydationCu(OH) 2 transformé enC 4 H 8 Ô 2 . Déterminez la structure du composé d’origine.
Solution: si 2 atomes de chlore sont situés sur des atomes de carbone différents, alors lorsqu'ils sont traités avec un alcali, nous obtiendrons un alcool dihydrique qui ne s'oxydera pasCu(OH) 2 . Si 2 atomes de chlore étaient situés sur un atome de carbone au milieu de la chaîne, alors une fois traitée avec un alcali, on obtiendrait une cétone qui ne s'oxyde pas.Cu(OH) 2. Ensuite, la connexion souhaitée est1,1-dichlorobutane.
CH 3 –CH 2 –CH 2 – CHCl 2 + 2NaOH → CH 3 –CH 2 –CH 2 – COH + 2NaCl + H 2 Ô
CH 3 –CH 2 –CH 2 – COH + 2Cu(OH) 2 →CH 3 –CH 2 –CH 2 – COOH + Cu 2 O+2H 2 Ô
3. Lorsque 19,2 g de sel de sodium d'acide monobasique saturé ont été chauffés avec de l'hydroxyde de sodium, 21,2 g de carbonate de sodium se sont formés. Nommez l’acide.
Solution:
Lorsqu'il est chauffé, une décarboxylation se produit :
R-COONa + NaOH → RH + Na 2 CO 3
υ (N / A 2 CO 3 ) = 21,2 / 106 = 0,2 taupe
υ (R-COONa) = 0,2taupe
M(R-COONa) = 19,2 / 0,2 = 96g/ taupe
M(R-COOH) =M(R-COONa) –M(Na) + M(H) = 96-23+1= 74g/ taupe
Conformément à formule générale d'acides carboxyliques monobasiques saturés, pour déterminer le nombre d'atomes de carbone, il faut résoudre l'équation :
12n + 2n + 32= 74
n=3
Réponse : l'acide propionique.
Pour consolider les connaissances sur les propriétés chimiques des substances organiques contenant de l'oxygène, nous réaliserons un test.
1 possibilité
Les formules suivantes correspondent aux alcools monohydriques saturés :
UN)
CH
2
Ô
B)
C
4
H
10
Ô
DANS)
C
2
H
6
Ô
G)
CH
4
Ô
D)
C
2
H
4
Ô
2
Il contient une combinaison de deux principes,
On est dans la naissance des miroirs.
Bien sûr, pas pour la contemplation,
Et pour la science de la compréhension.
...Et au royaume de la forêt on la retrouve,
Les petits frères sont ses amis ici,
Leur cœur leur est entièrement donné...
choix :
A) acide picrique
B) acide formique
B) acide acétique
D) groupe carboxyle
D) acide benzoïque
L'éthanol réagit avec les substances :
UN)
NaOH
B)
N / A
DANS)
HCl
G)
CH
3
COOH
D)
FeCl
3
Une réaction qualitative aux phénols est une réaction avec
UN)
NaOH
B)
Cu(OH)
2
DANS)
CuO
G)
FeCl
3
D)
HNO
3
L'éthanal réagit avec les substances
A) méthanol
B) hydrogène
B) solution ammoniacale d'oxyde d'argent
D) hydroxyde de cuivre (II)
D) chlorure d'hydrogène
Option 2
Les aldéhydes peuvent être obtenus
A) oxydation des alcènes
B) oxydation des alcools
B) hydratation des alcynes
D) lors du chauffage de sels de calcium d'acides carboxyliques
D) hydratation des alcènes
Le groupe fonctionnel des alcools est
UN)
COH
B)
OH
DANS)
COOH
G)
N.H.
2
D)
NON
2
2-méthylbutanol-2
A) alcool insaturé
B) limiter l'alcool
B) alcool monohydrique
D) alcool tertiaire
D) aldéhyde
Avez-vous observé la réaction ?
A) pour les alcools polyhydriques
B) oxydation de l'alcool
B) interaction du phénol avec le chlorure de fer (III)
D) « miroir argenté »
D) « miroir de cuivre »
L'acide acétique réagit avec les substances
A) hydrogène
B) le chlore
B) propanol
D) hydroxyde de sodium
D) métanalem
Les élèves remplissent leurs réponses dans le tableau :
UN | b | V | g | d | |
1 | + | + | + | ||
2 | + | ||||
3 | + | + | + | ||
4 | + | ||||
5 | + | + | + |
Si vous reliez les bonnes réponses avec une ligne continue, vous obtenez le chiffre « 5 ».
Travail de groupe d'étudiants.
Devoir pour le groupe 1

Objectifs:
Réactifs et équipements : acide acétylsalicylique (aspirine), eau, chlorure de fer(III); mortier et pilon, tige de verre, lampe à alcool, porte-éprouvette, entonnoir, filtre, verres, support avec éprouvettes, pipette, éprouvette graduée 10 ml.
Expérience 1. Preuve de l'absence d'hydroxyle phénolique dans l'acide acétylsalicylique (aspirine).
Placez 2-3 grains d'acide acétylsalicylique dans un tube à essai, ajoutez 1 ml d'eau et agitez vigoureusement. Ajoutez 1 à 2 gouttes de solution de chlorure de fer (III) à la solution obtenue. Qu'observez-vous ? Conclure.
Aucune couleur violette n'apparaît. Par conséquent, dans l'acide acétylsalicyliqueNOOS-S 6 N 4 -O-CO-CH 3 il n'y a pas de groupe phénolique libre, puisque cette substance est un ester formé d'acides acétique et salicylique.
Expérience 2. Hydrolyse de l'acide acétylsalicylique.
Un comprimé d'acide acétylsalicylique écrasé est placé dans un tube à essai et 10 ml d'eau sont ajoutés. Portez le contenu du tube à essai à ébullition et faites bouillir pendant 0,5 à 1 minute. Filtrez la solution. Ensuite, 1 à 2 gouttes de solution de chlorure de fer (III) sont ajoutées au filtrat obtenu. Qu'observez-vous ? Conclure.
Écrivez l'équation de la réaction :

Complétez le travail en remplissant un tableau qui contient les colonnes suivantes : opération réalisée, réactif, observations, conclusion.
Une couleur violette apparaît, indiquant la libération d'acide salicylique contenant un groupe phénolique libre. En tant qu'ester, l'acide acétylsalicylique est facilement hydrolysé lorsqu'il est bouilli avec de l'eau.
Devoir pour le groupe 2
1. Considérez les formules développées des substances, nommez les groupes fonctionnels.

2. Faites des travaux de laboratoire"Détection de groupes fonctionnels dans la molécule de glucose".
Objectifs: consolider les connaissances des élèves sur réactions qualitatives composés organiques, développer des compétences en détermination expérimentale de groupes fonctionnels.
Réactifs et équipements : solution glucose, indicateur universel, solution de sulfate de cuivre (II), solution d'hydroxyde de sodium, lampe à alcool, porte-éprouvette, allumettes, éprouvette graduée 10 ml.
2.1. Versez 2 ml de solution de glucose dans un tube à essai. À l'aide d'un indicateur universel, tirez une conclusion sur la présence ou l'absence d'un groupe carboxyle.
2.2. Préparez l'hydroxyde de cuivre (II) : versez 1 ml de sulfate de cuivre (II) dans un tube à essai et ajoutez-y de la soude. Ajouter 1 ml de glucose au précipité obtenu et agiter. Qu'observez-vous ? Pour quels groupes fonctionnels cette réaction est-elle typique ?
2.3. Chauffer le mélange obtenu lors de l'expérience n°2. Notez les changements. Pour quel groupe fonctionnel cette réaction est-elle typique ?
2.4. Complétez le travail en remplissant un tableau qui contient les colonnes suivantes : opération réalisée, réactif, observations, conclusion.
Expérience de démonstration. Interaction d'une solution de glucose avec une solution d'ammoniaque d'oxyde d'argent.
Résultats des travaux :
- il n'y a pas de groupe carboxyle, car la solution a une réaction neutre à l'indicateur ;
- le précipité d'hydroxyde de cuivre (II) se dissout et une couleur bleu vif apparaît, caractéristique des alcools polyhydriques ;
- lorsque cette solution est chauffée, un précipité jaune d'hydroxyde de cuivre (I) précipite, qui devient rouge lors d'un chauffage supplémentaire, indiquant la présence d'un groupe aldéhyde.
Conclusion. Ainsi, la molécule de glucose contient des groupes carbonyle et plusieurs groupes hydroxyle et est un alcool aldéhyde.
Devoir pour le groupe 3
Effet physiologique de l'éthanol
1. Quel est l’effet de l’éthanol sur les organismes vivants ?
2. À l'aide du matériel et des réactifs disponibles sur la table, démontrez l'effet de l'éthanol sur les organismes vivants. Commentez ce que vous voyez.
But de l'expérience : convaincre les élèves que l’alcool dénature les protéines et perturbe de manière irréversible leur structure et leurs propriétés.
Matériel et réactifs : support avec tubes à essai, pipette, éprouvette graduée 10 ml, blanc d'oeuf, éthanol, eau.
Déroulement de l'expérience : Versez 2 ml de blanc d'œuf dans 2 tubes à essai. Ajoutez 8 ml d'eau dans l'un et la même quantité d'éthanol dans l'autre.
Dans le premier tube à essai, la protéine se dissout et est bien absorbée par l'organisme. Dans le deuxième tube à essai, un précipité blanc dense se forme - les protéines ne se dissolvent pas dans l'alcool, l'alcool enlève l'eau des protéines. En conséquence, la structure et les propriétés de la protéine ainsi que ses fonctions sont perturbées.
3. Parlez-nous de l'effet de l'alcool éthylique sur divers organes et systèmes organiques humains.
Expliquer les conséquences de la consommation d'alcool aux femmes enceintes.
Spectacles étudiants.
Depuis l'Antiquité, l'homme sait grand nombre substances toxiques, ils diffèrent tous par la force de leur effet sur le corps. Parmi eux se distingue une substance connue en médecine comme un puissant poison protoplasmique - l'alcool éthylique. La mortalité due à l'alcoolisme dépasse le nombre de décès causés par tous maladies infectieuses pris ensemble.
Brûlant la membrane muqueuse de la cavité buccale, du pharynx, de l'œsophage, il entre tube digestif. Contrairement à de nombreuses autres substances, l’alcool est rapidement et complètement absorbé dans l’estomac. Facilement surmonté membranes biologiques, après environ une heure, il atteint sa concentration maximale dans le sang.
Les molécules d'alcool pénètrent rapidement dans les membranes biologiques dans le sang par rapport aux molécules d'eau. Les molécules d'alcool éthylique peuvent facilement traverser les membranes biologiques en raison de leur petite taille, de leur faible polarisation, de la formation de liaisons hydrogène avec les molécules d'eau et de la bonne solubilité de l'alcool dans les graisses.
Rapidement absorbé dans le sang et bien dissous dans le liquide intercellulaire, l'alcool pénètre dans toutes les cellules de l'organisme. Les scientifiques ont découvert qu'en perturbant les fonctions des cellules, cela provoque leur mort : en buvant 100 g de bière, environ 3000 cellules cérébrales meurent, 100 g de vin - 500, 100 g de vodka - 7500, contact des globules rouges avec les molécules d'alcool conduisent à la coagulation des cellules sanguines.
Le foie neutralise les substances toxiques qui pénètrent dans le sang. Les médecins appellent cet organe une cible pour l'alcool, puisque 90 % de l'éthanol y est neutralisé. Se produisent dans le foie procédés chimiques oxydation de l'alcool éthylique.
Nous rappelons avec les étudiants les étapes du processus d'oxydation de l'alcool :

L'alcool éthylique n'est oxydé en produits de décomposition finaux que si la consommation quotidienne d'éthanol ne dépasse pas 20 g. Si la dose est dépassée, des produits de décomposition intermédiaires s'accumulent dans l'organisme.
Cela entraîne un certain nombre d’effets secondaires effets négatifs: augmentation de la formation de graisse et de son accumulation dans les cellules hépatiques ; accumulation de composés peroxydes qui peuvent détruire membranes cellulaires, à la suite de quoi le contenu des cellules s'écoule à travers les pores formés ; phénomènes très indésirables, dont la combinaison conduit à la destruction du foie - la cirrhose.
L'acétaldéhyde est 30 fois plus toxique que l'alcool éthylique. De plus, à la suite de diverses réactions biochimiques dans les tissus et les organes, y compris le cerveau, la formation de tétrahydropapaveroline est possible, dont la structure et les propriétés ressemblent à des médicaments psychotropes bien connus - la morphine et le cannabinol. Les médecins ont prouvé que c'est l'acétaldéhyde qui provoque des mutations et diverses déformations chez les embryons.
L'acide acétique améliore la synthèse des acides gras et conduit à une dégénérescence graisseuse du foie.
En étudiant les propriétés physiques des alcools, nous avons abordé la question des modifications de leur toxicité dans la série homologue des alcools monohydriques. À mesure que le poids moléculaire des molécules de substance augmente, leurs propriétés narcotiques augmentent. Si l'on compare les alcools éthylique et pentylique, le poids moléculaire de ce dernier est 2 fois supérieur, et sa toxicité est 20 fois supérieure. Les alcools contenant trois à cinq atomes de carbone forment des huiles dites de fusel, dont la présence dans les boissons alcoolisées augmente leurs propriétés toxiques.
Dans cette série, l'exception est le méthanol, le poison le plus puissant. Lorsque 1 à 2 cuillères à café pénètrent dans le corps, le nerf optique est affecté, ce qui conduit à une cécité complète, et une consommation de 30 à 100 ml entraîne la mort. Le danger est accru par la similitude de l'alcool méthylique avec alcool éthylique par propriétés, apparence, odeur.
Avec les étudiants, nous essayons de trouver la cause de ce phénomène. Ils avancent diverses hypothèses. Nous insistons sur le fait que les facteurs qui augmentent la toxicité de l'alcool méthylique incluent la petite taille des molécules (vitesse de distribution élevée), ainsi que le fait que les produits intermédiaires de son oxydation - l'aldéhyde formique et l'acide formique - sont forts poisons.
L'alcool non neutralisé par le foie et les produits toxiques de sa dégradation pénètrent à nouveau dans la circulation sanguine et se distribuent dans tout le corps et y restent longtemps. Par exemple, l’alcool reste inchangé dans le cerveau 20 jours après sa consommation.
Nous attirons l'attention des étudiants sur la manière dont l'alcool et ses produits de dégradation sont éliminés de l'organisme.
10 % inchangé via les poumons, les reins et la peau | ||
90% sous forme CO 2 Et N 2 À PROPOS par les poumons et les reins |
Malheureusement, dans Dernièrement La consommation d’alcool, tout comme le tabagisme, est courante chez les femmes. L'influence de l'alcool sur la progéniture va dans deux directions.
Premièrement, la consommation d’alcool s’accompagne de profonds changements dans la sphère sexuelle tant chez les hommes que chez les femmes. L'alcool et ses produits de décomposition peuvent affecter les cellules reproductrices féminines et masculines avant même la fécondation - leurs informations génétiques changent (voir Fig. «Spermatozoïdes sains (1) et pathologiques (2)»).

Si la consommation d'alcool est prolongée, l'activité du système reproducteur est perturbée et commence à produire des cellules germinales défectueuses.
Deuxièmement, l'alcool affecte directement l'embryon. La consommation constante de 75 à 80 g de vodka, de cognac ou de 120 à 150 g de boissons alcoolisées plus faibles (bière) peut provoquer un syndrome d'alcoolisme fœtal. Par le placenta, non seulement l'alcool, mais aussi ses produits de décomposition, notamment l'acétaldéhyde, dix fois plus dangereux que l'alcool lui-même, pénètrent dans les eaux entourant le fœtus.
L'intoxication alcoolique a un effet néfaste sur le fœtus, car son foie, où pénètre d'abord le sang du placenta, ne possède pas encore d'enzyme spéciale qui décompose l'alcool et, non neutralisé, se propage dans tout le corps et provoque des changements irréversibles. L'alcool est particulièrement dangereux entre la 7e et la 11e semaine de grossesse, lorsqu'elles commencent à se développer. les organes internes. Cela affecte négativement leur développement, provoquant des perturbations et des changements. Le cerveau est particulièrement touché. En raison des effets de l'alcool, la démence, l'épilepsie, les névroses, les troubles cardiaques et rénaux peuvent se développer et des lésions des organes génitaux externes et internes peuvent survenir.
Parfois, des dommages au psychisme et à l'intellect sont déjà observés dans petite enfance, mais le plus souvent, ils sont identifiés lorsque les enfants commencent à étudier. Un tel enfant est intellectuellement affaibli et agressif. L'alcool a un effet beaucoup plus fort sur le corps d'un enfant que sur celui d'un adulte. Particulièrement sensible et facilement blessé système nerveux et le cerveau de l'enfant.
Regardons donc le tableau « L'influence de l'alcool sur l'hérédité et la santé des enfants » et tirons des conclusions .
Dans les familles de parents buveurs | Dans les familles de parents non buveurs | |
Décédé dans les premiers mois de sa vie | 44% | 8% |
Il s'est avéré inférieur, malade | 39% | 10% |
En bonne santé physique et mentale | 17% | 82% |
La consommation à long terme de boissons alcoolisées entraîne un ramollissement du cortex. De nombreuses hémorragies ponctuelles sont observées ; la transmission de l'excitation d'un cellule nerveuseà un autre. N'oubliez pas les mots d'avertissement laconiques de V.V. Maïakovski :
Ne buvez pas d'alcool.
Pour ceux qui en boivent, c'est un poison, pour ceux qui l'entourent, c'est une torture.
Ainsi, vous avez consolidé la capacité de prédire les propriétés chimiques de substances organiques inconnues, en vous appuyant sur la connaissance des groupes fonctionnels, répété les propriétés physiques et chimiques des substances organiques contenant de l'oxygène et consolidé la capacité de déterminer l'appartenance de composés organiques aux classes. de substances.
III. Devoirs.
1. Effectuer des transformations :

2. Explorez raisons possibles pollution environnement proche de la production : méthanol, phénol, formaldéhyde, acide acétique. Analyser l'influence de ces substances sur les objets naturels : l'atmosphère, les sources d'eau, le sol, les plantes, les animaux et les humains. Décrire les premiers secours en cas d'intoxication




