Préparation d'acides carboxyliques. Acides carboxyliques
Lire aussi
Acides carboxyliques. Les acides carboxyliques insaturés (insaturés) sont des composés dont les radicaux hydrocarbonés contiennent de multiples liaisons. Selon leur nombre et leur nature, on distingue : 1) les acides alcènephéniques de formule générale C*H2*-iCOOH, possédant une double liaison ; 2) les acides alcadiène-carboxyliques de formule générale CrHr-sCOOH, ayant deux doubles liaisons ; 3) les acides alkatriène carboxyliques de formule générale XaHg-3COOH, ayant trois doubles liaisons ; 4) acides alcynes carboxyliques de formule générale OD^-eCOOH, ayant une triple liaison. Mode de réception. 1. Oxydation des aldéhydes insaturés : acroléine, acide acrylique 2. Déshydrohalogénation des acides carboxyliques halogénés : CH2-CH2-CH2-COOH + 2KOH - CH2=CH-CH2-SOK+2H2O+KA 3. Déshydratation des p-hydroxyacides : Propriétés physiques. Acides carboxyliques insaturés avec un nombre d'atomes de carbone de 10 ou plus, ayant une configuration ^^, contrairement aux acides carboxyliques saturés avec conditions normales sont des liquides. Les isomères 7/?а« des acides carboxyliques insaturés comportant un nombre quelconque d’atomes de carbone sont des substances cristallines. . Dans le tableau 29.3 montre les propriétés physiques de certains représentants d'acides carboxyliques insaturés. Tableau 29.3. Propriétés physiques de certains représentants d'acides carboxyliques insaturés Nom de l'acide Formule Point de fusion, °C Température dpvniz, °C Acrylique C2H3-COOH 12,1 140,9 Propiol C2H - COOH 17,6 144 Crotonique (trans-omère) C3H5-COOH 71,4-71,7 185 Nom de acide Formule Point de fusion, °C Température X) Isocrotonique (isomère tfuc) C3H5-COOH 15,5 169 Oléique (isomère cis) C17H33COOH 13,4 228/15 Élandique (isomère trans) C17H33COOH 44 234/15 Linoléique Ci7H3iCOOH -5 149D Linolénique C ,7H29COOH -11,3 184/4 Les quatre derniers acides bout à basses pressions(indiqué en mm Hg séparé par une fraction). Propriétés chimiques. La présence de doubles et triples liaisons dans le radical hydrocarboné affecte la force des acides carboxyliques. Si l'acide propionique a une constante de dissociation K- = 1,34 Yu, alors pour l'acide acrylique elle est environ 4 fois supérieure (# = 5,6 * 10"5), et pour l'acide propiolique elle est mille fois supérieure (K = 1. 35 IG1). La présence de liaisons multiples dans les molécules d'acides carboxyliques insaturés détermine leur capacité à entrer dans des réactions d'addition et de polymérisation et les particularités de l'apparition de réactions d'oxydation 1. Réactions d'addition : 2. Réactions de polymérisation : coon coon 3. Des réactions d'oxydation : a) avec une oxydation soignée se forment. -COOH acide grotopique CH eCOOH+HOOC - COOH acide acétique oxalique [O) Représentants individuels. L'acide acrylique (propénoïque) CH2=CH - COOH est un liquide à l'odeur âcre, miscible à l'eau à tous égards. Il est largement utilisé pour. produire divers polymères. L'acide oléique C8H,7CH=CH - (CH^-COOH se trouve sous forme de glycérides dans la plupart des huiles végétales et graisses animales, est obtenu par hydrolyse, est un liquide huileux incolore, facilement oxydé à l'air, soluble dans les solvants organiques et non miscible. avec de l'eau . Utilisé pour la production de parfums et produits de beauté, nettoyants moussants, agents mouillants et plastifiants. Acide linoléique CH3 - (CH2)3 - (CH2 - CH - CH)2 - (CH2)7 -- COOH. Contenu sous forme de glycérides dans les huiles végétales, obtenus par leur hydrolyse, c'est un liquide jaune clair, très soluble dans les solvants organiques et insoluble dans l'eau. S'oxyde et polymérise facilement à l'air. L'acide linolénique est un liquide huileux jaune clair, insoluble dans l'eau et hautement soluble dans les solvants organiques. Contenu sous forme de glycérides dans les huiles végétales et obtenu grâce à leur hydrolyse. S'oxyde et polymérise facilement. Les acides linoléique et linolénique ne sont pas synthétisés dans le corps des humains et des animaux, mais sont nécessaires à la vie ; ils pénètrent dans l'organisme avec la nourriture, ils appartiennent donc aux acides gras dits essentiels.
Classification
a) Par basicité (c'est-à-dire le nombre de groupes carboxyles dans la molécule) :
RCOOH monobasique (monocarbone); Par exemple:
CH 3 CH 2 CH 2 COOH;
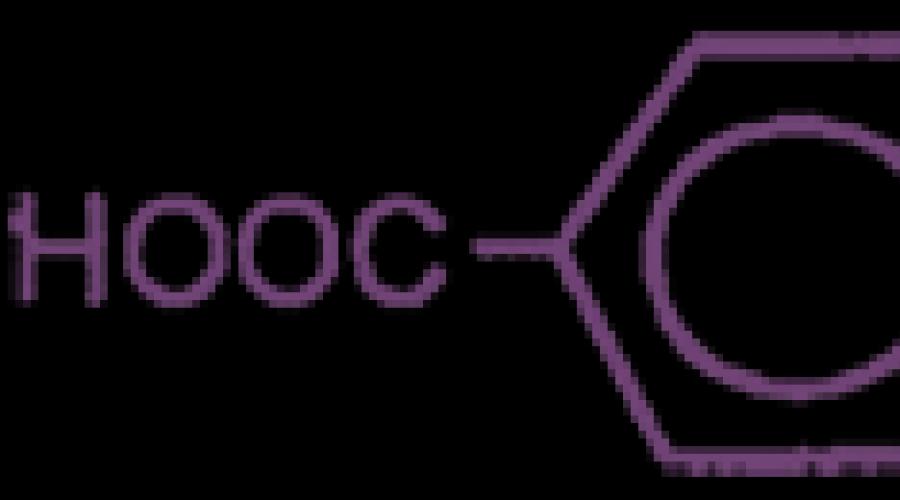
NOOS-CH 2 -COOH acide propanedioïque (malonique)

Tribasique (tricarboxylique) R(COOH) 3, etc.
b) Selon la structure du radical hydrocarboné :
Aliphatique
limite; par exemple : CH 3 CH 2 COOH ;
insaturé; par exemple : CH 2 = CHCOOH acide propénoïque (acrylique)

Alicycliques, par exemple :

Aromatiques, par exemple :

Acides monocarboxyliques saturés
(acides carboxyliques saturés monobasiques) - acides carboxyliques dans lesquels un radical hydrocarboné saturé est connecté à un groupe carboxyle -COOH. Ils ont tous la formule générale C n H 2n+1 COOH (n ≥ 0) ; ou CnH 2n O 2 (n≥1)
Nomenclature
Les noms systématiques des acides carboxyliques saturés monobasiques sont donnés par le nom de l'alcane correspondant avec l'ajout du suffixe - ovules et du mot acide.
1. Acide HCOOH méthane (formique)
2. CH 3 COOH acide éthanoïque (acétique)
3. Acide propanoïque (propionique) CH 3 CH 2 COOH
Isomérie
L'isomérie squelettique dans le radical hydrocarboné se manifeste, à commencer par l'acide butanoïque, qui possède deux isomères :

L'isomérie interclasse apparaît à partir de l'acide acétique :
CH3-COOH acide acétique;
H-COO-CH 3 formiate de méthyle (ester méthylique de l'acide formique) ;
HO-CH 2 -COH hydroxyéthanal (aldéhyde hydroxyacétique) ;
HO-CHO-CH 2 oxyde d'hydroxyéthylène.
Série homologue
Nom trivial |
Nom de l'UICPA |
|
Acide formique |
Acide méthane |
|
Acide acétique |
Acide éthanoique |
|
L'acide propionique |
Acide propanique |
|
Acide butyrique |
Acide butanoïque |
|
Acide valérique |
Acide pentanoïque |
|
Acide caproïque |
Acide hexanoïque |
|
Acide énanthique |
Acide heptanoïque |
|
Acide caprylique |
Acide octanoïque |
|
Acide pélargonique |
Acide nonanoïque |
|
Acide caprique |
Acide décanoïque |
|
Acide undécylique |
Acide undécanoïque |
|
L'acide palmitique |
Acide hexadécanoïque |
|
Acide stéarique |
Acide octadécanoïque |
Résidus acides et radicaux acides
Résidu acide |
Radical acide (acyle) |
|
CNUDCI |
NSOO- |
|
CH 3 COOH |
CH 3 COO- |
|
CH 3 CH 2 COOH |
CH 3 CH 2 COO- |
|
CH 3 (CH 2) 2 COOH |
CH 3 (CH 2) 2 COO- |
|
CH 3 (CH 2) 3 COOH |
CH 3 (CH 2) 3 COO- |
|
CH 3 (CH 2) 4 COOH |
CH 3 (CH 2) 4 COO- |
Structure électronique des molécules d'acide carboxylique

Le déplacement de la densité électronique vers l'atome d'oxygène carbonyle indiqué dans la formule provoque une forte polarisation de la liaison O-H, ce qui facilite l'abstraction d'un atome d'hydrogène sous la forme d'un proton - dans les solutions aqueuses, le processus d'acide la dissociation se produit :
RCOOH ↔ RCOO - + H +
Dans l'ion carboxylate (RCOO -), il y a une conjugaison p, π de la paire libre d'électrons de l'atome d'oxygène du groupe hydroxyle avec des nuages p formant une liaison π, ce qui entraîne une délocalisation de la liaison π et une liaison uniforme. répartition de la charge négative entre les deux atomes d'oxygène :

À cet égard, les acides carboxyliques, contrairement aux aldéhydes, ne sont pas caractérisés par des réactions d'addition.
Propriétés physiques

Les points d'ébullition des acides sont nettement supérieurs aux points d'ébullition des alcools et des aldéhydes avec le même nombre d'atomes de carbone, ce qui s'explique par la formation d'associations cycliques et linéaires entre les molécules d'acide dues aux liaisons hydrogène :
Propriétés chimiques
I. Propriétés acides
La force des acides diminue dans l’ordre suivant :
HCOOH → CH 3 COOH → C 2 H 6 COOH → ...
1. Réactions de neutralisation
CH 3 COOH + KOH → CH 3 COOC + n 2 O
2. Réactions avec oxydes basiques
2HCOOH + CaO → (HCOO) 2 Ca + H 2 O
3. Réactions avec les métaux
2CH 3 CH 2 COOH + 2Na → 2CH 3 CH 2 COONa + H 2
4. Réactions avec les sels d'acides plus faibles (y compris les carbonates et les bicarbonates)
2CH 3 COOH + Na 2 CO 3 → 2CH 3 COONa + CO 2 + H 2 O
2HCOOH + Mg(HCO 3) 2 → (HCOO) 2 Mg + 2СO 2 + 2H 2 O
(HCOOH + HCO 3 - → HCOO - + CO2 + H2O)
5. Réactions avec l'ammoniac
CH 3 COOH + NH 3 → CH 3 COONH 4
II. Substitution du groupe -OH
1. Interaction avec les alcools (réactions d'estérification)

2. Interaction avec NH 3 lors du chauffage (des amides acides se forment)

Amides acides  hydrolyser pour former des acides :
hydrolyser pour former des acides :

ou leurs sels :

3. Formation d'halogénures d'acide
Valeur la plus élevée contiennent des chlorures d'acide. Réactifs de chloration - PCl 3, PCl 5, chlorure de thionyle SOCl 2.

4. Formation d'anhydrides d'acide (déshydratation intermoléculaire)

Les anhydrides d'acide sont également formés par la réaction de chlorures d'acide avec des sels anhydres d'acides carboxyliques ; dans ce cas, il est possible d'obtenir des anhydrides mixtes de différents acides ; Par exemple:

III. Réactions de substitution des atomes d'hydrogène au niveau de l'atome de carbone α

Caractéristiques de la structure et propriétés de l'acide formique
Structure moléculaire

La molécule d'acide formique, contrairement aux autres acides carboxyliques, contient un groupe aldéhyde dans sa structure.
Propriétés chimiques
L'acide formique subit des réactions caractéristiques des acides et des aldéhydes. Présentant les propriétés d'un aldéhyde, il s'oxyde facilement en acide carbonique :
En particulier, HCOOH est oxydé par une solution ammoniacale d'Ag 2 O et d'hydroxyde de cuivre (II) Cu(OH) 2, c'est-à-dire qu'il donne réactions qualitatives par groupe aldéhyde :

Lorsqu'il est chauffé avec du H 2 SO 4 concentré, l'acide formique se décompose en monoxyde de carbone (II) et en eau :

L'acide formique est sensiblement plus fort que les autres acides aliphatiques car le groupe carboxyle qu'il contient est lié à un atome d'hydrogène plutôt qu'à un radical alkyle donneur d'électrons.
Méthodes d'obtention d'acides monocarboxyliques saturés
1. Oxydation des alcools et des aldéhydes
Schéma général d'oxydation des alcools et aldéhydes :
KMnO 4, K 2 Cr 2 O 7, HNO 3 et d'autres réactifs sont utilisés comme agents oxydants.
Par exemple:
5C 2 H 5 OH + 4KMnO 4 + 6H 2 S0 4 → 5CH 3 COOH + 2K 2 SO 4 + 4MnSO 4 + 11H 2 O
2. Hydrolyse des esters

3. Clivage oxydatif des doubles et triples liaisons dans les alcènes et alcynes

Méthodes d'obtention de HCOOH (spécifiques)
1. Réaction du monoxyde de carbone (II) avec l'hydroxyde de sodium
CO + NaOH → HCOONa formiate de sodium
2HCOONa + H 2 SO 4 → 2HCOON + Na 2 SO 4
2. Décarboxylation de l'acide oxalique

Méthodes de production de CH 3 COOH (spécifiques)
1. Oxydation catalytique du butane

2. Synthèse à partir de l'acétylène

3. Carbonylation catalytique du méthanol

4. Fermentation acide acétique de l'éthanol
C'est ainsi que l'on obtient l'acide acétique comestible.
Préparation d'acides carboxyliques supérieurs
Hydrolyse des graisses naturelles

Acides monocarboxyliques insaturés
Les représentants les plus importants
Formule générale des acides alcènes : C n H 2n-1 COOH (n ≥ 2)
CH 2 =CH-COOH acide propénoïque (acrylique)

Plus haut acides insaturés
Les radicaux de ces acides font partie des huiles végétales.
C 17 H 33 COOH - acide oléique, ou cis acide -octadiène-9-oïque

Transe-isomère l'acide oléique appelé acide élaïdique.
C 17 H 31 COOH - acide linoléique, ou cis, cis-acide octadiène-9,12-oïque

C 17 H 29 COOH - acide linolénique, ou cis, cis, cis Acide -octadécatriène-9,12,15-oïque
En plus des propriétés générales des acides carboxyliques, les acides insaturés sont caractérisés par des réactions d'addition au niveau de liaisons multiples dans le radical hydrocarboné. Ainsi, les acides insaturés, comme les alcènes, sont hydrogénés et décolorent l'eau bromée, par exemple :

Représentants sélectionnés des acides dicarboxyliques
Acides dicarboxyliques saturés HOOC-R-COOH
HOOC-CH 2 -COOH acide propanedioïque (malonique), (sels et esters - malonates)
HOOC-(CH 2) 2 -COOH acide butadioïque (succinique), (sels et esters - succinates)
HOOC-(CH 2) 3 -COOH acide pentadioique (glutarique), (sels et esters - glutorates)
HOOC-(CH 2) 4 -COOH acide hexadioïque (adipique), (sels et esters - adipates)
Caractéristiques des propriétés chimiques
Les acides dicarboxyliques sont à bien des égards similaires aux acides monocarboxyliques, mais ils sont plus forts. Par exemple, l’acide oxalique est près de 200 fois plus puissant que l’acide acétique.
Les acides dicarboxyliques se comportent comme des acides dibasiques et forment deux séries de sels - acides et neutres :
HOOC-COOH + NaOH → HOOC-COONa + H 2 O
HOOC-COOH + 2NaOH → NaOOC-COONa + 2H 2 O
Lorsqu'ils sont chauffés, les acides oxalique et malonique sont facilement décarboxylés :

Les principales méthodes sont les suivantes.
1. Oxydation des alcools primaires.
Étape 1 – formation d'aldéhydes.
CH 3 CH 2 OHCH 3 CHO
Étape 2 – obtention du produit cible.
CH3CHO  CH 3 COOH
CH 3 COOH
2. Hydrolyse des nitriles.
R. – C N + 2HOHR – COOH + NH3
3. Oxosynthèse à partir d'hydrocarbures insaturés.
CH3
CH =
CH 2 + CO + H 2 O  CH 3 CH 2 CH 2 COOH
CH 3 CH 2 CH 2 COOH
Dans le processus d'oxosynthèse, les molécules des produits résultants contiennent le plus souvent un atome de carbone de plus que les substances de départ.
Propriétés chimiques des acides carboxyliques
1. Réactions impliquant l’hydrogène du groupe carboxyle.
1.1. Certains acides se dissocient de manière significative avec l'élimination du cation H+.
N – UNS ⇄ NSOO + N +
Comme indiqué précédemment, les acides carboxyliques sont caractérisés par des constantes de dissociation relativement élevées. Pour l’acide formique on a :
 ,
,

HCOO - ion formiate ; CH 3 COO - ion acétate.
1.2. Interaction avec les métaux
2RCOOH + Mg (RCOO) 2 Mg + H 2
1.3. Interaction avec les alcalis.
RCOOH + NaOH RCOONa + H 2 O
1.4. Interaction avec les oxydes basiques.
2CH 3 COOH + MgO(CH 3 COO) 2 Mg+ H 2 O
1.5. Interaction avec des sels d'acides plus faibles (de force proche).
2CH 3 COOH + Na 2 CO 3 2CH 3 COONa + H 2 CO 3
2. Réactions impliquant un groupe carboxyle.
2 .1. Réactions avec les halogénures de phosphore.
.1. Réactions avec les halogénures de phosphore.
2.2. Réactions avec l'ammoniac. Lorsque l'acide et l'ammoniac sont mélangés, un sel d'ammonium se forme d'abord, qui est ensuite soumis à une distillation sèche :

Un cas particulier.

2 .3. Réactions avec les alcools
.3. Réactions avec les alcools
2.4. Dimérisation pour former des anhydrides d'acide.

H  cas difficile :
cas difficile :
3. Réactions impliquant l’atome d’hydrogène -carbone.
3.1. Halogénation.
La chloration, comme cas particulier d'halogénation.
![]()
4. Réactions d'oxydation.
HCOOH + [O] HO COOH H 2 O + CO 2

Propriétés des représentants individuels de la série homologue
L'acide formique HCOOH se trouve dans les aiguilles de pin, les orties et les sécrétions de fourmis. C'est un liquide incolore avec une odeur âcre et désagréable. Provoque des brûlures cutanées, se mélange de quelque manière que ce soit avec de l'eau, des éthers, des alcools. d= 1,21 g/cm3.
Acide acétique (éthanoïque, méthylcarboxylique) CH 3 COOH. À température normale, c'est un liquide incolore avec une odeur âcre. Miscible avec l'eau, l'éthanol, les éthers diéthyliques et diméthyliques, le benzène dans n'importe quelle proportion. Insoluble dans CS 2. Essence acétique – solution à 70-80 % de CH 3 COOH. Vinaigre alimentaire – solution à 5%. T pl = 17C, T ébullition = 118,1C, d = 1,05 g/cm 3. Il est utilisé en teinture, dans l'industrie du cuir, dans l'industrie agroalimentaire, pour la production d'esters (acétates).
Anhydride acétique. T pl =73,1С, T ébullition = 139,5С. Il a une odeur âcre et est soluble dans le benzène, l'éther diméthylique et le chloroforme. Moment dipolaire : 2,82D, H 2 O : 1,84D. Il est utilisé à grande échelle pour produire de l’acétate de cellulose et des produits pharmaceutiques.
Tâches sur le sujet
Tache 1. Calculer la fraction massique de sel dans une solution d'un acide carboxylique saturé monobasique avec sa masse initiale de 200 g et la fraction massique d'hydrogène dans l'acide de 8,1%, si le sel a été obtenu en absorbant 5,6 litres d'ammoniac dans une solution ( conditions normales).
Écrivons l'équation de réaction.
С k H 2k+1 COOH + NH 3 = С k H 2k+1 COONH 4 . (1)
Établissons la formule moléculaire de l'acide.
 ;
;  ;
;
200 000 + 200 = 113,4 000 + 372,6 ;  .
.
L’équation de réaction raffinée a la forme :
C 2 H 5 COOH + NH 3 = C 2 H 5 COONH 4,
d'où il résulte :
n(NH 3) = n(C 2 H 5 COONH 4);
m(C 2 H 5 COONH 4) = n(C 2 H 5 COONH 4) M(C 2 H 5 COONH 4) =
N(NH 3) M(C 2 H 5 COONH 4) =
m(NH 3) = n(NH 3) M(NH 3) =
 G.
G.
m 2 (solution) = m 1 (solution) + m (NH 3) ;
m 2 (solution) = 200 + 4,25 = 204,25 g.
Tâche 2. Lorsqu'un mélange d'acides carboxyliques monobasiques d'une masse totale de 50 g interagit avec un excès d'oxyde d'argent, 16,8 litres de gaz sont libérés (conditions normales). L'excès d'ammoniac a ensuite été passé à travers la solution résultante. Trouvez la masse du sel formé si la fraction massique réduite d'oxygène dans un mélange équimolaire d'acides est de 60,4 %.
Écrivons l'équation de réaction pour l'interaction des substances de départ avec l'oxyde d'argent, en tenant compte de celle des acides carboxyliques monobasiques saturés, seul l'acide formique réagit avec lui.
HCOOH + Ag 2 O = CO 2 + H 2 O + 2Ag (1)
Pour les autres
Avec k H 2 k +1 COOH + Ag 2 Ola réaction ne se produit pas. (2)
En utilisant l'équation de réaction (1), on trouve la masse d'acide formique :
n(HCOOH) =n(CO 2);m(HCOOH) =n(HCOOH)M(HCOOH) =
N(CO 2)M(НСООН) =  G.
G.
Trouvons la formule moléculaire d'un acide carboxylique inconnu.
;  ;
;
6400 = 845,6k+ 5556,8 ;  .
.
La formule moléculaire de l'acide est CH 3 COOH.
À la suite de l'interaction de HCOOH avec l'oxyde d'argent, seul l'acide acétique reste dans la solution qui, lorsqu'il interagit avec un excès d'ammoniac, forme un sel selon l'équation de réaction :
CH 3 COOH + NH 3 = CH 3 COONH 4. (3)
m(CH 3 COOH) = m(mélange) –m(HCOOH) = 50 – 34,5 = 15,5 g.
De l’équation de réaction (3) nous avons :
n(CH 3 COOH) = n(CH 3 COONH 4);
m(СH 3 COONH 4) = n(СH 3 COONH 4) M(СH 3 COONH 4) =
Envoyer votre bon travail dans la base de connaissances est simple. Utilisez le formulaire ci-dessous
Les étudiants, étudiants diplômés, jeunes scientifiques qui utilisent la base de connaissances dans leurs études et leur travail vous seront très reconnaissants.
Publié sur http://www.allbest.ru/
Contrôle Territoire de l'Altaï pour l'éducation et la jeunesse
KGOU SPO "Collège pédagogique de Kamenska"
Acides carboxyliques
(Résumé sur la chimie)
Complété:
élève du groupe 212 Chebakov D.S.
Vérifié:
professeur de chimie Merzlova S.A.
Pierre sur Obi
1. Détermination des acides carboxyliques
2.Isomérie et nomenclature
3.Être dans la nature
4.Reçu
5. Propriétés physiques
6. Propriétés chimiques
7.Application
Bibliographie
Définition du carbone acides
ACIDES CARBOXYLIQUES- les composés organiques contenant un ou plusieurs groupes carboxyles -COOH. Le nom vient du lat. carbo - charbon et grec. oxys - acide. Sur la base du nombre de ces groupes, on distingue les acides mono-, di-, tri- et tétracarboxyliques (un plus grand nombre de groupes -COOH dans une molécule est rare). Les acides carboxyliques peuvent être aliphatiques - avec des chaînes normales et ramifiées, cycliques et aromatiques, saturées et insaturées, contenant des atomes d'halogène et divers groupes fonctionnels : OH (hydroxyacides), NH2 (acides aminés), CO (acides céto), etc. De nombreux acides carboxyliques à l'état libre, ainsi que sous forme de divers dérivés (sels, esters), sont répandus dans la nature et jouent rôle vital dans la vie des plantes et des animaux.
Isomérie et nomenclature
L'isomérie des acides carboxyliques monobasiques saturés est similaire à l'isomérie des aldéhydes. Le plus souvent, des noms d'acides historiquement établis sont utilisés (formique, acétique, etc. Selon la nomenclature internationale, ils sont formés à partir des noms des hydrocarbures correspondants avec l'ajout de la terminaison -). nouveau et les mots « Acide », par exemple : acide méthanoïque, acide éthanoïque.
Les acides carboxyliques sont caractérisés par l'isomérie :
1.Squelette de carbone
CH3 - CH2 - CH2 - CH2 -COOH
CH2 - CH2 -COOH
produit chimique organique d'acide carboxylique
2. Radical
CH3 - CH2 - CH2 - CH2 -COOH 3 méthyléthane
CH3 - CH2 - CH2 - CH2 -COOH 4 méthylpentane
3. Connexions multiples
CH2 = CH - CH2 -COOH acide buténoïque 3
CH2 - CH = CH2 -COOH acide buténoïque 2
Être dans la nature
Les sources naturelles contiennent de nombreux acides insaturés sous forme d'esters. En règle générale, les acides insaturés supérieurs contiennent un nombre pair d'atomes de carbone et portent le nom de sources naturelles. Lorsqu’ils nomment des acides nouvellement isolés, les chimistes laissent souvent libre cours à leur imagination. Ainsi, le nom de l'homologue le plus proche de l'acide acrylique, crotonique CH3-CH=CH-COOH, ne vient pas du tout de la taupe, mais de la plante Croton tiglium, de l'huile de laquelle il a été isolé. Un isomère synthétique très important de l'acide crotonique est l'acide méthacrylique CH2=C(CH3)-COOH, à partir de l'ester duquel (méthacrylate de méthyle), ainsi que de l'acrylate de méthyle, est fabriqué un plastique transparent - le plexiglas. Lorsque deux acides isomères de structure CH3-CH=C(CH3)-COOH ont été découverts, ils ont été appelés angélique et tiglinique. L'acide angélique a été isolé de l'huile angélique, obtenue à partir de la racine d'angélique (angélique) de la plante Angelica officinalis. Et l'acide tiglique provient de la même huile de tiglium de Croton que l'acide crotonique, nommé uniquement d'après la deuxième partie de ce terme botanique. Une autre façon de trouver un nouveau nom consiste à réorganiser les lettres d’un nom déjà connu.
Acide arachidique trouvé dans l'huile d'arachide - les arachides. En termes d'échelle de production, elle occupe l'une des premières places parmi toutes les huiles comestibles, mais elle contient elle-même peu d'acide arachidique - seulement quelques pour cent. L'acide béhénique se trouve dans l'huile béhénique, extraite des grosses graines ressemblant à des noix d'une plante de la famille des Moringacées, commune en Indonésie. L'acide lignocérique presque pur (dans son nom il est facile de voir le latin lignum - bois, bois et céramique - cire) est extrait de la résine de hêtre. Auparavant, cet acide était également appelé acide carnaubique, car il est présent en grande quantité dans la cire de carnauba, qui recouvre les feuilles du palmier à cire brésilien.
Les acides gras contenus dans les huiles et les graisses sont extraits par l’homme en quantités énormes, mesurées chaque année en millions de tonnes. Les chimistes n’ont donc jamais manqué d’acides gras naturels à étudier.
Acide formique est devenu connu au XVIIe siècle, lorsqu'il a été découvert dans les sécrétions caustiques des fourmis rouges. La plupart des autres acides, qui ont leurs propres noms historiques, ont été obtenus principalement au 19ème siècle. et nommé d'après source naturelle, dans lequel ils sont contenus en quantités importantes ou ont été découverts pour la première fois. Par exemple, l'acide butyrique se trouve dans les huiles, y compris les huiles ordinaires. beurre- mais pas à l'état libre, mais sous forme d'ester avec la glycérine. L'acide butyrique libre, comme tous les acides carboxyliques, avec un petit nombre d'atomes de carbone, a une odeur âcre ; lorsque l'huile se gâte (rance), les acides butyrique et autres sont libérés à l'état libre et lui donnent mauvaise odeur et le goût.
Les noms des trois acides considérés utilisent des racines russes. Pour les dérivés de ces acides (sels, esters, etc.), il est d'usage d'utiliser des racines latines : formiate - pour l'acide formique (latin formica - fourmi), acétate - pour l'acide acétique (latin acetum - vinaigre), butyrate - pour butyrique acide (du grec butyron - huile); ces noms, y compris ceux des acides eux-mêmes, sont également acceptés dans les langues d'Europe occidentale.
D'autres acides carboxyliques se présentent dans la nature sous forme d'esters avec le glycérol et d'autres alcools polyhydriques - sous forme de graisses, d'huiles, de cires et rarement à l'état libre.
Acide valérique trouvé dans la racine de valériane. Les noms des trois acides pairs suivants (caproïque, caprylique et caprique) ont une racine commune (Capra en latin - chèvre), ces acides sont en réalité contenus dans les graisses lait de chèvre(comme d’ailleurs ceux d’une vache), mais à l’état libre, ils « sentent la chèvre ». La teneur de ces acides dans les matières grasses du lait n'est pas très élevée - de 7 à 14 % du total des acides gras.
L'acide pélargonique se trouve dans l'huile volatile du rosea pélargonium et d'autres plantes de la famille des géraniums. L'acide laurique (dans les livres anciens on l'appelait laurier) se trouve en grande quantité dans l'huile de laurier (jusqu'à 45 %). L'acide myristique prédomine dans l'huile des plantes de la famille myristique, par exemple dans les graines aromatiques du muscadier - la muscade.
L'acide palmitique facilement isolé de l'huile de palme extraite des noyaux noix de coco(copras). Cette huile est presque entièrement constituée de glycéride d’acide palmitique. Le nom acide stéarique vient du grec. stare - graisse, saindoux. Avec l'acide palmitique, il est l'un des acides gras les plus importants et constitue la majeure partie de la plupart des graisses végétales et animales. Les bougies étaient auparavant fabriquées à partir d’un mélange de ces acides (stéarine).
Reçu
En laboratoire, les acides carboxyliques, comme les acides inorganiques, peuvent être obtenus à partir de leurs sels en les traitant avec de l'acide sulfurique lorsqu'ils sont chauffés :
Dans l'industrie, les acides carboxyliques sont produits de différentes manières.
La méthode générale de production d'acides carboxyliques est l'oxydation des hydrocarbures avec l'oxygène de l'air. La réaction s'effectue comme en phase gazeuse à hypertension artérielle et température sans catalyseurs et en solutions. Dans ce cas, il se produit une fissuration des chaînes carbonées, de sorte que les acides ainsi obtenus contiennent toujours moins d'atomes de carbone que les hydrocarbures d'origine. Par exemple, l'acide acétique est obtenu par oxydation du N-butane dans une solution d'acide acétique :
Mn, Co, 6-8 MPa
2CH3 - CH2 - CH2 - CH3 + 5O2 4СH3COOH+2H2O
Propriétés physiques
Les acides carboxyliques inférieurs sont des liquides à l'odeur âcre, très solubles dans l'eau. À mesure que le poids moléculaire relatif augmente, la solubilité des acides dans l'eau diminue et le point d'ébullition augmente. Les acides supérieurs, à commencer par le pélargonique (n-nonanoïque) CH3-(CH2)7-COOH, sont solides, inodores et insolubles dans l'eau. Les acides carboxyliques inférieurs sous forme anhydre et sous forme de solutions concentrées irritent la peau et provoquent des brûlures, notamment l'acide formique et l'acide acétique.
Propriétés chimiques
Les propriétés générales des acides carboxyliques sont similaires aux propriétés correspondantes des acides inorganiques.
Les acides carboxyliques possèdent également des propriétés spécifiques dues à la présence de radicaux dans leurs molécules. Par exemple, l'acide acétique réagit avec le chlore :
acide monochloroacétique
Les propriétés chimiques de l'acide formique sont quelque peu différentes de celles des autres acides carboxyliques.
1. Parmi les acides carboxyliques monobasiques, l’acide formique est l’acide le plus fort.
2. En raison des caractéristiques structurelles de ses molécules, l'acide formique est similaire aux aldéhydes et s'oxyde facilement (la réaction du « miroir d'argent ») :
acide carbonique.
3. Lorsqu'il est chauffé avec de l'acide sulfurique concentré, l'acide formique libère de l'eau et du monoxyde de carbone (II) se forme :
Cette réaction est parfois utilisée pour produire du monoxyde de carbone (II) en laboratoire.
Comme déjà indiqué, le plus fort des acides carboxyliques monobasiques est l’acide formique.
Acide acétique beaucoup plus faible. Par conséquent, le radical méthyle CH3 - (et d'autres radicaux) affecte le groupe carboxyle. En conséquence, la liaison entre les atomes d’hydrogène et d’oxygène du groupe carboxyle devient moins polaire et l’élimination de l’ion hydrogène est plus difficile. Dans les radicaux acides carboxyliques, les atomes d'hydrogène peuvent être remplacés par des halogènes. Dans ce cas, la substitution se produit plus facilement dans l’unité hydrocarbure, qui est plus proche du groupe carboxyle. Par conséquent, le groupe carboxyle agit sur le radical hydrocarboné, c'est-à-dire que leur influence est mutuelle.
Application
L'acide formique est utilisé dans l'industrie comme agent réducteur puissant. Sa solution à 1,25 % dans l'alcool (alcool formique) est utilisée en médecine. L'acide acétique est de la plus haute importance ; il est nécessaire à la synthèse de colorants (par exemple l'indigo), de médicaments (par exemple l'aspirine), d'esters, d'anhydride acétique, d'acide monochloroacétique, etc. De grandes quantités sont consommées pour la production de fibres d'acétate, de films ininflammables et de verre organique qui transmet les rayons UV.
Ses sels, les acétates, sont largement utilisés. L'acétate de plomb (II) est utilisé pour fabriquer du blanc de plomb et des lotions de plomb en médecine, les acétates de fer (III) et d'aluminium sont utilisés comme mordants pour les tissus en ruine, et l'acétate de cuivre (II) est utilisé pour lutter contre les parasites des plantes. Une solution aqueuse à 3-9% d'acide acétique - vinaigre - est un arôme et un conservateur. Certains composés produits à partir de l'acide acétique, comme le sel de sodium de l'acide 2,4-dichlorophénoxyacétique, sont des herbicides, un moyen de lutter contre les mauvaises herbes. Les sels de sodium et de potassium des acides carboxyliques supérieurs sont les principaux composants du savon.
Les esters d'acide formique sont utilisés comme solvants et parfums
Bibliographie
G.E. Rudzitis, F.G. Feldman Chimie: Chimie organique: Manuel pour la 10e année. établissements d'enseignement général. - 5e éd. - M. : Éducation, 1998. - 160 p.
O.S.Gabrielyan Chimie. 10e année : Manuel pour les établissements d'enseignement général / O.S.Gabrielyan.-11e éd., révisé-M. : Outarde, 2006.- 267, p.
L.S. Guzey Chimie. 11e année : Manuel pour les établissements d'enseignement / R.P. Surovtseva, G.G. Lysova - 7e éd., stéréotype. M. : Outarde, 2006. - 223, p.
Publié sur Allbest.ru
Documents similaires
Les acides carboxyliques sont des composés organiques contenant un groupe carboxyle (carboxyle). Nomenclature et isomérie. Propriétés physiques. Propriétés chimiques. Acide acétique (méthanecarboxylique, éthanoïque) CH3-COOH. L'utilisation d'acides dans l'industrie.
résumé, ajouté le 16/12/2007
Acides carboxyliques monobasiques. Méthodes générales recevoir. Acides dibasiques, propriétés chimiques. Pyrolyse des acides oxalique et malonique. Acides dibasiques insaturés. Oxydation des hydroxyacides. Pyrolyse de l'acide tartrique. Esters. Obtenir des graisses.
manuel de formation, ajouté le 05/02/2009
Regroupement des composés avec un groupe fonctionnel carboxyle dans la classe des acides carboxyliques. Ensemble de propriétés chimiques, dont certaines sont similaires aux propriétés des alcools et des composés oxo. Séries homologues, nomenclature et préparation des acides carboxyliques.
test, ajouté le 05/08/2013
Les composés acyles sont des dérivés d'acides carboxyliques contenant un groupe acyle. Les propriétés des acides sont dues à la présence d'un groupe carboxyle, constitué de groupes hydroxyle et carbonyle. Méthodes de préparation et de réaction des anhydrides d'acide carboxylique.
résumé, ajouté le 03/02/2009
Les acides carboxyliques sont des acides plus forts que les alcools. Nature covalente des molécules et équilibre de dissociation. Formules d'acides carboxyliques. Réactions avec les métaux, leurs hydroxydes basiques et leurs alcools. une brève description de propriétés physiques des acides.
présentation, ajouté le 06/05/2011
Etude des propriétés physiques et chimiques des acides carboxyliques. Analyse des réactions de substitution nucléophile dans une série de dérivés. Caractéristique régime général mécanisme en présence d’un catalyseur. Revue de la série des acides cycliques, aromatiques et hétérocycliques.
résumé, ajouté le 19/12/2011
Familiarisation avec les faits historiques de la découverte et de la production de l'acide phosphorique. Prise en compte des propriétés physiques et chimiques fondamentales de l'acide phosphorique. Préparation de l'acide phosphorique d'extraction dans des conditions de laboratoire, sa signification et exemples d'application.
résumé, ajouté le 27/08/2014
Le concept du terme acides carboxyliques aromatiques. Acide sulfurique: indicateurs chimiques, règles d'utilisation. L'influence de la température sur la réaction de nitration et son composés de laboratoire. Procédés de production d'acides carboxyliques aromatiques monobasiques.
travail de cours, ajouté le 12/05/2008
De construction, formule chimique acide sulfurique. Matières premières et principales étapes de production d'acide sulfurique. Schémas de production d'acide sulfurique. Réactions pour la production d'acide sulfurique à partir du minéral pyrite sur un catalyseur. Préparation d'acide sulfurique à partir de sulfate de fer.
présentation, ajouté le 27/04/2015
Etude des propriétés mésogènes de polyesters cristallins liquides contenant un résidu acide camphre comme noyau central. Etude des propriétés chioptiques des copolyesters VIII en solution, influence du solvant. Préparation de polymères optiquement actifs.
Presque tout le monde a du vinaigre à la maison. Et la plupart des gens savent quelle est sa base. Mais qu’est-ce que c’est d’un point de vue chimique ? Quels autres types de cette série existent et quelles sont leurs caractéristiques ? Essayons de comprendre ce problème et étudions les acides carboxyliques monobasiques saturés. De plus, non seulement l'acide acétique est utilisé dans la vie quotidienne, mais aussi d'autres, et les dérivés de ces acides sont généralement des invités fréquents dans chaque foyer.
Classe des acides carboxyliques : caractéristiques générales
Du point de vue de la science chimique, cette classe de composés comprend des molécules contenant de l'oxygène qui possèdent un groupe spécial d'atomes - un groupe fonctionnel carboxyle. Il a la forme -COOH. Ainsi, formule générale, que possèdent tous les acides carboxyliques monobasiques saturés, ressemble à ceci : R-COOH, où R est une particule radicale qui peut inclure n'importe quel nombre d'atomes de carbone.
Selon cela, cette classe de composés peut être définie comme suit. Les acides carboxyliques sont des molécules organiques contenant de l'oxygène qui contiennent un ou plusieurs groupes fonctionnels -COOH - groupes carboxyle.
Le fait que ces substances appartiennent spécifiquement aux acides s'explique par la mobilité de l'atome d'hydrogène dans le carboxyle. La densité électronique n'est pas uniformément répartie, car l'oxygène est le plus électronégatif du groupe. De ceci Connexion O-H devient fortement polarisé et l’atome d’hydrogène devient extrêmement vulnérable. Il se divise facilement et entre dans des interactions chimiques. Par conséquent, les acides dans les indicateurs correspondants donnent une réaction similaire :

Grâce à l'atome d'hydrogène, les acides carboxyliques présentent des propriétés oxydantes. Cependant, la présence d’autres atomes leur permet de se régénérer et de participer à de nombreuses autres interactions.
Classification
Il existe plusieurs caractéristiques principales selon lesquelles les acides carboxyliques sont divisés en groupes. Le premier d’entre eux est la nature du radical. Sur la base de ce facteur, ils distinguent :
- Acides alicycliques. Exemple : quinquina.
- Aromatique. Exemple : le benjoin.
- Aliphatique. Exemple : vinaigre, acrylique, oxalique et autres.
- Hétérocyclique. Exemple : la nicotine.
Si nous parlons des liaisons dans la molécule, alors nous pouvons également distinguer deux groupes d'acides :

Le nombre de groupes fonctionnels peut également servir de signe de classification. Ainsi, on distingue les catégories suivantes.
- Monobase - un seul groupe -COOH. Exemple : formique, stéarique, butane, valériane et autres.
- Dibasique- respectivement, deux groupes -COOH. Exemple : acide oxalique, acide malonique et autres.
- Polybasique- citron, lait et autres.
Histoire de la découverte
La viticulture est florissante depuis l’Antiquité. Et comme vous le savez, l’un de ses produits est l’acide acétique. Par conséquent, l’histoire de la popularité de cette classe de composés remonte à l’époque de Robert Boyle et Johann Glauber. Cependant, pendant longtemps, il n’a pas été possible de déterminer la nature chimique de ces molécules.
Après tout, pendant longtemps, les vues des vitalistes ont dominé, qui niaient la possibilité de formation de matière organique sans êtres vivants. Mais déjà en 1670, D. Ray réussit à obtenir le tout premier représentant : le méthane ou l'acide formique. Il l'a fait en chauffant des fourmis vivantes dans une fiole.
Plus tard, les travaux des scientifiques Berzelius et Kolbe ont montré la possibilité de synthétiser ces composés à partir de substances non matière organique(par distillation charbon). Le résultat était du vinaigre. De cette manière, les acides carboxyliques ont été étudiés (propriétés physiques, structure) et le début a été posé pour la découverte de tous les autres représentants d'un certain nombre de composés aliphatiques.
Propriétés physiques
Aujourd'hui, tous leurs représentants ont été étudiés en détail. Pour chacun d’eux, vous pouvez trouver des caractéristiques à tous égards, y compris leur utilisation dans l’industrie et leur présence dans la nature. Nous examinerons ce que sont les acides carboxyliques, leurs paramètres et d'autres.
Ainsi, nous pouvons mettre en évidence plusieurs paramètres caractéristiques principaux.
- Si le nombre d'atomes de carbone dans la chaîne ne dépasse pas cinq, il s'agit alors de liquides odorants, mobiles et volatils. Au-dessus de cinq - substances huileuses lourdes, encore plus - substances solides ressemblant à de la paraffine.
- La densité des deux premiers représentants dépasse l'unité. Tous les autres sont plus légers que l’eau.
- Point d’ébullition : plus la chaîne est grande, plus la valeur est élevée. Plus la structure est ramifiée, plus elle est basse.
- Point de fusion : dépend de la parité du nombre d'atomes de carbone dans la chaîne. Pour les nombres pairs, il est plus élevé, pour les nombres impairs, il est inférieur.
- Ils se dissolvent très bien dans l'eau.
- Capable de former de fortes liaisons hydrogène.

De telles caractéristiques s'expliquent par la symétrie de la structure, et donc par la structure réseau cristallin, sa force. Plus les molécules sont simples et structurées, plus les acides carboxyliques sont performants. Les propriétés physiques de ces composés permettent de déterminer les domaines et les modalités de leur utilisation dans l'industrie.
Propriétés chimiques
Comme nous l'avons déjà indiqué plus haut, ces acides peuvent présenter des propriétés différentes. Les réactions les impliquant sont importantes pour la synthèse industrielle de nombreux composés. Désignons les propriétés chimiques les plus importantes que peut présenter un acide carboxylique monobasique.
- Dissociation : R-COOH = RCOO - + H + .
- Il présente, c'est-à-dire interagit avec les oxydes basiques, ainsi qu'avec leurs hydroxydes. AVEC métaux simples interagit selon le schéma standard (c'est-à-dire uniquement avec ceux qui précèdent l'hydrogène dans la série de tensions).
- Avec des acides plus forts (inorganiques), il se comporte comme une base.
- Capable d'être réduit en alcool primaire.
- Une réaction particulière est l'estérification. Il s'agit de l'interaction avec les alcools pour former un produit complexe : un ester.
- La réaction de décarboxylation, c’est-à-dire l’élimination d’une molécule de dioxyde de carbone d’un composé.
- Capable d'interagir avec les halogénures d'éléments tels que le phosphore et le soufre.

Il est évident à quel point les acides carboxyliques sont polyvalents. Les propriétés physiques, tout comme les propriétés chimiques, sont très diverses. De plus, il faut dire qu'en général, en termes de force en tant qu'acides, toutes les molécules organiques sont assez faibles par rapport à leurs homologues inorganiques. Leurs constantes de dissociation ne dépassent pas 4,8.
Modalités d'obtention
Il existe plusieurs manières principales d'obtenir des acides carboxyliques saturés.
1. En laboratoire, cela se fait par oxydation :
- alcools;
- les aldéhydes;
- les alcynes;
- les alkylbenzènes;
- destruction des alcènes.
2. Hydrolyse :
- les esters;
- les nitriles;
- les amides;
- trihaloalcanes.
4. Dans l'industrie, la synthèse s'effectue par oxydation d'hydrocarbures comportant un grand nombre d'atomes de carbone dans la chaîne. Le processus se déroule en plusieurs étapes avec la libération de nombreux sous-produits.
5. Certains acides individuels (formique, acétique, butyrique, valérique et autres) sont obtenus par des méthodes spécifiques utilisant des ingrédients naturels.
Composés basiques d'acides carboxyliques saturés : sels
Les sels d'acides carboxyliques sont des composés importants utilisés dans l'industrie. Ils sont obtenus grâce à l'interaction de ces derniers avec :
- les métaux;
- les oxydes basiques ;
- les alcalis;
- hydroxydes amphotères.

Parmi eux, ceux qui se forment entre métaux alcalins sodium et potassium et acides saturés supérieurs - palmitique, stéarique. Après tout, les produits d’une telle interaction sont des savons, liquides et solides.
Savon
Donc, si nous parlons d'une réaction similaire : 2C 17 H 35 -COOH + 2Na = 2C 17 H 35 COONa + H 2,
alors le produit résultant - le stéarate de sodium - est par nature normal savon à lessive utilisé pour laver les vêtements.
Si vous remplacez l'acide par de l'acide palmitique et le métal par du potassium, vous obtenez du palmitate de potassium - savon liquide pour se laver les mains. Par conséquent, nous pouvons affirmer avec certitude que les sels d’acides carboxyliques sont en réalité des composés organiques importants. Leur production industrielle et l'utilisation est tout simplement colossale par son ampleur. Si vous imaginez combien de savon chaque personne sur Terre dépense, il n’est pas difficile d’imaginer une telle échelle.
Esters d'acides carboxyliques
Un groupe spécial de composés qui a sa place dans la classification des substances organiques. C'est une classe. Ils sont formés par la réaction d'acides carboxyliques avec des alcools. Le nom de ces interactions est réactions d’estérification. Forme générale peut être représenté par l'équation :
R, -COOH + R"-OH = R, -COOR" + H 2 O.
Le produit à deux radicaux est un ester. De toute évidence, à la suite de la réaction, l'acide carboxylique, l'alcool, l'ester et l'eau ont subi des modifications significatives. Ainsi, l'hydrogène quitte la molécule d'acide sous forme de cation et rencontre le groupe hydroxo qui a été séparé de l'alcool. En conséquence, une molécule d’eau se forme. Le groupe restant de l'acide attache le radical de l'alcool à lui-même, formant une molécule d'ester.

Pourquoi ces réactions sont-elles si importantes et quelle est la signification industrielle de leurs produits ? Le fait est que les esters sont utilisés comme :
- compléments alimentaires;
- additifs aromatiques;
- composant de parfum;
- solvants;
- composants de vernis, peintures, matières plastiques;
- médicaments et ainsi de suite.
Force est de constater que leurs domaines d’utilisation sont suffisamment vastes pour justifier des volumes de production industrielle.
Acide éthanoïque (acétique)
Il s'agit d'un acide carboxylique monobasique limitant de la série aliphatique, qui est l'un des plus répandus en termes de volumes de production dans le monde. Sa formule est CH 3 COOH. Il doit sa popularité à ses propriétés. Après tout, les domaines d'utilisation sont extrêmement larges.
- C'est un additif alimentaire sous le code E-260.
- Utilisé dans l'industrie alimentaire pour la conservation.
- Utilisé en médecine pour la synthèse de médicaments.
- Composant dans la production de composés parfumés.
- Solvant.
- Participant au processus d'impression de livres et de teinture de tissus.
- Un composant nécessaire dans les réactions de synthèse chimique de nombreuses substances.
Dans la vie de tous les jours, sa solution à 80 % est généralement appelée essence de vinaigre, et si vous le diluez à 15 %, vous obtenez juste du vinaigre. L'acide pur à 100 % est appelé acide acétique glacial.
Acide formique
Le tout premier et le plus simple représentant de cette classe. Formule - CSNU. C'est également un additif alimentaire sous le code E-236. Ses sources naturelles :
- les fourmis et les abeilles ;
- ortie;
- aiguilles;
- des fruits.
Principaux domaines d'utilisation :
En chirurgie également, des solutions de cet acide sont utilisées comme antiseptiques.
