Quelle matière organique. Classes de composés organiques
Lire aussi
matière organique, composés organiques - une classe de composés comprenant du carbone (à l'exception des carbures, de l'acide carbonique, des carbonates, des oxydes de carbone et des cyanures). Les composés organiques sont généralement construits à partir de chaînes d'atomes de carbone liés entre eux par des liaisons covalentes et de divers substituants attachés à ces atomes de carbone.
La chimie organique est la science qui étudie la composition, la structure, la physique et Propriétés chimiques substances organiques.
Les substances organiques sont appelées substances dont les molécules sont constituées de carbone, d'hydrogène, d'oxygène, d'azote, de soufre et de certains autres éléments et contiennent dans leur composé de CC et Connexion S-N. De plus, la présence de ce dernier est obligatoire.
Les substances organiques sont connues de l'humanité depuis l'Antiquité. Comment science indépendante, la chimie organique n'est apparue qu'en début XIX siècle. En 1827 Le scientifique suédois J.J. Berzelius a publié le premier manuel sur les substances organiques. Il était un adepte de la théorie alors à la mode du vitalisme, qui affirmait que les substances organiques ne se forment que dans les organismes vivants sous l'influence d'un " force de vie".
Cependant, tous les scientifiques chimistes n'adhéraient pas aux vues vitalistes. Donc en 1782. K.V. Scheele, chauffant un mélange d'ammoniaque, gaz carbonique et le charbon, ont reçu de l'acide cyanhydrique, très répandu dans le monde végétal. En 1824-28. F. Wehler a obtenu l'acide oxalique et l'urée par synthèse chimique.
Les synthèses de diverses substances organiques réalisées au début des années 60 ont eu une importance particulière pour la démystification finale de la théorie du vitalisme. En 1842 N.I. Zinin a reçu de l'aniline, en 1845. A. Kolbe - acide acétique, en 1854. M. Berthelot a mis au point une méthode d'obtention de graisse synthétique, et en 1861. A.M. Butlerov a synthétisé une substance sucrée.
Avec l'effondrement de la théorie du vitalisme, la ligne séparant les substances organiques des substances inorganiques a été effacée. Et pourtant, les substances organiques sont caractérisées par une série caractéristiques spécifiques. Tout d'abord, leur nombre doit leur être attribué. Actuellement, plus de 10 millions de substances sont connues de l'humanité, dont environ 70% sont organiques.
Les principales raisons de l'abondance des substances organiques sont les phénomènes d'homologie et d'isomérie.
L'homologie est le phénomène de l'existence d'un certain nombre de substances qui ont le même composition qualitative, une structure similaire, mais différant en composition quantitative par un ou plusieurs groupes CH2, appelée différence homologique.
L'isomérie est un phénomène de l'existence d'un certain nombre de substances qui ont la même composition qualitative et quantitative, mais une structure de molécules différente, présentant des propriétés physiques et une activité chimique différentes.
Les molécules de substances organiques sont principalement constituées d'atomes non métalliques liés par des liaisons covalentes faiblement polaires. Par conséquent, selon le nombre d'atomes de carbone dans la molécule, ce sont des solides gazeux, liquides ou à bas point de fusion. De plus, les molécules organiques contiennent généralement des atomes de carbone et d'hydrogène sous une forme non oxydée ou légèrement oxydée, de sorte qu'elles sont facilement oxydées avec libération. un grand nombre chaleur, ce qui conduit à l'inflammation.
Didacticiel vidéo:
Conférence: Classification des substances organiques. Nomenclature des substances organiques (triviale et internationale)
Classification des substances organiques
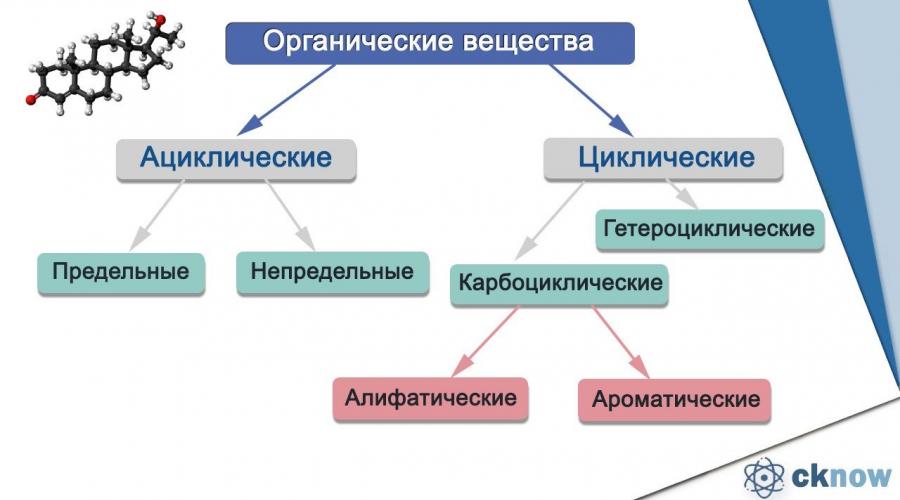
La classification des substances organiques est basée sur la théorie de A.M. Butlerov. Le tableau montre la classification des substances organiques en fonction du type de structure de la chaîne carbonée, c'est-à-dire selon le type de squelette carboné :

Composés acycliques- Ce sont des substances organiques dans les molécules desquelles les atomes de carbone sont reliés les uns aux autres en lignes droites, ainsi que des chaînes ouvertes ramifiées.
Acyclique, par exemple, comprend l'éthane :

ou acétylène :

Sinon, ces composés sont appelés composés aliphatiques ou gras, car les premiers composés de cette série de substances organiques ont été obtenus à partir de graisses végétales ou animales. Parmi les composés acycliques se distinguent:
Limite (ou saturée) - ces composés contiennent des liaisons C-C carbone-carbone covalentes simples non polaires et des liaisons C-H faiblement polaires dans le squelette carboné, ceci alcanes.
Général formule moléculaire alcanes - C n H 2n+2, où n est le nombre d'atomes de carbone dans une molécule d'hydrocarbure. Ceux-ci incluent des chaînes ouvertes, ainsi que des hydrocarbures fermés (cycliques). Tous les atomes de carbone des alcanes ont sp 3 - hybridation. Rappelez-vous les alcanes suivants :
Méthane - CH 4
Éthane - C 2 H 6 : CH 3 -CH 3
Propane - C 3 H 8 : CH 3 -CH 2 -CH 3
Butane - C 4 H 10 : CH 3 -(CH 2) 2 -CH 3
Pentane - C 5 H 12 : CH 3 -(CH 2) 3 -CH 3
Hexane - C 6 H 14 : CH 3 -(CH 2) 4 -CH 3
Heptane - C 7 H 16 : CH 3 -(CH 2) 5 -CH 3
Octane - C 8 H 18 : CH 3 - (CH 2 ) 6 -CH 3
Nonane - C 9 H 20 : CH 3 -(CH 2) 7 -CH 3
Doyen - C 10 H 22 : CH 3 -(CH 2) 8 -CH 3
Insaturé (ou insaturé) - contiennent des liaisons multiples - doubles (C \u003d C) ou triples (C ≡ C), ce sont des alcènes, des alcynes et des alcadiènes:
1) MAISlkens- contiennent une liaison carbone-carbone, qui est un double C=C. Formule générale - C n H 2n .Les atomes de carbone de ces composés ont sp 2 - hybridation. La liaison C=C a une liaison π et une liaison σ, donc les alcènes sont plus réactifs que les alcanes. Rappelez-vous les alcènes suivants :
Éthène (éthylène) - C 2 H 4: CH 2 \u003d CH 2
Propène (propylène) - C 3 H 6: CH 2 \u003d CH-CH 3
Butène - C 4 H 8: butène-1 CH 3 -CH 2 -CH \u003d CH, butène-2 CH 3 -CH \u003d CH-CH 3, isobutène [CH 3] 2 C \u003d CH 2
Penten - C 5 H 10 : 1-pentène CH 3 -CH 2 -CH 2 -CH \u003d CH 2, 2-pentène C 2 H 5 CH \u003d CHCH 3
Hexène - C 6 H 12 : 1-hexène CH 2 \u003d CH-CH 2 -CH 2 -CH 2 -CH 3, cis - hexène-2 CH 3 -CH=CH-CH 2 -CH 2 -CH 3 et autres isomères.
Heptène - C 7 H 14 : 1-heptène CH 2 \u003d CH-CH 2 -CH-CH 2 -CH 2 -CH 3, 2-heptène CH 3 -CH \u003d CH-CH 2 -CH 2 -CH 2 - CH3 et etc...
Octène - C 8 H 16 : 1-octène CH 2 \u003d CH-CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 3, 2-octène CH 3 -CH \u003d CH-CH 2 -CH 2 -CH 2 -CH 2 -CH 3, etc.
Nonène - C 9 H 18 : 3-nonène CH 3 -CH 2 -CH \u003d CH-CH 2 -CH 2 -CH 2 -CH 2 -CH 3, 5-nonène CH 3 -CH 2 -CH 2 -CH 2 - CH=CH-CH 2 -CH 2 -CH 3 etc.
Décène - C 10 H 20 : 2-décène CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH \u003d CH-CH 3, etc.
Comme vous l'avez remarqué, les noms des alcènes sont similaires aux noms des alcanes, avec une différence dans le suffixe. Les alcanes ont le suffixe -an et les alcènes ont le suffixe -en. De plus, le méthène est absent parmi les alcènes répertoriés. N'oubliez pas que le méthane n'existe pas car le méthane n'a qu'un seul carbone. Et pour la formation d'alcènes, la formation de doubles liaisons est nécessaire.
L'emplacement de la double liaison est indiqué par un nombre, par exemple, 1-butène : CH 2 \u003d CH-CH 2 -CH 3 ou 1-hexène : CH 3 -CH 2 -CH 2 -CH 2 -CH \u003d CH 2. Faites attention à cette règle : la numérotation des chaînes hydrocarbonées doit être faite de manière à ce que les doubles liaisons soient sous le numéro le plus bas, par exemple, 2-hexène :
2) Unparents– il y a une triple liaison С≡С dans les molécules. Formule générale - C n H 2n-2 .À noms d'alcynes suffixe -an remplacé par -in. Par exemple, 3-heptine : CH 3 -CH 2 -CH 2 -C≡C -CH 2 -CH 3. Pour l'éthyne HC≡CH, le nom trivial d'acétylène est également possible. La position de la triple liaison est indiquée de la même manière que dans le cas précédent avec les alcènes. S'il y a plus d'une triple liaison dans le composé, le suffixe -diyne ou -triyne est ajouté au nom. Si le composé contient à la fois des doubles et des triples liaisons, leur numérotation est déterminée par la double liaison, par conséquent, la double liaison est appelée en premier, puis la triple liaison. Par exemple, hexadiène-1,3-en-5 : CH 2 \u003d CH-CH 2 \u003d CH 2 -C≡CH.
3) MAISjeCadiens – il y a deux doubles liaisons С=С dans les molécules. Formule générale - C n H 2n-2,comme pour les alcynes. Les alcynes et les alcadiènes sont des isomères interclasses.Par exemple, 1,3-butadiène ou divinyl C 4 H 6 : CH 2 =CH-CH=CH 2 .
Composés cycliques- c'est matière organique, dont les molécules contiennent trois atomes ou plus reliés en un cycle fermé, formant des cycles.

Les hydrocarbures cycliques limitants sont appelés cycloalcanes. Eux à propos formule générale - C n H 2n. Les molécules ont une chaîne fermée ou des anneaux. Par exemple, le cyclopropane (C 3 H 6) :

et cyclobutane (C 4 H 8) :

Selon les atomes où les cycles ont été formés, ce type de composés est divisé en carbocyclique et hétérocyclique.
Carbocyclique , qui sont autrement appelés homocycliques, ne contiennent que des atomes de carbone dans les cycles. À leur tour, ils sont divisés en aliphatiques et aromatiques.
Composés alicycliques (aliphatiques) diffèrent en ce que les atomes de carbone peuvent être reliés les uns aux autres en chaînes droites, ramifiées ou en anneaux par des liaisons simples, doubles ou triples.
Un composé aliphatique typique est le cyclohexène :

composés aromatiques tire son nom de l'odeur aromatique de la substance. Autrement connu sous le nom d'arènes. Ils diffèrent par la présence d'un cycle benzénique dans le composé :
Il peut y avoir plusieurs anneaux de ce type dans la composition. Par exemple, le naphtalène :

De plus, ce groupe de composés a un système aromatique, qui caractérise la stabilité et la stabilité élevées du composé. Le système aromatique contient 4n+2 électrons dans l'anneau (où n = 0, 1, 2, …). Il est courant que ce groupe de substances organiques entre dans des réactions de substitution plutôt que dans des additions.
Les composés aromatiques peuvent avoir un groupe fonctionnel attaché directement au cycle. Par exemple, le toluène :
Composés hétérocycliques contiennent toujours un ou plusieurs hétéroatomes du cycle des hydrocarbures, qui sont des atomes d'oxygène, d'azote ou de soufre. S'il y a cinq hétéroatomes, les composés sont appelés à cinq chaînons, s'ils sont à six, respectivement, à six chaînons. Un exemple de composé hétérocyclique est la pyridine :

Classification des dérivés d'hydrocarbures
Les autres substances organiques sont considérées exclusivement comme des dérivés d'hydrocarbures, qui se forment lors de l'introduction de groupes fonctionnels dans des molécules d'hydrocarbures, y compris d'autres éléments chimiques. La formule des composés ayant un groupe fonctionnel peut être écrite comme R-X. Où R est un radical hydrocarboné (un fragment d'une molécule d'hydrocarbure sans un ou plusieurs atomes d'hydrogène ; X est un groupe fonctionnel. Par la présence de groupes fonctionnels, les hydrocarbures sont divisés en :
Dérivés halogènes - à en juger par le nom, il est clair que dans ces composés, les atomes d'hydrogène sont remplacés par des atomes d'halogène.
Alcools et phénols. Dans les alcools, les atomes d'hydrogène sont remplacés par le groupe hydroxyle -OH. Selon le nombre de ces groupes, les alcools sont divisés en monohydriques et polyhydriques, parmi lesquels sont dihydriques, trihydriques, etc.
Formule des monoalcools : C n H 2n +1OH ou C n H 2n +2O.
Formule des alcools polyhydriques : C n H 2n +2O x; x est l'atomicité de l'alcool.
Les alcools peuvent aussi être aromatiques. Formule des monoalcools aromatiques : C n H 2n -6O.
Il convient de rappeler que les dérivés d'hydrocarbures aromatiques dans lesquels un / plusieurs atomes d'hydrogène sont remplacés par des groupes hydroxyle n'appartiennent pas aux alcools. Ce type appartient à la classe des phénols. La raison pour laquelle les phénols ne sont pas classés comme alcools réside dans leurs propriétés chimiques spécifiques. Les phénols monohydriques sont isomères des alcools aromatiques monohydriques. Autrement dit, ils ont également une formule moléculaire commune C n H 2n -6O.
Amines- les dérivés de l'ammoniac, dans lesquels un, deux ou trois atomes d'hydrogène sont remplacés par un radical hydrocarboné. Amines dans lesquelles un seul atome d'hydrogène est remplacé par un radical hydrocarboné, c'est-à-dire répondant à la formule générale R-NH 2 sont appelées amines primaires. Les amines dans lesquelles deux atomes d'hydrogène sont remplacés par des radicaux hydrocarbonés sont dites secondaires. Leur formule est R-NH-R'. Il convient de rappeler que les radicaux R et R' peuvent être identiques ou différents. Si les trois atomes d'hydrogène de la molécule d'ammoniac sont remplacés par un radical hydrocarboné, alors les amines sont tertiaires. Dans ce cas, R, R', R'' peuvent être complètement identiques ou différents. La formule générale des amines limitantes primaires, secondaires et tertiaires est C n H 2n +3N. Les amines aromatiques avec un substituant insaturé ont la formule CnH2n-5N.
Aldéhydes et cétones. Dans les aldéhydes, au niveau de l'atome de carbone primaire, deux atomes d'hydrogène sont remplacés par un atome d'oxygène. C'est-à-dire que dans leur structure, il y a un groupe aldéhyde - CH=O. Formule générale - R-CH=O. Dans les cétones, au niveau de l'atome de carbone secondaire, deux atomes d'hydrogène sont remplacés par un atome d'oxygène. C'est-à-dire qu'il s'agit de composés dans la structure desquels se trouve un groupe carbonyle -C (O) -. Formule générale des cétones : R-C(O)-R'. Dans ce cas, les radicaux R, R' peuvent être identiques ou différents. Les aldéhydes et les cétones ont une structure assez similaire, mais ils sont toujours distingués en tant que classes, car ils présentent des différences significatives dans les propriétés chimiques. La formule générale pour limiter les cétones et les aldéhydes est : C n H 2n O.
acides carboxyliques contiennent un groupe carboxyle -COOH. Lorsqu'un acide contient deux groupes carboxyle, l'acide est appelé acide dicarboxylique. Les acides monocarboxyliques limites (avec un groupe -COOH) ont la formule générale - C n H 2n O 2 . Les acides monocarboxyliques aromatiques ont la formule générale C n H 2n -8O 2 .
Éthers- les composés organiques dans lesquels deux radicaux hydrocarbonés sont indirectement reliés par un atome d'oxygène. C'est-à-dire qu'ils ont une formule de la forme : R-O-R'. Dans ce cas, les radicaux R et R' peuvent être identiques ou différents. Formule d'éther limite - C n H 2n +1OH ou C n H 2n + 2O.
Esters– une classe de composés à base de composés organiques acides carboxyliques, dans laquelle l'atome d'hydrogène du groupe hydroxyle est remplacé par le radical hydrocarboné R.
Composés nitrés - les dérivés d'hydrocarbures, dans lesquels un ou plusieurs atomes d'hydrogène sont remplacés par un groupe nitro -NO 2. Les composés nitro limitants avec un groupe nitro ont la formule C n H 2n +1NO 2 .
Acides aminés ont deux groupes fonctionnels dans la structure en même temps - amino NH 2 et carboxyle - COOH. Par exemple : NH 2 -CH 2 -COOH. Les acides aminés limitants ayant un groupe carboxyle et un groupe amino sont isomères des composés nitrés limitants correspondants, c'est-à-dire qu'ils ont la formule générale C n H 2n +1NO 2 .
Nomenclature des composés organiques
La nomenclature de la connexion est divisée en 2 types :
trivial et
systématique.
Trivial est historiquement la première nomenclature apparue au tout début du développement chimie organique. Les noms des substances étaient de nature associative, par exemple, acide oxalique, urée, indigo.
Création d'une systématique, c'est-à-dire la nomenclature internationale a commencé en 1892. Puis la nomenclature de Genève a été lancée, qui de 1947 à nos jours a été poursuivie par l'IUPAC (IUPAC - International Uniform Chemical Nomenclature). Selon la nomenclature systématique, les noms des composés organiques sont formés à partir de la racine indiquant la longueur de la chaîne principale, c'est-à-dire des atomes de carbone reliés en une chaîne non ramifiée, ainsi que des préfixes et des suffixes indiquant la présence et l'emplacement de substituants, de groupes fonctionnels et de liaisons multiples.
Nomenclature systématique des alcanesNomenclature systématique des alcènes
Actuellement, plus de 10 millions de composés organiques sont connus. Un si grand nombre de composés nécessite une classification stricte et des règles de nomenclature internationales uniformes. Cette question fait l'objet d'une attention particulière dans le cadre de l'utilisation de la technologie informatique pour créer diverses bases de données.
1.1. Classification
La structure des composés organiques est décrite à l'aide de formules structurelles.
Une formule structurelle est une image de la séquence d'atomes de liaison dans une molécule à l'aide de symboles chimiques.
Le concept de séquence d'atomes de liaison dans une molécule est directement lié au phénomène isomérie, c'est-à-dire l'existence de composés de même composition mais de structure chimique différente, appelés de construction isomères (isomères bâtiments). La caractéristique la plus importante de la majorité composés inorganiques sert composé, exprimée par la formule moléculaire, par exemple acide chlorhydrique HC1, acide sulfurique H 2 SO 4. Pour les composés organiques, la composition et, par conséquent, la formule moléculaire ne sont pas des caractéristiques univoques, car de nombreux composés réellement existants peuvent correspondre à la même composition. Par exemple, les isomères structuraux butane et isobutane, ayant la même formule moléculaire C 4H10, diffèrent dans la séquence des atomes de liaison et ont des caractéristiques physico-chimiques différentes.

Le premier critère de classification est la division des composés organiques en groupes, en tenant compte de la structure du squelette carboné (Schéma 1.1).
Schéma 1.1.Classification des composés organiques selon la structure du squelette carboné

Les composés acycliques sont des composés à chaîne ouverte d'atomes de carbone.
Aliphatique (du grec.un leiphar- gras) hydrocarbures - les représentants les plus simples des composés acycliques - ne contiennent que des atomes de carbone et d'hydrogène et peuvent être riche(alcanes) et insaturé(alcènes, alcadiènes, alcynes). Leurs formules structurelles sont souvent écrites sous une forme abrégée (compressée), comme le montre l'exemple n-pentane et 2,3-diméthylbutane. Dans ce cas, la désignation des liaisons simples est omise, et les groupes identiques sont mis entre parenthèses et le nombre de ces groupes est indiqué.
La chaîne carbonée peut être non ramifié(par exemple, dans le n-pentane) et ramifié(par exemple, dans le 2,3-diméthylbutane et l'isoprène).

Les composés cycliques sont des composés à chaîne fermée d'atomes.
Selon la nature des atomes qui composent le cycle, on distingue les composés carbocycliques et hétérocycliques.
Composés carbocycliques ne contiennent que des atomes de carbone dans le cycle et sont divisés en aromatique et alicyclique(cyclique non aromatique). Le nombre d'atomes de carbone dans les cycles peut être différent. De grands cycles (macrocycles) sont connus, constitués de 30 atomes de carbone ou plus.
Pour l'image des structures cycliques sont pratiques formules squelettiques, dans lequel les symboles des atomes de carbone et d'hydrogène sont omis, mais les symboles des éléments restants (N, O, S, etc.) sont indiqués. Tel

formules, chaque coin du polygone signifie un atome de carbone avec le nombre requis d'atomes d'hydrogène (en tenant compte de la tétravalence de l'atome de carbone).
L'ancêtre des hydrocarbures aromatiques (arènes) est le benzène. Le naphtalène, l'anthracène et le phénanthrène sont des arènes polycycliques. Ils contiennent des cycles benzéniques fusionnés.

Composés hétérocycliques contenir dans le cycle, en plus des atomes de carbone, un ou plusieurs atomes d'autres éléments - hétéroatomes (du grec. hétéros- autre, différent) : azote, oxygène, soufre, etc.

Une grande variété de composés organiques peuvent être considérés dans leur ensemble comme des hydrocarbures ou leurs dérivés obtenus en introduisant des groupes fonctionnels dans la structure des hydrocarbures.
Un groupe fonctionnel est un hétéroatome ou un groupe d'atomes non hydrocarbonés qui détermine si un composé appartient à une certaine classe et est responsable de ses propriétés chimiques.
Le deuxième critère de classement, plus important, est la division des composés organiques en classes selon la nature des groupements fonctionnels. Les formules générales et les noms des classes les plus importantes sont donnés dans le tableau. 1.1.
Les composés avec un groupe fonctionnel sont appelés monofonctionnels (par exemple, l'éthanol), avec plusieurs groupes fonctionnels identiques - polyfonctionnels (par exemple,
Tableau 1.1.Les classes les plus importantes de composés organiques

* Les doubles et triples liaisons sont parfois appelées groupes fonctionnels.
** Nom occasionnellement utilisé thioéthers ne doit pas être utilisé car il
fait référence aux esters soufrés (voir 6.4.2).
glycérol), avec plusieurs groupes fonctionnels différents - hétérofonctionnels (par exemple, colamine).
Les composés de chaque classe sont séries homologues, c'est-à-dire un groupe de composés apparentés avec le même type de structure, dont chaque membre suivant diffère du précédent par la différence d'homologie CH 2 dans le radical hydrocarboné. Par exemple, les homologues les plus proches sont l'éthane С 2 H 6 et propane C s H 8, méthanol
CH 3 OH et éthanol CH 3 CH 2 OH, propane CH 3 CH 2 COOH et butane CH 3 canaux 2 canaux 2 Acides COOH. Les homologues ont des propriétés chimiques similaires et des propriétés physiques variant régulièrement.
1.2. Nomenclature
La nomenclature est un système de règles qui vous permet de donner un nom sans ambiguïté à chaque composé individuel. Pour la médecine, la connaissance des règles générales de nomenclature est particulièrement grande importance, puisque les noms de nombreux médicaments sont construits en fonction d'eux.
Actuellement généralement accepté Nomenclature systématique IUPAC(IUPAC - Union Internationale de Chimie Pure et Appliquée)*.
Cependant, ils sont encore conservés et largement utilisés (notamment en médecine) banal noms (ordinaires) et semi-triviaux utilisés avant même que la structure de la matière ne soit connue. Ces noms peuvent refléter sources naturelles et les méthodes de préparation, en particulier les propriétés remarquables et les applications. Par exemple, le lactose (sucre du lait) est isolé du lait (du lat. lactum- lait), acide palmitique - issu de l'huile de palme, acide pyruvique obtenu par pyrolyse de l'acide tartrique, le nom de la glycérine reflète son goût sucré (du grec. glykys- sucré).
Les noms triviaux ont particulièrement souvent des composés naturels - acides aminés, glucides, alcaloïdes, stéroïdes. L'utilisation de certains noms triviaux et semi-triviaux établis est autorisée par les règles de l'IUPAC. De tels noms comprennent, par exemple, "glycérol" et les noms de nombreux hydrocarbures aromatiques bien connus et leurs dérivés.
* Règles de nomenclature IUPAC pour la chimie. T. 2. - Chimie organique / per. de l'anglais. - M. : VINITI, 1979. - 896 p. ; Khlebnikov A.F., Novikov M.S. Nomenclature moderne des composés organiques, ou Comment nommer correctement les substances organiques. - Saint-Pétersbourg: NPO "Professional", 2004. - 431 p.
Dans les noms triviaux des dérivés disubstitués du benzène arrangement mutuel les substituants dans le cycle sont désignés par des préfixes ortho- (o-)- pour les groupes à proximité méta- (m-) passant par un atome de carbone et para-(n-)- contre. Par exemple:
Pour utiliser la nomenclature systématique IUPAC, vous devez connaître le contenu des termes de nomenclature suivants :
radical organique;
structure ancestrale;
Groupe caractéristique ;
Adjoint;
Lokant.
Radicaux organiques* - le reste de la molécule dont un ou plusieurs atomes d'hydrogène sont éliminés et une ou plusieurs valences restent libres.
Les radicaux hydrocarbonés de la série aliphatique ont Nom commun - alkyles(dans les formules générales désignées par R), les radicaux aromatiques - aryles(Ar). Les deux premiers représentants des alcanes - méthane et éthane - forment des radicaux monovalents méthyl CH 3 - et éthyl CH 3 CH 2 -. Les noms de radicaux monovalents sont généralement formés en remplaçant le suffixe -un suffixe -malade.
Un atome de carbone lié à un seul atome de carbone (c'est-à-dire terminal) est appelé primaire, avec deux - secondaire, avec trois - tertiaire avec quatre - Quaternaire.

* Ce terme ne doit pas être confondu avec le terme "radical libre", qui caractérise un atome ou un groupe d'atomes avec un électron non apparié.
Chaque homologue ultérieur, en raison du déséquilibre des atomes de carbone, forme plusieurs radicaux. Lorsqu'un atome d'hydrogène est retiré de l'atome de carbone terminal du propane, un radical est obtenu n-propyle (propyle normal), et de l'atome de carbone secondaire - le radical isopropyle. Le butane et l'isobutane forment chacun deux radicaux. Lettre n-(qui peut être omis) avant que le nom du radical indique que la valence libre est à la fin de la chaîne droite. Préfixe deuxième- (secondaire) signifie que la valence libre est à l'atome de carbone secondaire, et le préfixe tert- (tertiaire) - dans le tertiaire.

structure ancestrale - la structure chimique qui forme la base du composé appelé. Dans les composés acycliques, la structure mère est considérée chaîne principale d'atomes de carbone, dans les composés carbocycliques et hétérocycliques - cycle.
groupe caractéristique - un groupe fonctionnel associé à la structure mère ou entrant en partie dans sa composition.
Adjoint- tout atome ou groupe d'atomes qui remplace un atome d'hydrogène dans un composé organique.

Lokant(de lat. lieu- lieu) un chiffre ou une lettre indiquant la position d'un substituant ou d'une liaison multiple.
Deux types de nomenclature sont les plus largement utilisés : substitutionnelle et radicalaire-fonctionnelle.
1.2.1. Nomenclature substitutive
La conception générale du nom par nomenclature substitutive est présentée dans le schéma 1.2.
Schéma 1.2.Construction générale du nom du composé selon la nomenclature de remplacement

Le nom d'un composé organique est mot composé, comprenant le nom de la structure mère (racine) et les noms des différents types de substituants (sous forme de préfixes et de suffixes), reflétant leur nature, leur emplacement et leur nombre. D'où le nom de cette nomenclature - remplacement.
Les substituants sont divisés en deux types :
Radicaux hydrocarbonés et groupes caractéristiques, désignés uniquement par des préfixes (tableau 1.2);
Groupes caractéristiques, désignés à la fois par des préfixes et des suffixes, selon l'ancienneté (tableau 1.3).
Pour compiler le nom d'un composé organique selon la nomenclature substitutive, la séquence de règles suivante est utilisée.
Tableau 1.2.Certains groupes caractéristiques, désignés uniquement par des préfixes

Tableau 1.3.Préfixes et suffixes utilisés pour désigner les groupes de caractéristiques les plus importants

* L'atome de carbone marqué en couleur est inclus dans la structure mère.
** La plupart des phénols ont des noms triviaux.
Règle 1 Choix du groupe de caractéristiques seniors. Tous les substituants disponibles sont identifiés. Parmi les groupes caractéristiques, le groupe senior (si présent) est déterminé à l'aide de l'échelle d'ancienneté (voir tableau 1.3).
Règle 2 Détermination de la structure ancestrale. La chaîne principale d'atomes de carbone est utilisée comme structure mère dans les composés acycliques et comme structure cyclique principale dans les composés carbocycliques et hétérocycliques.
La chaîne principale d'atomes de carbone dans les composés acycliques est sélectionnée selon les critères ci-dessous, chaque critère suivant étant utilisé si le précédent ne conduit pas à un résultat univoque :
Le nombre maximal de groupes de caractéristiques désignés à la fois par des préfixes et des suffixes ;
Nombre maximal d'obligations multiples ;
Longueur de chaîne maximale d'atomes de carbone ;
Le nombre maximum de groupes de caractéristiques désignés uniquement par des préfixes.
Règle 3 La numérotation de la structure parent. La structure parent est numérotée de sorte que le groupe de caractéristiques le plus élevé obtienne le plus petit locant. Si le choix de la numérotation est ambigu, alors la règle des moindres locants est appliquée, c'est-à-dire qu'ils sont numérotés de manière à ce que les substituants reçoivent les plus petits numéros.
Règle 4 Le nom du bloc de structure parentale avec le groupe de caractéristiques senior. Au nom de la structure ancestrale, le degré de saturation se traduit par des suffixes : -un dans le cas d'un squelette carboné saturé, -fr - en présence de double et -dans - triple liaison. Un suffixe est attaché au nom de la structure ancestrale, désignant le groupe caractéristique principal.
Règle 5 Noms des substituants (sauf pour le groupe caractéristique senior). Donnez des noms aux substituants désignés par des préfixes dans ordre alphabétique. La position de chaque substituant et de chaque liaison multiple est indiquée par les nombres correspondant au numéro de l'atome de carbone auquel le substituant est lié (pour une liaison multiple, seul le plus petit nombre est indiqué).
Dans la terminologie russe, les chiffres sont placés avant les préfixes et après les suffixes, par exemple, 2-aminoéthanol H 2 NCH 2 CH 2 OH, butadiène-1,3
CH 2 \u003d CH-CH \u003d CH 2, propanol-1 CH 3 CH 2 CH 2 OH.
Pour illustrer ces règles, voici des exemples de construction des noms d'un certain nombre de composés conformément à régime général 1.2. Dans chaque cas, les caractéristiques de la structure et la manière dont elles se reflètent dans le nom sont notées.
Schéma 1.3.Construction d'un nom systématique pour l'halothane

2-bromo-1,1,1-trifluoro-2-chloroéthane (un agent pour l'anesthésie par inhalation)
Si le composé possède plusieurs substituants identiques au même atome de carbone, le locant est répété autant de fois qu'il y a de substituants, avec l'ajout du préfixe multiplicateur approprié (Schéma 1.3). Les substituants sont classés par ordre alphabétique, avec le préfixe multiplicateur (en cet exemple - Trois-) ne sont pas pris en compte par ordre alphabétique. Schéma 1.4. Construire un nom systématique pour le citral

après le suffixe -Al, quant à la combinaison -acide oïque, vous ne pouvez pas indiquer la position des groupes caractéristiques, car ils sont toujours au début de la chaîne (schéma 1.4). Les doubles liaisons reflètent le suffixe -diène avec les locataires correspondants dans le nom de la structure mère.
Le suffixe désigne le plus élevé des trois groupes de caractéristiques (schéma 1.5) ; les autres substituants, y compris les groupes caractéristiques non supérieurs, sont répertoriés par ordre alphabétique sous forme de préfixes.
Schéma 1.5.Construction d'un nom systématique pour la pénicillamine

Schéma 1.6.Construction d'un nom systématique pour l'acide oxaloacétique

acide oxobutanedioïque (produit du métabolisme des glucides)
Multiplier le préfixe di- avant la combinaison -acide oïque indique la présence de deux groupes caractéristiques supérieurs (schéma 1.6). Lokant avant oxo- omis car une position différente du groupe oxo correspond à la même structure.
Schéma 1.7.Construire un nom systématique pour le menthol

La numérotation dans le cycle part de l'atome de carbone auquel le groupe caractéristique le plus élevé (OH) est associé (schéma 1.7), malgré le fait que le plus petit ensemble de locants de tous les substituants du cycle peut être 1,2,4-, et non 1,2,5 - (comme dans l'exemple considéré).
Schéma 1.8.Construction d'un nom systématique pour le pyridoxal
jeSubstituants : HYDROXYMÉTHYLE, HYDROXY, MÉTHYLE je

Un groupe aldéhyde dont l'atome de carbone n'est pas inclus dans la structure mère (schéma 1.8) est désigné par le suffixe -carbodéhyde (voir tableau 1.3). Groupe -CH 2 OH est considéré comme un substituant composite et est appelé "hydroxyméthyle", c'est-à-dire méthyle, dans lequel l'atome d'hydrogène est à son tour remplacé par un groupe hydroxyle. Autres exemples de substituants composés : diméthylamino- (CH 3 ) 2 N-, éthoxy- (abréviation de éthyloxy) C 2 H 5 O-.
1.2.2. Nomenclature radicalo-fonctionnelle
La nomenclature radicalo-fonctionnelle est moins utilisée que la nomenclature substitutionnelle. Il est principalement utilisé pour des classes de composés organiques telles que les alcools, les amines, les éthers, les sulfures et quelques autres.
Pour les composés à un groupe fonctionnel, le nom usuel inclut le nom du radical hydrocarboné, et la présence d'un groupe fonctionnel se traduit indirectement par le nom de la classe de composés correspondante adoptée dans ce type de nomenclature (tableau 1.4).
Tableau 1.4.Noms des classes de composés utilisés dans la nomenclature fonctionnelle radicale*

1.2.3. Construire une structure par nom systématique
Décrire une structure à partir d'un nom systématique est généralement une tâche plus facile. Tout d'abord, la structure parente est écrite - une chaîne ouverte ou un cycle, puis les atomes de carbone sont numérotés et les substituants sont disposés. En conclusion, des atomes d'hydrogène sont ajoutés à condition que chaque atome de carbone soit tétravalent.
A titre d'exemple, la construction des structures du médicament PAS (abréviation d'acide para-aminosalicylique, nom systématique - acide 4-amino-2-hydroxybenzoïque) et de l'acide citrique (2-hydroxypropane-1,2,3-tricarboxylique) est donné.
Acide 4-amino-2-hydroxybenzoïque
Structure parentale - le nom trivial du cycle avec la caractéristique la plus élevée
groupe (COOH):

L'arrangement des substituants est un groupe sur l'atome C-4 et un groupe OH sur l'atome C-2 :
Acide 2-hydroxypropane-1,2,3-tricarboxylique
Chaîne carbonée principale et numérotation :
L'arrangement des substituants est composé de trois groupes COOH (acide tricarboxylique) et d'un groupe OH sur l'atome C-2 :
Ajout d'atomes d'hydrogène :


A noter que dans le nom systématique acide citrique sélectionné comme structure mère propane, pas une chaîne plus longue - pentane, car il est impossible d'inclure des atomes de carbone de tous les groupes carboxyle dans une chaîne à cinq carbones.
Dans le passé, les scientifiques divisaient toutes les substances de la nature en substances conditionnellement inanimées et vivantes, y compris les règnes animal et végétal parmi ces derniers. Les substances du premier groupe sont appelées minérales. Et ceux qui sont entrés dans le second ont commencé à être appelés substances organiques.
Qu'entend-on par là ? La classe des substances organiques est la plus étendue de tous les composés chimiques connus des scientifiques modernes. La question de savoir quelles substances sont organiques peut être répondue comme suit - ce sont des composés chimiques qui incluent du carbone.
Veuillez noter que tous les composés contenant du carbone ne sont pas organiques. Par exemple, les corbides et les carbonates, l'acide carbonique et les cyanures, les oxydes de carbone n'en font pas partie.
Pourquoi y a-t-il tant de substances organiques ?
La réponse à cette question réside dans les propriétés du carbone. Cet élément est curieux en ce qu'il est capable de former des chaînes à partir de ses atomes. Et en même temps, la liaison carbone est très stable.
De plus, dans les composés organiques, il présente une valence (IV) élevée, c'est-à-dire la capacité de former des liaisons chimiques avec d'autres substances. Et pas seulement simple, mais aussi double et même triple (sinon - multiples). À mesure que la multiplicité des liaisons augmente, la chaîne d'atomes se raccourcit et la stabilité des liaisons augmente.
Et le carbone est doté de la capacité de former des structures linéaires, plates et tridimensionnelles.
C'est pourquoi les substances organiques dans la nature sont si diverses. Vous pouvez facilement le vérifier vous-même : placez-vous devant un miroir et regardez attentivement votre reflet. Chacun de nous est un manuel ambulant de chimie organique. Pensez-y : au moins 30 % de la masse de chacune de vos cellules est constituée de composés organiques. Les protéines qui ont construit votre corps. Les glucides, qui servent de "carburant" et de source d'énergie. Graisses qui stockent des réserves d'énergie. Hormones qui contrôlent la fonction des organes et même votre comportement. Enzymes qui démarrent réactions chimiquesà l'intérieur de toi. Et même le "code source", les brins d'ADN, sont tous des composés organiques à base de carbone.
Composition des substances organiques
Comme nous l'avons dit au tout début, le principal materiel de construction pour la matière organique, c'est le carbone. Et pratiquement tous les éléments, combinés au carbone, peuvent former des composés organiques.
Dans la nature, le plus souvent dans la composition des substances organiques sont l'hydrogène, l'oxygène, l'azote, le soufre et le phosphore.
La structure des substances organiques
La diversité des substances organiques sur la planète et la diversité de leur structure peuvent être expliquées traits caractéristiques atomes de carbone.
Vous vous souvenez que les atomes de carbone sont capables de former des liens très forts les uns avec les autres, se connectant en chaînes. Le résultat est des molécules stables. La façon dont les atomes de carbone sont connectés dans une chaîne (disposés en zigzag) est l'une des principales caractéristiques de sa structure. Le carbone peut se combiner à la fois en chaînes ouvertes et en chaînes fermées (cycliques).
Il est également important que la structure des produits chimiques affecte directement leurs propriétés chimiques. Un rôle important est également joué par la façon dont les atomes et les groupes d'atomes d'une molécule s'influencent mutuellement.
En raison des particularités de la structure, le nombre de composés carbonés du même type va jusqu'à des dizaines et des centaines. Par exemple, on peut considérer les composés hydrogénés du carbone : méthane, éthane, propane, butane, etc.
Par exemple, méthane - CH 4. Cette combinaison d'hydrogène et de carbone conditions normales réside dans un gaz état d'agrégation. Lorsque l'oxygène apparaît dans la composition, un liquide se forme - alcool méthylique CH3OH.
Non seulement les substances de composition qualitative différente (comme dans l'exemple ci-dessus) présentent des propriétés différentes, mais les substances de même composition qualitative en sont également capables. Un exemple est la capacité différente du méthane CH 4 et de l'éthylène C 2 H 4 à réagir avec le brome et le chlore. Le méthane n'est capable de telles réactions que lorsqu'il est chauffé ou sous une lumière ultraviolette. Et l'éthylène réagit même sans éclairage ni chauffage.
Considérez cette option: la composition qualitative des composés chimiques est la même, la quantitative est différente. Ensuite, les propriétés chimiques des composés sont différentes. Comme dans le cas de l'acétylène C 2 H 2 et du benzène C 6 H 6.
Le dernier rôle dans cette variété n'est pas joué par de telles propriétés des substances organiques, "liées" à leur structure, comme l'isomérie et l'homologie.
Imaginez que vous ayez deux substances apparemment identiques - la même composition et la même formule moléculaire pour les décrire. Mais la structure de ces substances est fondamentalement différente, d'où la différence de composition chimique et propriétés physiques. Par exemple, la formule moléculaire C 4 H 10 peut s'écrire deux diverses substances: butane et isobutane.

On parle de isomères- des composés qui ont la même composition et le même poids moléculaire. Mais les atomes de leurs molécules sont situés dans un ordre différent (structure ramifiée et non ramifiée).
Concernant homologie- c'est une caractéristique d'une telle chaîne carbonée dans laquelle chaque membre suivant peut être obtenu en ajoutant un groupe CH 2 au précédent. Chaque série homologue peut être exprimée par une formule générale. Et connaissant la formule, il est facile de déterminer la composition de n'importe lequel des membres de la série. Par exemple, les homologues du méthane sont décrits par la formule C n H 2n+2 .
Au fur et à mesure que la "différence homologue" CH 2 est ajoutée, la liaison entre les atomes de la substance est renforcée. Prenons la série homologue du méthane : ses quatre premiers membres sont des gaz (méthane, éthane, propane, butane), les six suivants sont des liquides (pentane, hexane, heptane, octane, nonane, décane), puis des substances à l'état solide d'agrégation suivent (pentadécane, eicosan, etc.). Et plus la liaison entre les atomes de carbone est forte, plus masse moléculaire, points d'ébullition et de fusion des substances.
Quelles classes de substances organiques existent ?
Les substances organiques d'origine biologique comprennent:
- protéines;
- les glucides;
- acides nucléiques;
- lipides.
Les trois premiers points peuvent également être appelés polymères biologiques.
Une classification plus détaillée des produits chimiques organiques couvre les substances non seulement d'origine biologique.
Les hydrocarbures sont :
- composés acycliques :
- les hydrocarbures saturés (alcanes) ;
- hydrocarbures insaturés :
- alcènes;
- alcynes;
- alcadiènes.
- composés cycliques :
- composés carbocycliques :
- alicyclique;
- aromatique.
- composés hétérocycliques.
- composés carbocycliques :
Il existe également d'autres classes de composés organiques dans lesquels le carbone se combine avec des substances autres que l'hydrogène :
- alcools et phénols;
- aldéhydes et cétones;
- acides carboxyliques;
- esters;
- lipides;
- les glucides:
- monosaccharides;
- oligosaccharides;
- polysaccharides.
- mucopolysaccharides.
- amines;
- acides aminés;
- protéines;
- acides nucléiques.
Formules de substances organiques par classes

Exemples de substances organiques
Comme vous vous en souvenez, dans le corps humain, divers types de substances organiques sont à la base des fondations. Ce sont nos tissus et nos fluides, nos hormones et nos pigments, nos enzymes et notre ATP, et bien plus encore.
Dans le corps des humains et des animaux, les protéines et les graisses sont prioritaires (la moitié du poids sec d'une cellule animale est constituée de protéines). Dans les plantes (environ 80% de la masse sèche de la cellule) - pour les glucides, principalement complexes - les polysaccharides. Y compris pour la cellulose (sans laquelle il n'y aurait pas de papier), l'amidon.
Parlons de certains d'entre eux plus en détail.
Par exemple, environ les glucides. S'il était possible de prendre et de mesurer les masses de toutes les substances organiques de la planète, ce seraient les glucides qui remporteraient cette compétition.
Ils servent de source d'énergie dans le corps, sont des matériaux de construction pour les cellules et assurent également l'approvisionnement en substances. Les plantes utilisent l'amidon à cette fin et le glycogène pour les animaux.
De plus, les glucides sont très divers. Par exemple, les glucides simples. Les monosaccharides les plus courants dans la nature sont les pentoses (y compris le désoxyribose, qui fait partie de l'ADN) et les hexoses (le glucose, que vous connaissez bien).
Comme des briques, sur un grand chantier de la nature, les polysaccharides sont construits à partir de milliers et de milliers de monosaccharides. Sans eux, plus précisément, sans cellulose, sans amidon, il n'y aurait pas de plantes. Oui, et les animaux sans glycogène, lactose et chitine auraient du mal.
Regardons attentivement écureuils. La nature est le plus grand maître des mosaïques et des puzzles : à partir de seulement 20 acides aminés, 5 millions de types de protéines se forment dans le corps humain. Les protéines ont également de nombreuses fonctions vitales. Par exemple, la construction, la régulation des processus dans le corps, la coagulation du sang (il existe des protéines distinctes pour cela), le mouvement, le transport de certaines substances dans le corps, elles sont également une source d'énergie, sous la forme d'enzymes, elles agissent comme un catalyseur de réactions, assure une protection. En protégeant le corps du négatif influences externes rôle important jouer des anticorps. Et si une discorde survient dans le réglage fin du corps, les anticorps, au lieu de détruire les ennemis externes, peuvent agir comme des agresseurs de leurs propres organes et tissus du corps.

Les protéines sont également divisées en simples (protéines) et complexes (protéines). Et ils ont des propriétés inhérentes à eux seuls : dénaturation (destruction, que vous avez remarquée plus d'une fois lorsque vous avez fait bouillir un œuf dur) et renaturation (cette propriété est largement utilisée dans la fabrication d'antibiotiques, de concentrés alimentaires, etc.).
N'ignorons pas et lipides(graisses). Dans notre corps, ils servent de source d'énergie de réserve. En tant que solvants, ils contribuent au déroulement des réactions biochimiques. Participer à la construction du corps - par exemple, à la formation des membranes cellulaires.
Et quelques mots de plus sur des composés organiques aussi curieux que les hormones. Ils sont impliqués dans les réactions biochimiques et le métabolisme. Ces petites hormones font des hommes des hommes (testostérone) et des femmes des femmes (œstrogène). Rends-nous heureux ou tristes (les hormones jouent un rôle important dans les sautes d'humeur) glande thyroïde et l'endorphine donne une sensation de bonheur). Et ils déterminent même si nous sommes des "hiboux" ou des "alouettes". Êtes-vous prêt à étudier tard ou préférez-vous vous lever tôt et faire devoirs avant l'école, décide non seulement de votre routine quotidienne, mais aussi de certaines hormones surrénaliennes.
Conclusion
Le monde de la matière organique est vraiment incroyable. Il suffit de se plonger un peu dans son étude pour vous couper le souffle du sentiment de parenté avec toute vie sur Terre. Deux jambes, quatre ou des racines au lieu de jambes - nous sommes tous unis par la magie du laboratoire chimique de mère nature. Il fait que les atomes de carbone se rejoignent en chaînes, réagissent et créent des milliers de composés chimiques aussi divers.
Vous avez maintenant un petit guide de la chimie organique. Bien sûr, toutes les informations possibles ne sont pas présentées ici. Vous devrez peut-être clarifier certains points par vous-même. Mais vous pouvez toujours utiliser l'itinéraire que nous avons prévu pour vos recherches indépendantes.
Vous pouvez également utiliser la définition de la matière organique donnée dans l'article, classification et formules générales composés organiques et informations généralesà leur sujet pour préparer les cours de chimie à l'école.
Dites-nous dans les commentaires quelle section de chimie (organique ou inorganique) vous préférez et pourquoi. N'oubliez pas de partager l'article dans les réseaux sociaux afin que vos camarades de classe puissent l'utiliser aussi.
Veuillez signaler si vous trouvez une inexactitude ou une erreur dans l'article. Nous sommes tous humains et nous faisons tous parfois des erreurs.
blog.site, avec copie complète ou partielle du matériel, un lien vers la source est requis.
Il est maintenant établi que la classe des substances organiques est la plus étendue parmi les autres composés chimiques. Qu'est-ce que les chimistes appellent les substances organiques ? La réponse est : ce sont des substances qui contiennent du carbone. Cependant, il existe des exceptions à cette règle : l'acide carbonique, les cyanures, les carbonates, les oxydes de carbone ne font pas partie des composés organiques.
Le carbone est un élément chimique très curieux en son genre. Sa particularité est qu'il peut former des chaînes à partir de ses atomes. Cette connexion est très stable. Dans les composés organiques, le carbone présente une valence (IV) élevée. Nous parlons de la capacité à former des liens avec d'autres substances. Ces liaisons peuvent bien être non seulement simples, mais aussi doubles ou triples. Au fur et à mesure que le nombre de liaisons augmente, la chaîne d'atomes se raccourcit, la stabilité de cette liaison augmente.
Le carbone est également connu pour sa capacité à former des structures linéaires, planes et même tridimensionnelles. Ces propriétés de cet élément chimique ont déterminé une telle variété de substances organiques dans la nature. Environ un tiers de la masse totale de chaque cellule corps humain forment des composés organiques. Ce sont des protéines à partir desquelles le corps est principalement construit. Ces glucides sont le "carburant" universel pour le corps. Ce sont des graisses qui permettent de stocker de l'énergie. Les hormones contrôlent le travail de tous les organes et influencent même le comportement. Et les enzymes déclenchent de violentes réactions chimiques à l'intérieur du corps. De plus, le "code source" d'un être vivant - la chaîne d'ADN - est un composé organique à base de carbone.
Presque tous les éléments chimiques, lorsqu'ils sont combinés avec du carbone, sont capables de donner naissance à des composés organiques. Le plus souvent dans la nature, la composition des substances organiques comprend :
- oxygène;
- hydrogène;
- soufre;
- azote;
- phosphore.
Le développement de la théorie dans l'étude des substances organiques s'est déroulé simultanément dans deux directions interdépendantes: les scientifiques ont étudié la disposition spatiale des molécules de composés et ont clarifié l'essence des liaisons chimiques dans les composés. A l'origine de la théorie de la structure des substances organiques se trouve le chimiste russe A.M. Butlerov.
Principes de classification des substances organiques
Dans la branche scientifique connue sous le nom de chimie organique, les questions de classification des substances revêtent une importance particulière. La difficulté réside dans le fait que des millions de composés chimiques sont sujets à description.
Les exigences de la nomenclature sont très strictes : elle doit être systématique et adaptée à un usage international. Les spécialistes de n'importe quel pays doivent comprendre quel type de composé est impliqué et représenter sans ambiguïté sa structure. Un certain nombre d'efforts sont déployés pour rendre la classification des composés organiques adaptée au traitement informatique.
La classification moderne est basée sur la structure du squelette carboné de la molécule et la présence de groupes fonctionnels dans celle-ci.
Selon la structure de leur squelette carboné, les substances organiques sont divisées en groupes :
- acyclique (aliphatique);
- carbocyclique;
- hétérocyclique.
Les ancêtres de tous les composés en chimie organique sont les hydrocarbures constitués uniquement d'atomes de carbone et d'hydrogène. En règle générale, les molécules de substances organiques contiennent les soi-disant groupes fonctionnels. Ce sont des atomes ou des groupes d'atomes qui déterminent quelles seront les propriétés chimiques d'un composé. De tels groupes permettent également d'attribuer un composé à une classe particulière.
Des exemples de groupes fonctionnels sont :
- carbonyle;
- carboxyle;
- hydroxyle.
Les composés qui ne contiennent qu'un seul groupe fonctionnel sont appelés monofonctionnels. S'il existe plusieurs groupes de ce type dans une molécule organique, ils sont considérés comme polyfonctionnels (par exemple, le glycérol ou le chloroforme). Les hétérofonctionnels seront des composés où les groupes fonctionnels sont de composition différente. Ils peuvent être classés dans différentes classes en même temps. Exemple : acide lactique. Il peut être considéré comme un alcool et comme un acide carboxylique.
La transition d'une classe à l'autre s'effectue, en règle générale, avec la participation de groupes fonctionnels, mais sans modifier le squelette carboné.
Le squelette par rapport à une molécule s'appelle la séquence de liaison des atomes. Le squelette peut être carboné ou contenir ce que l'on appelle des hétéroatomes (par exemple, azote, soufre, oxygène, etc.). En outre, le squelette d'une molécule de composé organique peut être ramifié ou non ramifié ; ouvert ou cyclique.
Les composés aromatiques sont considérés comme un type particulier de composés cycliques : les réactions d'addition ne leur sont pas caractéristiques.
Principales classes de substances organiques
Les substances organiques d'origine biologique suivantes sont connues :
- les glucides;
- protéines;
- lipides;
- acides nucléiques.
Une classification plus détaillée des composés organiques inclut les substances qui ne sont pas d'origine biologique.
Il existe des classes de substances organiques, dans lesquelles le carbone est combiné avec d'autres substances (à l'exception de l'hydrogène):
- alcools et phénols;
- acides carboxyliques;
- aldéhydes et acides;
- esters;
- les glucides;
- lipides;
- acides aminés;
- acides nucléiques;
- protéines.
La structure des substances organiques
Une grande variété de composés organiques dans la nature s'explique par les caractéristiques des atomes de carbone. Ils sont capables de former des liens très forts, s'unissant en groupes - chaînes. Le résultat est des molécules assez stables. La façon dont les molécules s'enchaînent est une caractéristique clé de leur structure. Le carbone est capable de se combiner à la fois en chaînes ouvertes et en chaînes fermées (on les appelle cycliques).
La structure des substances affecte directement leurs propriétés. Les caractéristiques structurelles permettent l'existence de dizaines et de centaines de composés carbonés indépendants.
Un rôle important dans le maintien de la diversité des substances organiques est joué par des propriétés telles que l'homologie et l'isomérie.
Nous parlons de substances identiques à première vue : leur composition ne diffère pas l'une de l'autre, la formule moléculaire est la même. Mais la structure des composés est fondamentalement différente. Les propriétés chimiques des substances seront également différentes. Par exemple, les isomères du butane et de l'isobutane ont la même orthographe. Les atomes des molécules de ces deux substances sont disposés dans un ordre différent. Dans un cas ils sont ramifiés, dans l'autre ils ne le sont pas.
L'homologie est comprise comme une caractéristique d'une chaîne carbonée, où chaque membre suivant peut être obtenu en ajoutant le même groupe au précédent. En d'autres termes, chacune des séries homologues peut être entièrement exprimée par la même formule. Connaissant une telle formule, on peut facilement connaître la composition de n'importe quel membre de la série.

Exemples de substances organiques
Les glucides gagneraient complètement la compétition entre toutes les substances organiques, s'ils étaient pris dans leur ensemble en poids. C'est une source d'énergie pour les organismes vivants et un matériau de construction pour la plupart des cellules. Le monde des glucides est très diversifié. Les plantes n'existeraient pas sans amidon et cellulose. MAIS le monde animal serait impossible sans lactose et glycogène.
Les protéines sont un autre représentant du monde des substances organiques. À partir de seulement deux douzaines d'acides aminés, la nature parvient à former jusqu'à 5 millions de types de structures protéiques dans le corps humain. Les fonctions de ces substances incluent la régulation des processus vitaux dans le corps, assurant la coagulation du sang, le transfert de certains types de substances dans le corps. Sous forme d'enzymes, les protéines agissent comme des accélérateurs de réaction.
Une autre classe importante de composés organiques est celle des lipides (graisses). Ces substances servent de source de secours nécessaire pour le corpsénergie. Ce sont des solvants et ils facilitent le déroulement des réactions biochimiques. Les lipides sont également impliqués dans la construction des membranes cellulaires.
D'autres composés organiques - les hormones - sont également très intéressants. Ils sont responsables du flux des réactions biochimiques et du métabolisme. Ce sont les hormones thyroïdiennes qui rendent une personne heureuse ou triste. Et pour le sentiment de bonheur, comme les scientifiques l'ont découvert, l'endorphine est responsable.