Où est le silicium utilisé dans l'industrie. Silicium : application, propriétés chimiques et physiques
Lire aussi
Silicium (Si) - se situe dans la période 3, groupe IV du sous-groupe principal du système périodique. Propriétés physiques: le silicium existe sous deux formes : amorphe et cristallin. Le silicium amorphe est une poudre brune d'une densité de 2,33 g/cm3, qui se dissout dans les métaux fondus. Le silicium cristallin sont des cristaux de couleur sombre couleur grise, d'un éclat d'acier, dur et cassant, d'une densité de 2,4 g/cm3. Le silicium est composé de trois isotopes : Si (28), Si (29), Si (30).
Propriétés chimiques: configuration électronique: 1s22s22p63 s23p2 . Le silicium est un non-métal. Au niveau de l'énergie externe, le silicium possède 4 électrons, ce qui détermine ses états d'oxydation : +4, -4, -2. Valence - 2, 4. Le silicium amorphe a une plus grande réactivité que le cristallin. Dans des conditions normales, il interagit avec le fluor : Si + 2F2 = SiF4. A 1000 °C, Si réagit avec les non-métaux : avec CL2, N2, C, S.
Parmi les acides, le silicium n'interagit qu'avec un mélange d'acides nitrique et fluorhydrique :
Vis-à-vis des métaux, il se comporte différemment : il se dissout bien dans Zn, Al, Sn, Pb fondus, mais ne réagit pas avec eux ; avec d'autres métaux en fusion - avec Mg, Cu, Fe, le silicium interagit avec la formation de siliciures : Si + 2Mg = Mg2Si. Le silicium brûle dans l'oxygène : Si + O2 = SiO2 (sable).
Dioxyde de silicium ou silice- connexion stable Si, est largement répandu dans la nature. Il réagit avec sa fusion avec les alcalis, les oxydes basiques, formant des sels d'acide silicique - silicates. Reçu: dans l'industrie du silicium forme pure obtenu par réduction du dioxyde de silicium avec du coke dans des fours électriques : SiO2 + 2С = Si + 2СO?.
En laboratoire, le silicium est obtenu par calcination de sable blanc avec du magnésium ou de l'aluminium :
SiO2 + 2Mg = 2MgO + Si.
3SiO2 + 4Al = Al2O3 + 3Si.
Le silicium forme des acides : H2 SiO3 - acide méta-silicique; H2 Si2O5 est deux acide métasilicique.
Trouver dans la nature : minéral de quartz - SiO2. Les cristaux de quartz ont la forme d'un prisme hexagonal, incolore et transparent, appelé cristal de roche. Améthyste - cristal de roche, teint en violet avec des impuretés; la topaze fumée est peinte en brunâtre; l'agate et le jaspe sont des variétés cristallines de quartz. La silice amorphe est moins courante et existe sous la forme d'opale minérale, SiO2 nH2O. La terre de diatomées, la tripolite ou le kieselguhr (terre de diatomées) sont des formes terreuses de silicium amorphe.
42. Le concept de solutions colloïdales
Solutions colloïdales– les systèmes biphasiques fortement dispersés constitués d'un milieu de dispersion et d'une phase dispersée. La taille des particules est intermédiaire entre les vraies solutions, les suspensions et les émulsions. À particules colloïdales composition moléculaire ou ionique.
Il existe trois types de structure interne des particules primaires.
1. Suspensoïdes (ou colloïdes irréversibles)– des systèmes hétérogènes dont les propriétés peuvent être déterminées par une surface interfaciale développée. Par rapport aux suspensions, elles sont plus fortement dispersées. Ils ne peuvent pas exister longtemps sans un stabilisateur de dispersion. Elles sont appelées colloïdes irréversibles du fait que leur précipitation après évaporation à nouveau ne forme pas de sols. Leur concentration est faible - 0,1%. Elles diffèrent légèrement de la viscosité du milieu dispersé.
Les suspensoïdes peuvent être obtenus :
1) méthodes de dispersion (broyage de gros corps) ;
2) les méthodes de condensation (obtention de composés insolubles au moyen de réactions d'échange, d'hydrolyse, etc.).
La diminution spontanée de la dispersion dans les suspensoïdes dépend de l'énergie de surface libre. Pour obtenir une suspension durable, des conditions sont nécessaires à sa stabilisation.
Systèmes de dispersion stables :
1) milieu de dispersion ;
2) phase dispersée ;
3) stabilisateur du système dispersé.
Le stabilisant peut être ionique, moléculaire, mais le plus souvent de haut poids moléculaire.
Colloïdes protecteurs- des composés macromoléculaires ajoutés pour la stabilisation (protéines, peptides, alcool polyvinylique, etc.).
2. Colloïdes associatifs (ou micellaires) - semi-colloïdes naissant à une concentration suffisante de molécules constituées de radicaux hydrocarbonés (molécules amphiphiles) de substances de bas poids moléculaire lors de leur association en agrégats de molécules (micelles). Micelle se forment dans des solutions aqueuses de détergents (savons), colorants organiques.
3. Colloïdes moléculaires (colloïdes réversibles ou lyophiles) - substances naturelles et synthétiques de haut poids moléculaire. Leurs molécules ont la taille de particules colloïdales (macromolécules).
Les solutions diluées de colloïdes de composés macromoléculaires sont des solutions homogènes. Lorsqu'elles sont fortement diluées, ces solutions obéissent aux lois des solutions diluées.
Les macromolécules non polaires se dissolvent dans les hydrocarbures, les polaires - dans les solvants polaires.
Colloïdes réversibles- substances dont le résidu sec, lorsqu'une nouvelle portion de solvant est ajoutée, se dissout à nouveau.
Caractéristique de l'élément
14 Si 1s 2 2s 2 2p 6 3s 2 3p 2
Isotopes : 28 Si (92,27 %) ; 29Si (4,68%); 30 Si (3,05 %)
Le silicium est le deuxième élément le plus abondant de la croûte terrestre après l'oxygène (27,6 % en masse). Il n'existe pas dans la nature à l'état libre, on le trouve principalement sous forme de SiO 2 ou de silicates.
Les composés Si sont toxiques; inhalation les plus petites particules SiO 2 et d'autres composés de silicium (par exemple, l'amiante) provoquent maladie dangereuse- la silicose
Dans l'état fondamental, l'atome de silicium a une valence = II, et dans un état excité = IV.
L'état d'oxydation le plus stable du Si est +4. Dans les composés avec des métaux (siliciures), S.O. -quatre.
Méthodes d'obtention du silicium
Le composé de silicium naturel le plus courant est la silice (dioxyde de silicium) SiO 2 . C'est la principale matière première pour la production de silicium.
1) Récupération de SiO 2 avec du carbone dans des fours à arc à 1800 "C: SiO 2 + 2C \u003d Si + 2CO
2) Si de haute pureté à partir d'un produit technique est obtenu selon le schéma:
a) Si → SiCl 2 → Si
b) Si → Mg 2 Si → SiH 4 → Si
Propriétés physiques du silicium. Modifications allotropiques du silicium
1) Silicium cristallin - une substance de couleur gris argenté avec un éclat métallique, un réseau cristallin de type diamant; député 1415 "C, point d'ébullition 3249" C, densité 2,33 g/cm3; est un semi-conducteur.
2) Silicium amorphe - poudre brune.
Propriétés chimiques du silicium
Dans la plupart des réactions, Si agit comme agent réducteur :
À basses températures le silicium est chimiquement inerte; lorsqu'il est chauffé, sa réactivité augmente fortement.
1. Il interagit avec l'oxygène à T supérieure à 400°C :
Si + O 2 \u003d SiO 2 oxyde de silicium
2. Réagit avec le fluor déjà à température ambiante :
Si + 2F 2 = SiF 4 tétrafluorure de silicium
3. Les réactions avec d'autres halogènes se déroulent à une température = 300 - 500 ° C
Si + 2Hal 2 = SiHal 4
4. Avec la vapeur de soufre à 600°C se forme un disulfure :
5. La réaction avec l'azote se produit au-dessus de 1000°C :
3Si + 2N 2 = Si 3 N 4 nitrure de silicium
6. A une température = 1150°С il réagit avec le carbone :
SiO 2 + 3C \u003d SiC + 2CO
Le carborundum est proche du diamant en dureté.
7. Le silicium ne réagit pas directement avec l'hydrogène.
8. Le silicium est résistant aux acides. Interagit uniquement avec un mélange d'acides nitrique et fluorhydrique (fluorhydrique):
3Si + 12HF + 4HNO 3 = 3SiF 4 + 4NO + 8H 2 O
9. réagit avec les solutions alcalines pour former des silicates et libérer de l'hydrogène :
Si + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 2H 2
10. Les propriétés réductrices du silicium sont utilisées pour isoler les métaux de leurs oxydes :
2MgO \u003d Si \u003d 2Mg + SiO 2
Dans les réactions avec les métaux, Si est un agent oxydant :
Le silicium forme des siliciures avec les métaux s et la plupart des métaux d.
Composition des siliciures métal donné peut être différent. (Par exemple, FeSi et FeSi 2 ; Ni 2 Si et NiSi 2.) L'un des siliciures les plus connus est le siliciure de magnésium, qui peut être obtenu par interaction directe de substances simples :
2Mg + Si = Mg 2 Si
Silane (monosilane) SiH 4
Silanes (hydrogènes de silicium) Si n H 2n + 2, (comparer avec les alcanes), où n \u003d 1-8. Les silanes - analogues des alcanes, diffèrent d'eux par l'instabilité des chaînes -Si-Si-.
Le monosilane SiH 4 est un gaz incolore avec mauvaise odeur; soluble dans l'éthanol, l'essence.
Façons d'obtenir :
1. Décomposition du siliciure de magnésium avec de l'acide chlorhydrique : Mg 2 Si + 4HCI = 2MgCI 2 + SiH 4
2. Réduction des halogénures de Si avec de l'hydrure de lithium et d'aluminium : SiCl 4 + LiAlH 4 = SiH 4 + LiCl + AlCl 3
Propriétés chimiques.
Le silane est un réducteur puissant.
1.SiH 4 est oxydé par l'oxygène même à très basse température :
SiH 4 + 2O 2 \u003d SiO 2 + 2H 2 O
2. SiH 4 s'hydrolyse facilement, notamment en milieu alcalin :
SiH 4 + 2H 2 O \u003d SiO 2 + 4H 2
SiH 4 + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 4H 2
Oxyde de silicium (IV) (silice) SiO 2
La silice existe sous la forme Formes variées: cristallin, amorphe et vitreux. La forme cristalline la plus courante est le quartz. Lorsque les roches de quartz sont détruites, des sables de quartz se forment. Les monocristaux de quartz sont transparents, incolores (cristal de roche) ou colorés avec des impuretés de différentes couleurs (améthyste, agate, jaspe, etc.).
Le SiO 2 amorphe se présente sous la forme de l'opale minérale : le gel de silice est obtenu artificiellement, constitué de particules colloïdales de SiO 2 et étant un très bon adsorbant. Le SiO 2 vitreux est connu sous le nom de verre de quartz.
Propriétés physiques
Dans l'eau, SiO 2 se dissout très légèrement, dans les solvants organiques, il ne se dissout pratiquement pas non plus. La silice est un diélectrique.
Propriétés chimiques
1. SiO 2 est un oxyde acide, donc la silice amorphe se dissout lentement dans les solutions aqueuses d'alcalis :
SiO 2 + 2NaOH \u003d Na 2 SiO 3 + H 2 O
2. SiO 2 interagit également lorsqu'il est chauffé avec oxydes basiques:
SiO 2 + K 2 O \u003d K 2 SiO 3;
SiO 2 + CaO \u003d CaSiO 3
3. Étant un oxyde non volatil, SiO 2 déplace le dioxyde de carbone de Na 2 CO 3 (pendant la fusion) :
SiO 2 + Na 2 CO 3 \u003d Na 2 SiO 3 + CO 2
4. La silice réagit avec l'acide fluorhydrique, formant l'acide hydrofluorosilicique H 2 SiF 6 :
SiO 2 + 6HF \u003d H 2 SiF 6 + 2H 2 O
5. À 250 - 400 ° C, SiO 2 interagit avec HF et F 2 gazeux, formant du tétrafluorosilane (tétrafluorure de silicium):
SiO 2 + 4HF (gaz.) \u003d SiF 4 + 2H 2 O
SiO 2 + 2F 2 \u003d SiF 4 + O 2
Acides siliciques
Connu:
Acide orthosilicique H 4 SiO 4 ;
Acide métasilicique (silicique) H 2 SiO 3 ;
Acides di- et polysiliciques.
Tous les acides siliciques sont peu solubles dans l'eau et forment facilement des solutions colloïdales.
Façons de recevoir
1. Précipitation par des acides à partir de solutions de silicates de métaux alcalins :
Na 2 SiO 3 + 2HCl \u003d H 2 SiO 3 ↓ + 2NaCl
2. Hydrolyse des chlorosilanes: SiCl 4 + 4H 2 O \u003d H 4 SiO 4 + 4HCl
Propriétés chimiques
Les acides siliciques sont des acides très faibles (plus faibles que l'acide carbonique).
Lorsqu'ils sont chauffés, ils se déshydratent pour former de la silice comme produit final.
H 4 SiO 4 → H 2 SiO 3 → SiO 2
Silicates - sels d'acides siliciques
Les acides siliciques étant extrêmement faibles, leurs sels en solution aqueuse sont fortement hydrolysés :
Na 2 SiO 3 + H 2 O \u003d NaHSiO 3 + NaOH
SiO 3 2- + H 2 O \u003d HSiO 3 - + OH - (milieu alcalin)
Pour la même raison, lors du passage gaz carbonique L'acide silicique en est déplacé par des solutions de silicate:
K 2 SiO 3 + CO 2 + H 2 O \u003d H 2 SiO 3 ↓ + K 2 CO 3
SiO 3 + CO 2 + H 2 O \u003d H 2 SiO 3 ↓ + CO 3
Cette réaction peut être considérée comme une réaction qualitative pour les ions silicate.
Parmi les silicates, seuls Na 2 SiO 3 et K 2 SiO 3 sont très solubles, appelés verre soluble, et leurs solutions aqueuses sont verre liquide.
Verre
Le verre à vitre ordinaire a la composition Na 2 O CaO 6SiO 2, c'est-à-dire qu'il s'agit d'un mélange de silicates de sodium et de calcium. Il est obtenu par fusion de soude Na 2 CO 3 , de calcaire CaCO 3 et de sable SiO 2 ;
Na 2 CO 3 + CaCO 3 + 6SiO 2 \u003d Na 2 O CaO 6SiO 2 + 2CO 2
Ciment
Un liant en poudre qui, lorsqu'il interagit avec l'eau, forme une masse plastique, qui finit par se transformer en un corps solide semblable à de la pierre ; principal matériau de construction.
La composition chimique du ciment Portland le plus courant (en% en poids) - 20 - 23% SiO 2; 62 - 76 % CaO; 4 à 7 % Al 2 O 3; 2-5 % Fe203 ; 1-5% MgO.
Silicium. Propriétés physiques et chimiques du silicium
Le silicium est un élément du sous-groupe principal du quatrième groupe de la troisième période du système périodique des éléments chimiques D.I. Mendeleev, de numéro atomique 14. Désigné par le symbole Si (lat. Silicium), non métallique. Propriétés physiques : le silicium cristallin a un éclat métallique, réfractaire, très dur, semi-conducteur. 2. Propriétés chimiques : le silicium est inactif : a) à des températures élevées (400-600
- b) à partir de substances complexes, le silicium réagit avec les alcalis
- c) réagit avec les métaux pour former des siliciures
La silice, ses propriétés et ses applications. Silicates naturels et industriels. Leur utilisation dans la construction
Oxyde de silicium (IV) (dioxyde de silicium, silice SiO2) - cristaux incolores, mp 1713--1728 ° C, ont une dureté et une résistance élevées.
Le dioxyde de silicium est utilisé dans la production de verre, de céramique, d'abrasifs, de produits en béton, pour obtenir du silicium, comme charge dans la production de caoutchouc, dans la production de réfractaires de silice, en chromatographie, etc. Les cristaux de quartz ont des propriétés piézoélectriques et sont donc utilisé dans l'ingénierie radio, installations à ultrasons, dans les briquets. Le dioxyde de silicium est le composant principal de presque toutes les roches terrestres, en particulier la terre de diatomées. La silice et les silicates représentent 87% de la masse de la lithosphère. Le dioxyde de silicium amorphe non poreux est utilisé dans l'industrie agroalimentaire comme excipient anti-agglomérant et anti-agglomérant E551, dans la parapharmacie (dentifrices), dans l'industrie pharmaceutique comme excipient (répertorié dans la plupart des Pharmacopées), ainsi que comme additif alimentaire ou médicament comme entérosorbant. Des films de dioxyde de silicium obtenus artificiellement sont utilisés comme isolant dans la production de microcircuits et d'autres composants électroniques. Également utilisé pour la production de câbles à fibres optiques. La silice fondue pure est utilisée avec l'ajout de certains ingrédients spéciaux. Le filament de silice est également utilisé dans les éléments chauffants des cigarettes électroniques, car il absorbe bien le liquide et ne s'effondre pas sous le chauffage de la bobine. De gros cristaux de quartz transparents sont utilisés comme pierres semi-précieuses ; les cristaux incolores sont appelés cristal de roche, violet - améthystes, jaune - citrine. En microélectronique, le dioxyde de silicium est l'un des principaux matériaux. Il est utilisé comme couche isolante, ainsi que comme revêtement protecteur. Obtenu sous forme de couches minces par oxydation thermique du silicium, dépôt chimique en phase vapeur, pulvérisation magnétron. Le dioxyde de silicium SiO2 est un oxyde acide qui ne réagit pas avec l'eau. Résistant chimiquement aux acides, mais réagit avec le fluorure d'hydrogène gazeux
et acide fluorhydrique :
Ces deux réactions sont largement utilisées pour la gravure du verre. Lorsque SiO2 est fusionné avec des alcalis et des oxydes basiques, ainsi qu'avec des carbonates de métaux actifs, des silicates se forment - des sels d'acides siliciques très faibles et insolubles dans l'eau de formule générale xH2O ySiO2 qui n'ont pas une composition constante (assez souvent, ce ne sont pas les acides siliciques qui sont mentionnés dans la littérature, mais l'acide silicique, bien qu'il s'agisse en fait de la même substance).
Par exemple, l'orthosilicate de sodium peut être obtenu :
métasilicate de calcium :
ou silicate mixte de calcium et de sodium :
à partir de silicate
Na2CaSi6O14 (Na2O CaO 6SiO2)
fabriquer du verre à vitres. La plupart des silicates n'ont pas de composition permanente. De tous les silicates, seuls les silicates de sodium et de potassium sont solubles dans l'eau. Les solutions de ces silicates dans l'eau sont appelées verre liquide. En raison de l'hydrolyse, ces solutions se caractérisent par une forte environnement alcalin. Les silicates hydrolysés se caractérisent par la formation de solutions non pas vraies, mais colloïdales. Lors de l'acidification de solutions de silicates de sodium ou de potassium, un précipité blanc gélatineux d'acides siliciques hydratés se précipite. L'élément structurel principal du dioxyde de silicium solide et de tous les silicates est le groupe dans lequel l'atome de silicium Si est entouré d'un tétraèdre de quatre atomes d'oxygène O. Dans ce cas, chaque atome d'oxygène est relié à deux atomes de silicium. Les fragments peuvent être liés les uns aux autres de différentes manières. Parmi les silicates, selon la nature des liaisons qu'ils contiennent, les fragments sont divisés en îlot, chaîne, ruban, stratifié, cadre et autres. Les silicates sont une vaste classe de composés formés par du dioxyde de silicium (silice) et des oxydes d'autres éléments. SILICATES DANS LA NATURE. Afin de comprendre le rôle des silicates dans la vie humaine, attardons-nous d'abord sur la structure du globe. Selon les idées modernes, le globe se compose d'un certain nombre de coquillages. L'enveloppe externe de la Terre, la croûte terrestre ou lithosphère, est formée de coquilles de granit et de basalte et d'une fine couche sédimentaire. La coquille de granit est principalement constituée de granit - des intercroissances denses de feldspaths, de mica, d'amphiboles et de pyroxènes, et la coquille de basalte est constituée de roches silicatées ressemblant à du granit mais plus lourdes telles que le gabbro, les diabases et les basaltes. Les roches sédimentaires sont formées par la destruction d'autres roches sous l'influence de conditions caractéristiques de la surface de la Terre. Une partie intégrante de la couche sédimentaire sont, en particulier, des argiles, dont la base est la kaolinite minérale de silicate. Lithosphère à 95 wt. % est formé de silicates. Son épaisseur moyenne dans la région des continents est de 30 à 40 km. Ensuite, il y a la coquille simatique, ou manteau supérieur, parmi les minéraux desquels prédominent probablement les silicates de fer et de magnésium. Cette coquille couvre tout le globe et s'étend jusqu'à une profondeur de 1200 km. Plus loin, de 1200 à 2900 km, il y a une coque intermédiaire. Sa composition est controversée, mais l'existence de silicates y est également supposée. Sous cette coquille à une profondeur de 2900 à 6370 km se trouve le noyau. À Ces derniers temps il a été suggéré que le noyau a également une composition de silicate. En se déplaçant de la surface de la Terre vers son centre, la densité et la basicité des roches constitutives augmentent (le rapport entre la teneur en oxydes métalliques et en silice augmente), la pression et la température. Les outils les plus anciens ont été fabriqués par l'homme à partir de silex - un agrégat dense de calcédoine, de quartz et d'opale (800-60 mille ans avant JC). Plus tard, le jaspe, le cristal de roche, l'agate, l'obsidienne (verre de silicate volcanique), le jade ont commencé à être utilisés pour cela.Il n'y a pas de taxonomie généralement acceptée (nomenclature minéralogique) pour les minéraux silicatés, leurs noms proviennent le plus souvent de l'apparence des cristaux, de leur propriétés physiques, l'emplacement ou le nom du scientifique qui les a découverts. Plagioclase en grec signifie fendu obliquement, et pyroxène signifie réfractaire, ce qui correspond aux propriétés de ces minéraux. Les minéraux de quartz, selon la nature des impuretés, ont une large gamme de couleurs, qui détermine leurs noms : améthyste - violet, citrine - jaune, cristal de roche - glace. Les modifications de la stishovite et de la silice coésite et du minéral biotite proviennent des noms des scientifiques qui les ont découverts, S.M. Stishov, L. Coes et J.B. Bio, et le minéral kaolinite tire son nom de la montagne Kaoling en Chine, où l'argile a longtemps été extraite pour la production de porcelaine. Les silicates naturels et la silice elle-même jouent un rôle important en tant que matières premières et produits finaux dans les procédés industriels. Les aluminosilicates - les plagioclases, le feldspath potassique et la silice sont utilisés comme matières premières dans les industries de la céramique, du verre et du ciment. Pour la fabrication de produits textiles ignifuges et électriquement isolants (tissus, cordes, cordes), l'amiante, apparenté aux hydrosilicates - amphiboles, est largement utilisé. Certains types d'amiante sont très résistants aux acides et sont utilisés dans l'industrie chimique. Les biotites, membres du groupe des micas, sont utilisées comme matériaux d'isolation thermique dans la construction et l'instrumentation. Les pyroxènes sont utilisés dans la métallurgie et l'industrie du moulage de la pierre, et le pyroxène LiAl est utilisé pour obtenir du lithium métallique. Les pyroxènes sont partie intégrante les laitiers de haut-fourneau et les laitiers de métallurgie non ferreux, qui, à leur tour, sont également utilisés dans économie nationale. Les roches telles que les granites, les basaltes, les gabbros, les diabases sont d'excellents matériaux de construction. SILICATES D'ORIGINE ARTIFICIELLE. Sans matériaux de silicate - diverses sortes ciment, béton, béton de laitier, céramique, verre, revêtements sous forme d'émaux et de glaçures, on imagine mal nos vie courante. L'échelle de la production de matériaux de silicate semble être des chiffres impressionnants. Dans l'article, nous n'aborderons pas la nature et l'application des lunettes. Ces questions ont déjà été abordées dans. Les matériaux silicatés les plus anciens sont la céramique, obtenue à partir d'argiles et de leurs mélanges avec divers additifs minéraux, cuits à l'état de pierre. À ancien monde les produits céramiques étaient distribués sur toute la Terre. Dès la seconde moitié du XIX siècle et jusqu'à nos jours, l'industrie de la céramique industrielle a considérablement élargi la production et la gamme de céramiques. Un exemple de matériau de silicate artificiel est le ciment Portland, l'un des types les plus courants de liants minéraux. Le ciment est utilisé pour lier les éléments de construction afin de produire des blocs de construction massifs, des dalles, des tuyaux et des briques. Le ciment est à la base de ces matériaux de construction comme le béton, le béton de laitier, le béton armé. La construction de toute envergure ne peut exister sans ciment. Dans le cours scolaire de chimie, des idées de base sur la composition chimique et la technologie du ciment sont données, nous ne nous attarderons donc que sur quelques détails de clarification. Tout d'abord, le clinker de ciment est le produit de la cuisson d'un mélange d'argile et de calcaire, et le ciment est un clinker finement broyé avec des additifs minéraux qui régulent ses propriétés. Le ciment est utilisé mélangé avec du sable et de l'eau. Ses propriétés astringentes sont dues à la capacité des minéraux du ciment à interagir avec H2O et SiO2 et donc à durcir, formant une structure solide semblable à de la pierre. Lors de la prise du ciment, des processus complexes se produisent : hydratation des minéraux avec formation d'hydrosilicates et d'hydroaluminates, hydrolyse, formation de solutions colloïdales et leur cristallisation. Recherche sur les procédés de trempe mortier de ciment et les minéraux du clinker de ciment ont joué un grand rôle dans le développement de la science des silicates et de leur technologie. Nos chantiers consomment de grandes quantités de ciment, de briques, de planches de parement, de tuiles, de canalisations d'égout, de verre et de divers matériaux de construction naturels.
silicone minéral silicium une variété de silice - noire, gris foncé ou claire - est assez courante dans la nature et une personne la connaît bien. Mais oh propriétés curatives le silicium est devenu connu assez récemment: à la fin des années 70 du XXe siècle. Bien que l'humanité se soit familiarisée avec le silicium depuis très longtemps.
Le silex est la pierre qui a marqué le début de la civilisation humaine. Tout au long de l'âge de pierre, le silex a servi de matériau pour la fabrication d'outils et de chasse, le feu a été exploité avec son aide. Les propriétés curatives du silex sont mentionnées dans les traités des anciens philosophes. Il servait à tailler les verrues, à décorer les murs des pièces où l'on stockait la viande, à saupoudrer les plaies sous forme de poudre, ce qui empêchait la gangrène, les meules en silex des moulins permettaient d'obtenir une farine aux excellentes qualités boulangères et gustatives. Depuis l'Antiquité, le fond et la surface intérieure des puits sont tapissés de silex, car il a été remarqué que les personnes qui boivent de l'eau de ces puits tombent moins malades et que cette eau est exceptionnellement claire, savoureuse et cicatrisante.
Dans la nature, le silicium se présente sous la forme de minéraux largement répandus - quartz, calcédoine, opale et d'autres.Le groupe de ces minéraux comprend cornaline, et jaspe, strass, agate, opale, améthyste et bien d'autres pierres. La base de ces minéraux est le dioxyde de silicium ou la silice, mais la densité, la couleur et certaines autres propriétés sont différentes. La composition des silex, outre la silice, comprend une vingtaine d'éléments chimiques dont les principaux sont Mg, Ca, P, Sr, Mn, Cu, Zn, etc. D'où tant de noms. Mais le plus célèbre parmi les représentants de cette famille est sans aucun doute le silex. La majeure partie de la croûte terrestre est constituée de composés organiques silicium (28 vol.%).
Silicium (silicium - lat.) élément chimique, numéro atomique 14, groupe IV du système périodique. Les atomes de silicium forment la base de l'argile, du sable et des roches. On peut dire que tout le monde inorganique est associé au silicium. À conditions naturelles les minéraux de silicium se trouvent dans la calcite et la craie.
Le silicium est le deuxième élément le plus abondant de la croûte terrestre après l'oxygène et représente environ un tiers de son poids total. Un atome sur 6 de la croûte terrestre est un atome de silicium. L'eau de mer contient encore plus de silicium que de phosphore, si nécessaire à la vie sur Terre.
Dans notre corps, le silicium se trouve dans glande thyroïde, glandes surrénales, glande pituitaire. Sa concentration la plus élevée se trouve dans les cheveux et les ongles.
Le silicium fait également partie du collagène, la principale protéine du tissu conjonctif. Son rôle principal est la participation à une réaction chimique qui maintient ensemble les fibres individuelles de collagène et d'élastine, donnant au tissu conjonctif force et élasticité. Le silicium fait également partie du collagène des cheveux et des ongles, joue un rôle important dans la fusion des os lors des fractures.
Le silicium joue un rôle particulier dans la vie et la santé des personnes, ainsi que dans la flore et la faune. Le silicium est absorbé par les plantes sous forme d'acides siliciques dissous, de silicates et de silice colloïdale. Le manque de silicium affecte négativement la germination, la croissance et le rendement des céréales, principalement le riz, ainsi que la canne à sucre, le tournesol, les cultures telles que les pommes de terre, les betteraves, les carottes, les concombres et les tomates. Avec des légumes, des fruits, du lait, de la viande et d'autres produits, une personne devrait consommer 10 à 20 mg de silicium par jour. Cette quantité est nécessaire à la vie normale, à la croissance et au développement du corps.
Recherche scientifique sur le rôle du silicium pour la santé humaine sont couverts dans les monographies de V. Krivenko et autres "Lithothérapie", M., 1994, E. Mikheeva "Propriétés curatives du silicium", S-P, 2002, les travaux de M. Voronkov et moi Kuznetsov (AS URSS , Sib. otd., 1984), A. Panicheva, L. Zardashvili, N. Semenova, etc. Il est démontré que le silicium est impliqué dans l'échange de fluor, de magnésium, d'aluminium et d'autres composés minéraux, mais interagit particulièrement étroitement avec le strontium et le calcium. L'un des mécanismes d'action du silicium est qu'en raison de sa propriétés chimiques il crée des systèmes colloïdaux chargés électriquement qui ont la capacité d'adsorber des virus et des agents pathogènes inhabituels pour l'homme.
Certaines plantes sont capables de concentrer le silicium. ce topinambour, un radis, olive un, groseille, queue de cheval etc. Beaucoup de silicium s'accumule dans les céréales, en particulier dans le tégument (son) : riz, avoine, millet, orge, soja. Lors du broyage des grains dans un moulin, ils sont libérés de la coque, ce qui les prive de silicium et les dévalorise ainsi.
riche en silicium et eau minérale. Mais le sucre raffiné est pratiquement dépourvu de silicium. Seul le sucre jaune non raffiné contient du silicium et représente donc grande valeur.
Les prêles se distinguent par une teneur élevée en silicium - plantes répandues de la flore domestique, utilisées de plus en plus souvent ces dernières années. la médecine traditionnelle. À cet égard, l'extrait d'huile de bardane, l'extrait de prêle, les composés de silicium organique (céramides), qui font partie d'un médicament appelé huile de bardane avec extrait de prêle (avec céramides), ont fait leurs preuves. Des études spéciales ont montré que ce médicament :
Recommandations d'utilisation: en violation de la structure du cheveu, en raison de facteurs externes ou facteurs internes, ainsi que l'amincissement et l'aspect terne des cheveux.
Mode d'application: appliquer l'huile tiède sur les cheveux et le cuir chevelu, frotter délicatement et vigoureusement pendant au moins 15 minutes (en évitant les mouvements brusques et intenses, car cela casse et arrache les cheveux), puis répartir uniformément l'huile sur toute la longueur des cheveux. Appliquer pendant 1 heure, puis laver avec un shampooing doux.
Le silicium est également responsable des fonctions de protection, des processus métaboliques et de la détoxification. Il agit comme un agent biologique de "réticulation" impliqué dans la formation de "l'architecture" moléculaire des polysaccharides et de leurs complexes avec des protéines, donne de l'élasticité aux tissus conjonctifs, fait partie de l'élastine des vaisseaux sanguins, donne de la force, de l'élasticité et de l'imperméabilité à leurs parois et empêche la pénétration des lipides dans le plasma sanguin.
Des études ont montré que le silicium dans l'eau supprime les bactéries qui provoquent la fermentation et la décomposition, précipite les métaux lourds, neutralise le chlore et absorbe les radionucléides. Dans un organisme vivant, les substances biologiquement actives du silicium, ainsi que les structures protéiques, contribuent à la formation d'enzymes, d'acides aminés et d'hormones. Le silicium est particulièrement nécessaire dans le tissu conjonctif; on le trouve dans la glande thyroïde, les glandes surrénales et l'hypophyse. Beaucoup de silicium dans les cheveux. Sa concentration la plus élevée se trouve dans les cheveux et les ongles.
Silicium:
Le manque de silicium dans le corps entraîne :
Une relation a été trouvée entre la concentration de silicium dans boire de l'eau et les maladies cardiovasculaires. Tuberculose, diabète, lèpre, hépatite, hypertension, cataracte, arthrite, cancer s'accompagnent d'une diminution de la concentration de silicium dans les tissus et organes, ou de perturbations de son métabolisme.
Pendant ce temps, notre corps perd quotidiennement du silicium - en moyenne, nous consommons 3,5 mg de silicium par jour avec de la nourriture et de l'eau, et en perdons environ 9 mg !
Causes de la carence en silicium dans le corps :
Habituellement, une diminution de la teneur en silicium se produit dans le contexte d'une carence minérale générale et s'accompagne d'une carence en magnésium et en calcium.
Signes de carence en silicium:
On sait que l'âge biologique d'une personne est déterminé par le taux de processus métaboliques, c'est-à-dire taux de renouvellement en tant que cellules individuelles. Et si de nombreuses préparations cosmétiques sont capables de résoudre le problème de l'hydratation et de la protection à un degré ou à un autre, le problème de l'accélération du métabolisme nécessite un changement plus intensif de la couche externe de la peau.
Le ralentissement des processus de régénération de la peau commence vers 30 ans. À ce moment-là, le corps commence déjà à ressentir le manque de silicium. Notre corps ne peut pas restaurer seul une carence en silicium, car les composés de silicium naturel qui nous entourent sont pour la plupart biologiquement inactifs et ne peuvent pas participer aux réactions biochimiques à l'intérieur de la cellule.
Le silicium est beau produit cosmétique. Il nettoie la peau des formations pustuleuses. Il est particulièrement utile de se laver avec de l'eau de silicone, ainsi que de l'emporter à l'intérieur avec de l'acné juvénile. Au cours de la recherche, les scientifiques ont créé une nouvelle classe de composés de silicium organique capables d'accélérer les processus métaboliques de la peau et, en participant à la synthèse des protéines du tissu conjonctif d'élastine et de collagène, d'augmenter l'élasticité de la peau et d'éliminer les rides.
Les composés contenant du silicium brevetés par WGN accélèrent les processus métaboliques dans les cellules, régénèrent les fibres d'élastine et de collagène. Les résultats de la création de composés actifs de nanosilicium ont constitué la base du développement de la gamme NewAge de préparations cosmétiques dites « de nanosilicium ».
Nanosilicium bioactif pénètre dans les couches profondes de la peau, les assainit et assure une protection qui préserve la perméabilité et la respirabilité naturelles de la peau. Le nonosilicium, stimulant les processus de prolifération et de régénération, accélère le renouvellement de l'épiderme et restaure les fonctions des cellules dermiques - les fibroblastes.
Les avantages des cosmétiques au silicone sont la compatibilité dermatologique des composants ; la possibilité d'utilisation pour tout type de peau, y compris sensible ; haute efficacité d'action, stimulation douce des mécanismes biochimiques naturels de l'état fonctionnel de la peau.
Lorsqu'il interagit avec l'eau, le silex change ses propriétés. L'eau activée par le silex a un effet néfaste sur les micro-organismes, supprime les bactéries qui provoquent la décomposition et la fermentation, une précipitation active de composés de métaux lourds s'y produit, l'eau devient propre en apparence et agréable au goût, elle ne se détériore pas pendant longtemps et acquiert beaucoup autres qualités curatives.
Le silex appartient aux minéraux de la famille du quartz ou de la calcédoine. Le groupe de ces minéraux comprend la cornaline, le jaspe, le cristal de roche, l'agate, l'opale, l'améthyste et de nombreuses autres pierres. La base de ces minéraux est le dioxyde de silicium SiO2 ou la silice, mais la densité, la couleur et certaines autres propriétés sont différentes. La composition des silex, outre la silice, comprend une vingtaine d'éléments chimiques dont les principaux sont Mg, Ca, P, Sr, Mn, Cu, Zn, etc. D'où tant de noms. Mais le plus célèbre parmi les représentants de cette famille est sans aucun doute le silex.
Les causes et le mécanisme de l'interaction du silex avec l'eau ne sont pas complètement élucidés. Peut-être que l'effet curatif du silicium s'explique par sa capacité à former des associés spéciaux avec l'eau - des colloïdes qui absorbent la saleté et la microflore étrangère de l'environnement.
En parlant des propriétés bénéfiques du silicium pour le corps, nous pensons tout d'abord à l'eau. Le corps humain contient environ 70% d'eau, et il est donc difficile d'imaginer la vie sans elle. Et si l'on considère que tous les types de métabolisme s'effectuent par Environnement aquatique que c'est l'eau qui est le conducteur de la grande majorité des processus vitaux que sans lui, aucune forme de vie n'est possible - carbone, silicium ou autre, il devient clair que l'eau activée par le silicium revêt une importance particulière.
"...dans le système silex - solutions aqueuses de sels inorganiques, une décantation intensive d'un certain nombre de métaux se produit : aluminium, fer, cadmium, césium, zinc, plomb, strontium."- P. Aladovsky, chef du laboratoire de l'Institut central de recherche pour l'utilisation des ressources en eau, docteur en sciences chimiques. En d'autres termes, le silex déplace les métaux nocifs de l'eau, la purifiant. Ils restent en bas, mais en haut il s'avère eau pure.
« L'eau traitée au silex affecte la capacité d'adsorption des radionucléides. Cela permettra peut-être de l'utiliser pour résoudre certains problèmes radiochimiques sur le territoire de la Biélorussie contaminé par des radionucléides.- Docteur en chimie Yu. Davydov - chef du laboratoire de l'Institut des problèmes radiologiques de l'Académie nationale des sciences de la République du Bélarus.
"L'eau de silicium, à partir du cinquième jour de stockage, a la capacité de renforcer les capacités hémostatiques du sang, augmente sa capacité à coaguler." E. Ivanov - Directeur de l'Institut d'hématologie et de transfusion sanguine du ministère de la Santé de la République du Bélarus, MD. On pense immédiatement à l'hémophilie - une maladie dans laquelle le sang ne coagule pas bien. Et cela signifie qu'une personne qui a reçu même une petite égratignure peut mourir d'une perte de sang.
« Depuis plusieurs années, je n'ai pas observé de cancer chez de nombreux patients qui consommaient de l'eau activée au silicium (ACB). Nous avons constaté qu'au 5e-6e jour de prise de piles (6 à 8 fois par jour) chez les patients présentant de nombreux ulcères trophiques des membres inférieurs, le nombre de lymphocytes T et B augmente. Et cela indique la capacité de renouveler l'immunité perdue et affaiblie. De plus, l'AKB réduit la quantité de cholestérol dans le sang, en particulier dans l'obésité. Ainsi, la batterie sert à prévenir l'athérosclérose"- M. Sinyavsky Professeur du Département de formation médicale de Mogilevsky Université d'État leur. A.A. Kuleshova.
Qu'est-ce que c'est - eau de silicium? L'eau de silicium est une teinture de silex brun foncé qui est utilisée en interne et en externe. La méthode de préparation de l'eau de silex est assez simple. Dans un récipient de 2-3 litres, de préférence en verre, ajouter 40-50 g de petits cailloux de silex, de préférence brun intense (mais pas noir), verser l'eau du réseau d'adduction d'eau, mais mieux après une filtration normale, et la mettre dans un endroit protégé de la lumière directe du soleil et en dehors du rayonnement pathogène terrestre.
Cette eau à boire sera prête dans 2-3 jours. Soumis à la même technologie, mais si vous attachez le cou avec 2-3 couches de gaze et mettez de l'eau dans un endroit lumineux à une température supérieure à 5 ° C pendant 5-7 jours, cette eau, de par ses propriétés, peut être utilisée non seulement comme eau potable, mais aussi à des fins médicales, à des fins préventives. Il est utile de l'utiliser pour cuisiner - thé, soupes, etc. Vous pouvez boire de l'eau siliconée sans restriction (normalement 1,5 à 2 litres par jour). Si ce n'est pas possible, alors au moins 3 à 5 fois par jour pour un demi-verre et toujours par petites gorgées et de préférence sous une forme fraîche.
Utilisez du silex, comme déjà mentionné, uniquement de couleur marron clair (pas noir).
Seuls des minéraux naturels doivent être utilisés. Le fait est que le silex contient des restes de micro-organismes qui, à un moment donné, ont formé du silex à partir du limon du Crétacé et des époques plus anciennes.
Après une ou deux utilisations, la pierre doit être lavée à l'eau froide et aérée pendant 2 heures. air frais. Lorsque des dépôts ou dépôts apparaissent à la surface des pierres, celles-ci doivent être immergées dans une solution à 2% acide acétique ou eau salée pendant 2 heures; puis rincez 2-3 fois à l'eau ordinaire et plongez pendant 2 heures dans une solution de bicarbonate de soude et rincez à nouveau.
Les propriétés spécifiques de l'eau de silicium vous permettent de vous engager dans la prévention de nombreuses maladies. L'eau de silicium a un effet positif sur l'état général du corps dans son ensemble.
Si vous buvez de l'eau activée à base de silex ou y faites cuire des aliments, voici ce qui se passe :
- renforcement système immunitaire, le nombre de lymphocytes sanguins T et B augmente;
L'état des personnes souffrant de maladies du foie s'améliore, car. l'eau aide à l'écoulement de la bile;
Guérison rapide des brûlures, coupures, ecchymoses, ulcères trophiques;
Aide à l'indigestion, soulage l'inflammation du tube digestif et la gastrite;
Diminution de la glycémie, ainsi que du poids, prédisposés aux diabétiques en surpoids ;
Abaissement du taux de cholestérol dans le sang, en particulier dans l'obésité, prévention de l'athérosclérose et amélioration de la fonction rénale;
Normalise l'état des patients souffrant d'hypertension;
Normalise le métabolisme;
Le ton général augmente.
À application extérieure l'eau de silicium stimule les processus de récupération de l'organisme en :
- traitement des amygdalites, nez qui coule, inflammation des gencives (gargarisme de la gorge et de la bouche après avoir mangé) ;
Avec les maladies virales de la cavité buccale, la stomatite et la gingivite;
Traitement des allergies, furoncles, diathèses, dermatites, irritations cutanées diverses (lotions et lavage) ;
Avec la conjonctivite soulage les démangeaisons et l'inflammation;
Le lavage avec une telle eau aide à améliorer l'état de la peau, à réduire le nombre de rides et à prévenir l'apparition de nouvelles, aide à éliminer les bosses, les points noirs, l'acné;
Rincer la tête et les cheveux, frotter le cuir chevelu aide à renforcer et à faire pousser les cheveux;
Avec certaines maladies de peau (vésiculeuse simple, zona et rosier privé).
- En cas de chute et de cheveux « fourchus », rincez-vous la tête à l'eau « silex » ;
Pour soulager les irritations après le rasage, rincez votre visage avec la même eau ;
Avec "l'acné juvénile" laver et appliquer à l'intérieur de "l'eau" ;
Essuyez la peau du visage avec de l'eau glacée "de silex" avec des morceaux de glace;
Pour prévenir la paradanthose, rincez les gencives à "l'eau" lorsque vous vous brossez les dents.
L'utilisation de l'eau « silex » à des fins thérapeutiques et prophylactiques contribue à guérison rapide blessures, prévenir la formation de tumeurs avec un apport régulier en eau, améliorer la composition du sang, restaurer la fonction des glandes surrénales, éliminer les processus inflammatoires dans tube digestif et avec gastrite, normalisation de la glycémie, perte de poids, guérison des fractures (les os se développent ensemble plus rapidement et sans complications), amélioration de la fonction rénale et du métabolisme, séparation et excrétion de la bile. L'eau de silicium tue les virus; en prévention lors d'épidémies respiratoires, il est recommandé d'instiller "de l'eau" dans le nez. Cela aide à l'insomnie.
À ménage il est recommandé d'arroser les fleurs, ce qui prolonge la période de floraison; accélère la fructification arbres fruitiers et cultures maraîchères; augmente le rendement de 10 %. Tue la moisissure, la moisissure grise, en particulier sur les fraises, et d'autres champignons. Le trempage des graines dans une telle eau augmente la germination. Les fleurs sont mieux conservées dans un récipient avec des galets de silicium, leur durée de conservation augmente considérablement. Dans un aquarium, le silex empêche l'eau de fleurir. Le silicium aide à purifier l'eau lors d'une randonnée, ce qu'il est important que les touristes sachent.
Il est également utile de boire de l'eau de silicium pour l'athérosclérose (les vaisseaux sont débarrassés des dépôts sclérotiques), divers troubles métaboliques, l'amygdalite, la grippe, la pharyngite (le rinçage à l'eau de silicium réduit considérablement la durée de ces maladies - après tout, le silicium agit ici comme un antibiotique ), les rhumatismes, la maladie de Botkin (le silicium tue les virus pathogènes), les maladies des dents et des articulations (car le silicium restaure l'intégrité du tissu osseux).
Et maintenant le plus point important- contre-indications. L'eau siliconée a des contre-indications et doit être manipulée avec beaucoup de précautions. Les médecins ont remarqué que ceux qui ont une prédisposition au cancer, il vaut mieux l'abandonner complètement.
- Désignation - Si (silicium);
- Période - III ;
- Groupe - 14 (IVa);
- Masse atomique - 28,0855 ;
- Numéro atomique - 14 ;
- Rayon d'un atome = 132 pm ;
- Rayon covalent = 111 pm ;
- Répartition des électrons - 1s 2 2s 2 2p 6 3s 2 3p 2 ;
- t fusion = 1412°C;
- point d'ébullition = 2355°C;
- Electronégativité (selon Pauling / selon Alpred et Rochov) = 1,90 / 1,74 ;
- État d'oxydation : +4, +2, 0, -4 ;
- Densité (n.a.) \u003d 2,33 g / cm 3;
- Volume molaire = 12,1 cm 3 / mol.
Composés de silicium :
Le silicium a été isolé pour la première fois sous sa forme pure en 1811 (Français J. L. Gay-Lussac et L. J. Tenard). Le silicium élémentaire pur a été obtenu en 1825 (le Suédois J. Ya. Berzelius). L'élément chimique a reçu son nom "silicium" (traduit du grec ancien - montagne) en 1834 (chimiste russe G. I. Hess).
Le silicium est le plus abondant (après l'oxygène) élément chimique sur Terre (teneur dans la croûte terrestre 28-29% en poids). Dans la nature, le silicium est le plus souvent présent sous forme de silice (sable, quartz, silex, feldspaths), ainsi que dans les silicates et aluminosilicates. Le silicium est extrêmement rare sous sa forme pure. De nombreux silicates naturels sous leur forme pure sont pierres précieuses: émeraude, topaze, aigue-marine - tout est en silicone. L'oxyde de silicium (IV) cristallin pur se présente sous forme de cristal de roche et de quartz. L'oxyde de silicium, dans lequel diverses impuretés sont présentes, forme des pierres précieuses et semi-précieuses - améthyste, agate, jaspe.

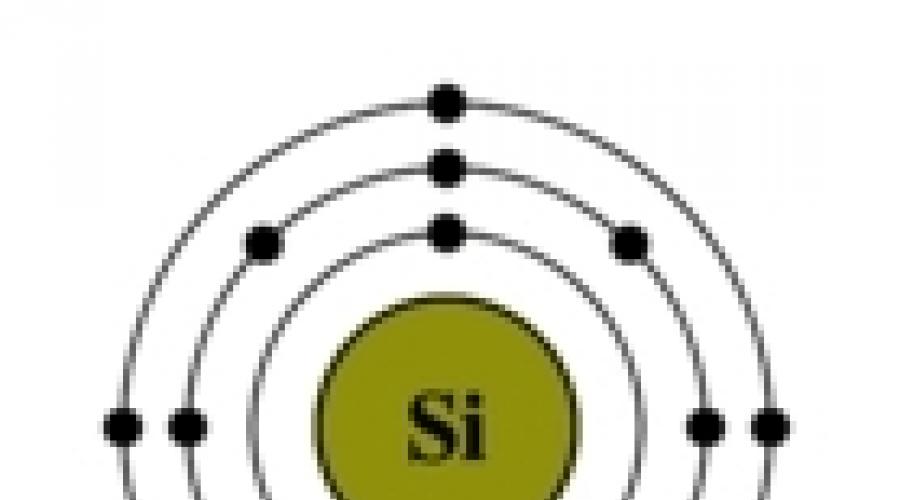
Riz. La structure de l'atome de silicium.
La configuration électronique du silicium est 1s 2 2s 2 2p 6 3s 2 3p 2 (voir Structure électronique des atomes). Dehors niveau d'énergie le silicium a 4 électrons : 2 appariés sur le sous-niveau 3s + 2 non appariés sur les orbitales p. Lorsqu'un atome de silicium passe dans un état excité, un électron du sous-niveau s "quitte" sa paire et va au sous-niveau p, où il y a une orbitale libre. Ainsi, à l'état excité, la configuration électronique de l'atome de silicium prend la forme suivante : 1s 2 2s 2 2p 6 3s 1 3p 3 .

Riz. Le passage de l'atome de silicium à un état excité.
Ainsi, le silicium dans les composés peut présenter une valence 4 (le plus souvent) ou 2 (voir Valence). Le silicium (ainsi que le carbone), réagissant avec d'autres éléments, forme des liaisons chimiques dans lesquelles il peut à la fois abandonner ses électrons et les accepter, mais la capacité d'accepter les électrons des atomes de silicium est moins prononcée que celle des atomes de carbone, en raison de la plus grande atome de silicium.
États d'oxydation du silicium :
- -4 : SiH 4 (silane), Ca 2 Si, Mg 2 Si (silicates métalliques) ;
- +4 - les plus stables : SiO 2 (oxyde de silicium), H 2 SiO 3 (acide silicique), silicates et halogénures de silicium ;
- 0 : Si (substance simple)
Le silicium comme substance simple
Le silicium est un gris foncé substance cristalline avec un éclat métallique. Silicium cristallin est un semi-conducteur.
Le silicium ne forme qu'une seule modification allotropique, similaire au diamant, mais pas aussi forte, car les liaisons Si-Si ne sont pas aussi fortes que dans la molécule de carbone du diamant (Voir Diamant).
Silicium amorphe- poudre brune, point de fusion 1420°C.
Le silicium cristallin est obtenu à partir de silicium amorphe par sa recristallisation. Contrairement au silicium amorphe, qui est une substance chimique plutôt active, le silicium cristallin est plus inerte en termes d'interaction avec d'autres substances.
La structure du réseau cristallin du silicium répète la structure du diamant - chaque atome est entouré de quatre autres atomes situés aux sommets du tétraèdre. Les atomes se lient les uns aux autres par des liaisons covalentes, qui ne sont pas aussi fortes que les liaisons carbone du diamant. Pour cette raison, même au n.s.a. certaines des liaisons covalentes du silicium cristallin sont rompues, ce qui entraîne la libération de certains électrons, grâce auxquels le silicium a une faible conductivité électrique. Au fur et à mesure que le silicium est chauffé, à la lumière ou avec l'ajout de certaines impuretés, le nombre de liaisons covalentes détruites augmente, à la suite de quoi le nombre d'électrons libres augmente, par conséquent, la conductivité électrique du silicium augmente également.
Propriétés chimiques du silicium
Comme le carbone, le silicium peut être à la fois un agent réducteur et un agent oxydant, selon la substance avec laquelle il réagit.
Au n.o. le silicium n'interagit qu'avec le fluor, ce qui s'explique par le réseau cristallin de silicium assez fort.
Le silicium réagit avec le chlore et le brome à des températures supérieures à 400°C.
Le silicium n'interagit avec le carbone et l'azote qu'à des températures très élevées.
- Dans les réactions avec les non-métaux, le silicium agit comme agent réducteur:
- dans des conditions normales, à partir de non-métaux, le silicium ne réagit qu'avec le fluor, formant un halogénure de silicium :
Si + 2F 2 = SiF 4 - à haute température, le silicium réagit avec le chlore (400°C), l'oxygène (600°C), l'azote (1000°C), le carbone (2000°C) :
- Si + 2Cl 2 = SiCl 4 - halogénure de silicium;
- Si + O 2 \u003d SiO 2 - oxyde de silicium;
- 3Si + 2N 2 = Si 3 N 4 - nitrure de silicium;
- Si + C \u003d SiC - carborundum (carbure de silicium)
- dans des conditions normales, à partir de non-métaux, le silicium ne réagit qu'avec le fluor, formant un halogénure de silicium :
- Dans les réactions avec les métaux, le silicium est agent d'oxydation(formé salicides:
Si + 2Mg = Mg 2 Si - Dans les réactions avec des solutions concentrées d'alcalis, le silicium réagit avec la libération d'hydrogène, formant des sels solubles d'acide silicique, appelés silicates:
Si + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 2H 2 - Le silicium ne réagit pas avec les acides (à l'exception de HF).
Obtention et utilisation du silicium
Obtenir du silicium :
- en laboratoire - à partir de silice (thérapie à l'aluminium):
3SiO 2 + 4Al = 3Si + 2Al 2 O 3 - dans l'industrie - par la réduction de l'oxyde de silicium avec du coke (silicium commercial pur) à haute température :
SiO 2 + 2C \u003d Si + 2CO - le silicium le plus pur est obtenu en réduisant le tétrachlorure de silicium avec de l'hydrogène (zinc) à haute température :
SiCl 4 + 2H 2 \u003d Si + 4HCl
Application de silicium :
- fabrication de radioéléments semi-conducteurs;
- comme additifs métallurgiques dans la production de composés résistants à la chaleur et aux acides;
- dans la production de photocellules pour batteries solaires ;
- comme redresseurs CA.