Obtention et application des propriétés physico-chimiques de l'hydrogène. Diverses formes d'hydrogène
Lire aussi
L'atome d'hydrogène a la formule électronique du niveau électronique externe (et unique) 1 s une . D'une part, par la présence d'un électron dans le niveau électronique externe, l'atome d'hydrogène s'apparente aux atomes métaux alcalins. Cependant, tout comme les halogènes, il ne manque qu'un seul électron pour remplir le niveau électronique externe, puisque pas plus de 2 électrons ne peuvent être localisés sur le premier niveau électronique. Il s'avère que l'hydrogène peut être placé simultanément à la fois dans le premier et dans l'avant-dernier (septième) groupe du tableau périodique, ce qui se fait parfois dans diverses options système périodique :
Du point de vue des propriétés de l'hydrogène en tant que substance simple, il a néanmoins plus de points communs avec les halogènes. L'hydrogène, ainsi que les halogènes, est un non-métal et forme des molécules diatomiques (H 2) similaires à celles-ci.
À conditions normales L'hydrogène est une substance gazeuse inactive. La faible activité de l'hydrogène s'explique par la grande force de la liaison entre les atomes d'hydrogène dans la molécule, qui nécessite soit un fort chauffage, soit l'utilisation de catalyseurs, soit les deux à la fois, pour la rompre.
Interaction de l'hydrogène avec des substances simples
avec des métaux
Parmi les métaux, l'hydrogène ne réagit qu'avec les alcalins et alcalino-terreux ! Les métaux alcalins sont les métaux du sous-groupe principal I-ème groupe(Li, Na, K, Rb, Cs, Fr), et pour les métaux alcalino-terreux du sous-groupe principal du groupe II, à l'exception du béryllium et du magnésium (Ca, Sr, Ba, Ra)
Lorsqu'il interagit avec des métaux actifs, l'hydrogène présente des propriétés oxydantes, c'est-à-dire abaisse son état d'oxydation. Dans ce cas, des hydrures de métaux alcalins et alcalino-terreux se forment, qui ont une structure ionique. La réaction se déroule lorsqu'elle est chauffée:
Il convient de noter que l'interaction avec les métaux actifs est le seul cas où l'hydrogène moléculaire H2 est un agent oxydant.
avec des non-métaux
Parmi les non-métaux, l'hydrogène ne réagit qu'avec le carbone, l'azote, l'oxygène, le soufre, le sélénium et les halogènes !
Le carbone doit être compris comme du graphite ou du carbone amorphe, car le diamant est une modification allotropique extrêmement inerte du carbone.
Lorsqu'il interagit avec des non-métaux, l'hydrogène ne peut remplir que la fonction d'agent réducteur, c'est-à-dire qu'il ne peut qu'augmenter son état d'oxydation :
Interaction de l'hydrogène avec des substances complexes
avec des oxydes métalliques
L'hydrogène ne réagit pas avec les oxydes métalliques qui sont dans la série d'activité des métaux jusqu'à l'aluminium (inclus), cependant, il est capable de réduire de nombreux oxydes métalliques à droite de l'aluminium lorsqu'il est chauffé :
avec des oxydes non métalliques
Parmi les oxydes non métalliques, l'hydrogène réagit lorsqu'il est chauffé avec des oxydes d'azote, des halogènes et du carbone. De toutes les interactions de l'hydrogène avec les oxydes non métalliques, sa réaction avec monoxyde de carbone CO.
Le mélange de CO et H 2 a même son propre nom - «gaz de synthèse», car, selon les conditions, des produits industriels aussi demandés que le méthanol, le formaldéhyde et même des hydrocarbures synthétiques peuvent en être obtenus:
avec des acides
L'hydrogène ne réagit pas avec les acides inorganiques !
Parmi les acides organiques, l'hydrogène ne réagit qu'avec les acides insaturés, ainsi qu'avec les acides contenant des groupements fonctionnels susceptibles d'être réduits par l'hydrogène, notamment des groupements aldéhyde, céto ou nitro.
aux sels
Dans le cas de solutions aqueuses de sels, leur interaction avec l'hydrogène ne se produit pas. Cependant, lorsque l'on fait passer de l'hydrogène sur des sels solides de certains métaux d'activité moyenne et faible, leur réduction partielle ou totale est possible, par exemple :
Propriétés chimiques des halogènes
Les halogènes sont les éléments chimiques du groupe VIIA (F, Cl, Br, I, At), ainsi que les substances simples qu'ils forment. Ci-après, sauf indication contraire, les halogènes seront compris comme des substances simples.
Tous les halogènes ont une structure moléculaire, ce qui conduit à des points de fusion et d'ébullition bas de ces substances. Les molécules halogènes sont diatomiques, c'est-à-dire leur formule peut s'écrire vue générale comme Hal 2.
Il convient de noter que ce particulier propriété physique l'iode, car sa capacité à sublimation ou, en d'autres termes, sublimation. sublimation, ils appellent le phénomène dans lequel une substance à l'état solide ne fond pas lorsqu'elle est chauffée, mais, en contournant la phase liquide, passe immédiatement à l'état gazeux.
La structure électronique de l'extérieur niveau d'énergie un atome de n'importe quel halogène a la forme ns 2 np 5, où n est le numéro de la période du tableau périodique dans laquelle se trouve l'halogène. Comme vous pouvez le voir, il ne manque qu'un seul électron dans l'enveloppe externe à huit électrons des atomes d'halogène. A partir de là, il est logique de supposer les propriétés principalement oxydantes des halogènes libres, ce qui est également confirmé dans la pratique. Comme vous le savez, l'électronégativité des non-métaux diminue en descendant dans le sous-groupe, et donc l'activité des halogènes diminue dans la série :
F 2 > Cl 2 > Br 2 > I 2
Interaction des halogènes avec des substances simples
Tous les halogènes sont hautement réactifs et réagissent avec la plupart des substances simples. Cependant, il convient de noter que le fluor, en raison de sa réactivité extrêmement élevée, peut réagir même avec ces substances simples avec lesquelles d'autres halogènes ne peuvent pas réagir. Ces substances simples comprennent l'oxygène, le carbone (diamant), l'azote, le platine, l'or et certains gaz nobles (xénon et krypton). Ceux. réellement, le fluor ne réagit pas seulement avec certains gaz nobles.
Les halogènes restants, c'est-à-dire le chlore, le brome et l'iode sont également des substances actives, mais moins actives que le fluor. Ils réagissent avec presque toutes les substances simples à l'exception de l'oxygène, de l'azote, du carbone sous forme de diamant, du platine, de l'or et des gaz nobles.
Interaction des halogènes avec les non-métaux
hydrogène
Tous les halogènes réagissent avec l'hydrogène pour former halogénures d'hydrogène avec la formule générale HHal. Dans le même temps, la réaction du fluor avec l'hydrogène commence spontanément même dans l'obscurité et se poursuit par une explosion conformément à l'équation :
La réaction du chlore avec l'hydrogène peut être initiée par une irradiation ultraviolette intense ou un chauffage. Fuite également avec une explosion :
Le brome et l'iode ne réagissent avec l'hydrogène que lorsqu'ils sont chauffés, et en même temps, la réaction avec l'iode est réversible :
phosphore
L'interaction du fluor avec le phosphore conduit à l'oxydation du phosphore en le degré le plus élevé oxydation (+5). Dans ce cas, la formation de pentafluorure de phosphore se produit :
Lorsque le chlore et le brome interagissent avec le phosphore, il est possible d'obtenir des halogénures de phosphore à la fois à l'état d'oxydation + 3 et à l'état d'oxydation + 5, ce qui dépend des proportions des réactifs :
Dans le cas du phosphore blanc dans une atmosphère de fluor, de chlore ou de brome liquide, la réaction démarre spontanément.
L'interaction du phosphore avec l'iode peut conduire à la formation de triiodure de phosphore uniquement en raison de la capacité oxydante nettement inférieure à celle des autres halogènes :
grise
Le fluor oxyde le soufre à l'état d'oxydation le plus élevé +6, formant de l'hexafluorure de soufre :
Le chlore et le brome réagissent avec le soufre, formant des composés contenant du soufre dans des états d'oxydation extrêmement inhabituels pour lui +1 et +2. Ces interactions sont très spécifiques, et pour réussir l'examen de chimie, la capacité d'écrire les équations de ces interactions n'est pas nécessaire. Par conséquent, les trois équations suivantes sont données plutôt à titre indicatif :
Interaction des halogènes avec les métaux
Comme mentionné ci-dessus, le fluor est capable de réagir avec tous les métaux, même ceux qui sont inactifs comme le platine et l'or :
Les halogènes restants réagissent avec tous les métaux sauf le platine et l'or :
Réactions des halogènes avec des substances complexes
Réactions de substitution avec des halogènes
Plus d'halogènes actifs, c'est-à-dire dont les éléments chimiques sont situés plus haut dans le tableau périodique, sont capables de déplacer les halogènes moins actifs des acides halohydriques et des halogénures métalliques qu'ils forment :
De même, le brome et l'iode déplacent le soufre des solutions de sulfures et/ou d'hydrogène sulfuré :
Le chlore est un agent oxydant plus puissant et oxyde le sulfure d'hydrogène dans sa solution aqueuse non pas en soufre, mais en acide sulfurique :
Interaction des halogènes avec l'eau
L'eau brûle dans le fluor avec une flamme bleue selon l'équation de réaction :
Le brome et le chlore réagissent différemment avec l'eau que le fluor. Si le fluor a agi comme agent oxydant, alors le chlore et le brome se disproportionnent dans l'eau, formant un mélange d'acides. Dans ce cas, les réactions sont réversibles :
L'interaction de l'iode avec l'eau se déroule à un degré si insignifiant qu'elle peut être négligée et considérée comme si la réaction ne se déroulait pas du tout.
Interaction des halogènes avec des solutions alcalines
Le fluor, lorsqu'il interagit avec une solution aqueuse d'alcali, agit à nouveau comme un agent oxydant :
Capacité d'écriture équation donnée pas nécessaire pour réussir l'examen. Il suffit de connaître le fait de la possibilité d'une telle interaction et rôle oxydant fluor dans cette réaction.
Contrairement au fluor, les halogènes restants sont disproportionnés dans les solutions alcalines, c'est-à-dire qu'ils augmentent et diminuent simultanément leur état d'oxydation. Dans le même temps, dans le cas du chlore et du brome, en fonction de la température, un écoulement dans deux directions différentes est possible. En particulier, à froid, les réactions se déroulent comme suit :
et lorsqu'il est chauffé :
L'iode réagit avec les alcalis exclusivement selon la deuxième option, c'est-à-dire avec la formation d'iodate, car l'hypoiodite est instable non seulement lorsqu'il est chauffé, mais aussi à des températures ordinaires et même au froid.
DÉFINITION
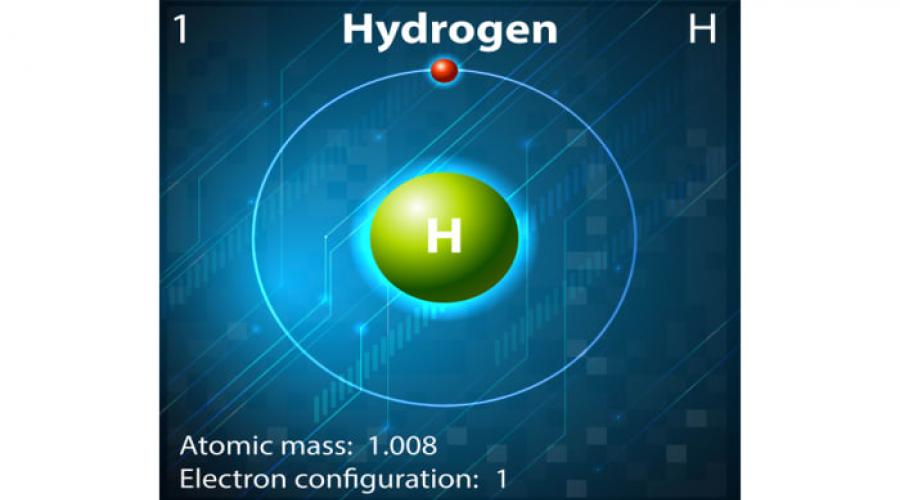
Hydrogène- le premier élément du tableau périodique éléments chimiques DI. Mendeleev. Le symbole est N.
Masse atomique - 1 h du matin La molécule d'hydrogène est diatomique - H 2.
La configuration électronique de l'atome d'hydrogène est 1s 1. L'hydrogène appartient à la famille des éléments s. Dans ses composés, il présente des états d'oxydation -1, 0, +1. L'hydrogène naturel est constitué de deux isotopes stables - le protium 1 H (99,98 %) et le deutérium 2 H (D) (0,015 %) - et d'un isotope radioactif du tritium 3 H (T) (traces, demi-vie - 12,5 ans) .
Propriétés chimiques de l'hydrogène
Dans des conditions normales, l'hydrogène moléculaire présente une réactivité relativement faible, ce qui s'explique par la force de liaison élevée dans la molécule. Lorsqu'il est chauffé, il interagit avec presque toutes les substances simples formées par des éléments des principaux sous-groupes (à l'exception des gaz nobles, B, Si, P, Al). À réactions chimiques peut agir à la fois comme agent réducteur (plus souvent) et comme agent oxydant (moins souvent).
Manifestes d'hydrogène propriétés de l'agent réducteur(H 2 0 -2e → 2H+) dans les réactions suivantes :
1. Réactions d'interaction avec des substances simples - non-métaux. L'hydrogène réagit avec des halogènes, de plus, la réaction d'interaction avec le fluor dans des conditions normales, dans l'obscurité, avec une explosion, avec du chlore - sous illumination (ou irradiation UV) par un mécanisme en chaîne, avec du brome et de l'iode uniquement lorsqu'ils sont chauffés; oxygène(un mélange d'oxygène et d'hydrogène dans un rapport volumique de 2:1 est appelé "gaz explosif"), grise, azote et carbone:
H 2 + Hal 2 \u003d 2HHal;
2H 2 + O 2 \u003d 2H 2 O + Q (t);
H 2 + S \u003d H 2 S (t \u003d 150 - 300C);
3H 2 + N 2 ↔ 2NH 3 (t = 50°C, p, kat = Fe, Pt);
2H2 + C ↔ CH4 (t, p, kat).
2. Réactions d'interaction avec des substances complexes. L'hydrogène réagit avec des oxydes de métaux peu actifs, et il est capable de réduire uniquement les métaux qui sont dans la série d'activité à droite du zinc :
CuO + H 2 \u003d Cu + H 2 O (t);
Fe 2 O 3 + 3H 2 \u003d 2Fe + 3H 2 O (t);
WO 3 + 3H 2 \u003d W + 3H 2 O (t).
L'hydrogène réagit avec des oxydes non métalliques:
H 2 + CO 2 ↔ CO + H 2 O (t);
2H 2 + CO ↔ CH 3 OH (t = 300C, p = 250 - 300 atm., kat = ZnO, Cr 2 O 3).
L'hydrogène entre dans des réactions d'hydrogénation avec des composés organiques de la classe des cycloalcanes, des alcènes, des arènes, des aldéhydes et des cétones, etc. Toutes ces réactions sont réalisées sous chauffage, sous pression, le platine ou le nickel étant utilisés comme catalyseurs :
CH 2 \u003d CH 2 + H 2 ↔ CH 3 -CH 3;
C6H6 + 3H2 ↔ C6H12;
C 3 H 6 + H 2 ↔ C 3 H 8;
CH 3 CHO + H 2 ↔ CH 3 -CH 2 -OH;
CH 3 -CO-CH 3 + H 2 ↔ CH 3 -CH (OH) -CH 3.
Hydrogène comme agent oxydant(H 2 + 2e → 2H -) agit dans les réactions avec les métaux alcalins et alcalino-terreux. Dans ce cas, des hydrures sont formés - des composés ioniques cristallins dans lesquels l'hydrogène présente un état d'oxydation de -1.
2Na + H2 ↔ 2NaH (t, p).
Ca + H2 ↔ CaH2 (t, p).
Propriétés physiques de l'hydrogène
L'hydrogène est un gaz léger incolore, inodore, de densité à n.o. - 0,09 g/l, 14,5 fois plus léger que l'air, t balle = -252,8C, t pl = - 259,2C. L'hydrogène est peu soluble dans l'eau et les solvants organiques, il est très soluble dans certains métaux : nickel, palladium, platine.
Selon la cosmochimie moderne, l'hydrogène est l'élément le plus abondant de l'univers. La principale forme d'existence de l'hydrogène dans Cosmos sont des atomes individuels. L'hydrogène est le 9e élément le plus abondant sur Terre. La principale quantité d'hydrogène sur Terre est à l'état lié - dans la composition de l'eau, du pétrole, gaz naturel, houille, etc. Sous la forme d'une substance simple, l'hydrogène est rarement trouvé - dans la composition des gaz volcaniques.
Obtenir de l'hydrogène
Il existe des méthodes de laboratoire et industrielles pour produire de l'hydrogène. Les méthodes de laboratoire comprennent l'interaction des métaux avec les acides (1), ainsi que l'interaction de l'aluminium avec des solutions aqueuses d'alcalis (2). Parmi les procédés industriels de production d'hydrogène, l'électrolyse de solutions aqueuses d'alcalis et de sels (3) et la conversion du méthane (4) jouent un rôle important :
Zn + 2HCl = ZnCl 2 + H 2 (1);
2Al + 2NaOH + 6H 2 O = 2Na + 3 H 2 (2);
2NaCl + 2H 2 O = H 2 + Cl 2 + 2NaOH (3);
CH4 + H2O ↔ CO + H2 (4).
Exemples de résolution de problèmes
EXEMPLE 1
| Exercer | Lorsque 23,8 g d'étain métallique ont interagi avec un excès d'acide chlorhydrique, de l'hydrogène a été libéré, en quantité suffisante pour obtenir 12,8 g de cuivre métallique.Déterminer l'état d'oxydation de l'étain dans le composé résultant. |
| La solution | Basé structure électronique atome d'étain (...5s 2 5p 2) nous pouvons conclure que l'étain est caractérisé par deux états d'oxydation - +2, +4. Sur cette base, nous allons composer les équations de réactions possibles : Sn + 2HCl = H2 + SnCl2 (1); Sn + 4HCl = 2H 2 + SnCl 4 (2); CuO + H 2 \u003d Cu + H 2 O (3). Trouvez la quantité de substance de cuivre : v (Cu) \u003d m (Cu) / M (Cu) \u003d 12,8 / 64 \u003d 0,2 mol. Selon l'équation 3, la quantité de substance hydrogène: v (H 2) \u003d v (Cu) \u003d 0,2 mol. Connaissant la masse d'étain, on trouve sa quantité de matière : v (Sn) \u003d m (Sn) / M (Sn) \u003d 23,8 / 119 \u003d 0,2 mol. Comparons les quantités de substances étain et hydrogène selon les équations 1 et 2 et selon l'état du problème : v 1 (Sn) : v 1 (H 2) = 1:1 (équation 1) ; v 2 (Sn): v 2 (H 2) = 1:2 (équation 2); v(Sn) : v(H2) = 0,2 : 0,2 = 1 : 1 (condition problématique). Par conséquent, l'étain réagit avec l'acide chlorhydrique selon l'équation 1 et l'état d'oxydation de l'étain est +2. |
| Réponse | L'état d'oxydation de l'étain est +2. |
EXEMPLE 2
| Exercer | Le gaz dégagé par l'action de 2,0 g de zinc pour 18,7 ml d'acide chlorhydrique à 14,6 % (densité de la solution 1,07 g/ml) a été passé en chauffant sur 4,0 g d'oxyde de cuivre (II). Quelle est la masse du mélange solide obtenu ? |
| La solution | Lorsque le zinc agit sur acide hydrochlorique de l'hydrogène est libéré : Zn + 2HCl \u003d ZnCl 2 + H 2 (1), qui, lorsqu'il est chauffé, réduit l'oxyde de cuivre (II) en cuivre (2): CuO + H 2 \u003d Cu + H 2 O. Trouvez la quantité de substances dans la première réaction : m (p-raHcl) = 18,7. 1,07 = 20,0 g ; m(HCl) = 20,0. 0,146 = 2,92g ; v (HCl) \u003d 2,92 / 36,5 \u003d 0,08 mol; v(Zn) = 2,0/65 = 0,031 mol. Le zinc est carencé, donc la quantité d'hydrogène libérée est de : v (H 2) \u003d v (Zn) \u003d 0,031 mol. Dans la seconde réaction, l'hydrogène manque car : v (CuO) \u003d 4,0 / 80 \u003d 0,05 mol. À la suite de la réaction, 0,031 mol de CuO se transformera en 0,031 mol de Cu, et la perte de masse sera : m (СuО) - m (Сu) \u003d 0,031 × 80 - 0,031 × 64 \u003d 0,50 g. La masse du mélange solide de CuO avec Cu après passage d'hydrogène sera : 4,0-0,5 = 3,5g |
| Réponse | La masse du mélange solide de CuO avec Cu est de 3,5 g. |
DÉFINITION
Hydrogène est le premier élément du tableau périodique. Désignation - H du latin "hydrogenium". Situé en première période, groupe IA. Fait référence aux non-métaux. La charge nucléaire est 1.
L'hydrogène est l'un des éléments chimiques les plus courants - sa part est d'environ 1% de la masse des trois coquilles la croûte terrestre(atmosphère, hydrosphère et lithosphère), qui, une fois convertis en pourcentages atomiques, donne le chiffre 17,0.
La quantité principale de cet élément est à l'état lié. Ainsi, l'eau contient environ 11 wt. %, argile - environ 1,5%, etc. Sous forme de composés avec le carbone, l'hydrogène fait partie du pétrole, des gaz naturels combustibles et de tous les organismes.
L'hydrogène est un gaz incolore et inodore (un schéma de la structure de l'atome est représenté sur la figure 1). Ses points de fusion et d'ébullition sont très bas (-259 o C et -253 o C, respectivement). À une température (-240 o C) et sous pression, l'hydrogène est capable de se liquéfier et, avec l'évaporation rapide du liquide résultant, il se transforme en un état solide (cristaux transparents). Il est légèrement soluble dans l'eau - 2:100 en volume. L'hydrogène se caractérise par sa solubilité dans certains métaux, par exemple dans le fer.
Riz. 1. La structure de l'atome d'hydrogène.
Poids atomique et moléculaire de l'hydrogène
DÉFINITION
Masse atomique relativeélément est le rapport de la masse d'un atome d'un élément donné à 1/12 de la masse d'un atome de carbone.
Relatif masse atomique est sans dimension et est noté A r (l'indice « r » est la lettre initiale mot anglais relatif, qui en traduction signifie "relatif"). La masse atomique relative de l'hydrogène atomique est de 1,008 amu.
Les masses des molécules, tout comme les masses des atomes, sont exprimées en unités de masse atomique.
DÉFINITION
masse moléculaire substance s'appelle la masse de la molécule, exprimée en unités de masse atomique. Poids moléculaire relatif les substances appellent le rapport de la masse d'une molécule d'une substance donnée à 1/12 de la masse d'un atome de carbone, dont la masse est de 12 a.m.u.
On sait que la molécule d'hydrogène est diatomique - H 2 . Le poids moléculaire relatif d'une molécule d'hydrogène sera égal à :
M r (H 2) \u003d 1,008 × 2 \u003d 2,016.
Isotopes de l'hydrogène
L'hydrogène a trois isotopes : le protium 1 H, le deutérium 2 H ou D et le tritium 3 H ou T. Leurs nombres de masse sont 1, 2 et 3. Le protium et le deutérium sont stables, le tritium est radioactif (demi-vie 12,5 ans). Dans les composés naturels, le deutérium et le protium sont en moyenne contenus dans un rapport de 1:6800 (selon le nombre d'atomes). Le tritium se trouve dans la nature en quantités négligeables.
Le noyau de l'atome d'hydrogène 1 H contient un proton. Les noyaux de deutérium et de tritium comprennent, outre le proton, un et deux neutrons.
Ions hydrogène
Un atome d'hydrogène peut soit donner son seul électron pour former un ion positif (qui est un proton "nu"), soit ajouter un électron, se transformant en un ion négatif, qui a une configuration électronique d'hélium.
Le détachement complet d'un électron d'un atome d'hydrogène nécessite la dépense d'une très grande énergie d'ionisation :
H + 315 kcal = H + + e.
En conséquence, dans l'interaction de l'hydrogène avec les métalloïdes, il n'y a pas de liaisons ioniques, mais seulement polaires.
La tendance d'un atome neutre à fixer un électron en excès est caractérisée par la valeur de son affinité électronique. Dans l'hydrogène, il est plutôt faiblement exprimé (cependant, cela ne signifie pas qu'un tel ion hydrogène ne peut pas exister):
H + e \u003d H - + 19 kcal.
Molécule et atome d'hydrogène
La molécule d'hydrogène est constituée de deux atomes - H 2 . Voici quelques propriétés qui caractérisent l'atome et la molécule d'hydrogène :
Exemples de résolution de problèmes
EXEMPLE 1
| Exercer | Prouver que les hydrures existent formule générale EN x contenant 12,5% d'hydrogène. |
| La solution | Calculez les masses d'hydrogène et de l'élément inconnu, en prenant la masse de l'échantillon à 100 g : m(H) = m(EN x)×w(H); m(H) = 100 × 0,125 = 12,5 g. m (E) \u003d m (EN x) - m (H); m (E) \u003d 100 - 12,5 \u003d 87,5 g. Trouvons la quantité de substance hydrogène et un élément inconnu, désignant la masse molaire de ce dernier par "x" (la masse molaire de l'hydrogène est de 1 g / mol): |
L'hydrogène est un élément spécial qui occupe deux cellules à la fois dans système périodique Mendeleev. Il est situé dans deux groupes d'éléments aux propriétés opposées, et cette caractéristique le rend unique. L'hydrogène est une substance simple et partie intégrante nombreux composés complexes, c'est un élément organogène et biogénique. Il vaut la peine de se familiariser en détail avec ses principales caractéristiques et propriétés.
L'hydrogène dans le système périodique de Mendeleïev
Les principales caractéristiques de l'hydrogène indiquées dans :
- le numéro de série de l'élément est 1 (il y a le même nombre de protons et d'électrons) ;
- la masse atomique est de 1,00795 ;
- l'hydrogène a trois isotopes, chacun ayant des propriétés particulières ;
- en raison du contenu d'un seul électron, l'hydrogène est capable de présenter des propriétés réductrices et oxydantes, et après le don d'un électron, l'hydrogène a une orbitale libre, qui participe à la formation de liaisons chimiques selon le mécanisme donneur-accepteur;
- l'hydrogène est un élément léger de faible densité ;
- l'hydrogène est un agent réducteur fort, il ouvre le groupe métal alcalin dans le premier groupe du sous-groupe principal ;
- lorsque l'hydrogène réagit avec des métaux et d'autres agents réducteurs puissants, il accepte leur électron et devient un agent oxydant. Ces composés sont appelés hydrures. Selon la caractéristique indiquée, l'hydrogène appartient conditionnellement au groupe des halogènes (dans le tableau, il est donné au-dessus du fluor entre parenthèses), avec lequel il présente des similitudes.
L'hydrogène en tant que substance simple
L'hydrogène est un gaz dont la molécule est composée de deux. Cette substance a été découverte en 1766 par le scientifique britannique Henry Cavendish. Il a prouvé que l'hydrogène est un gaz qui explose lorsqu'il interagit avec l'oxygène. Après avoir étudié l'hydrogène, les chimistes ont découvert que cette substance est la plus légère de toutes connues de l'homme.
Un autre scientifique, Lavoisier, a donné à l'élément le nom "hydrogénium", qui signifie en latin "donnant naissance à l'eau". En 1781, Henry Cavendish a prouvé que l'eau est une combinaison d'oxygène et d'hydrogène. En d'autres termes, l'eau est le produit de la réaction de l'hydrogène avec l'oxygène. Les propriétés combustibles de l'hydrogène étaient connues même des anciens scientifiques: les archives correspondantes ont été laissées par Paracelse, qui a vécu au XVIe siècle.
L'hydrogène moléculaire est un composé gazeux naturel commun dans la nature, qui se compose de deux atomes et lorsqu'un éclat brûlant est soulevé. Une molécule d'hydrogène peut se désintégrer en atomes qui se transforment en noyaux d'hélium, car ils sont capables de participer à réactions nucléaires. De tels processus se produisent régulièrement dans l'espace et sur le Soleil.
L'hydrogène et ses propriétés physiques
L'hydrogène a les paramètres physiques suivants :
- bout à -252,76 °C;
- fond à -259,14 °C ; *dans les limites de température indiquées, l'hydrogène est un liquide inodore et incolore ;
- l'hydrogène est légèrement soluble dans l'eau;
- l'hydrogène peut théoriquement se transformer à l'état métallique dans des conditions particulières (basses températures et haute pression) ;
- l'hydrogène pur est une substance explosive et combustible ;
- l'hydrogène est capable de diffuser à travers l'épaisseur des métaux, il s'y dissout donc bien;
- l'hydrogène est 14,5 fois plus léger que l'air ;
- à haute pression des cristaux d'hydrogène solide ressemblant à de la neige peuvent être obtenus.
Propriétés chimiques de l'hydrogène

Méthodes de laboratoire :
- interaction d'acides dilués avec des métaux actifs et des métaux d'activité moyenne;
- hydrolyse des hydrures métalliques;
- réaction avec l'eau des métaux alcalins et alcalino-terreux.
Composés d'hydrogène :
Halogénures d'hydrogène; composés hydrogène volatils de non-métaux; hydrures; les hydroxydes; hydroxyde d'hydrogène (eau); peroxyde d'hydrogène; composés organiques(protéines, lipides, glucides, vitamines, lipides, huiles essentielles, les hormones). Cliquez pour voir des expériences sûres sur l'étude des propriétés des protéines, des graisses et des glucides.
Pour collecter l'hydrogène résultant, vous devez garder le tube à essai retourné. L'hydrogène ne peut pas être récolté gaz carbonique car il est beaucoup plus léger que l'air. L'hydrogène s'évapore rapidement et lorsqu'il est mélangé à l'air (ou dans une grande accumulation), il explose. Par conséquent, il est nécessaire d'inverser le tube. Immédiatement après le remplissage, le tube est fermé avec un bouchon en caoutchouc.
Pour vérifier la pureté de l'hydrogène, vous devez apporter une allumette allumée au col du tube à essai. Si un pop sourd et silencieux se produit, le gaz est propre et les impuretés de l'air sont minimes. Si le pop est fort et sifflant, le gaz dans le tube à essai est sale, il contient une grande proportion de composants étrangers.
Attention! N'essayez pas de répéter ces expériences vous-même !
Les méthodes industrielles d'obtention de substances simples dépendent de la forme sous laquelle l'élément correspondant se trouve dans la nature, c'est-à-dire quelle peut être la matière première pour sa production. Ainsi, l'oxygène, qui est disponible à l'état libre, est obtenu de manière physique - par isolation de l'air liquide. L'hydrogène, en revanche, est presque entièrement sous forme de composés, donc, pour l'obtenir, méthodes chimiques. En particulier, des réactions de décomposition peuvent être utilisées. L'une des façons de produire de l'hydrogène est la réaction de décomposition de l'eau par le courant électrique.
La principale méthode industrielle de production d'hydrogène est la réaction avec l'eau du méthane, qui fait partie du gaz naturel. Elle s'effectue à haute température (il est facile de vérifier que lorsqu'on fait passer du méthane même dans de l'eau bouillante, aucune réaction ne se produit) :
CH 4 + 2H 2 0 \u003d CO 2 + 4H 2 - 165 kJ
En laboratoire, pour obtenir des substances simples, on n'utilise pas nécessairement des matières premières naturelles, mais on choisit les substances initiales à partir desquelles il est plus facile d'isoler la substance nécessaire. Par exemple, en laboratoire, l'oxygène n'est pas obtenu à partir de l'air. Il en va de même pour la production d'hydrogène. L'une des méthodes de laboratoire pour produire de l'hydrogène, parfois utilisée dans l'industrie, est la décomposition de l'eau par le courant électrique.
L'hydrogène est généralement produit en laboratoire en faisant réagir du zinc avec de l'acide chlorhydrique.
Dans l'industrie
1.Électrolyse de solutions aqueuses de sels :
2NaCl + 2H 2 O → H 2 + 2NaOH + Cl 2
2.Faire passer de la vapeur d'eau sur du coke chaudà environ 1000°C :
H 2 O + C ⇄ H 2 + CO
3.Du gaz naturel.
Conversion vapeur : CH 4 + H 2 O ⇄ CO + 3H 2 (1000 °C) Oxydation catalytique oxygène : 2CH 4 + O 2 ⇄ 2CO + 4H 2
4. Craquage et reformage d'hydrocarbures dans le processus de raffinage du pétrole.
Dans le laboratoire
1.Action des acides dilués sur les métaux. Pour réaliser une telle réaction, le zinc et l'acide chlorhydrique sont le plus souvent utilisés :
Zn + 2HCl → ZnCl2 + H2
2.Interaction du calcium avec l'eau :
Ca + 2H 2 O → Ca (OH) 2 + H 2
3.Hydrolyse des hydrures :
NaH + H2O → NaOH + H2
4.L'action des alcalis sur le zinc ou l'aluminium :
2Al + 2NaOH + 6H 2 O → 2Na + 3H 2 Zn + 2KOH + 2H 2 O → K 2 + H 2
5.Avec l'aide de l'électrolyse. Lors de l'électrolyse de solutions aqueuses d'alcalis ou d'acides, de l'hydrogène se dégage à la cathode, par exemple :
2H 3 O + + 2e - → H 2 + 2H 2 O
- Bioréacteur pour la production d'hydrogène
Propriétés physiques
L'hydrogène gazeux peut exister sous deux formes (modifications) - sous forme d'ortho - et de para-hydrogène.
Dans la molécule d'orthohydrogène (pf -259,10 °C, pb -252,56 °C), les spins nucléaires sont dirigés de la même manière (parallèle), tandis que dans le parahydrogène (pf -259,32 °C, t pb -252,89 °C) - opposé les uns aux autres (anti-parallèle).
Les formes allotropiques de l'hydrogène peuvent être séparées par adsorption sur charbon actif à température de l'azote liquide. A très basses températures l'équilibre entre l'orthohydrogène et le parahydrogène est presque entièrement déplacé vers ce dernier. À 80 K, le rapport hauteur/largeur est d'environ 1:1. Le parahydrogène désorbé, lorsqu'il est chauffé, se transforme en orthohydrogène jusqu'à la formation d'un équilibre à température ambiante mélanges (ortho-para : 75:25). Sans catalyseur, la transformation se produit lentement, ce qui permet d'étudier les propriétés des formes allotropiques individuelles. La molécule d'hydrogène est diatomique - H₂. Dans des conditions normales, c'est un gaz incolore, inodore et insipide. L'hydrogène est le gaz le plus léger, sa densité est plusieurs fois inférieure à celle de l'air. Évidemment, plus la masse des molécules est petite, plus leur vitesse est élevée à la même température. En tant que plus légères, les molécules d'hydrogène se déplacent plus rapidement que les molécules de tout autre gaz et peuvent donc transférer plus rapidement la chaleur d'un corps à un autre. Il s'ensuit que l'hydrogène a la conductivité thermique la plus élevée parmi les substances gazeuses. Sa conductivité thermique est environ sept fois supérieure à celle de l'air.
Propriétés chimiques
Les molécules d'hydrogène H₂ sont assez fortes et pour que l'hydrogène réagisse, il faut dépenser beaucoup d'énergie: H 2 \u003d 2H - 432 kJ Par conséquent, à des températures ordinaires, l'hydrogène ne réagit qu'avec des métaux très actifs, par exemple avec calcium, formant de l'hydrure de calcium: Ca + H 2 \u003d CaH 2 et avec le seul non-métal - le fluor, formant du fluorure d'hydrogène: F 2 + H 2 \u003d 2HF Avec la plupart des métaux et des non-métaux, l'hydrogène réagit à des températures élevées ou sous d'autres influences, telles que l'éclairage. Il peut "enlever" l'oxygène de certains oxydes, par exemple: CuO + H 2 \u003d Cu + H 2 0 L'équation écrite reflète la réaction de réduction. Les réactions de réduction sont appelées processus, à la suite desquels l'oxygène est retiré du composé; Les substances qui enlèvent l'oxygène sont appelées agents réducteurs (elles-mêmes s'oxydent). En outre, une autre définition des concepts d'"oxydation" et de "réduction" sera donnée. MAIS cette définition, historiquement le premier, conserve son importance à l'heure actuelle, en particulier dans chimie organique. La réaction de réduction est l'inverse de la réaction d'oxydation. Ces deux réactions se déroulent toujours simultanément comme un seul processus : lorsqu'une substance est oxydée (réduite), l'autre est nécessairement réduite (oxydée) en même temps.
N2 + 3H2 → 2NH3
Formes avec des halogènes halogénures d'hydrogène:
F 2 + H 2 → 2 HF, la réaction se déroule avec une explosion dans l'obscurité et à n'importe quelle température, Cl 2 + H 2 → 2 HCl, la réaction se déroule avec une explosion, uniquement à la lumière.
Il interagit avec les suies à fort échauffement :
C + 2H 2 → CH 4
Interaction avec les métaux alcalins et alcalino-terreux
Formes d'hydrogène avec des métaux actifs hydrures:
Na + H 2 → 2 NaH Ca + H 2 → CaH 2 Mg + H 2 → MgH 2
hydrures- substances solides salées, facilement hydrolysables :
CaH2 + 2H2O → Ca(OH)2 + 2H2
Interaction avec les oxydes métalliques (généralement des éléments d)
Les oxydes sont réduits en métaux :
CuO + H 2 → Cu + H 2 O Fe 2 O 3 + 3H 2 → 2 Fe + 3H 2 O WO 3 + 3H 2 → W + 3H 2 O
Hydrogénation des composés organiques
Sous l'action de l'hydrogène sur des hydrocarbures insaturés en présence d'un catalyseur au nickel et à température élevée, la réaction se produit hydrogénation:
CH 2 \u003d CH 2 + H 2 → CH 3 -CH 3
L'hydrogène réduit les aldéhydes en alcools :
CH3CHO + H2 → C2H5OH.
Géochimie de l'hydrogène
Hydrogène - basique materiel de construction univers. C'est l'élément le plus courant et tous les éléments en sont formés à la suite de réactions thermonucléaires et nucléaires.
L'hydrogène libre H 2 est relativement rare dans les gaz terrestres, mais sous forme d'eau, il joue un rôle exceptionnellement important dans les processus géochimiques.
L'hydrogène peut être présent dans les minéraux sous forme d'ion ammonium, d'ion hydroxyle et d'eau cristalline.
L'hydrogène est continuellement produit dans l'atmosphère à la suite de la décomposition de l'eau. radiation solaire. Il migre vers la haute atmosphère et s'échappe dans l'espace.
Application
- L'énergie hydrogène
L'hydrogène atomique est utilisé pour le soudage à l'hydrogène atomique.
Dans l'industrie alimentaire, l'hydrogène est enregistré comme additif alimentaire. E949 comme gaz de conditionnement.
Caractéristiques de circulation
L'hydrogène, lorsqu'il est mélangé à l'air, forme un mélange explosif - le soi-disant gaz détonant. Ce gaz est le plus explosif lorsque le rapport volumique de l'hydrogène et de l'oxygène est de 2: 1, ou de l'hydrogène et de l'air est d'environ 2: 5, car l'air contient environ 21% d'oxygène. L'hydrogène est également inflammable. L'hydrogène liquide peut causer de graves engelures s'il entre en contact avec la peau.
Des concentrations explosives d'hydrogène avec de l'oxygène se produisent de 4% à 96% en volume. En cas de mélange avec de l'air de 4% à 75 (74)% en volume.
Utilisation de l'hydrogène
Dans l'industrie chimique, l'hydrogène est utilisé dans la production d'ammoniac, de savon et de plastiques. Dans l'industrie alimentaire, la margarine est fabriquée à partir d'huiles végétales liquides utilisant de l'hydrogène. L'hydrogène est très léger et monte toujours dans l'air. Une fois les dirigeables et des ballons rempli d'hydrogène. Mais dans les années 30. 20ième siècle il y a eu plusieurs terribles accidents lorsque les dirigeables ont explosé et brûlé. De nos jours, les dirigeables sont remplis d'hélium. L'hydrogène est également utilisé comme carburant de fusée. Un jour, l'hydrogène pourrait être largement utilisé comme carburant pour les voitures et les camions. Les moteurs à hydrogène ne polluent pas environnement et n'émettent que de la vapeur d'eau (cependant, la production même d'hydrogène entraîne une certaine pollution de l'environnement). Notre Soleil est composé majoritairement d'hydrogène. La chaleur et la lumière solaires sont le résultat de la libération d'énergie nucléaire lors de la fusion des noyaux d'hydrogène.
Utilisation de l'hydrogène comme carburant (efficacité économique)
La caractéristique la plus importante des substances utilisées comme combustible est leur chaleur de combustion. Du cours de chimie générale, on sait que la réaction d'interaction de l'hydrogène avec l'oxygène se produit avec dégagement de chaleur. Si nous prenons 1 mol H 2 (2 g) et 0,5 mol O 2 (16 g) dans des conditions standard et excitons la réaction, alors selon l'équation
H 2 + 0,5 O 2 \u003d H 2 O
après l'achèvement de la réaction, 1 mol de H 2 O (18 g) se forme avec un dégagement d'énergie de 285,8 kJ / mol (à titre de comparaison: la chaleur de combustion de l'acétylène est de 1300 kJ / mol, propane - 2200 kJ / mol) . 1 m³ d'hydrogène pèse 89,8 g (44,9 mol). Par conséquent, pour obtenir 1 m³ d'hydrogène, 12832,4 kJ d'énergie seront dépensés. En tenant compte du fait que 1 kWh = 3600 kJ, on obtient 3,56 kWh d'électricité. Connaissant le tarif pour 1 kWh d'électricité et le coût de 1 m³ de gaz, on peut conclure qu'il est conseillé de passer à l'hydrogène carburant.
Par exemple, un modèle expérimental Honda FCX de 3e génération avec un réservoir d'hydrogène de 156 litres (contenant 3,12 kg d'hydrogène à une pression de 25 MPa) parcourt 355 km. En conséquence, 123,8 kWh sont obtenus à partir de 3,12 kg H2. A 100 km, la consommation d'énergie sera de 36,97 kWh. Connaissant le coût de l'électricité, le coût du gaz ou de l'essence, leur consommation pour une voiture aux 100 km, il est facile de calculer l'effet économique négatif du passage des voitures à l'hydrogène. Disons (Russie 2008), 10 cents par kWh d'électricité conduit au fait que 1 m³ d'hydrogène conduit à un prix de 35,6 cents, et en tenant compte de l'efficacité de la décomposition de l'eau de 40-45 cents, la même quantité de kWh de la combustion de l'essence coûte 12832,4 kJ / 42000 kJ / 0,7 kg / l * 80 cents / l = 34 cents au prix de détail, tandis que pour l'hydrogène, nous avons calculé option parfaite, hors transport, amortissement des équipements, etc. Pour du méthane dont l'énergie de combustion est d'environ 39 MJ par m³, le résultat sera deux à quatre fois inférieur du fait de la différence de prix (1m³ pour l'Ukraine coûte 179$, et pour l'Europe 350$) . Autrement dit, la quantité équivalente de méthane coûtera 10 à 20 cents.
Cependant, il ne faut pas oublier que lorsque nous brûlons de l'hydrogène, nous obtenons eau propre dont il a été extrait. C'est-à-dire que nous avons une énergie renouvelable magasinierénergie sans nuire à l'environnement, contrairement au gaz ou à l'essence, qui sont des sources d'énergie primaires.
Php à la ligne 377 Avertissement : require(http://www..php) : échec de l'ouverture du flux : aucun wrapper approprié n'a pu être trouvé dans /hsphere/local/home/winexins/site/tab/vodorod.php à la ligne 377 Fatal erreur : require() : Échec de l'ouverture requise "http://www..php" (include_path="..php à la ligne 377