La formule électronique de l'élément. Schéma de la structure de l'atome : noyau, couche électronique
Lire aussi
Les produits chimiques sont les éléments qui composent le monde qui nous entoure.
Les propriétés de chaque substance chimique sont divisées en deux types : les chimiques, qui caractérisent sa capacité à former d'autres substances, et les physiques, qui sont objectivement observées et peuvent être considérées indépendamment des transformations chimiques. Par exemple, les propriétés physiques d'une substance sont sa état d'agrégation(solide, liquide ou gazeux), conductivité thermique, capacité calorifique, solubilité dans divers milieux (eau, alcool, etc.), densité, couleur, goût, etc.
La transformation de certaines substances chimiques en d'autres substances est appelée phénomène chimique ou réaction chimique. Il convient de noter qu'il existe également des phénomènes physiques qui, évidemment, s'accompagnent d'une modification de certains propriétés physiques substances sans se transformer en d'autres substances. À phénomènes physiques, par exemple, comprennent la fonte de la glace, le gel ou l'évaporation de l'eau, etc.
Sur le fait qu'au cours de tout processus, il y a un phénomène chimique, on peut conclure en observant les traits caractéristiques réactions chimiques tels que changement de couleur, précipitation, dégagement de gaz, dégagement de chaleur et/ou de lumière.
Ainsi, par exemple, une conclusion sur le déroulement des réactions chimiques peut être tirée en observant:
La formation de sédiments lors de l'ébullition de l'eau, appelée tartre dans la vie quotidienne;
Le dégagement de chaleur et de lumière lors de la combustion d'un feu;
Changer la couleur de la tranche pomme fraîcheà l'antenne;
La formation de bulles de gaz lors de la fermentation de la pâte, etc.
Les plus petites particules de matière qui, au cours des réactions chimiques, ne subissent pratiquement pas de changements, mais seulement d'une manière nouvelle sont reliées les unes aux autres, sont appelées atomes.
L'idée même de l'existence de telles unités de matière est née dans la Grèce ancienne dans les esprits anciens philosophes, ce qui explique en fait l'origine du terme "atome", puisque "atomos" en traduction littérale du grec signifie "indivisible".
Cependant, contrairement à l'idée des anciens philosophes grecs, les atomes ne sont pas le minimum absolu de matière, c'est-à-dire ont eux-mêmes une structure complexe.
Chaque atome est constitué de particules dites subatomiques - protons, neutrons et électrons, désignés respectivement par les symboles p + , n o et e - . L'exposant dans la notation utilisée indique que le proton a une charge positive unitaire, l'électron a une charge négative unitaire et le neutron n'a pas de charge.
Quant à la structure qualitative de l'atome, chaque atome a tous les protons et neutrons concentrés dans le soi-disant noyau, autour duquel les électrons forment une coquille d'électrons.
Le proton et le neutron ont pratiquement les mêmes masses, c'est-à-dire m p ≈ m n , et la masse des électrons est presque 2000 fois inférieure à la masse de chacun d'eux, c'est-à-dire m p / m e ≈ m n / m e ≈ 2000.
Étant donné que la propriété fondamentale d'un atome est sa neutralité électrique et que la charge d'un électron est égale à la charge d'un proton, on peut en conclure que le nombre d'électrons dans tout atome est égal au nombre de protons.
Ainsi, par exemple, le tableau ci-dessous montre la composition possible des atomes :
Le type d'atomes avec la même charge nucléaire, c'est-à-dire Avec le même numéro les protons dans leurs noyaux sont appelés un élément chimique. Ainsi, à partir du tableau ci-dessus, nous pouvons conclure que atom1 et atom2 appartiennent à un élément chimique, et atom3 et atom4 appartiennent à un autre élément chimique.
Chaque élément chimique a son propre nom et son propre symbole, qui se lit d'une certaine manière. Ainsi, par exemple, l'élément chimique le plus simple, dont les atomes ne contiennent qu'un seul proton dans le noyau, porte le nom "hydrogène" et est désigné par le symbole "H", qui se lit comme "cendre", et l'élément chimique avec une charge nucléaire de +7 (c'est-à-dire contenant 7 protons) - "azote", a le symbole "N", qui se lit comme "en".
Comme vous pouvez le voir dans le tableau ci-dessus, les atomes d'un élément chimique peuvent différer dans le nombre de neutrons dans les noyaux.
Atomes appartenant au même élément chimique, mais ayant montant différent les neutrons et, par conséquent, la masse, sont appelés isotopes.
Ainsi, par exemple, l'élément chimique hydrogène a trois isotopes - 1 H, 2 H et 3 H. Les indices 1, 2 et 3 au-dessus du symbole H signifient le nombre total de neutrons et de protons. Ceux. sachant que l'hydrogène est un élément chimique, qui se caractérise par le fait qu'il y a un proton dans le noyau de ses atomes, on peut conclure qu'il n'y a pas du tout de neutrons dans l'isotope 1 H (1-1 = 0), en l'isotope 2 H - 1 neutron (2-1=1) et dans l'isotope 3 H - deux neutrons (3-1=2). Puisque, comme déjà mentionné, un neutron et un proton ont les mêmes masses, et que la masse d'un électron est négligeable par rapport à eux, cela signifie que l'isotope 2 H est presque deux fois plus lourd que l'isotope 1 H, et le 3 H isotope est trois fois plus lourd. . En raison d'une telle dispersion dans les masses des isotopes de l'hydrogène, les isotopes 2 H et 3 H se sont même vu attribuer des noms et des symboles individuels distincts, ce qui n'est typique d'aucun autre élément chimique. L'isotope 2 H a été nommé deutérium et a reçu le symbole D, et l'isotope 3 H a reçu le nom de tritium et a reçu le symbole T.
Si nous prenons la masse du proton et du neutron comme unité et négligeons la masse de l'électron, en fait, l'indice supérieur gauche, en plus du nombre total de protons et de neutrons dans l'atome, peut être considéré comme sa masse, et cet indice est donc appelé nombre de masse et désigné par le symbole A. Puisque la charge du noyau de tout proton correspond à l'atome et que la charge de chaque proton est conditionnellement considérée comme égale à +1, le nombre de protons dans le noyau est appelé le numéro de charge (Z). En désignant le nombre de neutrons dans un atome par la lettre N, mathématiquement la relation entre le nombre de masse, le nombre de charge et le nombre de neutrons peut être exprimée comme suit :
Selon les concepts modernes, l'électron a une nature double (onde-particule). Il a les propriétés d'une particule et d'une onde. Comme une particule, un électron a une masse et une charge, mais en même temps, le flux d'électrons, comme une onde, se caractérise par la capacité de diffraction.
Pour décrire l'état d'un électron dans un atome, on utilise les concepts de la mécanique quantique, selon lesquels l'électron n'a pas de trajectoire de mouvement spécifique et peut être localisé en tout point de l'espace, mais avec des probabilités différentes.
La région de l'espace autour du noyau où un électron est le plus susceptible de se trouver s'appelle l'orbite atomique.
Une orbitale atomique peut avoir diverses formes, taille et orientation. Une orbitale atomique est aussi appelée nuage d'électrons.
Graphiquement, une orbitale atomique est généralement désignée par une cellule carrée :
La mécanique quantique dispose d'un appareil mathématique extrêmement complexe, c'est pourquoi, dans le cadre d'un cours de chimie scolaire, seules les conséquences de la théorie de la mécanique quantique sont envisagées.
Selon ces conséquences, toute orbitale atomique et un électron qui s'y trouve sont complètement caractérisés par 4 nombres quantiques.
- Le nombre quantique principal - n - détermine l'énergie totale d'un électron dans une orbitale donnée. La plage de valeurs du nombre quantique principal est tout entiers, c'est à dire. n = 1,2,3,4, 5 etc...
- Le nombre quantique orbital - l - caractérise la forme de l'orbite atomique et peut prendre n'importe quelle valeur entière de 0 à n-1, où n, rappel, est le nombre quantique principal.
Les orbitales avec l = 0 sont appelées s-orbitales. Les orbitales s sont sphériques et n'ont pas de direction dans l'espace :
Les orbitales avec l = 1 sont appelées p-orbitales. Ces orbitales ont la forme d'un huit en trois dimensions, c'est-à-dire la forme obtenue en faisant tourner le chiffre huit autour de l'axe de symétrie, et ressemble extérieurement à un haltère :
Les orbitales avec l = 2 sont appelées ré-orbitales, et avec l = 3 – F-orbitales. Leur structure est beaucoup plus complexe.
3) Le nombre quantique magnétique - m l - détermine l'orientation spatiale d'une orbitale atomique particulière et exprime la projection du moment cinétique orbital sur la direction champ magnétique. Le nombre quantique magnétique m l correspond à l'orientation de l'orbitale par rapport à la direction du vecteur d'intensité du champ magnétique externe et peut prendre toutes les valeurs entières de –l à +l, y compris 0, c'est-à-dire le nombre total de valeurs possibles est (2l+1). Ainsi, par exemple, avec l = 0 m l = 0 (une valeur), avec l = 1 m l = -1, 0, +1 (trois valeurs), avec l = 2 m l = -2, -1, 0, + 1 , +2 (cinq valeurs du nombre quantique magnétique), etc.
Ainsi, par exemple, les orbitales p, c'est-à-dire les orbitales avec un nombre quantique orbital l = 1, ayant la forme d'un "huit en trois dimensions", correspondent à trois valeurs du nombre quantique magnétique (-1, 0, +1), qui, à son tour, correspond dans trois directions de l'espace perpendiculaires entre elles.
4) Le nombre quantique de spin (ou simplement spin) - m s - peut être conditionnellement considéré comme responsable du sens de rotation d'un électron dans un atome, il peut prendre des valeurs. Les électrons avec des spins différents sont indiqués par des flèches verticales pointant dans des directions différentes : ↓ et .
L'ensemble de toutes les orbitales d'un atome qui ont la même valeur du nombre quantique principal est appelé niveau d'énergie ou couche d'électrons. Tout arbitraire niveau d'énergie avec un certain nombre n se compose de n 2 orbitales.
L'ensemble des orbitales avec les mêmes valeurs du nombre quantique principal et du nombre quantique orbital est un sous-niveau d'énergie.
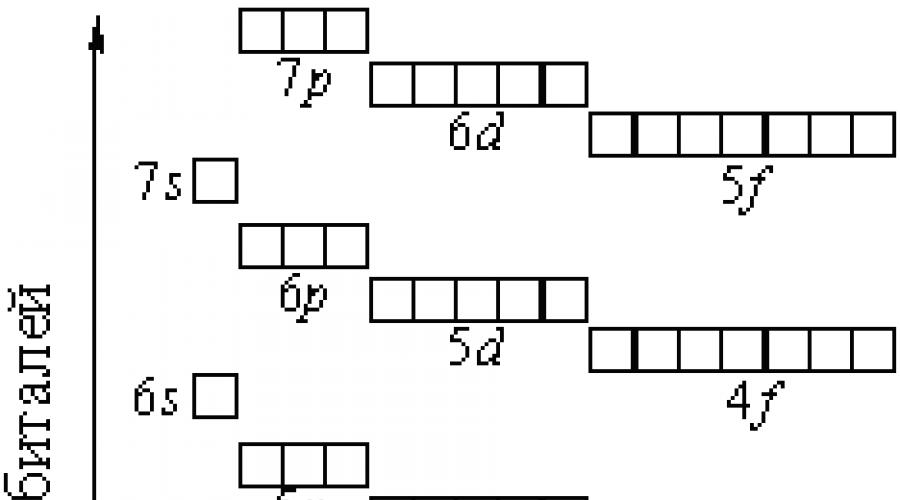
Chaque niveau d'énergie, qui correspond au nombre quantique principal n, contient n sous-niveaux. À son tour, chaque sous-niveau d'énergie avec un nombre quantique orbital l se compose de (2l + 1) orbitales. Ainsi, la sous-couche s consiste en une orbitale s, la sous-couche p - trois orbitales p, la sous-couche d - cinq orbitales d et la sous-couche f - sept orbitales f. Étant donné que, comme déjà mentionné, une orbitale atomique est souvent désignée par une cellule carrée, les sous-niveaux s, p, d et f peuvent être représentés graphiquement de la manière suivante:
Chaque orbitale correspond à un ensemble individuel strictement défini de trois nombres quantiques n, l et m l .
La distribution des électrons dans les orbitales s'appelle la configuration électronique.
Le remplissage des orbitales atomiques avec des électrons se produit selon trois conditions :
- Le principe de l'énergie minimale: Les électrons remplissent les orbitales à partir du sous-niveau d'énergie le plus bas. La séquence des sous-niveaux par ordre croissant d'énergie est la suivante : 1s<2s<2p<3s<3p<4s≤3d<4p<5s≤4d<5p<6s…;
Afin de faciliter la mémorisation de cette séquence de remplissage des sous-niveaux électroniques, l'illustration graphique suivante est très pratique :
- Principe de Pauli: Chaque orbitale peut contenir au plus deux électrons.
S'il y a un électron dans l'orbite, on l'appelle non apparié, et s'il y en a deux, on les appelle une paire d'électrons.
- règle de Hund: l'état le plus stable d'un atome est celui dans lequel, à l'intérieur d'un sous-niveau, l'atome a le nombre maximum possible d'électrons non appariés. Cet état le plus stable de l'atome est appelé l'état fondamental.
En fait, ce qui précède signifie que, par exemple, le placement des 1er, 2e, 3e et 4e électrons sur trois orbitales du sous-niveau p sera effectué comme suit :
Le remplissage des orbitales atomiques de l'hydrogène, qui a un nombre de charge de 1, au krypton (Kr) avec un nombre de charge de 36, sera effectué comme suit :
Une représentation similaire de l'ordre dans lequel les orbitales atomiques sont remplies est appelée un diagramme d'énergie. Sur la base des schémas électroniques des éléments individuels, vous pouvez écrire leurs soi-disant formules électroniques (configurations). Ainsi, par exemple, un élément avec 15 protons et, par conséquent, 15 électrons, c'est-à-dire le phosphore (P) aura le diagramme énergétique suivant :
Une fois traduit en formule électronique, l'atome de phosphore prendra la forme :
15 P = 1s 2 2s 2 2p 6 3s 2 3p 3
Les nombres de taille normale à gauche du symbole de sous-niveau indiquent le numéro du niveau d'énergie et les exposants à droite du symbole de sous-niveau indiquent le nombre d'électrons dans le sous-niveau correspondant.
Vous trouverez ci-dessous les formules électroniques des 36 premiers éléments de D.I. Mendeleev.
| période | Numéro d'article | symbole | Titre | formule électronique |
| je | 1 | H | hydrogène | 1s 1 |
| 2 | Il | hélium | 1s2 | |
| II | 3 | Li | lithium | 1s2 2s1 |
| 4 | Être | béryllium | 1s2 2s2 | |
| 5 | B | bore | 1s 2 2s 2 2p 1 | |
| 6 | C | carbone | 1s 2 2s 2 2p 2 | |
| 7 | N | azote | 1s 2 2s 2 2p 3 | |
| 8 | O | oxygène | 1s 2 2s 2 2p 4 | |
| 9 | F | fluor | 1s 2 2s 2 2p 5 | |
| 10 | Ne | néon | 1s 2 2s 2 2p 6 | |
| III | 11 | N / A | sodium | 1s 2 2s 2 2p 6 3s 1 |
| 12 | mg | magnésium | 1s 2 2s 2 2p 6 3s 2 | |
| 13 | Al | aluminium | 1s 2 2s 2 2p 6 3s 2 3p 1 | |
| 14 | Si | silicium | 1s 2 2s 2 2p 6 3s 2 3p 2 | |
| 15 | P | phosphore | 1s 2 2s 2 2p 6 3s 2 3p 3 | |
| 16 | S | soufre | 1s 2 2s 2 2p 6 3s 2 3p 4 | |
| 17 | CL | chlore | 1s 2 2s 2 2p 6 3s 2 3p 5 | |
| 18 | Ar | argon | 1s 2 2s 2 2p 6 3s 2 3p 6 | |
| IV | 19 | K | potassium | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| 20 | Californie | calcium | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 | |
| 21 | sc | scandium | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 | |
| 22 | Ti | titane | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 | |
| 23 | V | vanadium | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 | |
| 24 | Cr | chrome | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 s sur le ré sous-niveau | |
| 25 | Mn | manganèse | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 | |
| 26 | Fe | le fer | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 | |
| 27 | co | cobalt | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 | |
| 28 | Ni | nickel | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 | |
| 29 | Cu | cuivre | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 s sur le ré sous-niveau | |
| 30 | Zn | zinc | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 | |
| 31 | Géorgie | gallium | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 | |
| 32 | Ge | germanium | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 | |
| 33 | Comme | arsenic | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 | |
| 34 | Se | sélénium | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 | |
| 35 | BR | brome | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 | |
| 36 | kr | krypton | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 |
Comme déjà mentionné, dans leur état fondamental, les électrons des orbitales atomiques sont disposés selon le principe de moindre énergie. Néanmoins, en présence d'orbitales p vides dans l'état fondamental d'un atome, souvent, lorsqu'un excès d'énergie lui est communiqué, l'atome peut être transféré dans l'état dit excité. Ainsi, par exemple, un atome de bore dans son état fondamental a une configuration électronique et un diagramme d'énergie de la forme suivante :
5B = 1s 2 2s 2 2p 1
Et à l'état excité (*), c'est-à-dire lors de la transmission d'énergie à l'atome de bore, sa configuration électronique et son diagramme d'énergie ressembleront à ceci :
5 B* = 1s 2 2s 1 2p 2
Selon le sous-niveau de l'atome qui est rempli en dernier, les éléments chimiques sont divisés en s, p, d ou f.
Recherche des éléments s, p, d et f dans le tableau D.I. Mendeleïev :
- Les s-éléments ont le dernier s-sous-niveau à remplir. Ces éléments comprennent des éléments des sous-groupes principaux (à gauche dans la cellule du tableau) des groupes I et II.
- Pour les p-éléments, le p-sous-niveau est rempli. Les éléments p comprennent les six derniers éléments de chaque période, à l'exception des premier et septième, ainsi que des éléments des principaux sous-groupes des groupes III-VIII.
- les éléments d sont situés entre les éléments s et p dans les grandes périodes.
- Les éléments F sont appelés lanthanides et actinides. Ils sont placés en bas du tableau par D.I. Mendeleev.
La composition de l'atome.
Un atome est composé de noyau atomique et coquille d'électrons.
Le noyau d'un atome est constitué de protons ( p+) et neutrons ( n 0). La plupart des atomes d'hydrogène ont un seul noyau de proton.
Nombre de protons N(p+) est égal à la charge nucléaire ( Z) et le nombre ordinal de l'élément dans la série naturelle des éléments (et dans le système périodique des éléments).
N(p +) = Z
La somme du nombre de neutrons N(n 0), désigné simplement par la lettre N, et le nombre de protons Z appelé nombre de masse et est marqué de la lettre MAIS.
UN = Z + N
La couche d'électrons d'un atome est constituée d'électrons se déplaçant autour du noyau ( e -).
Nombre d'électrons N(e-) dans la couche électronique d'un atome neutre est égal au nombre de protons Z en son coeur.
La masse d'un proton est approximativement égale à la masse d'un neutron et 1840 fois la masse d'un électron, donc la masse d'un atome est pratiquement égale à la masse du noyau.
La forme d'un atome est sphérique. Le rayon du noyau est environ 100 000 fois plus petit que le rayon de l'atome.
Élément chimique- type d'atomes (ensemble d'atomes) de même charge nucléaire (avec le même nombre de protons dans le noyau).
Isotope- un ensemble d'atomes d'un élément avec le même nombre de neutrons dans le noyau (ou un type d'atomes avec le même nombre de protons et le même nombre de neutrons dans le noyau).
Différents isotopes diffèrent les uns des autres par le nombre de neutrons dans le noyau de leurs atomes.
Désignation d'un seul atome ou isotope : (symbole de l'élément E), par exemple : .
La structure de la couche électronique de l'atome
orbitale atomique est l'état d'un électron dans un atome. Symbole orbital - . Chaque orbitale correspond à un nuage d'électrons.
Les orbitales des atomes réels à l'état fondamental (non excité) sont de quatre types : s, p, ré et F.
nuage électronique- la partie de l'espace dans laquelle un électron peut être trouvé avec une probabilité de 90 (ou plus) pour cent.
Noter: parfois les concepts d'"orbite atomique" et de "nuage d'électrons" ne sont pas distingués, les appelant tous les deux "orbite atomique".
La couche électronique d'un atome est en couches. Couche électronique formé par des nuages d'électrons de même taille. Orbitales d'une forme de couche niveau électronique ("énergie"), leurs énergies sont les mêmes pour l'atome d'hydrogène, mais différentes pour les autres atomes.
Les orbitales de même niveau sont regroupées en électronique (énergie) sous-niveaux :
s- sous-niveau (composé d'un s-orbitales), symbole - .
p sous-niveau (composé de trois p
ré sous-niveau (composé de cinq ré-orbitales), symbole - .
F sous-niveau (se compose de sept F-orbitales), symbole - .
Les énergies des orbitales d'un même sous-niveau sont les mêmes.
Lors de la désignation des sous-niveaux, le numéro de la couche (niveau électronique) est ajouté au symbole du sous-niveau, par exemple : 2 s, 3p, 5ré moyens s- sous-niveau du deuxième niveau, p- sous-niveau du troisième niveau, ré- sous-niveau du cinquième niveau.
Le nombre total de sous-niveaux dans un niveau est égal au nombre de niveaux n. Le nombre total d'orbitales dans un niveau est n 2. En conséquence, le nombre total de nuages dans une couche est également n 2 .
Désignations : - orbitale libre (sans électrons), - orbitale avec un électron non apparié, - orbitale avec une paire d'électrons (avec deux électrons).
L'ordre dans lequel les électrons remplissent les orbitales d'un atome est déterminé par trois lois de la nature (les formulations sont données de manière simplifiée) :
1. Le principe de moindre énergie - les électrons remplissent les orbitales par ordre croissant d'énergie des orbitales.
2. Principe de Pauli - il ne peut y avoir plus de deux électrons dans une orbitale.
3. Règle de Hund - dans le sous-niveau, les électrons remplissent d'abord les orbitales libres (une à la fois), et seulement après cela, ils forment des paires d'électrons.
Le nombre total d'électrons dans le niveau électronique (ou dans la couche électronique) est de 2 n 2 .
La répartition des sous-niveaux par énergie s'exprime ensuite (par ordre croissant d'énergie) :
1s, 2s, 2p, 3s, 3p, 4s, 3ré, 4p, 5s, 4ré, 5p, 6s, 4F, 5ré, 6p, 7s, 5F, 6ré, 7p ...
Visuellement, cette séquence est exprimée par le diagramme énergétique :

La distribution des électrons d'un atome par niveaux, sous-niveaux et orbitales (la configuration électronique d'un atome) peut être décrite comme une formule électronique, un diagramme d'énergie ou, plus simplement, comme un diagramme de couches électroniques ("diagramme électronique") .
Exemples de structure électronique des atomes :










électrons de valence- les électrons d'un atome pouvant participer à la formation de liaisons chimiques. Pour tout atome, ce sont tous les électrons externes plus les électrons pré-externes dont l'énergie est supérieure à celle des électrons externes. Par exemple : l'atome de Ca a 4 électrons externes s 2, ils sont aussi de valence ; l'atome Fe a des électrons externes - 4 s 2 mais il en a 3 ré 6, donc l'atome de fer a 8 électrons de valence. La formule électronique de valence de l'atome de calcium est 4 s 2, et atomes de fer - 4 s 2 3ré 6 .
Système périodique des éléments chimiques de D. I. Mendeleïev
(système naturel d'éléments chimiques)
Loi périodique des éléments chimiques(formulation moderne): les propriétés des éléments chimiques, ainsi que des substances simples et complexes formées par eux, dépendent périodiquement de la valeur de la charge des noyaux atomiques.
Système périodique- expression graphique de la loi périodique.
Gamme naturelle d'éléments chimiques- un nombre d'éléments chimiques, rangés selon l'augmentation du nombre de protons dans les noyaux de leurs atomes, ou, ce qui revient au même, selon l'augmentation des charges des noyaux de ces atomes. Le numéro de série d'un élément de cette série est égal au nombre de protons dans le noyau de tout atome de cet élément.
Le tableau des éléments chimiques est construit en "découpant" la série naturelle des éléments chimiques en périodes(lignes horizontales du tableau) et groupements (colonnes verticales du tableau) d'éléments ayant une structure électronique similaire d'atomes.
Selon la manière dont les éléments sont combinés en groupes, un tableau peut être longue période(les éléments avec le même nombre et le même type d'électrons de valence sont collectés en groupes) et court terme(les éléments avec le même nombre d'électrons de valence sont rassemblés en groupes).
Les groupes du tableau de courte période sont divisés en sous-groupes ( principale et Effets secondaires), coïncidant avec les groupes du tableau de longue période.
Tous les atomes d'éléments d'une même période ont le même nombre de couches d'électrons, égal au nombre de la période.
Le nombre d'éléments dans les périodes : 2, 8, 8, 18, 18, 32, 32. La plupart des éléments de la huitième période ont été obtenus artificiellement, les derniers éléments de cette période n'ont pas encore été synthétisés. Toutes les périodes sauf la première commencent par un élément formant un métal alcalin (Li, Na, K, etc.) et se terminent par un élément formant un gaz rare (He, Ne, Ar, Kr, etc.).
Dans le tableau à courte période - huit groupes, chacun étant divisé en deux sous-groupes (principal et secondaire), dans le tableau à longue période - seize groupes, qui sont numérotés en chiffres romains avec les lettres A ou B, par exemple : IA, IIIB, VIA, VIIB. Le groupe IA du tableau longue période correspond au sous-groupe principal du premier groupe du tableau courte période ; groupe VIIB - sous-groupe secondaire du septième groupe : le reste - de la même manière.
Les caractéristiques des éléments chimiques changent naturellement en groupes et en périodes.
Par périodes (avec numéro de série croissant)
- la charge nucléaire augmente
- le nombre d'électrons externes augmente,
- le rayon des atomes diminue,
- la force de liaison des électrons avec le noyau augmente (énergie d'ionisation),
- l'électronégativité augmente.
- les propriétés oxydantes des substances simples sont renforcées ("non métallicité"),
- les propriétés réductrices des substances simples (« métallicité ») s'affaiblissent,
- affaiblit le caractère basique des hydroxydes et des oxydes correspondants,
- le caractère acide des hydroxydes et des oxydes correspondants augmente.
En groupe (avec numéro de série croissant)
- la charge nucléaire augmente
- le rayon des atomes augmente (uniquement dans les groupes A),
- la force de la liaison entre les électrons et le noyau diminue (énergie d'ionisation ; uniquement dans les groupes A),
- l'électronégativité diminue (uniquement dans les groupes A),
- affaiblir les propriétés oxydantes des substances simples ("non-métallicité" ; uniquement dans les groupes A),
- les propriétés réductrices des substances simples sont renforcées (« métallicité » ; uniquement dans les groupes A),
- le caractère basique des hydroxydes et des oxydes correspondants augmente (uniquement dans les groupes A),
- la nature acide des hydroxydes et des oxydes correspondants s'affaiblit (uniquement dans les groupes A),
- la stabilité des composés hydrogène diminue (leur activité réductrice augmente ; uniquement dans les groupes A).
Tâches et tests sur le thème "Thème 9. "La structure de l'atome. Loi périodique et système périodique des éléments chimiques de D. I. Mendeleïev (PSCE)"."
- Loi périodique - Loi périodique et structure des atomes Grade 8–9
Vous devez connaître: les lois de remplissage des orbitales avec des électrons (principe de moindre énergie, principe de Pauli, règle de Hund), la structure du système périodique des éléments.Vous devez être capable de : déterminer la composition d'un atome par la position d'un élément dans le système périodique, et, inversement, trouver un élément dans le système périodique en connaissant sa composition ; représenter le schéma de structure, la configuration électronique d'un atome, d'un ion, et, inversement, déterminer la position d'un élément chimique dans le PSCE à partir du schéma et de la configuration électronique ; caractériser l'élément et les substances qu'il forme selon sa position dans le PSCE ; déterminer les changements dans le rayon des atomes, les propriétés des éléments chimiques et les substances qu'ils forment au cours d'une période et d'un sous-groupe principal du système périodique.
Exemple 1 Déterminez le nombre d'orbitales dans le troisième niveau électronique. Quelles sont ces orbitales ?
Pour déterminer le nombre d'orbitales, on utilise la formule N orbitales = n 2 , où n- numéro de niveau. N orbitales = 3 2 = 9. Un 3 s-, trois 3 p- et cinq 3 ré-orbitales.Exemple 2 Déterminer l'atome dont l'élément a la formule électronique 1 s 2 2s 2 2p 6 3s 2 3p 1 .
Afin de déterminer de quel élément il s'agit, vous devez connaître son numéro de série, qui est égal au nombre total d'électrons dans l'atome. Dans ce cas : 2 + 2 + 6 + 2 + 1 = 13. C'est de l'aluminium.Après vous être assuré que tout ce dont vous avez besoin est appris, passez aux tâches. Nous vous souhaitons du succès.
Littérature recommandée :- O. S. Gabrielyan et autres Chimie, 11e année. M., Outarde, 2002 ;
- G.E. Rudzitis, F.G. Feldman. Chimie 11 cellules. M., Éducation, 2001.
Configuration électronique d'un atome est une formule montrant l'arrangement des électrons dans un atome par niveaux et sous-niveaux. Après avoir étudié l'article, vous découvrirez où et comment se trouvent les électrons, vous familiariserez avec les nombres quantiques et pourrez construire la configuration électronique d'un atome par son numéro, à la fin de l'article se trouve un tableau des éléments.
Pourquoi étudier la configuration électronique des éléments ?
Les atomes sont comme un constructeur : il y a un certain nombre de parties, elles diffèrent les unes des autres, mais deux parties de même type sont exactement pareilles. Mais ce constructeur est bien plus intéressant que celui en plastique, et voici pourquoi. La configuration change en fonction de qui se trouve à proximité. Par exemple, l'oxygène à côté de l'hydrogène peut être transformer en eau, à côté du sodium en gaz, et être à côté du fer le transforme complètement en rouille. Pour répondre à la question de savoir pourquoi cela se produit et pour prédire le comportement d'un atome à côté d'un autre, il est nécessaire d'étudier la configuration électronique, qui sera discutée ci-dessous.
Combien y a-t-il d'électrons dans un atome ?
Un atome est constitué d'un noyau et d'électrons qui tournent autour de lui, le noyau est constitué de protons et de neutrons. A l'état neutre, chaque atome a le même nombre d'électrons que le nombre de protons dans son noyau. Le nombre de protons était indiqué par le numéro de série de l'élément, par exemple, le soufre a 16 protons - le 16ème élément du système périodique. L'or a 79 protons - le 79e élément du tableau périodique. En conséquence, il y a 16 électrons dans le soufre à l'état neutre et 79 électrons dans l'or.
Où chercher un électron ?
En observant le comportement d'un électron, certains motifs ont été dérivés, ils sont décrits par des nombres quantiques, il y en a quatre au total :
- Nombre quantique principal
- Nombre quantique orbital
- Nombre quantique magnétique
- Nombre quantique de spin
Orbital
De plus, au lieu du mot orbite, nous utiliserons le terme "orbitale", l'orbitale est la fonction d'onde de l'électron, en gros - c'est la zone dans laquelle l'électron passe 90% du temps.
N - niveau
L - coque
M l - numéro orbital
M s - le premier ou le deuxième électron de l'orbite
Nombre quantique orbital l
À la suite de l'étude du nuage d'électrons, il a été constaté qu'en fonction du niveau d'énergie, le nuage prend quatre formes principales : une boule, des haltères et les deux autres, plus complexes. Par ordre croissant d'énergie, ces formes sont appelées coquilles s, p, d et f. Chacune de ces coquilles peut avoir 1 (sur s), 3 (sur p), 5 (sur d) et 7 (sur f) orbitales. Le nombre quantique orbital est la coquille sur laquelle se trouvent les orbitales. Le nombre quantique orbital pour les orbitales s, p, d et f, respectivement, prend les valeurs 0,1,2 ou 3.
Sur la couche s une orbitale (L=0) - deux électrons
Il y a trois orbitales sur la couche p (L=1) - six électrons
Il y a cinq orbitales sur la couche d (L=2) - dix électrons
Il y a sept orbitales (L = 3) sur la f-shell - quatorze électrons
Nombre quantique magnétique m l
Il y a trois orbitales sur la p-shell, elles sont désignées par des nombres de -L à +L, c'est-à-dire que pour la p-shell (L=1) il y a des orbitales "-1", "0" et "1" . Le nombre quantique magnétique est désigné par la lettre m l .
À l'intérieur de la coquille, il est plus facile pour les électrons d'être situés dans différentes orbitales, de sorte que les premiers électrons en remplissent un pour chaque orbitale, puis sa paire est ajoutée à chacune.
Considérez un d-shell :
La d-shell correspond à la valeur L=2, soit cinq orbitales (-2,-1,0,1 et 2), les cinq premiers électrons remplissent la coquille, en prenant les valeurs M l =-2, M l =-1, M l =0 , M l =1, M l =2.
Nombre quantique de spin m s
Le spin est le sens de rotation d'un électron autour de son axe, il y a deux sens, donc le nombre quantique de spin a deux valeurs : +1/2 et -1/2. Seuls deux électrons avec des spins opposés peuvent être sur le même sous-niveau d'énergie. Le nombre quantique de spin est noté m s
Nombre quantique principal n
Le nombre quantique principal est le niveau d'énergie, à l'heure actuelle sept niveaux d'énergie sont connus, chacun étant désigné par un chiffre arabe : 1,2,3,...7. Le nombre de coquillages à chaque niveau est égal au numéro du niveau : il y a un coquillage au premier niveau, deux au second, et ainsi de suite.
Numéro d'électron

Ainsi, tout électron peut être décrit par quatre nombres quantiques, la combinaison de ces nombres est unique pour chaque position de l'électron, prenons le premier électron, le niveau d'énergie le plus bas est N=1, une coquille est située au premier niveau, la première coquille à n'importe quel niveau a la forme d'une balle (s -shell), c'est-à-dire L=0, le nombre quantique magnétique ne pourra prendre qu'une valeur, M l =0 et le spin sera égal à +1/2. Si nous prenons le cinquième électron (quel que soit son atome), alors ses principaux nombres quantiques seront : N=2, L=1, M=-1, spin 1/2.
Atome- une particule électriquement neutre constituée d'un noyau chargé positivement et d'électrons chargés négativement. Au centre d'un atome se trouve un noyau chargé positivement. Il occupe une partie insignifiante de l'espace à l'intérieur de l'atome ; toute la charge positive et presque toute la masse de l'atome y sont concentrées.
Le noyau est constitué de particules élémentaires - proton et neutron; Les électrons se déplacent autour du noyau atomique dans des orbitales fermées.
Protons (p)- une particule élémentaire avec une masse relative de 1,00728 unités de masse atomique et une charge de +1 unité conventionnelle. Le nombre de protons dans le noyau atomique est égal au numéro de série de l'élément dans le système périodique de D.I. Mendeleev.
Neutron (n)- une particule neutre élémentaire avec une masse relative de 1,00866 unité de masse atomique (a.m.u.).
Le nombre de neutrons dans le noyau N est déterminé par la formule :
![]()
où A est le nombre de masse, Z est la charge du noyau, égale au nombre de protons (numéro de série).
Habituellement, les paramètres du noyau d'un atome s'écrivent comme suit : la charge du noyau est placée en bas à gauche du symbole de l'élément, et le nombre de masse est placé en haut, par exemple :
Cette entrée montre que la charge nucléaire (d'où le nombre de protons) pour un atome de phosphore est de 15, le nombre de masse est de 31 et le nombre de neutrons est de 31 - 15 = 16. Puisque les masses du proton et du neutron diffèrent très peu les uns des autres, la masse le nombre est approximativement égale à la masse atomique relative du noyau.
Électron (e -)- une particule élémentaire de masse 0,00055 a. e.m. et charge conditionnelle –1. Le nombre d'électrons dans un atome est égal à la charge du noyau atomique (le numéro de série de l'élément dans le système périodique de D.I. Mendeleev).
Les électrons se déplacent autour du noyau sur des orbites strictement définies, formant ce que l'on appelle le nuage d'électrons.
La région de l'espace autour du noyau atomique, où l'électron est le plus susceptible de se trouver (90 % ou plus), détermine la forme du nuage d'électrons.
Le nuage d'électrons de l'électron s a une forme sphérique ; le sous-niveau d'énergie s peut avoir un maximum de deux électrons.
Le nuage d'électrons de l'électron p est en forme d'haltère ; Trois orbitales p peuvent contenir un maximum de six électrons.
Les orbitales sont représentées par un carré, au-dessus ou au-dessous duquel elles écrivent les valeurs des nombres quantiques principaux et secondaires qui décrivent cette orbitale. Un tel enregistrement est appelé une formule électronique graphique, par exemple :

Dans cette formule, les flèches désignent un électron et la direction de la flèche correspond à la direction du spin - le moment magnétique intrinsèque de l'électron. Les électrons de spins opposés ↓ sont dits appariés.
Les configurations électroniques des atomes d'éléments peuvent être représentées par des formules électroniques, dans lesquelles les symboles de sous-niveau sont indiqués, le coefficient devant le symbole de sous-niveau indique son appartenance à ce niveau et le degré du symbole indique le nombre d'électrons de ce niveau. sous-niveau.
Le tableau 1 montre la structure des couches d'électrons des atomes des 20 premiers éléments du tableau périodique des éléments chimiques de D.I. Mendeleev.
Les éléments chimiques dans les atomes desquels le sous-niveau s du niveau externe est reconstitué avec un ou deux électrons sont appelés éléments s. Les éléments chimiques dans les atomes desquels le sous-niveau p (de un à six électrons) est rempli sont appelés éléments p.
Le nombre de couches d'électrons dans un atome d'un élément chimique est égal au nombre de périodes.
Selon règle de Hund les électrons sont situés dans des orbitales de même type et de même niveau d'énergie de telle sorte que le spin total soit maximal. Par conséquent, lors du remplissage du sous-niveau d'énergie, chaque électron occupe d'abord une cellule séparée, et seulement après cela, leur appariement commence. Par exemple, pour un atome d'azote, tous les électrons p seront dans des cellules séparées, et pour l'oxygène, leur appariement commencera, ce qui se terminera complètement en néon.


isotopes appelés atomes d'un même élément, contenant dans leur noyau le même nombre de protons, mais un nombre différent de neutrons.
Les isotopes sont connus pour tous les éléments. Par conséquent, les masses atomiques des éléments du système périodique sont la valeur moyenne des nombres de masse des mélanges naturels d'isotopes et diffèrent des valeurs entières. Ainsi, la masse atomique d'un mélange naturel d'isotopes ne peut servir de caractéristique principale d'un atome, et, par conséquent, d'un élément. Une telle caractéristique d'un atome est la charge nucléaire, qui détermine le nombre d'électrons dans la couche d'électrons de l'atome et sa structure.
Examinons quelques tâches typiques dans cette section.
Exemple 1 Quel élément atome a la configuration électronique 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ?
Cet élément a un électron 4s dans son niveau d'énergie externe. Par conséquent, cet élément chimique est dans la quatrième période du premier groupe du sous-groupe principal. Cet élément est le potassium.
Cette réponse peut être apportée d'une manière différente. En ajoutant le nombre total de tous les électrons, nous obtenons 19. Le nombre total d'électrons est égal au numéro atomique de l'élément. Le potassium est le numéro 19 dans le tableau périodique.
Exemple 2 L'oxyde RO 2 le plus élevé correspond à l'élément chimique. La configuration électronique du niveau d'énergie externe de l'atome de cet élément correspond à la formule électronique :
- ns 2 np 4
- ns 2 np 2
- ns 2 np 3
- ns 2 np 6
Selon la formule de l'oxyde le plus élevé (regardez les formules des oxydes les plus élevés du système périodique), nous établissons que cet élément chimique appartient au quatrième groupe du sous-groupe principal. Ces éléments ont quatre électrons dans leur niveau d'énergie externe - deux s et deux p. La bonne réponse est donc 2.
Tâches de formation
1. Le nombre total d'électrons s dans un atome de calcium est
1) 20
2) 40
3) 8
4) 6
2. Le nombre d'électrons p appariés dans un atome d'azote est
1) 7
2) 14
3) 3
4) 4
3. Le nombre d'électrons s non appariés dans un atome d'azote est
1) 7
2) 14
3) 3
4) 4
4. Le nombre d'électrons dans le niveau d'énergie externe d'un atome d'argon est
1) 18
2) 6
3) 4
4) 8
5. Le nombre de protons, de neutrons et d'électrons dans l'atome 9 4 Be est
1) 9, 4, 5
2) 4, 5, 4
3) 4, 4, 5
4) 9, 5, 9
6. Répartition des électrons sur les couches d'électrons 2 ; huit; 4 - correspond à l'atome situé dans (in)
1) 3e période, groupe IA
2) 2ème période, groupe IVA
3) 3ème période, groupe IVA
4) 3e période, groupe VA
7. L'élément chimique situé dans la 3ème période du groupe VA correspond au schéma de la structure électronique de l'atome
1) 2, 8, 6
2) 2, 6, 4
3) 2, 8, 5
4) 2, 8, 2
8. Un élément chimique de configuration électronique 1s 2 2s 2 2p 4 forme un composé hydrogène volatil dont la formule est
1) FR
2) EN 2
3) FR 3
4) FR 4
9. Le nombre de couches d'électrons dans un atome d'un élément chimique est
1) son numéro de série
2) numéro de groupe
3) le nombre de neutrons dans le noyau
4) numéro de période
10. Le nombre d'électrons externes dans les atomes d'éléments chimiques des principaux sous-groupes est
1) le numéro de série de l'élément
2) numéro de groupe
3) le nombre de neutrons dans le noyau
4) numéro de période
11. Deux électrons se trouvent dans la couche d'électrons externe des atomes de chacun des éléments chimiques de la série
1) Il, Sois, Ba
2) Mg, Si, O
3) C, Mg, Ca
4) Ba, Sr, B
12. Un élément chimique dont la formule électronique est 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 forme un oxyde de la composition
1) Li2O
2) MgO
3) K2O
4) Na2O
13. Le nombre de couches d'électrons et le nombre d'électrons p dans un atome de soufre est
1) 2, 6
2) 3, 4
3) 3, 16
4) 3, 10
14. La configuration électronique ns 2 np 4 correspond à l'atome
1) chlore
2) soufre
3) magnésium
4) silicium
15. Les électrons de valence de l'atome de sodium à l'état fondamental sont au sous-niveau d'énergie
1) 2s
2) 2p
3) 3s
4) 3p
16. Les atomes d'azote et de phosphore ont
1) le même nombre de neutrons
2) le même nombre de protons
3) la même configuration de la couche électronique externe
17. Les atomes de calcium ont le même nombre d'électrons de valence
1) potassium
2) aluminium
3) béryllium
4) le bore
18. Les atomes de carbone et de fluor ont
1) le même nombre de neutrons
2) le même nombre de protons
3) le même nombre de couches électroniques
4) le même nombre d'électrons
19. Au niveau de l'atome de carbone à l'état fondamental, le nombre d'électrons non appariés est
1) 1
3) 3
2) 2
4) 4
20. Dans l'atome d'oxygène à l'état fondamental, le nombre d'électrons appariés est
Électrons
Le concept d'atome est né dans le monde antique pour désigner les particules de matière. En grec, atome signifie « indivisible ».

Le physicien irlandais Stoney, sur la base d'expériences, est arrivé à la conclusion que l'électricité est transportée par les plus petites particules qui existent dans les atomes de tous les éléments chimiques. En 1891, Stoney proposa d'appeler ces particules des électrons, ce qui en grec signifie « ambre ». Quelques années après que l'électron ait reçu son nom, le physicien anglais Joseph Thomson et le physicien français Jean Perrin ont prouvé que les électrons portent une charge négative. C'est la plus petite charge négative, qui en chimie est considérée comme une unité (-1). Thomson a même réussi à déterminer la vitesse de l'électron (la vitesse d'un électron en orbite est inversement proportionnelle au nombre d'orbites n. Les rayons des orbites croissent proportionnellement au carré du nombre d'orbites. Dans la première orbite de l'hydrogène atome (n=1; Z=1), la vitesse est ≈ 2,2 106 m / c, soit environ cent fois inférieure à la vitesse de la lumière c=3 108 m/s.) et la masse d'un électron ( c'est presque 2000 fois moins que la masse d'un atome d'hydrogène).

L'état des électrons dans un atome
L'état d'un électron dans un atome est un ensemble d'informations sur l'énergie d'un électron particulier et l'espace dans lequel il se trouve. Un électron dans un atome n'a pas de trajectoire de mouvement, c'est-à-dire qu'on ne peut parler que de la probabilité de le trouver dans l'espace autour du noyau.
 Il peut être situé dans n'importe quelle partie de cet espace entourant le noyau, et la totalité de ses différentes positions est considérée comme un nuage d'électrons avec une certaine densité de charge négative. Au sens figuré, cela peut être imaginé comme suit : s'il était possible de photographier la position d'un électron dans un atome en centièmes ou en millionièmes de seconde, comme dans une photo-finish, alors l'électron sur de telles photographies serait représenté sous forme de points. La superposition d'innombrables photographies de ce type donnerait une image d'un nuage d'électrons avec la densité la plus élevée où il y aura la plupart de ces points.
Il peut être situé dans n'importe quelle partie de cet espace entourant le noyau, et la totalité de ses différentes positions est considérée comme un nuage d'électrons avec une certaine densité de charge négative. Au sens figuré, cela peut être imaginé comme suit : s'il était possible de photographier la position d'un électron dans un atome en centièmes ou en millionièmes de seconde, comme dans une photo-finish, alors l'électron sur de telles photographies serait représenté sous forme de points. La superposition d'innombrables photographies de ce type donnerait une image d'un nuage d'électrons avec la densité la plus élevée où il y aura la plupart de ces points.
L'espace autour du noyau atomique, dans lequel l'électron est le plus susceptible de se trouver, s'appelle l'orbite. Il contient environ 90 % de nuage électronique, et cela signifie qu'environ 90 % du temps, l'électron se trouve dans cette partie de l'espace. Se distingue par sa forme 4 types d'orbitales actuellement connus, qui sont désignés par le latin lettres s, p, d et f. Une représentation graphique de certaines formes d'orbitales électroniques est montrée dans la figure.

La caractéristique la plus importante du mouvement d'un électron sur une certaine orbite est l'énergie de sa connexion avec le noyau. Les électrons avec des valeurs d'énergie similaires forment une seule couche d'électrons, ou niveau d'énergie. Les niveaux d'énergie sont numérotés à partir du noyau - 1, 2, 3, 4, 5, 6 et 7.
Un entier n, désignant le numéro du niveau d'énergie, est appelé le nombre quantique principal. Il caractérise l'énergie des électrons occupant un niveau d'énergie donné. Les électrons du premier niveau d'énergie, les plus proches du noyau, ont l'énergie la plus faible. Par rapport aux électrons du premier niveau, les électrons des niveaux suivants seront caractérisés par une grande quantité d'énergie. Par conséquent, les électrons du niveau externe sont les moins fortement liés au noyau de l'atome.
Le plus grand nombre d'électrons dans le niveau d'énergie est déterminé par la formule :
N = 2n2,
où N est le nombre maximal d'électrons ; n est le numéro de niveau, ou le nombre quantique principal. Par conséquent, le premier niveau d'énergie le plus proche du noyau ne peut contenir plus de deux électrons ; sur le second - pas plus de 8; le troisième - pas plus de 18 ; le quatrième - pas plus de 32.
À partir du deuxième niveau d'énergie (n = 2), chacun des niveaux est subdivisé en sous-niveaux (sous-couches), qui diffèrent quelque peu les uns des autres par l'énergie de liaison avec le noyau. Le nombre de sous-niveaux est égal à la valeur du nombre quantique principal : le premier niveau d'énergie a un sous-niveau ; le deuxième - deux; troisième - trois ; quatrième - quatre sous-niveaux. Les sous-niveaux, à leur tour, sont formés par des orbitales. Chaque valeurn correspond au nombre d'orbitales égal à n.
Il est d'usage de désigner les sous-niveaux en lettres latines, ainsi que la forme des orbitales qui les composent : s, p, d, f.

Protons et neutrons

Un atome de n'importe quel élément chimique est comparable à un minuscule système solaire. Par conséquent, un tel modèle de l'atome, proposé par E. Rutherford, est appelé planétaire.
Le noyau atomique, dans lequel toute la masse de l'atome est concentrée, est constitué de particules de deux types - protons et neutrons.
Les protons ont une charge égale à la charge des électrons, mais de signe opposé (+1), et une masse égale à la masse d'un atome d'hydrogène (elle est acceptée en chimie comme une unité). Les neutrons ne portent aucune charge, ils sont neutres et ont une masse égale à celle d'un proton.
Les protons et les neutrons sont collectivement appelés nucléons (du latin noyau - noyau). La somme du nombre de protons et de neutrons dans un atome s'appelle le nombre de masse. Par exemple, le nombre de masse d'un atome d'aluminium :

13 + 14 = 27
nombre de protons 13, nombre de neutrons 14, nombre de masse 27
Comme la masse de l'électron, qui est négligeable, peut être négligée, il est évident que toute la masse de l'atome est concentrée dans le noyau. Les électrons représentent e - .
Parce que l'atome électriquement neutre, il est également évident que le nombre de protons et d'électrons dans un atome est le même. Il est égal au numéro de série de l'élément chimique qui lui est attribué dans le système périodique. La masse d'un atome est constituée de la masse des protons et des neutrons. Connaissant le numéro de série de l'élément (Z), c'est-à-dire le nombre de protons, et le nombre de masse (A), égal à la somme des nombres de protons et de neutrons, vous pouvez trouver le nombre de neutrons (N) à l'aide de la formule:

N=A-Z
Par exemple, le nombre de neutrons dans un atome de fer est :
56 — 26 = 30
isotopes
Les variétés d'atomes d'un même élément qui ont la même charge nucléaire mais des nombres de masse différents sont appelées isotopes. Les éléments chimiques trouvés dans la nature sont un mélange d'isotopes. Ainsi, le carbone a trois isotopes avec une masse de 12, 13, 14 ; oxygène - trois isotopes de masse 16, 17, 18, etc. La masse atomique relative d'un élément chimique généralement donnée dans le système périodique est la valeur moyenne des masses atomiques d'un mélange naturel d'isotopes d'un élément donné, en prenant compte tenu de leur contenu relatif dans la nature. Les propriétés chimiques des isotopes de la plupart des éléments chimiques sont exactement les mêmes. Cependant, les propriétés des isotopes de l'hydrogène diffèrent considérablement en raison de l'augmentation spectaculaire de leur masse atomique relative; ils ont même reçu des noms individuels et des symboles chimiques.

Éléments de la première période
Schéma de la structure électronique de l'atome d'hydrogène :

Les schémas de la structure électronique des atomes montrent la distribution des électrons sur les couches électroniques (niveaux d'énergie).

La formule électronique graphique de l'atome d'hydrogène (montre la distribution des électrons sur les niveaux et sous-niveaux d'énergie):

Les formules électroniques graphiques des atomes montrent la distribution des électrons non seulement en niveaux et sous-niveaux, mais aussi en orbites.
Dans un atome d'hélium, la première couche d'électrons est terminée - elle a 2 électrons. L'hydrogène et l'hélium sont des éléments s; pour ces atomes, l'orbitale s est remplie d'électrons.

Tous les éléments de la deuxième période la première couche d'électrons est remplie, et les électrons remplissent les orbitales s et p de la deuxième couche d'électrons conformément au principe de moindre énergie (d'abord s, puis p) et aux règles de Pauli et Hund.
Dans l'atome de néon, la deuxième couche d'électrons est terminée - elle a 8 électrons.
Pour les atomes d'éléments de la troisième période, les première et deuxième couches d'électrons sont terminées, de sorte que la troisième couche d'électrons est remplie, dans laquelle les électrons peuvent occuper les sous-niveaux 3s, 3p et 3d.
Une orbitale d'électrons 3s est complétée au niveau de l'atome de magnésium. Na et Mg sont des éléments s.
Pour l'aluminium et les éléments suivants, le sous-niveau 3p est rempli d'électrons.
Les éléments de la troisième période ont des orbitales 3d non remplies.
Tous les éléments de Al à Ar sont des p-éléments. Les éléments s et p forment les principaux sous-groupes du système périodique.

Éléments de la quatrième à la septième période
Une quatrième couche d'électrons apparaît au niveau des atomes de potassium et de calcium, le sous-niveau 4s est rempli, car il a moins d'énergie que le sous-niveau 3d.
K, Ca - éléments s inclus dans les principaux sous-groupes. Pour les atomes de Sc à Zn, le sous-niveau 3d est rempli d'électrons. Ce sont des éléments 3D. Ils sont inclus dans les sous-groupes secondaires, ils ont une couche électronique pré-externe remplie, ils sont appelés éléments de transition.
Faites attention à la structure des couches d'électrons des atomes de chrome et de cuivre. En eux, une "défaillance" d'un électron du sous-niveau 4s au sous-niveau 3d se produit, ce qui s'explique par la plus grande stabilité énergétique des configurations électroniques résultantes 3d 5 et 3d 10 :

Dans l'atome de zinc, la troisième couche d'électrons est terminée - tous les sous-niveaux 3s, 3p et 3d y sont remplis, au total il y a 18 électrons dessus. Dans les éléments suivant le zinc, la quatrième couche d'électrons continue d'être remplie, le sous-niveau 4p.
Les éléments de Ga à Kr sont des p-éléments.
La couche externe (quatrième) de l'atome de krypton est complète et possède 8 électrons. Mais il ne peut y avoir que 32 électrons dans la quatrième couche d'électrons ; les sous-niveaux 4d et 4f de l'atome de krypton restent encore vides.Les éléments de la cinquième période remplissent les sous-niveaux dans l'ordre suivant : 5s - 4d - 5p. Et il y a aussi des exceptions liées à " échec» électrons, y 41 Nb, 42 Mo, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
Dans les sixième et septième périodes, des éléments f apparaissent, c'est-à-dire des éléments dans lesquels les sous-niveaux 4f et 5f de la troisième couche électronique externe sont remplis, respectivement.
Les éléments 4f sont appelés lanthanides.
Les éléments 5f sont appelés actinides.
L'ordre de remplissage des sous-niveaux électroniques dans les atomes des éléments de la sixième période: 55 Cs et 56 Ba - 6s-éléments; 57 La … 6s 2 5d x - élément 5d ; 58 Ce - 71 Lu - éléments 4f ; 72 Hf - 80 Hg - éléments 5d ; 81 T1 - 86 Rn - éléments 6d. Mais même ici, il existe des éléments dans lesquels l'ordre de remplissage des orbitales électroniques est «violé», ce qui, par exemple, est associé à une plus grande stabilité énergétique des sous-niveaux f à moitié et complètement remplis, c'est-à-dire nf 7 et nf 14. Selon le sous-niveau de l'atome qui est rempli d'électrons en dernier, tous les éléments sont divisés en quatre familles électroniques, ou blocs :
- éléments s. Le sous-niveau s du niveau externe de l'atome est rempli d'électrons; les éléments s comprennent l'hydrogène, l'hélium et les éléments des principaux sous-groupes des groupes I et II.
- p-éléments. Le sous-niveau p du niveau externe de l'atome est rempli d'électrons; Les éléments p comprennent les éléments des sous-groupes principaux des groupes III-VIII.
- éléments d. Le sous-niveau d du niveau préexterne de l'atome est rempli d'électrons; Les éléments d comprennent les éléments des sous-groupes secondaires des groupes I à VIII, c'est-à-dire les éléments des décennies intercalaires de grandes périodes situées entre les éléments s et p. Ils sont aussi appelés éléments de transition.
- éléments f. Le sous-niveau f du troisième niveau extérieur de l'atome est rempli d'électrons ; ceux-ci comprennent les lanthanides et les antinoïdes.

Le physicien suisse W. Pauli en 1925 a établi que dans un atome d'une orbitale, il ne peut y avoir plus de deux électrons ayant des spins opposés (antiparallèles) (traduit de l'anglais - "broche"), c'est-à-dire ayant des propriétés qui peuvent être conditionnellement imaginées comme la rotation d'un électron autour de son axe imaginaire : dans le sens des aiguilles d'une montre ou dans le sens inverse des aiguilles d'une montre.

Ce principe s'appelle Principe de Pauli. S'il y a un électron dans l'orbite, alors on l'appelle non apparié, s'il y en a deux, alors ce sont des électrons appariés, c'est-à-dire des électrons avec des spins opposés. La figure montre un diagramme de la division des niveaux d'énergie en sous-niveaux et l'ordre dans lequel ils sont remplis.


Très souvent, la structure des coquilles d'électrons des atomes est représentée à l'aide de cellules énergétiques ou quantiques - elles écrivent les formules électroniques dites graphiques. Pour cet enregistrement, la notation suivante est utilisée : chaque cellule quantique est désignée par une cellule qui correspond à une orbitale ; chaque électron est indiqué par une flèche correspondant au sens du spin. Lors de l'écriture d'une formule électronique graphique, deux règles sont à retenir : Principe de Pauli et règle de F. Hund, selon lequel les électrons occupent les cellules libres, d'abord un à la fois et en même temps ont la même valeur de spin, et ensuite seulement s'apparient, mais les spins, selon le principe de Pauli, seront déjà dirigés de manière opposée.
Règle de Hund et principe de Pauli
règle de Hund- la règle de la chimie quantique, qui détermine l'ordre de remplissage des orbitales d'une certaine sous-couche et est formulée comme suit : la valeur totale du nombre quantique de spin des électrons de cette sous-couche doit être maximale. Formulé par Friedrich Hund en 1925.
Cela signifie que dans chacune des orbitales de la sous-couche, un électron est d'abord rempli, et seulement après l'épuisement des orbitales non remplies, un deuxième électron est ajouté à cette orbitale. Dans ce cas, il y a deux électrons avec des spins demi-entiers de signe opposé dans une orbitale, qui s'apparient (forment un nuage à deux électrons) et, par conséquent, le spin total de l'orbite devient égal à zéro.
Autre formulation: En dessous en énergie se trouve le terme atomique pour lequel deux conditions sont satisfaites.
- La multiplicité est maximale
- Lorsque les multiplicités coïncident, l'impulsion orbitale totale L est maximale.
Analysons cette règle en utilisant l'exemple du remplissage des orbitales du p-sous-niveau p- éléments de la deuxième période (c'est-à-dire du bore au néon (dans le schéma ci-dessous, les lignes horizontales indiquent les orbitales, les flèches verticales indiquent les électrons et la direction de la flèche indique l'orientation du spin).
La règle de Klechkovsky
La règle de Klechkovsky -à mesure que le nombre total d'électrons dans les atomes augmente (avec une augmentation des charges de leurs noyaux ou des nombres ordinaux d'éléments chimiques), les orbitales atomiques sont peuplées de telle manière que l'apparition d'électrons dans les orbitales de plus haute énergie ne dépend que de le nombre quantique principal n et ne dépend pas de tous les autres nombres quantiques, y compris ceux de l. Physiquement, cela signifie que dans un atome de type hydrogène (en l'absence de répulsion interélectron), l'énergie orbitale d'un électron n'est déterminée que par l'éloignement spatial de la densité de charge électronique du noyau et ne dépend pas des caractéristiques de son mouvement dans le domaine du noyau.
La règle empirique de Klechkovsky et la séquence de séquences d'une séquence d'énergie réelle quelque peu contradictoire d'orbitales atomiques n'en découlent que dans deux cas du même type: pour les atomes Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au, il y a un "échec" d'un électron avec s - sous-niveau de la couche externe au sous-niveau d de la couche précédente, ce qui conduit à un état énergétiquement plus stable de l'atome, à savoir: après avoir rempli l'orbite 6 avec deux électrons s