Propriétés chimiques de base des protéines. Fonctions des protéines dans le corps
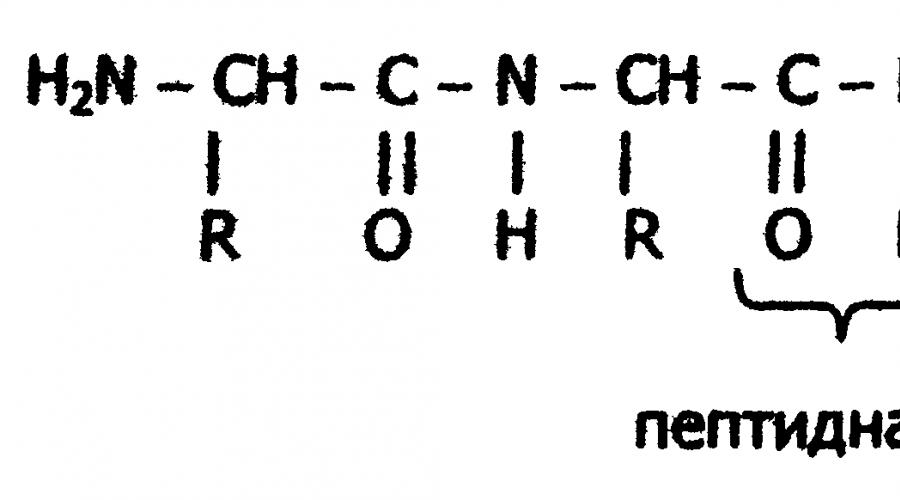
Lire aussi
N° 1. Protéines : liaison peptidique, leur détection.
Les protéines sont des macromolécules de polyamides linéaires formées d'acides a-aminés à la suite d'une réaction de polycondensation dans des objets biologiques.
Écureuils sont des composés macromoléculaires construits à partir de acides aminés. 20 acides aminés sont impliqués dans la fabrication des protéines. Ils se lient en longues chaînes qui forment l'épine dorsale d'une grande molécule de protéine de poids moléculaire.
Fonctions des protéines dans le corps
La combinaison des propriétés chimiques et physiques particulières des protéines confère à cette classe particulière de composés organiques un rôle central dans les phénomènes de la vie.
Les protéines ont les propriétés biologiques suivantes, ou remplissent les principales fonctions suivantes dans les organismes vivants :
1. Fonction catalytique des protéines. Tous les catalyseurs biologiques - les enzymes sont des protéines. À ce jour, des milliers d'enzymes ont été caractérisées, dont beaucoup ont été isolées sous forme cristalline. Presque toutes les enzymes sont de puissants catalyseurs, augmentant les taux de réactions d'au moins un million de fois. Cette fonction des protéines est unique, non caractéristique d'autres molécules polymères.
2. Nutritionnelle (fonction de réserve des protéines). Il s'agit tout d'abord de protéines destinées à la nutrition de l'embryon en développement : caséine de lait, ovalbumine d'œuf, protéines de stockage des graines de plantes. Un certain nombre d'autres protéines sont sans aucun doute utilisées dans le corps comme source d'acides aminés, qui, à leur tour, sont des précurseurs de substances biologiquement actives qui régulent le processus métabolique.
3. Fonction de transport des protéines. De nombreuses petites molécules et ions sont transportés par des protéines spécifiques. Par exemple, la fonction respiratoire du sang, à savoir le transport de l'oxygène, est assurée par les molécules d'hémoglobine, une protéine des globules rouges. Les albumines sériques sont impliquées dans le transport des lipides. Un certain nombre d'autres protéines de lactosérum forment des complexes avec les graisses, le cuivre, le fer, la thyroxine, la vitamine A et d'autres composés, assurant leur acheminement vers les organes appropriés.
4. Fonction protectrice des protéines. La principale fonction de protection est assurée par le système immunologique, qui assure la synthèse de protéines protectrices spécifiques - les anticorps - en réponse à l'entrée de bactéries, de toxines ou de virus (antigènes) dans l'organisme. Les anticorps se lient aux antigènes, interagissent avec eux et neutralisent ainsi leur effet biologique et maintiennent l'état normal du corps. La coagulation d'une protéine du plasma sanguin - le fibrinogène - et la formation d'un caillot sanguin qui protège contre la perte de sang lors de blessures est un autre exemple de la fonction protectrice des protéines.
5. Fonction contractile des protéines. De nombreuses protéines sont impliquées dans l'acte de contraction et de relaxation musculaire. Le rôle principal dans ces processus est joué par l'actine et la myosine - des protéines spécifiques du tissu musculaire. La fonction contractile est également inhérente aux protéines des structures subcellulaires, qui assurent les processus les plus fins de l'activité vitale cellulaire,
6. Fonction structurale des protéines. Les protéines ayant cette fonction se classent au premier rang parmi les autres protéines du corps humain. Les protéines structurales telles que le collagène sont largement distribuées dans le tissu conjonctif ; kératine dans les cheveux, les ongles, la peau; élastine - dans les parois vasculaires, etc.
7. Fonction hormonale (régulatrice) des protéines. Le métabolisme dans le corps est régulé par divers mécanismes. Dans cette régulation, une place importante est occupée par les hormones produites par les glandes endocrines. Un certain nombre d'hormones sont représentées par des protéines ou des polypeptides, par exemple des hormones de l'hypophyse, du pancréas, etc.
Liaison peptidique
Formellement, la formation d'une macromolécule protéique peut être représentée comme une réaction de polycondensation d'acides α-aminés.
D'un point de vue chimique, les protéines sont des composés organiques à haut poids moléculaire contenant de l'azote (polyamides), dont les molécules sont construites à partir de résidus d'acides aminés. Les monomères protéiques sont des acides α-aminés, caractéristique commune qui est la présence d'un groupe carboxyle -COOH et d'un groupe amino -NH 2 au niveau du deuxième atome de carbone (atome de carbone α) :
Sur la base des résultats de l'étude des produits de l'hydrolyse des protéines et mis en avant par A.Ya. Après les idées de Danilevsky sur le rôle des liaisons peptidiques -CO-NH- dans la construction d'une molécule protéique, le scientifique allemand E. Fischer a proposé au début du XXe siècle la théorie peptidique de la structure des protéines. Selon cette théorie, les protéines sont des polymères linéaires d'acides α-aminés liés par un peptide liaison - polypeptides :

Dans chaque peptide, un résidu d'acide aminé terminal a un groupe α-amino libre (N-terminal) et l'autre a un groupe α-carboxyle libre (C-terminal). La structure des peptides est généralement représentée à partir de l'acide aminé N-terminal. Dans ce cas, les résidus d'acides aminés sont indiqués par des symboles. Par exemple : Ala-Tyr-Leu-Ser-Tyr- - Cys. Cette entrée désigne un peptide dans lequel l'acide α-aminé N-terminal est lyatsya alanine et le C-terminal - cystéine. Lors de la lecture d'un tel enregistrement, les terminaisons des noms de tous les acides, à l'exception des derniers, se transforment en - "yl": alanyl-tyrosyl-leucyl-seryl-tyrosyl--cysteine. La longueur de la chaîne peptidique dans les peptides et les protéines trouvés dans le corps varie de deux à des centaines et des milliers de résidus d'acides aminés.
N° 2. Classification des protéines simples.
À Facile (protéines) comprennent les protéines qui, lorsqu'elles sont hydrolysées, ne donnent que des acides aminés.
Protéinoïdes ____protéines simples d'origine animale, insolubles dans l'eau, les solutions salines, les acides dilués et les alcalis. Ils remplissent principalement des fonctions de soutien (par exemple, le collagène, la kératine
protamines - des protéines nucléaires chargées positivement, d'un poids moléculaire de 10-12 kDa. Environ 80% sont composés d'acides aminés alcalins, ce qui leur permet d'interagir avec les acides nucléiques par des liaisons ioniques. Ils participent à la régulation de l'activité des gènes. Bien soluble dans l'eau;
histones - des protéines nucléaires qui jouent un rôle important dans la régulation de l'activité des gènes. Ils se trouvent dans toutes les cellules eucaryotes et sont divisés en 5 classes, différant par leur poids moléculaire et leurs acides aminés. Le poids moléculaire des histones est compris entre 11 et 22 kDa, et les différences de composition en acides aminés concernent la lysine et l'arginine, dont la teneur varie de 11 à 29 % et de 2 à 14 %, respectivement ;
prolamines - insoluble dans l'eau, mais soluble dans l'alcool à 70%, caractéristiques de structure chimique - beaucoup de proline, d'acide glutamique, pas de lysine ,
glutélines - soluble dans les solutions alcalines ,
globulines - des protéines insolubles dans l'eau et dans une solution semi-saturée de sulfate d'ammonium, mais solubles dans des solutions aqueuses de sels, d'alcalis et d'acides. Poids moléculaire - 90-100 kDa ;
albumines - protéines de tissus animaux et végétaux, solubles dans l'eau et les solutions salines. Le poids moléculaire est de 69 kDa ;
scléroprotéines - les protéines des tissus de soutien des animaux
Des exemples de protéines simples sont la fibroïne de soie, l'albumine sérique d'œuf, la pepsine, etc.
Numéro 3. Méthodes d'isolement et de précipitation (purification) des protéines.





Numéro 4. Les protéines comme polyélectrolytes. Point isoélectrique d'une protéine.
Les protéines sont des polyélectrolytes amphotères, c'est-à-dire présentent à la fois des propriétés acides et basiques. Cela est dû à la présence dans les molécules protéiques de radicaux d'acides aminés capables d'ionisation, ainsi que de groupes α-amino et α-carboxyle libres aux extrémités des chaînes peptidiques. Les propriétés acides de la protéine sont données par les acides aminés acides (aspartique, glutamique) et les propriétés alcalines - par les acides aminés basiques (lysine, arginine, histidine).
La charge d'une molécule de protéine dépend de l'ionisation des groupes acides et basiques des radicaux d'acides aminés. Selon le rapport des groupes négatifs et positifs, la molécule de protéine dans son ensemble acquiert une charge totale positive ou négative. Lorsqu'une solution protéique est acidifiée, le degré d'ionisation des groupements anioniques diminue, tandis que celui des groupements cationiques augmente ; lorsqu'il est alcalinisé - vice versa. À une certaine valeur de pH, le nombre de groupes chargés positivement et négativement devient le même et l'état isoélectrique de la protéine apparaît (la charge totale est de 0). La valeur de pH à laquelle la protéine est à l'état isoélectrique est appelée point isoélectrique et est notée pI, comme pour les acides aminés. Pour la plupart des protéines, le pI se situe entre 5,5 et 7,0, ce qui indique une certaine prédominance des acides aminés acides dans les protéines. Cependant, il existe également des protéines alcalines, par exemple la salmine - la principale protéine de la laitance de saumon (pl = 12). De plus, il existe des protéines qui ont une valeur de pI très faible, par exemple la pepsine, une enzyme du suc gastrique (pl=l). Au point isoélectrique, les protéines sont très instables et précipitent facilement, ayant la moindre solubilité.
Si la protéine n'est pas dans un état isoélectrique, alors champ électrique ses molécules se déplaceront vers la cathode ou l'anode, selon le signe de la charge totale et à une vitesse proportionnelle à sa valeur ; c'est l'essence de la méthode d'électrophorèse. Cette méthode peut séparer les protéines avec différentes valeurs de pI.
Bien que les protéines aient des propriétés tampons, leur capacité à des valeurs de pH physiologiques est limitée. L'exception concerne les protéines contenant beaucoup d'histidine, car seul le radical histidine a des propriétés tampons dans la plage de pH de 6 à 8. Il y a très peu de ces protéines. Par exemple, l'hémoglobine, contenant près de 8 % d'histidine, est un puissant tampon intracellulaire dans les globules rouges, maintenant le pH du sang à un niveau constant.
№5. Propriétés physicochimiques protéines.
Les protéines ont des propriétés chimiques, physiques et biologiques différentes, qui sont déterminées par la composition en acides aminés et l'organisation spatiale de chaque protéine. Les réactions chimiques des protéines sont très diverses, elles sont dues à la présence de groupements NH 2 -, COOH et de radicaux de nature diverse. Ce sont des réactions de nitration, acylation, alkylation, estérification, redox et autres. Les protéines ont des propriétés acido-basiques, tampon, colloïdales et osmotiques.
Propriétés acido-basiques des protéines
Propriétés chimiques. Avec un faible chauffage des solutions aqueuses de protéines, une dénaturation se produit. Cela crée un précipité.
Lorsque les protéines sont chauffées avec des acides, une hydrolyse se produit et un mélange d'acides aminés se forme.
Propriétés physico-chimiques des protéines
Les protéines ont un poids moléculaire élevé.
La charge d'une molécule de protéine. Toutes les protéines ont au moins un groupe -NH et -COOH libre.
Solutions de protéines- des solutions colloïdales aux propriétés différentes. Les protéines sont acides et basiques. Les protéines acides contiennent beaucoup de glu et d'asp, qui ont des groupes carboxyle supplémentaires et moins de groupes amino. Il existe de nombreux lys et args dans les protéines alcalines. Chaque molécule de protéine dans une solution aqueuse est entourée d'une coquille d'hydratation, car les protéines ont de nombreux groupes hydrophiles (-COOH, -OH, -NH 2, -SH) dus aux acides aminés. Dans les solutions aqueuses, la molécule de protéine a une charge. La charge de protéines dans l'eau peut changer en fonction du pH.
Précipitation des protéines. Les protéines ont une coque d'hydratation, une charge qui empêche de coller. Pour le dépôt, il est nécessaire de retirer la coque d'hydrate et de charger.
1. Hydratation. Le processus d'hydratation désigne la fixation de l'eau par les protéines, alors qu'elles présentent des propriétés hydrophiles : elles gonflent, leur masse et leur volume augmentent. Le gonflement de la protéine s'accompagne de sa dissolution partielle. L'hydrophilie des protéines individuelles dépend de leur structure. Les groupements hydrophiles amide (–CO–NH–, liaison peptidique), amine (NH2) et carboxyle (COOH) présents dans la composition et situés à la surface de la macromolécule protéique attirent les molécules d'eau en les orientant strictement vers la surface de la molécule . Entourant les globules protéiques, la coque hydratée (eau) empêche la stabilité des solutions protéiques. Au point isoélectrique, les protéines ont la moindre capacité à se lier à l'eau, la coquille d'hydratation autour des molécules de protéines est détruite, elles se combinent donc pour former de gros agrégats. L'agrégation des molécules de protéines se produit également lorsqu'elles sont déshydratées avec certains solvants organiques, tels que l'alcool éthylique. Cela conduit à la précipitation des protéines. Lorsque le pH du milieu change, la macromolécule protéique se charge et sa capacité d'hydratation change.
Les réactions de précipitation sont divisées en deux types.
Relargage des protéines : (NH 4 )SO 4 - seule la coquille d'hydratation est supprimée, la protéine conserve tous les types de sa structure, toutes les liaisons, conserve ses propriétés natives. Ces protéines peuvent ensuite être redissoutes et utilisées.
La précipitation avec perte des propriétés protéiques natives est un processus irréversible. La coque d'hydratation et la charge sont retirées de la protéine, diverses propriétés de la protéine sont violées. Par exemple, sels de cuivre, mercure, arsenic, fer, acides inorganiques concentrés - HNO 3 , H 2 SO 4 , HCl, acides organiques, alcaloïdes - tanins, iodure de mercure. L'ajout de solvants organiques abaisse le degré d'hydratation et conduit à la précipitation de la protéine. L'acétone est utilisée comme tel solvant. Les protéines sont également précipitées à l'aide de sels, par exemple le sulfate d'ammonium. Le principe de cette méthode repose sur le fait qu'avec une augmentation de la concentration en sel dans la solution, les atmosphères ioniques formées par les contre-ions protéiques sont comprimées, ce qui contribue à leur convergence vers une distance critique, à laquelle les forces intermoléculaires de van l'attraction de der Waals l'emporte sur les forces coulombiennes de répulsion des contre-ions. Cela conduit à l'adhésion des particules de protéines et à leur précipitation.
Lors de l'ébullition, les molécules de protéines commencent à se déplacer de manière aléatoire, se heurtent, la charge est supprimée et la coque d'hydratation diminue.
Pour détecter les protéines en solution, les éléments suivants sont utilisés :
réactions colorées;
Réactions de précipitation.
Méthodes d'isolement et de purification de protéines.
relargage;
électrophorèse;
chromatographie : adsorption, fractionnement;
ultracentrifugation.
homogénéisation- les cellules sont broyées en une masse homogène ;
extraction de protéines avec de l'eau ou des solutions eau-sel;
Organisation structurale des protéines.
Structure primaire- déterminé par l'enchaînement des acides aminés de la chaîne peptidique, stabilisé par des liaisons peptidiques covalentes (insuline, pepsine, chymotrypsine).
structure secondaire- structure spatiale de la protéine. Il s'agit soit d'une spirale, soit d'un pliage. Des liaisons hydrogène sont créées.
Structure tertiaire protéines globulaires et fibrillaires. Ils stabilisent les liaisons hydrogène, les forces électrostatiques (COO-, NH3+), les forces hydrophobes, les ponts sulfures, sont déterminés par la structure primaire. Protéines globulaires - toutes les enzymes, hémoglobine, myoglobine. Protéines fibrillaires - collagène, myosine, actine.
Structure quaternaire- présent uniquement dans certaines protéines. Ces protéines sont construites à partir de plusieurs peptides. Chaque peptide a sa propre structure primaire, secondaire et tertiaire, appelée protomères. Plusieurs protomères se rejoignent pour former une seule molécule. Un protomère ne fonctionne pas comme une protéine, mais uniquement en conjonction avec d'autres protomères.
Exemple: hémoglobine \u003d -globule + -globule - transporte O 2 dans l'ensemble, et non séparément.
Les protéines peuvent se renaturer. Cela nécessite une très courte exposition aux agents.

6) Méthodes de détection des protéines.
Les protéines sont des polymères biologiques de haut poids moléculaire, dont les unités structurelles (monomères) sont des acides aminés . Les acides aminés des protéines sont liés les uns aux autres par des liaisons peptidiques. dont la formation se produit en raison du groupe carboxyle se trouvant à -atome de carbone d'un acide aminé et -groupe amine d'un autre acide aminé avec la libération d'une molécule d'eau. Les unités monomères des protéines sont appelées résidus d'acides aminés.
Les peptides, les polypeptides et les protéines diffèrent non seulement par leur quantité, leur composition, mais également par la séquence des résidus d'acides aminés, les propriétés physicochimiques et les fonctions exécutées dans le corps. Le poids moléculaire des protéines varie de 6 000 à 1 million ou plus. Chimique et propriétés physiques les protéines sont dues à la nature chimique et aux propriétés physico-chimiques des radicaux, leurs résidus d'acides aminés constitutifs. Les méthodes de détection et de quantification des protéines dans les objets biologiques et les denrées alimentaires, ainsi que leur isolement à partir de tissus et de fluides biologiques, sont basées sur les propriétés physiques et chimiques de ces composés.
Protéines lors de l'interaction avec certains produits chimiques donner des composés colorés. La formation de ces composés se produit avec la participation de radicaux d'acides aminés, de leurs groupes spécifiques ou de liaisons peptidiques. Les réactions de couleur vous permettent de définir la présence d'une protéine dans un objet biologique ou solution et prouver la présence certains acides aminés dans une molécule de protéine. Sur la base des réactions colorées, certaines méthodes de détermination quantitative des protéines et des acides aminés ont été développées.
Considérez universel réactions biuret et ninhydrine, puisque toutes les protéines en donnent. Réaction xantoprotéique, réaction de Fohl et d'autres sont spécifiques, puisqu'ils sont dus aux groupes radicalaires de certains acides aminés dans la molécule protéique.
Les réactions colorées permettent d'établir la présence d'une protéine dans le matériau étudié et la présence de certains acides aminés dans ses molécules.
Réaction de Biuret. La réaction est due à la présence dans les protéines, peptides, polypeptides liaisons peptidiques, qui se forme en milieu alcalin avec ions cuivre(II) composés complexes colorés en couleur pourpre (avec une teinte rouge ou bleue). La couleur est due à la présence d'au moins deux groupes dans la molécule -CO-NH- reliés directement les uns aux autres ou avec la participation d'un atome de carbone ou d'azote.
Les ions cuivre (II) sont reliés par deux liaisons ioniques avec des groupes =C─O ˉ et quatre liaisons de coordination avec des atomes d'azote (=N−).
L'intensité de la couleur dépend de la quantité de protéines dans la solution. Cela permet d'utiliser cette réaction pour le dosage quantitatif des protéines. La couleur des solutions colorées dépend de la longueur de la chaîne polypeptidique. Les protéines donnent une couleur bleu-violet ; les produits de leur hydrolyse (poly- et oligopeptides) sont de couleur rouge ou rose. La réaction du biuret est donnée non seulement par les protéines, les peptides et les polypeptides, mais également par le biuret (NH 2 -CO-NH-CO-NH 2), l'oxamide (NH 2 -CO-CO-NH 2), l'histidine.
Le composé complexe du cuivre (II) avec des groupements peptidiques formés en milieu alcalin a la structure suivante :


Réaction à la ninhydrine. Dans cette réaction, des solutions de protéines, de polypeptides, de peptides et d'acides α-aminés libres, lorsqu'elles sont chauffées avec de la ninhydrine, donnent une couleur bleue, bleu-violet ou rose-violet. La couleur de cette réaction se développe en raison du groupe α-amino.


Les acides aminés réagissent très facilement avec la ninhydrine. Parallèlement à eux, le bleu-violet de Rueman est également formé de protéines, de peptides, d'amines primaires, d'ammoniac et de certains autres composés. Les amines secondaires, telles que la proline et l'hydroxyproline, donnent une couleur jaune.
La réaction à la ninhydrine est largement utilisée pour détecter et quantifier les acides aminés.
réaction xantoprotéique. Cette réaction indique la présence de résidus d'acides aminés aromatiques dans les protéines - tyrosine, phénylalanine, tryptophane. Il est basé sur la nitration du cycle benzénique des radicaux de ces acides aminés avec formation de composés nitrés de couleur jaune (grec "Xanthos" - jaune). En utilisant la tyrosine comme exemple, cette réaction peut être décrite sous la forme des équations suivantes.
En milieu alcalin, les dérivés nitrés des acides aminés forment des sels de structure quinoïde, de couleur orange. La réaction de la xantoprotéine est donnée par le benzène et ses homologues, le phénol et d'autres composés aromatiques.

Réactions aux acides aminés contenant un groupe thiol à l'état réduit ou oxydé (cystéine, cystine).
La réaction de Fohl. Lorsqu'il est bouilli avec un alcali, le soufre est facilement séparé de la cystéine sous forme de sulfure d'hydrogène, qui en milieu alcalin forme du sulfure de sodium:
A cet égard, les réactions de détermination des acides aminés contenant des thiols en solution sont divisées en deux étapes :
Le passage du soufre de l'état organique à l'état inorganique
Détection du soufre en solution
Pour détecter le sulfure de sodium, on utilise de l'acétate de plomb qui, lorsqu'il interagit avec l'hydroxyde de sodium, se transforme en son plumbite:
Pb(CH 3 ROUCOULER) 2 + 2NaOH Pb(ONa) 2 + 2CH 3 COOH
À la suite de l'interaction des ions soufre et du plomb, du sulfure de plomb noir ou brun se forme :
N / A 2 S + Pb(Sur un) 2 + 2 H 2 O PbS (précipité noir) + 4NaOH
Pour déterminer les acides aminés contenant du soufre, un volume égal d'hydroxyde de sodium et quelques gouttes de solution d'acétate de plomb sont ajoutés à la solution d'essai. Avec une ébullition intensive pendant 3 à 5 minutes, le liquide devient noir.
La présence de cystine peut être déterminée à l'aide de cette réaction, car la cystine est facilement réduite en cystéine.
Réaction de Millon :
Il s'agit d'une réaction à l'acide aminé tyrosine.
Les hydroxyles phénoliques libres des molécules de tyrosine, lorsqu'ils interagissent avec des sels, donnent des composés du sel de mercure du dérivé nitré de la tyrosine, colorés en rouge rosé :

Réaction de Pauli pour l'histidine et la tyrosine . La réaction de Pauli permet de détecter les acides aminés histidine et tyrosine dans la protéine, qui forment des composés complexes rouge cerise avec l'acide diazobenzènesulfonique. L'acide diazobenzènesulfonique se forme dans la réaction de diazotation lorsque l'acide sulfanilique réagit avec le nitrite de sodium en milieu acide :

Un volume égal d'une solution acide d'acide sulfanilique (préparé à l'aide d'acide chlorhydrique) et un double volume de solution de nitrite de sodium sont ajoutés à la solution d'essai, mélangés soigneusement et de la soude (carbonate de sodium) est immédiatement ajoutée. Après agitation, le mélange vire au rouge cerise, à condition que de l'histidine ou de la tyrosine soit présente dans la solution à tester.


Réaction d'Adamkevich-Hopkins-Kohl (Schulz-Raspail) au tryptophane (réaction au groupe indole). Le tryptophane réagit en milieu acide avec les aldéhydes, formant des produits de condensation colorés. La réaction se déroule en raison de l'interaction du cycle indole du tryptophane avec l'aldéhyde. On sait que le formaldéhyde se forme à partir d'acide glyoxylique en présence d'acide sulfurique :
R  Les solutions contenant du tryptophane en présence d'acides glyoxylique et sulfurique donnent une couleur rouge-violet.
Les solutions contenant du tryptophane en présence d'acides glyoxylique et sulfurique donnent une couleur rouge-violet.
L'acide glyoxylique est toujours présent en petites quantités dans l'acide acétique glacial. Par conséquent, la réaction peut être effectuée en utilisant de l'acide acétique. Dans le même temps, un volume égal d'acide acétique glacial (concentré) est ajouté à la solution d'essai et chauffé doucement jusqu'à dissolution du précipité. Après refroidissement, un volume d'acide sulfurique concentré égal au volume ajouté d'acide glyoxylique est ajouté à la mélange soigneusement le long du mur (pour éviter de mélanger les liquides). Après 5-10 minutes, on observe la formation d'un anneau rouge-violet à l'interface entre les deux couches. Si vous mélangez les couches, le contenu du plat deviendra uniformément violet.
À 
 condensation du tryptophane avec le formaldéhyde :
condensation du tryptophane avec le formaldéhyde :
Le produit de condensation est oxydé en bis-2-tryptophanylcarbinol qui, en présence d'acides minéraux, forme des sels bleu-violet :


7) Classification des protéines. Méthodes d'étude de la composition en acides aminés.
La nomenclature et la classification strictes des protéines n'existent toujours pas. Les noms des protéines sont donnés au hasard, le plus souvent en tenant compte de la source d'isolement de la protéine ou en tenant compte de sa solubilité dans certains solvants, de la forme de la molécule, etc.
Les protéines sont classées selon la composition, la forme des particules, la solubilité, la composition en acides aminés, l'origine, etc.
1. Composition Les protéines sont divisées en deux grands groupes : les protéines simples et complexes.
Les simples (protéines) comprennent les protéines qui ne donnent que des acides aminés lors de l'hydrolyse (protéinoïdes, protamines, histones, prolamines, glutélines, globulines, albumines). Des exemples de protéines simples sont la fibroïne de soie, l'albumine sérique d'œuf, la pepsine, etc.
Les complexes (protéides) comprennent les protéines composées d'une protéine simple et d'un groupe supplémentaire (prothétique) de nature non protéique. Le groupe des protéines complexes est divisé en plusieurs sous-groupes selon la nature du composant non protéique :
Métalloprotéines contenant dans leur composition des métaux (Fe, Cu, Mg...) associés directement à la chaîne polypeptidique ;
Phosphoprotéines - contiennent des résidus d'acide phosphorique, qui sont attachés à la molécule de protéine par des liaisons ester au site des groupes hydroxyle de la sérine, de la thréonine;
Glycoprotéines - leurs groupes prosthétiques sont des glucides;
Chromoprotéines - constituées d'une protéine simple et d'un composé non protéique coloré qui lui est associé, toutes les chromoprotéines sont biologiquement très actives ; comme groupements prosthétiques, ils peuvent contenir des dérivés de porphyrine, d'isoalloxazine et de carotène ;
Lipoprotéines - lipides du groupe prosthétique - triglycérides (graisses) et phosphatides ;
Les nucléoprotéines sont des protéines constituées d'une seule protéine et d'un acide nucléique qui lui est lié. Ces protéines jouent un rôle colossal dans la vie de l'organisme et seront discutées ci-dessous. Ils font partie de toute cellule, certaines nucléoprotéines existent dans la nature sous la forme de particules spéciales à activité pathogène (virus).
2. Forme des particules- les protéines sont divisées en fibrillaires (en forme de fil) et globulaires (sphériques) (voir page 30).
3. Par solubilité et caractéristiques de la composition en acides aminés on distingue les groupes suivants de protéines simples :
Protéinoïdes - protéines des tissus de soutien (os, cartilage, ligaments, tendons, cheveux, ongles, peau, etc.). Il s'agit principalement de protéines fibrillaires de gros poids moléculaire (> 150 000 Da), insolubles dans les solvants usuels : eau, sel et mélanges hydro-alcooliques. Ils ne se dissolvent que dans des solvants spécifiques ;
Les protamines (les protéines les plus simples) - des protéines solubles dans l'eau et contenant 80 à 90 % d'arginine et un ensemble limité (6 à 8) d'autres acides aminés, sont présentes dans le lait de divers poissons. En raison de la teneur élevée en arginine, ils ont des propriétés basiques, leur poids moléculaire est relativement faible et est approximativement égal à 4000-12000 Da. Ils sont un composant protéique dans la composition des nucléoprotéines ;
Les histones sont très solubles dans l'eau et les solutions acides diluées (0,1 N), ont une teneur élevée en acides aminés : arginine, lysine et histidine (au moins 30 %) et ont donc des propriétés basiques. Ces protéines se trouvent en quantités significatives dans les noyaux des cellules en tant que partie des nucléoprotéines et jouent un rôle important dans la régulation du métabolisme des acides nucléiques. Le poids moléculaire des histones est petit et égal à 11000-24000 Da;
Les globulines sont des protéines insolubles dans l'eau et les solutions salines dont la concentration en sel est supérieure à 7 %. Les globulines sont complètement précipitées à 50% de saturation de la solution avec du sulfate d'ammonium. Ces protéines se caractérisent par une forte teneur en glycine (3,5%), leur poids moléculaire > 100 000 Da. Les globulines sont des protéines faiblement acides ou neutres (p1=6-7,3) ;
Les albumines sont des protéines très solubles dans l'eau et les solutions salines fortes, et la concentration en sel (NH 4) 2 S0 4 ne doit pas dépasser 50% de la saturation. À des concentrations plus élevées, les albumines sont relarguées. Comparées aux globulines, ces protéines contiennent trois fois moins de glycine et ont un poids moléculaire de 40 000 à 70 000 Da. Les albumines ont un excès de charge négative et des propriétés acides (pl=4,7) en raison de la forte teneur en acide glutamique ;
Les prolamines sont un groupe de protéines végétales présentes dans le gluten. plantes céréalières. Ils ne sont solubles que dans une solution aqueuse à 60-80% d'alcool éthylique. Les prolamines ont une composition caractéristique en acides aminés : elles contiennent beaucoup (20-50 %) d'acide glutamique et de proline (10-15 %), d'où leur nom. Leur poids moléculaire est supérieur à 100 000 Da ;
Glutelins - les protéines végétales sont insolubles dans l'eau, les solutions salines et l'éthanol, mais solubles dans des solutions diluées (0,1 N) d'alcalis et d'acides. En termes de composition en acides aminés et de poids moléculaire, ils sont similaires aux prolamines, mais contiennent plus d'arginine et moins de proline.
Méthodes d'étude de la composition en acides aminés
Les protéines sont décomposées en acides aminés par des enzymes dans les sucs digestifs. Deux conclusions importantes ont été faites : 1) les protéines contiennent des acides aminés ; 2) les méthodes d'hydrolyse peuvent être utilisées pour étudier la composition chimique, en particulier en acides aminés, des protéines.
Pour étudier la composition en acides aminés des protéines, on utilise une combinaison d'hydrolyse acide (HCl), alcaline [Ba(OH) 2 ] et, plus rarement, enzymatique, ou l'une d'entre elles. Il a été établi que lors de l'hydrolyse d'une protéine pure ne contenant pas d'impuretés, 20 acides α-aminés différents sont libérés. Tous les autres acides aminés découverts dans les tissus des animaux, des plantes et des micro-organismes (plus de 300) existent dans la nature à l'état libre ou sous forme de courts peptides ou de complexes avec d'autres substances organiques.
La première étape dans la détermination de la structure primaire des protéines est l'évaluation qualitative et quantitative de la composition en acides aminés d'une protéine individuelle donnée. Il faut se rappeler que pour l'étude, vous devez disposer d'une certaine quantité de protéines pures, sans impuretés d'autres protéines ou peptides.
Hydrolyse acide des protéines
Pour déterminer la composition en acides aminés, il est nécessaire de détruire toutes les liaisons peptidiques de la protéine. La protéine analysée est hydrolysée dans 6 mol/l HCl à une température d'environ 110 ° C pendant 24 heures. À la suite de ce traitement, les liaisons peptidiques de la protéine sont détruites et seuls les acides aminés libres sont présents dans l'hydrolysat. De plus, la glutamine et l'asparagine sont hydrolysées en acides glutamique et aspartique (c'est-à-dire que la liaison amide dans le radical est rompue et que le groupe amino en est séparé).
Séparation des acides aminés par chromatographie échangeuse d'ions
Le mélange d'acides aminés obtenu par hydrolyse acide des protéines est séparé dans une colonne avec une résine échangeuse de cations. Une telle résine synthétique contient des groupes chargés négativement (par exemple, des résidus d'acide sulfonique -SO 3 -) fortement associés, auxquels sont attachés des ions Na + (Fig. 1-4).
Un mélange d'acides aminés est introduit dans l'échangeur de cations dans un environnement acide (pH 3,0), où les acides aminés sont principalement des cations, i. porter une charge positive. Les acides aminés chargés positivement se fixent aux particules de résine chargées négativement. Plus la charge totale de l'acide aminé est élevée, plus sa liaison avec la résine est forte. Ainsi, les acides aminés lysine, arginine et histidine se lient le plus fortement à l'échangeur de cations, tandis que les acides aspartique et glutamique se lient le plus faiblement.
La libération des acides aminés de la colonne est réalisée en les éluant (éluant) avec une solution tampon de force ionique croissante (c'est-à-dire avec une concentration en NaCl croissante) et un pH. Avec une augmentation du pH, les acides aminés perdent un proton, par conséquent, leur charge positive diminue, et donc la force de liaison avec les particules de résine chargées négativement.
Chaque acide aminé sort de la colonne à un pH et une force ionique spécifiques. En recueillant la solution (éluat) de l'extrémité inférieure de la colonne sous forme de petites portions, des fractions contenant des acides aminés individuels peuvent être obtenues.
(pour plus de détails sur "l'hydrolyse" voir la question #10)
8) Liaisons chimiques dans la structure protéique.



9) Le concept de hiérarchie et d'organisation structurale des protéines. (voir question #12)
10) Hydrolyse des protéines. Chimie de la réaction (étapes, catalyseurs, réactifs, conditions de réaction) - une description complète de l'hydrolyse.
11) Transformations chimiques des protéines.
Dénaturation et renaturation
Lorsque les solutions protéiques sont chauffées à 60-80% ou sous l'action de réactifs qui détruisent les liaisons non covalentes dans les protéines, la structure tertiaire (quaternaire) et secondaire de la molécule protéique est détruite, elle prend la forme d'une bobine aléatoire aléatoire pour dans une mesure plus ou moins grande. Ce processus est appelé dénaturation. Les acides, les alcalis, les alcools, les phénols, l'urée, le chlorure de guanidine, etc. peuvent être utilisés comme réactifs dénaturants. L'essence de leur action est qu'ils forment des liaisons hydrogène avec les groupes =NH et =CO - du squelette peptidique et avec les groupes acides de radicaux d'acides aminés, remplaçant leurs propres liaisons hydrogène intramoléculaires dans la protéine, à la suite de quoi les structures secondaires et tertiaires changent. Lors de la dénaturation, la solubilité de la protéine diminue, elle "coagule" (par exemple lors de la cuisson œuf de poule), l'activité biologique de la protéine est perdue. Sur cette base, par exemple, l'utilisation d'une solution aqueuse d'acide carbolique (phénol) comme antiseptique. Dans certaines conditions, avec un refroidissement lent d'une solution d'une protéine dénaturée, une renaturation se produit - la restauration de la conformation d'origine (native). Ceci confirme le fait que la nature du repliement de la chaîne peptidique est déterminée par la structure primaire.
Le processus de dénaturation d'une molécule de protéine individuelle, conduisant à la désintégration de sa structure tridimensionnelle "rigide", est parfois appelé la fusion de la molécule. Presque tout changement notable des conditions externes, comme le chauffage ou un changement significatif du pH, conduit à une violation constante des structures quaternaire, tertiaire et secondaire de la protéine. Habituellement, la dénaturation est causée par une augmentation de la température, l'action d'acides et d'alcalis forts, de sels de métaux lourds, de certains solvants (alcool), de radiations, etc.
La dénaturation conduit souvent au processus d'agrégation des particules de protéines en particules plus grosses dans une solution colloïdale de molécules de protéines. Visuellement, cela ressemble, par exemple, à la formation d'une "protéine" lors de la friture d'œufs.
La renaturation est le processus inverse de la dénaturation, dans lequel les protéines retrouvent leur structure naturelle. Il convient de noter que toutes les protéines ne sont pas capables de se renaturer ; dans la plupart des protéines, la dénaturation est irréversible. Si, lors de la dénaturation des protéines, des modifications physicochimiques sont associées à la transition de la chaîne polypeptidique d'un état densément emballé (ordonné) à un état désordonné, alors lors de la renaturation, la capacité des protéines à s'auto-organiser se manifeste, dont le chemin est prédéterminé par la séquence d'acides aminés de la chaîne polypeptidique, c'est-à-dire sa structure primaire déterminée par l'information héréditaire . Dans les cellules vivantes, cette information est probablement déterminante pour la transformation d'une chaîne polypeptidique désordonnée pendant ou après sa biosynthèse sur le ribosome en la structure d'une molécule protéique native. Lorsque les molécules d'ADN double brin sont chauffées à une température d'environ 100 ° C, les liaisons hydrogène entre les bases sont rompues et les brins complémentaires divergent - l'ADN se dénature. Cependant, lors d'un refroidissement lent, les brins complémentaires peuvent se reconnecter en une double hélice régulière. Cette capacité de renaturation de l'ADN est utilisée pour produire des molécules hybrides d'ADN artificiel.
Les corps protéiques naturels sont dotés d'une certaine configuration spatiale strictement définie et possèdent un certain nombre de propriétés physicochimiques et biologiques caractéristiques à des températures et des valeurs de pH physiologiques. Sous l'influence de divers facteurs physiques et chimiques, les protéines subissent une coagulation et précipitent, perdant leurs propriétés natives. Ainsi, la dénaturation doit être comprise comme une violation du plan général de la structure unique de la molécule protéique native, principalement sa structure tertiaire, entraînant la perte de ses propriétés caractéristiques (solubilité, mobilité électrophorétique, activité biologique, etc.). La plupart des protéines se dénaturent lorsque leurs solutions sont chauffées à plus de 50–60°C.
Les manifestations externes de la dénaturation sont réduites à une perte de solubilité, en particulier au point isoélectrique, à une augmentation de la viscosité des solutions protéiques, à une augmentation du nombre de groupes SH fonctionnels libres et à une modification de la nature de la diffusion des rayons X. . Le signe le plus caractéristique de la dénaturation est une forte diminution ou une perte totale par la protéine de son activité biologique (catalytique, antigénique ou hormonale). Lors de la dénaturation des protéines causée par l'urée 8M ou un autre agent, la plupart des liaisons non covalentes (en particulier les interactions hydrophobes et les liaisons hydrogène) sont détruites. Les liaisons disulfure sont rompues en présence de l'agent réducteur mercaptoéthanol, tandis que les liaisons peptidiques du squelette de la chaîne polypeptidique elle-même ne sont pas affectées. Dans ces conditions, des globules de molécules de protéines natives se déplient et des structures aléatoires et désordonnées se forment (Fig.)

Dénaturation d'une molécule protéique (schéma).
a - état initial ; b - début d'une violation réversible de la structure moléculaire; c - déploiement irréversible de la chaîne polypeptidique.

Dénaturation et renaturation de la ribonucléase (selon Anfinsen).
a - déploiement (urée + mercaptoéthanol) ; b - repliage.

1. Hydrolyse des protéines : H+
[− NH2─CH─ CO─NH─CH─CO − ]n +2nH2O → n NH2 − CH − COOH + n NH2 ─ CH ─ COOH
│ │ │ │
Acide aminé 1 acide aminé 2
2. Précipitation des protéines :
a) réversible
Protéine en solution ↔ précipité de protéines. Se produit sous l'action de solutions de sels Na+, K+
b) irréversible (dénaturation)
Lors de la dénaturation sous l'influence de facteurs externes (température; action mécanique - pression, frottement, agitation, ultrasons; action d'agents chimiques - acides, alcalis, etc.), une modification se produit dans les structures secondaire, tertiaire et quaternaire de la protéine macromolécule, c'est-à-dire sa structure spatiale native. Structure primaire, et donc composition chimique les protéines ne changent pas.
Lors de la dénaturation, les propriétés physiques des protéines changent : la solubilité diminue, l'activité biologique est perdue. Dans le même temps, l'activité de certains groupes chimiques augmente, l'effet des enzymes protéolytiques sur les protéines est facilité et, par conséquent, il est plus facilement hydrolysé.
Par exemple, l'albumine - blanc d'œuf - à une température de 60-70 ° est précipitée d'une solution (coagule), perdant la capacité de se dissoudre dans l'eau.
Schéma du processus de dénaturation des protéines (destruction des structures tertiaires et secondaires des molécules de protéines)
3. Brûler des protéines
Les protéines brûlent avec la formation d'azote, de dioxyde de carbone, d'eau et de certaines autres substances. La brûlure s'accompagne de l'odeur caractéristique des plumes brûlées.
4. Réactions colorées (qualitatives) aux protéines :
a) réaction de xantoprotéine (pour les résidus d'acides aminés contenant des cycles benzéniques) :
Protéine + HNO3 (conc.) → couleur jaune
b) réaction biuret (pour les liaisons peptidiques) :
Protéine + CuSO4 (sat) + NaOH (conc) → couleur violet vif
c) réaction cystéine (pour les résidus d'acides aminés contenant du soufre) :
Protéine + NaOH + Pb(CH3COO)2 → Coloration noire
Les protéines sont à la base de toute vie sur Terre et remplissent diverses fonctions dans les organismes.
Saler les protéines
Le relargage est le processus d'isolement des protéines à partir de solutions aqueuses avec des solutions neutres de sels concentrés de métaux alcalins et alcalino-terreux. Lorsque de fortes concentrations de sels sont ajoutées à la solution de protéines, la déshydratation des particules de protéines et l'élimination de la charge se produisent, tandis que les protéines précipitent. Le degré de précipitation des protéines dépend de la force ionique de la solution de précipitation, de la taille des particules de la molécule de protéine, de l'amplitude de sa charge et de son hydrophilie. Différentes protéines précipitent à différentes concentrations de sel. Par conséquent, dans les sédiments obtenus en augmentant progressivement la concentration de sels, les protéines individuelles se trouvent dans différentes fractions. Le relargage des protéines est un processus réversible, et une fois le sel retiré, la protéine retrouve ses propriétés naturelles. Par conséquent, le relargage est utilisé en pratique clinique dans la séparation des protéines du sérum sanguin, ainsi que dans l'isolement et la purification de diverses protéines.
Les anions et cations ajoutés détruisent la coque protéique hydratée des protéines, qui est l'un des facteurs de stabilité des solutions protéiques. Le plus souvent, des solutions de sulfates de Na et d'ammonium sont utilisées. De nombreuses protéines diffèrent par la taille de la coquille d'hydratation et l'ampleur de la charge. Chaque protéine a sa propre zone de relargage. Après élimination de l'agent de relargage, la protéine conserve son activité biologique et ses propriétés physico-chimiques. Dans la pratique clinique, la méthode de relargage est utilisée pour séparer les globulines (avec l'ajout de 50 % de sulfate d'ammonium (NH4) 2SO4 un précipité précipite) et les albumines (avec l'ajout de 100 % de sulfate d'ammonium (NH4) 2SO4 un précipité précipite).
Le relargage est influencé par :
1) nature et concentration du sel ;
2) environnements de pH ;
3) température.
Le rôle principal est joué par les valences des ions.
12) Caractéristiques de l'organisation de la structure primaire, secondaire et tertiaire de la protéine.
A l'heure actuelle, l'existence de quatre niveaux d'organisation structurale d'une molécule protéique a été prouvée expérimentalement : structure primaire, secondaire, tertiaire et quaternaire.
Écureuils
- les biopolymères dont les monomères sont des acides α-aminés liés par des liaisons peptidiques.
Isoler les acides aminés hydrophobe et hydrophile, qui, à leur tour, sont divisés en acides, basiques et neutres. Une caractéristique des acides a-aminés est leur capacité à interagir les uns avec les autres pour former des peptides.
Allouer:
dipeptides (carnosine et ansérine, localisé dans les mitochondries ; étant AO, empêchant leur gonflement);
oligopeptides, contenant jusqu'à 10 résidus d'acides aminés. Par exemple : tripeptide glutathion est l'un des principaux agents réducteurs de l'ARP, qui régule l'intensité de la peroxydation lipidique. Vasopressine et l'ocytocine- les hormones de l'hypophyse postérieure, comprennent 9 acides aminés.
Exister polypeptide s et, selon les propriétés qu'ils présentent, ils sont affectés à une classe différente de composés. Les médecins pensent que si l'administration parentérale d'un polypeptide provoque un rejet (une réaction allergique), il faut alors envisager protéine; si un tel phénomène n'est pas observé, alors le terme reste le même ( polypeptide). Hormone de l'adénohypophyse ACTH, affectant la sécrétion de corticostéroïdes dans le cortex surrénalien, sont appelés polypeptides (39 acides aminés), et insuline, constitué de 51 monomères et capable de provoquer une réponse immunitaire, est une protéine.
Niveaux d'organisation d'une molécule protéique.
Tout polymère a tendance à adopter une conformation plus énergétiquement favorable, qui est conservée en raison de la formation de liaisons supplémentaires, qui s'effectue à l'aide de groupes de radicaux d'acides aminés. Il est d'usage de distinguer quatre niveaux d'organisation structurale des protéines. Structure primaire- la séquence d'acides aminés de la chaîne polypeptidique, liés de manière covalente par le peptide ( amide) et les radicaux voisins forment un angle de 180 0 (forme trans). La présence de plus de 2 douzaines d'acides aminés protéinogènes différents et leur capacité à se lier dans différentes séquences déterminent la diversité des protéines dans la nature et leurs performances dans diverses fonctions. La structure primaire des protéines d'un individu est génétiquement établie et transmise par les parents à l'aide de polynucléotides d'ADN et d'ARN. Selon la nature des radicaux et à l'aide de protéines spéciales - chaperons la chaîne polypeptidique synthétisée tient dans l'espace - repliement des protéines.
structure secondaire La protéine a la forme d'une couche en spirale ou pliée en β. Les protéines fibrillaires (collagène, élastine) ont structure bêta. L'alternance de régions spiralisées et amorphes (désordonnées) leur permet de se rapprocher et, à l'aide de chaperons, de former une molécule plus dense - structure tertiaire.
La combinaison de plusieurs chaînes polypeptidiques dans l'espace et la création d'une formation fonctionnellement macromoléculaire forment structure quaternaireécureuil. Ces micelles sont appelées oligo- ou multimères, et leurs composants sont des sous-unités ( protomères). Une protéine de structure quaternaire a activité biologique seulement si toutes ses sous-unités sont interconnectées.
Ainsi, toute protéine naturelle se caractérise par une organisation unique, qui assure ses fonctions physico-chimiques, biologiques et physiologiques.
Propriétés physicochimiques.
Les protéines sont grandes et ont un poids moléculaire élevé, qui varie de 6 000 à 1 000 000 Daltons et plus, selon le nombre d'acides aminés et le nombre de protomères. Leurs molécules ont différentes formes : fibrillaire- il conserve la structure secondaire ; globulaire- avoir une organisation supérieure; et mixte. La solubilité des protéines dépend de la taille et de la forme de la molécule, de la nature des radicaux d'acides aminés. Les protéines globulaires sont très solubles dans l'eau, tandis que les protéines fibrillaires sont peu ou insolubles.
Propriétés des solutions protéiques : ont une faible pression osmotique, mais une pression oncotique élevée ; haute viscosité; mauvaise capacité de diffusion; souvent nuageux; opalescent ( Phénomène de Tyndall), - tout cela est utilisé dans l'isolement, la purification, l'étude des protéines natives. La séparation des composants d'un mélange biologique est basée sur leur précipitation. Les précipitations réversibles sont appelées relargage , se développant sous l'action des sels métaux alcalins, sels d'ammonium, alcalis et acides dilués. Il est utilisé pour obtenir des fractions pures qui conservent leur structure et leurs propriétés d'origine.
Le degré d'ionisation d'une molécule de protéine et sa stabilité en solution sont déterminés par le pH du milieu. La valeur du pH d'une solution à laquelle la charge des particules tend vers zéro est appelée point isoelectrique . De telles molécules sont capables de se déplacer dans un champ électrique ; la vitesse de déplacement est directement proportionnelle à l'amplitude de la charge et inversement proportionnelle à la masse du globule, qui sous-tend l'électrophorèse pour la séparation des protéines sériques.
Dépôt irréversible - dénaturation. Si le réactif pénètre profondément dans la micelle et détruit des liaisons supplémentaires, le fil compact se déplie. Les molécules qui s'approchent en raison des groupes libérés se collent et précipitent ou flottent et perdent leurs propriétés biologiques. Facteurs dénaturants : physique(température supérieure à 40 0 , différentes sortes rayonnement : rayons X, α-, β-, γ, UFL) ; chimique(acides concentrés, alcalis, sels de métaux lourds, urée, alcaloïdes, certains médicaments, poisons). La dénaturation est utilisée dans l'asepsie et l'antisepsie, ainsi que dans la recherche biochimique.
Les protéines ont des propriétés différentes (tableau 1.1).
Tableau 1.1
Propriétés biologiques des protéines
| Spécificité | Elle est déterminée par la composition unique en acides aminés de chaque protéine, qui est déterminée génétiquement et assure l'adaptation de l'organisme aux conditions environnementales changeantes, mais d'autre part, elle nécessite que ce fait soit pris en compte lors de la transfusion sanguine, de la transplantation d'organes et tissus. |
| Ligandité | la capacité des radicaux d'acides aminés à former des liaisons avec des substances de nature diverse ( ligands) : glucides, lipides, nucléotides, composés minéraux. Si la connexion est forte, alors ce complexe, appelé protéine complexe, remplit les fonctions qui lui sont destinées. |
| coopération | caractéristique des protéines à structure quaternaire. L'hémoglobine est constituée de 4 protomères, chacun étant relié à un hème qui peut se lier à l'oxygène. Mais l'hème de la première sous-unité le fait lentement, et chaque hème suivant plus facilement. |
| Polyfonctionnalité | la propriété d'une protéine d'accomplir une variété de fonctions. La myosine, une protéine musculaire contractile, a également une activité catalytique, hydrolysant l'ATP si nécessaire. L'hémoglobine susmentionnée est également capable de fonctionner comme une enzyme - la catalase. |
| complémentarité | Toutes les protéines s'intègrent dans l'espace de telle manière que des zones se forment, complémentaire d'autres composés, qui assure la réalisation de diverses fonctions (formation de complexes enzyme-substrat, hormone-récepteur, antigène-anticorps. |
Classement des protéines
Allouer protéines simples , composé uniquement d'acides aminés, et complexe , y compris groupe prosthétique. Les protéines simples sont divisées en globuleux et fibrillaire, et aussi en fonction de la composition en acides aminés sur basique, acide, neutre. protéines basiques globulaires protamines et histones. Ils ont un faible poids moléculaire, en raison de la présence d'arginine et de lysine, ils ont une basicité prononcée, en raison de la charge «-», ils interagissent facilement avec les polyanions des acides nucléiques. Les histones, en se liant à l'ADN, aident à s'adapter de manière compacte dans le noyau et à réguler la synthèse des protéines. Cette fraction est hétérogène et, lorsqu'elle interagit les unes avec les autres, forme nucléosomes autour duquel s'enroulent les brins d'ADN.
Les protéines globulaires acides sont albumines et globulines contenus dans les liquides extracellulaires (plasma sanguin, liquide céphalo-rachidien, lymphe, lait) et de masse et de taille différentes. Les albumines ont un poids moléculaire de 40 à 70 000 D, contrairement aux globulines (plus de 100 000 D). Les premiers comprennent l'acide glutamique, qui crée une grande charge "-" et une coque hydratée, ce qui permet d'avoir une grande stabilité de leur solution. Les globulines sont des protéines moins acides, elles sont donc facilement relargables et hétérogènes, elles sont divisées en fractions par électrophorèse. Capable de se lier à divers composés (hormones, vitamines, poisons, médicaments, ions), assurant leur transport. Avec leur aide, des paramètres importants de l'homéostasie sont stabilisés : pH et pression oncotique. Allouer aussi immunoglobulines(IgA, IgM, IgD, IgE, IgG), qui servent d'anticorps, ainsi que de facteurs de coagulation des protéines.
La clinique utilise le soi-disant taux de protéines (BC) représentant le rapport de la concentration d'albumine à la concentration de globuline :
Ses valeurs fluctuent en fonction des processus pathologiques.
protéines fibrillaires sont divisés en deux groupes : soluble ( actine, myosine, fibrinogène) et insoluble dans l'eau et les solutions eau-sel (protéines de soutien collagène, élastine, réticuline et couvrir - kératine tissus).
La classification des protéines complexes est basée sur les caractéristiques structurelles du groupe prothétique. Métalloprotéine — ferritine, riche en cations de fer, et localisée dans les cellules du système phagocytaire mononucléaire (hépatocytes, splénocytes, cellules de la moelle osseuse), est un dépôt métal donné. L'excès de fer entraîne une accumulation dans les tissus - hémosidérine, entraînant le développement hémosidérose. glycoprotéines métalliques - transferrine et céruloplasmine plasma sanguin, servant de formes de transport des ions de fer et de cuivre, respectivement, leur activité antioxydante a été révélée. Le travail de nombreuses enzymes dépend de la présence d'ions métalliques dans les molécules: pour la xanthine déshydrogénase - Mo ++, l'arginase - Mn ++ et l'alcool DG - Zn ++.
Phosphoprotéines - caséinogène de lait, vitelline de jaune et ovalbumine de blanc d'œuf, ichthuline d'œufs de poisson. Ils jouent un rôle important dans le développement de l'embryon, du fœtus et du nouveau-né : leurs acides aminés sont nécessaires à la synthèse de leurs propres protéines tissulaires, et le phosphate est utilisé soit comme lien dans les PL, les structures essentielles des membranes cellulaires, soit en tant que composant essentiel des macroergs, sources d'énergie dans la genèse de divers composés. Les enzymes régulent leur activité par phosphorylation-déphosphorylation.
Partie nucléoprotéines comprend l'ADN et l'ARN. Les apoprotéines sont soit des histones, soit des protamines. Tout chromosome est un complexe d'une molécule d'ADN avec de nombreuses histones. En utilisant nucléosome il y a un enroulement du fil de ce polynucléotide, ce qui réduit son volume.
Glycoprotéines comprennent divers glucides (oligosaccharides, type GAG acide hyaluronique, chondroïtine-, dermatane-, kératane-, héparane sulfates). Le mucus, riche en glycoprotéines, a une viscosité élevée, protégeant les parois des organes creux des irritants. Les glycoprotéines membranaires assurent les contacts intercellulaires, le travail des récepteurs, dans les membranes plasmiques des érythrocytes, elles sont responsables de la spécificité de groupe du sang. Les anticorps (oligosaccharides) interagissent avec des antigènes spécifiques. Le même principe sous-tend le fonctionnement des interférons, le système du complément. La céruloplasmine et la transferrine, qui transportent les ions cuivre et fer dans le plasma sanguin, sont également des glycoprotéines. Certaines hormones de l'adénohypophyse appartiennent à cette classe de protéines.
Lipoprotéines le groupe prothétique contient divers lipides (TAG, cholestérol libre, ses esters, PL). Malgré la présence des plus diverses substances, le principe de la structure des micelles LP est similaire (Fig. 1.1). A l'intérieur de cette particule se trouve une goutte de graisse contenant des lipides non polaires : TAG et esters de cholestérol. A l'extérieur, le noyau est entouré d'une membrane monocouche formée de PL, une protéine (apolipoprotéine) et HS. Certaines protéines sont intégrales et ne peuvent pas être séparées de la lipoprotéine, tandis que d'autres peuvent être transférées d'un complexe à un autre. Les fragments de polypeptides forment la structure de la particule, interagissent avec les récepteurs à la surface de la cellule, déterminent les tissus qui en ont besoin, servent d'enzymes ou de leurs activateurs qui modifient la LP. Les types de lipoprotéines suivants ont été isolés par ultracentrifugation : XM, VLDL, LPPP, LDL, HDL. Chaque type de LP se forme dans des tissus différents et assure le transport de certains lipides dans les fluides biologiques. Les molécules de ces protéines sont très solubles dans le sang, tk. ont petite taille et une charge négative à la surface. Une partie du LP est capable de se diffuser facilement à travers l'intima des artères, en la nourrissant. Chylomicrons servent de transporteurs de lipides exogènes, se déplaçant d'abord à travers la lymphe, puis à travers la circulation sanguine. Au fur et à mesure de leur progression, les HM perdent leurs lipides, les donnant aux cellules. VLDL servent de principales formes de transport des lipides synthétisés dans le foie, principalement les TAG, et la livraison du cholestérol endogène des hépatocytes aux organes et tissus est effectuée LDL. Au fur et à mesure qu'ils donnent des lipides aux cellules cibles, leur densité augmente (convertie en LPPP). La phase catabolique du métabolisme du cholestérol s'effectue HDL, qui le transportent des tissus vers le foie, d'où il est excrété dans la bile par le tractus gastro-intestinal du corps.
À chromoprotéines le groupement prosthétique peut être une substance ayant une couleur. Sous-classe − hémoprotéines, sert de partie non protéique gemme. Hémoglobine les érythrocytes assurent les échanges gazeux, ont une structure quaternaire, se composent de 4 chaînes polypeptidiques différentes dans l'embryon, le fœtus, l'enfant (Section IV. Chapitre 1). Contrairement à Hb. myoglobine a un hème et une chaîne polypeptidique, pliés en un globule. L'affinité de la myoglobine pour l'oxygène est supérieure à celle de l'hémoglobine, elle est donc capable d'accepter le gaz, de se déposer et de donner aux mitochondries au besoin. Les protéines contenant de l'hème sont catalase, peroxydase, qui sont des enzymes ARZ ; cytochromes- composants de l'ETC, qui est responsable du principal processus bioénergétique dans les cellules. Parmi les déshydrogénases, participant à la respiration tissulaire, on trouve flavoprotéines- chromoprotéines qui ont une couleur jaune (flavos - jaune) en raison de la présence de flavonoïdes en elles - composants de FMN et FAD. Rhodopsine est une protéine complexe dont le groupe prosthétique est forme active vitamine A - rétinol jaune orange. Le violet visuel - la principale substance sensible à la lumière des bâtonnets rétiniens, permet la perception de la lumière au crépuscule.
Fonctions des protéines
| De construction
(Plastique) |
Les protéines forment la base des membranes cellulaires et organoïdes, et forment également la base des tissus (collagène dans le tissu conjonctif). |
| catalytique | Toutes les enzymes sont des protéines - des biocatalyseurs. |
| Réglementaire | De nombreuses hormones sécrétées par l'hypophyse antérieure et les glandes parathyroïdes sont de nature protéique. |
| Le transport | Dans le plasma sanguin albumines assurer le transfert de l'IVH, de la bilirubine. Transferrine responsable de la livraison des cations de fer. |
| Respiratoire | Micelle hémoglobine, localisés dans les érythrocytes, sont capables de se lier à divers gaz, principalement à l'oxygène, au dioxyde de carbone, participant directement aux échanges gazeux. |
| Contractile | Protéines spécifiques des myocytes ( actine et myosine) participent à la contraction et à la relaxation. Une protéine du cytosquelette présente un effet similaire au moment de la ségrégation des chromosomes pendant la mitose. tubuline. |
| Protecteur | Les facteurs de coagulation des protéines protègent le corps d'une perte de sang inadéquate. Les protéines immunitaires (γ-globulines, interféron, protéines du système du complément) combattent les substances étrangères qui pénètrent dans l'organisme - antigènes. |
| Homéostatique | Les protéines extra- et intracellulaires peuvent maintenir un niveau de pH constant ( systèmes tampons) et la pression oncotique du milieu. |
| Récepteur | Les glycoprotéines des membranes cellulaires et organoïdes, étant localisées dans les zones extérieures, perçoivent divers signaux régulateurs. |
| visuel | Les signaux visuels dans la rétine sont reçus par une protéine - rhodopsine. |
| Nutritif | Les albumines plasmatiques et les globulines servent de réserves d'acides aminés. |
| Protéines chromosomiques ( histones, protamines) participent à la création d'un équilibre entre l'expression et la répression de l'information génétique. | |
| Énergie | Pendant la famine ou les processus pathologiques, lorsque l'utilisation des glucides à des fins énergétiques est perturbée (dans le diabète sucré), la protéolyse tissulaire est améliorée, dont les produits sont des acides aminés ( cétogène), en décomposition, servent de sources d'énergie. |
La classification des protéines est basée sur leur composition chimique. Selon cette classification, les protéines sont Facile et complexe. Les protéines simples sont composées uniquement d'acides aminés, c'est-à-dire d'un ou plusieurs polypeptides. Les protéines simples présentes dans le corps humain sont albumines, globulines, histones, protéines tissulaires de soutien.
Dans une molécule de protéine complexe, en plus des acides aminés, il existe également une partie non acide aminé appelée groupe prosthétique. Selon la structure de ce groupe, ces protéines complexes se distinguent comme phosphoprotéines ( contiennent de l'acide phosphorique) nucléoprotéines(contiennent de l'acide nucléique), glycoprotéines(contiennent des glucides) lipoprotéines(contiennent des lipoïdes) et autres.
Selon la classification, qui est basée sur la forme spatiale des protéines, les protéines sont divisées en fibrillaire et globulaire.
Les protéines fibrillaires sont constituées d'hélices, c'est-à-dire principalement d'une structure secondaire. Les molécules de protéines globulaires ont une forme sphérique et ellipsoïde.
Un exemple de protéines fibrillaires est collagène - la protéine la plus abondante dans le corps humain. Cette protéine représente 25 à 30 % du nombre total de protéines dans le corps. Le collagène a une résistance et une élasticité élevées. Il fait partie des vaisseaux des muscles, des tendons, du cartilage, des os, des parois vasculaires.
Un exemple de protéines globulaires sont albumines et globulines dans le plasma sanguin.
Propriétés physico-chimiques des protéines.
L'une des principales caractéristiques des protéines est leur haut poids moléculaire, qui varie de 6000 à plusieurs millions de daltons.
Une autre propriété physico-chimique importante des protéines est leur amphotère,c'est-à-dire la présence de propriétés à la fois acides et basiques. L'amphotéricité est associée à la présence dans la composition de certains acides aminés de groupes carboxyle libres, c'est-à-dire acides, et de groupes amino, c'est-à-dire alcalins. Cela conduit au fait que, dans un environnement acide, les protéines présentent des propriétés alcalines et, dans un environnement alcalin, elles sont acides. Cependant, dans certaines conditions, les protéines présentent des propriétés neutres. La valeur de pH à laquelle les protéines sont neutres est appelée point isoelectrique. Le point isoélectrique de chaque protéine est individuel. Les protéines selon cet indicateur sont divisées en deux grandes classes - acide et alcalin car le point isoélectrique peut être déplacé soit d'un côté, soit de l'autre.
Une autre propriété importante des molécules de protéines est solubilité. Malgré leur grande taille moléculaire, les protéines sont assez solubles dans l'eau. De plus, les solutions de protéines dans l'eau sont très stables. La première raison de la solubilité des protéines est la présence d'une charge à la surface des molécules de protéines, grâce à laquelle les molécules de protéines ne forment pratiquement pas d'agrégats insolubles dans l'eau. La deuxième raison de la stabilité des solutions de protéines est la présence d'une enveloppe d'hydrate (eau) dans la molécule de protéine. La coque d'hydratation sépare les protéines les unes des autres.
La troisième propriété physico-chimique importante des protéines est relargage,c'est-à-dire la capacité à précipiter sous l'action d'agents de déshydratation. Le relargage est un processus réversible. Cette capacité à entrer dans la solution, puis à en sortir est très importante pour la manifestation de nombreuses propriétés vitales.
Enfin, la propriété la plus importante des protéines est leur capacité à dénaturation.La dénaturation est la perte de nativeness par une protéine. Lorsque nous faisons des œufs brouillés dans une poêle, nous obtenons une dénaturation irréversible des protéines. La dénaturation est une violation permanente ou temporaire de la structure secondaire et tertiaire de la protéine, mais la structure primaire est préservée. En plus de la température (supérieure à 50 degrés), d'autres facteurs physiques peuvent provoquer une dénaturation : radiations, ultrasons, vibrations, acides forts et alcalis. La dénaturation peut être réversible ou irréversible. Avec de petits impacts, la destruction des structures secondaires et tertiaires de la protéine se produit de manière insignifiante. Ainsi, en l'absence d'effet dénaturant, une protéine peut restaurer sa structure native. Le processus de dénaturation inverse est appelé renaturation.Cependant, avec une exposition prolongée et forte la renaturation devient impossible, et la dénaturation est donc irréversible.
Avant de parler des propriétés des protéines, il convient de donner une brève définition de ce concept. Ce sont des substances organiques de haut poids moléculaire constituées d'acides alpha-aminés reliés par une liaison peptidique. Les protéines sont une partie importante de la nutrition humaine et animale, car tous les acides aminés ne sont pas produits par le corps - certains proviennent des aliments. Quelles sont leurs propriétés et fonctions ?
amphotère
C'est la première caractéristique des protéines. L'amphotère fait référence à leur capacité à présenter à la fois des propriétés acides et basiques.
Les protéines dans leur structure ont plusieurs types de groupes chimiques capables de s'ioniser dans une solution de H 2 O. Ceux-ci incluent:
- résidus carboxyle. Les acides glutamique et aspartique, pour être précis.
- groupes contenant de l'azote. Groupe ε-amino de la lysine, résidu arginine CNH(NH 2) et résidu imidazole d'un acide alpha-aminé hétérocyclique appelé histidine.
Chaque protéine a une caractéristique telle qu'un point isoélectrique. Ce concept est compris comme l'acidité du milieu à laquelle la surface ou la molécule n'a pas de charge électrique. Dans de telles conditions, l'hydratation et la solubilité des protéines sont minimisées.
L'indicateur est déterminé par le rapport des résidus d'acides aminés basiques et acides. Dans le premier cas, le point tombe sur la région alcaline. Dans le second - aigre.

Solubilité
Selon cette propriété, les protéines sont divisées en une petite classification. Voici ce qu'ils sont :
- Soluble. Elles sont appelées albumines. Ils sont peu solubles dans les solutions salines concentrées et coagulent lorsqu'ils sont chauffés. Cette réaction est appelée dénaturation. Le poids moléculaire des albumines est d'environ 65 000. Ils ne contiennent pas de glucides. Et les substances constituées d'albumine sont appelées albuminoïdes. Ceux-ci comprennent le blanc d'œuf, les graines de plantes et le sérum sanguin.
- insoluble. On les appelle scléroprotéines. Un exemple frappant est la kératine, une protéine fibrillaire dont la résistance mécanique est juste derrière la chitine. C'est à partir de cette substance que sont composés les ongles, les cheveux, la rampe de becs et de plumes d'oiseaux, ainsi que les cornes de rhinocéros. Ce groupe de protéines comprend également les cytokératines. C'est le matériau structurel des filaments intracellulaires du cytosquelette des cellules épithéliales. Une autre protéine insoluble est une protéine fibrillaire appelée fibroïne.
- hydrophile. Ils interagissent activement avec l'eau et l'absorbent. Ceux-ci comprennent les protéines de la substance intercellulaire, du noyau et du cytoplasme. Y compris la fibroïne et la kératine notoires.
- hydrophobe. Ils repoussent l'eau. Ceux-ci incluent des protéines qui sont des composants des membranes biologiques.

Dénaturation
C'est le nom du processus de modification d'une molécule protéique sous l'influence de certains facteurs déstabilisants. La séquence d'acides aminés reste la même. Mais les protéines perdent leurs propriétés naturelles (hydrophilie, solubilité et autres).
Il convient de noter que tout changement significatif des conditions externes peut entraîner des violations des structures protéiques. Le plus souvent, la dénaturation est provoquée par une augmentation de la température, ainsi que par l'effet des alcalis, des acides forts, des radiations, des sels de métaux lourds et même de certains solvants sur la protéine.
Fait intéressant, la dénaturation conduit souvent au fait que les particules de protéines sont agrégées en plus grandes. Un excellent exemple est, par exemple, des œufs brouillés. Après tout, tout le monde sait comment, lors de la friture, la protéine se forme à partir d'un liquide transparent.
Vous devriez également parler d'un phénomène tel que la renaturation. Ce processus est l'inverse de la dénaturation. Pendant ce temps, les protéines retrouvent leur structure naturelle. Et c'est vraiment possible. Un groupe de chimistes des États-Unis et d'Australie a trouvé un moyen de renaturer un œuf dur. Cela ne prendra que quelques minutes. Et cela nécessitera de l'urée (diamide d'acide carbonique) et une centrifugation.
Structure
Il faut le dire séparément, puisque nous parlons de l'importance des protéines. Au total, il existe quatre niveaux d'organisation structurelle:
- Primaire. La séquence de résidus d'acides aminés dans une chaîne polypeptidique est signifiée. La principale caractéristique est les motifs conservateurs. Ce sont des combinaisons stables de résidus d'acides aminés. On les trouve dans de nombreuses protéines complexes et simples.
- Secondaire. Cela fait référence à l'ordre d'un fragment local de la chaîne polypeptidique, qui est stabilisé par des liaisons hydrogène.
- Tertiaire. C'est la structure spatiale de la chaîne polypeptidique. Ce niveau est constitué de quelques éléments secondaires (ils sont stabilisés différents types interactions, où les hydrophobes sont les plus importantes). Ici, des liaisons ioniques, hydrogène, covalentes sont impliquées dans la stabilisation.
- Quaternaire. On l'appelle aussi domaine ou sous-unité. Ce niveau se compose de position relative chaînes de polypeptides dans le cadre d'un complexe protéique entier. Il est intéressant de noter que les protéines à structure quaternaire comprennent non seulement des chaînes de polypeptides identiques, mais également différentes.
Cette division a été proposée par un biochimiste danois nommé K. Lindstrom-Lang. Et même s'il est considéré comme obsolète, ils continuent à l'utiliser.

Type de bâtiment
Parlant des propriétés des protéines, il convient également de noter que ces substances sont divisées en trois groupes en fonction du type de structure. À savoir:
- protéines fibrillaires. Ils ont une structure allongée filamenteuse et un poids moléculaire élevé. La plupart d'entre eux sont insolubles dans l'eau. La structure de ces protéines est stabilisée par des interactions entre chaînes polypeptidiques (elles sont constituées d'au moins deux résidus d'acides aminés). Ce sont les substances fibrillaires qui forment le polymère, les fibrilles, les microtubules et les microfilaments.
- protéines globulaires. Le type de structure détermine leur solubilité dans l'eau. MAIS Forme générale les molécules sont sphériques.
- protéines membranaires. La structure de ces substances est caractéristique intéressante. Ils ont des domaines qui traversent la membrane cellulaire, mais des parties d'entre eux font saillie dans le cytoplasme et l'environnement extracellulaire. Ces protéines jouent le rôle de récepteurs - elles transmettent des signaux et sont responsables du transport transmembranaire des nutriments. Il est important de noter qu'ils sont très spécifiques. Chaque protéine ne laisse passer qu'une certaine molécule ou un certain signal.
Simple
Vous pouvez également en dire un peu plus à leur sujet. Les protéines simples ne sont constituées que de chaînes de polypeptides. Ceux-ci inclus:
- Protamine. Protéine nucléaire de faible poids moléculaire. Sa présence est la protection de l'ADN contre l'action des nucléases - des enzymes qui attaquent les acides nucléiques.
- Histones. Protéines simples fortement basiques. Ils sont concentrés dans les noyaux des cellules végétales et animales. Ils participent au "conditionnement" des brins d'ADN dans le noyau, ainsi qu'à des processus tels que la réparation, la réplication et la transcription.
- Albumines. Ils ont déjà été mentionnés ci-dessus. Les albumines les plus connues sont le sérum et l'œuf.
- Globuline. Participe à la coagulation du sang, ainsi qu'à d'autres réactions immunitaires.
- Prolamines. Ce sont des protéines de stockage des céréales. Leurs noms sont toujours différents. Dans le blé, ils sont appelés ptyalins. L'orge contient des hordéines. L'avoine a des avsnins. Fait intéressant, les prolamines sont divisées en leurs propres classes de protéines. Il n'y en a que deux : riche en S (avec une teneur en soufre) et pauvre en S (sans lui).

Complexe
Qu'en est-il des protéines complexes ? Ils contiennent des groupements prosthétiques ou sans acides aminés. Ceux-ci inclus:
- Glycoprotéines. Ils contiennent des résidus glucidiques avec une liaison covalente. Ces protéines complexes sont les plus importantes élément structurel membranes cellulaires. Ils comprennent également de nombreuses hormones. Et les glycoprotéines des membranes érythrocytaires déterminent le groupe sanguin.
- Lipoprotéines. Ils sont constitués de lipides (substances semblables aux graisses) et jouent le rôle de "transport" de ces substances dans le sang.
- Métalloprotéines. Ces protéines dans le corps sont d'une grande importance, car sans elles, l'échange de fer ne se produit pas. Leurs molécules contiennent des ions métalliques. Et les représentants typiques de cette classe sont la transferrine, l'hémosidérine et la ferritine.
- Nucléoprotéines. Ils sont constitués de RKN et d'ADN qui n'ont pas de liaison covalente. Un représentant éminent est la chromatine. C'est dans sa composition que l'information génétique est réalisée, l'ADN est réparé et répliqué.
- Phosphoprotéines. Ce sont des résidus d'acide phosphorique liés par covalence. Un exemple est la caséine, qui se trouve à l'origine dans le lait sous forme de sel de calcium (sous forme liée).
- Chromoprotéines. Ils ont une structure simple : une protéine et un composant coloré appartenant au groupe prosthétique. Ils participent à la respiration cellulaire, à la photosynthèse, aux réactions redox, etc. De plus, sans chromoprotéines, l'accumulation d'énergie ne se produit pas.
Métabolisme
On a déjà beaucoup parlé des propriétés physico-chimiques des protéines. Leur rôle dans le métabolisme doit également être mentionné.
Certains acides aminés sont indispensables car ils ne sont pas synthétisés par les organismes vivants. Les mammifères eux-mêmes les obtiennent de la nourriture. Au cours de sa digestion, la protéine est détruite. Ce processus commence par la dénaturation lorsqu'il est placé dans milieu acide. Ensuite - l'hydrolyse, à laquelle participent les enzymes.
Certains acides aminés que le corps reçoit éventuellement sont impliqués dans le processus de synthèse des protéines, dont les propriétés sont nécessaires à sa pleine existence. Et le reste est transformé en glucose - un monosaccharide, qui est l'une des principales sources d'énergie. Les protéines sont très importantes en termes de régimes ou de famine. S'il ne vient pas avec de la nourriture, le corps commencera à "se manger" - traitera ses propres protéines, en particulier les protéines musculaires.

Biosynthèse
Compte tenu des propriétés physicochimiques des protéines, il est nécessaire de se concentrer sur un sujet tel que la biosynthèse. Ces substances sont formées sur la base des informations codées dans les gènes. Toute protéine est une séquence unique de résidus d'acides aminés déterminée par le gène qui la code.
Comment cela peut-il arriver? Un gène codant pour une protéine transfère l'information de l'ADN à l'ARN. C'est ce qu'on appelle la retranscription. Dans la plupart des cas, la synthèse se produit alors sur les ribosomes - c'est l'organite le plus important d'une cellule vivante. Ce processus s'appelle la traduction.
Il existe également la synthèse dite non ribosomique. Il convient également de le mentionner, car nous parlons de l'importance des protéines. Ce type de synthèse est observé chez certaines bactéries et champignons inférieurs. Le processus est effectué par un complexe protéique de haut poids moléculaire (connu sous le nom de NRS synthase), et les ribosomes n'y participent pas.
Et, bien sûr, il y a aussi la synthèse chimique. Il peut être utilisé pour synthétiser des protéines courtes. Pour cela, des méthodes telles que la ligature chimique sont utilisées. C'est le contraire de la biosynthèse notoire sur les ribosomes. La même méthode peut être utilisée pour obtenir des inhibiteurs de certaines enzymes.
De plus, grâce à la synthèse chimique, il est possible d'introduire dans la composition des protéines les résidus d'acides aminés qui ne se trouvent pas dans les substances ordinaires. Disons ceux dont les chaînes latérales ont des marqueurs fluorescents.
Il convient de mentionner que les méthodes de synthèse chimique ne sont pas parfaites. Il existe certaines restrictions. Si la protéine contient plus de 300 résidus, la substance synthétisée artificiellement est susceptible de recevoir une structure incorrecte. Et cela affectera les propriétés.

Substances d'origine animale
Ils doivent être considérés Attention particulière. La protéine animale est une substance présente dans les œufs, la viande, les produits laitiers, la volaille, les fruits de mer et le poisson. Ils contiennent tous les acides aminés nécessaire pour le corps, dont 9 irremplaçables. Ici toute la ligne Les fonctions les plus importantes que remplissent les protéines animales :
- Catalyse de nombreuses réactions chimiques. Cette substance les lance et les accélère. Les protéines enzymatiques en sont « responsables ». Si le corps n'en reçoit pas suffisamment, l'oxydation et la réduction, la connexion et la rupture des liaisons moléculaires, ainsi que le transport des substances ne se dérouleront pas complètement. Fait intéressant, seule une petite partie des acides aminés entrent dans divers types d'interactions. Et une quantité encore plus petite (3-4 résidus) est directement impliquée dans la catalyse. Toutes les enzymes sont divisées en six classes - oxydoréductases, transférases, hydrolases, lyases, isomérases, ligases. Chacun d'eux est responsable d'une réaction particulière.
- Formation du cytosquelette qui forme la structure des cellules.
- Protection immunitaire, chimique et physique.
- Transport de composants importants nécessaires à la croissance et au développement des cellules.
- La transmission d'impulsions électriques qui sont importantes pour le fonctionnement de tout l'organisme, car sans elles l'interaction des cellules est impossible.
Et ce ne sont pas toutes les fonctions possibles. Mais même ainsi, la signification de ces substances est claire. La synthèse des protéines dans les cellules et dans le corps est impossible si une personne ne mange pas ses sources. Et ce sont de la viande de dinde, du bœuf, de l'agneau, de la viande de lapin. Beaucoup de protéines se trouvent dans les œufs, la crème sure, le yaourt, le fromage cottage, le lait. Vous pouvez également activer la synthèse des protéines dans les cellules du corps en ajoutant du jambon, des abats, des saucisses, du ragoût et du veau à votre alimentation.
Et ils sont l'un des plus complexes en structure et en composition parmi tous les composés organiques.
Rôle biologique protéines est exceptionnellement grande : elles constituent l'essentiel du protoplasme et des noyaux des cellules vivantes. Substances protéiques trouve dans tous les organismes végétaux et animaux. La réserve de protéines dans la nature peut être jugée par la quantité totale de matière vivante sur notre planète : la masse de protéines est d'environ 0,01 % de la masse de la croûte terrestre, soit 10 16 tonnes.
Écureuils dans leur composition élémentaire, ils diffèrent des glucides et des graisses : en plus du carbone, de l'hydrogène et de l'oxygène, ils contiennent également de l'azote. De plus, permanente partie intégrante le composé protéique le plus important est le soufre et certaines protéines contiennent du phosphore, du fer et de l'iode.
Propriétés des protéines
1. Solubilité différente dans l'eau. Les protéines solubles forment des solutions colloïdales.
2. Hydrolyse - sous l'action de solutions d'acides minéraux ou d'enzymes, la destruction se produit structure primaire des protéines et la formation d'un mélange d'acides aminés.
3. Dénaturation- destruction partielle ou totale de la structure spatiale inhérente à une molécule protéique donnée. Dénaturation se déroule sous l'influence de :
- - haute température
- - solutions d'acides, d'alcalis et de solutions salines concentrées
- - solutions de sels de métaux lourds
- - quelques matière organique(formaldéhyde, phénol)
- - rayonnement radioactif
La structure des protéines
La structure des protéines commencé à étudier au XIXe siècle. En 1888 Le biochimiste russe A.Ya.Danilevsky a suggéré la présence d'une liaison amide dans les protéines. Cette idée a été développée par le chimiste allemand E. Fischer et a trouvé une confirmation expérimentale dans ses travaux. Il a offert polypeptide théorie structurale écureuil. Selon cette théorie, une molécule protéique est constituée d'une longue chaîne ou de plusieurs chaînes polypeptidiques liées les unes aux autres. Ces chaînes peuvent être de différentes longueurs.
Fisher tenait un grand travail expérimental Avec polypeptides. Des polypeptides supérieurs contenant 15 à 18 acides aminés sont précipités à partir de solutions avec du sulfate d'ammonium (alun d'ammonium), c'est-à-dire qu'ils présentent des propriétés caractéristiques de protéines. Il a été montré que les polypeptides sont clivés par les mêmes enzymes que les protéines, et lorsqu'ils sont introduits dans le corps d'un animal, ils subissent les mêmes transformations que les protéines, et tout leur azote est libéré normalement sous forme d'urée (urée).
Les recherches menées au XXe siècle ont montré qu'il existe plusieurs niveaux d'organisation molécule de protéine.

Il existe des milliers de protéines différentes dans le corps humain et presque toutes sont construites à partir d'un ensemble standard de 20 acides aminés. La séquence de résidus d'acides aminés dans une molécule de protéine est appelée structure primaire écureuil. Propriétés des protéines et leurs fonctions biologiques sont déterminées par la séquence d'acides aminés. Travaux de clarification structure primaire des protéines ont été réalisées pour la première fois à l'Université de Cambridge sur l'exemple de l'une des protéines les plus simples - insuline . Pendant 10 ans, le biochimiste anglais F. Senger a analysé insuline. À la suite de l'analyse, il a été constaté que la molécule insuline se compose de deux chaînes polypeptidiques et contient 51 résidus d'acides aminés. Il a découvert que l'insuline a une masse molaire de 5687 g/mol et que sa composition chimique correspond à la formule C 254 H 337 N 65 O 75 S 6 . L'analyse a été effectuée manuellement à l'aide d'enzymes qui hydrolysent sélectivement les liaisons peptidiques entre certains résidus d'acides aminés.
Actuellement, la plupart des travaux sur la définition structure primaire des protéines automatique. Ainsi, la structure primaire de l'enzyme a été établie lysozyme.
Le type "d'empilement" de la chaîne polypeptidique est appelé la structure secondaire. Plus protéines la chaîne polypeptidique s'enroule en une bobine ressemblant à un "ressort étiré" (appelée "hélice A" ou "structure A"). Un autre type courant de structure secondaire est la structure en feuille pliée (appelée "structure B"). Alors, protéine de soie - fibroïne a exactement cette structure. Il est constitué d'une série de chaînes polypeptidiques parallèles entre elles et reliées par des liaisons hydrogène, grand nombre ce qui rend la soie très souple et résistante à la déchirure. Avec tout cela, il n'y a pratiquement pas de protéines dont les molécules ont 100% de "structure A" ou de "structure B".
 Protéine de fibroïne - protéine de soie naturelle
Protéine de fibroïne - protéine de soie naturelle La position spatiale de la chaîne polypeptidique est appelée la structure tertiaire de la protéine. La plupart des protéines sont classées comme globulaires car leurs molécules sont repliées en globules. La protéine conserve cette forme grâce aux liaisons entre des ions chargés différemment (-COO - et -NH 3 + et des ponts disulfure. De plus, molécule de protéine pliées de manière à ce que les chaînes hydrocarbonées hydrophobes soient à l'intérieur du globule, et les hydrophiles à l'extérieur.
La méthode consistant à combiner plusieurs molécules de protéines en une seule macromolécule est appelée structure protéique quaternaire. Un bon exemple d'une telle protéine est hémoglobine. Il a été constaté que, par exemple, pour un adulte, la molécule hémoglobine se compose de 4 chaînes polypeptidiques distinctes et d'une partie non protéique - l'hème.
Propriétés des protéines explique leur structure différente. La plupart des protéines sont amorphes, insolubles dans l'alcool, l'éther et le chloroforme. Dans l'eau, certaines protéines peuvent se dissoudre pour former une solution colloïdale. De nombreuses protéines sont solubles dans des solutions alcalines, certaines dans des solutions salines et d'autres dans de l'alcool dilué. L'état cristallin des blancs est rare: un exemple est les grains d'aleurone trouvés dans les graines de ricin, les citrouilles et le chanvre. cristallise aussi albumenœuf de poule et hémoglobine en sang.
Hydrolyse des protéines
Lorsqu'elles sont bouillies avec des acides ou des alcalis, ainsi que sous l'action d'enzymes, les protéines se décomposent en composés chimiques plus simples, formant un mélange d'acides aminés A à la fin de la chaîne de transformation. Un tel fractionnement est appelé hydrolyse des protéines. Hydrolyse des protéines a un grand signification biologique: pénétrant dans l'estomac et les intestins d'un animal ou d'une personne, la protéine est décomposée par l'action d'enzymes en acides aminés. Les acides aminés résultants, sous l'influence d'enzymes, forment à nouveau des protéines, mais déjà caractéristiques de cet organisme !
Dans les produits hydrolyse des protéines en plus des acides aminés, des glucides, de l'acide phosphorique et des bases puriques ont été trouvés. Sous l'influence de certains facteurs, par exemple le chauffage, les solutions de sels, d'acides et d'alcalis, l'action du rayonnement, les secousses, la structure spatiale inhérente à une molécule de protéine donnée peut être perturbée. Dénaturation peut être réversible ou irréversible, mais dans tous les cas, la séquence d'acides aminés, c'est-à-dire la structure primaire, reste inchangée. À la suite de la dénaturation, la protéine cesse d'exercer ses fonctions biologiques.
Pour les protéines, certaines réactions colorées sont connues qui sont caractéristiques de leur détection. Lorsque l'urée est chauffée, il se forme du biuret qui, avec une solution de sulfate de cuivre en présence d'alcali, donne une couleur violette ou une réaction qualitative pour les protéines, ce qui peut être fait à la maison). La réaction du biuret est produite par des substances contenant un groupe amide, et ce groupe est présent dans la molécule de protéine. La réaction de la xantoprotéine est que la protéine du concentré acide nitrique teint dans jaune. Cette réaction indique la présence d'un groupe benzène dans la protéine, qui se trouve dans les acides aminés tels que la phénylalanine et la tyrosine.
Lorsqu'elle est bouillie avec une solution aqueuse de nitrate de mercure et d'acide nitreux, la protéine prend une couleur rouge. Cette réaction indique la présence de tyrosine dans la protéine. En l'absence de tyrosine, la coloration rouge n'apparaît pas.