Grundlegende chemische Eigenschaften von Proteinen. Funktionen von Proteinen im Körper
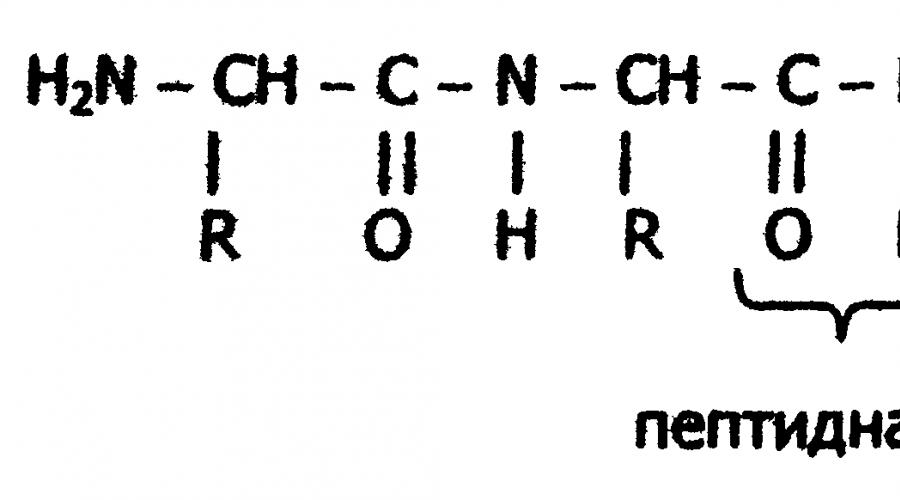
Lesen Sie auch
Nr. 1. Proteine: Peptidbindungen, ihr Nachweis.
Proteine sind Makromoleküle aus linearen Polyamiden, die durch a-Aminosäuren als Ergebnis einer Polykondensationsreaktion in biologischen Objekten gebildet werden.
Eichhörnchen sind Verbindungen mit hohem Molekulargewicht, aus denen hergestellt wird Aminosäuren. An der Bildung von Proteinen sind 20 Aminosäuren beteiligt. Sie verbinden sich zu langen Ketten, die die Grundlage für ein Proteinmolekül mit hohem Molekulargewicht bilden.
Funktionen von Proteinen im Körper
Die Kombination der besonderen chemischen und physikalischen Eigenschaften von Proteinen verleiht dieser Klasse organischer Verbindungen eine zentrale Rolle bei den Phänomenen des Lebens.
Proteine haben Folgendes biologische Eigenschaften oder führen in lebenden Organismen die folgenden Grundfunktionen aus:
1. Katalytische Funktion von Proteinen. Alle biologischen Katalysatoren – Enzyme – sind Proteine. Derzeit wurden Tausende von Enzymen charakterisiert, viele davon in kristalliner Form isoliert. Fast alle Enzyme sind leistungsstarke Katalysatoren, die die Reaktionsgeschwindigkeit um mindestens das Millionenfache erhöhen. Diese Funktion von Proteinen ist einzigartig und nicht charakteristisch für andere Polymermoleküle.
2. Ernährung (Reservefunktion von Proteinen). Dabei handelt es sich in erster Linie um Proteine, die den sich entwickelnden Embryo ernähren sollen: Milchkasein, Ei-Ovalbumin, Reserveproteine von Pflanzensamen. Zweifellos werden im Körper eine Reihe anderer Proteine als Quelle für Aminosäuren verwendet, die wiederum Vorläufer biologisch aktiver Substanzen sind, die den Stoffwechselprozess regulieren.
3. Transportfunktion von Proteinen. Der Transport vieler kleiner Moleküle und Ionen erfolgt durch spezifische Proteine. Beispielsweise wird die Atmungsfunktion des Blutes, nämlich die Sauerstoffübertragung, von Hämoglobinmolekülen übernommen – einem Protein der roten Blutkörperchen. Serumalbumine sind am Lipidtransport beteiligt. Eine Reihe anderer Molkenproteine bilden Komplexe mit Fetten, Kupfer, Eisen, Thyroxin, Vitamin A und anderen Verbindungen und gewährleisten so deren Abgabe an die entsprechenden Organe.
4. Schutzfunktion von Proteinen. Die Hauptschutzfunktion übernimmt das Immunsystem, das die Synthese spezifischer Schutzproteine – Antikörper – als Reaktion auf das Eindringen von Bakterien, Toxinen oder Viren (Antigenen) in den Körper gewährleistet. Antikörper binden Antigene, interagieren mit ihnen, neutralisieren dadurch deren biologische Wirkung und erhalten den normalen Zustand des Körpers aufrecht. Ein weiteres Beispiel für die Schutzfunktion von Proteinen ist die Gerinnung des Blutplasmaproteins Fibrinogen und die Bildung eines Blutgerinnsels, das vor Blutverlust bei Verletzungen schützt.
5. Kontraktile Funktion von Proteinen. An der Muskelkontraktion und -entspannung sind viele Proteine beteiligt. Die Hauptrolle bei diesen Prozessen spielen Aktin und Myosin – spezifische Proteine des Muskelgewebes. Die kontraktile Funktion ist auch den Proteinen subzellulärer Strukturen innewohnend, was die feinsten Prozesse des Zelllebens gewährleistet,
6. Strukturelle Funktion von Proteinen. Proteine mit dieser Funktion stehen unter den anderen Proteinen im menschlichen Körper an erster Stelle. Strukturproteine wie Kollagen sind im Bindegewebe weit verbreitet; Keratin in Haaren, Nägeln, Haut; Elastin – in Gefäßwänden usw.
7. Hormonelle (regulatorische) Funktion von Proteinen. Der Stoffwechsel im Körper wird durch verschiedene Mechanismen reguliert. Eine wichtige Rolle bei dieser Regulierung spielen die von den endokrinen Drüsen produzierten Hormone. Eine Reihe von Hormonen werden durch Proteine oder Polypeptide repräsentiert, beispielsweise Hormone der Hypophyse, der Bauchspeicheldrüse usw.
Peptidbindung
Formal kann die Bildung eines Proteinmakromoleküls als Polykondensationsreaktion von α-Aminosäuren dargestellt werden.
Aus chemischer Sicht handelt es sich bei Proteinen um hochmolekulare stickstoffhaltige organische Verbindungen (Polyamide), deren Moleküle aus Aminosäureresten aufgebaut sind. Die Monomere von Proteinen sind α-Aminosäuren. gemeinsames Merkmal Dies ist das Vorhandensein einer Carboxylgruppe -COOH und einer Aminogruppe -NH 2 am zweiten Kohlenstoffatom (α-Kohlenstoffatom):
Basierend auf den Ergebnissen der Untersuchung der Produkte der Proteinhydrolyse und den von A.Ya. Danilevskys Vorstellungen über die Rolle von Peptidbindungen -CO-NH- beim Aufbau eines Proteinmoleküls schlug der deutsche Wissenschaftler E. Fischer zu Beginn des 20. Jahrhunderts die Peptidtheorie der Proteinstruktur vor. Nach dieser Theorie sind Proteine lineare Polymere aus α-Aminosäuren, die durch ein Peptid verbunden sind Bindung - Polypeptide:

In jedem Peptid hat ein terminaler Aminosäurerest eine freie α-Aminogruppe (N-Terminus) und der andere eine freie α-Carboxylgruppe (C-Terminus). Die Struktur von Peptiden wird üblicherweise ausgehend von der N-terminalen Aminosäure dargestellt. In diesem Fall werden Aminosäurereste durch Symbole bezeichnet. Zum Beispiel: Ala-Tyr-Leu-Ser-Tyr- - Cys. Dieser Eintrag bezeichnet ein Peptid, in dem sich die N-terminale α-Aminosäure befindet wird von Alanin und dem C-Terminus gebildet - Cystein. Beim Lesen einer solchen Aufzeichnung ändern sich die Endungen der Namen aller Säuren mit Ausnahme der letzten in „Schlamm“: Alanyl-Tyrosyl-Leucyl-Seryl-Tyrosyl-Cystein. Die Länge der Peptidkette in Peptiden und Proteinen im Körper reicht von zwei bis zu Hunderten und Tausenden von Aminosäureresten.
Nr. 2. Klassifizierung einfacher Proteine.
ZU einfach (Proteine) umfassen Proteine, die bei der Hydrolyse nur Aminosäuren ergeben.
Proteinoide ____einfache Proteine tierischen Ursprungs, unlöslich in Wasser, Salzlösungen, verdünnten Säuren und Laugen. Führen hauptsächlich unterstützende Funktionen aus (z. B. Kollagen, Keratin).
Protamine – positiv geladene Kernproteine mit einem Molekulargewicht von 10-12 kDa. Sie bestehen zu etwa 80 % aus alkalischen Aminosäuren, was ihnen die Fähigkeit verleiht, über ionische Bindungen mit Nukleinsäuren zu interagieren. Beteiligen Sie sich an der Regulierung der Genaktivität. Sehr gut wasserlöslich;
Histone - Kernproteine, die spielen wichtige Rolle bei der Regulierung der Genaktivität. Sie kommen in allen eukaryotischen Zellen vor und werden in fünf Klassen eingeteilt, die sich im Molekulargewicht und Aminosäuregehalt unterscheiden. Das Molekulargewicht von Histonen liegt zwischen 11 und 22 kDa, und Unterschiede in der Aminosäurezusammensetzung betreffen Lysin und Arginin, deren Gehalt zwischen 11 und 29 % bzw. 2 bis 14 % variiert;
Prolamine – unlöslich in Wasser, aber löslich in 70 % Alkohol, chemische Strukturmerkmale – viel Prolin, Glutaminsäure, kein Lysin ,
Gluteline – löslich in alkalischen Lösungen ,
Globuline – Proteine, die in Wasser und in einer halbgesättigten Ammoniumsulfatlösung unlöslich, aber in wässrigen Lösungen von Salzen, Laugen und Säuren löslich sind. Molekulargewicht – 90–100 kDa;
Albumine – Proteine aus tierischen und pflanzlichen Geweben, löslich in Wasser und Salzlösungen. Die Molekularmasse beträgt 69 kDa;
Skleroproteine – Proteine des Stützgewebes von Tieren
Beispiele für einfache Proteine sind Seidenfibroin, Eierserumalbumin, Pepsin usw.
Nr. 3. Methoden zur Isolierung und Fällung (Reinigung) von Proteinen.





Nummer 4. Proteine als Polyelektrolyte. Isoelektrischer Punkt eines Proteins.
Proteine sind amphotere Polyelektrolyte, d.h. weisen sowohl saure als auch basische Eigenschaften auf. Dies ist auf das Vorhandensein ionisierfähiger Aminosäurereste in Proteinmolekülen sowie auf freie α-Amino- und α-Carboxylgruppen an den Enden der Peptidketten zurückzuführen. Die sauren Eigenschaften des Proteins werden durch saure Aminosäuren (Asparaginsäure, Glutaminsäure) und die alkalischen Eigenschaften durch basische Aminosäuren (Lysin, Arginin, Histidin) bestimmt.
Die Ladung eines Proteinmoleküls hängt von der Ionisierung saurer und basischer Gruppen von Aminosäureradikalen ab. Abhängig vom Verhältnis negativer und positiver Gruppen erhält das Proteinmolekül als Ganzes eine insgesamt positive oder negative Ladung. Wenn eine Proteinlösung angesäuert wird, nimmt der Ionisierungsgrad der anionischen Gruppen ab und der kationische Gruppen zu; Beim Alkalisieren ist das Gegenteil der Fall. Bei einem bestimmten pH-Wert gleicht sich die Anzahl der positiv und negativ geladenen Gruppen an und das Protein befindet sich in einem isoelektrischen Zustand (die Gesamtladung beträgt 0). Der pH-Wert, bei dem sich ein Protein im isoelektrischen Zustand befindet, wird isoelektrischer Punkt genannt und ähnlich wie bei Aminosäuren mit pI bezeichnet. Bei den meisten Proteinen liegt der pI im Bereich von 5,5–7,0, was auf ein gewisses Vorherrschen saurer Aminosäuren in Proteinen hinweist. Es gibt jedoch auch alkalische Proteine, zum Beispiel Salmin – das Hauptprotein aus Lachsmilch (pl = 12). Darüber hinaus gibt es Proteine, bei denen pI einen sehr niedrigen Wert hat, beispielsweise Pepsin, ein Enzym im Magensaft (pl=l). Am isoelektrischen Punkt sind Proteine sehr instabil und fallen leicht aus, wobei sie die geringste Löslichkeit aufweisen.
Wenn sich das Protein nicht in einem isoelektrischen Zustand befindet, dann elektrisches Feld Seine Moleküle bewegen sich je nach Vorzeichen der Gesamtladung und mit einer Geschwindigkeit proportional zu ihrer Größe zur Kathode oder Anode. Dies ist die Essenz der Elektrophoresemethode. Mit dieser Methode können Proteine mit unterschiedlichen pI-Werten getrennt werden.
Obwohl Proteine Puffereigenschaften haben, ist ihre Kapazität bei physiologischen pH-Werten begrenzt. Eine Ausnahme bilden Proteine, die viel Histidin enthalten, da nur der Histidinrest puffernde Eigenschaften im pH-Bereich von 6–8 aufweist. Es gibt nur sehr wenige solcher Proteine. Beispielsweise ist Hämoglobin, das fast 8 % Histidin enthält, ein starker intrazellulärer Puffer in roten Blutkörperchen, der den pH-Wert des Blutes auf einem konstanten Niveau hält.
№5. Physikalisch-chemische Eigenschaften Proteine.
Proteine haben unterschiedliche chemische, physikalische und biologische Eigenschaften, die durch die Aminosäurezusammensetzung und die räumliche Organisation jedes Proteins bestimmt werden. Die chemischen Reaktionen von Proteinen sind sehr vielfältig und werden durch die Anwesenheit von NH 2 -, COOH-Gruppen und Radikalen unterschiedlicher Natur verursacht. Dies sind Reaktionen der Nitrierung, Acylierung, Alkylierung, Veresterung, Oxidations-Reduktion und andere. Proteine haben Säure-Base-, Puffer-, kolloidale und osmotische Eigenschaften.
Säure-Base-Eigenschaften von Proteinen
Chemische Eigenschaften. Wenn wässrige Proteinlösungen leicht erhitzt werden, kommt es zur Denaturierung. In diesem Fall bildet sich ein Niederschlag.
Beim Erhitzen von Proteinen mit Säuren kommt es zur Hydrolyse, wodurch ein Aminosäuregemisch entsteht.
Physikochemische Eigenschaften von Proteinen
Proteine haben ein hohes Molekulargewicht.
Ladung eines Proteinmoleküls. Alle Proteine haben mindestens eine freie -NH- und -COOH-Gruppe.
Proteinlösungen- kolloidale Lösungen mit unterschiedlichen Eigenschaften. Proteine sind sauer und basisch. Saure Proteine enthalten viel Glu und Asp, die über zusätzliche Carboxyl- und weniger Aminogruppen verfügen. Alkalische Proteine enthalten viel Lys und Arg. Jedes Proteinmolekül in einer wässrigen Lösung ist von einer Hydratationshülle umgeben, da Proteine aufgrund von Aminosäuren viele hydrophile Gruppen (-COOH, -OH, -NH 2, -SH) aufweisen. In wässrigen Lösungen ist das Proteinmolekül geladen. Der Proteingehalt im Wasser kann je nach pH-Wert variieren.
Proteinfällung. Proteine haben eine Hydratationshülle, eine Ladung, die verhindert, dass sie zusammenkleben. Zur Deponierung ist es notwendig, die Hydratationshülle zu entfernen und aufzuladen.
1.Hydratation. Der Prozess der Hydratation bedeutet die Bindung von Wasser durch Proteine, und sie weisen hydrophile Eigenschaften auf: Sie quellen auf, ihre Masse und ihr Volumen nehmen zu. Das Quellen des Proteins geht mit seiner teilweisen Auflösung einher. Die Hydrophilie einzelner Proteine hängt von ihrer Struktur ab. Die hydrophilen Amid- (–CO-NH–, Peptidbindung), Amin- (NH2) und Carboxylgruppen (COOH), die in der Zusammensetzung vorhanden sind und sich auf der Oberfläche des Proteinmakromoleküls befinden, ziehen Wassermoleküle an und richten sie strikt an der Oberfläche des Moleküls aus . Durch die umgebenden Proteinkügelchen verhindert eine Hydratationshülle (wässrig) die Stabilität von Proteinlösungen. Am isoelektrischen Punkt haben Proteine die geringste Fähigkeit, Wasser zu binden; die Hydratationshülle um die Proteinmoleküle wird zerstört, sodass sie sich zu großen Aggregaten verbinden. Zur Aggregation von Proteinmolekülen kommt es auch, wenn sie mit bestimmten organischen Lösungsmitteln wie Ethylalkohol dehydriert werden. Dies führt zur Ausfällung von Proteinen. Wenn sich der pH-Wert der Umgebung ändert, wird das Proteinmakromolekül aufgeladen und seine Hydratationskapazität ändert sich.
Fällungsreaktionen werden in zwei Typen unterteilt.
Aussalzen von Proteinen: (NH 4)SO 4 – nur die Hydratationshülle wird entfernt, das Protein behält alle Arten seiner Struktur, alle Verbindungen und behält seine natürlichen Eigenschaften. Solche Proteine können dann wieder aufgelöst und verwendet werden.
Niederschlag mit Verlust der nativen Proteineigenschaften ist ein irreversibler Prozess. Die Hydratationshülle und Ladung werden vom Protein entfernt und verschiedene Eigenschaften im Protein werden gestört. Zum Beispiel Salze von Kupfer, Quecksilber, Arsen, Eisen, konzentrierte anorganische Säuren – HNO 3, H 2 SO 4, HCl, organische Säuren, Alkaloide – Tannine, Quecksilberiodid. Der Zusatz organischer Lösungsmittel verringert den Hydratationsgrad und führt zur Proteinausfällung. Als solches Lösungsmittel wird Aceton verwendet. Auch Proteine werden mit ausgefällt mit Salzen, zum Beispiel Ammoniumsulfat. Das Prinzip dieser Methode basiert auf der Tatsache, dass bei steigender Salzkonzentration in der Lösung die durch die Protein-Gegenionen gebildeten Ionenatmosphären komprimiert werden, was dazu beiträgt, sie näher an einen kritischen Abstand zu bringen, bei dem die intermolekularen Kräfte der Van-der-Waals-Anziehung wirken überwiegen die Coulomb-Abstoßungskräfte der Gegenionen. Dies führt dazu, dass Proteinpartikel zusammenkleben und ausfallen.
Beim Sieden beginnen sich Proteinmoleküle zufällig zu bewegen, kollidieren, die Ladung wird entfernt und die Hydratationshülle nimmt ab.
Zum Nachweis von Proteinen in Lösung werden verwendet:
Farbreaktionen;
Fällungsreaktionen.
Methoden zur Isolierung und Reinigung von Proteinen.
aussalzen;
Elektrophorese;
Chromatographie: Adsorption, Spaltung;
Ultrazentrifugation.
Homogenisierung- Zellen werden zu einer homogenen Masse gemahlen;
Extraktion von Proteinen mit wässrigen oder Wasser-Salz-Lösungen;
Strukturelle Organisation von Proteinen.
Primärstruktur- bestimmt durch die Reihenfolge der Aminosäuren in der Peptidkette, stabilisiert durch kovalente Peptidbindungen (Insulin, Pepsin, Chymotrypsin).
Sekundärstruktur- räumliche Struktur des Proteins. Dies ist entweder eine -Spirale oder -Faltung. Es entstehen Wasserstoffbrückenbindungen.
Tertiärstruktur- globuläre und fibrilläre Proteine. Stabilisieren Wasserstoffbrückenbindungen, elektrostatische Kräfte (COO-, NH3+), hydrophobe Kräfte, Sulfidbrücken, bestimmt durch die Primärstruktur. Globuläre Proteine – alle Enzyme, Hämoglobin, Myoglobin. Fibrilläre Proteine – Kollagen, Myosin, Aktin.
Quartärstruktur- nur in einigen Proteinen vorhanden. Solche Proteine sind aus mehreren Peptiden aufgebaut. Jedes Peptid hat seine eigene Primär-, Sekundär- und Tertiärstruktur, sogenannte Protomere. Mehrere Protomere verbinden sich zu einem Molekül. Ein Protomer fungiert nicht als Protein, sondern nur im Verbund mit anderen Protomeren.
Beispiel: Hämoglobin = -Kügelchen + -Kügelchen – transportiert O 2 insgesamt und nicht einzeln.
Das Protein kann renaturieren. Dies erfordert eine sehr kurze Einwirkung der Wirkstoffe.

6) Methoden zum Nachweis von Proteinen.
Proteine sind hochmolekulare biologische Polymere, deren strukturelle (monomere) Einheiten α-Aminosäuren sind. Aminosäuren in Proteinen sind durch Peptidbindungen miteinander verbunden. Die Bildung erfolgt aufgrund der Carboxylgruppe, die sich an befindet -Kohlenstoffatom einer Aminosäure und -Aminogruppe einer anderen Aminosäure, wodurch ein Wassermolekül freigesetzt wird. Die Monomereinheiten von Proteinen werden Aminosäurereste genannt.
Peptide, Polypeptide und Proteine unterscheiden sich nicht nur in Menge, Zusammensetzung, sondern auch in der Reihenfolge der Aminosäurereste, physikalisch-chemischen Eigenschaften und im Körper ausgeübten Funktionen. Das Molekulargewicht von Proteinen variiert zwischen 6.000 und 1 Million oder mehr. Chemische und physikalische Eigenschaften Proteine werden durch die chemische Natur und die physikalisch-chemischen Eigenschaften der in ihnen enthaltenen Radikale und Aminosäurereste bestimmt. Methoden zum Nachweis und zur Quantifizierung von Proteinen in biologischen Objekten und Lebensmitteln sowie zu deren Isolierung aus Geweben und biologischen Flüssigkeiten basieren auf den physikalischen und chemischen Eigenschaften dieser Verbindungen.
Proteine interagieren mit bestimmten Chemikalien geben farbige Verbindungen. Die Bildung dieser Verbindungen erfolgt unter Beteiligung von Aminosäureresten, ihren spezifischen Gruppen oder Peptidbindungen. Farbreaktionen ermöglichen Ihnen das Einstellen Vorhandensein von Protein in einem biologischen Objekt oder Lösung und beweisen Sie das Vorhandensein bestimmte Aminosäuren in einem Proteinmolekül. Basierend auf Farbreaktionen wurden einige Methoden zur quantitativen Bestimmung von Proteinen und Aminosäuren entwickelt.
Gilt als universell Biuret- und Ninhydrinreaktionen, da alle Proteine sie liefern. Xanthoprotein-Reaktion, Foll-Reaktion und andere sind spezifisch, da sie durch radikalische Gruppen bestimmter Aminosäuren im Proteinmolekül verursacht werden.
Farbreaktionen ermöglichen die Bestimmung des Vorhandenseins von Protein im untersuchten Material und des Vorhandenseins bestimmter Aminosäuren in seinen Molekülen.
Biuret-Reaktion. Die Reaktion ist auf das Vorhandensein von Proteinen, Peptiden und Polypeptiden zurückzuführen Peptidbindungen, welches in alkalische Umgebung Formular mit Kupfer(II)-Ionen komplexe Verbindungen eingefärbt violette Farbe (mit roter oder blauer Tönung).. Die Farbe ist auf das Vorhandensein von mindestens zwei Gruppen im Molekül zurückzuführen -CO-NH-, direkt miteinander verbunden oder unter Beteiligung eines Kohlenstoff- oder Stickstoffatoms.
Kupfer(II)-Ionen sind durch zwei ionische Bindungen mit =C─O ˉ-Gruppen und vier Koordinationsbindungen mit Stickstoffatomen (=N―) verbunden.
Die Intensität der Farbe hängt von der Proteinmenge in der Lösung ab. Dadurch kann diese Reaktion zur Proteinquantifizierung verwendet werden. Die Farbe farbiger Lösungen hängt von der Länge der Polypeptidkette ab. Proteine ergeben eine blauviolette Farbe; die Produkte ihrer Hydrolyse (Poly- und Oligopeptide) sind rot oder rosa gefärbt. Die Biuret-Reaktion wird nicht nur durch Proteine, Peptide und Polypeptide, sondern auch durch Biuret (NH 2 -CO-NH-CO-NH 2), Oxamid (NH 2 -CO-CO-NH 2) und Histidin hervorgerufen.
Die im alkalischen Milieu gebildete Komplexverbindung von Kupfer (II) mit Peptidgruppen hat folgende Struktur:


Ninhydrin-Reaktion. Bei dieser Reaktion ergeben Lösungen von Proteinen, Polypeptiden, Peptiden und freien α-Aminosäuren beim Erhitzen mit Ninhydrin eine blaue, blauviolette oder rosaviolette Farbe. Die Farbe entsteht bei dieser Reaktion durch die α-Aminogruppe.


α-Aminosäuren reagieren sehr leicht mit Ninhydrin. Daneben wird das blauviolette Ruehmann auch aus Proteinen, Peptiden, primären Aminen, Ammoniak und einigen anderen Verbindungen gebildet. Sekundäre Amine wie Prolin und Hydroxyprolin sorgen für eine gelbe Farbe.
Die Ninhydrin-Reaktion wird häufig zum Nachweis und zur Quantifizierung von Aminosäuren eingesetzt.
Xanthoprotein-Reaktion. Diese Reaktion weist auf das Vorhandensein aromatischer Aminosäurereste in Proteinen hin – Tyrosin, Phenylalanin, Tryptophan. Es basiert auf der Nitrierung des Benzolrings der Reste dieser Aminosäuren unter Bildung gelb gefärbter Nitroverbindungen (griechisch „Xanthos“ – gelb). Am Beispiel von Tyrosin kann diese Reaktion in Form der folgenden Gleichungen beschrieben werden.
In einer alkalischen Umgebung bilden Nitroderivate von Aminosäuren orange gefärbte Salze der Chinoidstruktur. Die Xanthoprotein-Reaktion wird durch Benzol und seine Homologen, Phenol und andere aromatische Verbindungen hervorgerufen.

Reaktionen auf Aminosäuren, die eine Thiolgruppe in reduziertem oder oxidiertem Zustand enthalten (Cystein, Cystin).
Fol-Reaktion. Beim Kochen mit Alkali lässt sich Schwefel leicht in Form von Schwefelwasserstoff vom Cystein trennen, der in alkalischer Umgebung Natriumsulfid bildet:
Dabei sind die Reaktionen zur Bestimmung thiolhaltiger Aminosäuren in Lösung in zwei Stufen unterteilt:
Übergang von Schwefel vom organischen in den anorganischen Zustand
Nachweis von Schwefel in Lösung
Zum Nachweis von Natriumsulfid wird Bleiacetat verwendet, das sich bei Wechselwirkung mit Natriumhydroxid in dessen Bleiacetat umwandelt:
Pb(CH 3 GURREN) 2 + 2NaOH Pb(ONa) 2 +2CH 3 COOH
Durch die Wechselwirkung von Schwefel- und Bleiionen entsteht schwarzes oder braunes Bleisulfid:
N / A 2 S + Pb(Auf einen) 2 + 2 H 2 Ö PbS (schwarzer Rückstand) + 4NaOH
Zur Bestimmung schwefelhaltiger Aminosäuren werden der Testlösung ein gleiches Volumen Natriumhydroxid und einige Tropfen Bleiacetatlösung zugesetzt. Bei intensivem Kochen für 3-5 Minuten verfärbt sich die Flüssigkeit schwarz.
Mit dieser Reaktion kann das Vorhandensein von Cystin festgestellt werden, da Cystin leicht zu Cystein reduziert wird.
Millon-Reaktion:
Dabei handelt es sich um eine Reaktion auf die Aminosäure Tyrosin.
Freie phenolische Hydroxyle von Tyrosinmolekülen ergeben bei Wechselwirkung mit Salzen Verbindungen des Quecksilbersalzes des Nitroderivats von Tyrosin, rosarot gefärbt:

Pauli-Reaktion auf Histidin und Tyrosin . Mithilfe der Pauli-Reaktion lassen sich die Aminosäuren Histidin und Tyrosin im Protein nachweisen, die mit Diazobenzolsulfonsäure kirschrote Komplexverbindungen bilden. Diazobenzolsulfonsäure entsteht bei der Diazotierungsreaktion, wenn Sulfanilsäure mit Natriumnitrit in saurer Umgebung reagiert:

Zur Testlösung werden ein gleiches Volumen einer sauren Sulfanilsäurelösung (hergestellt mit Salzsäure) und das doppelte Volumen einer Natriumnitritlösung gegeben, gründlich gemischt und sofort Soda (Natriumcarbonat) hinzugefügt. Nach dem Rühren verfärbt sich die Mischung in Gegenwart von Histidin oder Tyrosin in der Testlösung kirschrot.


Adamkiewicz-Hopkins-Kohl (Schultz-Raspail) Reaktion auf Tryptophan (Reaktion auf die Indolgruppe). Tryptophan reagiert im sauren Milieu mit Aldehyden und bildet farbige Kondensationsprodukte. Die Reaktion erfolgt aufgrund der Wechselwirkung des Indolrings von Tryptophan mit dem Aldehyd. Es ist bekannt, dass aus Glyoxylsäure in Gegenwart von Schwefelsäure Formaldehyd entsteht:
R  Lösungen, die Tryptophan enthalten, ergeben in Gegenwart von Glyoxyl- und Schwefelsäure eine rotviolette Farbe.
Lösungen, die Tryptophan enthalten, ergeben in Gegenwart von Glyoxyl- und Schwefelsäure eine rotviolette Farbe.
Glyoxylsäure ist in Eisessig immer in geringen Mengen enthalten. Daher kann die Reaktion mit durchgeführt werden Essigsäure. In diesem Fall wird der zu untersuchenden Lösung ein gleiches Volumen an Eisessig (konzentrierter Essigsäure) zugesetzt und vorsichtig erhitzt, bis sich der Niederschlag auflöst. Nach dem Abkühlen wird vorsichtig ein Volumen an konzentrierter Schwefelsäure hinzugefügt, das dem hinzugefügten Volumen an Glyoxylsäure entspricht Die Mischung entlang der Wand verteilen (um eine Vermischung von Flüssigkeiten zu vermeiden). Nach 5–10 Minuten ist an der Grenzfläche zwischen den beiden Schichten die Bildung eines rotvioletten Rings zu beobachten. Wenn Sie die Schichten mischen, wird der Inhalt der Schüssel gleichmäßig violett.
ZU 
 Kondensation von Tryptophan mit Formaldehyd:
Kondensation von Tryptophan mit Formaldehyd:
Das Kondensationsprodukt wird zu Bis-2-tryptophanylcarbinol oxidiert, das in Gegenwart von Mineralsäuren blauviolett gefärbte Salze bildet:


7) Klassifizierung von Proteinen. Methoden zur Untersuchung der Aminosäurezusammensetzung.
Es gibt noch keine strenge Nomenklatur und Klassifizierung von Proteinen. Die Namen von Proteinen werden auf der Grundlage zufälliger Merkmale vergeben, wobei meist die Quelle der Proteinisolierung oder ihre Löslichkeit in bestimmten Lösungsmitteln, die Form des Moleküls usw. berücksichtigt werden.
Proteine werden nach Zusammensetzung, Partikelform, Löslichkeit, Aminosäurezusammensetzung, Herkunft usw. klassifiziert.
1. Nach Zusammensetzung Proteine werden in zwei große Gruppen eingeteilt: einfache und komplexe Proteine.
Zu den einfachen Proteinen gehören Proteine, die bei Hydrolyse nur Aminosäuren ergeben (Proteinoide, Protamine, Histone, Prolamine, Gluteline, Globuline, Albumine). Beispiele für einfache Proteine sind Seidenfibroin, Eierserumalbumin, Pepsin usw.
Komplexe (Proteine) umfassen Proteine, die aus einem einfachen Protein und einer zusätzlichen (prosthetischen) Gruppe nicht-proteinischer Natur bestehen. Die Gruppe der komplexen Proteine wird je nach Art der Nicht-Protein-Komponente in mehrere Untergruppen unterteilt:
Metalloproteine, die Metalle (Fe, Cu, Mg usw.) enthalten, die direkt mit der Polypeptidkette verbunden sind;
Phosphoproteine – enthalten Phosphorsäurereste, die durch Esterbindungen an der Stelle der Hydroxylgruppen von Serin und Threonin an das Proteinmolekül gebunden sind;
Glykoproteine – ihre prothetischen Gruppen sind Kohlenhydrate;
Chromoproteine – bestehen aus einem einfachen Protein und einer damit verbundenen farbigen Nicht-Protein-Verbindung; alle Chromoproteine sind biologisch sehr aktiv; sie können Derivate von Porphyrin, Isoalloxazin und Carotin als prosthetische Gruppen enthalten;
Lipoproteine – prothetische Gruppe Lipide – Triglyceride (Fette) und Phosphatide;
Nukleoproteine sind Proteine, die aus einem einfachen Protein und einer damit verbundenen Nukleinsäure bestehen. Diese Proteine spielen eine große Rolle im Leben des Körpers und werden im Folgenden besprochen. Sie sind Teil jeder Zelle; einige Nukleoproteine kommen in der Natur in Form spezieller Partikel mit pathogener Aktivität (Viren) vor.
2. Nach Partikelform- Proteine werden in fibrilläre (fadenförmige) und globuläre (kugelförmige) Proteine unterteilt (siehe Seite 30).
3. Nach Löslichkeit und Eigenschaften der Aminosäurezusammensetzung Folgende Gruppen einfacher Proteine werden unterschieden:
Proteinoide sind Proteine des Stützgewebes (Knochen, Knorpel, Bänder, Sehnen, Haare, Nägel, Haut usw.). Dabei handelt es sich hauptsächlich um fibrilläre Proteine mit hohem Molekulargewicht (> 150.000 Da), die in gängigen Lösungsmitteln unlöslich sind: Wasser, Salz und Wasser-Alkohol-Mischungen. Sie lösen sich nur in bestimmten Lösungsmitteln;
Protamine (die einfachsten Proteine) sind wasserlösliche Proteine, die 80–90 % Arginin und eine begrenzte Menge (6–8) anderer Aminosäuren enthalten, die in der Milch verschiedener Fische vorkommen. Aufgrund des hohen Arginingehalts haben sie basische Eigenschaften; ihr Molekulargewicht ist relativ gering und beträgt etwa 4000-12000 Da. Sie sind ein Proteinbestandteil von Nukleoproteinen;
Histone sind in Wasser und verdünnten Säurelösungen (0,1 N) gut löslich, zeichnen sich durch einen hohen Gehalt an Aminosäuren aus: Arginin, Lysin und Histidin (mindestens 30 %) und haben daher basische Eigenschaften. Diese Proteine kommen als Teil der Nukleoproteine in erheblichen Mengen in den Zellkernen vor und spielen eine wichtige Rolle bei der Regulierung des Stoffwechsels Nukleinsäuren. Das Molekulargewicht von Histonen ist gering und beträgt 11.000–24.000 Da;
Globuline sind Proteine, die in Wasser und Salzlösungen mit einer Salzkonzentration von mehr als 7 % unlöslich sind. Globuline werden bei 50 %iger Sättigung der Lösung mit Ammoniumsulfat vollständig ausgefällt. Diese Proteine zeichnen sich durch einen hohen Glycingehalt (3,5 %) aus und ihr Molekulargewicht beträgt >100.000 Da. Globuline – leicht saure oder neutrale Proteine (p1=6-7,3);
Albumine sind Proteine, die in Wasser und starken Salzlösungen gut löslich sind und deren Salzkonzentration (NH 4) 2 S0 4 50 % der Sättigung nicht überschreiten sollte. Bei höheren Konzentrationen werden Albumine ausgesalzen. Im Vergleich zu Globulinen enthalten diese Proteine dreimal weniger Glycin und haben ein Molekulargewicht von 40.000–70.000 Da. Albumine haben aufgrund des hohen Gehalts an Glutaminsäure eine übermäßige negative Ladung und saure Eigenschaften (pl = 4,7);
Prolamine sind eine Gruppe pflanzlicher Proteine, die im Gluten vorkommen. Getreidepflanzen. Sie sind nur in 60–80 %iger wässriger Lösung löslich Ethylalkohol. Prolamine haben eine charakteristische Aminosäurezusammensetzung: Sie enthalten viel (20–50 %) Glutaminsäure und Prolin (10–15 %), weshalb sie auch ihren Namen haben. Ihr Molekulargewicht beträgt mehr als 100.000 Da;
Gluteline sind Pflanzenproteine, die in Wasser, Salzlösungen und Ethanol unlöslich sind, jedoch in verdünnten (0,1 N) Lösungen von Alkalien und Säuren löslich sind. Sie ähneln in ihrer Aminosäurezusammensetzung und ihrem Molekulargewicht den Prolaminen, enthalten jedoch mehr Arginin und weniger Prolin.
Methoden zur Untersuchung der Aminosäurezusammensetzung
Unter der Wirkung von Enzymen in Verdauungssäften werden Proteine in Aminosäuren zerlegt. Es wurden zwei wichtige Schlussfolgerungen gezogen: 1) Proteine enthalten Aminosäuren; 2) Hydrolysemethoden können verwendet werden, um die chemische Zusammensetzung, insbesondere die Aminosäurezusammensetzung, von Proteinen zu untersuchen.
Um die Aminosäurezusammensetzung von Proteinen zu untersuchen, wird eine Kombination aus saurer (HCl), alkalischer [Ba(OH) 2 ] und, seltener, enzymatischer Hydrolyse oder einer davon verwendet. Es wurde festgestellt, dass bei der Hydrolyse von reinem Protein, das keine Verunreinigungen enthält, 20 verschiedene α-Aminosäuren freigesetzt werden. Alle anderen im Gewebe von Tieren, Pflanzen und Mikroorganismen vorkommenden Aminosäuren (mehr als 300) kommen in der Natur in freiem Zustand oder in Form kurzer Peptide oder Komplexe mit anderen organischen Substanzen vor.
Der erste Schritt bei der Bestimmung der Primärstruktur von Proteinen ist eine qualitative und quantitative Bewertung der Aminosäurezusammensetzung eines bestimmten einzelnen Proteins. Es muss daran erinnert werden, dass Sie für die Forschung eine bestimmte Menge an reinem Protein benötigen, ohne Beimischungen anderer Proteine oder Peptide.
Saure Hydrolyse von Protein
Um die Aminosäurezusammensetzung zu bestimmen, ist es notwendig, alle Peptidbindungen im Protein zu zerstören. Das analysierte Protein wird in 6 mol/l HC1 bei einer Temperatur von etwa 110 °C für 24 Stunden hydrolysiert. Durch diese Behandlung werden Peptidbindungen im Protein zerstört und im Hydrolysat sind nur noch freie Aminosäuren vorhanden. Darüber hinaus werden Glutamin und Asparagin zu Glutamin- und Asparaginsäure hydrolysiert (d. h. die Amidbindung im Rest wird aufgebrochen und die Aminogruppe wird von ihnen abgespalten).
Trennung von Aminosäuren mittels Ionenaustauschchromatographie
Das durch saure Hydrolyse von Proteinen erhaltene Aminosäuregemisch wird in einer Säule mit einem Kationenaustauscherharz getrennt. Ein solches Kunstharz enthält fest daran gebundene negativ geladene Gruppen (z. B. Sulfonsäurereste -SO 3 -), an die Na + -Ionen gebunden sind (Abb. 1-4).
Dem Kationenaustauscher wird im sauren Milieu (pH 3,0) eine Mischung aus Aminosäuren zugesetzt, wobei es sich bei den Aminosäuren überwiegend um Kationen handelt, d.h. eine positive Ladung tragen. Positiv geladene Aminosäuren lagern sich an negativ geladene Harzpartikel an. Je größer die Gesamtladung der Aminosäure ist, desto stärker ist ihre Bindung an das Harz. So binden die Aminosäuren Lysin, Arginin und Histidin am stärksten an den Kationenaustauscher, Asparaginsäure und Glutaminsäure am schwächsten.
Die Freisetzung von Aminosäuren aus der Säule erfolgt durch Auswaschen (Eluieren) mit einer Pufferlösung mit zunehmender Ionenstärke (d. h. zunehmender NaCl-Konzentration) und pH-Wert. Mit zunehmendem pH-Wert verlieren Aminosäuren ein Proton, wodurch ihre positive Ladung und damit die Bindungsstärke mit den negativ geladenen Harzpartikeln abnimmt.
Jede Aminosäure verlässt die Säule mit einem bestimmten pH-Wert und einer bestimmten Ionenstärke. Durch das Sammeln der Lösung (Eluat) in kleinen Portionen am unteren Ende der Säule können Fraktionen mit einzelnen Aminosäuren gewonnen werden.
(weitere Einzelheiten zum Thema „Hydrolyse“ siehe Frage Nr. 10)
8) Chemische Bindungen in der Proteinstruktur.



9) Das Konzept der Hierarchie und strukturellen Organisation von Proteinen. (siehe Frage Nr. 12)
10) Proteinhydrolyse. Reaktionschemie (Schritte, Katalysatoren, Reagenzien, Reaktionsbedingungen) – eine vollständige Beschreibung der Hydrolyse.
11) Chemische Umwandlungen von Proteinen.
Denaturierung und Renaturierung
Beim Erhitzen von Proteinlösungen auf 60-80 % oder bei Einwirkung von Reagenzien, die nichtkovalente Bindungen in Proteinen zerstören, wird die Tertiär- (Quartär-) und Sekundärstruktur des Proteinmoleküls zerstört; es nimmt mehr oder weniger stark die Struktur an Form einer zufälligen Zufallsspule. Dieser Vorgang wird Denaturierung genannt. Denaturierende Reagenzien können Säuren, Laugen, Alkohole, Phenole, Harnstoff, Guanidinchlorid usw. sein. Der Kern ihrer Wirkung besteht darin, dass sie Wasserstoffbrückenbindungen mit =NH- und =CO-Gruppen des Peptidrückgrats und mit den Säuregruppen von Aminosäureresten bilden Dabei ersetzen sie ihre eigenen intramolekularen Wasserstoffbrückenbindungen in einem Protein, wodurch sich die Sekundär- und Tertiärstrukturen verändern. Bei der Denaturierung nimmt die Löslichkeit des Proteins ab, es „koaguliert“ (zum Beispiel beim Kochen). Hühnerei) geht die biologische Aktivität des Proteins verloren. Dies ist beispielsweise die Grundlage für den Einsatz einer wässrigen Lösung von Karbolsäure (Phenol) als Antiseptikum. Unter bestimmten Bedingungen kommt es beim langsamen Abkühlen einer denaturierten Proteinlösung zu einer Renaturierung – einer Wiederherstellung der ursprünglichen (nativen) Konformation. Dies bestätigt die Tatsache, dass die Art der Faltung der Peptidkette durch die Primärstruktur bestimmt wird.
Der Prozess der Denaturierung eines einzelnen Proteinmoleküls, der zum Zerfall seiner „starren“ dreidimensionalen Struktur führt, wird manchmal als Schmelzen des Moleküls bezeichnet. Nahezu jede spürbare Änderung der äußeren Bedingungen, beispielsweise Erwärmung oder eine signifikante Änderung des pH-Werts, führt zu einer sequenziellen Zerstörung der Quartär-, Tertiär- und Sekundärstrukturen des Proteins. Denaturierung wird normalerweise durch einen Temperaturanstieg, die Einwirkung starker Säuren und Laugen, Schwermetallsalze, einige Lösungsmittel (Alkohol), Strahlung usw. verursacht.
Die Denaturierung führt häufig zum Prozess der Aggregation von Proteinpartikeln zu größeren Partikeln in einer kolloidalen Lösung von Proteinmolekülen. Optisch sieht das beispielsweise aus wie die Bildung von „Eiweiß“ beim Braten von Eiern.
Renaturierung ist der umgekehrte Prozess der Denaturierung, bei dem Proteine in ihre natürliche Struktur zurückkehren. Es ist zu beachten, dass nicht alle Proteine zur Renaturierung fähig sind; Bei den meisten Proteinen ist die Denaturierung irreversibel. Wenn bei der Denaturierung von Proteinen physikalisch-chemische Veränderungen mit dem Übergang der Polypeptidkette von einem dicht gepackten (geordneten) Zustand in einen ungeordneten Zustand einhergehen, manifestiert sich bei der Renaturierung die Fähigkeit von Proteinen zur Selbstorganisation, deren Weg ist vorgegeben durch die Reihenfolge der Aminosäuren in der Polypeptidkette, d. h. ihre Primärstruktur, bestimmt durch Erbinformationen. In lebenden Zellen diese Information ist wahrscheinlich entscheidend für die Umwandlung einer ungeordneten Polypeptidkette während oder nach ihrer Biosynthese am Ribosom in die Struktur eines nativen Proteinmoleküls. Wenn doppelsträngige DNA-Moleküle auf eine Temperatur von etwa 100 °C erhitzt werden, werden die Wasserstoffbrückenbindungen zwischen den Basen aufgebrochen und die komplementären Stränge trennen sich – die DNA denaturiert. Bei langsamer Abkühlung können sich die komplementären Ketten jedoch wieder zu einer regelmäßigen Doppelhelix verbinden. Diese Fähigkeit der DNA zur Renaturierung wird genutzt, um künstliche Hybrid-DNA-Moleküle herzustellen.
Natürliche Proteinkörper sind mit einer spezifischen, streng spezifizierten räumlichen Konfiguration ausgestattet und weisen bei physiologischen Temperaturen und pH-Werten eine Reihe charakteristischer physikalisch-chemischer und biologischer Eigenschaften auf. Unter dem Einfluss verschiedener physikalischer und chemischer Faktoren unterliegen Proteine einer Koagulation und Ausfällung, wodurch ihre ursprünglichen Eigenschaften verloren gehen. Daher sollte Denaturierung als Verletzung des allgemeinen Plans der einzigartigen Struktur des nativen Proteinmoleküls, hauptsächlich seiner Tertiärstruktur, verstanden werden, was zum Verlust seiner charakteristischen Eigenschaften (Löslichkeit, elektrophoretische Mobilität, biologische Aktivität usw.) führt. Die meisten Proteine denaturieren, wenn ihre Lösungen auf über 50–60 °C erhitzt werden.
Äußere Denaturierungserscheinungen werden auf einen Verlust der Löslichkeit, insbesondere am isoelektrischen Punkt, einen Anstieg der Viskosität von Proteinlösungen, einen Anstieg der Anzahl freier funktioneller SH-Gruppen und eine Veränderung der Art der Röntgenstreuung reduziert. Das charakteristischste Zeichen einer Denaturierung ist eine starke Abnahme oder ein vollständiger Verlust der biologischen Aktivität eines Proteins (katalytisch, antigen oder hormonell). Die durch 8M Harnstoff oder ein anderes Mittel verursachte Denaturierung von Proteinen zerstört hauptsächlich nichtkovalente Bindungen (insbesondere hydrophobe Wechselwirkungen und Wasserstoffbrückenbindungen). Disulfidbindungen werden in Gegenwart des Reduktionsmittels Mercaptoethanol aufgebrochen, während die Peptidbindungen der Polypeptidkette selbst nicht beeinträchtigt werden. Unter diesen Bedingungen entfalten sich Kügelchen aus nativen Proteinmolekülen und es bilden sich zufällige und ungeordnete Strukturen (Abb.)

Denaturierung eines Proteinmoleküls (Schema).
a - Ausgangszustand; b – beginnende reversible Störung der Molekülstruktur; c – irreversible Entfaltung der Polypeptidkette.

Denaturierung und Renaturierung der Ribonuklease (nach Anfinsen).
a - Einsatz (Harnstoff + Mercaptoethanol); b - erneutes Falten.

1. Proteinhydrolyse: H+
[− NH2─CH─ CO─NH─CH─CO − ]n +2nH2O → n NH2 − CH − COOH + n NH2 ─ CH ─ COOH
│ │ │ │
Aminosäure 1 Aminosäure 2
2. Proteinfällung:
a) reversibel
Protein in Lösung ↔ Proteinniederschlag. Tritt unter dem Einfluss von Lösungen von Na+-, K+-Salzen auf
b) irreversibel (Denaturierung)
Bei der Denaturierung unter dem Einfluss äußerer Faktoren (Temperatur; mechanische Einwirkung – Druck, Reiben, Schütteln, Ultraschall; Einwirkung chemischer Mittel – Säuren, Laugen usw.) kommt es zu einer Veränderung der Sekundär-, Tertiär- und Quartärstrukturen des Proteins Makromolekül, also seine natürliche räumliche Struktur. Die Primärstruktur und daher chemische Zusammensetzung Proteine verändern sich nicht.
Bei der Denaturierung verändern sich die physikalischen Eigenschaften von Proteinen: Die Löslichkeit nimmt ab und die biologische Aktivität geht verloren. Gleichzeitig erhöht sich die Aktivität bestimmter chemischer Gruppen, die Wirkung proteolytischer Enzyme auf Proteine wird erleichtert und somit leichter hydrolysierbar.
Beispielsweise fällt Albumin – Eiweiß – bei einer Temperatur von 60–70 °C aus der Lösung aus (koaguliert) und verliert seine Fähigkeit, sich in Wasser aufzulösen.
Schema des Proteindenaturierungsprozesses (Zerstörung der Tertiär- und Sekundärstrukturen von Proteinmolekülen)
3. Proteinverbrennung
Bei der Verbrennung von Proteinen entstehen Stickstoff, Kohlendioxid, Wasser und einige andere Substanzen. Bei der Verbrennung entsteht der charakteristische Geruch verbrannter Federn
4. Farbliche (qualitative) Reaktionen auf Proteine:
a) Xanthoprotein-Reaktion (auf Aminosäurereste, die Benzolringe enthalten):
Protein + HNO3 (konz.) → gelbe Farbe
b) Biuret-Reaktion (auf Peptidbindungen):
Protein + CuSO4 (gesättigt) + NaOH (konz.) → leuchtend violette Farbe
c) Cysteinreaktion (auf schwefelhaltige Aminosäurereste):
Protein + NaOH + Pb(CH3COO)2 → Schwarze Farbe
Proteine sind die Grundlage allen Lebens auf der Erde und erfüllen vielfältige Funktionen in Organismen.
Proteine aussalzen
Beim Aussalzen werden Proteine aus wässrigen Lösungen mit neutralen Lösungen konzentrierter Salze von Alkali- und Erdalkalimetallen isoliert. Wenn einer Proteinlösung große Salzkonzentrationen zugesetzt werden, dehydrieren die Proteinpartikel, die Ladung wird entfernt und die Proteine fallen aus. Der Grad der Proteinfällung hängt von der Ionenstärke der Fälllösung, der Partikelgröße des Proteinmoleküls, der Größe seiner Ladung und der Hydrophilie ab. Bei unterschiedlichen Salzkonzentrationen fallen unterschiedliche Proteine aus. Daher finden sich in Sedimenten, die durch allmähliche Erhöhung der Salzkonzentration gewonnen werden, einzelne Proteine in unterschiedlichen Fraktionen. Das Aussalzen von Proteinen ist ein reversibler Prozess und nach der Entfernung des Salzes erhält das Protein seine natürlichen Eigenschaften zurück. Daher wird das Aussalzen in der klinischen Praxis zur Trennung von Blutserumproteinen sowie zur Isolierung und Reinigung verschiedener Proteine eingesetzt.
Zugesetzte Anionen und Kationen zerstören die hydratisierte Proteinhülle von Proteinen, die einen der Stabilitätsfaktoren von Proteinlösungen darstellt. Die am häufigsten verwendeten Lösungen sind Na- und Ammoniumsulfate. Viele Proteine unterscheiden sich in der Größe ihrer Hydratationshülle und der Menge ihrer Ladung. Jedes Protein hat seine eigene Aussalzzone. Nach der Entfernung des Aussalzmittels behält das Protein seine biologische Aktivität und seine physikalisch-chemischen Eigenschaften. In der klinischen Praxis wird die Aussalzmethode verwendet, um Globuline (ein Niederschlag bildet sich, wenn eine 50 %ige Lösung von Ammoniumsulfat (NH4)2SO4 hinzugefügt wird) und Albumine (ein Niederschlag bildet sich, wenn eine 100 %ige Lösung von Ammoniumsulfat (NH4) hinzugefügt wird) zu trennen. 2SO4 wird hinzugefügt).
Die Aussalzmenge wird beeinflusst durch:
1) Art und Konzentration des Salzes;
2) pH-Umgebung;
3) Temperatur.
Die Hauptrolle spielt dabei die Wertigkeit der Ionen.
12) Merkmale der Organisation der Primär-, Sekundär- und Tertiärstruktur des Proteins.
Derzeit wurde die Existenz von vier Ebenen der strukturellen Organisation eines Proteinmoleküls experimentell nachgewiesen: Primär-, Sekundär-, Tertiär- und Quartärstruktur.
Eichhörnchen
– Biopolymere, deren Monomere durch Peptidbindungen miteinander verbundene α-Aminosäuren sind.
Isoliert Aminosäuren hydrophob Und hydrophil, die wiederum in sauer, basisch und neutral unterteilt werden. Ein Merkmal von a-Aminosäuren ist ihre Fähigkeit, untereinander zu interagieren und Peptide zu bilden.
Markieren:
Dipeptide (Carnosin und Anserin, lokalisiert in Mitochondrien; als AO, was deren Schwellung verhindert);
Oligopeptide, einschließlich bis zu 10 Aminosäureresten. Zum Beispiel: Tripeptid Glutathion dient als eines der Hauptreduktionsmittel bei ARZ, das die Intensität von LPO reguliert. Vasopressin Und Oxytocin- Hormone des Hinterlappens der Hypophyse, umfassen 9 Aminosäuren.
Existieren Polypeptid s und je nach ihren Eigenschaften werden sie in verschiedene Verbindungsklassen eingeteilt. Ärzte glauben, dass die parenterale Verabreichung eines Polypeptids, die eine Abstoßung (allergische Reaktion) hervorruft, in Betracht gezogen werden sollte Eiweiß; Wenn ein solches Phänomen nicht beobachtet wird, bleibt der Begriff derselbe ( Polypeptid). Adenohypophyse-Hormon ACTH, die die Sekretion von GCS in der Nebennierenrinde beeinflussen, werden als Polypeptide (39 Aminosäuren) klassifiziert und Insulin Es besteht aus 51 Monomeren und ist in der Lage, eine Immunantwort auszulösen. Es ist ein Protein.
Organisationsebenen eines Proteinmoleküls.
Jedes Polymer neigt dazu, eine energetisch günstigere Konformation anzunehmen, die durch die Bildung zusätzlicher Bindungen, die über Gruppen von Aminosäureresten erfolgt, erhalten bleibt. Es ist üblich, vier Ebenen der strukturellen Organisation von Proteinen zu unterscheiden. Primärstruktur– Sequenz von Aminosäuren in einer Polypeptidkette, kovalent verknüpft durch Peptid ( Amid)-Bindungen und benachbarte Radikale stehen in einem Winkel von 180 0 (trans-Form). Das Vorhandensein von mehr als zwei Dutzend verschiedenen proteinogenen Aminosäuren und ihre Fähigkeit, sich in unterschiedlichen Sequenzen zu binden, bestimmen die Vielfalt der Proteine in der Natur und ihre Erfüllung einer Vielzahl von Funktionen. Die Primärstruktur der Proteine einer einzelnen Person wird genetisch bestimmt und von den Eltern mithilfe von DNA- und RNA-Polynukleotiden weitergegeben. Je nach Art der Radikale und mit Hilfe spezieller Proteine – Begleitpersonen die synthetisierte Polypeptidkette passt in den Raum - Proteinfaltung.
Sekundärstruktur Das Protein hat die Form einer Helix oder einer β-Faltenschicht. Fibrilläre Proteine (Kollagen, Elastin) haben Beta-Struktur. Der Wechsel helikaler und amorpher (ungeordneter) Abschnitte ermöglicht es ihnen, sich anzunähern und mit Hilfe von Chaperonen ein dichter gepacktes Molekül zu bilden – Tertiärstruktur.
Es entsteht die Kombination mehrerer Polypeptidketten im Raum und die Entstehung einer funktionellen makromolekularen Formation Quartärstruktur Eichhörnchen. Solche Mizellen werden üblicherweise als bezeichnet Oligo- oder Multimere, und ihre Komponenten sind Untereinheiten ( Protomer). Ein Protein mit einer Quartärstruktur hat biologische Aktivität nur wenn alle seine Untereinheiten miteinander verbunden sind.
Somit zeichnet sich jedes natürliche Protein durch eine einzigartige Organisation aus, die seine physikalisch-chemischen, biologischen und physiologischen Funktionen gewährleistet.
Physikalisch-chemische Eigenschaften.
Proteine sind groß und haben ein hohes Molekulargewicht, das je nach Anzahl der Aminosäuren und Protomeren zwischen 6.000 und 1.000.000 Dalton und mehr liegt. Ihre Moleküle haben unterschiedliche Formen: fibrillär– die Sekundärstruktur bleibt erhalten; kugelförmig– eine höhere Organisation haben; und gemischt. Die Löslichkeit von Proteinen hängt von der Größe und Form des Moleküls sowie von der Art der Aminosäurereste ab. Globuläre Proteine sind in Wasser gut löslich, während fibrilläre Proteine entweder leicht oder unlöslich sind.
Eigenschaften von Proteinlösungen: haben einen niedrigen osmotischen, aber hohen onkotischen Druck; hoch viskos; schlechte Diffusionsfähigkeit; oft bewölkt; opalisierend ( Tyndall-Phänomen), – all dies wird bei der Isolierung, Reinigung und Untersuchung nativer Proteine verwendet. Die Trennung der Bestandteile eines biologischen Gemisches beruht auf deren Ausfällung. Man nennt es reversible Abscheidung aussalzen , entsteht unter Einwirkung von Alkalimetallsalzen, Ammoniumsalzen, verdünnten Laugen und Säuren. Es wird verwendet, um reine Fraktionen zu erhalten, die ihre ursprüngliche Struktur und Eigenschaften behalten.
Der Ionisierungsgrad eines Proteinmoleküls und seine Stabilität in Lösung werden durch den pH-Wert des Mediums bestimmt. Man nennt den pH-Wert einer Lösung, bei dem die Teilchenladung gegen Null tendiert isoelektrischer Punkt . Solche Moleküle sind in der Lage, sich in einem elektrischen Feld zu bewegen; Die Bewegungsgeschwindigkeit ist direkt proportional zur Ladungsmenge und umgekehrt proportional zur Masse des Kügelchens, das der Elektrophorese zur Trennung von Serumproteinen zugrunde liegt.
Irreversible Ablagerung - Denaturierung. Dringt das Reagenz tief in die Mizelle ein und zerstört weitere Bindungen, entfaltet sich der kompakt gelegte Faden. Aufgrund der freigesetzten Gruppen verkleben sich annähernde Moleküle und fallen aus oder schweben und verlieren ihre biologischen Eigenschaften. Denaturierende Faktoren: körperlich(Temperatur über 40 0, Verschiedene Arten Strahlung: Röntgen, α-, β-, γ, UV); chemisch(konzentrierte Säuren, Laugen, Schwermetallsalze, Harnstoff, Alkaloide, einige Medikamente, Gifte). Denaturierung wird in der Asepsis und Antiseptika sowie in der biochemischen Forschung eingesetzt.
Proteine haben unterschiedliche Eigenschaften (Tabelle 1.1).
Tabelle 1.1
Biologische Eigenschaften von Proteinen
| Spezifität | wird durch die einzigartige Aminosäurezusammensetzung jedes Proteins bestimmt, die genetisch bedingt ist und die Anpassung des Körpers an veränderte Bedingungen gewährleistet Außenumgebung, aber andererseits muss dieser Umstand bei Bluttransfusionen, Organ- und Gewebetransplantationen berücksichtigt werden. |
| Ligandität | die Fähigkeit von Aminosäureresten, Bindungen mit Substanzen unterschiedlicher Natur einzugehen ( Liganden): Kohlenhydrate, Lipide, Nukleotide, Mineralstoffe. Wenn die Verbindung stark ist, wird dieser Komplex aufgerufen komplexes Protein, führt die dafür vorgesehenen Funktionen aus. |
| Kooperationsbereitschaft | charakteristisch für Proteine mit Quartärstruktur. Hämoglobin besteht aus 4 Protomeren, die jeweils mit Häm verbunden sind, das Sauerstoff binden kann. Das Häm der ersten Untereinheit erledigt dies jedoch langsam und jede weitere Untereinheit erledigt dies leichter. |
| Multifunktionalität | die Fähigkeit eines Proteins, eine Vielzahl von Funktionen zu erfüllen. Myosin, ein muskelkontraktiles Protein, hat ebenfalls eine katalytische Aktivität und hydrolysiert bei Bedarf ATP. Das oben erwähnte Hämoglobin ist auch in der Lage, als Enzym – Katalase – zu wirken. |
| Komplementarität | Alle Proteine sind im Raum so angeordnet, dass Bereiche entstehen komplementär andere Verbindungen, die die Erfüllung verschiedener Funktionen gewährleisten (Bildung von Enzym-Substrat-, Hormon-Rezeptor-, Antigen-Antikörper-Komplexen). |
Proteinklassifizierung
Markieren einfache Proteine , nur aus Aminosäuren bestehend, und Komplex , einschließlich Prothetische Gruppe. Einfache Proteine werden unterteilt in kugelförmig und fibrillär, und auch abhängig von der Aminosäurezusammensetzung basisch, sauer, neutral. Globuläre Grundproteine - Protamine und Histone. Sie haben ein niedriges Molekulargewicht, aufgrund der Anwesenheit von Arginin und Lysin weisen sie eine ausgeprägte Basizität auf, aufgrund der „-“-Ladung interagieren sie leicht mit Polyanionen von Nukleinsäuren. Durch die Bindung an die DNA tragen Histone dazu bei, dass sie kompakt in den Zellkern passen und die Proteinsynthese regulieren. Diese Fraktion ist heterogen und bildet sich, wenn sie miteinander interagiert Nukleosomen, auf dem DNA-Stränge aufgewickelt sind.
Zu den sauren globulären Proteinen gehören Albumine und Globuline, in extrazellulären Flüssigkeiten (Blutplasma, Liquor, Lymphe, Milch) enthalten und in Gewicht und Größe unterschiedlich. Albumine haben im Gegensatz zu Globulinen (über 100.000 D) ein Molekulargewicht von 40-70.000 D. Zu den ersteren gehört Glutaminsäure, die eine große „-“-Ladung und eine Hydratationshülle erzeugt, wodurch ihre Lösung äußerst stabil ist. Globuline sind weniger saure Proteine, daher lassen sie sich leicht aussalzen und sind heterogen; sie werden mittels Elektrophorese in Fraktionen aufgeteilt. Sie sind in der Lage, verschiedene Verbindungen (Hormone, Vitamine, Gifte, Medikamente, Ionen) zu binden und so für deren Transport zu sorgen. Mit ihrer Hilfe werden wichtige Parameter der Homöostase stabilisiert: pH-Wert und onkotischer Druck. Auch ausgezeichnet Immunglobuline(IgA, IgM, IgD, IgE, IgG), die als Antikörper dienen, sowie Proteingerinnungsfaktoren.
Die Klinik nutzt das sogenannte Proteinverhältnis (BC) , das das Verhältnis der Albuminkonzentration zur Globulinkonzentration darstellt:
Seine Werte schwanken je nach pathologischen Prozessen.
Fibrilläre Proteine in zwei Gruppen unterteilt: löslich ( Aktin, Myosin, Fibrinogen) und unlöslich in Wasser und Wasser-Salz-Lösungen (Stützproteine). - Kollagen, Elastin, Retikulin und integumentäre - Keratin Stoffe).
Die Klassifizierung komplexer Proteine basiert auf den Strukturmerkmalen der prothetischen Gruppe. Metalloprotein — Ferritin, reich an Eisenkationen und lokalisiert in den Zellen des mononukleären Phagozytensystems (Hepatozyten, Splenozyten, Knochenmarkszellen), ist ein Depot dieses Metalls. Überschüssiges Eisen führt zur Ansammlung im Gewebe - Hämosiderin, provoziert Entwicklung Hämosiderose. Metalloglykoproteine – Transferrin Und Coeruloplasmin Blutplasma, das als Transportform für Eisen- bzw. Kupferionen dient, wurde ihre antioxidative Aktivität aufgedeckt. Die Arbeit vieler Enzyme hängt von der Anwesenheit von Metallionen in den Molekülen ab: für Xanthindehydrogenase – Mo++, Arginase – Mn++ und AlkoholDH – Zn++.
Phosphoproteine – Milchkaseinogen, Eigelb-Vitellin und Eiweiß-Ovalbumin, Fischkaviar-Ichthulin. Sie spielen eine wichtige Rolle bei der Entwicklung des Embryos, des Fötus und des Neugeborenen: Ihre Aminosäuren sind für die Synthese ihrer eigenen Gewebeproteine notwendig, und Phosphat wird entweder als Bindeglied in PL – den obligatorischen Strukturen von Zellmembranen – verwendet als wichtiger Bestandteil von Makroergs – Energiequellen bei der Entstehung verschiedener Verbindungen. Enzyme regulieren ihre Aktivität durch Phosphorylierung-Dephosphorylierung.
Teil Nukleoproteine umfasst DNA und RNA. Histone oder Protamine wirken als Apoproteine. Jedes Chromosom ist ein Komplex aus einem DNA-Molekül und vielen Histonen. Mit Hilfe Nukleosomen Der Faden dieses Polynukleotids ist gewickelt, wodurch sich sein Volumen verringert.
Glykoproteine umfassen verschiedene Kohlenhydrate (Oligosaccharide, GAG-Typ). Hyaluronsäure, Chondroitin-, Dermatan-, Keratan-, Heparansulfate). Der an Glykoproteinen reiche Schleim hat eine hohe Viskosität und schützt die Wände der Hohlorgane vor Reizstoffen. Membranglykoproteine sorgen für interzelluläre Kontakte, die Funktion von Rezeptoren und sind in den Plasmamembranen von Erythrozyten für die Gruppenspezifität des Blutes verantwortlich. Antikörper (Oligosaccharide) interagieren mit bestimmten Antigenen. Die Funktionsweise von Interferonen und dem Komplementsystem basiert auf dem gleichen Prinzip. Zu den Glykoproteinen zählen auch Ceruloplasmin und Transferrin, die Kupfer- und Eisenionen im Blutplasma transportieren. Einige Hormone der Adenohypophyse gehören zu dieser Proteinklasse.
Lipoproteine Die prosthetische Gruppe enthält verschiedene Lipide (TAG, freies Cholesterin, seine Ester, PL). Trotz der Anwesenheit der meisten verschiedene Substanzen, das Prinzip der Struktur von LP-Mizellen ist ähnlich (Abb. 1.1). In diesem Partikel befindet sich ein Fetttröpfchen, das unpolare Lipide enthält: TAG und Cholesterinester. Außen ist der Kern von einer einschichtigen Membran umgeben, die aus PL, einem Protein, besteht (Apolipoprotein) und HS. Einige Proteine sind integral und können nicht vom Lipoprotein getrennt werden, während andere von einem Komplex auf einen anderen übertragen werden können. Polypeptidfragmente bilden die Struktur des Partikels, interagieren mit Rezeptoren auf der Zelloberfläche, bestimmen, welche Gewebe sie benötigen, und dienen als Enzyme oder deren Aktivatoren, die das Medikament modifizieren. Die folgenden Arten von Lipoproteinen wurden durch Ultrazentrifugation isoliert: CM, VLDL, LPPP, LDL, HDL. Jede Lipidart wird in unterschiedlichen Geweben gebildet und sorgt für den Transport bestimmter Lipide in biologischen Flüssigkeiten. Die Moleküle dieser Proteine sind im Blut gut löslich, weil haben kleine Größen und negative Ladung auf der Oberfläche. Ein Teil des LP kann leicht durch die Intima der Arterien diffundieren und diese nähren. Chylomikronen dienen als Träger exogener Lipide und bewegen sich zunächst durch die Lymphe und dann durch den Blutkreislauf. Im weiteren Verlauf verlieren CMs ihre Lipide und geben sie an die Zellen ab. VLDL dienen als Haupttransportformen der in der Leber synthetisierten Lipide, hauptsächlich TAG, und dienen der Abgabe von endogenem Cholesterin von Hepatozyten an Organe und Gewebe LDL. Wenn sie Lipide an Zielzellen abgeben, nimmt ihre Dichte zu (sie werden in Lipide umgewandelt). BOB). Es kommt zur katabolen Phase des Cholesterinstoffwechsels HDL, die es vom Gewebe zur Leber übertragen, von wo aus es als Teil der Galle über den Magen-Darm-Trakt aus dem Körper ausgeschieden wird.
U Chromoproteine Eine prothetische Gruppe kann eine Substanz sein, die eine Farbe hat. Unterklasse - Hämoproteine, dient als Nicht-Protein-Teil Häm. Hämoglobin Erythrozyten sorgen für den Gasaustausch, haben eine Quartärstruktur und bestehen im Embryo, Fötus und Kind aus 4 verschiedenen Polypeptidketten (Abschnitt IV. Kapitel 1). Im Gegensatz zu Hb Myoglobin hat eine Häm- und eine Polypeptidkette, gerollt in einer Kugel. Die Affinität von Myoglobin zu Sauerstoff ist höher als die von Hämoglobin, sodass es das Gas aufnehmen, speichern und bei Bedarf an die Mitochondrien abgeben kann. Zu den Häm-haltigen Proteinen gehören Katalase, Peroxidase, bei denen es sich um ARZ-Enzyme handelt; Cytochrome– Bestandteile des ETC, das für den wichtigsten bioenergetischen Prozess in Zellen verantwortlich ist. Unter den Dehydrogenasen, die an der Gewebeatmung beteiligt sind, finden wir Flavoproteine– Chromoproteine, die aufgrund der Anwesenheit von Flavonoiden – Komponenten FMN und FAD – eine gelbe (Flavos – gelbe) Farbe haben. Rhodopsin- ein komplexes Protein, dessen prothetische Gruppe ist Aktive Form Vitamin A – Retinol gelb-orange Farbe. Sehpurpur ist die wichtigste lichtempfindliche Substanz der Stäbchen der Netzhaut und sorgt für die Lichtwahrnehmung in der Dämmerung.
Funktionen von Proteinen
| Strukturell
(Plastik) |
Proteine bilden die Grundlage für Zell- und Organellenmembranen und auch für Gewebe (Kollagen im Bindegewebe). |
| Katalytisch | Alle Enzyme – Proteine – sind Biokatalysatoren. |
| Regulatorisch | Viele Hormone, die vom Hypophysenvorderlappen und den Nebenschilddrüsen ausgeschüttet werden, sind proteinhaltiger Natur. |
| Transport | Im Blutplasma Albumine stellen Sie die Übertragung von IVH und Bilirubin sicher. Transferrin verantwortlich für die Lieferung von Eisenkationen. |
| Atemwege | Mizellen Hämoglobin, lokalisiert in Erythrozyten, können sich an verschiedene Gase, vor allem Sauerstoff und Kohlendioxid, binden und direkt am Gasaustausch teilnehmen. |
| Kontraktiv | Spezifische Proteine von Myozyten ( Aktin und Myosin) - Teilnehmer an Kontraktion und Entspannung. Ein Zytoskelettprotein zeigt einen ähnlichen Effekt zum Zeitpunkt der Chromosomentrennung während der Mitose. Tubulin. |
| Schützend | Proteingerinnungsfaktoren schützen den Körper vor unzureichendem Blutverlust. Immunproteine (γ-Globuline, Interferon, Proteine des Komplementsystems) bekämpfen in den Körper eindringende Fremdstoffe – Antigene. |
| Homöostatisch | Extra- und intrazelluläre Proteine können einen konstanten pH-Wert aufrechterhalten ( Puffersysteme ) und onkotischer Druck der Umgebung. |
| Rezeptor | Glykoproteine zellulärer und organoider Membranen, die in externen Bereichen lokalisiert sind, nehmen verschiedene regulatorische Signale wahr. |
| Visuell | Visuelle Signale in der Netzhaut werden von einem Protein empfangen – Rhodopsin. |
| Nahrhaft | Albumine und Globuline im Blutplasma dienen als Aminosäurereserven |
| Chromosomenproteine ( Histone, Protamine) sind an der Schaffung eines Gleichgewichts zwischen Ausdruck und Unterdrückung genetischer Informationen beteiligt. | |
| Energie | Während des Fastens oder bei pathologischen Prozessen, wenn die Verwendung von Kohlenhydraten zu Energiezwecken gestört ist (mit Diabetes Mellitus) Die Gewebeproteolyse wird verstärkt, deren Produkte Aminosäuren sind ( ketogen), zerfallen und als Energiequelle dienen. |
Die Klassifizierung von Proteinen basiert auf ihrer chemischen Zusammensetzung. Nach dieser Klassifizierung sind Proteine einfach Und Komplex. Einfache Proteine bestehen nur aus Aminosäuren, also aus einem oder mehreren Polypeptiden. Zu den einfachen Proteinen, die im menschlichen Körper vorkommen, gehören: Albumine, Globuline, Histone, unterstützende Gewebeproteine.
In einem komplexen Proteinmolekül gibt es neben Aminosäuren auch einen sogenannten Nicht-Aminosäure-Teil Prothetische Gruppe. Abhängig von der Struktur dieser Gruppe werden komplexe Proteine unterschieden wie z Phosphoproteine( enthalten Phosphorsäure) Nukleoproteine(enthalten Nukleinsäure), Glykoproteine(enthalten Kohlenhydrate) Lipoproteine(enthalten Lipoid) und andere.
Nach der Klassifizierung, die auf der räumlichen Form von Proteinen basiert, werden Proteine in unterteilt fibrillär Und kugelförmig.
Fibrilläre Proteine bestehen aus Helices, also überwiegend aus Sekundärstrukturen. Moleküle globulärer Proteine haben eine sphärische und ellipsoide Form.
Ein Beispiel für fibrilläre Proteine ist Kollagen – das am häufigsten vorkommende Protein im menschlichen Körper. Dieses Protein macht 25–30 % der Gesamtzahl der Proteine im Körper aus. Kollagen hat eine hohe Festigkeit und Elastizität. Es ist Teil der Blutgefäße von Muskeln, Sehnen, Knorpeln, Knochen und Gefäßwänden.
Beispiele für globuläre Proteine sind Albumine und Globuline des Blutplasmas.
Physikochemische Eigenschaften von Proteinen.
Eines der Hauptmerkmale von Proteinen ist ihre hohes Molekulargewicht, die zwischen 6000 und mehreren Millionen Dalton liegt.
Eine weitere wichtige physikalisch-chemische Eigenschaft von Proteinen ist ihre Amphoterizität,das heißt, das Vorhandensein sowohl saurer als auch basischer Eigenschaften. Amphoterizität ist mit dem Vorhandensein freier Carboxylgruppen, also saurer, und Aminogruppen, also alkalischer, in einigen Aminosäuren verbunden. Dies führt dazu, dass sich Proteine in einer sauren Umgebung befinden alkalische Eigenschaften und in einer alkalischen Umgebung - sauer. Unter bestimmten Bedingungen weisen Proteine jedoch neutrale Eigenschaften auf. Als pH-Wert bezeichnet man den pH-Wert, bei dem Proteine neutrale Eigenschaften aufweisen isoelektrischer Punkt. Der isoelektrische Punkt ist für jedes Protein individuell. Proteine werden nach diesem Indikator in zwei große Klassen eingeteilt - sauer und alkalisch, da der isoelektrische Punkt entweder zur einen oder zur anderen Seite verschoben werden kann.
Eine weitere wichtige Eigenschaft von Proteinmolekülen ist Löslichkeit. Trotz der großen Molekülgröße sind Proteine in Wasser gut löslich. Darüber hinaus sind Lösungen von Proteinen in Wasser sehr stabil. Der erste Grund für die Löslichkeit von Proteinen ist das Vorhandensein einer Ladung auf der Oberfläche von Proteinmolekülen, wodurch Proteinmoleküle praktisch keine in Wasser unlöslichen Aggregate bilden. Der zweite Grund für die Stabilität von Proteinlösungen ist das Vorhandensein einer Hydratationshülle (Wasserhülle) im Proteinmolekül. Die Hydratationshülle trennt die Proteine voneinander.
Die dritte wichtige physikalisch-chemische Eigenschaft von Proteinen ist aussalzen,das heißt, die Fähigkeit zur Ausfällung unter dem Einfluss wasserentfernender Mittel. Das Aussalzen ist ein reversibler Vorgang. Diese Fähigkeit, sich in die Lösung hinein und aus dieser heraus zu bewegen, ist für die Manifestation vieler lebenswichtiger Eigenschaften sehr wichtig.
Schließlich ist die wichtigste Eigenschaft von Proteinen ihre Fähigkeit Denaturierung.Denaturierung ist der Verlust der Ursprünglichkeit eines Proteins. Wenn wir Eier in einer Pfanne rühren, kommt es zu einer irreversiblen Denaturierung des Proteins. Unter Denaturierung versteht man die dauerhafte oder vorübergehende Störung der Sekundär- und Tertiärstruktur eines Proteins, die Primärstruktur bleibt jedoch erhalten. Neben der Temperatur (über 50 Grad) kann die Denaturierung auch durch andere physikalische Faktoren verursacht werden: Strahlung, Ultraschall, Vibration, starke Säuren und Laugen. Die Denaturierung kann reversibel oder irreversibel sein. Bei kleinen Stößen kommt es zu einer geringfügigen Zerstörung der Sekundär- und Tertiärstrukturen des Proteins. Daher kann das Protein ohne denaturierende Effekte seine ursprüngliche Struktur wiederherstellen. Den umgekehrten Vorgang der Denaturierung nennt man Renaturierung.Allerdings bei längerer und starker Einwirkung Eine Renaturierung wird unmöglich und die Denaturierung somit irreversibel.
Bevor wir über die Eigenschaften von Proteinen sprechen, lohnt es sich, eine kurze Definition zu geben dieses Konzept. Dabei handelt es sich um hochmolekulare organische Substanzen, die aus durch eine Peptidbindung verbundenen Alpha-Aminosäuren bestehen. Proteine sind ein wichtiger Bestandteil der menschlichen und tierischen Ernährung, da nicht alle Aminosäuren vom Körper selbst hergestellt werden – einige stammen aus der Nahrung. Was sind ihre Eigenschaften und Funktionen?
Amphoterizität
Dies ist das erste Merkmal von Proteinen. Amphoterizität bezieht sich auf ihre Fähigkeit, sowohl saure als auch basische Eigenschaften zu zeigen.
Proteine haben in ihrer Struktur mehrere Arten chemischer Gruppen, die H 2 O in Lösung ionisieren können. Dazu gehören:
- Carboxylreste. Genauer gesagt Glutaminsäure und Asparaginsäure.
- Stickstoffhaltige Gruppen. Die ε-Aminogruppe von Lysin, der Argininrest CNH(NH 2) und der Imidazolrest einer heterozyklischen Alpha-Aminosäure namens Histidin.
Jedes Protein hat ein Merkmal wie einen isoelektrischen Punkt. Dieses Konzept bezieht sich auf den Säuregehalt der Umgebung, in der die Oberfläche oder das Molekül keine elektrische Ladung aufweist. Unter diesen Bedingungen werden Proteinhydratation und -löslichkeit minimiert.
Der Indikator wird durch das Verhältnis von basischen und sauren Aminosäureresten bestimmt. Im ersten Fall liegt der Punkt im alkalischen Bereich. Im zweiten - sauer.

Löslichkeit
Basierend auf dieser Eigenschaft werden Proteine in eine kleine Klassifizierung eingeteilt. So sind sie:
- Löslich. Sie werden Albumine genannt. Sie sind in konzentrierten Salzlösungen mäßig löslich und koagulieren beim Erhitzen. Diese Reaktion wird Denaturierung genannt. Das Molekulargewicht von Albuminen beträgt etwa 65.000. Sie enthalten keine Kohlenhydrate. Und Substanzen, die aus Albumin bestehen, werden Albuminoide genannt. Dazu gehören Eiweiß, Pflanzensamen und Blutserum.
- Unlöslich. Sie werden Skleroproteine genannt. Ein markantes Beispiel ist Keratin, ein fibrilläres Protein mit einer mechanischen Festigkeit, die nur von Chitin übertroffen wird. Aus dieser Substanz bestehen Nägel, Haare, die Rhamphotheca von Vogelschnäbeln und -federn sowie die Hörner eines Nashorns. Zu dieser Gruppe von Proteinen gehören auch Zytokeratine. Dies ist das Strukturmaterial der intrazellulären Filamente des Zytoskeletts von Epithelzellen. Ein weiteres unlösliches Protein ist ein fibrilläres Protein namens Fibroin.
- Hydrophil. Sie interagieren aktiv mit Wasser und nehmen es auf. Dazu gehören Proteine der Interzellularsubstanz, des Zellkerns und des Zytoplasmas. Einschließlich des berüchtigten Fibroin und Keratin.
- Hydrophob. Sie stoßen Wasser ab. Dazu gehören Proteine, die Bestandteile biologischer Membranen sind.

Denaturierung
Dies ist die Bezeichnung für den Prozess der Veränderung eines Proteinmoleküls unter dem Einfluss bestimmter destabilisierender Faktoren. Die Aminosäuresequenz bleibt jedoch gleich. Aber Proteine verlieren ihre natürlichen Eigenschaften (Hydrophilie, Löslichkeit usw.).
Es ist zu beachten, dass jede wesentliche Änderung der äußeren Bedingungen zu Störungen der Proteinstrukturen führen kann. Am häufigsten wird die Denaturierung durch einen Temperaturanstieg sowie die Einwirkung von Alkali, starker Säure, Strahlung, Schwermetallsalzen und sogar bestimmten Lösungsmitteln auf das Protein hervorgerufen.
Interessanterweise führt die Denaturierung häufig dazu, dass sich Proteinpartikel zu größeren zusammenlagern. Ein markantes Beispiel ist zum Beispiel Rührei. Jeder weiß, wie beim Braten aus einer klaren Flüssigkeit Eiweiß entsteht.
Wir sollten auch über ein Phänomen wie die Renaturierung sprechen. Dieser Vorgang ist die Umkehrung der Denaturierung. Dabei kehren Proteine in ihre natürliche Struktur zurück. Und es ist wirklich möglich. Eine Gruppe von Chemikern aus den USA und Australien hat einen Weg gefunden, ein hartgekochtes Ei zu renaturieren. Dies dauert nur wenige Minuten. Und dafür benötigen Sie Harnstoff (Kohlensäurediamid) und Zentrifugation.
Struktur
Es ist notwendig, gesondert darüber zu sprechen, da es sich um die Bedeutung von Proteinen handelt. Insgesamt gibt es vier Ebenen der Aufbauorganisation:
- Primär. Bezieht sich auf die Abfolge von Aminosäureresten in einer Polypeptidkette. Das Hauptmerkmal sind konservative Motive. Dies ist die Bezeichnung für stabile Kombinationen von Aminosäureresten. Sie kommen in vielen komplexen und einfachen Proteinen vor.
- Sekundär. Damit ist die Ordnung eines beliebigen lokalen Fragments einer Polypeptidkette gemeint, das durch Wasserstoffbrückenbindungen stabilisiert wird.
- Tertiär. Damit wird die räumliche Struktur der Polypeptidkette bezeichnet. Diese Ebene besteht aus einigen sekundären Elementen (sie sind stabilisiert). verschiedene Typen Wechselwirkungen, wobei hydrophobe Wechselwirkungen am wichtigsten sind). Dabei sind ionische, Wasserstoff- und kovalente Bindungen an der Stabilisierung beteiligt.
- Quartär. Sie wird auch Domäne oder Untereinheit genannt. Diese Ebene besteht aus relative Position Ketten von Polypeptiden als Teil eines integralen Proteinkomplexes. Interessant ist, dass Proteine mit Quartärstruktur nicht nur identische, sondern auch unterschiedliche Ketten von Polypeptiden enthalten.
Diese Einteilung wurde von einem dänischen Biochemiker namens K. Lindström-Lang vorgeschlagen. Und selbst wenn es als veraltet gilt, wird es weiterhin verwendet.

Arten von Strukturen
Wenn man über die Eigenschaften von Proteinen spricht, ist auch zu beachten, dass diese Stoffe je nach Strukturtyp in drei Gruppen eingeteilt werden. Nämlich:
- Fibrilläre Proteine. Sie haben eine fadenförmige längliche Struktur und ein großes Molekulargewicht. Die meisten von ihnen sind nicht wasserlöslich. Die Struktur dieser Proteine wird durch Wechselwirkungen zwischen Polypeptidketten stabilisiert (sie bestehen aus mindestens zwei Aminosäureresten). Es sind fibrilläre Substanzen, die das Polymer, Fibrillen, Mikrotubuli und Mikrofilamente bilden.
- Kugelförmige Proteine. Die Art der Struktur bestimmt ihre Löslichkeit in Wasser. A allgemeine Form Moleküle sind kugelförmig.
- Membranproteine. Die Struktur dieser Stoffe ist interessante Funktion. Sie haben Domänen, die die Zellmembran durchdringen, aber Teile von ihnen ragen in das Zytoplasma und die interzelluläre Umgebung hinein. Diese Proteine spielen die Rolle von Rezeptoren – sie übertragen Signale und sind für den Transmembrantransport verantwortlich Nährstoffe. Es ist wichtig zu beachten, dass sie sehr spezifisch sind. Jedes Protein lässt nur ein bestimmtes Molekül oder Signal durch.
Einfach
Sie können uns auch etwas mehr über sie erzählen. Einfache Proteine bestehen nur aus Polypeptidketten. Diese beinhalten:
- Protamin. Kernprotein mit niedrigem Molekulargewicht. Seine Anwesenheit schützt die DNA vor der Wirkung von Nukleasen – Enzymen, die Nukleinsäuren angreifen.
- Histone. Stark basische einfache Proteine. Sie sind in den Zellkernen pflanzlicher und tierischer Zellen konzentriert. Sie sind an der „Verpackung“ von DNA-Strängen im Zellkern sowie an Prozessen wie Reparatur, Replikation und Transkription beteiligt.
- Albumin. Sie wurden oben bereits besprochen. Die bekanntesten Albumine sind Molke und Ei.
- Globulin. Beteiligt sich an der Blutgerinnung sowie anderen Immunreaktionen.
- Prolamine. Dies sind die Reserveproteine von Getreide. Ihre Namen sind immer unterschiedlich. Im Weizen werden sie Ptyaline genannt. In Gerste - Horden. Hafer hat Avsnine. Interessanterweise werden Prolamine in eigene Proteinklassen eingeteilt. Es gibt nur zwei davon: S-reich (mit Schwefelgehalt) und S-arm (ohne Schwefelgehalt).

Komplex
Was ist mit komplexen Proteinen? Sie enthalten prothetische Gruppen oder solche ohne Aminosäuren. Diese beinhalten:
- Glykoproteine. Sie enthalten Kohlenhydratreste mit kovalenten Bindungen. Diese komplexen Proteine sind die wichtigsten Strukturkomponente Zellmembranen. Dazu gehören auch viele Hormone. Und Glykoproteine der Erythrozytenmembranen bestimmen die Blutgruppe.
- Lipoproteine. Sie bestehen aus Lipiden (fettähnlichen Stoffen) und übernehmen die Rolle des „Transports“ dieser Stoffe im Blut.
- Metalloproteine. Diese Proteine sind im Körper von großer Bedeutung, da ohne sie kein Eisenstoffwechsel stattfindet. Ihre Moleküle enthalten Metallionen. Und typische Vertreter dieser Klasse sind Transferrin, Hämosiderin und Ferritin.
- Nukleoproteine. Sie bestehen aus RKN und DNA, die keine kovalente Bindung haben. Ein markanter Vertreter ist Chromatin. In seiner Zusammensetzung werden genetische Informationen realisiert, DNA wird repariert und repliziert.
- Phosphoproteine. Sie bestehen aus kovalent verknüpften Phosphorsäureresten. Ein Beispiel ist Casein, das zunächst als Calciumsalz (in gebundener Form) in der Milch enthalten ist.
- Chromoproteine. Sie haben eine einfache Struktur: ein Protein und eine farbige Komponente, die zur prothetischen Gruppe gehören. Sie sind an der Zellatmung, der Photosynthese, Redoxreaktionen usw. beteiligt. Außerdem findet ohne Chromoproteine keine Energieakkumulation statt.
Stoffwechsel
Über die physikalisch-chemischen Eigenschaften von Proteinen wurde oben bereits viel gesagt. Erwähnenswert ist auch ihre Rolle im Stoffwechsel.
Es gibt Aminosäuren, die essentiell sind, da sie von lebenden Organismen nicht synthetisiert werden. Säugetiere selbst nehmen sie über die Nahrung auf. Bei der Verdauung wird das Protein zerstört. Dieser Prozess beginnt mit der Denaturierung, wenn es in eine saure Umgebung gebracht wird. Dann - Hydrolyse, an der Enzyme beteiligt sind.
Bestimmte Aminosäuren, die der Körper letztendlich erhält, sind am Prozess der Proteinsynthese beteiligt, deren Eigenschaften für seine volle Existenz notwendig sind. Und der Rest wird zu Glukose verarbeitet – einem Monosaccharid, das eine der Hauptenergiequellen darstellt. Protein ist während einer Diät oder beim Fasten sehr wichtig. Wenn ihm keine Nahrung zugeführt wird, beginnt der Körper, sich selbst zu „fressen“ – seine eigenen Proteine, insbesondere Muskelproteine, zu verarbeiten.

Biosynthese
Bei der Betrachtung der physikalisch-chemischen Eigenschaften von Proteinen muss man sich auf ein Thema wie die Biosynthese konzentrieren. Diese Stoffe werden auf Basis der in Genen kodierten Informationen gebildet. Jedes Protein ist eine einzigartige Sequenz von Aminosäureresten, die durch das dafür kodierende Gen bestimmt wird.
Wie kommt es dazu? Ein Gen, das für ein Protein kodiert, überträgt Informationen von der DNA auf die RNA. Dies nennt man Transkription. In den meisten Fällen erfolgt die Synthese dann an Ribosomen – den wichtigsten Organellen einer lebenden Zelle. Dieser Vorgang wird Übersetzung genannt.
Es gibt auch die sogenannte nicht-ribosomale Synthese. Es ist auch erwähnenswert, da wir über die Bedeutung von Proteinen sprechen. Diese Art der Synthese wird bei einigen Bakterien und niederen Pilzen beobachtet. Der Prozess wird durch einen Proteinkomplex mit hohem Molekulargewicht (bekannt als NRS-Synthase) durchgeführt, an dem Ribosomen nicht beteiligt sind.
Und natürlich gibt es auch die chemische Synthese. Es kann zur Synthese kurzer Proteine verwendet werden. Hierzu werden Methoden wie die chemische Ligation eingesetzt. Dies ist das Gegenteil der berüchtigten Biosynthese an Ribosomen. Mit der gleichen Methode lassen sich Inhibitoren bestimmter Enzyme gewinnen.
Darüber hinaus ist es dank der chemischen Synthese möglich, Aminosäurereste in Proteine einzuführen, die in gewöhnlichen Substanzen nicht vorkommen. Akzeptieren wir diejenigen, deren Seitenketten fluoreszierende Markierungen haben.
Es ist erwähnenswert, dass die Methoden der chemischen Synthese nicht fehlerfrei sind. Es gibt bestimmte Einschränkungen. Enthält ein Protein mehr als 300 Reste, dann hat die künstlich synthetisierte Substanz höchstwahrscheinlich die falsche Struktur. Und das wird sich auf die Eigenschaften auswirken.

Stoffe tierischen Ursprungs
Sie müssen berücksichtigt werden Besondere Aufmerksamkeit. Tierisches Eiweiß ist eine Substanz, die in Eiern, Fleisch, Milchprodukten, Geflügel, Meeresfrüchten und Fisch vorkommt. Sie enthalten alle Aminosäuren für den Körper notwendig, darunter 9 unersetzliche. Hier ganze Zeile Die wichtigsten Funktionen von tierischem Eiweiß:
- Katalyse vieler chemischer Reaktionen. Diese Substanz bringt sie in Gang und beschleunigt sie. Dafür sind enzymatische Proteine „verantwortlich“. Wenn der Körper nicht genügend davon erhält, können Oxidation und Reduktion, das Knüpfen und Aufbrechen molekularer Bindungen sowie der Stofftransport nicht vollständig ablaufen. Interessant ist, dass nur ein kleiner Teil der Aminosäuren verschiedene Wechselwirkungen eingeht. Und eine noch geringere Menge (3-4 Reste) ist direkt an der Katalyse beteiligt. Alle Enzyme werden in sechs Klassen eingeteilt – Oxidoreduktasen, Transferasen, Hydrolasen, Lyasen, Isomerasen, Ligasen. Jeder von ihnen ist für die eine oder andere Reaktion verantwortlich.
- Bildung des Zytoskeletts, das die Struktur der Zellen bildet.
- Immun-, chemischer und physikalischer Schutz.
- Transport wichtiger Komponenten, die für das Zellwachstum und die Zellentwicklung notwendig sind.
- Übertragung elektrischer Impulse, die für das Funktionieren des gesamten Organismus wichtig sind, da ohne sie eine Zellinteraktion nicht möglich ist.
Und das sind nicht alle möglichen Funktionen. Dennoch ist die Bedeutung dieser Substanzen klar. Die Proteinsynthese in Zellen und im Körper ist unmöglich, wenn eine Person ihre Quellen nicht zu sich nimmt. Und es handelt sich um Putenfleisch, Rind, Lamm, Kaninchen. Viel Eiweiß steckt auch in Eiern, Sauerrahm, Joghurt, Hüttenkäse und Milch. Sie können die Proteinsynthese in den Körperzellen auch aktivieren, indem Sie Ihrer Ernährung Schinken, Innereien, Wurst, Eintopf und Kalbfleisch hinzufügen.
Und sie gehören in Struktur und Zusammensetzung zu den komplexesten aller organischen Verbindungen.
Biologische Rolle Proteine extrem groß: Sie machen den größten Teil des Protoplasmas und der Kerne lebender Zellen aus. Eiweißstoffe kommt in allen pflanzlichen und tierischen Organismen vor. Der Vorrat an Proteinen in der Natur lässt sich anhand der Gesamtmenge der lebenden Materie auf unserem Planeten beurteilen: Die Masse der Proteine beträgt etwa 0,01 % der Masse Erdkruste, also 10 16 Tonnen.
Eichhörnchen In ihrer elementaren Zusammensetzung unterscheiden sie sich von Kohlenhydraten und Fetten: Sie enthalten neben Kohlenstoff, Wasserstoff und Sauerstoff auch Stickstoff. Darüber hinaus dauerhaft Bestandteil Die wichtigsten Proteinverbindungen sind Schwefel, einige Proteine enthalten Phosphor, Eisen und Jod.
Eigenschaften von Proteinen
1. Unterschiedliche Löslichkeit in Wasser. Lösliche Proteine bilden kolloidale Lösungen.
2. Hydrolyse – unter dem Einfluss von Lösungen von Mineralsäuren oder Enzymen kommt es zur Zerstörung primäre Proteinstruktur und Bildung einer Mischung von Aminosäuren.
3. Denaturierung- teilweise oder vollständige Zerstörung der einem bestimmten Proteinmolekül innewohnenden räumlichen Struktur. Denaturierung tritt auf unter dem Einfluss von:
- - hohe Temperatur
- - Lösungen von Säuren, Laugen und konzentrierten Salzlösungen
- - Lösungen von Schwermetallsalzen
- - manche organische Substanz(Formaldehyd, Phenol)
- - radioaktive Strahlung
Proteinstruktur
Proteinstruktur begann im 19. Jahrhundert zu studieren. Im Jahr 1888 Der russische Biochemiker A.Ya. Danilevsky stellte die Hypothese auf, dass in Proteinen eine Amidbindung vorhanden ist. Diese Idee wurde später vom deutschen Chemiker E. Fischer entwickelt und fand in seinen Arbeiten experimentelle Bestätigung. Er bot an Polypeptid Theorie der Struktur Eichhörnchen. Nach dieser Theorie besteht ein Proteinmolekül aus einer langen Kette oder mehreren miteinander verbundenen Polypeptidketten. Solche Ketten können unterschiedlich lang sein.
Fischer führte ein großes durch experimentelle Arbeit Mit Polypeptide. Höhere Polypeptide mit 15–18 Aminosäuren werden durch Ammoniumsulfat (Ammoniumalaun) aus Lösungen ausgefällt, d. h. sie weisen charakteristische Eigenschaften auf Proteine. Es wurde gezeigt, dass Polypeptide von denselben Enzymen abgebaut werden wie Proteine, und wenn sie in den Körper des Tieres eingeführt werden, durchlaufen sie die gleichen Umwandlungen wie Proteine und ihr gesamter Stickstoff wird normalerweise in Form von Harnstoff (Harnstoff) freigesetzt.
Im 20. Jahrhundert durchgeführte Untersuchungen zeigten, dass es mehrere Organisationsebenen gibt Proteinmolekül.

Es gibt Tausende verschiedener Proteine im menschlichen Körper und fast alle bestehen aus einem Standardsatz von 20 Aminosäuren. Die Reihenfolge der Aminosäurereste in einem Proteinmolekül wird aufgerufen Primärstruktur Eichhörnchen. Eigenschaften von Proteinen und ihre biologischen Funktionen werden durch ihre Aminosäuresequenz bestimmt. Arbeiten Sie an der Klärung primäre Proteinstruktur wurden erstmals an der Universität Cambridge am Beispiel eines der einfachsten Proteine durchgeführt – Insulin . Im Laufe von 10 Jahren führte der englische Biochemiker F. Sanger eine Analyse durch Insulin. Als Ergebnis der Analyse wurde festgestellt, dass das Molekül Insulin besteht aus zwei Polypeptidketten und enthält 51 Aminosäurereste. Er fand heraus, dass Insulin eine Molmasse von 5687 g/mol hat und seine chemische Zusammensetzung der Formel C 254 H 337 N 65 O 75 S 6 entspricht. Die Analyse wurde manuell unter Verwendung von Enzymen durchgeführt, die Peptidbindungen zwischen bestimmten Aminosäureresten selektiv hydrolysieren.
Derzeit wird viel an der Definition gearbeitet Primärstruktur von Proteinen automatisiert. So entstand die Primärstruktur des Enzyms Lysozym.
Die Art der „Faltung“ einer Polypeptidkette wird als Sekundärstruktur bezeichnet. Am meisten Proteine Die Polypeptidkette ist spiralförmig aufgewickelt und erinnert an eine „verlängerte Feder“ (genannt „A-Helix“ oder „A-Struktur“). Eine weitere häufige Art von Sekundärstruktur ist die gefaltete Blattstruktur (genannt „B-Struktur“). Also, Seidenprotein - Fibroin hat genau diese Struktur. Es besteht aus einer Reihe von Polypeptidketten, die parallel zueinander angeordnet und durch Wasserstoffbrückenbindungen verbunden sind. große Nummer Dadurch ist Seide sehr flexibel und dehnbar. Dabei gibt es praktisch keine Proteine, deren Moleküle zu 100 % eine „A-Struktur“ oder „B-Struktur“ aufweisen.
 Fibroinprotein – natürliches Seidenprotein
Fibroinprotein – natürliches Seidenprotein Die räumliche Lage der Polypeptidkette wird als Tertiärstruktur des Proteins bezeichnet. Die meisten Proteine werden als globulär klassifiziert, da ihre Moleküle zu Kügelchen gefaltet sind. Das Protein behält diese Form aufgrund der Bindungen zwischen unterschiedlich geladenen Ionen (-COO- und -NH 3 +) und Disulfidbrücken bei. Darüber hinaus Proteinmolekül so gefaltet, dass die hydrophoben Kohlenwasserstoffketten innerhalb der Kügelchen liegen und die hydrophilen außen.
Die Methode, mehrere Proteinmoleküle zu einem Makromolekül zusammenzufassen, wird als bezeichnet Quartäre Proteinstruktur. Ein markantes Beispiel für ein solches Protein wäre Hämoglobin. Das wurde beispielsweise für ein erwachsenes menschliches Molekül festgestellt Hämoglobin besteht aus 4 separaten Polypeptidketten und einem Nicht-Protein-Teil – Häm.
Eigenschaften von Proteinen erklärt ihre unterschiedlichen Strukturen. Die meisten Proteine sind amorph und in Alkohol, Ether und Chloroform unlöslich. In Wasser können sich einige Proteine auflösen und eine kolloidale Lösung bilden. Viele Proteine sind in alkalischen Lösungen, einige in Salzlösungen und einige in verdünntem Alkohol löslich. Der kristalline Zustand von Proteinen ist selten: Beispiele hierfür sind Aleuronkörner, die in Rizinusbohnen, Kürbis und Hanf vorkommen. Kristallisiert auch Eiweiß Hühnerei und Hämoglobin in Blut.
Proteinhydrolyse
Beim Kochen mit Säuren oder Laugen sowie unter Einwirkung von Enzymen zerfallen Proteine in einfachere chemische Verbindungen und bilden am Ende der Transformationskette ein Gemisch aus A-Aminosäuren. Diese Aufteilung nennt man Proteinhydrolyse. Proteinhydrolyse hat ein tolles biologische Bedeutung: Im Magen und Darm eines Tieres oder Menschen angekommen, wird das Protein durch Enzyme in Aminosäuren zerlegt. Die resultierenden Aminosäuren bilden anschließend unter dem Einfluss von Enzymen wieder Proteine, die jedoch bereits für einen bestimmten Organismus charakteristisch sind!
Bei Produkten Proteinhydrolyse Neben Aminosäuren wurden auch Kohlenhydrate, Phosphorsäure und Purinbasen gefunden. Unter dem Einfluss bestimmter Faktoren, zum Beispiel Erhitzen, Lösungen von Salzen, Säuren und Laugen, Strahlung, Schütteln, kann die einem bestimmten Proteinmolekül innewohnende räumliche Struktur gestört werden. Denaturierung kann reversibel oder irreversibel sein, aber in jedem Fall bleibt die Aminosäuresequenz, also die Primärstruktur, unverändert. Durch die Denaturierung erfüllt das Protein seine inhärenten biologischen Funktionen nicht mehr.
Für Proteine sind bestimmte Farbreaktionen bekannt, die für deren Nachweis charakteristisch sind. Beim Erhitzen von Harnstoff entsteht Biuret, das mit einer Kupfersulfatlösung in Gegenwart von Alkali eine violette Farbe oder eine qualitative Reaktion auf Protein ergibt, die zu Hause durchgeführt werden kann. Die Biuret-Reaktion wird durch Substanzen ausgelöst, die eine Amidgruppe enthalten, und diese Gruppe ist im Proteinmolekül vorhanden. Bei der Xanthoprotein-Reaktion wird das Protein konzentriert Salpetersäure eingemalt Gelb. Diese Reaktion weist auf das Vorhandensein einer Benzolgruppe im Protein hin, die in Aminosäuren wie Phenylanin und Tyrosin vorkommt.
Beim Kochen mit einer wässrigen Lösung aus Quecksilbernitrat und salpetriger Säure ergibt das Protein eine rote Farbe. Diese Reaktion weist auf das Vorhandensein von Tyrosin im Protein hin. In Abwesenheit von Tyrosin tritt keine rote Farbe auf.