Methoden zur Infektion eines Hühnerembryos mit einem Virus. Hühnerembryonen
Zweck der Lektion
Schüler mit Methoden zur Auswahl von Hühnerembryonen für die Kultivierung von Viren vertraut machen.
Ausrüstung und Materialien
Hühnerembryonen 9-12 Tage Inkubationszeit, Ovoskop, Alkoholtupfer, Embryoständer, Pinzetten, Scheren, Klebeband, Nadeln, Spritzen, Bleistifte, Stanzen, Nadeln, Tabellen, Diagramme, Multimedia-Ausrüstung, Präsentationen MS Office Steckdose zum Thema der Lektion.
Methodik der Unterrichtsdurchführung und Richtlinien Zu diesem Thema
Erklärung des Lehrers
Die Kultivierung von Viren auf Hühnerembryonen ist die zugänglichste und bequemste Methode zur primären Isolierung des Virus. Die Anwendung dieser Infektionsmethode hat gegenüber anderen Methoden eine Reihe von Vorteilen gezeigt. Zur Infektion werden Embryonen mit einer Inkubationszeit von 5–12 Tagen verwendet.
VOR- UND NACHTEILE VON HÜHNEREMBRYONEN ALS BIOLOGISCHE OBJEKTE
Die Kultivierung von Viren in Hühnerembryonen ist die zugänglichste und bequemste Methode zur primären Isolierung von Viren aus kranken Tieren und Gegenständen Außenumgebung und zur anschließenden Kultivierung von Viren im Labor. Diese Methode wird häufig zur Identifizierung von Viren und Antikörpern sowie zur Herstellung von Impfstoffen und Diagnostika eingesetzt. Die Praxis hat eine Reihe von Vorteilen dieser Methode gegenüber der Kultivierung von Viren in Labortieren gezeigt. Es ist bekannt, dass weiße Mäuse, die in virologischen Studien häufig verwendet werden, spontan mit einer Reihe von Virusinfektionen infiziert werden können: Ektromelie, lymphozytäre Choriomeningitis, Taylor-Enzephalitis, virale Pneumonie, Sendai-Virus und andere, was die Arbeit äußerst erschwert und häufig dazu führt zu falschen Schlussfolgerungen bei der Bewertung der erzielten Ergebnisse. Ergebnisse. Durch die Kultivierung von Viren auf Hühnerembryonen werden die oben genannten Schwierigkeiten weitgehend beseitigt. Zusammen mit diesem von Hühnerembryo Sie können eine deutlich größere Menge an Viren erhalten als bei Versuchstieren. Der Hühnerembryo ist lebensfähiger und widerstandsfähiger gegen verschiedene Arten von Einflüssen, die beim Einbringen des Testmaterials unvermeidlich sind. Mit einer bekannten Fähigkeit, mit Embryonen zu arbeiten und die Regeln der Asepsis einzuhalten, ist ihr Tod unbedeutend. Die größte Verschwendung von Embryonen entsteht beim Einbringen des Materials in die Fruchthöhle und den Dottersack, aber selbst in diesen Fällen überschreitet sie 10–15 % nicht, wenn die notwendigen Inkubationsbedingungen erfüllt sind.
Hühnerembryonen als lebendes System gelangten in den 30er Jahren des 20. Jahrhunderts in die virologische Praxis. Ihr Einsatz hat das Spektrum der im Labor gezüchteten Viren erweitert und ermöglicht eine erfolgreichere Lösung der Probleme der Virologie, da Hühnerembryonen gegenüber Labortieren eine Reihe von Vorteilen haben: 1) Die Schale und die Unterschalenmembran schützen die Embryo durch bakterielle Infektion aus der äußeren Umgebung; 2) Ein wichtiger Vorteil von Embryonen ist auch ihre hohe Empfindlichkeit gegenüber einer Vielzahl von Viren, was durch die unzureichende Entwicklung von Schutzmechanismen erklärt wird; 3) Hühnerembryonen sind aufgrund der Entwicklung eines breiten Netzwerks von Geflügelfarmen und Brütereien ein leicht zugängliches Objekt; 4) Hühnerembryonen sind wirtschaftlich und erfordern keine Pflege oder Fütterung.
Die Hauptnachteile sind: 1) die Unfähigkeit, die Sterilität dieses lebenden Systems vollständig zu gewährleisten, da Embryonen in ihrem Inhalt Viren und andere Krankheitserreger tragen können (Viren der infektiösen Hühnerbronchitis, Newcastle-Krankheit, Influenza, Leukämie, Chlamydien und Mykoplasmen). Ihre Anwesenheit kann die Ergebnisse der Studie verfälschen; 2) Hühnerembryonen sind nicht gegenüber allen Viren empfindlich.
ZWECKE DER VERWENDUNG VON HÜHNEREMBRYONEN
Hühnerembryos werden in der Virologie hauptsächlich für die gleichen Zwecke wie Labortiere verwendet, nämlich:
– Nachweis des aktiven Virus durch Bioassay im pathologischen Material;
– primäre Isolierung des Virus. Viren, die bei Vögeln Krankheiten verursachen, sowie einige Säugetierviren werden effektiv isoliert und auf Hühnerembryonen kultiviert;
– Virenhaltung im Labor;
– Titration von Viren;
– Anreicherung des Virus für Laborforschung und Beschaffung von Impfstoffen;
– als Testobjekt in der Neutralisationsreaktion.
ANFORDERUNGEN AN HÜHNEREMBRYONEN
Eier müssen aus sicheren Quellen bezogen werden Viruserkrankungen Bauernhöfe. Befruchtete Eier, selbst von klinisch gesunden Hühnern, können verschiedene Viren enthalten, die bei diesen Vögeln vorkommen: Newcastle-Krankheit, infektiöse Bronchitis, infektiöse Laryngotracheitis, Enzephalomyelitis, Parainfluenza-2, Polyarthritis, Pocken, Arboviren, Adenoviren usw. Das Vorhandensein dieser Viren kann, können einerseits zu Diagnosefehlern führen und andererseits aufgrund des Interferenzphänomens zur Unterdrückung der Vermehrung des in der Untersuchungsprobe befindlichen Virus führen. Embryonen, die kein Virus enthalten, aber von Hühnern stammen, die asymptomatisch mit bestimmten Viren infiziert sind, können aufgrund des Vorhandenseins spezifischer Antikörper, die von der Mutter mit dem Eigelb gewonnen werden, auch weniger empfindlich oder völlig unempfindlich gegenüber den Auswirkungen eines bestimmten Virus sein. Für eine erfolgreiche Isolierung des Virus ist es erforderlich, dass die Hühner, deren Embryonen für die Arbeit verwendet werden, nicht gegen die Krankheit geimpft sind, deren Erreger gesucht wird. Eierschalen müssen unpigmentiert und sauber sein (können nicht gewaschen werden). Das Alter des Embryos muss der gewählten Infektionsmethode entsprechen.
Um eine normale Entwicklung der Embryonen in befruchteten Eiern während der Inkubationszeit zu gewährleisten, ist es notwendig, eine bestimmte Temperatur und Luftfeuchtigkeit aufrechtzuerhalten. Sich entwickelnde Embryonen vertragen eine Überhitzung deutlich schlechter als eine Abkühlung. Daher verursacht ein kurzfristiger (innerhalb weniger Stunden) Ausfall der Heizungsanlage keinen großen Schaden. Für eine längere Pause ist eine Erwärmung erforderlich.
Bruteier benötigen freien Zugang frische Luft, das durch Lüftungsschlitze eintritt. Sie müssen immer offen sein. Ein Ei verbraucht, wie allgemein angenommen wird, 1 Liter Sauerstoff pro Tag, was nicht verwunderlich ist, wenn man sich an die schnelle Entwicklung des Embryos während der 21-tägigen Inkubation erinnert. Deshalb sollten Eier nicht dicht nebeneinander oder übereinander gelegt werden. Herkömmliche Thermostate sind zum Ausbrüten von Eiern nicht geeignet. Sie können für diese Zwecke nur im äußersten Notfall verwendet werden, aber gleichzeitig häufig lüften und ein Gefäß mit Wasser hineinstellen, um die erforderliche Luftfeuchtigkeit zu gewährleisten.
Zur Inkubation gelegte Eier werden nach 3–5 Tagen mit einer speziellen Tisch- oder Handlampe (sofern die Eier nicht aus der Brutschale genommen werden) untersucht, um unbefruchtete Eier auszuwählen. Livorno-Eier eignen sich am besten für virologische Arbeiten, da ihre dünne weiße Schale eine bessere Sicht auf den Inhalt ermöglicht. Eier, die unbefruchtet sind oder tote Embryonen enthalten, werden aus dem Inkubator entfernt. Der Anteil befruchteter Eier variiert stark und hängt von vielen Faktoren ab, unter anderem von der Jahreszeit: Im Frühling ist er am höchsten, im Winter am niedrigsten.
Am Tag der geplanten Infektion werden die Embryonen zum zweiten Mal gescannt. Dieser Zeitraum hängt von der Art des Virus sowie dem Weg seiner Einschleppung ab. Die Infektionsstelle wird mit einem normalen Bleistift (kein Tintenstift) auf der Schale markiert.
STRUKTUR DES HÜHNEREMBRYOS
Typischerweise legt ein Huhn ein befruchtetes Ei, in dem sich der Embryo im Blastula- oder frühen Gastrula-Stadium befindet. Wenn ein Ei auf eine Temperatur nahe der Körpertemperatur des Huhns erhitzt wird, weitere Entwicklung Embryo (Abb. 15). Im Zeitraum vom 5. bis 12. Inkubationstag können Hühnerembryonen zur Infektion mit Viren eingesetzt werden.
Abbildung 15 – Schematischer Schnitt eines Hühnerembryos am 8. Tag der Inkubation: 1 – Schale; 2 – Unterschalenmembran; 3 – Chorioallantoismembran; 4 – Allantoishöhle; 5 – Dottersack; 6 – Eiweiß; 7 – Luftkammer; 8 – Körper des Embryos; 9 – Fruchthöhle
Ein Ei mit einem sich entwickelnden Hühnerembryo ist außen mit einer harten, porösen Schale bedeckt, an der die Unterschalenmembran fest anliegt. Letzteres ist am stumpfen Ende des Eies in zwei Blätter geteilt, zwischen denen sich eine Luftkammer bildet. Der Körper des Embryos liegt exzentrisch im Ei, wobei der Rücken näher an der Schale liegt und der Kopf zur Luftkammer zeigt. Der Embryo wird in das Fruchtwasser eingetaucht, das die Fruchthöhle füllt, und ist über eine Nabelschnur mit dem Eigelb verbunden. Auch das Eigelb liegt exzentrisch und relativ zum Embryo, als ob es auf der anderen Seite der Längsachse wäre.
Direkt unter der Schalenmembran befindet sich eine Allantoishöhle, die das Fruchtwasser und den Dottersack bedeckt und am 10.-11. Tag im scharfen Ende des Eies verschlossen ist. Während der Entwicklung verschmilzt die Allantoismembran mit dem Chorion und bildet eine einzige Chorioallantoismembran (CAO). Am scharfen Ende des Eies befindet sich der Rest des Proteins.
Die Infektion des einen oder anderen Teils des Embryos erfolgt während der Zeit seiner maximalen Entwicklung, wenn die Anzahl der empfindlichen Zellen am größten ist.
Während des Inkubationsprozesses verändert sich die Größe der embryonalen Strukturen, was größtenteils durch ihre Größe erklärt wird funktionaler Zweck und bestimmt das optimale Alter des Embryos für eine Infektion.
Der Dottersack ist also wie ein Reservoir Nährstoffe hat zu Beginn der Inkubation das größte Volumen und nimmt dann (nach dem 12. Tag) mit der Entwicklung des Embryos ab. Infizieren Sie den Dottersack vom 5. bis 7. Tag der Inkubation.
Die Fruchthöhle, die eine Pufferumgebung für die Entwicklung des Embryos darstellt, bedeckt ihn bereits am 5. Tag der Inkubation. Die durchschnittliche Flüssigkeitsmenge beträgt zur Mitte der Inkubationszeit etwa 1 ml.
Zur Infektion der Fruchthöhle werden Embryonen im Alter von 6–10 Tagen verwendet.
Die Allantoishöhle dient der Sammlung von Stoffwechselprodukten; darin reichern sich Harnsäuresalze, Phosphor- und Stickstoffverbindungen an. Während des Wachstums und der Entwicklung des Embryos wird die Allantoisflüssigkeit sauer. Die Allantoishöhle erreicht ihre maximale Größe am 9.-12. Tag der Embryonalentwicklung, daher erfolgt die Infektion der Allantoishöhle hauptsächlich am 9.-11. Tag der Inkubation.
Die Chorioallantoismembran ist reich an Blutgefäßen, die eng an der Innenfläche der porösen Hülle anliegen, mit Sauerstoff gesättigt sind und ihn dem Körper des Embryos zuführen und dabei die Funktion des Atmungsorgans des Embryos erfüllen. CAO erreicht seine maximale Entwicklung am 11.-13. Tag. Die Infektion der Chorioallantoismembran erfolgt am 10.-12. Inkubationstag.
VORBEREITUNG VON HÜHNEREMBRYONEN AUF EINE INFEKTION
Embryonen werden aus der Brutstätte transportiert, ohne unterwegs gekühlt zu werden. Im Labor werden Embryonen in einem Thermostat bei einer Temperatur von 37 °C und einer Luftfeuchtigkeit von 60–70 % inkubiert, was durch das Stellen offener Weithalsgefäße mit Wasser in den Thermostat erreicht wird. Belüftungslöcher Thermostate müssen geöffnet sein. Embryonen werden mit der Luftkammer nach oben in spezielle Ständer gelegt. Es wird empfohlen, den Embryonen zu ermöglichen, sich innerhalb von 24 Stunden vor der Infektion an die neuen Bedingungen anzupassen und ihre Funktionen nach dem Transportstress zu normalisieren. Wenn das Labor über eine eigene Brüterei verfügt, können die vom Huhn gelegten befruchteten Eier innerhalb von 10 Tagen dort abgelegt werden.
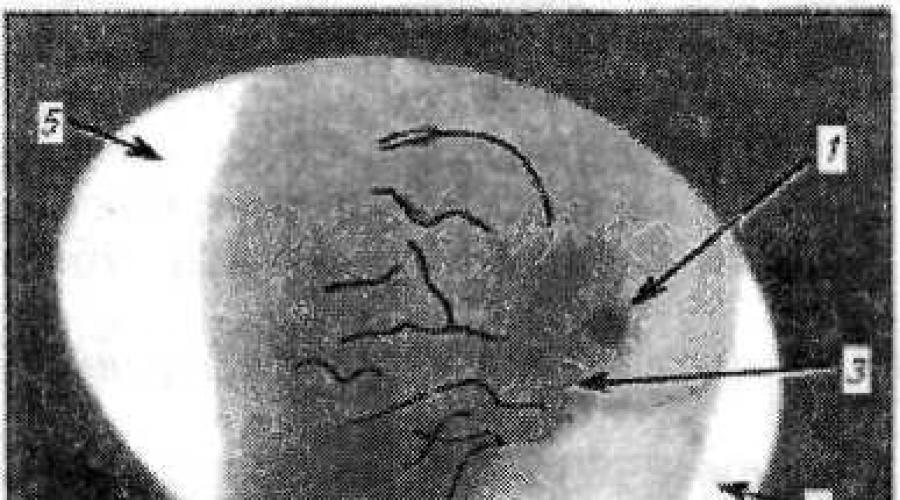
Die Vorbereitung von Hühnerembryonen auf eine Infektion umfasst die Ovoskopie und Desinfektion der Schale sowie eine entsprechende Vorbereitung des Arbeitsplatzes. Beim Ovoskopieren werden Eier gegen eine ausreichend helle Lichtquelle (Ovoskop) betrachtet, wodurch auf der unbeleuchteten Seite der Schale Schatten von inneren Strukturen entstehen (Abb. 16). Das Ovoscoping wird in einem abgedunkelten Raum durchgeführt. Gleichzeitig werden auf der Schale mit einem Graphitstift der Rand der Luftkammer, die Lage des Embryos und ein 0,5 x 0,5 cm großer Abschnitt der avaskulären Zone markiert. Diese Markierungen dienen als Orientierung bei der Auswahl die Stelle zum Einbringen des virushaltigen Materials. Bei der Ovoskopie wird auch festgestellt, ob der Embryo lebt oder tot ist. Als lebendig gelten Embryonen, die aktive Bewegungen mit guter Blutversorgung der CAO-Gefäße zeigen.

Abbildung 16 – Ovoskopie eines Hühnerembryos am 10. Tag der Inkubation. Es sind Schatten sichtbar: 1 – Embryo; 2 – Dottersack; 3 – Blutgefäße XAO; 4 – Luftkammer; 5 – Eichhörnchen
Hühnerembryonen werden unter aseptischen Bedingungen (vorzugsweise in einer Box) infiziert. In der Vorbox werden die Embryonenhüllen mit jodiertem Alkohol behandelt, in der Box werden sie dann erneut abgewischt und manchmal auch flambiert – behandelt mit der Flamme eines mit Alkohol befeuchteten Tupfers.
Embryonen werden in speziellen Ständern fixiert, die in einer Emailleküvette auf einem mit einer Desinfektionslösung befeuchteten 3-4-lagigen Mulltuch installiert sind.
Bei der Arbeit werden durch Kochen sterilisierte Werkzeuge verwendet. Sie werden in ein Glas mit Alkohol gegeben und vor jeder Wiederverwendung mit einer Brennerflamme verbrannt.
Demonstration
a) klinische Krankheitszeichen bei infizierten Versuchstieren; b) Methoden zur Tötung von Labortieren; c) Autopsietechniken (die Aufmerksamkeit der Schüler auf den Zustand lenken). innere Organe) und Methoden zur Gewinnung virushaltigen Materials; d) Techniken zur Anfertigung von Gehirnabdrücken; e) Maßnahmen zur Desinfektion des Arbeitsplatzes und der Leiche nach der Autopsie eines infizierten Tieres.
Aufgaben
1.Untersuchen Sie die Struktur eines Hühnerembryos.
2. Führen Sie eine Ovoskopie eines Hühnerembryos durch, bestimmen Sie seine Lebensfähigkeit und markieren Sie die Grenzen der Schatten natürlicher Formationen.
3. Bereiten Sie Hühnerembryonen auf die Infektion vor.
Selbstständige Arbeit Studenten
a) Erkennung der von jedem Schüler infizierten Mäuse anhand der Farbmarkierung und Analyse derselben klinischer Zustand, Abtöten, Fixieren in einer Küvette mit Wachsboden (Paraffin), Öffnen; b) Analyse pathologischer Veränderungen, Gewinnung virushaltigen Materials (Parenchymorgane), schichtweise Erstellung von Gehirnabdrücken.
Die Schüler führen eine Ovoskopie eines Hühnerembryos durch, bestimmen seine Lebensfähigkeit und markieren die Grenzen der Schatten natürlicher Formationen.
Zusammenfassung der Lektion
Aufgabe für die nächste Lektion
1. Die Struktur eines Hühnerembryos.
2. Warum werden Hühnerembryonen in der Virologie verwendet?
3. Wie ist der Aufbau eines sich entwickelnden Hühnerembryos?
Für virologische Studien werden Hühnerembryonen im Alter von 7–12 Tagen verwendet ( am häufigsten 9-12 Tage, manchmal 5-12 Tage).
Vor der Infektion wird die Lebensfähigkeit des Embryos bestimmt. Bei der Ovoskopie sind lebende Embryonen beweglich und das Gefäßmuster ist deutlich sichtbar. Die Grenzen des Luftsacks werden mit einem einfachen Bleistift markiert. Hühnerembryonen werden unter aseptischen Bedingungen mit sterilen Instrumenten infiziert, nachdem die Schale über dem Luftraum mit Jod oder Alkohol vorbehandelt wurde.
Methoden zur Infektion von Hühnerembryonen kann unterschiedlich sein: Einbringen des Virus in die Chorioallantoismembran, in die Fruchtwasser- und Allantoishöhle, in den Dottersack und in den Körper des Embryos. Die Wahl der Infektionsmethode hängt von den biologischen Eigenschaften des untersuchten Virus ab.
Es gibt zwei Möglichkeiten, Hühnerembryonen zu infizieren:
1) Öffnen – die Schale über dem Luftsack wird mit Alkohol und Jod behandelt, die Schale wird mit einer scharfen Schere abgeschnitten, die obere Schicht der Luftsackschale wird entfernt und die Infektion wird durchgeführt. Das Loch wird mit einem speziellen Glasdeckel oder einer speziellen Glasschale verschlossen und mit sterilem geschmolzenem Paraffin versiegelt.
2) Geschlossen – die Hülle über dem Luftsack wird mit Alkohol und Jod behandelt, mit einem Stechinstrument wird ein Loch in die Hülle gebohrt und unter Kontrolle werden 0,1–0,2 ml virushaltiges Material mit einer Spritze mit dicker Nadel injiziert eines Ovoskops. Das Loch wird mit sterilem, geschmolzenem Paraffin verschlossen.
Infizierte Embryonen werden 2–4 Tage lang in einem Thermostat inkubiert. Anschließend werden sie den ganzen Tag über auf 4 °C gekühlt, um eine maximale Gefäßverengung zu erreichen. Unter sterilen Bedingungen öffnen, nachdem die Schale zuvor mit Alkohol oder Jod behandelt wurde.
Hinweise auf das Virus in einem Hühnerembryo geben der Tod des Embryos, eine positive Hämagglutinationsreaktion auf Glas mit Allantois- oder Fruchtwasser sowie fokale Läsionen („Plaques“) auf der Chorion-Allantois-Membran.
Viren können nur in lebenden Zellen kultiviert werden. Zu diesem Zweck wird jedes biologische System verwendet: tierische Organismen, Hühnerembryonen, Zellkulturen. Bei der Auswahl der Versuchstiere müssen folgende Anforderungen erfüllt sein: - Die Tiere müssen gesund sein. Neuankömmlinge im Vivarium werden in Quarantäne gehalten (Mäuse und Ratten 14 Tage, andere 21 Tage). Um latente (versteckte) Infektionen viraler Ätiologie auszuschließen.
Für alle Tiere gelten folgende Anforderungen: - Tiere müssen empfindlich gegenüber diesem Virus sein; - das Alter des Tieres hat sehr wichtig: Junge und Neugeborene sind am empfindlichsten, aber in einigen Fällen werden erwachsene Tiere verwendet, um eindeutige klinische Anzeichen der Krankheit zu erkennen; - Tiere müssen das gleiche Alter und Körpergewicht haben; Hierfür sind lineare Tiere besser geeignet, d.h. durch Inzucht gewonnen.
Für virologische Studien werden subkutane, kutane, intradermale, intramuskuläre, intraperitoneale, intravenöse, orale, intranasale und intrazerebrale Infektionen von Labortieren verwendet.
Isolierung und Kultivierung von Viren
Die Isolierung und Identifizierung des Erregers ist der „Goldstandard“ in der Diagnostik viraler Infektionen.
Zellkultur
Viren vermehren sich nur in lebenden Zellen und die Isolierung des Erregers in einer infizierten Zellkultur ist eine der wichtigsten Methoden zur Diagnose viraler Infektionen. Da sich die meisten pathogenen Viren durch Gewebe- und Typspezifität unterscheiden, ist es möglich, für fast jedes Virus geeignete Zell- oder Gewebekulturen auszuwählen und Standardkultivierungsbedingungen (das Vorhandensein von Zellen desselben Typs) zu schaffen. Die Vermehrung des Virus wird durch empfindliche (permissive) Zellen sichergestellt. Wenn daher ein unbekannter Erreger isoliert wird, werden 3-4 Zellkulturen gleichzeitig infiziert, wobei davon ausgegangen wird, dass eine davon möglicherweise permissiv ist. Zellkulturen werden durch Dispergierung der entsprechenden Organe und Gewebe gewonnen, häufiger werden jedoch embryonale Gewebe (menschlich und tierisch) oder transformierte Tumorzellen verwendet. Wenn Zellkulturen auf einer geeigneten flachen Oberfläche platziert werden, wachsen sie typischerweise als Monoschicht.
Primäre trypsinisierte Kulturen. Zellsuspensionen werden durch Homogenisierung der entsprechenden, mit Trypsin vorbehandelten Gewebe gewonnen. Kulturen bestehen oft aus gemischten Zelltypen und können nicht rekultiviert werden. Die Lebensfähigkeit solcher Pflanzen beträgt 2-3 Wochen.
Halbkontinuierliche Zelllinien dargestellt durch diploide Zellen von Menschen und Tieren. Kulturen eignen sich nur begrenzt für erneute Ausbreitung und Wachstum (in der Regel nicht mehr als 20–30 erneute Aussaaten), behalten aber ihre Lebensfähigkeit bei und unterliegen keiner spontanen Transformation.
Kontinuierliche Zelllinien(heteroploide Kulturen) werden durch Zellen repräsentiert, die einer Langzeitkultivierung und spontanen Transformationen unterzogen wurden. Kulturen sind zur wiederholten Ausbreitung und Transplantation fähig. Die Arbeit mit ihnen ist im Vergleich zur Vorbereitung von Primärkulturen weniger arbeitsintensiv. Die transplantierten Zellen sind in ihrer Morphologie relativ identisch und in ihren Eigenschaften stabil.
Organkulturen
Nicht alle Zelltypen sind in der Lage, als Monoschicht zu wachsen; in manchen Fällen ist die Aufrechterhaltung differenzierter Zellen nur in Organkulturen möglich. Es handelt sich in der Regel um eine Gewebesuspension mit einer speziellen Funktion, die auch als „Gewebe“ bezeichnet wird Kultur des Erlebens von Gewebe.
Hühnerembryonen (Abb. 1-20) - praktisch ideale Modelle zur Kultivierung bestimmter Viren (zum Beispiel Influenza und Masern). Der geschlossene Hohlraum des Embryos verhindert das Eindringen von Mikroorganismen von außen sowie die Entstehung spontaner Virusinfektionen. Embryonen werden zur primären Isolierung von Viren aus pathologischem Material verwendet; zum Passivieren und Konservieren sowie zum Gewinnen benötigte Mengen Virus. Einige Erreger (z. B. Herpesviren) verursachen charakteristische Veränderungen (daran lässt sich die Erkrankung erkennen). Die Infektion erfolgt an der Chorion-Allantois-Membran, in der Amnion- oder Allantoishöhle oder im Dottersack.
Infektion der Chorion-Allantois-Membran. Normalerweise werden 10-12 Tage alte Embryonen verwendet. Die Eier werden im Durchlicht betrachtet, die Lage des Luftsacks wird notiert und ein Bereich ohne Blutgefäße ausgewählt. Entfernen Sie vorsichtig das Schalenfragment, lösen Sie die äußere Schale und ziehen Sie diese mit leichtem Druck ab. Dann wird am Rand des Luftsacks ein Loch gemacht. Beim Absaugen durch dieses Loch wird die Chorion-Allantois-Membran von der Außenmembran abgeschält. Darauf wird das bakterien- und protozoenfreie Testmaterial aufgetragen (durch Bakterienfilter geleitet und mit Bakteriziden behandelt).
Infektion in der Fruchthöhle. Typischerweise werden 7-14 Tage alte Embryonen verwendet, bei denen nach Ablösung der Chorion-Allantois-Membran (siehe oben) die Öffnung erweitert, die Amnionmembran mit einer Pinzette gegriffen und durch die Chorion-Allantois-Membran entfernt wird. Dadurch wird das Testmaterial in die Fruchthöhle eingeführt.
Infektion in der Allantoishöhle. 10 Tage alte Embryonen werden durch Löcher in der Schale und den darunter liegenden Membranen infiziert (siehe oben).
Infektion im Dottersack. Es werden 3-8 Tage alte Embryonen verwendet, bei denen in diesem Alter der Dottersack fast die gesamte Eihöhle einnimmt. Die Infektion erfolgt durch ein Loch im Luftsack
Beobachtung und Aufzeichnung der Ergebnisse. Als virushaltiges Material können Sie den Inhalt des Dottersacks, Allantois- und Fruchtwasser oder den gesamten Embryo, zusammen mit der Umgebung, verwenden
Stoffe in Stücke. Zur Identifizierung von Abb. 1-20.Schematische Darstellung
charakteristische Läsionen am Chorion des sich entwickelnden Hühnerembryos.
Die Schale wird von der Allantoismembran entfernt
und die äußere Hülle. Anschließend wird die Membran entfernt und in steriles Wasser gelegt. Die Art der Läsionen wird vor einem dunklen Hintergrund untersucht.
Tiermodelle
Wenn es nicht möglich ist, das Virus mit Standardmethoden zu isolieren und zu identifizieren in vitro Tieren, die gegenüber dem Erreger empfindlich sind, wird infektiöses Material verabreicht und nach der Entwicklung eines typischen Infektionsprozesses werden empfindliche Zellkulturen erneut infiziert. Am häufigsten werden Mäuse, Kaninchen und Affen verwendet; Um einige Viren (z. B. Coxsackie-Viren) zu isolieren, werden säugende Mäuse infiziert. Aufgrund der hohen Kosten und Komplexität der Labortierhaltung wurden diese fast überall durch Zellkulturen ersetzt. Dennoch werden Tiermodelle aktiv eingesetzt, um die Merkmale der Pathogenese und die Bildung von Immunantworten bei Virusinfektionen zu untersuchen.
Zweck der Lektion: Schüler mit Methoden zur Infektion von Hühnerembryonen zur Kultivierung von Viren vertraut zu machen.
Ausrüstung und Materialien: Hühnerembryonen 9-12 Tage Inkubation, Ovoskop, Alkoholtupfer, Ständer für Embryonen, Pinzette, Schere, Klebeband, Nadeln, Spritzen, Bleistifte, Stanzen, Nadeln, Tabellen, Diagramme, Multimedia-Ausrüstung, Präsentationen MS Office Power Point zum Thema der Lektion.
Erklärung des Lehrers.
Die Infektionsmethode beeinflusst die Vermehrung von Viren in Embryonen erheblich. Vor der Infektion werden bebrütete Eier durchgeleuchtet und tote Eier getrennt. Auf den Schalen von Eiern mit lebenden Embryonen, die sich durch die rote Farbe der Blutgefäße und die Bewegung des Embryos auszeichnen, wird die Infektionsstelle mit einem Bleistift markiert.
Die Embryonen werden in einer sterilen Box mit Arbeitstisch, zwei Stühlen, Gasversorgung, Wasserversorgung und Vakuum infiziert. Die Infektion der Fruchthöhle erfolgt in einem abgedunkelten Raum. Arbeitsplatz sollte gut beleuchtet sein. Vor der Arbeit wird der Tisch desinfiziert. Um die Oberfläche von Eiern zu desinfizieren, bereiten Sie eine antiseptische Lösung (70 % Alkohol, 2 % Jodlösung) und einen mit Watte umwickelten Holzstab, eine gebogene Zahnsonde oder einen Bohrer zum Bohren vor. Eierschalen. Die Infektion der Eier erfolgt mit sterilen Tuberkulinisierungsspritzen und speziellen Nadeln. Die Infektionsstelle am Ei ist mit Paraffin gefüllt. Dazu werden Paraffinstäbchen vorbereitet: Ein Glasstab wird in ein mit geschmolzenem Paraffin gefülltes Reagenzglas eingeführt und darauf geachtet, dass er sich in der Mitte des Reagenzglases befindet, bis das Paraffin abkühlt.
Wenn ein Paraffinstab benötigt wird, werden die Wände des Reagenzglases auf einem Brenner erhitzt und das Paraffin mit einem Glasstab aus dem Reagenzglas gezogen. Halten Sie den Stab über die Flamme und schmelzen Sie die Menge Paraffin, die erforderlich ist, um das Loch im Ei zu schließen. Diese Methode ist sehr sauber und erzeugt keine Paraffindämpfe.
Zusätzlich werden in einer Box ein Glas mit sterilen Wattestäbchen, ein Glas mit einer 3%igen Natronlauge für gebrauchte Instrumente und ein Gefäß mit einer Chloraminlösung für gebrauchte Glasgegenstände auf den Arbeitstisch gestellt. Bei Bedarf können Sie einen Eierbecher, einen kleinen Emaillebecher und sterile Nährmedien vorbereiten. Der so vorbereitete Arbeitstisch wird 1-2 Stunden lang einer UV-Bestrahlung ausgesetzt.
Angesichts der Pathogenität der untersuchten Viren wird mit Maske, Gummihandschuhen und Schutzbrille gearbeitet.
Es gibt sechs Methoden zur Infektion von Embryonen. Am häufigsten wird eine Infektion in die Allantoishöhle und die Chorioallantoismembran eingesetzt, seltener in die Fruchthöhle und in den Dottersack und sehr selten in den Körper des Embryos und in die Blutgefäße des CAO. Die Wahl der Methode wird durch den Tropismus des Virus sowie den Zweck der Infektion bestimmt. Bei jeder Infektionsmethode werden 0,1–0,2 ml infektiöses Material injiziert.
Infektion in der Allantoishöhle.
Bei einer Infektion mit dieser Methode vermehren sich Influenzaviren, Newcastle-Krankheit, Pferde-Rhinopneumonie, vesikuläre Stomatitis usw. gut. Es gibt mehrere Varianten der Methode.
Erste Wahl. Der Embryo wird vertikal mit dem stumpfen Ende nach oben fixiert. In die Schale wird auf der Seite des Embryos und manchmal auf der dem Embryo gegenüberliegenden Seite, 5-6 mm über dem Rand der Luftkammer, ein Loch mit einem Durchmesser von etwa 1 mm gebohrt. Die Nadel wird parallel zur Längsachse bis zu einer Tiefe von 10-12 mm eingeführt (Abb. 16). Nach der Injektion des virushaltigen Materials wird die Nadel entfernt und das Loch in der Hülle mit einem Tropfen geschmolzenem sterilem Paraffin verschlossen.
Abbildung 16. Infektion in der Allantoishöhle (erste Option) (nach Nikolaou)
Zweite Option. Das in der Schale über der Luftkammer angebrachte Loch dient nur dazu, einen Teil der Luft entweichen zu lassen. Das Loch für die Infektion selbst wird im Bereich der avaskulären Zone der Chorioallantoismembran (CAO) auf der Seite des Embryos angebracht. Die Nadel wird maximal 2-3 mm tief eingeführt. Injizieren Sie eine infektiöse Flüssigkeit in einem Volumen von 0,1–0,2 ml und verschließen Sie das Loch mit Paraffin (siehe Abb. 17).
Infektion der Chorioallantoismembran.
Diese Methode zur Infektion von Hühnerembryonen wird häufig zur Kultivierung epitheliotroper und pantropischer Viren von Pocken, infektiöser Laryngotracheitis bei Vögeln, Staupe, Aujeszky-Krankheit, Blauzungenkrankheit usw. verwendet.
Eine solche Infektion kann durch eine natürliche oder künstliche Luftkammer erfolgen.
Für eine Infektion durch eine natürliche Luftkammer Der Embryo wird mit dem stumpfen Ende nach oben senkrecht auf ein Stativ gestellt und in der Schale gegen die Mitte der Luftkammer ein rundes Fenster mit einem Durchmesser von 15-20 mm ausgeschnitten. Durch dieses Fenster wird die Unterschalenmembran mit einer Pinzette entfernt. 0,2 mm einer virenhaltigen Suspension werden auf den freiliegenden Bereich des CAO aufgetragen (Abb. 18), das Loch wird mit einem Heftpflaster oder seltener mit einem mit geschmolzenem Paraffin verstärkten Deckglas verschlossen.
Infektion durch eine künstliche Luftkammer wird häufiger verwendet als das erste, da es den Kontakt von virushaltigem Material gewährleistet größere Oberfläche XAO und führt daher zur Bildung weiterer Viren.
Abbildung 17. Infektion eines Hühnerembryos in der Allantoishöhle (zweite Option) (nach Nikolaou)
Abbildung 18. Infektion bei KhAO durch eine natürliche Luftkammer (nach Nikolaou et al.)
Abbildung 19. Infektion eines Hühnerembryos bei KhAO durch eine künstliche Luftkammer (nach Nikolaou et al.)
Um einen Embryo mit dieser Methode zu infizieren, wird er horizontal mit dem Embryo nach oben in einen Ständer gestellt. In die Schale werden zwei Löcher gebohrt: eines klein über der Mitte der Luftkammer (zum Ansaugen von Luft) und das andere mit einem Durchmesser von 0,2 bis 0,5 cm seitlich, auf der Seite des Embryos. Die Komplexität der Methode besteht darin, dass Sie beim Bohren des zweiten Lochs zunächst vorsichtig ein Stück der Schale entfernen und dann die Schale mit einer Gleitbewegung, ohne die chemische Substanz zu beschädigen, zur Seite bewegen müssen, damit Luft durch das entstehende Loch strömen kann Defekt. Anschließend wird durch das erste Loch (Abb. 19, a) mithilfe eines Gummiballs Luft aus der natürlichen Luftkammer abgesaugt (Abb. 19, a). Dadurch strömt Außenluft durch das seitliche Loch ein und bildet eine künstliche Luftkammer, den Boden davon ist das XAO (Abb. 19, b).
Durch das seitliche Loch wird eine infektiöse Flüssigkeit auf die Oberfläche des CAO aufgetragen und das Loch mit einem Stück Klebeband verschlossen. Das erste Loch muss nicht verschlossen werden, da die innere Schicht der Schalenmembran durch diese Infektionsmethode nicht beschädigt wird und weiterhin als Barriere für die Mikroflora in der Umgebung fungiert.
Die weitere Inkubation der mit dieser Methode infizierten Embryonen erfolgt in horizontaler Position mit der seitlichen Öffnung nach oben.
Infektion im Dottersack.
Meistens wird es zur Vermehrung von Chlamydien sowie von Viren der Marek-Krankheit, der Rhinopneumonie des Pferdes, der Blauzungenkrankheit von Schafen usw. verwendet. Sie infizieren Embryonen im Alter von 5 bis 7 Tagen und manchmal von 2 bis 3 Tagen (RIF). Valley-Fieber-Virus). Es werden zwei Infektionsmöglichkeiten genutzt.
Erste Wahl. Embryonen werden in vertikaler Position auf einem Stativ platziert. Über der Mitte der Luftkammer wird ein Loch in die Schale gebohrt und eine Nadel bis zu einer Tiefe von 3,5 bis 4 cm in einem Winkel von 45° zur vertikalen Achse in entgegengesetzter Richtung zum Standort des Embryos eingeführt (Abb. 20).
Abbildung 20. Infektion eines Hühnerembryos im Dottersack (nach Nicolaou et al.)
Zweite Option. Manchmal wird ein ähnlicher Infektionsweg bei einem horizontal auf einem Stativ montierten Embryo durchgeführt; In diesem Fall befindet sich der Embryo unten und das Eigelb darüber. Das Loch in der Schale wird mit einem Tropfen geschmolzenem Paraffin verschlossen.
Infektion in der Fruchthöhle.
Hierzu werden 6 bis 10 Tage alte Embryonen verwendet. Die Methode wird zur Kultivierung von Influenzaviren, Newcastle-Krankheit, Rhinopneumonie bei Pferden usw. verwendet. Es gibt zwei Infektionsmethoden.
Geschlossene Methode. Die Ansteckung erfolgt in einer abgedunkelten Box. Die Eizelle wird horizontal mit dem Embryo nach oben auf das Ovoskop gelegt. Eine Nadel mit stumpfem Ende wird durch ein Loch in der Schale über der Luftkammer in Richtung Embryo eingeführt. Der Beweis dafür, dass die Nadel in das Amnion eingedrungen ist, ist die Bewegung des fetalen Körpers in Bewegungsrichtung.
Offene Methode. Die Schale über der Luftkammer wird so geschnitten, dass ein Fenster mit einem Durchmesser von 1,5-2,5 cm entsteht. Durch dieses wird die Unterschalenmembran unter Augenkontrolle mit einer Pinzette entfernt. Dann wird eine anatomische (14 cm) Pinzette mit geschlossenen Backen geführt, die die Chorioallantoismembran in Richtung des Embryos drückt. Wenn die Pinzette dort ankommt, öffnen sich die Backen, greifen die Fruchtwassermembran zusammen mit dem CAO und ziehen sie zum Fenster. Halten Sie die Pinzette mit der darin fixierten Amnionmembran mit der linken Hand fest und führen Sie ein virushaltiges Material ein (Abb. 21). Anschließend werden alle Schalen abgesenkt, das Fenster mit einem Heftpflaster verschlossen und der Embryo in vertikaler Position inkubiert.
Abbildung 21. Infektion eines Hühnerembryos im Amnion offene Methode(nach Nikolaou et al.)
Infektion in den Blutgefäßen von XAO.
Bei der Ovoskopie 11–13 Tage alter Embryonen fällt ein großes Blutgefäß auf. Im weiteren Verlauf wird ein Teil der Schale entfernt, 1-2 Tropfen Alkohol aufgetragen, wodurch die Schalenmembran für eine Weile transparent wird. Unter Augenkontrolle mit einem Ovoskop wird die Nadel in das Gefäß eingeführt, was durch ihre Beweglichkeit bei kleinen seitlichen Bewegungen der Nadel bestätigt wird. Der freiliegende Bereich der Unterschalenmembran wird mit einem Stück Heftpflaster abgedeckt.
Das Einbringen des Materials in die Gefäße kann auch auf etwas andere Weise erfolgen: Die Schale über der Luftkammer wird abgeschnitten, die Unterschalenmembran mit Alkohol befeuchtet und das Material in die sichtbar gewordenen XAO-Gefäße eingebracht. Das Loch wird mit einem Stück sterilem Klebeband abgedeckt.
Die beschriebenen technischen Methoden zur experimentellen Infektion von Hühnerembryonen sind nicht die einzigen, sondern bieten verschiedene Möglichkeiten.
Infektion im Körper des Embryos.
Für die Infektion werden Embryonen verwendet, die 7–12 Tage alt sind. Es gibt zwei bekannte Versionen der Methode.
Erste Wahl. Sie infizieren das Amnion auf die gleiche Weise wie das geschlossene Amnion, mit dem einzigen Unterschied, dass sie eine scharfe Nadel nehmen und auf einem Ovoskop der Indikator für das Eindringen der Nadel in den Körper als Unterordnung des Embryos angesehen wird zu den Bewegungen der Nadel.
Zweite Option. Sie infizieren das Amnion auf die gleiche Weise wie beim offenen Weg: Durch ein Fenster in der Schale wird der Körper des Embryos mit einer Pinzette hochgezogen. Das Material wird in das Gehirn oder bestimmte Bereiche des Körpers injiziert. Bei solchen Infektionsmethoden kommt es zu einem erheblichen Prozentsatz des unspezifischen Embryotods.
Virusansammlung im Hühnerembryo
Vor der weiteren Inkubation schreiben sie auf die Schale von Hühnerembryonen, die mit irgendeiner Methode infiziert wurden, mit einem einfachen (Graphit-)Stift, womit der Embryo wann infiziert ist und gegebenenfalls weitere Informationen. Infizierte Hühnerembryonen werden zur weiteren Inkubation in einen Thermostat gegeben, wobei die eingeführten Viren reproduziert und in den entsprechenden Strukturen angereichert werden. Die Inkubationstemperatur von Embryonen variiert zwischen 33 und 38 °C, abhängig von den Eigenschaften des Virus, mit dem die Infektion durchgeführt wurde. Die Embryonen werden ständig überwacht, mit einem Ovoskop untersucht und tote Embryonen werden ausgewählt.
Der Tod von Embryonen in den ersten 24 Stunden nach der Infektion ist meist auf die Vermehrung von Pilzen, die mit dem Inokulum in den Embryo eingeführte bakterielle Mikroflora oder eine Verletzung während der Infektion zurückzuführen. Dieser Tod gilt als unspezifisch. In mehr späte Termine Embryonen sterben in der Regel durch Virusvermehrung in Embryonen. Sobald tote Embryonen entdeckt werden, werden diese sofort in einen Kühlschrank mit einer Temperatur von 4 °C überführt. Solche Bedingungen tragen einerseits zur Erhaltung der Aktivität des im Embryo angesammelten Virus bei, andererseits zur Verdichtung des Gewebes und zur Leere der Blutgefäße, was die spätere Dissektion erheblich erleichtert.
Embryonen werden inkubiert, bis eine maximale Virusanreicherung erreicht ist. Dieser Zeitraum ist für jedes Virus und sogar jeden Stamm spezifisch und variiert zwischen 2 und 7-8 Tagen. So sind es für den Newcastle-Krankheitsvirus-Stamm H 2-3 Tage, für den gleichen Virusstamm B - 5 Tage, für das aviäre infektiöse Laryngotracheitis-Virus - 5 Tage usw. Anschließend werden alle Embryonen durch Abkühlen bei 4 °C abgetötet mindestens 3-4 Stunden und geöffnet.
Entkeimte Eier.
Die Methode basiert auf der Entnahme des Embryos aus der Eizelle während der Zeit, in der die Chorioallantoismembran von innen vollständig an ihre Schale angrenzt. Fügt man einem solchen Ei einen Nährboden hinzu, entsteht eine Art Gewebekultur, in der sich das Virus vermehren kann. Die Methode hat eine Reihe von Vorteilen: Sie ermöglicht die Gewinnung eines reineren Virus als im Allantois-Fruchtwasser, was für die Reduzierung der allergenen Eigenschaften von aus diesem Material hergestellten Impfstoffen wichtig ist; Das Fehlen des Dottersacks und damit der darin enthaltenen spezifischen Antikörper ermöglicht es einigen Viren, sich besser zu vermehren. In einigen Fällen liefert diese Methode gute Ergebnisse bei diagnostischen Arbeiten, da große Mengen des Testmaterials eingebracht werden können, was die Möglichkeit einer Virusisolierung erhöht.
Die Methode wurde bereits 1949 von Bernkopf vorgeschlagen, findet jedoch aufgrund von Anwendungsschwierigkeiten keine breite Anwendung. Diese Schwierigkeiten hängen mit der Eigenschaft der Chorioallantoismembran zusammen, sich während der Inkubation von der Hülle zu lösen, was den Wert der Kultur verringert und die Manipulation der Gewinnung des Virus und des Austauschs des Nährmediums erschwert.
E. Groiel (1963) führte eine Reihe von Modifikationen ein, die diese Schwierigkeiten beseitigten. Er schlug vor, 15 Tage alte oder noch ältere Eier zu verwenden, die während der Brutzeit häufig gewendet werden sollten, um eine gleichmäßige Entwicklung der Schale auf der Eierschale zu gewährleisten. Bei Durchleuchtung werden die Grenzen der Luftkammer angezeigt. 0,5 cm oberhalb dieser Linie wird die Schale abgesägt, auf den Rand der Schale wird geschmolzenes Paraffin (56-58 C°) gegossen, das aushärtet und den Rand des Eies fixiert. Dann wird ein rundes Loch in die Membran über dem Embryo geschnitten, sodass ein schmaler Rand um ihn herum verbleibt. Nächste Stufe- vorsichtige Entfernung des Embryos aus der Eizelle. In diesem Fall sollte das Ei horizontal gehalten und langsam gedreht werden. Auf diese Weise werden die Gefäße, die den Embryo mit dem CAO verbinden, gefunden und mit einer Schere durchtrennt. Wird das Ei senkrecht gehalten, dann zieht der Embryo mit seiner Masse die Schale zurück und reißt sie meist im Bereich des scharfen Endes des Eies ab. Bereits das Eindringen einer geringen Flüssigkeitsmenge zwischen den chemischen Substanzen und der Schale führt zu einer vollständigen Ablösung der Schale innerhalb von 1-2 Tagen.
Nach der Entnahme des Embryos wird die das Ei auskleidende Membran mehrmals mit auf 4-0°C gekühlter Kochsalzlösung gewaschen, bis die Flüssigkeit klar wird. Anschließend werden 20 ml eines auf 37 °C erhitzten Nährmediums in die Eierhöhle eingebracht und das Ei mit einer sterilen Gummikappe verschlossen, nachdem es zuvor in Paraffin getaucht wurde. Ein im Ei eingebettetes Röhrchen mit Gummistopfen ermöglicht sowohl die Entnahme als auch die Verabreichung von Flüssigkeit ohne das Risiko einer bakteriellen Kontamination. Ein solches biologisches Objekt bleibt mehrere Tage lang lebensfähig.
Nach der Methode von Yoshino und anderen wird der Hohlraum entkeimter Eier mit einer Lösung von Agar in Hanks-Lösung gefüllt. Entkeimte Eier werden durch ein Röhrchen in der Kappe infiziert.
Kontrollfragen:
1. Die Struktur eines Hühnerembryos.
2. Warum werden Hühnerembryonen in der Virologie verwendet?
3. Wie ist der Aufbau eines sich entwickelnden Hühnerembryos?