Schema unei lectii de chimie (clasa a 11-a) pe tema: Rezumat al unei lectii de chimie "Reprezentanti ai acizilor carboxilici nesaturati. Relatia dintre hidrocarburi, alcooli, aldehide si acizi"
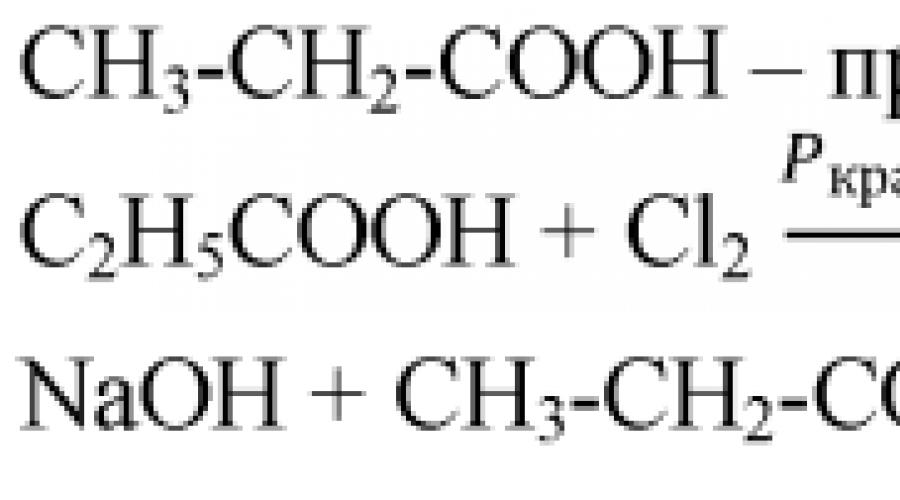
Citeste si
Opțiunea 1
1. Scrieți ecuațiile de reacție care pot fi folosite pentru a efectua următoarele transformări: metan → clormetan → metanol → formaldehidă → acid formic. Precizați condițiile de reacție.
2. Scrieți formula de structură a unei substanțe din compoziția C₃H₆O₂, dacă se știe că soluția sa apoasă își schimbă culoarea portocaliului de metil în roșu, cu clorul această substanță formează compusul C₃H₅ClO₂, iar când sarea sa de sodiu este încălzită cu hidroxid de sodiu. , se formează etan. Denumiți substanța. 
3. Calculați masa substanței (în grame) și cantitatea de substanță (în moli) a fiecărui produs în timpul următoarelor transformări: brometan → etanol → acid etanoic. Brometanul a fost luat cu o masă de 218 g. 
Opțiunea 2
1. Scrieți ecuațiile de reacție care pot fi folosite pentru a efectua următoarele transformări: acetilenă → etilenă → etanol → acetaldehidă → acid acetic. Precizați condițiile de reacție. 
2. Scrieți formula de structură a unei substanțe din compoziția C₄H₈O, dacă se știe că aceasta interacționează cu hidroxidul de cupru (II) și formează acid 2-metilpropanoic la oxidare. Denumiți această substanță. 
3. Calculați masa substanței (în grame) și cantitatea de substanță (în moli) a fiecărui produs în timpul următoarelor transformări: propan → 2-cloropropan → propanol-2. Propanul a fost luat cu o masă de 22 g. 
Opțiunea 3
1. Scrieți ecuațiile de reacție care pot fi folosite pentru a efectua următoarele transformări: metan → acetilenă → acetaldehidă → alcool etilic → acid etanoic. Precizați condițiile de reacție. 
2. Scrieți formula structurală a unei substanțe din compoziția C₅H₁₀O, dacă se știe că adaugă hidrogen în prezența unui catalizator, iar la încălzire cu hidroxid de cupru (II) proaspăt preparat, formează un precipitat roșu. Denumiți această substanță. 
3. Calculați masa substanței (în grame) și cantitatea de substanță (în moli) a fiecărui produs în timpul următoarelor transformări: benzen → clorbenzen → fenol. Benzenul a fost luat cu o masă de 156 g. 
Opțiunea 4
1. Scrieți ecuațiile de reacție care pot fi folosite pentru a efectua următoarele transformări: metan → formaldehidă → metanol → acid formic → acid carbonic. Precizați condițiile de reacție. 
2. Scrieți formula structurală a unei substanțe din compoziția C₂H₆O₂, dacă se știe că aceasta interacționează cu sodiul pentru a elibera hidrogen și formează o substanță albastru strălucitor cu hidroxid de cupru (II). Denumiți această substanță. 
3. Calculați masa substanței (în grame) și cantitatea de substanță (în moli) a fiecărui produs în timpul următoarelor transformări: clormetan → metanol → acid metanoic. S-a luat clormetan cu o masă de 202 g. 
Tema lecției „Relația genetică a hidrocarburilor, alcoolilor, aldehidelor și cetonelor” Scop Dezvoltarea capacității de a elabora formule structurale pentru aceste informații. Pentru a forma deprinderea de a implementa lanțuri de transformări ale substanțelor organice. Îmbunătățirea cunoștințelor privind clasificarea și nomenclatura substanțelor organice.
Programul de activități „Compilarea formulei structurale a unei substanțe din aceste informații” 1) Traduceți aceasta informatieîn limbajul diagramelor. 2) Să presupunem clasa de conexiune. 3) Setați clasa compusului și formula sa structurală. 4) Scrieți ecuațiile reacțiilor în curs.


Programul de activităţi: „Implementarea lanţurilor de transformări” 1). Enumerați reacțiile chimice. 2).Determină și semnează clasa fiecărei substanțe din lanțul de transformări. 3) Analizați lanțul: A) Deasupra săgeții scrieți formulele reactivilor și condițiile de reacție; B) Sub săgeată, scrieți formulele pentru produse suplimentare cu semnul minus. 4).Scrieți ecuațiile reacției: A) Aranjați coeficienții; b) Numiți produșii reacției.



Clasificare compusi organici prin structura lanțului de carbon 1. În funcție de natura scheletului de carbon se disting compuși aciclici (liniari și ramificati și ciclici).Compuși aciclici (alifatici, neciclici) - compuși care au UC deschis liniar sau ramificat. numiți adesea normali.Compuși ciclici – compuși care conțin molecule închise în ciclul UC


Clasificarea atomilor de carbon individuali În scheletele de carbon în sine, se obișnuiește să se clasifice atomii de carbon individuali în funcție de numărul de atomi de carbon legați chimic. Dacă un anumit atom de carbon este legat de un atom de carbon, atunci se numește primar, cu doi - secundar, trei - terțiar și patru - cuaternar. În scheletele de carbon în sine, este obișnuit să se clasifice atomii de carbon individuali după numărul de atomi de carbon legați chimic. Dacă un anumit atom de carbon este legat de un atom de carbon, atunci se numește primar, cu doi - secundar, trei - terțiar și patru - cuaternar. Cum se numește atomul de carbon reprezentat: Cum se numește atomul de carbon reprezentat: a) în interiorul cercului _________________; b) în interiorul pătratului __________________; c) în interiorul inimii __________________; d) în interiorul triunghiului _________________;

Lecția: Nomenclatura și izomeria alcoolilor. Proprietățile chimice ale alcoolilor. Relația genetică dintre alcooli și hidrocarburi.
Scopul lecției. Pentru a aprofunda cunoștințele studenților despre nomenclatura sistematică și izomerie. Arătați generalitatea proprietăților alcoolilor monohidroxilici saturați, datorită unei structuri similare. Dezvoltați conceptul de influență reciprocă a atomilor dintr-o moleculă, relația genetică dintre compușii organici, folosind exemplul conversiei hidrocarburilor saturate în alcooli (prin reacții de substituție, schimb, adiție).
Echipament: Pe masa demonstrativă: mostre de alcooli monohidroxilici saturați (metil, etil (abs.), butilic (amil), sodiu metalic, clorură de sodiu (calcinat), acid sulfuric (conc.), 3 pahare,
Lecția începe cu întrebări referitoare la materialul acoperit:
1) Care sunt motivele diferențelor de proprietăți fizice ale omologilor din seria alcoolilor monohidroxilici saturați?
2) Ce este o legătură de hidrogen și cum afectează ea proprietățile alcoolilor?
Studiem material nou prin metoda muncă independentă elevi. Deoarece cunosc nomenclatura și izomeria hidrocarburilor și a derivaților lor halogenați, această secțiune este asimilată în timpul exercițiului (la tablă și în caiete). Elevii citesc mai întâi manualul și apoi fac următoarele sarcini:
1) Scrieți formulele structurale ale alcoolilor: a) 2,2-metiletilbutanol-1, b) 3,3-dimetilpentanol-2. Care sunt aceste substanțe în relație între ele?
2) Scrieți formulele structurale ale tuturor alcoolilor izomeri corespunzătoare formulei C 5 H 11 OH.
3) Faceți formule de eteri izomeri pentru alcoolii propilici.
Conversație cu clasa despre compoziția alcoolilor, despre prezența în ei a unei grupe funcționale care le determină proprietățile chimice. Folosind exemplul alcoolului etilic, se numesc mai multe reacții care au loc cu participarea hidrogenului grupării hidroxo, întreaga grupă hidroxo.
Știind că proprietățile omologilor trebuie să fie similare, elevii de-; scoateți o concluzie despre proprietățile chimice generale ale alcoolilor din această serie. Pentru a confirma concluzia, demonstrăm experimente privind producerea de clormetan din alcool metilic; interacțiunea alcoolului propilic cu sodiul.
Pentru a testa cunoștințele elevilor cu privire la influența reciprocă a atomilor dintr-o moleculă, le punem o întrebare: cum ar trebui să afecteze radicalul de hidrocarbură al alcoolului viteza reacției de substituție? Sugerăm că, odată cu creșterea radicalului de hidrocarbură, viteza de reacție a alcoolului cu sodiul ar trebui să scadă. Confirmăm ipoteza prin demonstrarea experimentului: turnăm 10 ml de alcool etilic (abs.), butilic și amil în 3 pahare chimice și coborâm bucățile de sodiu purificate de aceeași dimensiune (acoperim paharele cu pâlnii). ), Elevii compară ratele de eliberare a bulelor de hidrogen în fiecare caz.
Notăm selectiv mai multe ecuații ale reacțiilor care au loc în timpul experimentelor.
2C2H5OH + 2 Na \u003d 2 C 2 H 5 ONa + H 2
2C4H9OH + 2 N / A= 2 C 4 H 9 Pe o+ H 2
Pentru a dezvolta conceptul de influență reciprocă, luăm în considerare capacitatea de a disocia 2-cloretanol.
Alte proprietăți generale sunt fixate teoretic în procesul de finalizare a sarcinii: prin ce reacții poate fi convertit propanol-1 în propanol-2? Scrieți ecuațiile de reacție corespunzătoare, explicați mecanismul uneia dintre ele. Pentru a finaliza sarcina, elevii folosesc cunoștințele despre deshidratarea intramoleculară a alcoolilor:
1)CH3-CH2-CH2OH (H2SO4 la t(-H2O))=CH3-CH=CH2
CH3-CH=CH2+HCI=CH3-CHCI-CH3
CH3-CHCI-CH3+KOH=CH3-CHOH-CH3+ KCI
În continuare, invităm studenții să analizeze reacția de hidratare a propilenei pentru a consolida cunoștințele despre regula Markovnikov și mecanismul ionic. Ei ar trebui să explice că sub influența radicalului metil, densitatea norului de electroni al legăturii π se deplasează la atomul de carbon opus.
Aici subliniem că prin reacția de hidratare, hidrocarburile nesaturate sunt direct asociate cu alcoolii și trecem la ultima întrebare a lecției - despre relația genetică dintre alcooli și hidrocarburi. Oferim studenților sarcina de a scrie ecuațiile de reacție cu care puteți obține alcool metilic din metan. Ei lucrează mai întâi conform manualului, apoi completează temele. , formulăm concluzia despre existența unei relații genetice între hidrocarburi (saturate și nesaturate), derivați halogenați ai hidrocarburilor și alcooli.
EXPERIMENTE DE LABORATOR PE TEMA: "LEGATURA GENETICA INTRE HIDROCARBURI, ALCOOLI, ALDEHIDE SI ACIZI"
Limitați hidrocarburile
Dintre hidrocarburile saturate, metanul este studiat în detaliu în școală ca substanță care este cea mai simplă ca compoziție și structură, cea mai accesibilă cunoștințelor practice și de mare importanță economică națională ca materie primă chimică și combustibil.
Experimentele cu prima substanță studiată în chimia organică trebuie efectuate în cantitate suficientă și cu o atenție deosebită din punct de vedere metodologic, deoarece trebuie să arate noi aspecte ale experimentului în studiul chimiei organice. Aici, empiric, se va putea stabili compoziția și formulă moleculară substanțe, care este primul pas în determinarea formulelor structurale ale compușilor organici.
METAN.
Ordinea experimentelor cu metanul poate fi diferită. Practic, se va stabili dacă profesorul începe subiectul cu obținerea metanului și apoi pune la punct experimente pentru a studia proprietățile acestuia folosind substanța obținută în lecție, sau folosește metanul pregătit în prealabil pentru a urmări clar succesiunea întrebărilor de studiu - mai întâi luați în considerare proprietăți fizice substanțe, apoi proprietățile chimice, aplicarea substanței și, în final, producerea acesteia. În acest din urmă caz, experiența de obținere a metanului va fi prezentată doar la finalul subiectului.
Prima modalitate de a studia tema și, în consecință, de a construi un experiment este mai complicată metodologic, dar mai economică în timp. A doua metodă va necesita mai mult timp, dar este metodologic mai simplă și, în plus, valoroasă prin faptul că va permite în concluzie repetarea și consolidarea cunoștințelor experimentelor de bază cu substanța atunci când aceasta este primită în lecție.
Când se studiază metanul, nu este nevoie în mod special de experimente de laborator. În esență, ele ar putea fi reduse aici doar la obținerea de metan și arderea acestuia. Dar obținerea metanului din acetat de sodiu și arderea acestuia poate fi afișată cu ușurință pe un tabel demonstrativ.
Ar fi mai oportun după studierea întregii teme „Hidrocarburi” să livrezi o lecție practică specială. În această lecție, elevii vor replica experiența de a produce metan și vor putea verifica că metanul nu decolorează apa cu brom și soluția de permanganat de potasiu.
Obținerea metanului în laborator. Cea mai convenabilă metodă de laborator pentru producerea metanului este interacțiunea acetatului de sodiu cu varul sodic.
Interacțiunea cu sare acizi carboxilici cu alcali este într-un mod general obtinerea de hidrocarburi. Reacția în vedere generala este reprezentată de ecuația:
dacă R = CH3, atunci se formează metan.
Deoarece soda caustică este o substanță higroscopică, iar prezența umidității interferează cu finalizarea cu succes a reacției, se adaugă oxid de calciu. Un amestec de sodă caustică cu oxid de calciu se numește var sodic.
Este necesară o încălzire destul de puternică pentru ca reacția să se desfășoare cu succes, cu toate acestea, supraîncălzirea excesivă a amestecului duce la procese secundare și la producerea de produse nedorite, cum ar fi acetona:
Acetatul de sodiu trebuie deshidratat înainte de testare. De asemenea, calcarul trebuie calcinat înainte de prepararea amestecului. Dacă nu există soda de var gata preparată, se prepară în felul următor. Într-o ceașcă de fier sau de porțelan, se toarnă var zdrobit bine calcinat CaO cu jumătate din cantitatea unei soluții apoase saturate de NaOH alcalin. Amestecul este evaporat până la uscare, calcinat și zdrobit. Substanțele sunt depozitate într-un desicator.
Pentru a demonstra producția de metan, cel mai bine este să folosiți un balon mic cu un tub de evacuare și pentru sesiune practica- eprubetă (Fig. 1 și 2).
Asamblați dispozitivul așa cum se arată în fig. 1 sau 2. O soluție alcalină este turnată într-o sticlă de spălare pentru a capta impuritățile (Fig. I). Un amestec de acetat de sodiu și var sodic este plasat într-un balon de reacție sau într-o eprubetă. Pentru a face acest lucru, substanțele fin divizate sunt bine amestecate într-un raport de volum de 1:3, adică. cu un exces considerabil de var pentru a face ca acetatul de sodiu să reacţioneze cât mai complet posibil.

Orez.

Balonul este încălzit cu un arzător printr-o plasă de azbest, iar eprubeta pe flacără deschisă. Metanul este colectat într-o eprubetă conform metodei de deplasare a apei. Pentru a verifica puritatea gazului rezultat, eprubeta este scoasă din apă și gazul este aprins fără să se răstoarne.
Deoarece nu este recomandabil să se întrerupă procesul de obținere a metanului și este imposibil să se termine toate celelalte experimente în timp ce reacția este în desfășurare, se recomandă colectarea gazului pentru experimentele ulterioare în mai multe cilindri (eprubete) sau într-un gazometru.
Cilindrii umpluti se lasa putin in baie sau se inchid sub apa cu o placa de sticla (pluta) si se aseaza cu capul in jos pe masa.
Metanul este mai ușor decât aerul. Pentru a se familiariza cu proprietățile fizice ale metanului, profesorul demonstrează un cilindru cu gazul colectat. Elevii observă că metanul este un gaz incolor. Colectarea metanului prin metoda deplasării apei sugerează că acest gaz este aparent insolubil în apă. Profesorul confirmă această concluzie.
Pe cântare sunt echilibrate două baloane identice de cea mai mare capacitate posibilă. Unul dintre baloane este suspendat cu capul în jos (Fig. 3). Metanul din dispozitiv este trecut în acest balon pentru ceva timp. Cântarul urcă. Pentru a împiedica elevii să creadă că modificarea greutății se datorează presiunii jetului de gaz pe fundul balonului, ei acordă atenție faptului că dezechilibrul rămâne chiar și după oprirea trecerii metanului.
După ce cântarul este adus din nou în echilibru (pentru aceasta, sticla cu metan este răsturnată pentru o vreme), pentru comparație și concluzii mai convingătoare, metanul este trecut în balonul care stă în mod normal pe solzi. Echilibrul balanței nu este perturbat.

După ce a arătat că metanul este mai ușor decât aerul, profesorul raportează cât cântărește conditii normale litru de metan. Aceste informații vor fi necesare mai târziu în derivarea formulei moleculare a substanței.
Arderea metanului. În urma unei analize a proprietăților fizice ale metanului, se poate pune întrebarea care este formula moleculară a metanului. Profesorul informează că, pentru a clarifica această problemă, va fi necesar să se familiarizeze mai întâi cu una dintre proprietățile chimice ale metanului - arderea.
Arderea metanului poate fi prezentată în două moduri.
1. cilindru de sticla(capacitate, de exemplu, 250 ml), umplut cu metan, puneți pe masă, scoateți farfuria de pe ea sau deschideți dopul și dați imediat foc gazului cu o așchie. Pe măsură ce metanul arde, flacăra coboară în cilindru.

Pentru ca flacăra să se mențină tot timpul deasupra cilindrului și să fie clar vizibilă pentru elevi, apa poate fi turnată treptat în cilindru cu metan care arde, deplasând astfel gazul spre exterior (Fig. 4).
2. Metanul se aprinde direct la tubul de iesire al aparatului pentru obtinerea gazului sau gazometrului (in ambele cazuri este obligatorie verificarea puritatii!). Mărimea flăcării este controlată de intensitatea încălzirii în primul caz și de înălțimea coloanei de lichid deplasat în al doilea caz. Dacă metanul este purificat de impurități, arde cu o flacără aproape incoloră. Pentru a elimina o parte din luminozitatea flăcării (culoarea galbenă) datorită sărurilor de sodiu din sticla tubului, se poate atașa un vârf de metal la capătul tubului.
ALDEHIDE ȘI CETONE
Când studiază aldehidele, studenții din experimente se familiarizează cu natura treptată a oxidării substanțelor organice, cu chimia importantelor Procese de producție iar cu principiul obţinerii răşinilor sintetice.
Pentru ca elevii să înțeleagă locul aldehidelor în seria produșilor de oxidare a hidrocarburilor, atunci când alcătuiesc ecuații chimice, nu trebuie să evitați folosirea denumirilor și formulelor acizilor în care sunt transformate aldehidele. Formulele acizilor pot fi date dogmatic în prealabil; în viitor, elevii vor primi o justificare experimentală pentru ei.
În studiul aldehidelor, majoritatea experimentelor sunt efectuate cu formaldehida ca substanță cea mai accesibilă școlii și de mare importanță industrială. În conformitate cu aceasta, formaldehidei i se acordă locul principal în acest capitol. Pentru acetaldehidă, sunt luate în considerare numai reacțiile de producție. Cetonele nu sunt predate în mod specific la școală; prin urmare, dintre aceștia, doar un reprezentant este luat aici - acetona, iar experimentele cu aceasta sunt date în principal pentru activitati extracuriculare elevi.
FORMALDEHIDA (METANALA)
Este recomandabil să construiți un plan pentru studierea acestei substanțe, astfel încât, imediat după ce s-au familiarizat cu proprietățile fizice ale aldehidelor, elevii să învețe cum să o obțină, apoi proprietățile chimice etc. O cunoaștere puțin mai devreme a metodelor de obținere a aldehidei va face posibilă în continuare, la studierea proprietăților chimice (reacții de oxidare), să se considere aldehidele ca o verigă în lanțul de oxidare a hidrocarburilor.
Formalina poate fi folosită ca probă atunci când se familiarizează cu proprietățile formaldehidei. Acest lucru ar trebui să se asigure imediat că elevii înțeleg clar diferența dintre formol și formaldehidă.
Miros de formaldehidă. Dintre proprietățile fizice ale formaldehidei, familiarizarea cu mirosul este cea mai accesibilă în practică. În acest scop, pe mesele elevilor se distribuie eprubete cu 0,5-1 ml de formol. Odată ce elevii sunt familiarizați cu mirosul, formol poate fi colectat și utilizat pentru experimente ulterioare. Familiarizarea cu mirosul de formol va permite elevilor să detecteze această substanță în alte experimente.
Inflamabilitatea formaldehidei. Formalina se încălzește într-o eprubetă și se aprind vaporii eliberați; ard cu o flacără aproape incoloră. Flacăra poate fi văzută dacă dai foc la o așchie sau la o bucată de hârtie din ea. Experimentul se desfășoară într-o hotă.
Obținerea formaldehidei. Deoarece, înainte de a face cunoștință cu proprietățile chimice, formaldehida poate fi detectată numai prin miros, prima experiență de obținere a acesteia ar trebui făcută sub formă de muncă de laborator.
1. Turnați câteva picături de metanol într-o eprubetă. În flacăra unui arzător, o mică bucată de plasă de cupru rulată într-un tub sau o spirală de sârmă de cupru este încălzită și coborâtă rapid în metanol.
Când este calcinat, cuprul se oxidează și devine acoperit cu un strat negru de oxid de cupru, în alcool este restabilit și devine roșu:

Se detectează un miros puternic de aldehidă. Dacă procesul de oxidare se repetă de 2-3 ori, atunci se poate obține o concentrație semnificativă de formaldehidă și soluția poate fi folosită pentru experimentele ulterioare.
2. Pe lângă oxidul de cupru, pentru a obține formaldehidă pot fi folosiți și alți agenți oxidanți familiari studenților.
La o soluție slabă de permanganat de potasiu într-un tub demonstrativ, adăugați 0,5 ml de metanol și amestecul este încălzit până la fierbere. Apare mirosul de formaldehidă, iar culoarea violetă a permanganatului dispare.
Într-o eprubetă se toarnă 2-3 ml dintr-o soluție saturată de dicromat de potasiu K 2 Cr 2 O 7 și același volum de acid sulfuric concentrat. Adăugați metanol în picături și încălziți amestecul cu mare atenție (îndreptați deschiderea tubului în lateral!). În plus, reacția continuă cu eliberarea de căldură. Culoarea galbenă a amestecului de crom dispare și apare culoarea verde a sulfatului de crom.

Ecuația de reacție cu elevii nu poate fi dezasamblată. Ca și în cazul precedent, aceștia sunt informați doar că bicromatul de potasiu oxidează alcoolul metilic la aldehidă, transformându-se în același timp într-o sare de crom trivalent Cr2(SO4)3.
Interacțiunea formaldehidei cu oxidul de argint(reacția unei oglinzi argintii). Această experiență ar trebui să fie demonstrată studenților în așa fel încât să servească simultan ca instrucție pentru sesiunea practică ulterioară.
Obținerea rășinilor fenol-formaldehidice. Cea mai mare parte a formaldehidei obținute în industrie este utilizată pentru sinteza fenol-formaldehidei și a altor rășini necesare producerii materialelor plastice. Producția de rășini fenol-formaldehidă se bazează pe reacția de policondensare.
Cea mai accesibilă în condiții școlare este sinteza rășinii fenol-formaldehidice. Până în acest moment, studenții sunt deja familiarizați cu ambele materii prime pentru producerea rășinii - fenol și formaldehidă; experiența este relativ necomplicată și decurge fără probleme; Chimia procesului nu este deosebit de dificilă pentru studenți dacă este descrisă după cum urmează:

În funcție de raportul cantitativ dintre fenol și formaldehidă, precum și de catalizatorul utilizat (acid sau alcalin), se poate obține rășină novolac sau rezol. Primul este termoplastic și are structura liniara de mai sus. Al doilea este termorigid, deoarece moleculele sale liniare conțin grupe alcoolice libere - CH 2 OH, capabile să reacționeze cu atomii mobili de hidrogen ai altor molecule, rezultând o structură tridimensională.
ACETEC ALDEHIDA (ETANAL)
După o cunoaștere detaliată a proprietăților formaldehidei în această secțiune a subiectului cea mai mare valoare dobândiți experimente legate de producerea de acetaldehidă. Aceste experimente pot fi concepute pentru: a) să arate că toate aldehidele pot fi obținute prin oxidarea alcoolilor monohidroxilici corespunzători, b) să arate modul în care structura aldehidelor poate fi fundamentată experimental, c) să introducă chimia metodei industriale de obținere a acetaldehidei conform la Kuchsrov.
Prepararea acetaldehidei prin oxidarea etanolului. Oxidul de cupru (II) poate fi luat ca agent de oxidare pentru alcool. Reacția se desfășoară în mod similar cu oxidarea metanolului:
- 1. Nu se toarnă mai mult de 0,5 ml de alcool etilic într-o eprubetă și se scufundă un fir de cupru încins. Se detectează mirosul de acetaldehidă, care amintește de fructe, și se observă reducerea cuprului. Dacă alcoolul este oxidat de 2-3 ori, de fiecare dată încălzind cuprul până la formarea oxidului de cupru, atunci, după colectarea soluțiilor obținute de studenți în eprubete, va fi posibilă utilizarea aldehidei pentru experimente cu aceasta.
- 2. 5 g de dicromat de potasiu mărunțit K2Cr2O7 se pun într-un balon mic cu tub de scurgere, se toarnă 20 ml acid sulfuric diluat (1:5) și apoi se toarnă 4 ml alcool etilic. Un frigider este atașat de balon și încălzit la o flacără mică printr-o plasă de azbest. Recipientul pentru distilat este plasat în apă cu gheață sau zăpadă. Se toarnă puțină apă în recipient și capătul frigiderului este coborât în apă. Acest lucru se face pentru a reduce volatilizarea vaporilor de acetaldehidă (bp 21 °C). Împreună cu etanolul, o anumită cantitate de apă este distilată în recipient, alcoolul nereacționat format acid aceticși alți subproduși ai reacției. Cu toate acestea, nu este necesară izolarea acetaldehidei pure, deoarece produsul rezultat oferă o performanță bună în reacțiile obișnuite ale aldehidelor. Prezența aldehidei este determinată de miros și de reacția unei oglinzi de argint.
Se atrage atenția elevilor asupra schimbării culorii în balon. Culoarea verde a sulfatului de crom (III) Cr2 (SO4)3 rezultat devine deosebit de distinctă dacă conținutul balonului este diluat cu apă după experiment. Se observă că schimbarea culorii bicromatului de potasiu a avut loc datorită oxidării alcoolului de către acesta.
Obținerea acetaldehidei prin hidratarea acetilenei. Descoperirea remarcabilă a chimistului rus M.G. Kucherov - adăugarea de apă la acetilenă în prezența sărurilor de mercur a stat la baza unei metode industriale larg răspândite de producere a acetaldehidei.
În ciuda mare importanțăși accesibilitatea pentru școală, această metodă este rar demonstrată la orele de chimie.
În industrie, procesul se realizează prin trecerea acetilenei în apă care conține săruri divalente de mercur și acid sulfuric, la o temperatură de 70°C. Acetaldehida formată în aceste condiții este distilată și condensată, după care intră în turnuri speciale pentru oxidare în acid acetic. Acetilena se obține din carbură de calciu în mod obișnuit și se purifică din impurități.
Nevoia de purificare a acetilenei și menținerea temperaturii în vasul de reacție, pe de o parte, și incertitudinea în obținerea produsul dorit Pe de altă parte, de obicei reduc interesul pentru această experiență. Între timp, experimentul poate fi realizat destul de simplu și de încredere atât într-o formă simplificată, cât și în condiții apropiate de cele industriale.
1. Un experiment care, într-o anumită măsură, reflectă condițiile de desfășurare a reacției în producție și face posibilă obținerea unei soluții suficient de concentrate de aldehidă, poate fi realizat în dispozitivul prezentat în fig. 29.

Prima etapă este producția de acetilenă. Bucăți de carbură de calciu sunt introduse în balon și se adaugă încet apă sau o soluție saturată de sare comună din pâlnia de picurare. Viteza de fixare este reglată astfel încât să se stabilească un flux constant de acetilenă, aproximativ o bulă la 1-2 s. Purificarea acetilenei se efectuează într-o spălătorie cu o soluție de sulfat de cupru:
CuS04 + H2SH2SO4
După purificare, gazul este trecut într-un balon cu o soluție de catalizator (15–20 ml apă, 6–7 ml acid sulfuric concentrat și aproximativ 0,5 g oxid de mercur (II). Balonul, în care este hidratată acetilena, se încălzește cu un arzător (alcool), iar acetaldehida rezultată în formă gazoasă intră în eprubete cu apă, unde este absorbită.
După 5--7 minute într-o eprubetă, este posibil să se obțină o soluție de etanal de o concentrație semnificativă. Pentru a finaliza experimentul, mai întâi opriți alimentarea cu apă la carbura de calciu, apoi deconectați dispozitivul și, fără nicio distilare suplimentară a aldehidei din balonul de reacție, utilizați soluțiile rezultate în eprubete pentru experimentele corespunzătoare.
2. În forma cea mai simplificată, reacția lui M. G. Kucherov poate fi efectuată după cum urmează.
Într-un balon mic cu fund rotund, 30 ml apă și 15 ml conc. acid sulfuric. Amestecul se răcește și se adaugă puțin (pe vârful unei spatule) oxid de mercur (II). Amestecul este încălzit cu grijă printr-o plasă de azbest până la fierbere, în timp ce oxidul de mercur este transformat în sulfat de mercur (II).
Tazhibaeva Asemgul Isintaevna
Profesor la liceul Kamennobrodskaya
Lecție de chimie în clasa a 11-a
Tema lecției: Relația genetică dintre hidrocarburi, alcooli, aldehide, alcooli, acizi carboxilici.
Tip de lecție: lectia generalizarea cunostintelor.
Obiectivele lecției: consolidarea, generalizarea și sistematizarea cunoștințelor privind compușii organici care conțin oxigen, inclusiv pe baza relației genetice dintre clasele acestor substanțe. Pentru a consolida capacitatea de a prezice proprietățile chimice ale substanțelor organice necunoscute, pe baza cunoașterii grupurilor funcționale. Pentru a dezvolta la elevi vorbirea bazată pe dovezi, capacitatea de a folosi terminologia chimică, de a conduce, observa și descrie un experiment chimic. Ridicați nevoia de cunoaștere despre acele substanțe cu care venim în contact în viață.
Metode: verbal, vizual, practic, căutarea problemelor, controlul cunoștințelor.
Reactivi: acid acetilsalicilic (aspirina), apă, clorură de fier (III), soluție de glucoză, indicator universal, soluție de sulfat de cupru (II), soluție de hidroxid de sodiu, albuș de ou, etanol, butanol-1, acid acetic, acid stearic.
Echipament: computer, ecran, proiector, tabel „Clasificarea substanțelor organice care conțin oxigen”, rezumatul de referință „Grupul funcțional determină proprietățile unei substanțe”, mortar și pistil, baghetă de sticlă, lampă cu spirt, suport pentru eprubete, pâlnie, filtru, pahare , suport pentru eprubete, pipetă, cilindru de măsurare pe 10 ml.
I. Moment organizatoric.
Astăzi la clasă:
1) Veți consolida capacitatea de a prezice proprietățile chimice ale substanțelor organice necunoscute, pe baza cunoștințelor grupurilor funcționale.
2) Vei afla ce grupe funcționale știi că fac parte din cel mai faimos antipiretic.
3) Veți găsi grupe funcționale într-o substanță cu gust dulce care este folosită în medicină ca nutrientși o componentă a fluidelor de înlocuire a sângelui.
4) Vei vedea cum poți obține argint pur.
5) Vom vorbi despre impact fiziologic Alcool etilic.
6) Vom discuta despre consecințele consumului de alcool băuturi alcoolice femeile însărcinate.
7) Vei fi plăcut surprins: se dovedește că deja știi atât de multe!
II. Repetarea și generalizarea cunoștințelor dobândite de elevi.
1. Clasificarea compușilor organici care conțin oxigen.
Generalizarea materialului începe cu clasificarea substanțelor organice care conțin oxigen. Pentru a face acest lucru, vom folosi tabelul „Clasificarea compușilor organici care conțin oxigen”. În timpul lucrului frontal, vom repeta grupele funcționale care conțin oxigen.
În chimia organică, există trei grupuri funcționale majore care includ atomi de oxigen:hidroxil, carbonil Șicarboxil. Acesta din urmă poate fi văzut ca o combinație a celor două anterioare. În funcție de atomi sau grupe de atomi cu care sunt asociate aceste grupări funcționale, substanțele care conțin oxigen sunt împărțite în alcooli, fenoli, aldehide, cetone și acizi carboxilici.
Luați în considerare aceste grupuri funcționale și influența lor asupra proprietăților fizice și chimice ale substanțelor.
Vizualizarea unui clip video.
Știți deja că aceasta nu este singura caracteristică de clasificare posibilă. Pot exista mai multe grupuri funcționale identice într-o moleculă și acordați atenție liniei corespunzătoare din tabel.
Rândul următor reflectă clasificarea substanțelor în funcție de tipul de radical asociat grupului funcțional. Aș dori să atrag atenția asupra faptului că, spre deosebire de alcooli, aldehide, cetone și acizi carboxilici, hidroxiarenele se disting într-o clasă separată de compuși - fenoli.
Numărul grupelor funcționale și structura radicalului determină formula moleculară generală a substanțelor. În acest tabel, ele sunt date numai pentru reprezentanții limitatori ai claselor cu un singur grup funcțional.
Toate clasele de compuși care „se potrivesc” în tabel suntmonofuncțional, adică au o singură funcție care conține oxigen.
Pentru a consolida materialul privind clasificarea și nomenclatura substanțelor care conțin oxigen, dau mai multe formule de compuși și cer elevilor să determine „locul lor” în clasificarea de mai sus și să dea un nume.
Nume | Clasa de substante | |
acid propinoic | Acid nesaturat, monobazic |
|
| Butandiol-1,4 | Alcool dihidric limitativ |
| 1,3-dihidroxibenzen | Fenol diatomic |
| 3-metilbutanal | Limitați aldehida |
| Buten-3-pe-2 | Cetonă nesaturată |
| 2-metilbutanol-2 | Limită, alcool monohidric |
Relația dintre structura și proprietățile compușilor care conțin oxigen.
Natura grupului funcțional are un impact semnificativ asupra proprietăților fizice ale substanțelor din această clasă și determină în mare măsură proprietățile sale chimice.
Conceptul de „proprietăți fizice” include starea de agregare substante.
Starea agregată a conexiunilor liniare de diferite clase:
Alcoolii | Aldehide | acizi carboxilici | |
1 | și. | G. | și. |
2 | și. | și. | și. |
3 | și. | și. | și. |
4 | și. | și. | și. |
5 | și. | și. | și. |
Seria omoloagă de aldehide începe cu gazos at temperatura camerei substanțe - formaldehida, iar printre alcoolii monohidroxilici și acizii carboxilici nu există gaze. Cu ce este legat?
Moleculele de alcooli și acizi sunt în plus legate între ele prin legături de hidrogen.
Profesorul le cere elevilor să formuleze definiția „legăturii de hidrogen”(aceasta este o legătură intermoleculară între oxigenul unei molecule și hidrogenul hidroxil al altei molecule) , o corectează și, dacă este necesar, dictează pentru scriere: o legătură chimică între un atom de hidrogen cu deficit de electroni și un atom bogat în electroni al unui element cu electronegativitate mare (F , O , N ) se numeștehidrogen.
Acum comparați punctele de fierbere (°C) ale primilor cinci omologi ai substanțelor din trei clase.
Alcoolii | Aldehide | acizi carboxilici | |
1 | +64,7 | -19 | +101 |
2 | +78,3 | +21 | +118 |
3 | +97,2 | +50 | +141 |
4 | +117,7 | +75 | +163 |
5 | +137,8 | +120 | +186 |
Ce se poate spune după ce se uită la tabele?
Nu există substanțe gazoase în seria omoloagă a alcoolilor și acizilor carboxilici și punctele de fierbere ale substanțelor sunt ridicate. Acest lucru se datorează prezenței legăturilor de hidrogen între molecule. Datorită legăturilor de hidrogen, moleculele sunt asociate (parcă ar fi reticulate), prin urmare, pentru ca moleculele să devină libere și să dobândească volatilitate, este necesar să se cheltuiască energie suplimentară pentru a rupe aceste legături.
Ce se poate spune despre solubilitatea alcoolilor, aldehidelor și acizilor carboxilici în apă? (Demonstrarea solubilității în apă a alcoolilor - etil, propil, butilic și acizi - formic, acetic, propionic, butiric și stearic. Este demonstrată și o soluție de aldehidă formică în apă.)
La răspuns, se folosește o schemă pentru formarea legăturilor de hidrogen între moleculele de acid și apă, alcooli, acizi.


Trebuie remarcat faptul că odată cu creșterea greutății moleculare, solubilitatea alcoolilor și acizilor în apă scade. Cu cât este mai mare radicalul de hidrocarbură dintr-o moleculă de alcool sau acid, cu atât este mai dificil pentru grupa OH să mențină molecula în soluție din cauza formării de legături slabe de hidrogen.
3. Relația genetică între diferitele clase de compuși care conțin oxigen.
Desenez pe tablă formulele unui număr de compuși care conțin fiecare un atom de carbon:
CH 4 → CH 3 OH → HCOH → HCOOH → CO 2
De ce sunt studiate în această ordine în cursul chimiei organice?
Cum se schimbă starea de oxidare a unui atom de carbon?
Elevii dictează o linie: -4, -2, 0, +2, +4
Acum devine clar că fiecare compus ulterior este o formă din ce în ce mai oxidată a celui precedent. Din aceasta, este evident că ar trebui să se deplaseze de-a lungul seriei genetice de la stânga la dreapta cu ajutorul reacțiilor de oxidare și în direcția opusă - cu utilizarea proceselor de reducere.
Cad cetonele din acest „cerc de rude”? Desigur că nu. Precursorii lor sunt alcoolii secundari.
Proprietăți chimice fiecare clasă de substanţe a fost discutată în detaliu în lecţiile corespunzătoare. Pentru a rezuma acest material, mi-am propus ca teme pentru acasă sarcini pentru transformări reciproce într-o formă oarecum neobișnuită.
1. Compus cu formula molecularaC 3 H 8 O supus dehidrogenării, rezultând un produs al compozițieiC 3 H 6 O . Această substanță suferă o reacție „oglindă de argint”, formând un compusC 3 H 6 O 2 . Acțiunea acestei din urmă substanțe cu hidroxid de calciu a dat o substanță folosită ca aditiv alimentar sub codul E 282. Inhibă creșterea mucegaiului în produsele de panificație și cofetărie și, în plus, se găsește în produse precum brânza elvețiană. Determinați formula aditivului E 282, scrieți ecuațiile reacțiilor menționate și denumiți toate substanțele organice.
Soluţie :
CH 3 – CH 2 – CH 2 –OH → CH 3 – CH 2 – COH+H 2 ( pisică. – Cu, 200-300 °C)
CH 3 – CH 2 – COH + Ag 2 O→CH 3 – CH 2 – COOH + 2Ag (forma simplificată a ecuației, soluție de amoniac de oxid de argint)
2CH 3 – CH 2 – COOH+CUa(OH) 2 → (CH 3 – CH 2 – COO) 2 Ca+2H 2 Oh
Răspuns: propionat de calciu.
2. Conexiune compozițieC 4 H 8 Cl 2 cu schelet de carbon neramificat încălzit cu o soluție apoasăNaOH și a primit materie organică, care, atunci când este oxidatăCu(OH) 2 s-a transformat inC 4 H 8 O 2 . Determinați structura compusului original.
Soluţie: dacă 2 atomi de clor sunt pe diferiți atomi de carbon, atunci când sunt tratați cu alcali, am obține un alcool dihidroxilic care nu s-ar oxidaCu(OH) 2 . Dacă 2 atomi de clor ar fi la un atom de carbon în mijlocul lanțului, atunci când sunt tratați cu alcali, s-ar obține o cetonă care nu se oxideazăCu(OH) 2. Atunci conexiunea dorită este1,1-diclorbutan.
CH 3 – CH 2 – CH 2 – CHCl 2 + 2NaOH → CH 3 – CH 2 – CH 2 – COH + 2NaCl + H 2 O
CH 3 – CH 2 – CH 2 – COH + 2Cu(OH) 2 → CH 3 – CH 2 – CH 2 – COOH + Cu 2 O+2H 2 O
3. Când 19,2 g de sare de sodiu a acidului monobazic saturat au fost încălzite cu hidroxid de sodiu, s-au format 21,2 g de carbonat de sodiu. Denumiți acidul.
Soluţie:
Când este încălzită, are loc decarboxilarea:
R-COONa + NaOH → RH + Na 2 CO 3
υ (N / A 2 CO 3 ) = 21,2 / 106 = 0,2 cârtiță
υ (R-COONa) = 0,2cârtiță
M(R-COONa) = 19,2 / 0,2 = 96G/ cârtiță
M(R-COOH) =M(R-COONa) -M(Na) + M(H) = 96-23+1 = 74G/ cârtiță
În conformitate cu formula generală de limitare a acizilor carboxilici monobazici, pentru a determina numărul de atomi de carbon, este necesar să se rezolve ecuația:
12n + 2n + 32= 74
n=3
Răspuns: acid propionic.
Pentru a consolida cunoștințele despre proprietățile chimice ale substanțelor organice care conțin oxigen, să efectuăm un test.
1 opțiune
Alcoolii monohidroxilici limitanți corespund formulelor:
A)
CH
2
O
B)
C
4
H
10
O
ÎN)
C
2
H
6
O
G)
CH
4
O
D)
C
2
H
4
O
2
Este o combinație a două principii,
Unul este în nașterea oglinzilor.
Cu siguranță nu pentru contemplare
Și pentru știința înțelegerii.
... Și în regatul pădurii se întâlnește,
Frații mai mici sunt prietenii ei aici,
Inimile lor sunt pline...
Opțiuni:
a) acid picric
B) acid formic
B) acid acetic
D) grupare carboxil
D) acid benzoic
Etanolul reacţionează cu substanţe:
A)
NaOH
B)
N / A
ÎN)
acid clorhidric
G)
CH
3
COOH
D)
FeCl
3
O reacție calitativă la fenoli este o reacție cu
A)
NaOH
B)
Cu(OH)
2
ÎN)
CuO
G)
FeCl
3
D)
HNO
3
Etanalul reacționează cu substanțele
a) metanol
B) hidrogen
C) soluție de amoniac de oxid de argint
D) hidroxid de cupru (II).
D) acid clorhidric
Opțiunea 2
Se pot obține aldehide
A) oxidarea alchenelor
B) oxidarea alcoolilor
C) hidratarea alchinelor
D) la încălzirea sărurilor de calciu ale acizilor carboxilici
D) hidratarea alchenelor
Grupa funcțională a alcoolilor este
A)
COH
B)
Oh
ÎN)
COOH
G)
NH
2
D)
NU
2
2-metilbutanol-2
A) alcool nesaturat
B) alcool saturat
B) alcool monohidroxilic
D) alcool terțiar
D) aldehidă
Ai văzut reacția
A) alcooli polihidroxilici
B) oxidarea alcoolului
C) interacțiunea fenolului cu clorura de fier (III).
D) „oglindă de argint”
D) „oglindă de cupru”
Acidul acetic reacționează cu substanțele
a) hidrogen
B) clor
B) propanol
D) hidroxid de sodiu
D) metanalem
Elevii își scriu răspunsurile în tabel:
A | b | V | G | d | |
1 | + | + | + | ||
2 | + | ||||
3 | + | + | + | ||
4 | + | ||||
5 | + | + | + |
Dacă legați răspunsurile corecte cu o linie continuă, obțineți numărul „5”.
Munca de grup a elevilor.
Sarcină pentru 1 grup

Obiective:
Reactivi si echipamente: acid acetilsalicilic (aspirina), apă, clorură de fier (III); mortar și pistil, baghetă de sticlă, lampă cu spirt, suport pentru eprubete, pâlnie, filtru, pahare, suport pentru eprubete, pipetă, cilindru dozator de 10 ml.
Experiența 1. Dovada absenței hidroxilului fenolic în acidul acetilsalicilic (aspirina).
Se pun 2-3 boabe de acid acetilsalicilic într-o eprubetă, se adaugă 1 ml apă și se agită puternic. La soluția rezultată se adaugă 1-2 picături de soluție de clorură de fier (III). La ce te uiti? Trageți propriile concluzii.
Colorația violet nu apare. Prin urmare, în acid acetilsalicilicNOOS-S 6 H 4 -O-CO-CH 3 nu există o grupare fenolică liberă, deoarece această substanță este un ester format din acizi acetic și salicilic.
Experiența 2. Hidroliza acidului acetilsalicilic.
Puneți o tabletă zdrobită de acid acetilsalicilic într-o eprubetă și adăugați 10 ml apă. Aduceți conținutul tubului la fierbere și fierbeți timp de 0,5-1 min. Filtrați soluția. Apoi se adaugă 1-2 picături de soluție de clorură de fier(III) la filtratul obținut. La ce te uiti? Trageți propriile concluzii.
Scrieți ecuația reacției:

Finalizați lucrarea completând un tabel în care sunt următoarele coloane: operație efectuată, reactiv, observații, ieșire.
Apare o culoare violetă, indicând eliberarea de acid salicilic care conține o grupare fenolică liberă. Ca ester, acidul acetilsalicilic se hidrolizează ușor când este fiert cu apă.
Sarcina pentru grupa 2
1. Luați în considerare formulele structurale ale substanțelor, denumiți grupele funcționale.

2. Faceți laboratorul„Descoperirea grupurilor funcționale în molecula de glucoză”.
Obiective: să consolideze cunoștințele elevilor despre reacțiile calitative ale compușilor organici, să dezvolte abilitățile de determinare experimentală a grupelor funcționale.
Reactivi si echipamente: soluţie glucoză, indicator universal, soluție de sulfat de cupru (II), soluție de hidroxid de sodiu, lampă cu alcool, suport pentru eprubete, chibrituri, cilindru dozator de 10 ml.
2.1. Se toarnă 2 ml de soluție de glucoză într-o eprubetă. Folosind un indicator universal, deduceți prezența sau absența unei grupări carboxil.
2.2. Obțineți hidroxid de cupru (II): turnați 1 ml de sulfat de cupru (II) într-o eprubetă și adăugați hidroxid de sodiu. Se adaugă 1 ml de glucoză la precipitatul rezultat, se agită. La ce te uiti? Ce grupe funcționale sunt caracterizate de această reacție?
2.3. Se încălzește amestecul obținut în experimentul nr. 2. Marcați modificările. Care grup funcțional este caracterizat de această reacție?
2.4. Finalizați lucrarea completând un tabel în care sunt următoarele coloane: operație efectuată, reactiv, observații, ieșire.
Experiență demonstrativă. Interacțiunea soluției de glucoză cu soluția de amoniac de oxid de argint.
Rezultatele muncii:
- nu există grupare carboxil, deoarece soluția are o reacție neutră la indicator;
- precipitatul de hidroxid de cupru (II) se dizolvă și apare o culoare albastru strălucitor, care este caracteristică alcoolilor polihidroxilici;
- când această soluție este încălzită, precipită un precipitat galben de hidroxid de cupru (I), care devine roșu la încălzirea ulterioară, indicând prezența unei grupări aldehide.
Concluzie. Astfel, molecula de glucoză conține un carbonil și mai multe grupări hidroxil și este un alcool aldehidic.
Sarcina pentru grupa 3
Acțiunea fiziologică a etanolului
1. Care este efectul etanolului asupra organismelor vii?
2. Folosind echipamentul și reactivii de pe masă, demonstrați efectul etanolului asupra organismelor vii. Comentează ceea ce vezi.
Scopul experienței: pentru a convinge elevii că alcoolul denaturează proteinele, le distruge ireversibil structura și proprietățile.
Echipamente și reactivi: suport cu eprubete, pipeta, cilindru gradat 10 ml, albus, etanol, apa.
Experimentează progresul: Turnați 2 ml de albuș de ou în 2 eprubete. Adăugați 8 ml de apă la unul, aceeași cantitate de etanol la celălalt.
În primul tub, proteina se dizolvă și este bine absorbită de organism. În a doua eprubetă se formează un precipitat alb dens - proteinele nu se dizolvă în alcool, alcoolul ia apa din proteine. Ca urmare, structura și proprietățile proteinei, funcțiile sale sunt încălcate.
3. Spuneți-ne despre efectul alcoolului etilic asupra diferitelor organe și sisteme ale organelor umane.
Discutați despre efectele consumului de alcool asupra femeilor însărcinate.
Spectacole elevilor.
Din cele mai vechi timpuri, omul a cunoscut număr mare substante toxice, toate diferă prin puterea impactului asupra corpului. Printre acestea, iese în evidență o substanță, care este cunoscută în medicină ca o otravă protoplasmatică puternică - acesta este alcoolul etilic. Rata mortalității cauzate de alcoolism depășește numărul deceselor cauzate de toți boli infecțioase luat impreuna.
Arzând membrana mucoasă a gurii, faringelui, esofagului, intră tract gastrointestinal. Spre deosebire de multe alte substanțe, alcoolul este absorbit rapid și complet în stomac. Depășit cu ușurință membrane biologice, după aproximativ o oră atinge concentrația maximă în sânge.
Moleculele de alcool pătrund rapid în membranele biologice în sânge în comparație cu moleculele de apă. Moleculele de alcool etilic pot traversa cu ușurință membranele biologice datorită dimensiunii lor mici, polarizării slabe, formării de legături de hidrogen cu moleculele de apă și solubilității bune a alcoolului în grăsimi.
Absorbit rapid în sânge, dizolvându-se bine în lichidul intercelular, alcoolul pătrunde în toate celulele corpului. Oamenii de știință au descoperit că, prin perturbarea funcțiilor celulelor, provoacă moartea acestora: atunci când se beau 100 g de bere, aproximativ 3000 de celule cerebrale mor, 100 g de vin - 500, 100 g de vodcă - 7500, contactul celulelor roșii cu alcoolul. moleculele duce la coagularea celulelor sanguine.
În ficat, substanțele toxice care intră în sânge sunt neutralizate. Medicii numesc acest organ o țintă pentru alcool, deoarece 90% din etanol este neutralizat în el. Apare în ficat procese chimice oxidarea etanolului.
Reamintim împreună cu elevii etapele procesului de oxidare a alcoolului:

Alcoolul etilic se oxidează până la produși de descompunere finală numai dacă consumul zilnic de etanol nu depășește 20 g. Dacă doza este depășită, în organism se acumulează produse intermediare de descompunere.
Acest lucru duce la o serie de laturi efecte negative: creșterea formării de grăsime și acumularea acesteia în celulele hepatice; acumularea de compuși peroxidici capabili să distrugă membranele celulare, în urma căruia conținutul celulelor curge prin porii formați; fenomene foarte nedorite, a căror totalitate duce la distrugerea ficatului - ciroză.
Aldehida acetică este de 30 de ori mai toxică decât alcoolul etilic. În plus, ca urmare a diferitelor reacții biochimice în țesuturi și organe, inclusiv în creier, este posibilă formarea tetrahidropapaverolinei, a cărei structură și proprietăți seamănă cu medicamentele psihotrope bine-cunoscute - morfină și canabinol. Medicii au demonstrat că acetaldehida este cea care provoacă apariția mutațiilor și diferitelor deformări la embrioni.
Acidul acetic îmbunătățește sinteza acizilor grași și duce la degenerarea grasă a ficatului.
Studiind proprietățile fizice ale alcoolilor, am abordat problema modificărilor toxicității acestora în seria omoloagă de alcooli monohidroxilici. Odată cu creșterea greutății moleculare a moleculelor de substanțe, proprietățile lor narcotice cresc. Dacă comparăm alcoolii etilici și pentilici, atunci greutatea moleculară a acestuia din urmă este de 2 ori mai mare, iar toxicitatea - de 20 de ori. Alcoolii care conțin trei până la cinci atomi de carbon formează așa-numitele uleiuri de fusel, a căror prezență în băuturile alcoolice le crește proprietățile toxice.
În această serie, excepția este metanolul - cea mai puternică otravă. Când 1-2 lingurițe din acesta intră în organism, nervul optic este afectat, ceea ce duce la orbire completă, iar utilizarea a 30-100 ml duce la moarte. Pericolul este sporit de asemănarea alcoolului metilic cu Alcool etilic după proprietăți, aspect, miros.
Împreună cu elevii, încercăm să găsim cauza acestui fenomen. Ei au prezentat diverse ipoteze. Ne oprim asupra faptului că factorii care cresc toxicitatea alcoolului metilic includ dimensiunea mică a moleculelor (viteză mare de propagare), precum și faptul că produșii intermediari ai oxidării sale - aldehida formică și acidul formic - sunt otrăvuri puternice. .
Alcoolul care nu este neutralizat de ficat și produsele toxice ale degradarii sale intră din nou în fluxul sanguin și sunt transportate în tot organismul, rămânând în el pentru o lungă perioadă de timp. De exemplu, în creier, alcoolul se găsește neschimbat după 20 de zile de la administrare.
Atragem atenția elevilor asupra modului în care alcoolul și produsele sale de degradare sunt excretate din organism.
10% nemodificat prin plămâni, rinichi și piele | ||
90% în natură CO 2 Și H 2 DESPRE prin plămâni și rinichi |
Din păcate, în ultimii ani, consumul de alcool, precum fumatul, este frecvent în rândul femeilor. Influența alcoolului asupra descendenților merge în două direcții.
În primul rând, consumul de alcool este însoțit de schimbări profunde în sfera sexuală atât a bărbaților, cât și a femeilor. Alcoolul și produsele sale de descompunere pot afecta atât celulele germinale feminine, cât și cele masculine chiar înainte de fertilizare - informațiile lor genetice se modifică (vezi Fig. „Spermatozoizi sănătoși (1) și patologici (2)”).

Dacă consumul de alcool este prelungit, activitatea sistemului reproducător este perturbată, acesta începe să producă celule germinale defecte.
În al doilea rând, alcoolul afectează direct fătul. Utilizarea constantă a 75-80 g de vodcă, coniac sau 120-150 g de băuturi alcoolice mai slabe (bere) poate provoca sindromul alcoolic fetal. Prin placentă, în apele din jurul fătului intră nu numai alcoolul, ci și produșii săi de descompunere, în special acetaldehida, care este de zece ori mai periculoasă decât alcoolul în sine.
Intoxicația cu alcool are un efect dăunător asupra fătului, deoarece ficatul acestuia, în care intră în primul rând sângele din placentă, nu are încă o enzimă specială care să descompună alcoolul, iar acesta, neneutralizat, se răspândește în tot organismul și provoacă modificări ireversibile. Alcoolul este deosebit de periculos în săptămâna 7-11 de sarcină, când organele interne încep să se dezvolte. Afectează negativ dezvoltarea lor, provocând tulburări și schimbări. Creierul este afectat în special. Din cauza influenței alcoolului, demența, epilepsia, nevrozele, tulburările cardiace și renale se pot dezvolta, organele genitale externe și interne sunt afectate.
Uneori se observă deja afectarea psihicului și intelectului copilărie timpurie, dar cel mai adesea sunt detectate atunci când copiii încep să învețe. Un astfel de copil este slăbit intelectual, agresiv. Alcoolul afectează corpul copilului mult mai puternic decât corpul unui adult. Deosebit de sensibil și vulnerabil sistem nervosși creierul copilului.
Deci, să ne uităm la tabelul „Influența alcoolului asupra eredității și sănătății copiilor” și să tragem concluzii .
În familiile părinților băutori | În familiile părinților nebautori | |
A murit în primele luni de viață | 44% | 8% |
Sa dovedit a fi defect, bolnav | 39% | 10% |
Sanatoasa din punct de vedere fizic si psihic | 17% | 82% |
Utilizarea prelungită a băuturilor alcoolice duce la înmuierea stratului cortical. Se observă numeroase hemoragii petechiale; întreruperea transmiterii excitaţiei de la unul celula nervoasa altcuiva. Nu uitați cuvintele laconice de avertizare ale lui V. V. Mayakovsky:
Nu beți băuturi alcoolice.
Băutorii - otravă, alții - tortură.
Astfel, ați consolidat capacitatea de a prezice proprietățile chimice ale substanțelor organice necunoscute, pe baza cunoașterii grupurilor funcționale, ați repetat proprietățile fizice și chimice ale substanțelor organice care conțin oxigen, ați consolidat capacitatea de a determina apartenența compușilor organici la clase de substante.
III. Teme pentru acasă.
1. Efectuați transformări:

2. Explorează motive posibile poluare mediu inconjurator aproape de producție: metanol, fenol, formaldehidă, acid acetic. Analizați impactul acestor substanțe asupra obiectelor naturale: atmosferă, sursele de apă, sol, plante, animale și oameni. Descrieți măsurile de prim ajutor pentru otrăvire




