Proprietățile chimice de bază ale proteinelor. Funcțiile proteinelor în organism
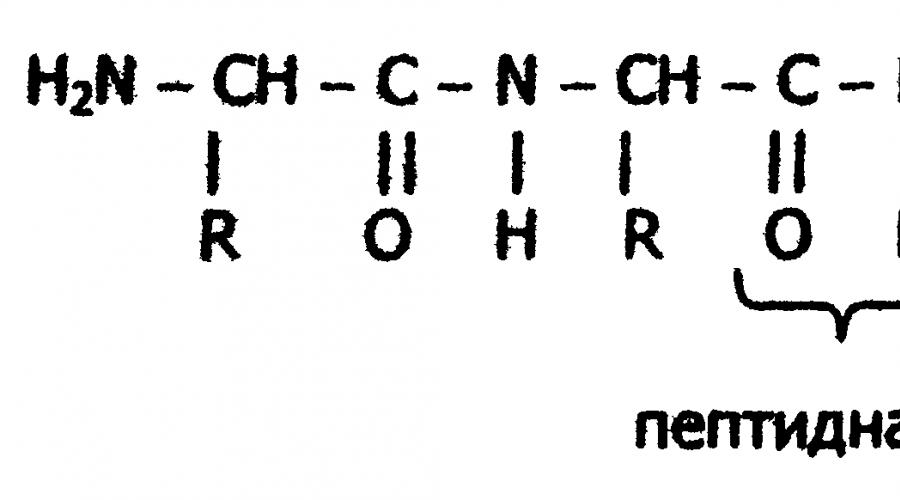
Citeste si
Numarul 1. Proteine: legătură peptidică, detectarea lor.
Proteinele sunt macromolecule de poliamide liniare formate din a-aminoacizi ca rezultat al unei reacții de policondensare în obiectele biologice.
Veverițe sunt compuși macromoleculari construiți din aminoacizi. 20 de aminoacizi sunt implicați în producerea proteinelor. Ele se leagă împreună în lanțuri lungi care formează coloana vertebrală a unei molecule de proteină cu greutate moleculară mare.
Funcțiile proteinelor în organism
Combinația de proprietăți chimice și fizice deosebite ale proteinelor oferă acestei clase particulare de compuși organici un rol central în fenomenele vieții.
Proteinele au următoarele proprietăți biologice sau îndeplinesc următoarele funcții principale în organismele vii:
1. Funcția catalitică a proteinelor. Toți catalizatorii biologici - enzimele sunt proteine. Până în prezent, au fost caracterizate mii de enzime, multe dintre ele izolate sub formă cristalină. Aproape toate enzimele sunt catalizatori puternici, crescând viteza reacțiilor de cel puțin un milion de ori. Această funcție a proteinelor este unică, nu este caracteristică altor molecule polimerice.
2. Nutrițional (funcția de rezervă a proteinelor). Acestea sunt, în primul rând, proteine destinate nutriției embrionului în curs de dezvoltare: cazeina din lapte, ovalbumină din ou, proteine de depozitare a semințelor de plante. O serie de alte proteine sunt, fără îndoială, folosite în organism ca sursă de aminoacizi, care, la rândul lor, sunt precursori ai unor substanțe biologic active care reglează procesul metabolic.
3. Funcția de transport a proteinelor. Multe molecule și ioni mici sunt transportați de proteine specifice. De exemplu, funcția respiratorie a sângelui, și anume transportul oxigenului, este realizată de moleculele de hemoglobină, o proteină din globulele roșii. Albuminele serice sunt implicate în transportul lipidelor. O serie de alte proteine din zer formează complexe cu grăsimi, cupru, fier, tiroxină, vitamina A și alți compuși, asigurând livrarea lor către organele corespunzătoare.
4. Funcția protectoare a proteinelor. Funcția principală de protecție este îndeplinită de sistemul imunologic, care asigură sinteza unor proteine de protecție specifice - anticorpi - ca răspuns la intrarea în organism a bacteriilor, toxinelor sau virusurilor (antigenelor). Anticorpii leagă antigenele, interacționând cu aceștia și, prin urmare, neutralizează efectul lor biologic și mențin starea normală a organismului. Coagularea unei proteine din plasma sanguină - fibrinogenul - și formarea unui cheag de sânge care protejează împotriva pierderii de sânge în timpul leziunilor este un alt exemplu al funcției protectoare a proteinelor.
5. Funcția contractilă a proteinelor. Multe proteine sunt implicate în actul de contracție și relaxare musculară. Rolul principal în aceste procese este jucat de actina și miozina - proteine specifice țesutului muscular. Funcția contractilă este, de asemenea, inerentă proteinelor structurilor subcelulare, care asigură cele mai fine procese ale activității vitale celulare,
6. Funcția structurală a proteinelor. Proteinele cu această funcție se situează pe primul loc printre alte proteine din corpul uman. Proteinele structurale precum colagenul sunt distribuite pe scară largă în țesutul conjunctiv; keratina în păr, unghii, piele; elastina - în pereții vasculari etc.
7. Funcția hormonală (reglatoare) a proteinelor. Metabolismul în organism este reglat prin diferite mecanisme. În această reglementare, un loc important îl ocupă hormonii produși de glandele endocrine. O serie de hormoni sunt reprezentați de proteine sau polipeptide, de exemplu, hormoni ai glandei pituitare, pancreasului etc.
Legătură peptidică
Formal, formarea unei macromolecule proteice poate fi reprezentată ca o reacție de policondensare a α-aminoacizilor.
Din punct de vedere chimic, proteinele sunt compuși organici (poliamide) cu un conținut ridicat de azot, ale căror molecule sunt construite din reziduuri de aminoacizi. Monomerii proteici sunt α-aminoacizi, trasatura comuna care este prezența unei grupări carboxil -COOH și a unei grupări amino -NH2 la al doilea atom de carbon (a-atomul de carbon):
Pe baza rezultatelor studierii produselor hidrolizei proteinelor și prezentate de A.Ya. Ideile lui Danilevsky despre rolul legăturilor peptidice -CO-NH- în construcția unei molecule proteice, omul de știință german E. Fischer a propus la începutul secolului al XX-lea teoria peptidică a structurii proteinelor. Conform acestei teorii, proteinele sunt polimeri liniari de α-aminoacizi legați printr-o peptidă legătură - polipeptide:

În fiecare peptidă, un rest de aminoacid terminal are o grupare a-amino liberă (N-terminal) iar celălalt are o grupare a-carboxil liberă (capitul C-terminal). Structura peptidelor este de obicei descrisă pornind de la aminoacidul N-terminal. În acest caz, reziduurile de aminoacizi sunt indicate prin simboluri. De exemplu: Ala-Tyr-Leu-Ser-Tyr- - Cys. Această intrare denotă o peptidă în care se află α-aminoacidul N-terminal lyatsya alanina și C-terminal - cisteină. Când citiți o astfel de înregistrare, terminațiile numelor tuturor acizilor, cu excepția ultimilor, se schimbă în - "il": alanil-tirosil-leucil-seril-tirosil--cisteină. Lungimea lanțului peptidic în peptidele și proteinele găsite în organism variază de la două la sute și mii de reziduuri de aminoacizi.
nr. 2. Clasificarea proteinelor simple.
La simplu (proteinele) includ proteine care, atunci când sunt hidrolizate, dau numai aminoacizi.
Proteinoide ____proteine simple de origine animală, insolubile în apă, soluții sărate, acizi și alcali diluați. Ele îndeplinesc în principal funcții de susținere (de exemplu, colagen, keratina
protaminele - proteine nucleare încărcate pozitiv, cu o greutate moleculară de 10-12 kDa. Aproximativ 80% sunt compuse din aminoacizi alcalini, ceea ce face posibil ca aceștia să interacționeze cu acizii nucleici prin legături ionice. Ei participă la reglarea activității genelor. Bine solubil în apă;
histonele - proteine nucleare care joacă un rol important în reglarea activității genelor. Ele se găsesc în toate celulele eucariote și sunt împărțite în 5 clase, care diferă în greutate moleculară și aminoacizi. Greutatea moleculară a histonelor este în intervalul de la 11 la 22 kDa, iar diferențele în compoziția aminoacizilor se referă la lizină și arginină, al căror conținut variază de la 11 la 29% și, respectiv, de la 2 la 14%;
prolaminele - insolubil în apă, dar solubil în alcool 70%, caracteristici ale structurii chimice - multă prolină, acid glutamic, fără lizină ,
gluteline - solubil in solutii alcaline ,
globuline - proteine care sunt insolubile în apă și într-o soluție semisaturată de sulfat de amoniu, dar solubile în soluții apoase de săruri, alcaline și acizi. Greutate moleculară - 90-100 kDa;
albumine - proteine ale tesuturilor animale si vegetale, solubile in apa si solutii saline. Greutatea moleculară este de 69 kDa;
scleroproteine - proteinele țesuturilor de susținere ale animalelor
Exemple de proteine simple sunt fibroina de mătase, albumina serică de ou, pepsina etc.
Numărul 3. Metode de izolare și precipitare (purificare) a proteinelor.





nr. 4. Proteinele ca polielectroliți. Punctul izoelectric al unei proteine.
Proteinele sunt polielectroliți amfoteri, adică prezintă atât proprietăți acide, cât și bazice. Acest lucru se datorează prezenței în moleculele proteice a radicalilor de aminoacizi capabili de ionizare, precum și a grupărilor libere α-amino și α-carboxil la capetele lanțurilor peptidice. Proprietățile acide ale proteinei sunt date de aminoacizii acizi (aspartic, glutamic), iar proprietățile alcaline - de aminoacizii bazici (lizina, arginina, histidina).
Sarcina unei molecule proteice depinde de ionizarea grupurilor acide și bazice ale radicalilor de aminoacizi. În funcție de raportul dintre grupurile negative și pozitive, molecula proteică în ansamblu capătă o sarcină totală pozitivă sau negativă. Când o soluție proteică este acidulată, gradul de ionizare al grupărilor anionice scade, în timp ce cel al grupărilor cationice crește; când este alcalinizată - invers. La o anumită valoare a pH-ului, numărul grupelor încărcate pozitiv și negativ devine același și apare starea izoelectrică a proteinei (sarcina totală este 0). Valoarea pH-ului la care proteina se află în stare izoelectrică se numește punct izoelectric și se notează pI, similar cu aminoacizii. Pentru majoritatea proteinelor, pI se află în intervalul 5,5-7,0, ceea ce indică o anumită predominanță a aminoacizilor acizi în proteine. Cu toate acestea, există și proteine alcaline, de exemplu, salminul - principala proteină din laptele de somon (pl=12). În plus, există proteine care au o valoare pI foarte scăzută, de exemplu, pepsina, o enzimă a sucului gastric (pl=l). La punctul izoelectric, proteinele sunt foarte instabile și precipită ușor, având cea mai mică solubilitate.
Dacă proteina nu este într-o stare izoelectrică, atunci câmp electric moleculele sale se vor deplasa spre catod sau anod, în funcție de semnul sarcinii totale și cu o viteză proporțională cu valoarea acestuia; aceasta este esența metodei electroforezei. Această metodă poate separa proteinele cu diferite valori pI.
Deși proteinele au proprietăți tampon, capacitatea lor la valorile fiziologice ale pH-ului este limitată. Excepție fac proteinele care conțin multă histidină, deoarece numai radicalul histidină are proprietăți tampon în intervalul de pH 6-8. Există foarte puține dintre aceste proteine. De exemplu, hemoglobina, care conține aproape 8% histidină, este un puternic tampon intracelular în celulele roșii din sânge, menținând pH-ul sângelui la un nivel constant.
№5. Proprietăți fizico-chimice proteine.
Proteinele au proprietăți chimice, fizice și biologice diferite, care sunt determinate de compoziția de aminoacizi și de organizarea spațială a fiecărei proteine. Reacțiile chimice ale proteinelor sunt foarte diverse, se datorează prezenței grupărilor NH 2 -, COOH și radicalilor de natură variată. Acestea sunt reacții de nitrare, acilare, alchilare, esterificare, redox și altele. Proteinele au proprietăți acido-bazice, tampon, coloidale și osmotice.
Proprietățile acido-bazice ale proteinelor
Proprietăți chimice. Odată cu încălzirea slabă a soluțiilor apoase de proteine, are loc denaturarea. Acest lucru creează un precipitat.
Când proteinele sunt încălzite cu acizi, are loc hidroliza și se formează un amestec de aminoacizi.
Proprietățile fizico-chimice ale proteinelor
Proteinele au o greutate moleculară mare.
Sarcina unei molecule de proteine. Toate proteinele au cel puțin o grupare -NH și -COOH liberă.
Soluții de proteine- solutii coloidale cu proprietati diferite. Proteinele sunt acide și bazice. Proteinele acide conțin o mulțime de glu și asp, care au carboxil suplimentar și mai puține grupe amino. Există multe lys și args în proteinele alcaline. Fiecare moleculă de proteină dintr-o soluție apoasă este înconjurată de o înveliș de hidratare, deoarece proteinele au multe grupe hidrofile (-COOH, -OH, -NH 2, -SH) datorită aminoacizilor. În soluții apoase, molecula proteică are o sarcină. Încărcătura de proteine din apă se poate modifica în funcție de pH.
Precipitarea proteinelor. Proteinele au o înveliș de hidratare, o sarcină care împiedică lipirea. Pentru depunere, este necesar să îndepărtați învelișul de hidrat și să încărcați.
1. Hidratarea. Procesul de hidratare înseamnă legarea apei de către proteine, în timp ce acestea prezintă proprietăți hidrofile: se umflă, le crește masa și volumul. Umflarea proteinei este însoțită de dizolvarea parțială a acesteia. Hidrofilitatea proteinelor individuale depinde de structura lor. Grupările amide hidrofile (–CO–NH–, legătură peptidică), amine (NH2) și carboxil (COOH) prezente în compoziție și situate la suprafața macromoleculei proteice atrag moleculele de apă, orientându-le strict către suprafața moleculei. . Înconjurând globulele proteice, învelișul de hidrat (apă) împiedică stabilitatea soluțiilor proteice. În punctul izoelectric, proteinele au cea mai mică capacitate de a lega apa, învelișul de hidratare din jurul moleculelor proteice este distrus, astfel încât acestea se combină pentru a forma agregate mari. Agregarea moleculelor de proteine are loc și atunci când sunt deshidratate cu unii solvenți organici, cum ar fi alcoolul etilic. Aceasta duce la precipitarea proteinelor. Când pH-ul mediului se modifică, macromolecula proteică se încarcă, iar capacitatea sa de hidratare se modifică.
Reacțiile de precipitare sunt împărțite în două tipuri.
Sărarea proteinelor: (NH 4)SO 4 - numai învelișul de hidratare este îndepărtat, proteina își păstrează toate tipurile de structură, toate legăturile, își păstrează proprietățile native. Astfel de proteine pot fi apoi re-dizolvate și utilizate.
Precipitația cu pierderea proprietăților proteinelor native este un proces ireversibil. Învelișul de hidratare și încărcătura sunt îndepărtate din proteină, diferite proprietăți ale proteinei sunt încălcate. De exemplu, săruri de cupru, mercur, arsenic, fier, acizi anorganici concentrați - HNO 3 , H 2 SO 4 , HCl, acizi organici, alcaloizi - taninuri, iodură de mercur. Adăugarea de solvenți organici scade gradul de hidratare și duce la precipitarea proteinei. Acetona este utilizată ca astfel de solvent. Proteinele se precipită și cu ajutorul sărurilor, de exemplu, sulfatul de amoniu. Principiul acestei metode se bazează pe faptul că, odată cu creșterea concentrației de sare din soluție, atmosferele ionice formate de contraionii proteici sunt comprimate, ceea ce contribuie la convergența lor la o distanță critică, la care forțele intermoleculare ale van. Atracția der Waals depășește forțele Coulomb de respingere ale contraionilor. Aceasta duce la aderența particulelor de proteine și la precipitarea acestora.
La fierbere, moleculele de proteine încep să se miște aleatoriu, se ciocnesc, sarcina este îndepărtată, iar învelișul de hidratare scade.
Pentru a detecta proteinele în soluție, se folosesc următoarele:
reacții de culoare;
reacții de precipitare.
Metode de izolare și purificare a proteinelor.
sărare;
electroforeză;
cromatografia: adsorbție, scindare;
ultracentrifugarea.
omogenizare- celulele sunt măcinate până la o masă omogenă;
extracția proteinelor cu apă sau soluții de apă-sare;
Organizarea structurală a proteinelor.
Structura primară- determinată de secvența de aminoacizi din lanțul peptidic, stabilizată prin legături peptidice covalente (insulina, pepsină, chimotripsină).
structura secundara- structura spațială a proteinei. Aceasta este fie o spirală, fie o pliere. Se creează legături de hidrogen.
Structura terțiară proteine globulare și fibrilare. Ele stabilizează legăturile de hidrogen, forțele electrostatice (COO-, NH3+), forțele hidrofobe, punțile sulfuroase, sunt determinate de structura primară. Proteine globulare - toate enzimele, hemoglobina, mioglobina. Proteine fibrilare - colagen, miozina, actina.
Structura cuaternară- se gaseste doar in unele proteine. Astfel de proteine sunt construite din mai multe peptide. Fiecare peptidă are propria sa structură primară, secundară, terțiară, numită protomeri. Mai mulți protomeri se unesc pentru a forma o moleculă. Un protomer nu funcționează ca o proteină, ci doar în combinație cu alți protomeri.
Exemplu: hemoglobina \u003d -globul + -globul - transportă O 2 în agregat și nu separat.
Proteinele se pot renatura. Acest lucru necesită o expunere foarte scurtă la agenți.

6) Metode de detectare a proteinelor.
Proteinele sunt polimeri biologici cu molecul mare, ale căror unități structurale (monomerice) sunt -aminoacizi. Aminoacizii din proteine sunt legați între ei prin legături peptidice. a cărei formare are loc datorită grupării carboxil aflate la -atomul de carbon al unui aminoacid și -grupa amina a unui alt aminoacid cu eliberarea unei molecule de apa. Unitățile monomerice ale proteinelor se numesc resturi de aminoacizi.
Peptidele, polipeptidele și proteinele diferă nu numai prin cantitate, compoziție, ci și prin secvența reziduurilor de aminoacizi, proprietăți fizico-chimice și funcții îndeplinite în organism. Greutatea moleculară a proteinelor variază de la 6 mii la 1 milion sau mai mult. Chimice și proprietăți fizice proteinele se datorează naturii chimice și proprietăților fizico-chimice ale radicalilor, reziduurilor lor constitutive de aminoacizi. Metodele de detectare și cuantificare a proteinelor în obiecte biologice și alimente, precum și izolarea acestora din țesuturi și fluide biologice, se bazează pe proprietățile fizice și chimice ale acestor compuși.
Proteine atunci când interacționează cu anumite substanțe chimice dau compuși colorați. Formarea acestor compuși are loc cu participarea radicalilor de aminoacizi, a grupurilor lor specifice sau a legăturilor peptidice. Reacțiile de culoare vă permit să setați prezența unei proteine într-un obiect biologic sau soluție și dovediți prezența anumiți aminoacizi dintr-o moleculă de proteină. Pe baza reacțiilor de culoare au fost dezvoltate unele metode de determinare cantitativă a proteinelor și aminoacizilor.
Considerați universal reacții biuret și ninhidrine, deoarece toate proteinele le dau. Reacția xantoproteică, reacția Fohl iar altele sunt specifice, deoarece se datorează grupărilor radicale ale anumitor aminoacizi din molecula proteică.
Reacțiile de culoare vă permit să stabiliți prezența unei proteine în materialul studiat și prezența anumitor aminoacizi în moleculele sale.
Reacția biuretului. Reacția se datorează prezenței în proteine, peptide, polipeptide legături peptidice, care sub formă de mediu alcalin cu ioni de cupru (II). compuși complecși colorați în culoare violet (cu o nuanță roșie sau albastră).. Culoarea se datorează prezenței a cel puțin două grupe în moleculă -CO-NH- conectate direct între ele sau cu participarea unui atom de carbon sau de azot.
Ionii de cupru (II) sunt legați prin două legături ionice cu grupări =C─O ˉ și patru legături de coordonare cu atomi de azot (=N−).
Intensitatea culorii depinde de cantitatea de proteine din soluție. Acest lucru face posibilă utilizarea acestei reacții pentru determinarea cantitativă a proteinei. Culoarea soluțiilor colorate depinde de lungimea lanțului polipeptidic. Proteinele dau o culoare albastru-violet; produsele hidrolizei lor (poli- și oligopeptide) sunt de culoare roșie sau roz. Reacția biuretului este dată nu numai de proteine, peptide și polipeptide, ci și de biuret (NH 2 -CO-NH-CO-NH 2), oxamidă (NH 2 -CO-CO-NH 2), histidină.
Compusul complex de cupru (II) cu grupări peptidice formate într-un mediu alcalin are următoarea structură:


Reacția ninhidrinei. În această reacție, soluțiile de proteine, polipeptide, peptide și α-aminoacizi liberi, atunci când sunt încălzite cu ninhidrina, dau o culoare albastră, albastru-violet sau roz-violet. Culoarea în această reacție se dezvoltă datorită grupării α-amino.


-aminoacizii reacţionează foarte uşor cu ninhidrina. Alături de ei, albastru-violetul lui Rueman este format și din proteine, peptide, amine primare, amoniac și alți compuși. Aminele secundare, cum ar fi prolina și hidroxiprolina, dau o culoare galbenă.
Reacția ninhidrinei este utilizată pe scară largă pentru detectarea și cuantificarea aminoacizilor.
reacție xantoproteică. Această reacție indică prezența reziduurilor de aminoacizi aromatici în proteine - tirozină, fenilalanină, triptofan. Se bazează pe nitrarea inelului benzenic al radicalilor acestor aminoacizi cu formarea de compuși nitro de culoare galbenă (greacă "Xanthos" - galben). Folosind tirozina ca exemplu, această reacție poate fi descrisă sub forma următoarelor ecuații.
Într-un mediu alcalin, derivații nitro ai aminoacizilor formează săruri din structura chinoidului, de culoare portocalie. Reacția xantoproteică este dată de benzen și omologii săi, fenol și alți compuși aromatici.

Reacții la aminoacizi care conțin o grupare tiol în stare redusă sau oxidată (cisteină, cistina).
Reacția lui Fohl. Când este fiert cu alcali, sulful se desprinde ușor de cisteină sub formă de hidrogen sulfurat, care într-un mediu alcalin formează sulfură de sodiu:
În acest sens, reacțiile pentru determinarea aminoacizilor care conțin tiol în soluție sunt împărțite în două etape:
Trecerea sulfului de la starea organică la starea anorganică
Detectarea sulfului în soluție
Pentru a detecta sulfura de sodiu, se folosește acetat de plumb, care, atunci când interacționează cu hidroxidul de sodiu, se transformă în plumbitul său:
Pb(CH 3 GÂNGURI) 2 + 2NaOH Pb(ONa) 2 + 2 canale 3 COOH
Ca urmare a interacțiunii ionilor de sulf și plumb, se formează sulfură de plumb neagră sau maro:
N / A 2 S + Pb(Pe o) 2 + 2 H 2 O PbS (precipitat negru) + 4NaOH
Pentru a determina aminoacizii care conțin sulf, se adaugă în soluția de testat un volum egal de hidroxid de sodiu și câteva picături de soluție de acetat de plumb. Cu fierbere intensivă timp de 3-5 minute, lichidul devine negru.
Prezența cistinei poate fi determinată folosind această reacție, deoarece cistina este ușor redusă la cisteină.
Reacția Millon:
Aceasta este o reacție la aminoacidul tirozină.
Hidroxilii fenolici liberi ai moleculelor de tirozină, atunci când interacționează cu sărurile, dau compuși ai sării de mercur a derivatului nitro al tirozinei, colorați roșu roz:

Reacția Pauli pentru histidină și tirozină . Reacția Pauli face posibilă detectarea aminoacizilor histidină și tirozină din proteină, care formează compuși complecși roșu vișiniu cu acid diazobenzensulfonic. Acidul diazobenzensulfonic se formează în reacția de diazotizare atunci când acidul sulfanilic reacționează cu nitritul de sodiu într-un mediu acid:

La soluția de testat se adaugă un volum egal dintr-o soluție acidă de acid sulfanilic (preparată cu acid clorhidric) și un volum dublu de soluție de nitrit de sodiu, se amestecă bine și se adaugă imediat sodă (carbonat de sodiu). După agitare, amestecul devine roșu vișiniu, cu condiția ca histidină sau tirozină să fie prezente în soluția de testat.


Reacția Adamkevich-Hopkins-Kohl (Schulz-Raspail) la triptofan (reacție la grupul indol). Triptofanul reacționează într-un mediu acid cu aldehidele, formând produse de condensare colorate. Reacția are loc datorită interacțiunii inelului indolic al triptofanului cu aldehida. Se știe că formaldehida se formează din acid glioxilic în prezența acidului sulfuric:
R  Soluțiile care conțin triptofan în prezența acizilor glioxilic și sulfuric dau o culoare roșu-violet.
Soluțiile care conțin triptofan în prezența acizilor glioxilic și sulfuric dau o culoare roșu-violet.
Acidul glioxilic este întotdeauna prezent în cantități mici în acidul acetic glacial. Prin urmare, reacția poate fi efectuată folosind acid acetic. În același timp, la soluția de testat se adaugă un volum egal de acid acetic glacial (concentrat) și se încălzește ușor până când precipitatul se dizolvă.După răcire, se adaugă un volum de acid sulfuric concentrat egal cu volumul adăugat de acid glioxilic. amestecați cu grijă de-a lungul peretelui (pentru a evita amestecarea lichidelor). După 5-10 minute se observă formarea unui inel roșu-violet la interfața dintre cele două straturi. Dacă amestecați straturile, conținutul vasului va deveni uniform violet.
La 
 condensarea triptofanului cu formaldehida:
condensarea triptofanului cu formaldehida:
Produsul de condensare este oxidat la bis-2-triptofanilcarbinol, care în prezența acizilor minerali formează săruri albastru-violete:


7) Clasificarea proteinelor. Metode de studiere a compoziției aminoacizilor.
Nomenclatura strictă și clasificarea proteinelor încă nu există. Denumirile proteinelor sunt date aleatoriu, cel mai adesea ținând cont de sursa izolării proteinelor sau ținând cont de solubilitatea acesteia în anumiți solvenți, de forma moleculei etc.
Proteinele sunt clasificate în funcție de compoziție, forma particulelor, solubilitate, compoziția de aminoacizi, origine etc.
1. Compoziţie Proteinele sunt împărțite în două grupe mari: proteine simple și complexe.
Simple (proteinele) includ proteine care dau numai aminoacizi la hidroliză (proteinoide, protamine, histone, prolamine, gluteline, globuline, albumine). Exemple de proteine simple sunt fibroina de mătase, albumina serică de ou, pepsina etc.
Complexul (proteidele) include proteine compuse dintr-o proteină simplă și un grup suplimentar (protetic) de natură non-proteică. Grupul de proteine complexe este împărțit în mai multe subgrupe, în funcție de natura componentei non-proteice:
Metaloproteine care conțin în compoziția lor metale (Fe, Cu, Mg etc.) asociate direct cu lanțul polipeptidic;
Fosfoproteine - conțin reziduuri de acid fosforic, care sunt atașate de molecula proteică prin legături esterice la locul grupărilor hidroxil ale serinei, treoninei;
Glicoproteine - grupele lor protetice sunt carbohidrați;
Cromoproteinele - constau dintr-o proteina simpla si un compus non-proteic colorat asociat cu aceasta, toate cromoproteinele sunt biologic foarte active; ca grupări protetice, ele pot conţine derivaţi de porfirine, izoaloxazină şi caroten;
Lipoproteine - lipide din grupul protetic - trigliceride (grăsimi) și fosfatide;
Nucleoproteinele sunt proteine care constau dintr-o singură proteină și un acid nucleic legat de aceasta. Aceste proteine joacă un rol colosal în viața organismului și vor fi discutate mai jos. Ele fac parte din orice celulă, unele nucleoproteine există în natură sub formă de particule speciale cu activitate patogenă (virusuri).
2. Forma particulelor- proteinele sunt împărțite în fibrilare (sub formă de fir) și globulare (sferice) (vezi pagina 30).
3. După solubilitate și caracteristicile compoziției de aminoacizi se disting următoarele grupe de proteine simple:
Proteinoide - proteine ale tesuturilor de sustinere (oase, cartilaje, ligamente, tendoane, par, unghii, piele etc.). Acestea sunt în principal proteine fibrilare cu o greutate moleculară mare (> 150.000 Da), insolubile în solvenți obișnuiți: apă, sare și amestecuri apă-alcool. Se dizolvă numai în solvenți specifici;
Protaminele (cele mai simple proteine) - proteine care sunt solubile în apă și conțin 80-90% arginină și un set limitat (6-8) de alți aminoacizi, sunt prezente în laptele diverșilor pești. Datorită conținutului ridicat de arginină, au proprietăți de bază, greutatea lor moleculară este relativ mică și este aproximativ egală cu 4000-12000 Da. Sunt o componentă proteică în compoziția nucleoproteinelor;
Histonele sunt foarte solubile în apă și soluții acide diluate (0,1 N), au un conținut ridicat de aminoacizi: arginină, lizină și histidină (cel puțin 30%) și, prin urmare, au proprietăți bazice. Aceste proteine se găsesc în cantități semnificative în nucleele celulelor ca parte a nucleoproteinelor și joacă un rol important în reglarea metabolismului acidului nucleic. Greutatea moleculară a histonelor este mică și egală cu 11000-24000 Da;
Globulinele sunt proteine insolubile în apă și soluții saline cu o concentrație de sare de peste 7%. Globulinele sunt complet precipitate la saturația de 50% a soluției cu sulfat de amoniu. Aceste proteine se caracterizează printr-un conținut ridicat de glicină (3,5%), greutatea lor moleculară > 100.000 Da. Globulinele sunt proteine slab acide sau neutre (p1=6-7,3);
Albuminele sunt proteine foarte solubile în apă și soluții saline puternice, iar concentrația de sare (NH 4) 2 S0 4 nu trebuie să depășească 50% din saturație. La concentrații mai mari, albuminele sunt sărate. Comparativ cu globulinele, aceste proteine contin de trei ori mai putina glicina si au o greutate moleculara de 40.000-70.000 Da. Albuminele au o sarcină negativă în exces și proprietăți acide (pl=4,7) datorită conținutului ridicat de acid glutamic;
Prolaminele sunt un grup de proteine vegetale găsite în gluten. plante de cereale. Sunt solubile numai în soluție apoasă de alcool etilic 60-80%. Prolaminele au o compoziție de aminoacizi caracteristică: conțin mult (20-50%) acid glutamic și prolină (10-15%), motiv pentru care și-au primit numele. Greutatea lor moleculară este de peste 100.000 Da;
Gluteline - proteinele vegetale sunt insolubile în apă, soluții sărate și etanol, dar solubile în soluții diluate (0,1 N) de alcalii și acizi. În ceea ce privește compoziția de aminoacizi și greutatea moleculară, acestea sunt similare cu prolaminele, dar conțin mai multă arginină și mai puțină prolină.
Metode de studiere a compoziției aminoacizilor
Proteinele sunt descompuse în aminoacizi de către enzimele din sucurile digestive. S-au făcut două concluzii importante: 1) proteinele conţin aminoacizi; 2) metodele de hidroliză pot fi utilizate pentru a studia compoziția chimică, în special a aminoacizilor, a proteinelor.
Pentru a studia compoziția de aminoacizi a proteinelor, se utilizează o combinație de hidroliză acidă (HCl), alcalină [Ba(OH) 2 ] și, mai rar, hidroliză enzimatică sau una dintre ele. S-a stabilit că în timpul hidrolizei unei proteine pure care nu conține impurități se eliberează 20 de α-aminoacizi diferiți. Toți ceilalți aminoacizi descoperiți în țesuturile animalelor, plantelor și microorganismelor (mai mult de 300) există în natură în stare liberă sau sub formă de peptide scurte sau complexe cu alte substanțe organice.
Primul pas în determinarea structurii primare a proteinelor este evaluarea calitativă și cantitativă a compoziției de aminoacizi a unei anumite proteine individuale. Trebuie reținut că pentru studiu trebuie să aveți o anumită cantitate de proteină pură, fără impurități ale altor proteine sau peptide.
Hidroliza acidă a proteinelor
Pentru a determina compoziția aminoacizilor, este necesar să se distrugă toate legăturile peptidice din proteină. Proteina analizată este hidrolizată în 6 mol/l HC1 la o temperatură de aproximativ 110 ° C timp de 24 de ore.Ca urmare a acestui tratament, legăturile peptidice din proteină sunt distruse și doar aminoacizii liberi sunt prezenți în hidrolizat. În plus, glutamina și asparagina sunt hidrolizate în acizi glutamic și aspartic (adică, legătura amidă din radical este ruptă și gruparea amino este scindată din ele).
Separarea aminoacizilor folosind cromatografia de schimb ionic
Amestecul de aminoacizi obținut prin hidroliza acidă a proteinelor este separat într-o coloană cu o rășină schimbătoare de cationi. O astfel de rășină sintetică conține grupări încărcate negativ (de exemplu, reziduuri de acid sulfonic -SO 3 -) puternic asociate cu ea, de care sunt atașați ioni Na + (Fig. 1-4).
Un amestec de aminoacizi este introdus în schimbătorul de cationi într-un mediu acid (pH 3,0), unde aminoacizii sunt în principal cationi, de exemplu. poartă o sarcină pozitivă. Aminoacizii încărcați pozitiv se atașează de particulele de rășină încărcate negativ. Cu cât este mai mare sarcina totală a aminoacidului, cu atât este mai puternică legătura sa cu rășina. Astfel, aminoacizii lizină, arginina și histidina se leagă cel mai puternic de schimbătorul de cationi, în timp ce acizii aspartic și glutamic se leagă cel mai slab.
Eliberarea aminoacizilor din coloană se realizează prin eluarea (eluarea) acestora cu o soluție tampon cu putere ionică crescândă (adică, cu creșterea concentrației de NaCl) și pH. Odată cu creșterea pH-ului, aminoacizii pierd un proton, ca urmare, sarcina lor pozitivă scade și, prin urmare, puterea legăturii cu particulele de rășină încărcate negativ.
Fiecare aminoacid iese din coloană la un anumit pH și putere ionică. Prin colectarea soluției (eluat) de la capătul inferior al coloanei sub formă de porțiuni mici, se pot obține fracții care conțin aminoacizi individuali.
(pentru mai multe detalii despre „hidroliză” vezi întrebarea #10)
8) Legături chimice în structura proteinelor.



9) Conceptul de ierarhie și organizare structurală a proteinelor. (vezi întrebarea #12)
10) Hidroliza proteinelor. Chimia reacțiilor (pasare, catalizatori, reactivi, condiții de reacție) - o descriere completă a hidrolizei.
11) Transformări chimice ale proteinelor.
Denaturare și renaturare
Atunci când soluțiile de proteine sunt încălzite la 60-80% sau sub acțiunea unor reactivi care distrug legăturile necovalente din proteine, structura terțiară (cuaternară) și secundară a moleculei proteice este distrusă, aceasta ia forma unei bobine aleatoare pentru a într-o măsură mai mare sau mai mică. Acest proces se numește denaturare. Ca reactivi de denaturare pot fi folosiți acizi, alcalii, alcooli, fenoli, uree, clorură de guanidină etc.. Esența acțiunii lor este aceea că formează legături de hidrogen cu grupările =NH și =CO - ale scheletului peptidic și cu grupările acide ale radicali de aminoacizi, înlocuindu-și propriile legături de hidrogen intramoleculare în proteină, în urma cărora structurile secundare și terțiare se modifică. În timpul denaturarii, solubilitatea proteinei scade, se „coagulează” (de exemplu, la gătit ou de gaina), activitatea biologică a proteinei se pierde. Pe baza acestui fapt, de exemplu, utilizarea unei soluții apoase de acid carbolic (fenol) ca antiseptic. În anumite condiții, cu răcirea lentă a unei soluții de proteină denaturată, are loc renaturarea - refacerea conformației originale (native). Acest lucru confirmă faptul că natura plierii lanțului peptidic este determinată de structura primară.
Procesul de denaturare a unei molecule de proteine individuale, care duce la dezintegrarea structurii sale tridimensionale „rigide”, este uneori numit topirea moleculei. Aproape orice schimbare vizibilă a condițiilor externe, cum ar fi încălzirea sau o schimbare semnificativă a pH-ului, duce la o încălcare consecventă a structurilor cuaternare, terțiare și secundare ale proteinei. De obicei, denaturarea este cauzată de creșterea temperaturii, de acțiunea acizilor și alcalinelor puternice, a sărurilor metalelor grele, a anumitor solvenți (alcool), a radiațiilor etc.
Denaturarea duce adesea la procesul de agregare a particulelor de proteine în altele mai mari într-o soluție coloidală de molecule de proteine. Din punct de vedere vizual, aceasta arată, de exemplu, ca formarea unei „proteine” la prăjirea ouălor.
Renaturarea este procesul invers de denaturare, în care proteinele revin la structura lor naturală. Trebuie remarcat faptul că nu toate proteinele sunt capabile să se renatureze; în majoritatea proteinelor, denaturarea este ireversibilă. Dacă, în timpul denaturarii proteinelor, modificările fizico-chimice sunt asociate cu tranziția lanțului polipeptidic de la o stare dens (ordonată) la una dezordonată, atunci în timpul renaturarii se manifestă capacitatea proteinelor de a se autoorganiza, a cărei cale este predeterminat de secvența de aminoacizi din lanțul polipeptidic, adică structura sa primară determinată de informații ereditare. În celulele vii, această informație este probabil decisivă pentru transformarea unui lanț polipeptidic dezordonat în timpul sau după biosinteza acestuia pe ribozom în structura unei molecule de proteină nativă. Când moleculele de ADN dublu catenar sunt încălzite la o temperatură de aproximativ 100 ° C, legăturile de hidrogen dintre baze sunt rupte, iar catenele complementare diverg - ADN-ul se denaturează. Cu toate acestea, la răcirea lentă, firele complementare se pot reconecta într-o dublă spirală obișnuită. Această capacitate a ADN-ului de a renatura este folosită pentru a produce molecule hibride de ADN artificial.
Corpurile proteice naturale sunt înzestrate cu o anumită configurație spațială, strict definită și au o serie de proprietăți fizico-chimice și biologice caracteristice la temperaturi fiziologice și valori ale pH-ului. Sub influența diverșilor factori fizici și chimici, proteinele suferă coagulare și precipită, pierzându-și proprietățile native. Astfel, denaturarea trebuie înțeleasă ca o încălcare a planului general al structurii unice a moleculei de proteine native, în principal structura sa terțiară, ceea ce duce la pierderea proprietăților sale caracteristice (solubilitate, mobilitate electroforetică, activitate biologică etc.). Majoritatea proteinelor se denaturază atunci când soluțiile lor sunt încălzite peste 50-60°C.
Manifestările externe ale denaturarii sunt reduse la o pierdere a solubilității, în special la punctul izoelectric, o creștere a vâscozității soluțiilor de proteine, o creștere a numărului de grupe SH funcționale libere și o schimbare a naturii împrăștierii razelor X. . Cel mai caracteristic semn de denaturare este o scădere bruscă sau pierdere completă de către proteină a activității sale biologice (catalitică, antigenică sau hormonală). În timpul denaturarii proteinelor cauzate de ureea 8M sau de un alt agent, cele mai multe legături necovalente (în special, interacțiunile hidrofobe și legăturile de hidrogen) sunt distruse. Legăturile disulfurice sunt rupte în prezența agentului de reducere mercaptoetanol, în timp ce legăturile peptidice ale coloanei vertebrale a lanțului polipeptidic în sine nu sunt afectate. În aceste condiții, globulele de molecule de proteine native se desfășoară și se formează structuri aleatorii și dezordonate (Fig.)

Denaturarea unei molecule de proteine (schemă).
a - starea initiala; b - începerea încălcării reversibile a structurii moleculare; c - desfăşurarea ireversibilă a lanţului polipeptidic.

Denaturarea și renaturarea ribonucleazei (după Anfinsen).
a - desfășurare (uree + mercaptoetanol); b - repliere.

1. Hidroliza proteinelor: H+
[− NH2─CH─ CO─NH─CH─CO − ]n +2nH2O → n NH2 − CH − COOH + n NH2 ─ CH ─ COOH
│ │ │ │
Aminoacid 1 aminoacid 2
2. Precipitarea proteinelor:
a) reversibile
Proteine în soluție ↔ precipitat proteic. Apare sub acțiunea soluțiilor de săruri Na+, K+
b) ireversibilă (denaturare)
În timpul denaturarii sub influența factorilor externi (temperatură; acțiune mecanică - presiune, frecare, scuturare, ultrasunete; acțiunea agenților chimici - acizi, alcaline etc.), are loc o modificare în structurile secundare, terțiare și cuaternare ale proteinei. macromolecula, adică structura sa spațială nativă. Structura primară și, prin urmare compoziție chimică proteinele nu se modifică.
În timpul denaturarii, proprietățile fizice ale proteinelor se modifică: solubilitatea scade, activitatea biologică se pierde. În același timp, activitatea unor grupe chimice crește, efectul enzimelor proteolitice asupra proteinelor este facilitat și, în consecință, este mai ușor hidrolizat.
De exemplu, albumina - albușul de ou - la o temperatură de 60-70 ° este precipitată dintr-o soluție (coagulează), pierzând capacitatea de a se dizolva în apă.
Schema procesului de denaturare a proteinelor (distrugerea structurilor terțiare și secundare ale moleculelor de proteine)
3. Arderea proteinelor
Proteinele ard cu formarea de azot, dioxid de carbon, apă și alte substanțe. Arderea este însoțită de mirosul caracteristic de pene arse.
4. Reacții de culoare (calitative) la proteine:
a) reacția xantoproteinelor (pentru resturile de aminoacizi care conțin inele benzenice):
Proteină + HNO3 (conc.) → culoare galbenă
b) reacția biuretului (pentru legăturile peptidice):
Proteine + CuSO4 (sat) + NaOH (conc) → culoare violet strălucitor
c) reacția cisteinei (pentru reziduurile de aminoacizi care conțin sulf):
Proteină + NaOH + Pb(CH3COO)2 → Colorare neagră
Proteinele sunt baza întregii vieți de pe Pământ și îndeplinesc diverse funcții în organism.
Sărarea proteinelor
Salirea este procesul de izolare a proteinelor din soluții apoase cu soluții neutre de săruri concentrate ale metalelor alcaline și alcalino-pământoase. Când se adaugă concentrații mari de săruri la soluția de proteine, au loc deshidratarea particulelor de proteine și îndepărtarea încărcăturii, în timp ce proteinele precipită. Gradul de precipitare a proteinei depinde de puterea ionică a soluției de precipitare, de dimensiunea particulelor moleculei de proteină, de mărimea încărcăturii sale și de hidrofilitate. Diferite proteine precipită la diferite concentrații de sare. Prin urmare, în sedimentele obținute prin creșterea treptată a concentrației de săruri, proteinele individuale se află în diferite fracțiuni. Sărarea proteinelor este un proces reversibil, iar după ce sarea este îndepărtată, proteina își recapătă proprietățile naturale. Prin urmare, sărarea este utilizată în practica clinică în separarea proteinelor din serul sanguin, precum și în izolarea și purificarea diferitelor proteine.
Anionii și cationii adăugați distrug învelișul proteic hidratat al proteinelor, care este unul dintre factorii de stabilitate ai soluțiilor de proteine. Cel mai adesea, se folosesc soluții de sulfați de Na și amoniu. Multe proteine diferă în ceea ce privește dimensiunea învelișului de hidratare și mărimea încărcăturii. Fiecare proteină are propria sa zonă de sărare. După îndepărtarea agentului de sărare, proteina își păstrează activitatea biologică și proprietățile fizico-chimice. În practica clinică, metoda de sărare este utilizată pentru separarea globulinelor (cu adaos de 50% sulfat de amoniu (NH4)2SO4 a precipitat) și albuminele (cu adăugarea de 100% sulfat de amoniu (NH4)2SO4 a precipitat).
Sărarea este influențată de:
1) natura și concentrația sării;
2) medii cu pH;
3) temperatura.
Rolul principal este jucat de valențele ionilor.
12) Caracteristici ale organizării structurii primare, secundare, terțiare a proteinei.
În prezent, s-a dovedit experimental existența a patru niveluri de organizare structurală a unei molecule proteice: structura primară, secundară, terțiară și cuaternară.
Veverițe
- biopolimeri, ai căror monomeri sunt α-aminoacizi legați prin legături peptidice.
Izolați aminoacizii hidrofobși hidrofil, care, la rândul lor, sunt împărțite în acide, bazice și neutre. O caracteristică a a-aminoacizilor este capacitatea lor de a interacționa între ei pentru a forma peptide.
Aloca:
dipeptide (carnozina si anserina, localizat în mitocondrii; fiind AO, prevenind umflarea acestora);
oligopeptide, conţinând până la 10 reziduuri de aminoacizi. De exemplu: tripeptidă glutation servește ca unul dintre principalii agenți reducători din ARP, care reglează intensitatea peroxidării lipidelor. Vasopresinași oxitocina- hormonii hipofizei posterioare, includ 9 aminoacizi.
Exista polipeptidă s și, în funcție de proprietățile pe care le prezintă, sunt atribuiți unei clase diferite de compuși. Medicii cred că, dacă administrarea parenterală a unei polipeptide provoacă respingere (o reacție alergică), atunci ar trebui luată în considerare. proteină; dacă nu se observă un astfel de fenomen, atunci termenul rămâne același ( polipeptidă). Hormonul adenohipofizei ACTH, care afectează secreția de corticosteroizi în cortexul suprarenal, sunt denumite polipeptide (39 de aminoacizi) și insulină, format din 51 de monomeri și capabil să provoace un răspuns imun, este o proteină.
Niveluri de organizare a unei molecule de proteine.
Orice polimer tinde să adopte o conformație mai favorabilă din punct de vedere energetic, care este reținută datorită formării de legături suplimentare, care se realizează cu ajutorul grupurilor de radicali de aminoacizi. Se obișnuiește să se distingă patru niveluri de organizare structurală a proteinelor. Structura primară- secvența de aminoacizi din lanțul polipeptidic, legați covalent prin peptide ( amidă), iar radicalii vecini sunt la un unghi de 180 0 (forma trans). Prezența a mai mult de 2 duzini de aminoacizi proteinogeni diferiți și capacitatea lor de a se lega în secvențe diferite determină diversitatea proteinelor în natură și îndeplinirea lor de diferite funcții. Structura primară a proteinelor unui individ este stabilită genetic și transmisă de la părinți cu ajutorul polinucleotidelor ADN și ARN. În funcție de natura radicalilor și cu ajutorul unor proteine speciale - însoţitori lanțul polipeptidic sintetizat se potrivește în spațiu - plierea proteinelor.
structura secundara proteina are forma unui strat spiralat sau pliat β. Proteinele fibrilare (colagen, elastina) au structura beta. Alternarea regiunilor spiralizate și amorfe (dezordonate) le permite să se apropie unele de altele și, cu ajutorul însoțitorilor, să formeze o moleculă mai dens - structura tertiara.
Se formează combinarea mai multor lanțuri polipeptidice în spațiu și crearea unei formațiuni macromoleculare funcționale structura cuaternară veveriţă. Astfel de micelii se numesc oligo- sau multimeri, iar componentele lor sunt subunități ( protomeri). O proteină cu structură cuaternară are activitate biologică numai dacă toate subunitățile sale sunt interconectate.
Astfel, orice proteină naturală se caracterizează printr-o organizare unică, care îi asigură funcțiile fizico-chimice, biologice și fiziologice.
Proprietăți fizico-chimice.
Proteinele sunt mari și au o greutate moleculară mare, care variază de la 6.000 la 1.000.000 de daltoni și mai mult, în funcție de numărul de aminoacizi și numărul de protomeri. Moleculele lor au diferite forme: fibrilare- păstrează structura secundară; globular- având o organizare superioară; si amestecate. Solubilitatea proteinelor depinde de mărimea și forma moleculei, de natura radicalilor aminoacizi. Proteinele globulare sunt foarte solubile în apă, în timp ce proteinele fibrilare sunt fie ușor, fie insolubile.
Proprietățile soluțiilor proteice: au presiune osmotică scăzută, dar oncotică ridicată; vâscozitate ridicată; capacitate slabă de difuzare; adesea tulbure; opalescent ( Fenomenul Tyndall), - toate acestea sunt folosite în izolarea, purificarea, studiul proteinelor native. Separarea componentelor unui amestec biologic se bazează pe precipitarea acestora. Se numește precipitații reversibile sărând afară , dezvoltându-se sub acţiunea sărurilor Metale alcaline, săruri de amoniu, alcaline diluate și acizi. Este folosit pentru a obține fracții pure care își păstrează structura și proprietățile native.
Gradul de ionizare al unei molecule de proteină și stabilitatea acesteia în soluție sunt determinate de pH-ul mediului. Se numește valoarea pH-ului unei soluții la care sarcina particulelor tinde spre zero punct izoelectric . Astfel de molecule sunt capabile să se miște într-un câmp electric; viteza de mișcare este direct proporțională cu mărimea sarcinii și invers proporțională cu masa globului, care stă la baza electroforezei pentru separarea proteinelor serice.
depunere ireversibilă - denaturare. Dacă reactivul pătrunde adânc în micelă și distruge legături suplimentare, firul compact se desface. Moleculele care se apropie datorită grupurilor eliberate se lipesc împreună și precipită sau plutesc și își pierd proprietățile biologice. Factori de denaturare: fizic(temperatura peste 40°C, tipuri diferite radiații: raze X, α-, β-, γ, UFL); chimic(acizi concentrați, alcaline, săruri ale metalelor grele, uree, alcaloizi, unele medicamente, otrăvuri). Denaturarea este utilizată în asepsie și antisepsie, precum și în cercetarea biochimică.
Proteinele au proprietăți diferite (Tabelul 1.1).
Tabelul 1.1
Proprietățile biologice ale proteinelor
| Specificitate | Este determinată de compoziția unică de aminoacizi a fiecărei proteine, care este determinată genetic și asigură adaptarea organismului la condițiile de mediu în schimbare, dar, pe de altă parte, necesită ca acest fapt să fie luat în considerare la transfuzia de sânge, transplantul de organe. și țesuturi. |
| Liganditatea | capacitatea radicalilor de aminoacizi de a forma legături cu substanțe de natură variată ( liganzi): carbohidrați, lipide, nucleotide, compuși minerali. Dacă conexiunea este puternică, atunci acest complex, numit proteine complexe, îndeplinește funcțiile destinate acestuia. |
| cooperare | caracteristic proteinelor cu structură cuaternară. Hemoglobina este formată din 4 protomeri, fiecare dintre care este conectat la un hem care se poate lega de oxigen. Dar hemul primei subunități face acest lucru încet, iar fiecare ulterior mai ușor. |
| Polifuncționalitate | proprietatea unei proteine de a îndeplini o varietate de funcții. Miozina, o proteină musculară contractilă, are și activitate catalitică, hidrolizând ATP dacă este necesar. Hemoglobina menționată mai sus este, de asemenea, capabilă să funcționeze ca o enzimă - catalaza. |
| complementaritatea | Toate proteinele se potrivesc în spațiu astfel încât să se formeze zone, complementar alți compuși, care asigură îndeplinirea diferitelor funcții (formarea complexelor enzimă-substrat, hormon-receptor, antigen-anticorp. |
Clasificarea proteinelor
Aloca proteine simple , constând numai din aminoacizi, și complex , inclusiv grupare prostetică. Proteinele simple sunt împărțite în globular și fibrilar, și, de asemenea, în funcție de compoziția de aminoacizi pe bazic, acid, neutru. proteinele de bază globulare protamine și histone. Au o greutate moleculară mică, datorită prezenței argininei și lizinei, au o bazicitate pronunțată, datorită sarcinii „-”, interacționează ușor cu polianionii acizilor nucleici. Histonele, prin legarea de ADN, ajută la încadrarea compactă în nucleu și reglează sinteza proteinelor. Această fracțiune este eterogenă și, atunci când interacționează între ele, se formează nucleozomiîn jurul căruia sunt înfăşurate firele de ADN.
Proteinele globulare acide sunt albumine și globuline conținute în lichidele extracelulare (plasmă sanguină, lichid cefalorahidian, limfă, lapte) și diferă ca masă și dimensiune. Albuminele au o greutate moleculară de 40-70 mii D, spre deosebire de globulinele (peste 100 mii D). Primele includ acid glutamic, care creează o sarcină mare „-” și o înveliș hidratat, ceea ce face posibilă o stabilitate ridicată a soluției lor. Globulinele sunt proteine mai puțin acide; prin urmare, sunt ușor sărate și sunt eterogene; sunt împărțite în fracții folosind electroforeză. Capabil să se lege de diverși compuși (hormoni, vitamine, otrăvuri, medicamente, ioni), asigurând transportul acestora. Cu ajutorul lor sunt stabilizați parametri importanți ai homeostaziei: pH-ul și presiunea oncotică. Alocați de asemenea imunoglobuline(IgA, IgM, IgD, IgE, IgG), care servesc ca anticorpi, precum și ca factori de coagulare a proteinelor.
Clinica folosește așa-numitul raportul de proteine (BC) reprezentând raportul dintre concentrația de albumină și concentrația de globulină:
Valorile sale fluctuează în funcție de procesele patologice.
proteine fibrilare sunt împărțite în două grupe: solubil ( actina, miozina, fibrinogen) şi insolubilîn apă și soluții de apă-sare (proteine suport colagen, elastina, reticulinași acoperire - cheratinașervețele).
Clasificarea proteinelor complexe se bazează pe caracteristicile structurale ale grupului protetic. Metaloproteine — feritina, bogat în cationi de fier, și localizat în celulele sistemului fagocitar mononuclear (hepatocite, splenocite, celule măduvei osoase), este un depozit metalul dat. Excesul de fier duce la acumularea în țesuturi - hemosiderina, provocând dezvoltarea hemosideroza. glicoproteine metalice - transferinăși ceruloplasmina plasma sanguină, servind ca forme de transport ale ionilor de fier și respectiv de cupru, a fost dezvăluită activitatea lor antioxidantă. Activitatea multor enzime depinde de prezența ionilor metalici în molecule: pentru xantin dehidrogenază - Mo ++, arginază - Mn ++ și alcool DG - Zn ++.
Fosfoproteine - cazeinogen din lapte, vitellin de gălbenuș și ovalbumină de albuș de ou, ichtulină de icre de pește. Ele joacă un rol important în dezvoltarea embrionului, fătului și nou-născutului: aminoacizii lor sunt necesari pentru sinteza propriilor proteine tisulare, iar fosfatul este folosit fie ca o legătură în PL, structurile esențiale ale membranelor celulare, fie ca o componentă esențială a macroergilor, surse de energie în geneza diferiților compuși. Enzimele își reglează activitatea prin fosforilare-defosforilare.
Parte nucleoproteine include ADN și ARN. Apoproteinele sunt fie histone, fie protamine. Orice cromozom este un complex al unei molecule de ADN cu multe histone. Prin utilizarea nucleozom există o înfășurare a firului acestei polinucleotide, care îi reduce volumul.
Glicoproteine includ diverși carbohidrați (oligozaharide, tip GAG acid hialuronic, condroitin-, dermatan-, keratan-, heparan sulfați). Mucusul, bogat în glicoproteine, are o vâscozitate ridicată, protejând pereții organelor goale de iritanți. Glicoproteinele membranare asigură contacte intercelulare, lucrul receptorilor, în membranele plasmatice ale eritrocitelor ele sunt responsabile pentru specificitatea grupului sângelui. Anticorpii (oligozaharide) interacționează cu antigeni specifici. Același principiu stă la baza funcționării interferonilor, sistemul complementului. Ceruloplasmina și transferrina, care transportă ioni de cupru și fier în plasma sanguină, sunt și ele glicoproteine. Unii hormoni de adenohipofiză aparțin acestei clase de proteine.
Lipoproteinele grupul protetic contine diverse lipide (TAG, colesterol liber, esterii sai, PL). În ciuda prezenței celor mai diverse substanțe, principiul structurii micelilor LP este similar (Fig. 1.1). În interiorul acestei particule se află o picătură de grăsime care conține lipide nepolare: TAG și esteri de colesterol. În exterior, nucleul este înconjurat de o membrană cu un singur strat formată din PL, o proteină (apolipoproteina)și HS. Unele proteine sunt integrale și nu pot fi separate de lipoproteină, în timp ce altele pot fi transferate de la un complex la altul. Fragmentele polipeptidice formează structura particulei, interacționează cu receptorii de pe suprafața celulei, determinând ce țesuturi au nevoie de ea, servesc ca enzime sau activatori ai acestora care modifică LP. Următoarele tipuri de lipoproteine au fost izolate prin ultracentrifugare: XM, VLDL, LPPP, LDL, HDL. Fiecare tip de LP se formează în țesuturi diferite și asigură transportul anumitor lipide în fluidele biologice. Moleculele acestor proteine sunt foarte solubile în sânge. avea mărime micăși sarcină negativă la suprafață. O parte din LP este capabilă să difuzeze ușor prin intima arterelor, hrănindu-l. Chilomicronii servesc ca purtători de lipide exogene, mișcându-se mai întâi prin limfă și apoi prin fluxul sanguin. Pe măsură ce progresează, HM-urile își pierd lipidele, dându-le celulelor. VLDL servesc ca principalele forme de transport ale lipidelor sintetizate în ficat, în principal TAG, și se realizează livrarea colesterolului endogen din hepatocite către organe și țesuturi. LDL. Pe măsură ce donează lipide celulelor țintă, densitatea acestora crește (convertită în LPPP). Se realizează faza catabolică a metabolismului colesterolului HDL, care îl transportă de la țesuturi la ficat, de unde este excretat în bilă prin tractul gastrointestinal din organism.
La cromoproteinele grupul protetic poate fi o substanță având o culoare. Subclasa − hemoproteinele, servește ca o parte non-proteică bijuterie. Hemoglobină eritrocitele asigură schimbul de gaze, are o structură cuaternară, constă din 4 lanțuri polipeptidice diferite în embrion, făt, copil (Secțiunea IV. Capitolul 1). Spre deosebire de Hb. mioglobina are un lanț hem și un polipeptid, pliate într-un glob. Afinitatea mioglobinei pentru oxigen este mai mare decât cea a hemoglobinei, astfel încât este capabilă să accepte gaze, să depună și să cedeze mitocondriilor după cum este necesar. Proteinele care conțin hem sunt catalază, peroxidază, care sunt enzime ARZ; citocromilor- componente ale ETC, care este responsabil pentru principalul proces bioenergetic din celule. Printre dehidrogenaze se găsesc participanți la respirația tisulară flavoproteine- cromoproteine care au o culoare galbenă (flavos - galben) datorită prezenței flavonoidelor în ele - componente ale FMN și FAD. rodopsina este o proteină complexă al cărei grup protetic este formă activă vitamina A - retinol galben-portocaliu. Vizual violet - principala substanță sensibilă la lumină a tijelor retiniene, oferă percepția luminii la amurg.
Funcțiile proteinelor
| Structural
(plastic) |
Proteinele formează baza membranelor celulare și organoide și, de asemenea, formează baza țesutului (colagenul în țesutul conjunctiv). |
| catalitic | Toate enzimele sunt proteine - biocatalizatori. |
| de reglementare | Mulți hormoni secretați de hipofiza anterioară și glandele paratiroide sunt de natură proteică. |
| Transport | În plasma sanguină albumine asigură transferul IVH, bilirubinei. Transferrina responsabil pentru livrarea cationilor de fier. |
| Respirator | Micele hemoglobină, localizate în eritrocite, sunt capabile să se lege cu diferite gaze, în primul rând cu oxigen, dioxid de carbon, participând direct la schimbul de gaze. |
| contractilă | Proteine specifice miocitelor ( actina si miozina) sunt participanți la contracție și relaxare. O proteină din citoschelet prezintă un efect similar în momentul segregării cromozomilor în timpul mitozei. tubulina. |
| De protecţie | Factorii de coagulare a proteinelor protejează organismul de pierderea inadecvată de sânge. Proteinele imune (γ-globuline, interferon, proteine din sistemul complementului) luptă împotriva substanțelor străine care intră în organism - antigene. |
| Homeostatic | Proteinele extra și intracelulare pot menține un nivel constant al pH-ului ( sisteme tampon) și presiunea oncotică a mediului. |
| Receptor | Glicoproteinele membranelor celulare și organoide, fiind localizate în zonele exterioare, percep diverse semnale de reglare. |
| vizual | Semnalele vizuale din retină sunt primite de o proteină - rodopsina. |
| nutritiv | Albuminele plasmatice și globulinele servesc drept rezerve de aminoacizi. |
| Proteine cromozomiale ( histone, protamine) sunt implicați în crearea unui echilibru de exprimare și reprimare a informațiilor genetice. | |
| Energie | În timpul înfometării sau proceselor patologice, atunci când utilizarea carbohidraților în scopuri energetice este întreruptă (în diabet zaharat), proteoliza tisulară este îmbunătățită, ai căror produse sunt aminoacizi ( cetogenic), în descompunere, servesc drept surse de energie. |
Clasificarea proteinelor se bazează pe compoziția lor chimică. Conform acestei clasificări, proteinele sunt simpluși complex. Proteinele simple sunt formate doar din aminoacizi, adică una sau mai multe polipeptide. Proteinele simple găsite în corpul uman sunt albumine, globuline, histone, proteine tisulare de susținere.
Într-o moleculă de proteină complexă, pe lângă aminoacizi, există și o parte non-aminoacizi numită grupare prostetică.În funcție de structura acestui grup, astfel de proteine complexe se disting ca fosfoproteine ( conţin acid fosforic) nucleoproteine(conțin acid nucleic), glicoproteine(conțin carbohidrați) lipoproteinele(conțin lipoide) și altele.
Conform clasificării, care se bazează pe forma spațială a proteinelor, proteinele sunt împărțite în fibrilareși globular.
Proteinele fibrilare constau din elice, adică predominant dintr-o structură secundară. Moleculele de proteine globulare au o formă sferică și elipsoidă.
Un exemplu de proteine fibrilare este colagen - cea mai abundentă proteină din corpul uman. Această proteină reprezintă 25-30% din numărul total de proteine din organism. Colagenul are rezistență și elasticitate ridicate. Face parte din vasele mușchilor, tendoanelor, cartilajelor, oaselor, pereților vasculari.
Un exemplu de proteine globulare sunt albumine și globuline din plasma sanguină.
Proprietățile fizico-chimice ale proteinelor.
Una dintre principalele caracteristici ale proteinelor este lor greutate moleculară mare, care variază de la 6000 la câteva milioane de daltoni.
O altă proprietate fizico-chimică importantă a proteinelor este lor amfoter,adică prezența proprietăților atât acide, cât și bazice. Amfoteritatea este asociată cu prezența în compoziția unor aminoacizi a grupărilor carboxil libere, adică acide, și a grupărilor amino, adică alcaline. Acest lucru duce la faptul că într-un mediu acid proteinele prezintă proprietăți alcaline, iar într-un mediu alcalin sunt acide. Cu toate acestea, în anumite condiții, proteinele prezintă proprietăți neutre. Se numește valoarea pH-ului la care proteinele sunt neutre punct izoelectric. Punctul izoelectric pentru fiecare proteină este individual. Proteinele conform acestui indicator sunt împărțite în două clase mari - acide si alcaline deoarece punctul izoelectric poate fi deplasat fie într-o parte, fie în cealaltă.
O altă proprietate importantă a moleculelor proteice este solubilitate.În ciuda dimensiunilor moleculare mari, proteinele sunt destul de solubile în apă. În plus, soluțiile de proteine din apă sunt foarte stabile. Primul motiv pentru solubilitatea proteinelor este prezența unei sarcini pe suprafața moleculelor de proteine, din cauza căreia moleculele de proteine practic nu formează agregate insolubile în apă. Al doilea motiv pentru stabilitatea soluțiilor de proteine este prezența unui înveliș de hidrat (apă) în molecula de proteină. Învelișul de hidratare separă proteinele unele de altele.
A treia proprietate fizico-chimică importantă a proteinelor este sărare,adică capacitatea de a precipita sub acţiunea agenţilor de deshidratare. Sărarea este un proces reversibil. Această capacitate de a intra în soluție, apoi din ea este foarte importantă pentru manifestarea multor proprietăți vitale.
În cele din urmă, cea mai importantă proprietate a proteinelor este capacitatea lor de a denaturare.Denaturarea este pierderea nativității de către o proteină. Când facem omletă într-o tigaie, obținem o denaturare ireversibilă a proteinelor. Denaturarea este o încălcare permanentă sau temporară a structurii secundare și terțiare a proteinei, dar structura primară este păstrată. Pe lângă temperatură (peste 50 de grade), alți factori fizici pot provoca denaturarea: radiații, ultrasunete, vibrații, acizi puternici și alcalii. Denaturarea poate fi reversibilă sau ireversibilă. Cu impacturi mici, distrugerea structurilor secundare și terțiare ale proteinei are loc nesemnificativ. Prin urmare, în absența unui efect de denaturare, o proteină își poate restabili structura nativă. Procesul de denaturare inversă se numește renaturare.Cu toate acestea, cu expunere prelungită și puternică renaturarea devine imposibilă, iar denaturarea este astfel ireversibilă.
Înainte de a vorbi despre proprietățile proteinelor, merită să oferim o scurtă definiție a acestui concept. Acestea sunt substanțe organice cu molecul mare care constau din alfa-aminoacizi legați printr-o legătură peptidică. Proteinele sunt o parte importantă a nutriției umane și animale, deoarece nu toți aminoacizii sunt produși de organism - unii provin din alimente. Care sunt proprietățile și funcțiile lor?
Amfoter
Aceasta este prima caracteristică a proteinelor. Amfoter se referă la capacitatea lor de a prezenta proprietăți atât acide, cât și bazice.
Proteinele în structura lor au mai multe tipuri de grupări chimice care sunt capabile să ionizeze într-o soluție de H 2 O. Acestea includ:
- reziduuri carboxil. Acizi glutamic și aspartic, mai exact.
- grupări care conţin azot. gruparea ε-amino a lizinei, restul de arginină CNH(NH2) și restul imidazol al unui alfa-aminoacid heterociclic numit histidină.
Fiecare proteină are o astfel de caracteristică ca punct izoelectric. Acest concept este înțeles ca aciditatea mediului la care suprafața sau molecula nu are o sarcină electrică. În astfel de condiții, hidratarea și solubilitatea proteinelor sunt minimizate.
Indicatorul este determinat de raportul dintre reziduurile de aminoacizi bazice și acide. În primul caz, punctul cade pe regiunea alcalină. În al doilea - acru.

Solubilitate
Conform acestei proprietăți, proteinele sunt împărțite într-o mică clasificare. Iată care sunt acestea:
- Solubil. Se numesc albumine. Sunt puțin solubile în soluții saline concentrate și se coagulează când sunt încălzite. Această reacție se numește denaturare. Greutatea moleculară a albuminelor este de aproximativ 65 000. Ele nu conțin carbohidrați. Iar substanțele care constau din albumină se numesc albuminoizi. Acestea includ albușul de ou, semințele de plante și serul de sânge.
- insolubil. Se numesc scleroproteine. Un exemplu izbitor este cheratina, o proteină fibrilă cu rezistență mecanică a doua numai după chitina. Din această substanță sunt compuse unghiile, părul, rampa de ciocuri și pene de păsări, precum și coarne de rinocer. Acest grup de proteine include și citocheratine. Acesta este materialul structural al filamentelor intracelulare ale citoscheletului celulelor epiteliale. O altă proteină insolubilă este o proteină fibrilă numită fibroină.
- hidrofil. Ei interacționează activ cu apa și o absorb. Acestea includ proteine ale substanței intercelulare, nucleu și citoplasmă. Inclusiv fibroină și cheratina notorie.
- hidrofob. Ele resping apa. Acestea includ proteine care sunt componente ale membranelor biologice.

Denaturarea
Acesta este denumirea procesului de modificare a unei molecule proteice sub influența anumitor factori destabilizatori. Secvența de aminoacizi rămâne aceeași. Dar proteinele își pierd proprietățile naturale (hidrofilitate, solubilitate și altele).
Trebuie remarcat faptul că orice modificare semnificativă a condițiilor externe poate duce la încălcări ale structurilor proteinelor. Cel mai adesea, denaturarea este provocată de creșterea temperaturii, precum și de efectul alcalinelor, al acidului puternic, al radiațiilor, al sărurilor de metale grele și chiar al anumitor solvenți asupra proteinei.
Interesant este că adesea denaturarea duce la faptul că particulele de proteine sunt agregate în altele mai mari. Un prim exemplu este, de exemplu, omletă. La urma urmei, toată lumea este familiarizată cu modul în care, în procesul de prăjire, proteina se formează dintr-un lichid transparent.
Ar trebui să vorbiți și despre un astfel de fenomen precum renaturarea. Acest proces este inversul denaturarii. În timpul acesteia, proteinele revin la structura lor naturală. Și chiar este posibil. Un grup de chimiști din SUA și Australia au găsit o modalitate de a reface un ou fiert tare. Va dura doar câteva minute. Și acest lucru va necesita uree (diamida acidului carbonic) și centrifugare.
Structura
Trebuie spus separat, întrucât vorbim despre importanța proteinelor. În total, există patru niveluri de organizare structurală:
- Primar. Se înțelege secvența resturilor de aminoacizi dintr-un lanț polipeptidic. Caracteristica principală sunt motivele conservatoare. Acestea sunt combinații stabile de reziduuri de aminoacizi. Se găsesc în multe proteine complexe și simple.
- Secundar. Aceasta se referă la ordonarea unui fragment local al lanțului polipeptidic, care este stabilizat prin legături de hidrogen.
- Terţiar. Aceasta este structura spațială a lanțului polipeptidic. Acest nivel este format din câteva elemente secundare (sunt stabilizate tipuri diferite interacțiuni, unde hidrofobe sunt cele mai importante). Aici, legăturile ionice, de hidrogen, covalente sunt implicate în stabilizare.
- Cuaternar. Se mai numește și domeniu sau subunitate. Acest nivel este format din poziție relativă lanțuri de polipeptide ca parte a unui întreg complex proteic. Este interesant că proteinele cu structură cuaternară includ nu numai lanțuri de polipeptide identice, ci și diferite.
Această diviziune a fost propusă de un biochimist danez pe nume K. Lindstrom-Lang. Și chiar dacă este considerat învechit, ei continuă să-l folosească.

Tipuri de clădiri
Vorbind despre proprietățile proteinelor, trebuie remarcat și faptul că aceste substanțe sunt împărțite în trei grupe în funcție de tipul de structură. Și anume:
- proteine fibrilare. Au o structură filamentoasă alungită și o greutate moleculară mare. Cele mai multe dintre ele sunt insolubile în apă. Structura acestor proteine este stabilizată prin interacțiunile dintre lanțurile polipeptidice (acestea sunt formate din cel puțin două resturi de aminoacizi). Substanțele fibrilare sunt cele care formează polimerul, fibrilele, microtubulii și microfilamentele.
- proteine globulare. Tipul structurii determină solubilitatea lor în apă. DAR forma generala moleculele sunt sferice.
- proteine membranare. Structura acestor substanţe este caracteristică interesantă. Au domenii care traversează membrana celulară, dar părți din ele ies în citoplasmă și în mediul extracelular. Aceste proteine joacă rolul de receptori - transmit semnale și sunt responsabile de transportul transmembranar al nutrienților. Este important de reținut că sunt foarte specifice. Fiecare proteină trece doar o anumită moleculă sau semnal.
Simplu
De asemenea, puteți spune puțin mai multe despre ele. Proteinele simple constau numai din lanțuri de polipeptide. Acestea includ:
- Protamina. Proteine nucleare cu greutate moleculară mică. Prezența sa este protecția ADN-ului de acțiunea nucleazelor - enzime care atacă acizii nucleici.
- Histones. Proteine simple puternic de bază. Sunt concentrate în nucleele celulelor vegetale și animale. Ei participă la „ambalarea” catenelor de ADN din nucleu și, de asemenea, la procese precum repararea, replicarea și transcripția.
- Albumine. Ele au fost deja menționate mai sus. Cele mai cunoscute albumine sunt serul și oul.
- Globulina. Participă la coagularea sângelui, precum și la alte reacții imune.
- Prolaminele. Acestea sunt proteine de depozitare a cerealelor. Numele lor sunt întotdeauna diferite. În grâu se numesc ptialine. Orzul are hordeine. Ovăzul are avsnins. Interesant este că prolaminele sunt împărțite în propriile lor clase de proteine. Există doar două dintre ele: bogat în S (cu conținut de sulf) și sărac în S (fără acesta).

Complex
Dar proteinele complexe? Conțin grupe protetice sau cele fără aminoacizi. Acestea includ:
- Glicoproteine. Acestea conțin reziduuri de carbohidrați cu o legătură covalentă. Aceste proteine complexe sunt cele mai importante componentă structurală membranele celulare. Acestea includ, de asemenea, mulți hormoni. Și glicoproteinele membranelor eritrocitare determină grupa sanguină.
- Lipoproteinele. Sunt formate din lipide (substanțe asemănătoare grăsimilor) și joacă rolul de „transport” al acestor substanțe în sânge.
- Metaloproteine. Aceste proteine din organism sunt de mare importanță, deoarece fără ele schimbul de fier nu are loc. Moleculele lor conțin ioni metalici. Și reprezentanții tipici ai acestei clase sunt transferrina, hemosiderina și feritina.
- Nucleoproteine. Ele constau din RKN și ADN care nu au o legătură covalentă. Un reprezentant proeminent este cromatina. În compoziția sa se realizează informația genetică, ADN-ul este reparat și replicat.
- Fosfoproteine. Sunt resturi de acid fosforic legate covalent. Un exemplu este cazeina, care se găsește inițial în lapte sub formă de sare de calciu (sub formă legată).
- Cromoproteinele. Au o structură simplă: o proteină și o componentă colorată aparținând grupului protetic. Ei iau parte la respirația celulară, fotosinteză, reacții redox etc. De asemenea, fără cromoproteine, nu are loc acumularea de energie.
Metabolism
S-au spus deja multe despre proprietățile fizico-chimice ale proteinelor. Trebuie menționat și rolul lor în metabolism.
Există aminoacizi care sunt indispensabili deoarece nu sunt sintetizați de organismele vii. Mamiferele înseși le obțin din alimente. În procesul de digestie, proteina este distrusă. Acest proces începe cu denaturarea atunci când este introdus mediu acid. Apoi - hidroliza, la care participă enzimele.
Anumiți aminoacizi pe care organismul îi primește în cele din urmă sunt implicați în procesul de sinteză a proteinelor, ale căror proprietăți sunt necesare pentru existența sa deplină. Iar restul este procesat în glucoză - o monozaharidă, care este una dintre principalele surse de energie. Proteinele sunt foarte importante în ceea ce privește dietele sau înfometarea. Dacă nu vine cu mâncare, organismul va începe să „mănânce singur” - să-și proceseze propriile proteine, în special proteinele musculare.

Biosinteza
Având în vedere proprietățile fizico-chimice ale proteinelor, este necesar să ne concentrăm pe un subiect precum biosinteza. Aceste substanțe se formează pe baza informațiilor care sunt codificate în gene. Orice proteină este o secvență unică de resturi de aminoacizi determinată de gena care o codifică.
Cum se întâmplă asta? O genă care codifică o proteină transferă informații de la ADN la ARN. Aceasta se numește transcripție. În cele mai multe cazuri, sinteza are loc apoi pe ribozomi - acesta este cel mai important organel al unei celule vii. Acest proces se numește traducere.
Există și așa-numita sinteză non-ribozomală. De asemenea, merită menționat, întrucât vorbim despre importanța proteinelor. Acest tip de sinteză se observă la unele bacterii și ciuperci inferioare. Procesul se desfășoară printr-un complex proteic cu greutate moleculară mare (cunoscut sub numele de NRS sintază), iar ribozomii nu iau parte la aceasta.
Și, desigur, există și sinteza chimică. Poate fi folosit pentru a sintetiza proteine scurte. Pentru aceasta se folosesc metode precum ligatura chimică. Acesta este opusul biosintezei notorii pe ribozomi. Aceeași metodă poate fi folosită pentru a obține inhibitori ai anumitor enzime.
În plus, datorită sintezei chimice, este posibil să se introducă în compoziția proteinelor acele reziduuri de aminoacizi care nu se găsesc în substanțele obișnuite. Să spunem cei ale căror lanțuri laterale au etichete fluorescente.
De menționat că metodele de sinteză chimică nu sunt perfecte. Există anumite restricții. Dacă proteina conține mai mult de 300 de reziduuri, atunci substanța sintetizată artificial este probabil să primească o structură incorectă. Și acest lucru va afecta proprietățile.

Substanțe de origine animală
Ele trebuie luate în considerare Atentie speciala. Proteina animală este o substanță care se găsește în ouă, carne, produse lactate, păsări de curte, fructe de mare și pește. Conțin toți aminoacizii necesare organismului, inclusiv 9 de neînlocuit. Aici întreaga linie Cele mai importante funcții pe care le îndeplinește proteinele animale:
- Cataliza multor reacții chimice. Această substanță le lansează și le accelerează. Proteinele enzimatice sunt „responsabile” de acest lucru. Dacă organismul nu primește suficient din ele, atunci oxidarea și reducerea, conectarea și ruperea legăturilor moleculare, precum și transportul substanțelor nu vor continua pe deplin. Interesant este că doar o mică parte din aminoacizi intră în diferite tipuri de interacțiuni. Și o cantitate și mai mică (3-4 reziduuri) este direct implicată în cataliză. Toate enzimele sunt împărțite în șase clase - oxidoreductaze, transferaze, hidrolaze, lazaze, izomeraze, ligaze. Fiecare dintre ei este responsabil pentru o anumită reacție.
- Formarea citoscheletului care formează structura celulelor.
- Protecție imună, chimică și fizică.
- Transportul componentelor importante necesare creșterii și dezvoltării celulelor.
- Transmiterea impulsurilor electrice care sunt importante pentru funcționarea întregului organism, deoarece fără ele interacțiunea celulelor este imposibilă.
Și acestea nu sunt toate funcțiile posibile. Dar chiar și așa, semnificația acestor substanțe este clară. Sinteza proteinelor în celule și în organism este imposibilă dacă o persoană nu își mănâncă sursele. Si sunt carne de curcan, vita, miel, iepure. O mulțime de proteine se găsesc în ouă, smântână, iaurt, brânză de vaci, lapte. De asemenea, puteți activa sinteza proteinelor în celulele corpului adăugând în alimentație șuncă, organe, cârnați, tocană și vițel.
Și sunt unul dintre cei mai complexe ca structură și compoziție dintre toți compușii organici.
Rolul biologic proteine este excepțional de mare: ele constituie cea mai mare parte a protoplasmei și a nucleelor celulelor vii. Substante proteiceîntâlnită în toate organismele vegetale și animale. Rezerva de proteine din natură poate fi judecată după cantitatea totală de materie vie de pe planeta noastră: masa proteinelor este de aproximativ 0,01% din masa scoarței terestre, adică 10 16 tone.
Veverițe prin compoziția lor elementară se deosebesc de carbohidrați și grăsimi: pe lângă carbon, hidrogen și oxigen, conțin și azot. În plus, permanent parte integrantă cei mai importanți compuși proteici este sulful, iar unele proteine conțin fosfor, fier și iod.
Proprietăți proteice
1. Solubilitate diferită în apă. Proteinele solubile formează soluții coloidale.
2. Hidroliza - sub actiunea solutiilor de acizi minerali sau enzime se produce distrugerea structura primară a proteineiși formarea unui amestec de aminoacizi.
3. Denaturarea- distrugerea parțială sau completă a structurii spațiale inerente unei molecule proteice date. Denaturarea are loc sub influența:
- - temperatura ridicata
- - solutii de acizi, alcaline si solutii sarate concentrate
- - solutii de saruri ale metalelor grele
- - niste materie organică(formaldehidă, fenol)
- - radiatii radioactive
Structura proteinelor
Structura proteinelor a început să studieze în secolul al XIX-lea. În 1888 Biochimistul rus A.Ya.Danilevsky a sugerat prezența unei legături amidice în proteine. Această idee a fost dezvoltată în continuare de chimistul german E. Fischer și a găsit confirmare experimentală în lucrările sale. S-a oferit polipeptidă teoria structurală veveriţă. Conform acestei teorii, o moleculă de proteină constă dintr-un lanț lung sau mai multe lanțuri polipeptidice legate între ele. Astfel de lanțuri pot fi de diferite lungimi.
Fisher ținea un mare munca experimentala Cu polipeptide. Polipeptidele superioare care conțin 15-18 aminoacizi sunt precipitate din soluții cu sulfat de amoniu (alaun de amoniu), adică prezintă proprietăți caracteristice proteine. S-a demonstrat că polipeptidele sunt scindate de aceleași enzime ca și proteinele, iar atunci când sunt introduse în corpul unui animal, ele suferă aceleași transformări ca și proteinele, iar tot azotul lor este eliberat în mod normal sub formă de uree (uree).
Cercetările efectuate în secolul al XX-lea au arătat că există mai multe niveluri de organizare moleculă proteică.

Există mii de proteine diferite în corpul uman și aproape toate sunt construite dintr-un set standard de 20 de aminoacizi. Secvența reziduurilor de aminoacizi dintr-o moleculă de proteină se numește structura primara veveriţă. Proprietăți proteice iar funcţiile lor biologice sunt determinate de secvenţa de aminoacizi. Lucrare de clarificare structura primară a proteinei au fost efectuate pentru prima dată la Universitatea din Cambridge pe exemplul uneia dintre cele mai simple proteine - insulină . Pe parcursul a 10 ani, biochimistul englez F. Senger a analizat insulină. În urma analizei, s-a constatat că molecula insulină este format din două lanțuri polipeptidice și conține 51 de resturi de aminoacizi. El a descoperit că insulina are o masă molară de 5687 g/mol, iar compoziția sa chimică corespunde formulei C 254 H 337 N 65 O 75 S 6 . Analiza a fost efectuată manual folosind enzime care hidrolizează selectiv legăturile peptidice dintre anumite resturi de aminoacizi.
În prezent, majoritatea lucrează pe definiție structura primară a proteinelor automatizate. Deci structura primară a enzimei a fost stabilită lizozimă.
Tipul de „stivuire” a lanțului polipeptidic se numește structură secundară. Cel mai proteine lanțul polipeptidic se înfășoară într-o spirală asemănătoare unui „arc întins” (numit „A-helix” sau „A-structură”). Un alt tip comun de structură secundară este structura foii pliate (denumită „structură B”). Asa de, proteine de mătase - fibroină are exact această structură. Este format dintr-o serie de lanțuri polipeptidice care sunt paralele între ele și sunt conectate prin legături de hidrogen, număr mare ceea ce face ca matasea sa fie foarte flexibila si rezistenta la rupere. Cu toate acestea, practic nu există proteine ale căror molecule au 100% „structură A” sau „structură B”.
 Proteina fibroină - proteină naturală de mătase
Proteina fibroină - proteină naturală de mătase Poziția spațială a lanțului polipeptidic se numește structura terțiară a proteinei. Majoritatea proteinelor sunt clasificate ca globulare deoarece moleculele lor sunt pliate în globule. Proteina menține această formă datorită legăturilor dintre ionii încărcați diferit (-COO - și -NH 3 + și punți disulfură. În plus, moleculă proteică pliate astfel încât lanțurile hidrocarburice hidrofobe să fie în interiorul globului, iar cele hidrofile în exterior.
Se numește metoda de combinare a mai multor molecule de proteine într-o singură macromoleculă structura proteinelor cuaternare. Un bun exemplu al unei astfel de proteine este hemoglobină. S-a constatat că, de exemplu, pentru un adult, molecula hemoglobină constă din 4 lanțuri polipeptidice separate și o parte neproteică - hem.
Proprietăți proteice explică diferitele lor structuri. Majoritatea proteinelor sunt amorfe, insolubile în alcool, eter și cloroform. În apă, unele proteine se pot dizolva pentru a forma o soluție coloidală. Multe proteine sunt solubile în soluții alcaline, unele în soluții sărate și altele în alcool diluat. Starea cristalină a alburilor este rară: un exemplu sunt boabele de aleurone găsite în boabele de ricin, dovleci și cânepă. de asemenea, cristalizează albumină ou de gaina si hemoglobinăîn sânge.
Hidroliza proteinelor
Când sunt fierte cu acizi sau alcaline, precum și sub acțiunea enzimelor, proteinele se descompun în compuși chimici mai simpli, formând un amestec de A-aminoacizi la sfârșitul lanțului de transformare. O astfel de divizare se numește hidroliza proteinelor. Hidroliza proteinelor are un mare semnificație biologică: ajungând în stomacul și intestinele unui animal sau unei persoane, proteina este descompusă prin acțiunea enzimelor în aminoacizi. Aminoacizii rezultați, sub influența enzimelor, formează din nou proteine, dar deja caracteristice acestui organism!
În produse hidroliza proteinelor pe lângă aminoacizi, s-au găsit carbohidrați, acid fosforic și baze purinice. Sub influența unor factori, de exemplu, încălzirea, soluțiile de săruri, acizi și alcalii, acțiunea radiațiilor, agitarea, structura spațială inerentă unei anumite molecule de proteine poate fi perturbată. Denaturarea poate fi reversibilă sau ireversibilă, dar în orice caz, secvența de aminoacizi, adică structura primară, rămâne neschimbată. Ca urmare a denaturarii, proteina inceteaza sa-si indeplineasca functiile biologice.
Pentru proteine se cunosc unele reacții de culoare care sunt caracteristice pentru detectarea lor. Când ureea este încălzită, se formează biuretul care, cu o soluție de sulfat de cupru în prezența alcaline, dă o culoare violetă sau o reacție calitativă pentru proteine, care se poate face acasă). Reacția biuretului este produsă de substanțe care conțin o grupare amidă, iar această grupă este prezentă în molecula proteică. Reacția xantoproteină este aceea că proteina din concentrat acid azotic vopsit în galben. Această reacție indică prezența unei grupări benzen în proteină, care se găsește în aminoacizi precum fenilalanina și tirozină.
Când este fiert cu o soluție apoasă de azotat de mercur și acid azotat, proteina dă o culoare roșie. Această reacție indică prezența tirozinei în proteină. În absența tirozinei, nu apare colorația roșie.