Unde se folosește siliciul în industrie. Siliciu: aplicație, proprietăți chimice și fizice
Citeste si
Siliciu (Si) - se află în perioada 3, grupa IV a subgrupului principal al sistemului periodic. Proprietăți fizice: siliciul există în două modificări: amorf și cristalin. Siliciul amorf este o pulbere maro cu o densitate de 2,33 g/cm3, care se dizolvă în topituri de metal. Siliciul cristalin sunt cristale de întuneric culoarea gri, cu un luciu de otel, dur si casant, cu o densitate de 2,4 g/cm3. Siliciul este format din trei izotopi: Si (28), Si (29), Si (30).
Proprietăți chimice: configuratie electronica: 1s22s22p63 s23p2 . Siliciul este un nemetal. La nivel de energie externă, siliciul are 4 electroni, ceea ce îi determină stările de oxidare: +4, -4, -2. Valenta - 2, 4. Siliciul amorf are o reactivitate mai mare decat cristalinul. În condiții normale, interacționează cu fluorul: Si + 2F2 = SiF4. La 1000 °C, Si reacționează cu nemetale: cu CL2, N2, C, S.
Dintre acizi, siliciul interacționează numai cu un amestec de acizi azotic și fluorhidric:
În ceea ce privește metalele, se comportă diferit: se dizolvă bine în Zn, Al, Sn, Pb topit, dar nu reacționează cu acestea; cu alte topituri de metale - cu Mg, Cu, Fe, siliciu interactioneaza cu formarea siliciurilor: Si + 2Mg = Mg2Si. Siliciul arde în oxigen: Si + O2 = SiO2 (nisip).
Dioxid de siliciu sau silice- conexiune stabilă Si, este larg răspândit în natură. Reacționează prin fuziunea sa cu alcalii, oxizi bazici, formând săruri ale acidului silicic - silicați. Chitanță:în industria siliciului formă pură obţinut prin reducerea dioxidului de siliciu cu cocs în cuptoare electrice: SiO2 + 2С = Si + 2СO?.
În laborator, siliciul se obține prin calcinarea nisipului alb cu magneziu sau aluminiu:
SiO2 + 2Mg = 2MgO + Si.
3SiO2 + 4Al = Al2O3 + 3Si.
Siliciul formează acizi: H2 SiO3 - acid meta-silicic; H2 Si2O5 este doi acid metasilicic.
Găsirea în natură: mineral de cuarț - SiO2. Cristalele de cuarț au forma unei prisme hexagonale, incolore și transparente, numită cristal de stâncă. Ametist - cristal de stâncă, vopsit violet cu impurități; topazul fumuriu este vopsit maroniu; agatul și jaspul sunt soiuri cristaline de cuarț. Silicea amorfă este mai puțin comună și există sub formă de opal mineral, SiO2 nH2O. Pământul de diatomee, tripolitul sau kieselguhr (pământul de diatomee) sunt forme pământoase de siliciu amorf.
42. Conceptul de soluții coloidale
Soluții coloidale– sisteme bifazate foarte dispersate constând dintr-un mediu de dispersie și o fază dispersată. Dimensiunile particulelor sunt intermediare între soluțiile, suspensiile și emulsiile adevărate. La particule coloidale compoziție moleculară sau ionică.
Există trei tipuri de structură internă a particulelor primare.
1. Suspensoizi (sau coloizi ireversibili)– sisteme eterogene, ale căror proprietăți pot fi determinate de o suprafață interfacială dezvoltată. În comparație cu suspensiile, acestea sunt mai dispersate. Ele nu pot exista mult timp fără un stabilizator de dispersie. Ei sunt numiti, cunoscuti coloizi ireversibili datorită faptului că precipitarea lor după evaporare din nou nu formează soluri. Concentrația lor este scăzută - 0,1%. Ele diferă ușor de vâscozitatea mediului dispersat.
Se pot obține suspensoizi:
1) metode de dispersie (macinarea corpurilor mari);
2) metode de condensare (obținerea compușilor insolubili prin reacții de schimb, hidroliză etc.).
Scăderea spontană a dispersiei în suspensoizi depinde de energia de suprafață liberă. Pentru a obține o suspensie de lungă durată sunt necesare condiții pentru stabilizarea acesteia.
Sisteme de dispersie stabile:
1) mediu de dispersie;
2) fază dispersată;
3) stabilizator al sistemului dispersat.
Stabilizatorul poate fi ionic, molecular, dar cel mai adesea cu un nivel molecular ridicat.
Coloizi de protecție- compuși macromoleculari care se adaugă pentru stabilizare (proteine, peptide, alcool polivinilic etc.).
2. Asociativi (sau coloizi micelari) - semicoloizi care apar la o concentrație suficientă de molecule constând din radicali de hidrocarburi (molecule amfifile) de substanțe cu greutate moleculară mică în timpul asocierii lor în agregate de molecule (micele). Micele se formează în soluții apoase de detergenți (săpunuri), coloranți organici.
3. Coloizi moleculari (coloizi reversibili sau liofili) - substanțe naturale și sintetice cu greutate moleculară mare. Moleculele lor au dimensiunea particulelor coloidale (macromolecule).
Soluțiile diluate de coloizi ai compușilor macromoleculari sunt soluții omogene. Când sunt puternic diluate, aceste soluții respectă legile soluțiilor diluate.
Macromoleculele nepolare se dizolvă în hidrocarburi, cele polare - în solvenți polari.
Coloizi reversibile- substanțe, al căror reziduu uscat, atunci când se adaugă o nouă porțiune de solvent, intră din nou în soluție.
Caracteristica elementului
14 Si 1s 2 2s 2 2p 6 3s 2 3p 2
Izotopi: 28 Si (92,27%); 29Si (4,68%); 30 Si (3,05%)
Siliciul este al doilea element cel mai abundent din scoarța terestră după oxigen (27,6% din masă). Nu se găsește în natură în stare liberă, se găsește în principal sub formă de SiO 2 sau silicați.
Compușii Si sunt toxici; inhalare cele mai mici particule SiO 2 și alți compuși de siliciu (de exemplu, azbest) cauze boala periculoasa- silicoza
În starea fundamentală, atomul de siliciu are o valență = II, iar în stare excitată = IV.
Cea mai stabilă stare de oxidare a Si este +4. În compușii cu metale (siliciuri), S.O. -patru.
Metode de obținere a siliciului
Cel mai comun compus natural de siliciu este siliciul (dioxid de siliciu) SiO 2 . Este principala materie primă pentru producția de siliciu.
1) Recuperarea SiO 2 cu carbon în cuptoare cu arc la 1800 "C: SiO 2 + 2C \u003d Si + 2CO
2) Si de înaltă puritate dintr-un produs tehnic se obține conform schemei:
a) Si → SiCl 2 → Si
b) Si → Mg 2 Si → SiH 4 → Si
Proprietățile fizice ale siliciului. Modificări alotropice ale siliciului
1) Siliciu cristalin - o substanță de culoare gri-argintiu cu un luciu metalic, o rețea cristalină de tip diamant; p.p. 1415"C, p.p. 3249"C, densitate 2,33 g/cm3; este un semiconductor.
2) Siliciu amorf - pulbere maro.
Proprietățile chimice ale siliciului
În majoritatea reacțiilor, Si acționează ca un agent reducător:
La temperaturi scăzute Siliciul este inert din punct de vedere chimic; atunci când este încălzit, reactivitatea acestuia crește brusc.
1. Interacționează cu oxigenul la T peste 400°C:
Si + O 2 \u003d SiO 2 oxid de siliciu
2. Reacționează cu fluorul deja la temperatura camerei:
Si + 2F2 = SiF4 tetrafluorura de siliciu
3. Reacțiile cu alți halogeni au loc la o temperatură = 300 - 500 ° C
Si + 2Hal 2 = SiHal 4
4. Cu vaporii de sulf la 600 ° C formează o disulfură:
5. Reacția cu azotul are loc peste 1000°C:
3Si + 2N 2 = Si 3 N 4 nitrură de siliciu
6. La o temperatură = 1150°С reacţionează cu carbonul:
SiO 2 + 3C \u003d SiC + 2CO
Carborundum este aproape de diamant în duritate.
7. Siliciul nu reacționează direct cu hidrogenul.
8. Siliciul este rezistent la acizi. Interacționează numai cu un amestec de acizi azotic și fluorhidric (fluorhidric):
3Si + 12HF + 4HNO 3 = 3SiF 4 + 4NO + 8H 2 O
9. reacționează cu soluțiile alcaline pentru a forma silicați și eliberează hidrogen:
Si + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 2H 2
10. Proprietățile reducătoare ale siliciului sunt folosite pentru a izola metalele de oxizii lor:
2MgO \u003d Si \u003d 2Mg + SiO 2
În reacțiile cu metale, Si este un agent oxidant:
Siliciul formează siliciuri cu metalele s și majoritatea metalelor d.
Compoziția siliciurilor metalul dat poate fi diferit. (De exemplu, FeSi și FeSi 2; Ni 2 Si și NiSi 2.) Una dintre cele mai cunoscute siliciuri este siliciura de magneziu, care poate fi obținut prin interacțiunea directă a unor substanțe simple:
2Mg + Si = Mg2Si
Silan (monosilan) SiH 4
Silani (hidrogeni de siliciu) Si n H 2n + 2, (comparați cu alcanii), unde n \u003d 1-8. Silanii - analogi ai alcanilor, diferă de aceștia prin instabilitatea lanțurilor -Si-Si-.
Monosilanul SiH 4 este un gaz incolor cu miros urât; solubil în etanol, benzină.
Modalități de a obține:
1. Descompunerea siliciurului de magneziu cu acid clorhidric: Mg 2 Si + 4HCI = 2MgCI 2 + SiH 4
2. Reducerea halogenurilor de Si cu hidrură de litiu aluminiu: SiCl 4 + LiAlH 4 = SiH 4 + LiCl + AlCl 3
Proprietăți chimice.
Silanul este un agent reducător puternic.
1.SiH 4 este oxidat de oxigen chiar și la temperaturi foarte scăzute:
SiH 4 + 2O 2 \u003d SiO 2 + 2H 2 O
2. SiH 4 este ușor hidrolizat, mai ales într-un mediu alcalin:
SiH 4 + 2H 2 O \u003d SiO 2 + 4H 2
SiH 4 + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 4H 2
Oxid de siliciu (IV) (silice) SiO2
Siliciul există sub formă diferite forme: cristalin, amorf si sticlos. Cea mai comună formă cristalină este cuarțul. Când rocile de cuarț sunt distruse, se formează nisipuri de cuarț. Monocristalele de cuarț sunt transparente, incolore (cristal de rocă) sau colorate cu impurități în diverse culori (ametist, agat, jasp etc.).
SiO 2 amorf apare sub forma opalului mineral: gelul de silice se obtine artificial, format din particule de SiO 2 coloidale si fiind un foarte bun adsorbant. SiO 2 sticlos este cunoscut sub numele de sticlă de cuarț.
Proprietăți fizice
În apă, SiO 2 se dizolvă foarte puțin, în solvenți organici practic nu se dizolvă. Siliciul este un dielectric.
Proprietăți chimice
1. SiO 2 este un oxid acid, prin urmare silicea amorfă se dizolvă încet în soluții apoase de alcalii:
SiO2 + 2NaOH \u003d Na2SiO3 + H2O
2. SiO 2 interacționează și atunci când este încălzit cu oxizi bazici:
SiO 2 + K 2 O \u003d K 2 SiO 3;
SiO 2 + CaO \u003d CaSiO 3
3. Fiind un oxid nevolatil, SiO 2 înlocuiește dioxidul de carbon din Na 2 CO 3 (în timpul fuziunii):
SiO 2 + Na 2 CO 3 \u003d Na 2 SiO 3 + CO 2
4. Siliciul reacţionează cu acidul fluorhidric, formând acid hidrofluorosilic H 2 SiF 6:
SiO 2 + 6HF \u003d H 2 SiF 6 + 2H 2 O
5. La 250 - 400 ° C, SiO 2 interacționează cu HF gazos și F 2, formând tetrafluorosilan (tetrafluorura de siliciu):
SiO 2 + 4HF (gaz.) \u003d SiF 4 + 2H 2 O
SiO 2 + 2F 2 \u003d SiF 4 + O 2
Acizi silicici
Cunoscut:
acid ortosilicic H4Si04;
Acid metasilicic (silicic) H2Si03;
Acizi di- și polisilicici.
Toți acizii silicici sunt puțin solubili în apă și formează cu ușurință soluții coloidale.
Modalități de a primi
1. Precipitarea de către acizi din soluții de silicați de metale alcaline:
Na 2 SiO 3 + 2HCl \u003d H 2 SiO 3 ↓ + 2NaCl
2. Hidroliza clorosilanilor: SiCl 4 + 4H 2 O \u003d H 4 SiO 4 + 4HCl
Proprietăți chimice
Acizii silicici sunt acizi foarte slabi (mai slabi decât acidul carbonic).
Când sunt încălzite, se deshidratează pentru a forma silice ca produs final.
H4SiO4 → H2SiO3 → SiO2
Silicati - saruri ale acizilor silicici
Deoarece acizii silicici sunt extrem de slabi, sărurile lor din soluții apoase sunt puternic hidrolizate:
Na 2 SiO 3 + H 2 O \u003d NaHSiO 3 + NaOH
SiO 3 2- + H 2 O \u003d HSiO 3 - + OH - (mediu alcalin)
Din același motiv, la trecere dioxid de carbon Acidul silic este îndepărtat din ele prin soluții de silicați:
K 2 SiO 3 + CO 2 + H 2 O \u003d H 2 SiO 3 ↓ + K 2 CO 3
SiO 3 + CO 2 + H 2 O \u003d H 2 SiO 3 ↓ + CO 3
Această reacție poate fi considerată o reacție calitativă pentru ionii de silicat.
Dintre silicați, doar Na 2 SiO 3 și K 2 SiO 3 sunt foarte solubili, care se numesc sticlă solubilă, iar soluțiile lor apoase sunt sticla lichida.
Sticlă
Geamul obișnuit are compoziția Na 2 O CaO 6SiO 2, adică este un amestec de silicați de sodiu și calciu. Se obține prin topirea sodă Na 2 CO 3 , CaCO 3 calcar și SiO 2 nisip;
Na 2 CO 3 + CaCO 3 + 6SiO 2 \u003d Na 2 O CaO 6SiO 2 + 2CO 2
Ciment
Un material liant sub formă de pulbere care, atunci când interacționează cu apa, formează o masă de plastic, care în cele din urmă se transformă într-un corp solid asemănător pietrei; materialul principal de construcție.
Compoziția chimică a celui mai comun ciment Portland (în% din greutate) - 20 - 23% SiO 2; 62 - 76% CaO; 4 - 7% Al203; 2-5% Fe203; 1-5% MgO.
Siliciu. Proprietățile fizice și chimice ale siliciului
Siliciul este un element al subgrupului principal al celui de-al patrulea grup al perioadei a treia a sistemului periodic de elemente chimice D.I. Mendeleev, cu număr atomic 14. Desemnat prin simbolul Si (lat. Siliciu), nemetal. Proprietăți fizice: siliciul cristalin are un luciu metalic, refractar, foarte dur, semiconductor. 2. Proprietăți chimice: siliciul este inactiv: a) la temperaturi ridicate (400-600
- b) din substante complexe, siliciul reactioneaza cu alcalii
- c) reacţionează cu metalele pentru a forma siliciuri
Silice, proprietățile și aplicațiile sale. Silicati naturali si industriali. Utilizarea lor în construcții
Oxid de siliciu (IV). (dioxid de siliciu, silice SiO2) - cristale incolore, p.t. 1713--1728 ° C, au duritate și rezistență ridicate.
Dioxidul de siliciu este folosit la producerea sticlei, ceramicii, abrazivelor, produselor din beton, pentru obtinerea de siliciu, ca umplutura in productia de cauciuc, in productia de materiale refractare de silice, in cromatografie etc. Cristalele de cuart au proprietati piezoelectrice si de aceea sunt utilizat în inginerie radio, instalatii cu ultrasunete, la brichete. Dioxidul de siliciu este componenta principală a aproape tuturor rocilor terestre, în special, pământul de diatomee. Siliciul și silicații reprezintă 87% din masa litosferei. Dioxidul de siliciu amorf neporos este utilizat în industria alimentară ca excipient antiaglomerant și antiaglomerant E551, în parafarmaceutice (paste de dinți), în industria farmaceutică ca excipient (inclus în majoritatea Farmacopeilor), precum și ca aditiv alimentar. sau medicament ca enterosorbent. Filmele obținute artificial de dioxid de siliciu sunt folosite ca izolator în producția de microcircuite și alte componente electronice. Folosit și pentru producția de cabluri de fibră optică. Silice topită pură este utilizată cu adăugarea unor ingrediente speciale. Filamentul de silice este folosit și în elementele de încălzire ale țigărilor electronice, deoarece absoarbe bine lichidul și nu se prăbușește sub încălzirea bobinei. Cristalele mari de cuarț transparente sunt folosite ca pietre semiprețioase; cristalele incolore se numesc cristal de stâncă, violet - ametist, galben - citrin. În microelectronică, dioxidul de siliciu este unul dintre materialele principale. Este folosit ca strat izolator, precum și ca strat de protecție. Obținut sub formă de pelicule subțiri prin oxidarea termică a siliciului, depunerea chimică în vapori, pulverizarea cu magnetron. Dioxidul de siliciu SiO2 este un oxid acid care nu reacționează cu apa. Rezistent chimic la acizi, dar reacţionează cu acidul fluorhidric gazos
și acid fluorhidric:
Aceste două reacții sunt utilizate pe scară largă pentru gravarea sticlei. Când SiO2 este fuzionat cu alcalii și oxizi bazici, precum și cu carbonați ai metalelor active, se formează silicați - săruri ale acizilor silicici foarte slabi, insolubili în apă, cu formula generală xH2O ySiO2, care nu au o compoziție constantă (destul de des, nu acizii silicici sunt mentionati in literatura de specialitate, ci acidul silicic, desi de fapt vorbim de aceeasi substanta).
De exemplu, ortosilicatul de sodiu poate fi obținut:
metasilicat de calciu:
sau amestec de silicat de calciu și sodiu:
din silicat
Na2CaSi6O14 (Na2O CaO 6SiO2)
fabricarea geamurilor. Majoritatea silicaților nu au o compoziție permanentă. Dintre toți silicații, doar silicații de sodiu și potasiu sunt solubili în apă. Soluțiile acestor silicați în apă se numesc sticlă lichidă. Datorită hidrolizei, aceste soluții se caracterizează prin puternic mediu alcalin. Silicații hidrolizați se caracterizează prin formarea de soluții nu adevărate, ci coloidale. La acidificarea soluțiilor de silicați de sodiu sau de potasiu, precipită un precipitat alb gelatinos de acizi silicici hidratați. Principalul element structural atât al dioxidului de siliciu solid, cât și al tuturor silicaților este grupul în care atomul de siliciu Si este înconjurat de un tetraedru de patru atomi de oxigen O. În acest caz, fiecare atom de oxigen este conectat la doi atomi de siliciu. Fragmentele pot fi legate între ele în moduri diferite. Printre silicați, în funcție de natura legăturilor din ei, fragmentele sunt împărțite în insulă, lanț, panglică, stratificat, cadru și altele. Silicații sunt o clasă extinsă de compuși formați din dioxid de siliciu (silice) și oxizi ai altor elemente. SILICATII IN NATURA. Pentru a înțelege rolul silicaților în viața umană, să ne oprim mai întâi asupra structurii globului. Potrivit ideilor moderne, globul este format dintr-un număr de scoici. Învelișul exterior al Pământului, scoarța terestră sau litosfera, este format din scoici de granit și bazalt și un strat sedimentar subțire. Învelișul de granit constă în principal din granit - intercreșteri dense de feldspați, mică, amfiboli și piroxeni, iar învelișul de bazalt constă din roci de silicat asemănătoare granitului, dar mai grele, cum ar fi gabro, diabaze și bazalt. Rocile sedimentare se formează prin distrugerea altor roci sub influența condițiilor caracteristice suprafeței Pământului. O parte integrantă a stratului sedimentar sunt, în special, argile, a căror bază este caolinitul mineral silicat. Litosferă la 95 gr. % este format din silicati. Grosimea sa medie în regiunea continentelor este de 30-40 km. Apoi se află învelișul simatic, sau mantaua superioară, printre mineralele cărora, probabil, predomină silicații de fier și magneziu. Acest înveliș acoperă întregul glob și se extinde până la o adâncime de 1200 km. În plus, de la 1200 la 2900 km, există o carcasă intermediară. Compoziția sa este controversată, dar în ea se presupune și existența silicaților. Sub această înveliș, la o adâncime de 2900 până la 6370 km se află miezul. LA timpuri recente s-a sugerat că miezul are și o compoziție de silicați. La deplasarea de la suprafața Pământului în centrul său, densitatea și bazicitatea rocilor constitutive cresc (raportul dintre conținutul de oxizi metalici și siliciu crește), presiunea și temperatura. Cele mai vechi unelte au fost făcute de om din silex - un agregat dens de calcedonie, cuarț și opal (800-60 de mii de ani î.Hr.). Mai târziu, pentru aceasta a început să se folosească jasp, cristal de stâncă, agat, obsidian (sticlă de silicat vulcanic), jad.Nu există o taxonomie general acceptată (nomenclatură minerală) pentru mineralele silicate, denumirile lor provin cel mai adesea de la aspectul cristalelor, lor proprietățile fizice, locația sau numele omului de știință care le-a descoperit. Plagioclase în greacă înseamnă împărțit oblic, iar piroxenul înseamnă refractar, ceea ce corespunde proprietăților acestor minerale. Mineralele de cuarț, în funcție de natura impurităților, au o gamă largă de culori, ceea ce le determină denumirea: ametist - violet, citrin - galben, cristal de stâncă - gheață. Modificările mineralelor de silice și biotit stishovit și coezit au provenit din numele oamenilor de știință care le-au descoperit, S.M. Stishov, L. Coes și J.B. Bio, iar caolinitul mineral își ia numele de la muntele Kaoling din China, unde argila a fost extrasă de multă vreme pentru producția de porțelan. Silicații naturali și siliciul în sine joacă un rol important ca materii prime și produse finite în procesele industriale. Aluminosilicații - plagioclazele, feldspatul de potasiu și silicea sunt utilizați ca materii prime în industria ceramică, sticlei și cimentului. Pentru fabricarea produselor textile ignifuge și electroizolante (țesături, frânghii, frânghii), azbestul, legat de hidrosilicați - amfiboli, este utilizat pe scară largă. Unele tipuri de azbest sunt foarte rezistente la acizi și sunt utilizate în industria chimică. Biotitele, membri ai grupului micas, sunt folosite ca electrice și materiale termoizolanteîn construcţii şi instrumentare. Piroxenii sunt utilizați în industria metalurgică și turnarea pietrei, iar piroxenul LiAl este utilizat pentru obținerea litiului metalic. Piroxenii sunt parte integrantă zguri de furnal și zguri neferoase din metalurgie, care, la rândul lor, sunt, de asemenea, utilizate în economie nationala. Rocile precum granitele, bazalții, gabroul, diabazele sunt excelente materiale de construcție. SILICATI DE ORIGINE ARTIFICIALA. Fara materiale silicate - diferite feluri ciment, beton, beton de zgură, ceramică, sticlă, acoperiri sub formă de emailuri și glazuri, cu greu ne putem imagina viata de zi cu zi. Amploarea producției de materiale silicate pare a fi cifre impresionante. În articol nu vom atinge natura și aplicarea ochelarilor. Aceste aspecte au fost deja luate în considerare. Cele mai vechi materiale silicate sunt ceramice, obținute din argile și amestecurile lor cu diverși aditivi minerali, arse într-o stare asemănătoare pietrei. LA lumea antica produse ceramice au fost distribuite pe tot Pământul. Din a doua jumătatea anului XIX secolului și până în prezent, industria ceramică industrială a extins nemăsurat producția și gama de ceramică. Un exemplu de material silicat artificial este cimentul Portland, unul dintre cele mai comune tipuri de lianți minerali. Cimentul este folosit pentru a lega piesele de construcție pentru a produce blocuri de construcție masive, plăci, țevi și cărămizi. Cimentul este la baza unei astfel de utilizate pe scară largă materiale de construcții precum betonul, betonul de zgură, betonul armat. Construcția de orice scară nu poate exista fără ciment. La cursul școlar de chimie sunt date idei de bază despre compoziția chimică și tehnologia cimentului, așa că ne vom opri doar asupra unor detalii clarificatoare. În primul rând, clincherul de ciment este produsul arderii unui amestec de argilă și calcar, iar cimentul este clincher măcinat fin cu aditivi minerali care îi reglează proprietățile. Cimentul este folosit în amestec cu nisip și apă. Proprietățile sale astringente se datorează capacității mineralelor de ciment de a interacționa cu H2O și SiO2 și astfel să se întărească, formând o structură puternică asemănătoare pietrei. Când cimentul se înfundă, apar procese complexe: hidratarea mineralelor cu formarea de hidrosilicați și hidroaluminați, hidroliza, formarea soluțiilor coloidale și cristalizarea acestora. Cercetări privind procesele de întărire ciment mortar iar mineralele de clincher de ciment au jucat un rol important în dezvoltarea științei silicaților și a tehnologiei acestora. Șantierele noastre consumă cantități mari de ciment, cărămizi, scânduri de parament, gresie, țevi de canalizare, sticlă și diverse materiale de construcție naturale.
mineral siliconic siliciu o varietate de silice - negru, gri închis sau deschis - este destul de comună în natură, iar o persoană este bine familiarizată cu aceasta. Dar oh Proprietăți de vindecare siliciul a devenit cunoscut destul de recent: la sfârșitul anilor 70 ai secolului XX. Deși omenirea s-a familiarizat cu siliciul de foarte mult timp.
Flint este piatra care a marcat începutul civilizației umane. Pe tot parcursul epocii de piatră, silexul a servit ca material pentru fabricarea uneltelor și vânătoarea, focul a fost exploatat cu ajutorul lui. Proprietățile vindecătoare ale silexului sunt menționate în tratatele filozofilor antici. Era folosit pentru tăierea negilor, pentru decorarea pereților în încăperile în care se depozita carnea, pentru pudrarea rănilor sub formă de pulbere, care preveni cangrena, pietrele de mori de silex în mori făceau posibilă obținerea făinii cu calități excelente de copt și gust. Din cele mai vechi timpuri, fundul și suprafața interioară a fântânilor au fost căptușite cu silex, deoarece s-a observat că oamenii care beau apă din astfel de fântâni se îmbolnăvesc mai puțin, iar o astfel de apă este neobișnuit de limpede, gustoasă și vindecătoare.
În natură, siliciul apare sub formă de minerale larg distribuite - cuarț, calcedonie, opal si altele.Grupul acestor minerale include corneliană, și jasp, stras, agat, opal, ametist si multe alte pietre. Baza acestor minerale este dioxidul de siliciu sau silicea, dar densitatea, culoarea și alte proprietăți sunt diferite. Compoziția silexului, pe lângă silice, include aproximativ 20 de elemente chimice, dintre care principalele sunt Mg, Ca, P, Sr, Mn, Cu, Zn etc. De aici atâtea denumiri. Dar cel mai faimos dintre reprezentanții acestei familii este, fără îndoială, silexul. Cea mai mare parte a scoarței terestre este formată din compusi organici siliciu (28 vol.%).
Siliciu (Siliciu - lat.) element chimic, numar atomic 14, grupa IV a sistemului periodic. Atomii de siliciu formează baza argilei, nisipului și rocilor. Putem spune că întreaga lume anorganică este asociată cu siliciul. LA conditii naturale mineralele de siliciu se găsesc în calcit și cretă.
Siliciul este al doilea element cel mai abundent din scoarța terestră după oxigen și reprezintă aproximativ o treime din greutatea sa totală. Fiecare al șaselea atom din scoarța terestră este un atom de siliciu. Apa de mare conține și mai mult siliciu decât fosfor, care este atât de necesar pentru viața pe Pământ.
În corpul nostru, siliciul se găsește în glanda tiroida, glandele suprarenale, glanda pituitară. Cea mai mare concentrație se găsește în păr și unghii.
Siliciul face, de asemenea, parte din colagen, principala proteină din țesutul conjunctiv. Rolul său principal este participarea la o reacție chimică care ține împreună fibrele individuale de colagen și elastină, dând țesutului conjunctiv rezistență și elasticitate. Siliciul face parte și din colagenul părului și al unghiilor, joacă un rol important în fuziunea oaselor în fracturi.
Siliciul are un rol deosebit în viața și sănătatea oamenilor, precum și a florei și faunei. Siliciul este absorbit de plante sub formă de acizi silicici dizolvați, silicați și siliciu coloidal. Lipsa siliciului afectează negativ germinația, creșterea și randamentul cerealelor, în principal orezului, precum și a trestiei de zahăr, floarea soarelui, culturi precum cartofi, sfeclă, morcovi, castraveți și roșii. Cu legume, fructe, lapte, carne și alte produse, o persoană ar trebui să consume zilnic 10-20 mg de siliciu. Această cantitate este necesară pentru viața normală, creșterea și dezvoltarea organismului.
Cercetare științifică despre rolul siliciului pentru sănătatea umană sunt tratate în monografiile lui V. Krivenko și alții „Litoterapie”, M., 1994, E. Mikheeva „Proprietățile vindecătoare ale siliciului”, S-P, 2002, lucrările lui M. Voronkov și I Kuznetsov (AS URSS, Sib. otd., 1984), A. Panicheva, L. Zardashvili, N. Semenova etc. Se arată că siliciul este implicat în schimbul de fluor, magneziu, aluminiu și alți compuși minerali, dar interacționează îndeosebi strâns cu stronțiul și calciul. Unul dintre mecanismele de acțiune a siliciului este acela datorită acestuia proprietăți chimice creează sisteme coloidale încărcate electric care au capacitatea de a adsorbi viruși și agenți patogeni neobișnuiți pentru oameni.
Unele plante sunt capabile să concentreze siliciul. aceasta anghinare de la Ierusalim, ridiche, măsline A, coacăz, coada-calului etc. În culturile de cereale se acumulează mult siliciu, în special în învelișul semințelor (tărâțe): orez, ovăz, mei, orz, soia. Când măcinați boabele într-o moară, acestea sunt eliberate de coajă, ceea ce le privează de siliciu și, prin urmare, le devalorizează.
bogat în siliciu și apă minerală. Dar zahărul rafinat este practic lipsit de siliciu. Doar zahărul galben nerafinat are siliciu și, prin urmare, reprezintă de mare valoare.
Coada-calului se remarcă printr-un conținut ridicat de siliciu - plante larg răspândite ale florei interne, folosite din ce în ce mai des în ultimii ani. Medicina traditionala. În acest sens, extractul de ulei de brusture, extractul de coada calului, compușii organici de siliciu (ceramide), care fac parte dintr-un medicament numit ulei de brusture cu extract de coada calului (cu ceramide), s-au dovedit bine. Studiile speciale au arătat că acest medicament:
Recomandări de utilizare: cu încălcarea structurii părului, din cauza externe sau factori interni, precum și aspectul subțire și plictisitor al părului.
Mod de aplicare: aplicati ulei cald pe par si pe scalp, frecati usor si temeinic timp de cel putin 15 minute (evitand miscarile bruste si intense, deoarece aceasta rupe si smulge parul), apoi distribuiti uleiul uniform pe toata lungimea parului. Aplicați timp de 1 oră, apoi spălați cu un șampon ușor.
Siliciul este, de asemenea, responsabil pentru furnizarea de funcții de protecție, procese metabolice și detoxifiere. Funcționează ca un agent biologic de „reticulare” implicat în formarea „arhitecturii” moleculare a polizaharidelor și a complexelor acestora cu proteine, conferă elasticitate țesuturilor conjunctive, face parte din elastina vaselor de sânge, conferă rezistență, elasticitate și impermeabilitate. pe pereții acestora și împiedică pătrunderea lipidelor în plasma sanguină.
Studiile au arătat că siliciul din apă suprimă bacteriile care provoacă fermentarea și degradarea, precipită metalele grele, neutralizează clorul și absoarbe radionuclizii. Într-un organism viu, substanțele biologic active ale siliciului, împreună cu structurile proteice, contribuie la formarea enzimelor, aminoacizilor și hormonilor. Siliciul este necesar în special în țesutul conjunctiv; se găsește în glanda tiroidă, glandele suprarenale și glanda pituitară. Mult siliciu in par. Cea mai mare concentrație se găsește în păr și unghii.
Siliciu:
Lipsa de siliciu în organism duce la:
S-a găsit o relație între concentrația de siliciu în bând apă si boli cardiovasculare. Tuberculoza, diabetul, lepra, hepatita, hipertensiunea arterială, cataracta, artrita, cancerul sunt însoțite de o scădere a concentrației de siliciu în țesuturi și organe sau de tulburări ale metabolismului acestuia.
Între timp, corpul nostru pierde siliciu zilnic - în medie, consumăm 3,5 mg de siliciu pe zi cu alimente și apă și pierdem aproximativ 9 mg!
Cauzele deficienței de siliciu în organism:
De obicei, o scădere a conținutului de siliciu are loc pe fondul deficienței minerale generale și este însoțită de o deficiență de magneziu și calciu.
Semne de deficit de siliciu:
Se știe că vârsta biologică a unei persoane este determinată de rata proceselor metabolice, adică. rata de reînnoire ca celule individuale. Și dacă multe preparate cosmetice sunt capabile să rezolve problema hidratării și protecției într-un grad sau altul, atunci problema accelerării metabolismului necesită o schimbare mai intensă a stratului exterior al pielii.
Încetinirea proceselor de regenerare a pielii începe la aproximativ 30 de ani. În acest moment, corpul începe deja să simtă lipsa de siliciu. Corpul nostru nu poate restabili deficitul de siliciu singur, deoarece compușii naturali de siliciu din jurul nostru sunt în mare parte inactivi din punct de vedere biologic și nu sunt capabili să participe la reacțiile biochimice din interiorul celulei.
Siliciul este frumos produs cosmetic. Curăță pielea de formațiuni pustuloase. Este deosebit de util să spălați cu apă siliconată, precum și să o luați în interior cu acneea tinerească. În procesul de cercetare, oamenii de știință au creat o nouă clasă de compuși organici de siliciu care pot accelera procesele metabolice ale pielii și, prin participarea la sinteza proteinelor din țesutul conjunctiv de elastină și colagen, cresc elasticitatea pielii și elimină ridurile.
Compușii care conțin siliciu brevetați de WGN accelerează procesele metabolice în celule, regenerează elastina și fibrele de colagen. Rezultatele creării de compuși activi de nanosiliciu au stat la baza dezvoltării liniei NewAge de așa-numitele preparate cosmetice „nanosilicium”.
Nanosiliciu bioactiv pătrunde în straturile profunde ale pielii, le curăță și oferă protecție care păstrează permeabilitatea naturală și respirabilitatea pielii. Nonosiliciul, stimulând procesele de proliferare și regenerare, accelerează reînnoirea epidermei și restabilește funcțiile celulelor dermice - fibroblaste.
Avantajele cosmeticelor din silicon sunt compatibilitatea dermatologică a componentelor; posibilitatea de utilizare pentru orice tip de piele, inclusiv cea sensibilă; eficiență ridicată de acțiune, stimulare moale a mecanismelor biochimice naturale ale stării funcționale a pielii.
Când interacționează cu apa, silexul își schimbă proprietățile. Apa activată de silex are un efect dăunător asupra microorganismelor, suprimă bacteriile care provoacă degradarea și fermentația, în ea are loc precipitarea activă a compușilor de metale grele, apa devine curată la aspect și plăcut la gust, nu se deteriorează mult timp și dobândește multe alte calități vindecătoare.
Flint aparține mineralelor din familia cuarțului sau calcedoniei. Grupul acestor minerale include carnelian, jasp, cristal de stâncă, agat, opal, ametist și multe alte pietre. Baza acestor minerale este dioxidul de siliciu SiO2 sau silice, dar densitatea, culoarea și alte proprietăți sunt diferite. Compoziția silexului, pe lângă silice, include aproximativ 20 de elemente chimice, dintre care principalele sunt Mg, Ca, P, Sr, Mn, Cu, Zn etc. De aici atâtea denumiri. Dar cel mai faimos dintre reprezentanții acestei familii este, fără îndoială, silexul.
Cauzele și mecanismul interacțiunii silexului cu apa nu au fost pe deplin elucidate. Poate că efectul de vindecare al siliciului se explică prin capacitatea sa de a forma asociații speciali cu apa - coloizi care absorb murdăria și microflora străină din mediu.
Vorbind despre proprietățile benefice ale siliciului pentru organism, ne amintim în primul rând de apă. Corpul uman conține aproximativ 70% apă și, prin urmare, este dificil să ne imaginăm viața fără ea. Și dacă ne gândim că toate tipurile de metabolism sunt efectuate prin mediu acvatic că apa este conducătoarea marii majorităţi a fiziologice procesele vieții că fără ea, nicio formă de viață nu este posibilă - carbon, siliciu sau orice alta, devine clar că apa activată de siliciu are o importanță deosebită.
„...în sistemul silex - soluții apoase de săruri anorganice are loc o decantare intensivă a unui număr de metale: aluminiu, fier, cadmiu, cesiu, zinc, plumb, stronțiu.”- P. Aladovsky, șeful laboratorului Institutului Central de Cercetare pentru Utilizarea Resurselor de Apă, doctor în științe chimice. Cu alte cuvinte, silexul înlocuiește metalele dăunătoare din apă, purificând-o. Ei rămân pe jos, dar deasupra se dovedește apa pura.
„Apa tratată cu silex afectează capacitatea de adsorbție a radionuclizilor. Acest lucru, probabil, va permite utilizarea acestuia pentru a rezolva unele probleme radiochimice de pe teritoriul Belarusului contaminat cu radionuclizi.”- Doctor în Chimie Yu. Davydov - șef al laboratorului Institutului de Probleme Radiologice al Academiei Naționale de Științe a Republicii Belarus.
„Apa de silicon, începând din a cincea zi de depozitare, are capacitatea de a întări capacitățile hemostatice ale sângelui, crește capacitatea acestuia de a coagula.” E. Ivanov - Director al Institutului de Hematologie și Transfuzie Sanguină al Ministerului Sănătății al Republicii Belarus, MD. Imediat îmi vine în minte hemofilia - o boală în care sângele nu se coagulează bine. Și asta înseamnă că o persoană care a primit chiar și o zgârietură mică poate muri din cauza pierderii de sânge.
„De câțiva ani, nu am observat cancer la mulți pacienți care au consumat apă activată cu siliciu (ACB). Am constatat că în a 5-a-6-a zi de luare a bateriilor (de 6-8 ori pe zi) la pacienții cu numeroase ulcere trofice ale extremităților inferioare, numărul de limfocite T și B crește. Și aceasta indică capacitatea de a reînnoi imunitatea pierdută și slăbită. În plus, AKB reduce cantitatea de colesterol din sânge, în special în cazul obezității. Astfel, bateria servește la prevenirea aterosclerozei”- M. Sinyavsky Profesor al Departamentului de Formare Medicală a lui Mogilevsky universitate de stat lor. A.A. Kuleshova.
Ce este - apa de siliciu? Apa de silicon este o tinctură de silex maro închis, care se folosește intern și extern. Metoda de preparare a apei de silex este destul de simplă. Într-un recipient de 2-3 litri, de preferință din sticlă, se adaugă 40-50 g pietricele mici de silex, de preferință maro intens strălucitor (dar nu negru), se toarnă apă din rețeaua de alimentare cu apă, dar mai bine după filtrarea normală, și se pune într-un ferit de lumina directă a soarelui și în afara radiațiilor patogene terestre.
O astfel de apă de băut va fi gata în 2-3 zile. Sub rezerva aceleiași tehnologii, dar dacă legați gâtul cu 2-3 straturi de tifon și puneți apă într-un loc luminos la o temperatură de peste 5 ° C timp de 5-7 zile, atunci această apă, prin proprietățile ei, poate fi folosită. nu numai ca apa potabila, ci si in scopuri medicale.scopuri preventive. Este util să-l folosiți pentru gătit - ceai, supe etc. Puteți bea apă siliconată fără restricții (în mod normal 1,5-2 litri pe zi). Dacă nu este posibil, atunci de cel puțin 3-5 ori pe zi pentru o jumătate de pahar și întotdeauna în înghițituri mici și de preferință într-o formă rece.
Folosiți silex, așa cum am menționat deja, numai culoarea maro strălucitoare (nu neagră).
Trebuie folosite numai minerale naturale. Faptul este că silexul conține rămășițe de microorganisme, care la un moment dat formau silex din nămolul Cretacic și din epocile mai vechi.
După una sau două utilizări, piatra trebuie spălată cu apă rece și ventilată timp de 2 ore. aer proaspat. Când apar depuneri sau depuneri pe suprafața pietrelor, acestea trebuie scufundate într-o soluție de 2% acid acetic sau apă cu sare timp de 2 ore; apoi clătiți de 2-3 ori cu apă obișnuită și scufundați timp de 2 ore într-o soluție de bicarbonat de sodiu și clătiți din nou.
Proprietățile specifice ale apei cu siliciu vă permit să vă implicați în prevenirea multor boli. Apa de silicon are un efect pozitiv asupra stării generale a corpului în ansamblu.
Dacă beți apă activată cu cremene sau gătiți alimente pe ea, se întâmplă următoarele:
- întărire sistem imunitar, numărul de limfocite din sânge T și B crește;
Starea persoanelor care suferă de boli hepatice se îmbunătățește, deoarece. apa ajută la scurgerea bilei;
Vindecarea rapidă a arsurilor, tăieturilor, vânătăilor, ulcerelor trofice;
Ajută la indigestie, ameliorează inflamația din tractul digestiv și gastrita;
Scăderea nivelului de zahăr din sânge, precum și a greutății, predispus la diabetici supraponderali;
Scăderea nivelului de colesterol din sânge, în special în obezitate, prevenirea aterosclerozei și îmbunătățirea funcției renale;
Normalizează starea pacienților care suferă de hipertensiune arterială;
Normalizează metabolismul;
Tonul general crește.
La aplicare în aer liber apa de siliciu stimulează procesele de recuperare ale organismului în:
- tratamentul amigdalitei, curgerii nazale, inflamației gingiilor (gargară la nivelul gâtului și gurii după masă);
Cu boli virale ale cavității bucale, stomatită și gingivite;
Tratamentul alergiilor, furunculelor, diatezei, dermatitelor, diverselor iritatii ale pielii (lotiuni si spalat);
Cu conjunctivită ameliorează mâncărimea și inflamația;
Spălarea cu o astfel de apă ajută la îmbunătățirea stării pielii, la reducerea numărului de riduri și la prevenirea apariției altora noi, ajută la eliminarea bubișurilor, punctelor negre, acneei;
Clătirea capului și a părului, frecarea scalpului ajută la întărirea și creșterea părului;
Cu unele boli de piele (simple veziculare, herpes zoster și deprivare de trandafiri).
- În caz de cădere și „despicare” păr, clătiți-vă capul cu apă „de cremene”;
Pentru a calma iritația după bărbierit, clătește-ți fața cu aceeași apă;
Cu „acnee tinerească” se spală și se aplică în interiorul „apei”;
Ștergeți pielea feței cu apă înghețată „de cremene” cu bucăți de gheață;
Pentru a preveni paradantoza, clătiți gingiile cu „apă” atunci când vă spălați pe dinți.
Utilizarea apei „de cremene” în scopuri terapeutice și profilactice contribuie la vindecare rapidă răni, prevenirea formării tumorilor cu aport regulat de apă, îmbunătățirea compoziției sângelui, restabilirea funcției glandelor suprarenale, eliminarea proceselor inflamatorii în tract gastrointestinal iar cu gastrită, normalizarea glicemiei, scăderea în greutate, vindecarea fracturilor (oasele cresc împreună mai repede și fără complicații), îmbunătățirea funcției renale și a metabolismului, separarea și excreția bilei. Apa siliconică ucide virușii; pentru prevenirea în timpul epidemiilor respiratorii, se recomandă insuflarea „apei” în nas. Acest lucru ajută la insomnie.
LA gospodărie se recomanda udarea florilor, ceea ce prelungeste perioada de inflorire; accelerează fructificarea pomi fructiferiși culturi de legume; crește randamentul cu 10%. Ucide mucegaiul, mucegaiul gri, în special pe căpșuni și alte ciuperci. Înmuierea semințelor într-o astfel de apă crește germinarea. Florile sunt cel mai bine depozitate într-un recipient cu pietricele de silicon, durata lor de valabilitate crește dramatic. Într-un acvariu, silexul împiedică înflorirea apei. Siliciul ajută la purificarea apei la o excursie, ceea ce este important să știe turiștii.
De asemenea, este util să bei apă cu siliciu pentru ateroscleroză (vasele sunt curățate de depozitele sclerotice), diferite tulburări metabolice, amigdalita, gripă, faringită (clătirea cu apă de siliciu reduce semnificativ durata acestor boli - la urma urmei, siliciul acționează ca un antibiotic aici ), reumatism, boala Botkin (siliciul ucide virușii patogeni), boli ale dinților și articulațiilor (deoarece siliciul restabilește integritatea țesuturilor osoase).
Și acum cel mai mult punct important- contraindicatii. Apa siliconică are contraindicații și trebuie manipulată cu mare atenție. Medicii au observat că cei care au o predispoziție la cancer, este mai bine să-l abandoneze complet.
- Denumire - Si (Siliciu);
- Perioada - III;
- Grupa - 14 (IVa);
- Masa atomică - 28,0855;
- Numărul atomic - 14;
- Raza unui atom = 132 pm;
- Raza covalentă = 111 pm;
- Distribuția electronilor - 1s 2 2s 2 2p 6 3s 2 3p 2 ;
- t topire = 1412°C;
- punct de fierbere = 2355°C;
- Electronegativitatea (după Pauling / după Alpred și Rochov) = 1,90 / 1,74;
- Stare de oxidare: +4, +2, 0, -4;
- Densitate (n.a.) \u003d 2,33 g / cm 3;
- Volumul molar = 12,1 cm 3 / mol.
Compuși de siliciu:
Siliciul a fost izolat pentru prima dată în forma sa pură în 1811 (francezii J. L. Gay-Lussac și L. J. Tenard). Siliciul elementar pur a fost obținut în 1825 (suedezul J. Ya. Berzelius). Elementul chimic și-a primit numele „siliciu” (tradus din greaca veche – munte) în 1834 (chimistul rus G. I. Hess).
Siliciul este cel mai abundent (după oxigen) element chimic pe Pământ (conținut în scoarța terestră 28-29% din greutate). În natură, siliciul este prezent cel mai adesea sub formă de silice (nisip, cuarț, silex, feldspați), precum și în silicați și aluminosilicați. Siliciul este extrem de rar în forma sa pură. Mulți silicați naturali în forma lor pură sunt pietre pretioase: smarald, topaz, acvamar - totul este silicon. Oxidul de siliciu (IV) cristalin pur apare sub formă de cristal de rocă și cuarț. Oxidul de siliciu, în care sunt prezente diverse impurități, formează pietre prețioase și semiprețioase - ametist, agat, jasp.

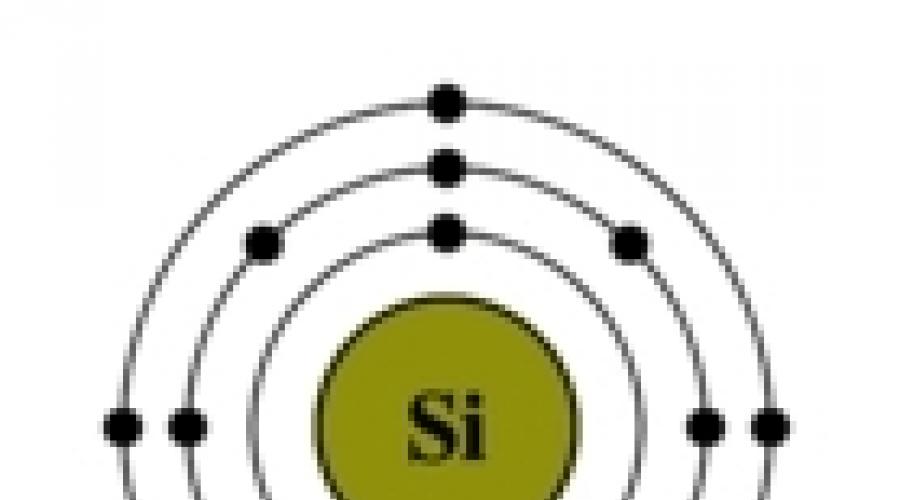
Orez. Structura atomului de siliciu.
Configurația electronică a siliciului este 1s 2 2s 2 2p 6 3s 2 3p 2 (vezi Structura electronică a atomilor). Pe dinafara nivel de energie siliciul are 4 electroni: 2 perechi pe subnivelul 3s + 2 nepereche pe orbitalii p. Când un atom de siliciu trece într-o stare excitată, un electron de la subnivelul s „își părăsește” perechea și merge la subnivelul p, unde există un orbital liber. Astfel, în starea excitată, configurația electronică a atomului de siliciu ia următoarea formă: 1s 2 2s 2 2p 6 3s 1 3p 3 .

Orez. Trecerea atomului de siliciu la o stare excitată.
Astfel, siliciul din compuși poate prezenta valență 4 (cel mai des) sau 2 (vezi Valență). Siliciul (precum și carbonul), reacționând cu alte elemente, formează legături chimice în care poate atât să renunțe la electroni, cât și să îi accepte, dar capacitatea de a accepta electroni din atomii de siliciu este mai puțin pronunțată decât cea a atomilor de carbon, datorită faptului că este mai mare. atom de siliciu.
Starile de oxidare a siliciului:
- -4 : SiH4 (silan), Ca2Si, Mg2Si (silicaţi metalici);
- +4 - cele mai stabile: SiO 2 (oxid de siliciu), H 2 SiO 3 (acid silicic), silicati si halogenuri de siliciu;
- 0 : Si (substanță simplă)
Siliciul ca o substanță simplă
Siliciul este un gri închis substanță cristalină cu un luciu metalic. Siliciu cristalin este un semiconductor.
Siliciul formează o singură modificare alotropică, similară cu diamantul, dar nu la fel de puternică, deoarece legăturile Si-Si nu sunt la fel de puternice ca în molecula de carbon din diamant (vezi Diamond).
Siliciu amorf- pulbere maro, punct de topire 1420°C.
Siliciul cristalin se obține din siliciul amorf prin recristalizarea acestuia. Spre deosebire de siliciul amorf, care este o substanță chimică destul de activă, siliciul cristalin este mai inert în ceea ce privește interacțiunea cu alte substanțe.
Structura rețelei cristaline de siliciu repetă structura diamantului - fiecare atom este înconjurat de alți patru atomi situati la vârfurile tetraedrului. Atomii se leagă între ei prin legături covalente, care nu sunt la fel de puternice ca legăturile de carbon din diamant. Din acest motiv, chiar și la n.a.s. unele dintre legăturile covalente din siliciul cristalin sunt rupte, drept urmare o parte din electroni sunt eliberați, datorită cărora siliciul are o conductivitate electrică mică. Pe măsură ce siliciul este încălzit, la lumină sau cu adăugarea unor impurități, crește numărul de legături covalente distruse, drept urmare numărul de electroni liberi crește, prin urmare, crește și conductibilitatea electrică a siliciului.
Proprietățile chimice ale siliciului
Ca și carbonul, siliciul poate fi atât un agent reducător, cât și un agent oxidant, în funcție de substanța cu care reacționează.
La n.o. siliciul interacționează doar cu fluorul, ceea ce se explică prin rețeaua cristalină de siliciu destul de puternică.
Siliciul reacționează cu clorul și bromul la temperaturi care depășesc 400°C.
Siliciul interacționează cu carbonul și azotul numai la temperaturi foarte ridicate.
- În reacțiile cu nemetale, siliciul acționează ca agent de reducere:
- în condiții normale, din nemetale, siliciul reacționează numai cu fluor, formând halogenură de siliciu:
Si + 2F 2 = SiF 4 - la temperaturi ridicate, siliciul reacţionează cu clorul (400°C), oxigenul (600°C), azotul (1000°C), carbonul (2000°C):
- Si + 2Cl2 = SiCl4 - halogenură de siliciu;
- Si + O 2 \u003d SiO 2 - oxid de siliciu;
- 3Si + 2N2 = Si3N4 - nitrură de siliciu;
- Si + C \u003d SiC - carborundum (carbură de siliciu)
- în condiții normale, din nemetale, siliciul reacționează numai cu fluor, formând halogenură de siliciu:
- În reacțiile cu metale, siliciul este agent oxidant(format salicide:
Si + 2Mg = Mg2Si - În reacțiile cu soluții concentrate de alcalii, siliciul reacţionează cu eliberarea de hidrogen, formând săruri solubile ale acidului silicic, numite silicati:
Si + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 2H 2 - Siliciul nu reacționează cu acizii (cu excepția HF).
Obținerea și utilizarea siliciului
Obținerea de siliciu:
- în laborator - din silice (terapie cu aluminiu):
3SiO2 + 4Al = 3Si + 2Al2O3 - în industrie - prin reducerea oxidului de siliciu cu cocs (siliciu pur comercial) la temperatură ridicată:
SiO 2 + 2C \u003d Si + 2CO - cel mai pur siliciu se obtine prin reducerea tetraclorurii de siliciu cu hidrogen (zinc) la temperatura ridicata:
SiCl 4 + 2H 2 \u003d Si + 4HCl
Aplicarea siliciului:
- fabricarea de radioelemente semiconductoare;
- ca aditivi metalurgici în producția de compuși rezistenți la căldură și acizi;
- în producția de fotocelule pentru baterii solare;
- ca redresoare de curent alternativ.