Proprietățile fizico-chimice ale proteinelor pe scurt. 3
Citeste si
Conținutul articolului
PROTEINE (Articolul 1)- o clasă de polimeri biologici prezenți în fiecare organism viu. Cu participarea proteinelor, au loc principalele procese care asigură activitatea vitală a corpului: respirația, digestia, contracția musculară, transmiterea impulsurilor nervoase. Țesutul osos, pielea, părul, formațiunile de coarne ale ființelor vii sunt compuse din proteine. Pentru majoritatea mamiferelor, creșterea și dezvoltarea organismului are loc datorită produselor care conțin proteine ca componentă alimentară. Rolul proteinelor în organism și, în consecință, structura lor este foarte diversă.
Compoziția proteinelor.
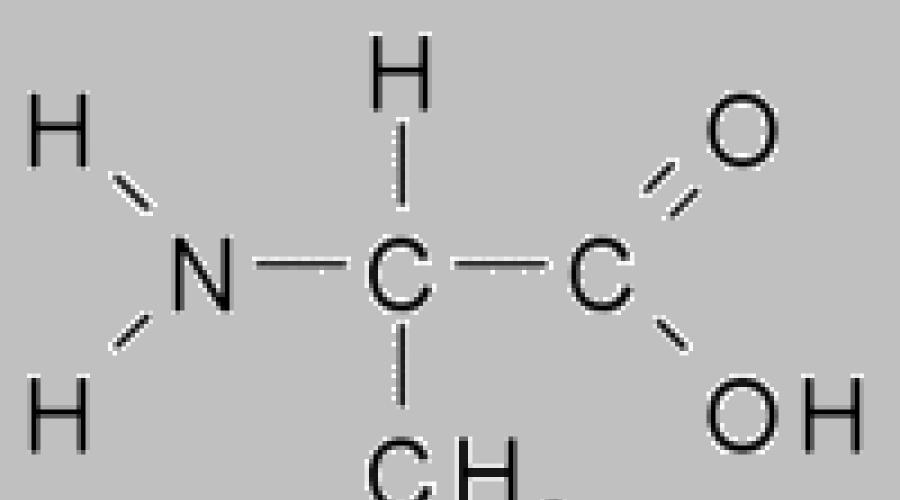
Toate proteinele sunt polimeri, ale căror lanțuri sunt asamblate din fragmente de aminoacizi. Aminoacizii sunt compusi organici, care conțin în compoziția lor (conform denumirii) gruparea amino NH 2 și acid organic, adică. carboxil, grupa COOH. Dintre toată varietatea de aminoacizi existenți (teoretic, numărul de aminoacizi posibili este nelimitat), doar cei care au un singur atom de carbon între gruparea amino și gruparea carboxil participă la formarea proteinelor. LA vedere generala aminoacizii implicaţi în formarea proteinelor pot fi reprezentaţi prin formula: H 2 N–CH(R)–COOH. Gruparea R atașată atomului de carbon (cea dintre grupările amino și carboxil) determină diferența dintre aminoacizii care alcătuiesc proteinele. Acest grup poate consta numai din atomi de carbon și hidrogen, dar mai des conține, pe lângă C și H, diverse grupări funcționale (capabile de transformări ulterioare), de exemplu, HO-, H 2 N- etc. Există, de asemenea, un opțiune când R \u003d H.
Organismele ființelor vii conțin mai mult de 100 de aminoacizi diferiți, însă nu toți sunt folosiți în construcția proteinelor, ci doar 20, așa-numitul „fundamental”. În tabel. 1 arată numele lor (majoritatea numelor s-au dezvoltat istoric), formula structurală, precum și abrevierea utilizată pe scară largă. Toate formulele structurale sunt aranjate în tabel, astfel încât fragmentul principal al aminoacidului să fie în dreapta.
| Nume | Structura | Desemnare |
| GLICINA | GLI | |
| ALANIN | ALA | |
| VALIN | ARBORE | |
| LEUCINE | LEI | |
| ISOLEUCINĂ | ILE | |
| SERIN | SER | |
| TREONINA | TRE | |
| CISTEINĂ | CIS | |
| METIONINĂ | ÎNTÂLNIT | |
| LIZINA | LIZ | |
| ARGININA | AWG | |
| ACID ASPARAGIC | ASN | |
| ASPARAGINA | ASN | |
| ACID GLUTAMIC | GLU | |
| GLUTAMINĂ | GLN | |
| Fenilalanină | uscător de păr | |
| TIROZINA | TIR | |
| triptofan | TREI | |
| HISTIDINA | GIS | |
| PROLINE | PRO | |
| În practica internațională, denumirea prescurtată a aminoacizilor enumerați folosind abrevieri latine cu trei litere sau o literă este acceptată, de exemplu, glicină - Gly sau G, alanină - Ala sau A. | ||
Dintre acești douăzeci de aminoacizi (Tabelul 1), numai prolina conține o grupare NH (în loc de NH2) lângă gruparea carboxil COOH, deoarece face parte din fragmentul ciclic.
Opt aminoacizi (valină, leucină, izoleucină, treonină, metionină, lizină, fenilalanină și triptofan), așezați pe masă pe un fundal gri, sunt numiți esențiali, deoarece organismul trebuie să îi primească constant cu alimente proteice pentru creșterea și dezvoltarea normală.
O moleculă de proteină se formează ca urmare a conexiunii secvenţiale a aminoacizilor, în timp ce gruparea carboxil a unui acid interacționează cu gruparea amino a moleculei învecinate, ca urmare, se formează o legătură peptidică –CO–NH– și se formează o legătură de apă. molecula este eliberată. Pe fig. 1 prezintă conexiunea în serie a alaninei, valinei și glicinei.
Orez. unu CONEXIUNEA SERIALĂ A AMINOACIZILORîn timpul formării unei molecule proteice. Calea de la gruparea amino terminală H2N la gruparea carboxil terminală COOH a fost aleasă ca direcție principală a lanțului polimeric.
Pentru a descrie în mod compact structura unei molecule de proteine, sunt utilizate abrevierile pentru aminoacizi (Tabelul 1, a treia coloană) implicați în formarea lanțului polimeric. Fragmentul moleculei prezentat în Fig. 1, notează în felul următor: H2N-ALA-VAL-GLY-COOH.
Moleculele proteice conțin de la 50 la 1500 de resturi de aminoacizi (lanțurile mai scurte sunt numite polipeptide). Individualitatea unei proteine este determinată de setul de aminoacizi care alcătuiesc lanțul polimeric și, nu mai puțin important, de ordinea alternanței acestora de-a lungul lanțului. De exemplu, molecula de insulină este formată din 51 de resturi de aminoacizi (este una dintre proteinele cu cel mai scurt lanț) și este formată din două lanțuri paralele interconectate de lungime inegală. Secvența fragmentelor de aminoacizi este prezentată în fig. 2.
Orez. 2 MOLECULA DE INSULINA, construite din 51 de resturi de aminoacizi, fragmentele acelorași aminoacizi sunt marcate cu culoarea de fond corespunzătoare. Reziduurile de aminoacizi de cisteină (denumirea prescurtată CIS) conținute în lanț formează punți disulfură -S-S-, care leagă două molecule de polimer sau formează jumperi într-un singur lanț.
Moleculele aminoacidului cisteină (Tabelul 1) conțin grupări sulfhidride reactive -SH, care interacționează între ele, formând punți disulfură -S-S-. Rolul cisteinei în lumea proteinelor este special, cu participarea sa, se formează legături încrucișate între moleculele de proteine polimerice.
Combinația de aminoacizi într-un lanț polimeric are loc într-un organism viu sub controlul acizilor nucleici, ei sunt cei care asigură o ordine strictă de asamblare și reglează lungimea fixă a moleculei de polimer ().
Structura proteinelor.
Compoziția moleculei proteice, prezentată sub formă de resturi de aminoacizi alternante (Fig. 2), se numește structura primară a proteinei. Legăturile de hidrogen () apar între grupările imino HN și grupările carbonil CO prezente în lanțul polimeric, ca urmare, molecula proteică capătă o anumită formă spațială, numită structură secundară. Cele mai frecvente sunt două tipuri de structură secundară în proteine.
Prima opțiune, numită α-helix, este implementată folosind legături de hidrogen într-o moleculă de polimer. Parametrii geometrici ai moleculei, determinați de lungimile și unghiurile de legătură, sunt astfel încât formarea legăturilor de hidrogen este posibilă pentru grupele H-Nși C=O, între care există două fragmente peptidice H-N-C=O (Fig. 3).
Compoziția lanțului polipeptidic prezentat în fig. 3 se scrie sub forma prescurtată după cum urmează:
H 2 N-ALA VAL-ALA-LEY-ALA-ALA-ALA-ALA-VAL-ALA-ALA-ALA-COOH.
Ca urmare a acțiunii de contractare a legăturilor de hidrogen, molecula ia forma unei helix - așa-numita α-helix, este descrisă ca o panglică elicoidă curbată care trece prin atomii care formează lanțul polimeric (Fig. 4)
Orez. patru MODEL 3D AL O MOLECULE DE PROTEINĂ sub formă de α-helix. Legăturile de hidrogen sunt prezentate sub formă de linii punctate verzi. formă cilindrică spirala este vizibilă la un anumit unghi de rotație (atomii de hidrogen nu sunt prezentați în figură). Culoarea atomilor individuali este dată în conformitate cu regulile internaționale, care recomandă negru pentru atomii de carbon, albastru pentru azot, roșu pentru oxigen și galben pentru sulf (culoarea albă este recomandată pentru atomii de hidrogen neprezentați în figură, în acest caz, întreaga structură reprezentată pe un fundal întunecat).
O altă variantă a structurii secundare, numită structură β, este, de asemenea, formată cu participarea legăturilor de hidrogen, diferența este că grupările H-N și C=O a două sau mai multe lanțuri polimerice situate în paralel interacționează. Deoarece lanțul polipeptidic are o direcție (Fig. 1), variante sunt posibile atunci când direcția lanțurilor este aceeași (structură β paralelă, Fig. 5) sau sunt opuse (structura β antiparalelă, Fig. 6) .
Lanțurile polimerice de diferite compoziții pot participa la formarea structurii β, în timp ce grupările organice care încadrează lanțul polimeric (Ph, CH 2 OH etc.) joacă în majoritatea cazurilor un rol secundar, aranjarea reciprocă a H-N și C. =O grupuri este decisivă. Deoarece grupările H-N și C=O sunt direcționate în direcții diferite față de lanțul polimeric (în sus și în jos în figură), devine posibil ca trei sau mai multe lanțuri să interacționeze simultan.
Compoziția primului lanț polipeptidic din Fig. 5:
H 2 N-LEI-ALA-FEN-GLI-ALA-ALA-COOH
Compoziția celui de-al doilea și al treilea lanț:
H 2 N-GLY-ALA-SER-GLY-TRE-ALA-COOH
Compoziția lanțurilor polipeptidice prezentată în fig. 6, la fel ca în Fig. 5, diferența este că al doilea lanț are direcția opusă (în comparație cu Fig. 5).
Este posibil să se formeze o structură β în cadrul unei molecule, atunci când un fragment de lanț dintr-o anumită secțiune se dovedește a fi rotit cu 180°, în acest caz, două ramuri ale unei molecule au direcția opusă, ca urmare, un antiparalel se formează structura β (Fig. 7).
Structura prezentată în fig. 7 într-o imagine plată, prezentată în fig. 8 sub forma unui model tridimensional. Secțiunile structurii β sunt de obicei notate într-un mod simplificat printr-o panglică ondulată plată care trece prin atomii care formează lanțul polimeric.
În structura multor proteine, se alternează secțiuni ale helixului α și structurilor β asemănătoare panglicii, precum și lanțuri polipeptidice unice. Aranjamentul și alternanța lor reciprocă în lanțul polimeric se numește structura terțiară a proteinei.
Metodele de reprezentare a structurii proteinelor sunt prezentate mai jos folosind crambină de proteine vegetale ca exemplu. Formulele structurale ale proteinelor, care conțin adesea până la sute de fragmente de aminoacizi, sunt complexe, greoaie și greu de înțeles, de aceea se folosesc uneori formule structurale simplificate - fără simboluri ale elementelor chimice (Fig. 9, opțiunea A), dar în același timp timp în care păstrează culoarea loviturilor de valență în conformitate cu regulile internaționale (Fig. 4). În acest caz, formula este prezentată nu într-o imagine plată, ci într-o imagine spațială, care corespunde structurii reale a moleculei. Această metodă permite, de exemplu, să se facă distincția între punțile disulfurice ( subiecte similare, care sunt în insulină, fig. 2), grupări fenil din cadrul lateral al lanțului etc. Imaginea moleculelor sub formă de modele tridimensionale (bile legate prin tije) este ceva mai vizuală (Fig. 9, varianta B). Cu toate acestea, ambele metode nu permit arătarea structurii terțiare, așa că biofizicianul american Jane Richardson a propus să descrie structurile α ca panglici răsucite spiralat (vezi Fig. 4), structurile β ca panglici ondulate plate (Fig. 8) și conectarea. ei lanțuri simple - sub formă de mănunchiuri subțiri, fiecare tip de structură are propria sa culoare. Această metodă de reprezentare a structurii terțiare a unei proteine este acum utilizată pe scară largă (Fig. 9, varianta B). Uneori, pentru un conținut informațional mai mare, sunt prezentate împreună o structură terțiară și o formulă structurală simplificată (Fig. 9, varianta D). Există, de asemenea, modificări ale metodei propuse de Richardson: α-helicele sunt descrise ca cilindri, iar β-structurile sunt sub formă de săgeți plate care indică direcția lanțului (Fig. 9, opțiunea E). Mai puțin obișnuită este metoda în care întreaga moleculă este descrisă ca un mănunchi, unde structurile inegale se disting prin culori diferite, iar punțile disulfurice sunt prezentate ca punți galbene (Fig. 9, varianta E).
Opțiunea B este cea mai convenabilă pentru percepție, atunci când, atunci când descrieți structura terțiară, caracteristicile structurale ale proteinei (fragmente de aminoacizi, ordinea lor de alternanță, legături de hidrogen) nu sunt indicate, în timp ce se presupune că toate proteinele conțin „detalii” luate dintr-un set standard de douăzeci de aminoacizi (Tabelul 1). Sarcina principală în înfățișarea unei structuri terțiare este de a arăta aranjarea spațială și alternanța structurilor secundare.
Orez. 9 DIVERSE VERSIUNI DE IMAGINI ALE STRUCTURII PROTEINEI CRUMBIN.
A este o formulă structurală într-o imagine spațială.
B - structură sub forma unui model tridimensional.
B este structura terțiară a moleculei.
G - o combinație de opțiuni A și B.
E - imagine simplificată a structurii terțiare.
E - structura tertiara cu punti disulfurice.
Cea mai convenabilă pentru percepție este o structură terțiară tridimensională (opțiunea B), eliberată de detaliile formulei structurale.
O moleculă de proteină care are o structură terțiară, de regulă, capătă o anumită configurație, care este formată din interacțiuni polare (electrostatice) și legături de hidrogen. Ca rezultat, molecula ia forma unei bobine compacte - proteine globulare (globuli, lat. minge), sau proteine filamentoase - fibrilare (fibra, lat. fibră).
Un exemplu de structură globulară este albumina proteică, proteina unui ou de găină aparține clasei albuminelor. Lanțul polimeric al albuminei este asamblat în principal din alanină, acid aspartic, glicină și cisteină, alternând într-o anumită ordine. Structura terțiară conține elice α legate prin lanțuri simple (Fig. 10).
Orez. zece STRUCTURA GLOBULĂ A ALBUMINEI
Un exemplu de structură fibrilă este proteina fibroină. Conțin o cantitate mare de reziduuri de glicină, alanină și serină (fiecare al doilea reziduu de aminoacizi este glicină); reziduurile de cisteină care conțin grupări sulfhidrură sunt absente. Fibroina, componenta principală a mătăsii naturale și a pânzelor de păianjen, conține structuri β legate prin lanțuri simple (Fig. 11).
Orez. unsprezece PROTEINĂ FIBRILARĂ FIBROINĂ
Posibilitatea formării unei structuri terțiare de un anumit tip este inerentă structurii primare a proteinei, adică. determinată în prealabil de ordinea alternanţei resturilor de aminoacizi. Din anumite seturi de astfel de reziduuri apar predominant elice α (există destul de multe astfel de seturi), un alt set duce la apariția structurilor β, lanțurile simple se caracterizează prin compoziția lor.
Unele molecule de proteine, deși păstrează o structură terțiară, sunt capabile să se combine în agregate supramoleculare mari, în timp ce sunt ținute împreună prin interacțiuni polare, precum și prin legături de hidrogen. Astfel de formațiuni sunt numite structura cuaternară a proteinei. De exemplu, proteina feritină, care constă în principal din leucină, acid glutamic, acid aspartic și histidină (fericina conține toate cele 20 de resturi de aminoacizi în cantități variate) formează o structură terțiară de patru elice α așezate paralel. Când moleculele sunt combinate într-un singur ansamblu (Fig. 12), se formează o structură cuaternară, care poate include până la 24 de molecule de feritină.
Fig.12 FORMAREA STRUCTURII CUATERNARE A FERITINEI PROTEINE GLOBUARE
Un alt exemplu de formațiuni supramoleculare este structura colagenului. Este o proteină fibrilă ale cărei lanțuri sunt construite în principal din glicină alternând cu prolină și lizină. Structura conține lanțuri simple, triple elice α, alternând cu structuri β sub formă de panglici stivuite în mănunchiuri paralele (Fig. 13).
Fig.13 STRUCTURA SUPRAMOLECULARĂ A PROTEINEI FIBRILARE DE COLAGEN
Proprietățile chimice ale proteinelor.
Sub acțiunea solvenților organici, deșeurile unor bacterii (fermentația acidului lactic) sau cu creșterea temperaturii, structurile secundare și terțiare sunt distruse fără a deteriora structura sa primară, ca urmare, proteina își pierde solubilitatea și pierde. activitate biologică, acest proces se numește denaturare, adică pierderea proprietăților naturale, de exemplu, coagul laptelui acru, proteina coagulată a unui ou fiert de găină. La temperaturi ridicate, proteinele organismelor vii (în special, microorganismele) se denaturază rapid. Astfel de proteine nu sunt capabile să participe la procesele biologice, ca urmare, microorganismele mor, astfel încât laptele fiert (sau pasteurizat) poate fi păstrat mai mult timp.
Legăturile peptidice H-N-C=O, formând lanțul polimeric al moleculei proteice, sunt hidrolizate în prezența acizilor sau alcalinelor, iar lanțul polimeric se rupe, ceea ce, în cele din urmă, poate duce la aminoacizii originali. Legăturile peptidice incluse în elice α sau structuri β sunt mai rezistente la hidroliză și diferite atacuri chimice (comparativ cu aceleași legături din lanțuri simple). O dezasamblare mai delicată a moleculei proteice în aminoacizii ei constitutivi se realizează într-un mediu anhidru folosind hidrazină H 2 N–NH 2, în timp ce toate fragmentele de aminoacizi, cu excepția ultimului, formează așa-numitele hidrazide de acid carboxilic care conțin fragmentul C (O)–HN–NH 2 ( Fig. 14).
Orez. paisprezece. CLIEVA POLIPEPTIDE
O astfel de analiză poate oferi informații despre compoziția de aminoacizi a unei proteine, dar este mai important să se cunoască secvența acestora într-o moleculă de proteină. Una dintre metodele utilizate pe scară largă în acest scop este acțiunea asupra lanțului polipeptidic de fenilizotiocianat (FITC), care în mediu alcalin se atașează de polipeptidă (de la capătul care conține grupa amino), iar când reacția mediului se transformă în acidă, se desprinde din lanț, luând cu ea un fragment dintr-un aminoacid (Fig. 15).
Orez. cincisprezece Scindarea POLIPEPTIDĂ SECVENTIALĂ
Multe metode speciale au fost dezvoltate pentru o astfel de analiză, inclusiv cele care încep să „dezmonteze” o moleculă de proteină în componentele sale constitutive, pornind de la capătul carboxil.
Punțile disulfurice încrucișate S-S (formate prin interacțiunea reziduurilor de cisteină, Fig. 2 și 9) sunt scindate, transformându-le în grupe HS prin acțiunea diverșilor agenți reducători. Acțiunea agenților oxidanți (oxigen sau peroxid de hidrogen) duce din nou la formarea de punți disulfurice (Fig. 16).
Orez. 16. Scindarea punților disulfurice
Pentru a crea legături încrucișate suplimentare în proteine, se utilizează reactivitatea grupărilor amino și carboxil. Mai accesibile pentru diverse interacțiuni sunt grupările amino care se află în cadrul lateral al lanțului - fragmente de lizină, asparagină, lizină, prolină (Tabelul 1). Când astfel de grupări amino interacționează cu formaldehida, are loc procesul de condensare și apar punți încrucișate –NH–CH2–NH– (Fig. 17).
Orez. 17 CREAREA PUNTURI TRANSVERSALE SUPLIMENTARE ÎNTRE MOLECULELE DE PROTEINĂ.
Grupările carboxil terminale ale proteinei sunt capabile să reacționeze cu compuși complecși ai unor metale polivalente (compușii de crom sunt mai des utilizați) și apar și legături încrucișate. Ambele procese sunt utilizate în tăbăcirea pielii.
Rolul proteinelor în organism.
Rolul proteinelor în organism este divers.
Enzime(fermentatie lat. - fermentație), celălalt nume al lor este enzime (en zumh grecesc. - în drojdie) - acestea sunt proteine cu activitate catalitică, sunt capabile să mărească viteza proceselor biochimice de mii de ori. Sub acțiunea enzimelor componentele constitutive alimente: proteine, grăsimi și carbohidrați - sunt descompuse în compuși mai simpli, din care sunt apoi sintetizate noi macromolecule, necesare organismului un anumit tip. De asemenea, enzimele participă la multe procese biochimice de sinteză, de exemplu, la sinteza proteinelor (unele proteine ajută la sintetizarea altora).
Enzimele nu sunt doar catalizatori foarte eficienți, ci și selectivi (direcționează reacția strict în direcția dată). În prezența lor, reacția se desfășoară cu un randament de aproape 100% fără formarea de produse secundare și, în același timp, condițiile de curgere sunt blânde: presiunea atmosferică și temperatura normală a unui organism viu. Pentru comparație, sinteza amoniacului din hidrogen și azot în prezența unui catalizator de fier activat se realizează la 400–500°C și o presiune de 30 MPa, randamentul de amoniac este de 15–25% pe ciclu. Enzimele sunt considerate catalizatori de neegalat.
Studiul intensiv al enzimelor a început la mijlocul secolului al XIX-lea; în prezent au fost studiate peste 2.000 de enzime diferite; aceasta este cea mai diversă clasă de proteine.
Denumirile enzimelor sunt următoarele: numele reactivului cu care enzima interacționează sau numele reacției catalizate se adaugă cu terminația -aza, de exemplu, arginaza descompune arginina (Tabelul 1), decarboxilaza catalizează decarboxilarea, adică eliminarea CO2 din gruparea carboxil:
– COOH → – CH + CO 2
Adesea, pentru a indica mai exact rolul unei enzime, atât obiectul, cât și tipul de reacție sunt indicate în numele acesteia, de exemplu, alcool dehidrogenaza este o enzimă care dehidrogenează alcoolii.
Pentru unele enzime descoperite cu destul de mult timp în urmă, denumirea istorică (fără terminația -aza) a fost păstrată, de exemplu, pepsină (pepsis, greacă. digestia) și tripsină (tripsis greacă. lichefiere), aceste enzime descompun proteinele.
Pentru sistematizare, enzimele sunt combinate în clase mari, clasificarea se bazează pe tipul de reacție, clasele sunt denumite după principiul general - denumirea reacției și desinența - aza. Unele dintre aceste clase sunt enumerate mai jos.
Oxidorreductaza sunt enzime care catalizează reacțiile redox. Dehidrogenazele incluse în această clasă efectuează transferul de protoni, de exemplu, alcool dehidrogenaza (ADH) oxidează alcoolii la aldehide, oxidarea ulterioară a aldehidelor la acizi carboxilici este catalizată de aldehid dehidrogenazele (ALDH). Ambele procese au loc în organism în timpul procesării etanolului în acid acetic (Fig. 18).
Orez. optsprezece OXIDAREA ETANOLULUI ÎN DOUĂ ETAPE la acid acetic
Nu etanolul are un efect narcotic, ci produsul intermediar acetaldehida, cu cât activitatea enzimei ALDH este mai scăzută, cu atât trece mai lent etapa a doua - oxidarea acetaldehidei în acid acetic și cu cât efectul de intoxicare este mai lung și mai puternic de la ingerare. de etanol. Analiza a arătat că peste 80% dintre reprezentanții rasei galbene au o activitate relativ scăzută a ALDH și deci o toleranță la alcool semnificativ mai severă. Motivul pentru această activitate înnăscută redusă a ALDH este că o parte din reziduurile de acid glutamic din molecula „atenuată” de ALDH este înlocuită cu fragmente de lizină (Tabelul 1).
Transferaze- enzimele care catalizează transferul grupărilor funcționale, de exemplu, transiminaza catalizează transferul unei grupări amino.
Hidrolazele sunt enzime care catalizează hidroliza. Tripsina și pepsina menționate anterior hidrolizează legăturile peptidice, iar lipazele scindează legătura esterică din grăsimi:
–RC(O)OR 1 + H2O → –RC(O)OH + HOR 1
Legătura- enzime care catalizează reacţiile care au loc în mod nehidrolitic, în urma unor astfel de reacţii se rup legăturile C-C, C-O, C-N şi se formează noi legături. Enzima decarboxilaza aparține acestei clase
Izomeraze- enzime care catalizează izomerizarea, de exemplu, conversia acidului maleic în acid fumaric (Fig. 19), acesta este un exemplu de izomerizare cis-trans ().
Orez. 19. IZOMERIZAREA ACIDULUI MALEICîn acid fumaric în prezenţa enzimei.
Se observă activitatea enzimelor principiu general, conform căreia există întotdeauna o corespondență structurală între enzimă și reactivul reacției accelerate. Conform expresiei figurative a unuia dintre fondatorii doctrinei enzimelor, reactivul se apropie de enzimă ca la cheia unei broaște. În acest sens, fiecare enzimă catalizează o anumită reacție chimică sau un grup de reacții de același tip. Uneori, o enzimă poate acționa asupra unui singur compus, cum ar fi ureaza (uron greacă. - urina) catalizează doar hidroliza ureei:
(H 2 N) 2 C \u003d O + H 2 O \u003d CO 2 + 2NH 3
Cea mai fină selectivitate este arătată de enzimele care disting între antipozii optic activi - izomeri stângaci și dreptaci. L-arginaza acționează numai asupra argininei levogitoare și nu afectează izomerul dextrogiro. L-lactat dehidrogenaza acţionează numai asupra esterilor levogitori ai acidului lactic, aşa-numiţii lactaţi (lactis lat. lapte), în timp ce D-lactat dehidrogenaza descompune doar D-lactații.
Majoritatea enzimelor acționează nu asupra unuia, ci asupra unui grup de compuși înrudiți, de exemplu, tripsina „preferă” să scinda legăturile peptidice formate din lizină și arginină (Tabelul 1.)
Proprietățile catalitice ale unor enzime, cum ar fi hidrolazele, sunt determinate numai de structura moleculei proteice în sine, o altă clasă de enzime - oxidoreductaze (de exemplu, alcool dehidrogenaza) poate fi activă numai în prezența moleculelor non-proteice asociate cu acestea - vitamine care activează Mg, Ca, Zn, Mn și fragmente de acizi nucleici (Fig. 20).
Orez. douăzeci MOLECULA DE ALCOOL DEHIDROGENAZĂ
Proteinele de transport leagă și transportă diverse molecule sau ioni prin membranele celulare (atât în interiorul, cât și în exteriorul celulei), precum și de la un organ la altul.
De exemplu, hemoglobina leagă oxigenul pe măsură ce sângele trece prin plămâni și îl livrează către diferite țesuturi ale corpului, unde oxigenul este eliberat și apoi folosit pentru a oxida componentele alimentare, acest proces servește ca sursă de energie (uneori se folosesc termenul de „ardere” Produse alimentare in corp).
Pe lângă partea proteică, hemoglobina conține un compus complex de fier cu o moleculă de porfirină ciclică (porphyros). greacă. - violet), care determină culoarea roșie a sângelui. Acest complex (Fig. 21, stânga) joacă rolul unui purtător de oxigen. În hemoglobină, complexul porfirinic de fier este situat în interiorul moleculei proteice și este reținut prin interacțiuni polare, precum și printr-o legătură de coordonare cu azotul din histidină (Tabelul 1), care face parte din proteină. Molecula de O2, care este transportată de hemoglobină, este atașată printr-o legătură de coordonare la atomul de fier din partea opusă celei de care este atașată histidina (Fig. 21, dreapta).
Orez. 21 STRUCTURA COMPLEXULUI DE FIER
Structura complexului este prezentată în dreapta sub forma unui model tridimensional. Complexul este menținut în molecula proteică printr-o legătură de coordonare (linie albastră întreruptă) între atomul de Fe și atomul de N din histidină, care face parte din proteină. Molecula de O2, care este transportată de hemoglobină, este coordonată (linia punctată roșie) cu atomul de Fe din țara opusă complexului plan.
Hemoglobina este una dintre cele mai studiate proteine, este formată din elice a legate prin lanțuri simple și conține patru complexe de fier. Astfel, hemoglobina este ca un pachet voluminos pentru transferul a patru molecule de oxigen simultan. Forma hemoglobinei corespunde proteinelor globulare (Fig. 22).
Orez. 22 FORMA GLOBULARĂ A HEMOGLOBINEI
Principalul „avantaj” al hemoglobinei este că adăugarea de oxigen și separarea lui ulterioară în timpul transmiterii la diferite țesuturi și organe au loc rapid. Monoxidul de carbon, CO (monoxidul de carbon), se leagă de Fe din hemoglobină și mai repede, dar, spre deosebire de O 2 , formează un complex greu de descompus. Ca urmare, o astfel de hemoglobină nu este capabilă să lege O 2, ceea ce duce (când sunt inhalate cantități mari de monoxid de carbon) la moartea corpului prin sufocare.
A doua funcție a hemoglobinei este transferul CO 2 expirat, dar nu atomul de fier, ci H 2 din grupul N al proteinei este implicat în procesul de legare temporară a dioxidului de carbon.
„Performanța” proteinelor depinde de structura lor, de exemplu, înlocuirea singurului reziduu de aminoacizi al acidului glutamic din lanțul polipeptidic al hemoglobinei cu un reziduu de valină (o anomalie congenitală rar observată) duce la o boală numită anemie falciforme.
Există și proteine de transport care pot lega grăsimile, glucoza, aminoacizii și le pot transporta atât în interiorul, cât și în exteriorul celulelor.
Proteinele de transport de tip special nu transportă substanțele în sine, ci acționează ca un „regulator de transport”, trecând anumite substanțe prin membrană (peretele exterior al celulei). Astfel de proteine sunt adesea numite proteine membranare. Au forma unui cilindru gol și, fiind încastrate în peretele membranei, asigură deplasarea unor molecule sau ioni polari în celulă. Un exemplu de proteină membranară este porina (Fig. 23).
Orez. 23 PROTEINĂ PORINĂ
Proteinele alimentare și de depozitare, după cum sugerează și numele, servesc ca surse de nutriție internă, mai des pentru embrionii de plante și animale, precum și în stadiile incipiente de dezvoltare a organismelor tinere. Proteinele dietetice includ albumina (Fig. 10) - componenta principală a albușului de ou, precum și cazeina - principala proteină a laptelui. Sub acțiunea enzimei pepsine, cazeina se coagulează în stomac, ceea ce asigură reținerea acesteia în tractul digestiv și absorbția eficientă. Cazeina conține fragmente din toți aminoacizii necesari organismului.
În feritina (Fig. 12), care este conținută în țesuturile animalelor, sunt stocați ionii de fier.
Mioglobina este, de asemenea, o proteină de stocare, care seamănă cu hemoglobina ca compoziție și structură. Mioglobina este concentrată în principal în mușchi, rolul său principal este stocarea oxigenului, pe care i-o dă hemoglobina. Este saturat rapid cu oxigen (mult mai rapid decât hemoglobina), apoi îl transferă treptat în diferite țesuturi.
Proteinele structurale îndeplinesc o funcție de protecție (piele) sau de susținere - țin corpul împreună și îi conferă rezistență (cartilaj și tendoane). Componenta lor principală este colagenul proteic fibrilar (Fig. 11), cea mai comună proteină din lumea animală, în corpul mamiferelor, el reprezintă aproape 30% din masa totală a proteinelor. Colagenul are o rezistență mare la tracțiune (se cunoaște rezistența pielii), dar datorită conținutului scăzut de legături încrucișate din colagenul pielii, pieile de animale nu sunt foarte potrivite în forma lor brută pentru fabricarea diferitelor produse. Pentru a reduce umflarea pielii în apă, contracția în timpul uscării, precum și pentru a crește rezistența în starea de udare și pentru a crește elasticitatea în colagen, se creează legături încrucișate suplimentare (Fig. 15a), aceasta este așa-numita procesul de tăbăcire a pielii.
În organismele vii, moleculele de colagen care au apărut în procesul de creștere și dezvoltare a organismului nu sunt actualizate și nu sunt înlocuite cu cele nou sintetizate. Pe măsură ce corpul îmbătrânește, numărul de legături încrucișate din colagen crește, ceea ce duce la o scădere a elasticității acestuia și, deoarece reînnoirea nu are loc, apar modificări legate de vârstă - o creștere a fragilității cartilajului și a tendoanelor, apariția riduri pe piele.
Ligamentele articulare conțin elastina, o proteină structurală care se întinde ușor în două dimensiuni. Proteina resilină, care este situată în punctele de prindere a aripilor la unele insecte, are cea mai mare elasticitate.
Formațiuni de corn - păr, unghii, pene, constând în principal din proteină de keratina (Fig. 24). Principala sa diferență este conținutul vizibil de reziduuri de cisteină, care formează punți disulfurice, care conferă părului, precum și țesăturilor de lână, elasticitate ridicată (capacitatea de a-și restabili forma originală după deformare).
Orez. 24. FRAGMENT DE KERATINA PROTEINĂ FIBRILARĂ
Pentru o modificare ireversibilă a formei unui obiect de keratina, trebuie mai întâi să distrugi punțile disulfură cu ajutorul unui agent reducător, să îi dai o nouă formă și apoi să recreezi punțile disulfură cu ajutorul unui agent oxidant (Fig. . 16), așa se face, de exemplu, părul permanent.
Odată cu o creștere a conținutului de reziduuri de cisteină din cheratina și, în consecință, cu o creștere a numărului de punți disulfurice, capacitatea de a se deforma dispare, dar apare o rezistență ridicată în același timp (coarnele de ungulate și coji de țestoasă conțin până la 18% din fragmentele de cisteină). Corpul mamiferelor conține până la 30 tipuri variate cheratina.
Fibroina proteina fibrilara legata de keratina secretata de omizile viermilor de matase in timpul ondularii coconului, precum si de catre paianjeni in timpul teserii panzei, contine doar structuri β legate prin lanturi simple (Fig. 11). Spre deosebire de cheratina, fibroina nu are punți transversale de disulfură, are o rezistență la tracțiune foarte puternică (rezistența pe unitate de secțiune transversală a unor probe de bandă este mai mare decât cea a cablurilor de oțel). Din cauza absenței legăturilor încrucișate, fibroina este inelastică (se știe că țesăturile de lână sunt aproape de neșters, iar țesăturile de mătase sunt ușor șifonate).
proteine reglatoare.
Proteinele reglatoare, numite mai frecvent, sunt implicate în diferite procese fiziologice. De exemplu, hormonul insulina (Fig. 25) este format din două lanțuri α legate prin punți disulfurice. Insulina reglează procesele metabolice care implică glucoza, absența acesteia duce la diabet.
Orez. 25 INSULINĂ PROTEINĂ
Glanda pituitară a creierului sintetizează un hormon care reglează creșterea organismului. Exista proteine reglatoare care controlează biosinteza diferitelor enzime din organism.
Proteinele contractile și motorii dau corpului capacitatea de a se contracta, de a schimba forma și de a se mișca, în primul rând, vorbim despre mușchi. 40% din masa tuturor proteinelor conținute în mușchi este miozină (mys, myos, greacă. - mușchi). Molecula sa conține atât o parte fibrilară, cât și una globulară (Fig. 26)
Orez. 26 MOLECULA DE MIOZInă
Astfel de molecule se combină în agregate mari care conțin 300-400 de molecule.
Când concentrația ionilor de calciu se modifică în spațiul din jurul fibrelor musculare, are loc o modificare reversibilă a conformației moleculelor - o schimbare a formei lanțului datorită rotației fragmentelor individuale în jurul legăturilor de valență. Acest lucru duce la contracția și relaxarea mușchilor, semnalul de modificare a concentrației ionilor de calciu provine de la terminațiile nervoase din fibrele musculare. Contracția musculară artificială poate fi cauzată de acțiunea impulsurilor electrice, ducând la o schimbare bruscă a concentrației ionilor de calciu, aceasta este baza pentru stimularea mușchiului inimii pentru a restabili activitatea inimii.
Proteinele protectoare vă permit să protejați organismul de invazia bacteriilor atacatoare, virușilor și de pătrunderea proteinelor străine (denumirea generalizată a corpurilor străine este antigene). Rolul proteinelor protectoare este îndeplinit de imunoglobuline (celălalt nume al lor este anticorpi), ele recunosc antigenele care au pătruns în organism și se leagă ferm de ele. În corpul mamiferelor, inclusiv al oamenilor, există cinci clase de imunoglobuline: M, G, A, D și E, structura lor, după cum sugerează și numele, este globulară, în plus, toate sunt construite într-un mod similar. Organizarea moleculară a anticorpilor este prezentată mai jos folosind imunoglobulina de clasă G ca exemplu (Fig. 27). Molecula conține patru lanțuri polipeptidice conectate prin trei punți disulfurice S-S (în Fig. 27 sunt prezentate cu legături de valență îngroșate și simboluri S mari), în plus, fiecare lanț polimeric conține punți disulfurice intracatenei. Două lanțuri polimerice mari (evidențiate cu albastru) conțin 400–600 de reziduuri de aminoacizi. Alte două lanțuri (evidențiate în verde) sunt aproape jumătate mai lungi, conținând aproximativ 220 de resturi de aminoacizi. Toate cele patru lanțuri sunt amplasate în așa fel încât grupările terminale H2N sunt direcționate într-o singură direcție.
Orez. 27 DESENUL SCHEMATIC AL STRUCTURII IMUNOGLOBULINEI
După contactul corpului cu o proteină străină (antigen), celulele sistem imunitarîncepe să producă imunoglobuline (anticorpi), care se acumulează în serul sanguin. În prima etapă, munca principală este realizată de secțiuni de lanț care conțin terminalul H 2 N (în Fig. 27, secțiunile corespunzătoare sunt marcate cu albastru deschis și verde deschis). Acestea sunt locuri de captare a antigenului. În procesul de sinteză a imunoglobulinei, aceste situsuri sunt formate în așa fel încât structura și configurația lor să corespundă cât mai mult posibil cu structura antigenului care se apropie (ca o cheie a unui lacăt, ca enzimele, dar sarcinile în acest caz sunt diferit). Astfel, pentru fiecare antigen, un anticorp strict individual este creat ca răspuns imun. Nici o proteină cunoscută nu își poate schimba structura atât de „plastic” în funcție de factori externi, pe lângă imunoglobuline. Enzimele rezolvă problema conformității structurale cu reactivul într-un mod diferit - cu ajutorul unui set gigantic de diverse enzime pentru toate cazurile posibile, iar imunoglobulinele reconstruiesc de fiecare dată „instrumentul de lucru”. Mai mult decât atât, regiunea balama a imunoglobulinei (Fig. 27) oferă celor două regiuni de captare o oarecare mobilitate independentă, ca urmare, molecula de imunoglobulină poate „găsi” imediat cele două regiuni cele mai convenabile pentru captare în antigen pentru a fixa în siguranță. aceasta seamănă cu acțiunile unei creaturi crustacee.
Apoi, se activează un lanț de reacții succesive ale sistemului imunitar al organismului, se conectează imunoglobulinele din alte clase, ca urmare, proteina străină este dezactivată, iar apoi antigenul (microorganism străin sau toxina) este distrus și îndepărtat.
După contactul cu antigenul, concentrația maximă de imunoglobuline este atinsă (în funcție de natura antigenului și de caracteristicile individuale ale organismului însuși) în câteva ore (uneori câteva zile). Organismul păstrează memoria unui astfel de contact, iar atunci când este atacat din nou cu același antigen, imunoglobulinele se acumulează în serul sanguin mult mai repede și în cantități mai mari - apare imunitatea dobândită.
Clasificarea de mai sus a proteinelor este într-o anumită măsură condiționată, de exemplu, proteina trombină, menționată printre proteinele protectoare, este în esență o enzimă care catalizează hidroliza legăturilor peptidice, adică aparține clasei de proteaze.
Proteinele protectoare sunt adesea denumite proteine de venin de șarpe și proteine toxice ale unor plante, deoarece sarcina lor este de a proteja organismul de daune.
Există proteine ale căror funcții sunt atât de unice încât face dificilă clasificarea lor. De exemplu, proteina monelina, găsită într-o plantă africană, are un gust foarte dulce și a făcut obiectul studiului ca substanță netoxică care poate fi folosită în locul zahărului pentru a preveni obezitatea. Plasma sanguină a unor pești din Antarctica conține proteine cu proprietăți antigel care împiedică înghețarea sângelui acestor pești.
Sinteza artificială a proteinelor.
Condensarea aminoacizilor care duce la un lanț polipeptidic este un proces bine studiat. Este posibil să se efectueze, de exemplu, condensarea oricărui aminoacid sau un amestec de acizi și să se obțină, respectiv, un polimer care conține aceleași unități, sau unități diferite, alternând în ordine aleatorie. Astfel de polimeri se aseamănă puțin cu polipeptidele naturale și nu posedă activitate biologică. Sarcina principală este de a conecta aminoacizii într-o ordine strict definită, pre-planificată, pentru a reproduce secvența reziduurilor de aminoacizi din proteinele naturale. Omul de știință american Robert Merrifield a propus o metodă originală care a făcut posibilă rezolvarea unei astfel de probleme. Esența metodei este că primul aminoacid este atașat la un gel polimeric insolubil care conține grupări reactive care se pot combina cu grupele –COOH – ale aminoacidului. Polistirenul reticulat cu grupări clormetil introduse în el a fost luat ca atare substrat polimeric. Pentru ca aminoacidul luat pentru reacție să nu reacționeze cu el însuși și să nu unească gruparea H2N cu substratul, gruparea amino a acestui acid este pre-blocata cu un substituent voluminos [(C4H 9) 3] 3 OS (O) -grup. După ce aminoacidul s-a atașat la suportul polimeric, gruparea de blocare este îndepărtată și un alt aminoacid este introdus în amestecul de reacție, în care gruparea H2N este de asemenea blocată anterior. Într-un astfel de sistem, este posibilă doar interacțiunea grupării H2N a primului aminoacid și a grupării –COOH a celui de-al doilea acid, care se realizează în prezența catalizatorilor (săruri de fosfoniu). Apoi se repetă întreaga schemă, introducând al treilea aminoacid (Fig. 28).
Orez. 28. SCHEMA DE SINTEZĂ A LANȚURILOR DE POLIPEPTIDE
În ultima etapă, lanțurile polipeptidice rezultate sunt separate de suportul de polistiren. Acum întregul proces este automatizat, există sintetizatoare automate de peptide care funcționează conform schemei descrise. Multe peptide utilizate în medicină și agricultură au fost sintetizate prin această metodă. De asemenea, a fost posibil să se obțină analogi îmbunătățiți ai peptidelor naturale cu acțiune selectivă și îmbunătățită. Au fost sintetizate unele proteine mici, cum ar fi hormonul insulina și unele enzime.
Există și metode de sinteză a proteinelor care copiază procese naturale: sintetizează fragmente de acizi nucleici reglați pentru a produce anumite proteine, apoi aceste fragmente sunt introduse într-un organism viu (de exemplu, într-o bacterie), după care organismul începe să producă proteina dorită. În acest fel, se obțin acum cantități semnificative de proteine și peptide greu accesibile, precum și analogii acestora.
Proteinele ca surse alimentare.
Proteinele dintr-un organism viu sunt descompuse în mod constant în aminoacizii lor originali (cu participarea indispensabilă a enzimelor), unii aminoacizi trec în alții, apoi proteinele sunt sintetizate din nou (și cu participarea enzimelor), adică. corpul se reînnoiește constant. Unele proteine (colagenul pielii, parul) nu sunt reinnoite, organismul le pierde continuu si in schimb sintetizeaza altele noi. Proteinele ca surse alimentare îndeplinesc două funcții principale: furnizează organismului material de construcție pentru sinteza de noi molecule de proteine și, în plus, furnizează organismului energie (surse de calorii).
Mamiferele carnivore (inclusiv oamenii) obțin proteinele necesare din alimente vegetale și animale. Niciuna dintre proteinele obținute din alimente nu este integrată în organism într-o formă neschimbată. În tractul digestiv, toate proteinele absorbite sunt descompuse în aminoacizi, iar proteinele necesare unui anumit organism sunt deja construite din ele, în timp ce restul de 12 pot fi sintetizați din 8 acizi esențiali (Tabelul 1) în organism dacă nu sunt. furnizate în cantități suficiente cu alimente, dar acizii esențiali trebuie să fie furnizați cu alimente fără greșeală. Atomii de sulf din cisteină sunt obținuți de organism cu aminoacidul esențial metionină. O parte din proteine se descompune, eliberând energia necesară menținerii vieții, iar azotul conținut în ele este excretat din organism prin urină. De obicei, corpul uman pierde 25–30 g de proteine pe zi, astfel încât alimentele proteice trebuie să fie întotdeauna prezente în cantitatea potrivită. Necesarul minim zilnic de proteine este de 37 g pentru bărbați și 29 g pentru femei, dar aportul recomandat este aproape de două ori mai mare. Atunci când evaluați alimentele, este important să luați în considerare calitatea proteinelor. În absența sau conținutul scăzut de aminoacizi esențiali, proteina este considerată de valoare scăzută, astfel încât astfel de proteine ar trebui consumate în cantități mai mari. Așadar, proteinele leguminoaselor conțin puțină metionină, iar proteinele grâului și porumbului sunt sărace în lizină (ambele aminoacizi sunt esențiali). Proteinele animale (cu excepția colagenului) sunt clasificate ca alimente complete. Un set complet de toți acizii esențiali conține cazeină din lapte, precum și brânză de vaci și brânză preparată din aceasta, deci o dietă vegetariană, dacă este foarte strictă, adică. „fără lactate”, necesită un consum crescut de leguminoase, nuci și ciuperci pentru a furniza organismului aminoacizi esențiali în cantitatea potrivită.
Aminoacizii și proteinele sintetice sunt, de asemenea, folosiți ca produse alimentare, adăugându-le în furaje, care conțin aminoacizi esențiali în cantități mici. Există bacterii care pot procesa și asimila hidrocarburile uleioase, în acest caz, pentru sinteza completă a proteinelor, acestea trebuie hrănite cu compuși care conțin azot (amoniac sau nitrați). Proteina obtinuta in acest mod este folosita ca hrana pentru animale si pasari. Un set de enzime, carbohidraze, care catalizează hidroliza componentelor greu de descompune ale alimentelor cu carbohidrați ( pereții celulari culturi de cereale), în urma cărora alimentele vegetale sunt absorbite mai complet.
Mihail Levitsky
PROTEINE (Articolul 2)
(proteine), o clasă de compuși complecși care conțin azot, cei mai caracteristici și importanți (împreună cu acizii nucleici) componente ale materiei vii. Proteinele îndeplinesc multe și variate funcții. Majoritatea proteinelor sunt enzime care catalizează reacții chimice. Mulți hormoni care reglează procesele fiziologice sunt si proteine. Proteinele structurale precum colagenul și cheratina sunt principalele componente ale țesutului osos, părului și unghiilor. Proteinele contractile ale mușchilor au capacitatea de a-și modifica lungimea, folosind energia chimică pentru a efectua lucrări mecanice. Proteinele sunt anticorpi care leagă și neutralizează substanțele toxice. Unele proteine la care pot răspunde influente externe(lumină, miros), servesc ca receptori în organele de simț care percep iritația. Multe proteine situate în interiorul celulei și pe membrana celulară îndeplinesc funcții de reglare.
În prima jumătate a secolului al XIX-lea mulți chimiști, și printre ei în primul rând J. von Liebig, au ajuns treptat la concluzia că proteinele sunt o clasă specială de compuși azotați. Denumirea de „proteine” (din grecescul protos – primul) a fost propusă în 1840 de chimistul olandez G. Mulder.
PROPRIETĂȚI FIZICE
Proteinele sunt albe în stare solidă, dar incolore în soluție, cu excepția cazului în care poartă un grup cromofor (colorat), cum ar fi hemoglobina. Solubilitatea în apă a diferitelor proteine variază foarte mult. De asemenea, variază cu pH-ul și cu concentrația de săruri din soluție, astfel încât se pot alege condițiile în care o proteină va precipita selectiv în prezența altor proteine. Această metodă de „sărare” este utilizată pe scară largă pentru izolarea și purificarea proteinelor. Proteina purificată precipită adesea din soluție sub formă de cristale.
În comparație cu alți compuși, greutatea moleculară a proteinelor este foarte mare - de la câteva mii la multe milioane de daltoni. Prin urmare, în timpul ultracentrifugării, proteinele sunt precipitate și, în plus, la viteze diferite. Datorită prezenței grupurilor încărcate pozitiv și negativ în moleculele de proteine, acestea se mișcă la viteze diferite și în câmp electric. Aceasta este baza electroforezei, o metodă folosită pentru a izola proteinele individuale din amestecuri complexe. Purificarea proteinelor se realizează și prin cromatografie.
PROPRIETĂȚI CHIMICE
Structura.
Proteinele sunt polimeri, adică molecule construite ca lanțuri din unități monomerice repetate, sau subunități, al căror rol este jucat de alfa-aminoacizi. Formula generala aminoacizi
unde R este un atom de hidrogen sau o grupare organică.
O moleculă de proteină (lanț polipeptidic) poate consta doar dintr-un număr relativ mic de aminoacizi sau câteva mii de unități monomerice. Conectarea aminoacizilor într-un lanț este posibilă deoarece fiecare dintre ei are două grupe chimice diferite: o grupare amino cu proprietăți bazice, NH2, și o grupare carboxil acidă, COOH. Ambele grupări sunt atașate la un atom de carbon. Gruparea carboxil a unui aminoacid poate forma o legătură amidă (peptidă) cu gruparea amino a altui aminoacid:
După ce doi aminoacizi au fost conectați în acest fel, lanțul poate fi extins prin adăugarea unui al treilea la al doilea aminoacid și așa mai departe. După cum se poate observa din ecuația de mai sus, atunci când se formează o legătură peptidică, este eliberată o moleculă de apă. În prezența acizilor, alcalinelor sau a enzimelor proteolitice, reacția se desfășoară în direcția opusă: lanțul polipeptidic este scindat în aminoacizi cu adăugarea de apă. Această reacție se numește hidroliză. Hidroliza are loc spontan, iar energia este necesară pentru a combina aminoacizii într-un lanț polipeptidic.
O grupare carboxil și o grupare amidă (sau o grupare imidă similară cu aceasta - în cazul aminoacidului prolina) sunt prezente în toți aminoacizii, în timp ce diferențele dintre aminoacizi sunt determinate de natura acelei grupe, sau „partea”. lanț", care este indicat mai sus prin litera R. Rolul catenei laterale poate fi jucat de un atom de hidrogen, cum ar fi aminoacidul glicina, și de unele grupări voluminoase, cum ar fi histidina și triptofanul. Unele lanțuri laterale sunt inerte chimic, în timp ce altele sunt foarte reactive.
Pot fi sintetizați multe mii de aminoacizi diferiți și mulți aminoacizi diferiți apar în natură, dar pentru sinteza proteinelor se folosesc doar 20 de tipuri de aminoacizi: alanină, arginină, asparagină, acid aspartic, valină, histidină, glicină, glutamină, glutamic. acid, izoleucină, leucină, lizină, metionină, prolină, serină, tirozină, treonină, triptofan, fenilalanină și cisteină (în proteine, cisteina poate fi prezentă ca dimer - cistina). Adevărat, în unele proteine există și alți aminoacizi în plus față de cei douăzeci care apar în mod regulat, dar aceștia se formează ca urmare a modificării oricăruia dintre cei douăzeci enumerați după ce a fost inclus în proteină.
activitate optică.
Toți aminoacizii, cu excepția glicinei, au patru grupe diferite atașate la atomul de carbon α. În ceea ce privește geometria, patru grupuri diferite pot fi atașate în două moduri și, în consecință, există două configurații posibile, sau doi izomeri, legați unul de celălalt ca obiect la imaginea sa în oglindă, de exemplu. Cum mâna stângă La dreapta. O configurație se numește stânga sau stângaci (L), iar cealaltă dreptaci sau dreptaci (D), deoarece cei doi astfel de izomeri diferă în direcția de rotație a planului luminii polarizate. Doar L-aminoacizii apar în proteine (excepția este glicina; aceasta poate fi reprezentată doar într-o singură formă, deoarece două dintre cele patru grupe ale sale sunt aceleași) și toți au activitate optică (din moment ce există un singur izomer). D-aminoacizii sunt rari în natură; se găsesc în unele antibiotice și în peretele celular al bacteriilor.
Secvența de aminoacizi.
Aminoacizii din lanțul polipeptidic nu sunt aranjați aleatoriu, ci într-o anumită ordine fixă, iar această ordine determină funcțiile și proprietățile proteinei. Variând ordinea celor 20 de tipuri de aminoacizi, puteți obține un număr mare de proteine diferite, la fel cum puteți alcătui multe texte diferite din literele alfabetului.
În trecut, determinarea secvenței de aminoacizi a unei proteine a durat adesea câțiva ani. Definiție directă iar acum o sarcină destul de laborioasă, deși au fost create dispozitive care permit realizarea automată a acesteia. De obicei, este mai ușor să determinați secvența de nucleotide a genei corespunzătoare și să obțineți secvența de aminoacizi a proteinei din aceasta. Până în prezent, secvențele de aminoacizi a multor sute de proteine au fost deja determinate. Funcțiile proteinelor decodificate sunt de obicei cunoscute, iar acest lucru ajută la imaginarea posibilelor funcții ale proteinelor similare formate, de exemplu, în neoplasmele maligne.
Proteine complexe.
Proteinele care constau numai din aminoacizi sunt numite simple. Deseori, totuși, un atom de metal sau un compus chimic care nu este un aminoacid este atașat la lanțul polipeptidic. Astfel de proteine sunt numite complexe. Un exemplu este hemoglobina: conține porfirina de fier, care îi conferă culoarea roșie și îi permite să acționeze ca purtător de oxigen.
Denumirile majorității proteinelor complexe conțin o indicație a naturii grupelor atașate: zaharurile sunt prezente în glicoproteine, grăsimile în lipoproteine. Dacă activitatea catalitică a enzimei depinde de grupul atașat, atunci se numește grup protetic. Adesea, unele vitamine joacă rolul unui grup protetic sau fac parte din acesta. Vitamina A, de exemplu, atașată la una dintre proteinele retinei, determină sensibilitatea acesteia la lumină.
Structura terțiară.
Ceea ce este important nu este atât secvența de aminoacizi a proteinei (structura primară), cât și modul în care este așezată în spațiu. De-a lungul întregii lungimi a lanțului polipeptidic, ionii de hidrogen formează legături regulate de hidrogen, care îi conferă forma unei spirale sau a unui strat (structură secundară). Din combinarea unor astfel de spirale și straturi, ia naștere o formă compactă. următoarea comandă- structura terţiară a proteinei. În jurul legăturilor care țin legăturile monomerice ale lanțului, sunt posibile rotații prin unghiuri mici. Prin urmare, din punct de vedere pur geometric, numărul de configurații posibile pentru orice lanț polipeptidic este infinit de mare. În realitate, fiecare proteină există în mod normal într-o singură configurație, determinată de secvența sa de aminoacizi. Această structură nu este rigidă, pare că „respiră” - oscilează în jurul unei anumite configurații medii. Lanțul este pliat într-o configurație în care energia liberă (capacitatea de a lucra) este minimă, la fel cum un arc eliberat este comprimat doar într-o stare corespunzătoare unui minim de energie liberă. Adesea, o parte a lanțului este legată rigid de cealaltă prin legături disulfurice (–S–S–) între două reziduuri de cisteină. Acesta este, parțial, motivul pentru care cisteina dintre aminoacizi joacă un rol deosebit de important.
Complexitatea structurii proteinelor este atât de mare încât nu este încă posibil să se calculeze structura terțiară a unei proteine, chiar dacă secvența ei de aminoacizi este cunoscută. Dar dacă este posibil să se obțină cristale de proteine, atunci structura sa terțiară poate fi determinată prin difracție de raze X.
În proteinele structurale, contractile și în unele alte proteine, lanțurile sunt alungite și mai multe lanțuri ușor pliate situate unul lângă altul formează fibrile; fibrilele, la rândul lor, se pliază în formațiuni mai mari - fibre. Cu toate acestea, majoritatea proteinelor în soluție sunt globulare: lanțurile sunt înfășurate într-un glob, ca firele într-o minge. Energia liberă cu această configurație este minimă, deoarece aminoacizii hidrofobi („resplători de apă”) sunt ascunși în interiorul globului, iar aminoacizii hidrofili („atrage apa”) sunt pe suprafața acestuia.
Multe proteine sunt complexe ale mai multor lanțuri polipeptidice. Această structură se numește structura cuaternară a proteinei. Molecula de hemoglobină, de exemplu, este formată din patru subunități, fiecare dintre ele fiind o proteină globulară.
Proteinele structurale datorită configurației lor liniare formează fibre în care rezistența la tracțiune este foarte mare, în timp ce configurația globulară permite proteinelor să intre în interacțiuni specifice cu alți compuși. Pe suprafața globului, cu așezarea corectă a lanțurilor, apar cavități de o anumită formă, în care se află grupări chimice reactive. Dacă această proteină este o enzimă, atunci o altă moleculă, de obicei mai mică, a unei substanțe intră într-o astfel de cavitate, așa cum o cheie intră într-o broască; în acest caz, configurația norului de electroni al moleculei se modifică sub influența grupărilor chimice situate în cavitate, iar acest lucru îl obligă să reacționeze într-un anumit mod. În acest fel, enzima catalizează reacția. Moleculele de anticorpi au, de asemenea, cavități în care se leagă diferite substanțe străine și sunt astfel făcute inofensive. Modelul „cheie și blocare”, care explică interacțiunea proteinelor cu alți compuși, face posibilă înțelegerea specificității enzimelor și anticorpilor, adică. capacitatea lor de a reacţiona numai cu anumiţi compuşi.
Proteine în diferite tipuri de organisme.
Proteinele care îndeplinesc aceeași funcție în diferite specii de plante și animale și, prin urmare, poartă același nume au, de asemenea, o configurație similară. Ele, totuși, diferă oarecum în secvența lor de aminoacizi. Pe măsură ce speciile se depărtează de un strămoș comun, unii aminoacizi în anumite poziții sunt înlocuiți cu mutații cu alții. Mutațiile dăunătoare care provoacă boli ereditare sunt eliminate prin selecție naturală, dar cele benefice sau cel puțin neutre pot fi păstrate. Cu cât două specii biologice sunt mai apropiate una de cealaltă, cu atât se găsesc mai puține diferențe în proteinele lor.
Unele proteine se schimbă relativ repede, altele sunt destul de conservatoare. Acestea din urmă includ, de exemplu, citocromul c, o enzimă respiratorie găsită în majoritatea organismelor vii. La oameni și la cimpanzei, secvențele sale de aminoacizi sunt identice, în timp ce în citocromul c al grâului, doar 38% dintre aminoacizi s-au dovedit a fi diferiți. Chiar și atunci când comparăm oameni și bacterii, asemănarea citocromilor cu (diferențele de aici afectează 65% dintre aminoacizi) poate fi încă observată, deși strămoșul comun al bacteriilor și al oamenilor a trăit pe Pământ în urmă cu aproximativ două miliarde de ani. În zilele noastre, compararea secvențelor de aminoacizi este adesea folosită pentru a construi un arbore filogenetic (genealogic) care reflectă relațiile evolutive dintre diferite organisme.
Denaturarea.
Molecula de proteină sintetizată, pliabilă, capătă propria configurație. Această configurație poate fi însă distrusă prin încălzire, prin modificarea pH-ului, prin acțiunea solvenților organici și chiar prin simpla agitare a soluției până când apar bule pe suprafața acesteia. O proteină alterată în acest fel se numește denaturată; își pierde activitatea biologică și devine de obicei insolubilă. Exemple binecunoscute de proteine denaturate sunt ouăle fierte sau frișca. Proteinele mici, care conțin doar aproximativ o sută de aminoacizi, sunt capabile să se renatureze, adică. redobândiți configurația originală. Dar majoritatea proteinelor sunt pur și simplu transformate într-o masă de lanțuri polipeptidice încurcate și nu își restabilesc configurația anterioară.
Una dintre principalele dificultăți în izolarea proteinelor active este sensibilitatea lor extremă la denaturare. Această proprietate a proteinelor își găsește o aplicație utilă în conservarea produselor alimentare: temperatura ridicată denaturează ireversibil enzimele microorganismelor, iar microorganismele mor.
SINTEZA PROTEINEI
Pentru sinteza proteinelor, un organism viu trebuie să aibă un sistem de enzime capabile să atașeze un aminoacid de altul. De asemenea, este necesară o sursă de informații care să determine ce aminoacizi ar trebui conectați. Deoarece există mii de tipuri de proteine în organism și fiecare dintre ele constă în medie din câteva sute de aminoacizi, informațiile necesare trebuie să fie cu adevărat enorme. Este stocat (similar cu modul în care o înregistrare este stocată pe o bandă magnetică) în moleculele de acid nucleic care alcătuiesc genele.
Activarea enzimatică.
Un lanț polipeptidic sintetizat din aminoacizi nu este întotdeauna o proteină în el forma finala. Multe enzime sunt mai întâi sintetizate ca precursori inactivi și devin active numai după ce o altă enzimă îndepărtează câțiva aminoacizi de la un capăt al lanțului. Unele dintre enzimele digestive, cum ar fi tripsina, sunt sintetizate în această formă inactivă; aceste enzime sunt activate în tractul digestiv ca urmare a îndepărtării fragmentului terminal al lanțului. Hormonul insulina, a cărui moleculă în forma sa activă este formată din două lanțuri scurte, este sintetizat sub forma unui singur lanț, așa-numitul. proinsulină. Apoi partea de mijloc a acestui lanț este îndepărtată, iar fragmentele rămase se leagă unele de altele, formând molecula de hormon activ. Proteinele complexe se formează numai după ce un anumit grup chimic este atașat la proteină, iar acest atașament necesită adesea și o enzimă.
Circulația metabolică.
După hrănirea unui animal cu aminoacizi marcați cu izotopi radioactivi de carbon, azot sau hidrogen, eticheta este rapid încorporată în proteinele sale. Dacă aminoacizii marcați încetează să intre în organism, atunci cantitatea de etichetă în proteine începe să scadă. Aceste experimente arată că proteinele rezultate nu sunt stocate în organism până la sfârșitul vieții. Toate acestea, cu câteva excepții, sunt într-o stare dinamică, descompunându-se constant în aminoacizi, apoi resintetizați.
Unele proteine se descompun atunci când celulele mor și sunt distruse. Acest lucru se întâmplă tot timpul, de exemplu, cu celulele roșii din sânge și celulele epiteliale care căptușesc suprafața interioară a intestinului. În plus, descompunerea și resinteza proteinelor au loc și în celulele vii. Destul de ciudat, se știe mai puțin despre descompunerea proteinelor decât despre sinteza lor. Ceea ce este clar, însă, este că enzimele proteolitice sunt implicate în defalcare, similare celor care descompun proteinele în aminoacizi în tractul digestiv.
Timpul de înjumătățire al diferitelor proteine este diferit - de la câteva ore la multe luni. Singura excepție sunt moleculele de colagen. Odată formate, acestea rămân stabile și nu sunt reînnoite sau înlocuite. În timp, însă, unele dintre proprietățile lor, în special elasticitatea, se modifică și, deoarece nu sunt reînnoite, anumite modificări legate de vârstă sunt rezultatul acestui lucru, de exemplu, apariția ridurilor pe piele.
proteine sintetice.
Chimiștii au învățat de mult cum să polimerizeze aminoacizii, dar aminoacizii se combină aleatoriu, astfel încât produsele unei astfel de polimerizări se aseamănă puțin cu cele naturale. Adevărat, este posibilă combinarea aminoacizilor într-o ordine dată, ceea ce face posibilă obținerea unor proteine active biologic, în special insulină. Procesul este destul de complicat, iar în acest fel este posibil să se obțină doar acele proteine ale căror molecule conțin aproximativ o sută de aminoacizi. Este de preferat în schimb să se sintetizeze sau să izola secvența de nucleotide a unei gene corespunzătoare secvenței de aminoacizi dorite și apoi să se introducă această genă într-o bacterie, care va produce prin replicare o cantitate mare din produsul dorit. Această metodă are însă și dezavantajele sale.
PROTEINE ȘI NUTRIȚIE
Când proteinele din organism sunt descompuse în aminoacizi, acești aminoacizi pot fi reutilizați pentru sinteza proteinelor. În același timp, aminoacizii înșiși sunt supuși degradarii, astfel încât nu sunt utilizați pe deplin. De asemenea, este clar că în timpul creșterii, sarcinii și vindecării rănilor, sinteza proteinelor trebuie să depășească degradarea. Organismul pierde continuu unele proteine; acestea sunt proteinele părului, ale unghiilor și ale stratului de suprafață al pielii. Prin urmare, pentru sinteza proteinelor, fiecare organism trebuie să primească aminoacizi din alimente.
Surse de aminoacizi.
Plantele verzi sintetizează toți cei 20 de aminoacizi găsiți în proteine din CO2, apă și amoniac sau nitrați. Multe bacterii sunt, de asemenea, capabile să sintetizeze aminoacizi în prezența zahărului (sau a unui echivalent) și a azotului fixat, dar zahărul este în cele din urmă furnizat de plantele verzi. La animale, capacitatea de a sintetiza aminoacizi este limitată; obțin aminoacizi mâncând plante verzi sau alte animale. În tractul digestiv, proteinele absorbite sunt descompuse în aminoacizi, aceştia din urmă sunt absorbiţi, iar din acestea se construiesc proteinele caracteristice organismului dat. Niciuna dintre proteinele absorbite nu este încorporată în structurile corpului ca atare. Singura excepție este că la multe mamifere, o parte din anticorpii materni pot trece intacte prin placentă în circulația fetală, iar prin laptele matern (în special la rumegătoare) pot fi transferate nou-născutului imediat după naștere.
Nevoia de proteine.
Este clar că pentru a menține viața, organismul trebuie să primească o anumită cantitate de proteine din alimente. Cu toate acestea, dimensiunea acestei nevoi depinde de o serie de factori. Organismul are nevoie de hrană atât ca sursă de energie (calorii), cât și ca material pentru construirea structurilor sale. În primul rând este nevoia de energie. Aceasta înseamnă că atunci când există puțini carbohidrați și grăsimi în dietă, proteinele dietetice sunt folosite nu pentru sinteza propriilor proteine, ci ca sursă de calorii. Cu postul prelungit, chiar și propriile proteine sunt cheltuite pentru a satisface nevoile energetice. Dacă în dietă există destui carbohidrați, atunci aportul de proteine poate fi redus.
bilantul de azot.
În medie cca. 16% din masa totală de proteine este azot. Când aminoacizii care alcătuiesc proteinele sunt descompuse, azotul conținut în aceștia este excretat din organism prin urină și (într-o măsură mai mică) în fecale sub formă de diverși compuși azotați. Prin urmare, este convenabil să se utilizeze un astfel de indicator precum balanța de azot pentru a evalua calitatea nutriției proteice, de exemplu. diferența (în grame) dintre cantitatea de azot introdusă în organism și cantitatea de azot excretată pe zi. Cu o alimentație normală la un adult, aceste cantități sunt egale. Într-un organism în creștere, cantitatea de azot excretat este mai mică decât cantitatea de azot primit, de exemplu. soldul este pozitiv. Cu o lipsă de proteine în dietă, echilibrul este negativ. Dacă în dietă există suficiente calorii, dar proteinele sunt complet absente în ea, organismul economisește proteine. În același timp, metabolismul proteic încetinește, iar reutilizarea aminoacizilor în sinteza proteinelor decurge cât mai eficient posibil. Cu toate acestea, pierderile sunt inevitabile, iar compușii azotați sunt încă excretați în urină și parțial în fecale. Cantitatea de azot excretată din organism pe zi în timpul înfometării de proteine poate servi ca măsură a lipsei zilnice de proteine. Este firesc să presupunem că prin introducerea în alimentație a unei cantități de proteine echivalente cu această deficiență, este posibilă restabilirea echilibrului de azot. Cu toate acestea, nu este. După ce a primit această cantitate de proteine, organismul începe să folosească aminoacizii mai puțin eficient, așa că sunt necesare niște proteine suplimentare pentru a restabili echilibrul de azot.
Dacă cantitatea de proteine din dietă depășește ceea ce este necesar pentru a menține echilibrul de azot, atunci nu pare să fie rău din acest lucru. Aminoacizii în exces sunt pur și simplu folosiți ca sursă de energie. Un exemplu deosebit de izbitor este eschimosul, care consumă puțini carbohidrați și de aproximativ zece ori mai multe proteine decât este necesar pentru a menține echilibrul de azot. În majoritatea cazurilor, totuși, utilizarea proteinelor ca sursă de energie este dezavantajoasă din cauza o anumită sumă Puteți obține mult mai multe calorii din carbohidrați decât din aceeași cantitate de proteine. În țările sărace, populația primește caloriile necesare din carbohidrați și consumă o cantitate minimă de proteine.
Dacă organismul primește numărul necesar de calorii sub formă de produse neproteice, atunci cantitatea minimă de proteine care menține echilibrul de azot este de cca. 30 g pe zi. Aproximativ la fel de multă proteină este conținută în patru felii de pâine sau 0,5 litri de lapte. O cantitate puțin mai mare este de obicei considerată optimă; recomandat de la 50 la 70 g.
Aminoacizi esentiali.
Până acum, proteinele au fost considerate ca un întreg. Între timp, pentru ca sinteza proteinelor să aibă loc, toți aminoacizii necesari trebuie să fie prezenți în organism. Unii dintre aminoacizii pe care organismul animalului însuși este capabil să-i sintetizeze. Se numesc interschimbabile, deoarece nu trebuie să fie prezente în dietă - este important doar ca, în general, aportul de proteine ca sursă de azot să fie suficient; apoi, cu un deficit de aminoacizi neesențiali, organismul îi poate sintetiza în detrimentul celor care sunt prezenți în exces. Aminoacizii „esențiali” rămași nu pot fi sintetizați și trebuie ingerați cu alimente. Esențiale pentru oameni sunt valina, leucina, izoleucina, treonina, metionina, fenilalanina, triptofanul, histidina, lizina și arginina. (Deși arginina poate fi sintetizată în organism, este considerată un aminoacid esențial deoarece nou-născuții și copiii în creștere produc cantități insuficiente din acesta. Pe de altă parte, pentru o persoană de vârstă matură, aportul unora dintre acești aminoacizi din alimente poate deveni opțional.)
Această listă de aminoacizi esențiali este aproximativ aceeași la alte vertebrate și chiar la insecte. Valoarea nutritivă a proteinelor este de obicei determinată prin hrănirea lor la șobolani în creștere și monitorizarea creșterii în greutate a animalelor.
Valoarea nutritivă a proteinelor.
Valoarea nutritivă a unei proteine este determinată de aminoacidul esențial care este cel mai deficitar. Să ilustrăm acest lucru cu un exemplu. Proteinele corpului nostru conțin în medie cca. 2% triptofan (în greutate). Să presupunem că dieta include 10 g de proteine care conțin 1% triptofan și că există destui alți aminoacizi esențiali în ea. În cazul nostru, 10 g din această proteină defectuoasă este în esență echivalent cu 5 g dintr-o proteină completă; restul de 5 g poate servi doar ca sursă de energie. Rețineți că, deoarece aminoacizii practic nu sunt stocați în organism și pentru ca sinteza proteinelor să aibă loc, toți aminoacizii trebuie să fie prezenți simultan, efectul aportului de aminoacizi esențiali poate fi detectat numai dacă toți intră în corpul în același timp.
Compoziția medie a majorității proteinelor animale este apropiată de compoziția medie a proteinelor corpul uman, așa că deficitul de aminoacizi este puțin probabil să ne amenințe dacă dieta noastră este bogată în alimente precum carne, ouă, lapte și brânză. Cu toate acestea, există proteine, precum gelatina (un produs al denaturarii colagenului), care conțin foarte puțini aminoacizi esențiali. Proteinele vegetale, deși sunt mai bune decât gelatina în acest sens, sunt și ele sărace în aminoacizi esențiali; mai ales puțin în ele lizină și triptofan. Cu toate acestea, o dietă pur vegetariană nu este deloc dăunătoare, decât dacă consumă o cantitate ceva mai mare de proteine vegetale, suficientă pentru a furniza organismului aminoacizi esențiali. Majoritatea proteinelor se găsesc în plante în semințe, în special în semințele de grâu și diferite leguminoase. Lăstarii tineri, cum ar fi sparanghelul, sunt, de asemenea, bogați în proteine.
Proteine sintetice în dietă.
Prin adăugarea unor cantități mici de aminoacizi esențiali sintetici sau proteine bogate în acestea la proteinele incomplete, precum proteinele din porumb, este posibilă creșterea semnificativă a valorii nutriționale a acestora din urmă, adică. crescând astfel cantitatea de proteine consumată. O altă posibilitate este să crești bacterii sau drojdii pe hidrocarburi petroliere cu adaos de nitrați sau amoniac ca sursă de azot. Proteina microbiană obținută în acest mod poate servi ca hrană pentru păsări de curte sau animale, sau poate fi consumată direct de oameni. A treia metodă, utilizată pe scară largă, utilizează fiziologia rumegătoarelor. La rumegătoare, în secțiunea inițială a stomacului, așa-numitele. Rumenul este locuit de forme speciale de bacterii și protozoare care transformă proteinele vegetale defecte în proteine microbiene mai complete, iar acestea, la rândul lor, după digestie și absorbție, se transformă în proteine animale. Ureea, un compus sintetic ieftin care conține azot, poate fi adăugată în hrana animalelor. Microorganismele care trăiesc în rumen folosesc azotul ureic pentru a transforma carbohidrații (din care sunt mult mai mulți în furaj) în proteine. Aproximativ o treime din tot azotul din hrana animalelor poate veni sub formă de uree, ceea ce înseamnă în esență, într-o anumită măsură, sinteza chimică a proteinelor.
Doneţk şcoală cuprinzătoare I - III etape Nr 21
„Vverite. Obținerea proteinelor prin reacția de policondensare a aminoacizilor. Structuri primare, secundare și terțiare ale proteinelor. Proprietățile chimice ale proteinelor: combustie, denaturare, hidroliză și reacții de culoare. Funcțiile biochimice ale proteinelor”.
Pregătit
profesor de chimie
profesor - metodolog
Donețk, 2016
„Viața este un mod de existență a corpurilor proteice”
Subiectul lecției. Veverițe. Obținerea proteinelor prin reacția de policondensare a aminoacizilor. Structuri primare, secundare și terțiare ale proteinelor. Proprietățile chimice ale proteinelor: combustie, denaturare, hidroliză și reacții de culoare. Funcțiile biochimice ale proteinelor.
Obiectivele lecției. Să familiarizeze elevii cu proteinele ca cel mai înalt grad de dezvoltare a substanțelor din natură care au dus la apariția vieții; arată structura, proprietățile și varietatea funcțiilor biologice ale acestora; să extindă conceptul de reacție de policondensare folosind exemplul obținerii proteinelor, să informeze școlarii despre igiena alimentară, despre menținerea sănătății lor. Dezvoltați gândirea logică la elevi.
Reactivi si echipamente. Tabelul „Structuri primare, secundare și terțiare ale proteinelor”. Reactivi: HNO3, NaOH, CuSO4, proteina de pui, fir de lana, sticla chimica.
metoda lecției. Informare și dezvoltare.
Tipul de lecție. O lecție de stăpânire a noilor cunoștințe și abilități.
În timpul orelor
eu. Organizarea timpului.
II. Verificarea temelor, actualizarea și corectarea cunoștințelor de bază.
Sondaj Blitz
1. Explicați termenul „aminoacid”.
2. Numiți grupele funcționale care alcătuiesc aminoacizii.
3. Nomenclatura aminoacizilor și izomeria acestora.
4. De ce aminoacizii prezintă proprietăți amfotere? Scrieți ecuațiile reacțiilor chimice.
5. Datorită ce proprietăți aminoacizii formează polipeptide. Scrieți reacția de policondensare a aminoacizilor.
III. Mesajul temei, obiectivele lecției, motivația activităților educaționale.
IV. Percepția și conștientizarea inițială a noului material.
Profesor.
„Oriunde întâlnim viața, descoperim că aceasta este asociată cu un tip de corp proteic”, a scris F. Engels în cartea sa „Anti-Dühring”. Lipsa proteinelor din alimente duce la o slăbire generală a organismului, la copii - la o încetinire a dezvoltării mentale și fizice. Astăzi, mai mult de jumătate din umanitate nu primește hrană suma necesară proteine. O persoană are nevoie de 115 g de proteine pe zi, proteinele nu sunt stocate în rezervă, spre deosebire de carbohidrați și grăsimi, așa că trebuie să vă monitorizați dieta. Suntem familiarizați cu cheratina - proteina care alcătuiește părul, unghiile, pene, pielea - îndeplinește o funcție de construcție; familiarizat cu proteina pepsină - se găsește în sucul gastric și este capabilă să distrugă alte proteine în timpul digestiei; proteina trombină este implicată în coagularea sângelui; hormon pancreatic - insulina - regleaza metabolismul glucozei; hemoglobina transportă O2 către toate celulele și țesuturile corpului etc.
De unde provine această varietate nesfârșită de molecule de proteine, varietatea funcțiilor lor și rolul lor special în procesele vieții? Pentru a răspunde la această întrebare, să ne întoarcem la compoziția și structura proteinelor.
Proteinele sunt formate din atomi?
Pentru a răspunde la această întrebare, să facem o încălzire. Ghiciți ghicitorile și explicați semnificația răspunsurilor.
1. El este peste tot și peste tot:
În piatră, în aer, în apă.
El este în roua dimineții
Și albastru pe cer.
(oxigen)
2. Sunt cel mai ușor element,
În natură, nici un pas fără mine.
Și cu oxigen sunt în acest moment
3. În aer, este gazul principal,
Ne înconjoară peste tot.
Viața plantelor se estompează
Fără el, fără îngrășământ.
Trăiește în celulele noastre
4. Scolarii au plecat in drumetie
(Aceasta este abordarea problemei chimice).
Noaptea, un foc a fost aprins de lună,
Se cântau cântece despre foc strălucitor.
Lasă-ți deoparte sentimentele:
Ce elemente au ars în foc?
(carbon, hidrogen)
Da, așa este, acestea sunt principalele elemente chimice care alcătuiesc proteina.
Aceste patru elemente pot fi spuse în cuvintele lui Schiller: „Patru elemente, îmbinând împreună, dau viață și construiesc lumea”.
Proteinele sunt polimeri naturali constând din resturi de α-aminoacizi legate prin legături peptidice.
Compoziția proteinelor include 20 de aminoacizi diferiți, de unde uriașa varietate de proteine în diferitele lor combinații. Există până la 100.000 de proteine în corpul uman.
Referință istorică.
Prima ipoteză despre structura moleculei proteice a fost propusă în anii '70. secolul al 19-lea Aceasta a fost teoria ureide a structurii proteinelor.
În 1903 Oamenii de știință germani au exprimat teoria peptidelor, care a dat cheia misterului structurii proteinei. Fisher a sugerat că proteinele sunt polimeri ai aminoacizilor legați prin legături peptidice.
Ideea că proteinele sunt formațiuni polimerice a fost exprimată încă de la 70-88 de ani. secolul al 19-lea , oameni de știință ruși. Această teorie a fost confirmată în lucrările moderne.
Chiar și prima cunoaștere cu proteinele oferă o idee despre structura extrem de complexă a moleculelor lor. Proteinele sunt obținute prin reacția de policondensare a aminoacizilor:
https://pandia.ru/text/80/390/images/image007_47.gif" width="16" height="18">H - N - CH2 - C + H - N - CH2 - C →
https://pandia.ru/text/80/390/images/image012_41.gif" height="20">
NH2 - CH - C - N - CH - C - N - CH - C - ... + nH2O →
⸗ O ⸗ O ⸗ O
→ NH2 – CH – C + NH2 – CH – C + NH2 – CH – C + …
OH OH OH
4. Profesorul demonstrează experiența: arderea unui fir de lână; se simte un miros de pene pârjolite - așa poți distinge lâna de țesăturile de alte tipuri.
V. Generalizarea și sistematizarea cunoștințelor.
1. Faceți un rezumat de bază al proteinelor.
baza vieții ← Proteine → polipeptide
(C, H, O, N) ↓ ↓ ↓ \ structuri proteice
funcții chimice de culoare
care proprietăți ale reacțiilor proteice
2. Scrieți ecuațiile de reacție pentru formarea unei dipeptide din glicină și valină.
VI. Rezumând lecția, teme.
Învață §38 p. 178 - 184. Finalizarea sarcinilor de testare p. 183.
Veverițe - Aceștia sunt biopolimeri formați din resturi de α-aminoacizi interconectate prin legături peptidice (-CO-NH-). Proteinele fac parte din celulele și țesuturile tuturor organismelor vii. Moleculele proteice conțin 20 de reziduuri diferite de aminoacizi.
structura proteinelor
Proteinele au o varietate inepuizabilă de structuri.
Structura primară a unei proteine este secvența de unități de aminoacizi dintr-un lanț polipeptidic liniar.
structura secundara- aceasta este o configurație spațială a unei molecule proteice, asemănătoare cu o spirală, care se formează ca urmare a răsucirii lanțului polipeptidic din cauza legăturilor de hidrogen dintre grupele: CO și NH.
Structura terțiară- aceasta este configurația spațială pe care o ia lanțul polipeptidic răsucit în spirală.
Structura cuaternară sunt formațiuni polimerice ale mai multor macromolecule proteice.
Proprietăți fizice
Proprietățile proteinelor sunt foarte diverse, pe care le efectuează. Unele proteine se dizolvă în apă, formând, de regulă, soluții coloidale (de exemplu, albuș de ou); altele se dizolvă în soluții de sare diluată; altele sunt insolubile (de exemplu, proteinele țesuturilor tegumentare).
Proprietăți chimice
Denaturarea- distrugerea structurii secundare, terțiare a proteinei sub influența diverșilor factori: temperatură, acțiunea acizilor, sărurile metalelor grele, alcoolilor etc.
În timpul denaturarii sub influența factorilor externi (temperatura, acțiunea mecanică, acțiunea agenților chimici și alți factori), are loc o schimbare în structurile secundare, terțiare și cuaternare ale macromoleculei proteice, adică structura sa spațială nativă. Structura primară și, în consecință, compoziția chimică a proteinei nu se modifică. Proprietățile fizice se modifică: solubilitatea scade, capacitatea de hidratare, activitatea biologică se pierde. Forma macromoleculei proteice se modifică, are loc agregarea. În același timp, activitatea unor grupe crește, efectul enzimelor proteolitice asupra proteinelor este facilitat și, în consecință, este mai ușor hidrolizat.
În tehnologia alimentară, special valoare practică are denaturarea termică a proteinelor, gradul căreia depinde de temperatură, durata de încălzire și umiditate. Acest lucru trebuie reținut atunci când se dezvoltă modalități de tratare termică a materiilor prime alimentare, semifabricatelor și uneori a produselor finite. Procesele de denaturare termică joacă un rol deosebit în albirea materialelor vegetale, uscarea cerealelor, coacerea pâinii și obținerea pastelor. Denaturarea proteinelor poate fi cauzată și de acțiune mecanică (presiune, frecare, scuturare, ultrasunete). Actiunea reactivilor chimici (acizi, alcaline, alcool, acetona) duce la denaturarea proteinelor. Toate aceste tehnici sunt utilizate pe scară largă în alimentație și biotehnologie.
Reacții calitative la proteine:
a) La arderea proteinelor - miros de pene arse.
b) Proteina + HNO 3 → culoare galbenă
c) Soluție proteică + NaOH + CuSO 4 → culoare violetă
Hidroliză
Proteină + H 2 O → un amestec de aminoacizi
Funcțiile proteinelor în natură:
catalitice (enzime);
Regulator (hormoni);
Structurale (keratină de lână, fibroină de mătase, colagen);
motor (actină, miozină);
transport (hemoglobina);
Rezervă (cazeină, albumină de ou);
protectoare (imunoglobuline), etc.
Hidratarea
Procesul de hidratare înseamnă legarea apei de către proteine, în timp ce acestea prezintă proprietăți hidrofile: se umflă, le crește masa și volumul. Umflarea proteinelor este însoțită de dizolvarea parțială a acesteia. Hidrofilitatea proteinelor individuale depinde de structura lor. Grupările amide hidrofile (–CO–NH–, legătură peptidică), amine (NH 2) și carboxil (COOH) prezente în compoziție și situate la suprafața macromoleculei proteice atrag moleculele de apă, orientându-le strict spre suprafața molecula. Înconjurând globulele proteice, învelișul de hidrat (apă) împiedică stabilitatea soluțiilor proteice. În punctul izoelectric, proteinele au cea mai mică capacitate de a lega apa; învelișul de hidratare din jurul moleculelor proteice este distrus, astfel încât acestea se combină pentru a forma agregate mari. Agregarea moleculelor de proteine are loc și atunci când sunt deshidratate cu unii solvenți organici, cum ar fi alcoolul etilic. Aceasta duce la precipitarea proteinelor. Când pH-ul mediului se modifică, macromolecula proteică se încarcă, iar capacitatea sa de hidratare se modifică.
Cu o umflare limitată, soluțiile concentrate de proteine formează sisteme complexe numite jeleu. Jeleurile nu sunt fluide, elastice, au plasticitate, o anumită rezistență mecanică și sunt capabile să-și păstreze forma. Proteinele globulare pot fi complet hidratate prin dizolvarea în apă (de exemplu, proteinele din lapte), formând soluții cu o concentrație scăzută. Proprietățile hidrofile ale proteinelor sunt mare importanțăîn biologie și industria alimentară. Un jeleu foarte mobil, construit în principal din molecule de proteine, este citoplasma - conținutul semi-lichid al celulei. Jeleul foarte hidratat este gluten crud izolat din aluatul de grâu și conține până la 65% apă. Hidrofilia, calitatea principală a boabelor de grâu, a proteinelor din cereale și a făinii, joacă un rol important în depozitarea și prelucrarea cerealelor, în coacere. Aluatul, care se obține în industria de panificație, este o proteină umflată în apă, un jeleu concentrat care conține boabe de amidon.
Spumante
Procesul de spumare este capacitatea proteinelor de a forma sisteme lichid-gaz foarte concentrate numite spume. Stabilitatea spumei, în care proteina este un agent de spumare, depinde nu numai de natura și concentrația acesteia, ci și de temperatură. Proteinele sunt utilizate pe scară largă ca agenți de spumare în industria cofetăriei (marshmallow, marshmallow, sufleu).Pâinea are o structură de spumă, iar acest lucru îi afectează proprietățile gustative.
Combustie
Proteinele ard cu formarea de azot, dioxid de carbon și apă, precum și alte substanțe. Arderea este însoțită de mirosul caracteristic de pene arse.
reacții de culoare.
- Xantoproteină - interacțiunea ciclurilor aromatice și heteroatomice într-o moleculă proteică cu acid azotic concentrat, însoțită de apariția unei culori galbene;
- Biuret - există o interacțiune a soluțiilor slab alcaline de proteine cu o soluție de sulfat de cupru (II) cu formarea de compuși complecși între ionii Cu 2+ și polipeptide. Reacția este însoțită de apariția unei culori violet-albastru;
- când proteinele sunt încălzite cu alcali în prezența sărurilor de plumb, se formează un precipitat negru, care conține sulf.
Forma moleculei proteice. Studiile conformației native a moleculelor de proteine au arătat că aceste particule au în majoritatea cazurilor o formă mai mult sau mai puțin asimetrică. În funcție de gradul de asimetrie, adică raportul dintre axele lungi (b) și scurte (a) ale moleculei proteice, se disting proteinele globulare (sferice) și fibrilare (filamentoase).
Globulare sunt molecule proteice în care plierea lanțurilor polipeptidice a dus la formarea unei structuri sferice. Printre acestea sunt strict sferice, eliptice și în formă de tijă. Ele diferă prin gradul de asimetrie. De exemplu, albumina de ou are b/a = 3, gliadina de grâu are 11, iar zeina de porumb are 20. Multe proteine din natură sunt globulare.
Proteinele fibrilare formează filamente lungi, foarte asimetrice. Multe dintre ele au o funcție structurală sau mecanică. Acestea sunt colagen (b/a - 200), keratine, fibroină.
Proteinele fiecărui grup au proprietățile lor caracteristice. Multe proteine globulare sunt solubile în apă și soluții saline diluate. Proteinele fibrilare solubile se caracterizează prin soluții foarte vâscoase. Proteinele globulare, de regulă, au o valoare biologică bună - sunt absorbite în timpul digestiei, în timp ce multe proteine fibrilare nu sunt.
Nu există o graniță clară între proteinele globulare și cele fibrilare. Un număr de proteine ocupă o poziție intermediară și combină caracteristicile atât ale celor globulare, cât și ale celor fibrilare. Astfel de proteine includ, de exemplu, miozina musculară (b/a = 75) și fibrinogenul din sânge (b/a = 18). Miozina are o formă asemănătoare tijei, similară cu forma proteinelor fibrilare, totuși, ca și proteinele globulare, este solubilă în soluții saline. Soluțiile de miozină și fibrinogen sunt vâscoase. Aceste proteine sunt absorbite în timpul digestiei. În același timp, actina, o proteină musculară globulară, nu este absorbită.
Denaturarea proteinelor. Conformația nativă a moleculelor proteice nu este rigidă, este mai degrabă labilă (lat. „labilis” - alunecare) și poate fi serios perturbată sub o serie de influențe. Încălcarea conformației native a unei proteine, însoțită de o modificare a proprietăților sale native fără a rupe legăturile peptidice, se numește denaturare (în latină „denaturare” - pentru a priva proprietățile naturale) proteinei.
Denaturarea proteinelor poate fi cauzată de diverse motive care conduc la întreruperea interacțiunilor slabe, precum și la ruperea legăturilor disulfurice care stabilizează structura lor nativă.
Încălzirea majorității proteinelor la temperaturi de peste 50°C, precum și ultravioletele și alte tipuri de iradiere cu energie înaltă, cresc vibrațiile atomilor din lanțul polipeptidic, ceea ce duce la întreruperea diferitelor legături din ele. Chiar și agitarea mecanică poate provoca denaturarea proteinelor.
Denaturarea proteinelor are loc și din cauza atacului chimic. Acizii sau alcalii puternici afectează ionizarea grupărilor acide și bazice, determinând întreruperea legăturilor ionice și a unor legături de hidrogen din moleculele de proteine. Uree (H 2 N-CO-NH 2) și solvenți organici - alcooli, fenoli etc. - rupe sistemul de legături de hidrogen și slăbesc interacțiunile hidrofobe în moleculele de proteine (uree - din cauza unei încălcări a structurii apei, solvenți organici - datorită stabilirii contactelor cu radicalii aminoacizi nepolari). Mercaptoetanolul distruge legăturile disulfurice din proteine. Ionii de metale grele perturbă interacțiunile slabe.
În timpul denaturarii, are loc o modificare a proprietăților proteinei și, în primul rând, o scădere a solubilității acesteia. De exemplu, atunci când sunt fierte, proteinele se coagulează și precipită din soluții sub formă de cheaguri (ca atunci când fierbeți un ou de găină). Precipitarea proteinelor din soluții are loc și sub influența precipitanților proteici, care sunt utilizați ca acid tricloracetic, reactiv Barnstein (un amestec de hidroxid de sodiu cu sulfat de cupru), soluție de tanin etc.
În timpul denaturarii, capacitatea de absorbție a apei a proteinei scade, adică capacitatea acesteia de a se umfla; pot apărea noi grupuri chimice, de exemplu: atunci când sunt expuse la măsuri de captoetanol - grupe SH. Ca urmare a denaturării, proteina își pierde activitatea biologică.
Deși structura primară a unei proteine nu este afectată de denaturare, modificările sunt ireversibile. Cu toate acestea, de exemplu, odată cu îndepărtarea treptată a ureei prin dializă dintr-o soluție de proteină denaturată, are loc renaturarea acesteia: structura nativă a proteinei este restabilită și, odată cu aceasta, într-o măsură sau alta, proprietățile sale native. O astfel de denaturare se numește reversibilă.
Denaturarea ireversibilă a proteinelor are loc în timpul îmbătrânirii organismelor. Prin urmare, de exemplu, semințele de plante, chiar și în condiții optime de păstrare, își pierd treptat capacitatea de germinare.
Denaturarea proteinelor are loc la coacerea pâinii, uscarea pastelor, legumele, în timpul gătitului etc. Ca urmare, valoarea biologică a acestor proteine crește, deoarece proteinele denaturate (parțial distruse) sunt absorbite mai ușor în timpul digestiei.
Punctul izoelectric al unei proteine. Proteinele conțin diverse grupe bazice și acide care au capacitatea de a ioniza. Într-un mediu puternic acid, grupările principale (grupele amino etc.) sunt protonate activ, iar moleculele proteice capătă o sarcină totală pozitivă, iar într-un mediu puternic alcalin, grupările carboxil se disociază ușor, iar moleculele proteice capătă o sarcină totală negativă.
Sursele unei sarcini pozitive în proteine sunt radicalii laterali ai resturilor de lizină, arginină și histidină și gruparea a-amino a restului de aminoacid N-terminal. Sursele sarcinii negative sunt radicalii laterali ai resturilor de acid aspartic și glutamic și gruparea α-carboxil a restului de aminoacid C-terminal.
La o anumită valoare a pH-ului mediului, există o egalitate de sarcini pozitive și negative pe suprafața moleculei de proteină, adică sarcina sa electrică totală se dovedește a fi zero. Această valoare a pH-ului soluției, la care molecula proteică este neutră din punct de vedere electric, se numește punctul izoelectric al proteinei (pi).
Punctele izoelectrice sunt constante caracteristice proteinelor. Ele sunt determinate de compoziția și structura lor de aminoacizi: numărul și aranjarea reziduurilor de aminoacizi acide și bazice din lanțurile polipeptidice. Punctele izoelectrice ale proteinelor, în care predomină reziduurile de aminoacizi acide, sunt situate în regiunea pH-ului.<7, а белков, в которых преобладают остатки основных аминокислот - в области рН>7. Punctele izoelectrice ale majorității proteinelor se află într-un mediu ușor acid.
În stare izoelectrică, soluțiile proteice au o vâscozitate minimă. Acest lucru se datorează unei modificări a formei moleculei de proteine. În punctul izoelectric, grupurile încărcate opus sunt atrase unele de altele, iar proteinele se răsucesc în bile. Când pH-ul se schimbă de la punctul izoelectric, grupurile încărcate asemănătoare se resping reciproc, iar moleculele de proteine se desfășoară. În starea desfășurată, moleculele de proteine dau soluțiilor o vâscozitate mai mare decât cea rulată în bile.
La punctul izoelectric, proteinele au solubilitate minimă și pot precipita cu ușurință.
Cu toate acestea, precipitarea proteinelor la punctul izoelectric încă nu are loc. Acest lucru este prevenit de moleculele de apă structurate care rețin o parte semnificativă a radicalilor hidrofobi de aminoacizi pe suprafața globulelor de proteine.
Proteinele pot fi precipitate folosind solvenți organici (alcool, acetonă), care perturbă sistemul de contacte hidrofobe în moleculele proteice, precum și concentrații mari de sare (sărare), care reduc hidratarea globulelor proteice. În acest din urmă caz, o parte din apă merge să dizolve sarea și încetează să mai participe la dizolvarea proteinei. O astfel de soluție, din cauza lipsei de solvent, devine suprasaturată, ceea ce atrage după sine precipitarea unei părți din ea în precipitat. Moleculele de proteine încep să se lipească împreună și, formând particule din ce în ce mai mari, precipită treptat din soluție.
Proprietățile optice ale unei proteine. Soluțiile de proteine au activitate optică, adică capacitatea de a roti planul de polarizare a luminii. Această proprietate a proteinelor se datorează prezenței elementelor asimetrice în moleculele lor - atomi de carbon asimetrici și un a-helix drept.
Când o proteină este denaturată, proprietățile sale optice se schimbă, ceea ce este asociat cu distrugerea helixului a. Proprietățile optice ale proteinelor complet denaturate depind doar de prezența atomilor de carbon asimetrici în ele.
Prin diferența de manifestare a proprietăților optice ale proteinei înainte și după denaturare, se poate determina gradul de spiralizare a acesteia.
Reacții calitative la proteine. Proteinele se caracterizează prin reacții de culoare datorită prezenței anumitor grupări chimice în ele. Aceste reacții sunt adesea folosite pentru a detecta proteine.
Când se adaugă sulfat de cupru și alcalii la soluția de proteine, apare o culoare liliac, asociată cu formarea de complexe de ioni de cupru cu grupe peptidice ale proteinei. Deoarece această reacție dă biuret (H2N-CO-NH-CO-NH2), se numește biuret. Este adesea folosit pentru determinarea cantitativă a proteinei, împreună cu metoda I. Kjeldahl, deoarece intensitatea culorii rezultate este proporțională cu concentrația de proteine din soluție.
Când soluțiile de proteine sunt încălzite cu acid azotic concentrat, apare o culoare galbenă datorită formării nitroderivaților ai aminoacizilor aromatici. Această reacție se numește xantoproteină(greacă „xanthos” - galben).
Multe soluții de proteine, atunci când sunt încălzite, reacționează cu o soluție de nitrat de mercur, care formează compuși complexi purpuri cu fenolii și derivații acestora. Acesta este un test Millon calitativ pentru tirozină.
Ca urmare a încălzirii majorității soluțiilor de proteine cu acetat de plumb într-un mediu alcalin, precipită un precipitat negru de sulfură de plumb. Această reacție este folosită pentru a detecta aminoacizii care conțin sulf și se numește reacția Fohl.
Și sunt unul dintre cei mai complexe ca structură și compoziție dintre toți compușii organici.
Rolul biologic proteine este excepțional de mare: ele constituie cea mai mare parte a protoplasmei și a nucleelor celulelor vii. Substante proteiceîntâlnită în toate organismele vegetale și animale. Rezerva de proteine din natură poate fi judecată după cantitatea totală de materie vie de pe planeta noastră: masa proteinelor este de aproximativ 0,01% din masă. Scoarta terestra, adică 10 16 tone.
Veverițe prin compoziția lor elementară se deosebesc de carbohidrați și grăsimi: pe lângă carbon, hidrogen și oxigen, conțin și azot. În plus, permanent parte integrantă cei mai importanți compuși proteici este sulful, iar unele proteine conțin fosfor, fier și iod.
Proprietățile proteinelor
1. Solubilitate diferită în apă. Proteinele solubile formează soluții coloidale.
2. Hidroliza - sub influența soluțiilor de acizi minerali sau enzime, are loc distrugerea structura primară a proteineiși formarea unui amestec de aminoacizi.
3. Denaturarea- distrugerea parțială sau completă a structurii spațiale inerente unei molecule proteice date. Denaturarea are loc sub influența:
- - temperatura ridicata
- - solutii de acizi, alcaline si solutii sarate concentrate
- - solutii de saruri ale metalelor grele
- - unele substante organice (formaldehida, fenol)
- - radiatii radioactive
Structura proteinelor
Structura proteinelor a început să studieze în secolul al XIX-lea. În 1888 Biochimistul rus A.Ya.Danilevsky a sugerat prezența unei legături amidice în proteine. Această idee a fost dezvoltată în continuare de chimistul german E. Fischer și a găsit confirmare experimentală în lucrările sale. S-a oferit polipeptidă teoria structurală veveriţă. Conform acestei teorii, o moleculă de proteină constă dintr-un lanț lung sau mai multe lanțuri polipeptidice legate între ele. Astfel de lanțuri pot fi de diferite lungimi.
Fisher ținea un mare munca experimentala Cu polipeptide. Polipeptidele superioare care conțin 15-18 aminoacizi sunt precipitate din soluții cu sulfat de amoniu (alaun de amoniu), adică prezintă proprietăți caracteristice proteine. S-a demonstrat că polipeptidele sunt scindate de aceleași enzime ca și proteinele, iar atunci când sunt introduse în corpul unui animal, ele suferă aceleași transformări ca și proteinele, iar tot azotul lor este eliberat în mod normal sub formă de uree (uree).
Cercetările efectuate în secolul al XX-lea au arătat că există mai multe niveluri de organizare molecula proteica.

Există mii de proteine diferite în corpul uman și aproape toate sunt construite dintr-un set standard de 20 de aminoacizi. Secvența reziduurilor de aminoacizi dintr-o moleculă de proteină se numește structura primara veveriţă. Proprietățile proteinelor iar funcţiile lor biologice sunt determinate de secvenţa de aminoacizi. Lucrare de clarificare structura primară a proteinei au fost efectuate pentru prima dată la Universitatea din Cambridge pe exemplul uneia dintre cele mai simple proteine - insulină . Pe parcursul a 10 ani, biochimistul englez F. Senger a analizat insulină. În urma analizei, s-a constatat că molecula insulină este format din două lanțuri polipeptidice și conține 51 de resturi de aminoacizi. El a descoperit că insulina are o masă molară de 5687 g/mol, iar compoziția sa chimică corespunde formulei C 254 H 337 N 65 O 75 S 6 . Analiza a fost efectuată manual folosind enzime care hidrolizează selectiv legăturile peptidice dintre anumite resturi de aminoacizi.
În prezent, majoritatea lucrează pe definiție structura primară a proteinelor automatizate. Deci structura primară a enzimei a fost stabilită lizozimă.
Tipul de „stivuire” a lanțului polipeptidic se numește structură secundară. Cel mai proteine lanțul polipeptidic se înfășoară într-o spirală asemănătoare unui „arc întins” (numit „A-helix” sau „A-structură”). Un alt tip comun de structură secundară este structura foii pliate (denumită „structură B”). Asa de, proteine de mătase - fibroină are exact această structură. Este format dintr-o serie de lanțuri polipeptidice care sunt paralele între ele și sunt conectate prin legături de hidrogen, număr mare ceea ce face ca matasea sa fie foarte flexibila si rezistenta la rupere. Cu toate acestea, practic nu există proteine ale căror molecule au 100% „structură A” sau „structură B”.
 Proteina fibroină - proteină naturală de mătase
Proteina fibroină - proteină naturală de mătase Poziția spațială a lanțului polipeptidic se numește structura terțiară a proteinei. Majoritatea proteinelor sunt clasificate ca globulare deoarece moleculele lor sunt pliate în globule. Proteina menține această formă datorită legăturilor dintre ionii încărcați diferit (-COO - și -NH 3 + și punți disulfură. În plus, molecula proteica pliate astfel încât lanțurile hidrocarburice hidrofobe să fie în interiorul globului, iar cele hidrofile în exterior.
Se numește metoda de combinare a mai multor molecule de proteine într-o singură macromoleculă structura proteinelor cuaternare. Un prim exemplu o astfel de proteină poate fi hemoglobină. S-a constatat că, de exemplu, pentru un adult, molecula hemoglobină constă din 4 lanțuri polipeptidice separate și o parte neproteică - hem.
Proprietățile proteinelor explică diferitele lor structuri. Majoritatea proteinelor sunt amorfe, insolubile în alcool, eter și cloroform. În apă, unele proteine se pot dizolva pentru a forma o soluție coloidală. Multe proteine sunt solubile în soluții alcaline, unele în soluții sărate și altele în alcool diluat. Starea cristalină a alburilor este rară: un exemplu sunt boabele de aleurone găsite în boabele de ricin, dovleci și cânepă. de asemenea, cristalizează albumină ou de gaina si hemoglobinăîn sânge.
Hidroliza proteinelor
Când sunt fierte cu acizi sau alcaline, precum și sub acțiunea enzimelor, proteinele se descompun în compuși chimici mai simpli, formând un amestec de A-aminoacizi la sfârșitul lanțului de transformare. O astfel de divizare se numește hidroliza proteinelor. Hidroliza proteinelor are un mare semnificație biologică: ajungând în stomacul și intestinele unui animal sau unei persoane, proteina este descompusă prin acțiunea enzimelor în aminoacizi. Aminoacizii rezultați, sub influența enzimelor, formează din nou proteine, dar deja caracteristice acestui organism!
În produse hidroliza proteinelor pe lângă aminoacizi, s-au găsit carbohidrați, acid fosforic și baze purinice. Sub influența unor factori, de exemplu, încălzirea, soluțiile de săruri, acizi și alcalii, acțiunea radiațiilor, agitarea, structura spațială inerentă unei anumite molecule de proteine poate fi perturbată. Denaturarea poate fi reversibilă sau ireversibilă, dar în orice caz, secvența de aminoacizi, adică structura primară, rămâne neschimbată. Ca urmare a denaturarii, proteina inceteaza sa-si indeplineasca functiile biologice.
Pentru proteine se cunosc unele reacții de culoare care sunt caracteristice pentru detectarea lor. Când ureea este încălzită, se formează biuretul care, cu o soluție de sulfat de cupru în prezența alcaline, dă o culoare violetă sau o reacție calitativă pentru proteine, care se poate face acasă). Reacția biuretului este produsă de substanțe care conțin o grupare amidă, iar această grupă este prezentă în molecula proteică. Reacția xantoproteină este aceea că proteina din acidul azotic concentrat devine galbenă. Această reacție indică prezența unei grupări benzen în proteină, care se găsește în aminoacizi precum fenilalanina și tirozină.
Când este fiert cu o soluție apoasă de azotat de mercur și acid azotat, proteina dă o culoare roșie. Această reacție indică prezența tirozinei în proteină. În absența tirozinei, nu apare colorația roșie.