caracteristic metalelor alcaline. Care sunt proprietățile elementelor alcaline
Citeste si
Metale alcaline - denumirea comună elemente din grupa I sistem periodic elemente chimice. Compoziția sa este litiu (Li), sodiu (Na), potasiu (K), rubidiu (Rb), cesiu (Cs), franciu (Fr) și elementul ipotetic ununenium (Uue). Denumirea grupului provine de la denumirea de hidroxizi de sodiu și potasiu solubili, care au reacția și gustul alcalin. Considera aspecte comune structuri ale atomilor elementelor, proprietăți, producerea și utilizarea substanțelor simple.
Numerotarea grupului învechită și nouă
Conform sistemului de numerotare învechit, metalele alcaline, care ocupă coloana verticală cea mai din stânga a tabelului periodic, aparțin grupei I-A. În 1989, Uniunea Chimică Internațională (IUPAC) a propus o opțiune diferită (perioada lungă) ca principală. Metalele alcaline, în conformitate cu noua clasificare și numerotare continuă, aparțin grupei I. Reprezentantul perioadei a 2-a, litiul, deschide acest set, iar elementul radioactiv din perioada a 7-a, franciul, îl completează. Toate metalele din primul grup au un electron s în învelișul exterior al atomilor, la care renunță (recuperează) cu ușurință.
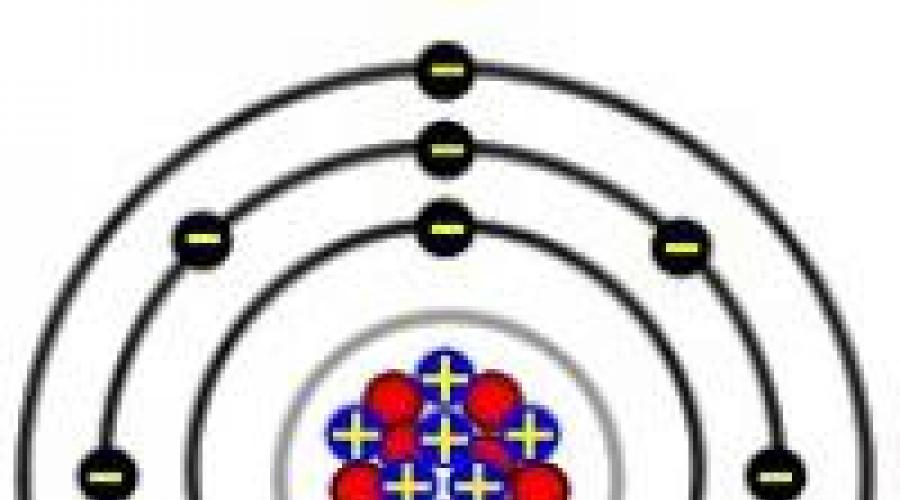
Structura atomilor de metale alcaline
Elementele din primul grup se caracterizează prin prezența unui al doilea nivel de energie, care repetă structura gazului inert anterior. Litiul are 2 electroni pe penultimul strat, restul au câte 8 electroni fiecare. În reacțiile chimice, atomii donează cu ușurință un electron s extern, dobândind o configurație favorabilă energetic a unui gaz nobil. Elementele din primul grup au valori mici ale energiei de ionizare și electronegativității (EO). Ele formează cu ușurință ioni pozitivi încărcați individual. În trecerea de la litiu la franciu, numărul de protoni și electroni, raza atomului, crește. Rubidiul, cesiul și franciul donează un electron exterior mai ușor decât elementele care le preced în grup. În consecință, în grupul de sus în jos, capacitatea de restaurare crește.

Oxidabilitatea ușoară a metalelor alcaline duce la faptul că elementele din primul grup există în natură sub formă de compuși ai cationilor lor singuri încărcați. Conținutul din scoarța terestră de sodiu - 2,0%, potasiu - 1,1%. Alte elemente din acesta sunt în cantități mici, de exemplu, rezervele de franciu - 340 g. Clorura de sodiu este dizolvată în apa de mare, saramură din lacurile sărate și estuare, formează depozite de rocă sau sare comună. Alături de halită, apare silvinita NaCl. KCl și silvin KCl. Feldspatul este format din aluminosilicat de potasiu K 2 . Carbonatul de sodiu este dizolvat în apa mai multor lacuri, iar rezervele de sulfat ale elementului sunt concentrate în apele Mării Caspice (Kara-Bogaz-Gol). În Chile există zăcăminte de azotat de sodiu (salpetru chilian). Există un număr limitat de compuși de litiu care se găsesc în mod natural. Rubidiul și cesiul se găsesc ca impurități în compușii elementelor din grupa I, iar franciul se găsește în compoziția minereurilor de uraniu.
Secvența de descoperire a metalelor alcaline
Chimistul și fizicianul britanic G. Davy a efectuat în 1807 electroliza topiurilor alcaline, obținând pentru prima dată sodiu și potasiu în formă liberă. În 1817, omul de știință suedez Johann Arfvedson a descoperit elementul litiu în minerale, iar în 1825 G. Davy a izolat metalul pur. Rubidiumul a fost descoperit pentru prima dată în 1861 de R. Bunsen și G. Kirchhoff. Cercetătorii germani au analizat compoziția aluminosilicaților și au obținut o linie roșie în spectrul corespunzătoare unui nou element. În 1939, un angajat al Institutului de Radioactivitate din Paris, Marguerite Pere, a stabilit existența unui izotop de franciu. Ea a numit și elementul în onoarea patriei sale. Ununennium (eca-francium) este numele preliminar pentru un nou tip de atom cu număr de serie 119. Simbolul chimic Uue este folosit temporar. Cercetătorii din 1985 încearcă să sintetizeze un nou element, care va fi primul în perioada a 8-a, al șaptelea din grupa I.
Proprietățile fizice ale metalelor alcaline

Aproape toate metalele alcaline sunt alb argintiu și au un luciu metalic când sunt proaspăt tăiate (cesiul este galben auriu). În aer, luciul se estompează, apare o peliculă gri, pe litiu este negru-verzui. Acest metal are cea mai mare duritate dintre vecinii săi din grup, dar este inferior talcului, cel mai moale mineral care deschide scara Mohs. Sodiul și potasiul se îndoaie ușor, pot fi tăiate. rubidiu, cesiu și franciu formă pură reprezinta o masa pastoasa. Topirea metalelor alcaline are loc la o temperatură relativ scăzută. Pentru litiu, atinge 180,54 °C. Sodiul se topește la 97,86°C, potasiul la 63,51°C, rubidiul la 39,32°C și cesiul la 28,44°C. Densitatea metalelor alcaline este mai mică decât a substanțelor înrudite. Litiul plutește în kerosen, se ridică la suprafața apei, potasiul și sodiul plutesc în ea.
Stare de cristal
Cristalizarea metalelor alcaline are loc în singonia cubică (centrată pe corp). Atomii din compoziția sa au o bandă de conducere, la ale cărei niveluri libere pot trece electronii. Aceste particule active realizează o legătură chimică specială - una metalică. Caracterul comun al structurii nivelurilor de energie și natura rețelelor cristaline explică asemănarea elementelor din primul grup. În trecerea de la litiu la cesiu, masele atomilor elementelor cresc, ceea ce duce la o creștere regulată a densității, precum și la modificarea altor proprietăți.
Proprietățile chimice ale metalelor alcaline
Singurul electron extern din atomii de metale alcaline este slab atras de nucleu, astfel încât aceștia se caracterizează prin energie de ionizare scăzută, afinitate electronică negativă sau aproape de zero. Elementele din grupa I, având activitate reducătoare, sunt practic incapabile de oxidare. În grupul de sus în jos, activitatea în reacțiile chimice crește:

Producerea și utilizarea metalelor alcaline
Metalele aparținând grupei I sunt produse în industrie prin electroliza topiturii halogenurilor lor și a altor compuși naturali. Când sunt descompuși de un curent electric, ionii pozitivi de la catod câștigă electroni și se reduc la metal liber. Anionul este oxidat la electrodul opus.

În timpul electrolizei topituri de hidroxid, particulele de OH sunt oxidate la anod, se eliberează oxigen și se obține apă. O altă metodă este reducerea termică a metalelor alcaline din topiturile sărurilor lor cu calciu. Substanțele simple și compușii elementelor din grupa I au valoare practică. Litiul este materia primă pentru energie nucleara, folosit în tehnologia rachetelor. În metalurgie, este folosit pentru a îndepărta reziduurile de hidrogen, azot, oxigen și sulf. Hidroxid supliment electrolit în bateriile alcaline.

Sodiul este necesar pentru energia nucleară, metalurgie și sinteza organică. Cesiul și rubidiul sunt folosite la fabricarea celulelor solare. Hidroxizii și sărurile, în special clorurile, nitrații, sulfații, carbonații metalelor alcaline, sunt utilizați pe scară largă. Cationii au activitate biologică, ionii de sodiu și potasiu sunt deosebit de importanți pentru corpul uman.
Metalele alcaline sunt elemente S. Pe stratul exterior de electroni, fiecare dintre ei are câte un electron (ns1). Razele atomice cresc de sus în jos în subgrup, energia de ionizare scade, iar activitatea de reducere, precum și capacitatea de a dona electroni de valență din stratul exterior, crește.
Metalele luate în considerare sunt foarte active, prin urmare nu se găsesc în natură în stare liberă. Se pot găsi sub formă de compuși, în compoziția mineralelor (sare de masă NaCl, silvinita NaCl∙KCl, sarea Glauber NaSO4∙10H2O și altele) sau ca ioni în apa de mare.
Proprietățile fizice ale metalelor alcaline
Toate metalele alcaline la conditii normale sunt alb argintii substanțe cristaline cu conductivitate termică și electrică ridicată. Au un pachet cubic centrat pe corp (BCP). Densitățile, punctele de fierbere și de topire ale metalelor din grupa I sunt relativ scăzute. De sus în jos în subgrup, densitățile cresc și punctele de topire scad.
Obținerea metalelor alcaline
Metalele alcaline sunt obținute de obicei prin electroliza sărurilor topite (de obicei cloruri) sau alcaline. În timpul electrolizei unei topituri de NaCl, de exemplu, sodiu pur este eliberat la catod, iar clorul gazos este eliberat la anod: 2NaCl (topitură) \u003d 2Na + Cl2.
Proprietățile chimice ale metalelor alcaline
Din punct de vedere al proprietăților chimice, litiul, sodiul, potasiul, rubidiul, cesiul și franciul sunt metalele cele mai active și unul dintre cei mai puternici agenți reducători. În reacții, ei donează cu ușurință electroni din stratul exterior, transformându-se în ioni încărcați pozitiv. În compușii formați din metale alcaline predomină legăturile ionice.
Când metalele alcaline interacționează cu oxigenul, se formează peroxizii ca produs principal și oxizii ca produs secundar:
4Na+O2=2Na2O (oxid de sodiu).
Cu halogeni dau halogenuri, cu sulf - sulfuri, cu hidrogen - hidruri:
2Na+Cl2=2NaCl (clorură de sodiu),
2Na+S=Na2S (sulfură de sodiu),
2Na+H2=2NaH (hidrură de sodiu).
Hidrura de sodiu este un compus instabil. Se descompune cu apă, dând hidrogen alcalin și liber:
NaH+H2O=NaOH+H2.
Hidrogenul liber se formează și atunci când metalele alcaline în sine interacționează cu apa:
2Na+2H2O=2NaOH+H2.
Aceste metale reacţionează, de asemenea, cu acizii diluaţi, înlocuind hidrogenul din ei:
2Na+2HCI=2NaCI+H2.
Metalele alcaline reacţionează cu halogenurile organice prin reacţia Wurtz.
Special (corecțional)
şcoală cuprinzătoare- internat pentru nevăzători
și copiii cu deficiențe de vedere din Perm
Rezumat finalizat
elevi de clasa a X-a
Ponomarev Oleg,
Korshunov Artem
supraveghetor:
L.Yu. Zaharova,
profesor de chimie
Permanent
Introducere
Caracteristici generale ale elementelor grupei I A
4 – 10
1.1. Istoria descoperirii și distribuției în natură a metalelor alcaline
4 – 5
5 - 6
6 – 8
8 – 9
9 – 10
Rolul biologic al elementelor grupului I A. Utilizarea lor în medicină
11 – 17
Modalități de aport de metale alcaline în corpul uman
18 – 21
22 – 23
concluzii
24 – 25
Cărți uzate
Introducere
A sosit vremea când fiecare ar trebui să se gândească la propria sănătate și nu numai la propria sănătate. Cunoștințele dobândite la școală, de exemplu, în chimie, nu le folosim foarte des Viata de zi cu zi. Cu toate acestea, acest subiect poate deveni o sursă de cunoștințe despre sănătatea noastră. Datorită chimiei, aflăm cum substanțele planetei noastre afectează procesele de viață ale corpului și, în general, viața umană însăși, ce ne este util și în ce cantități și, în sfârșit, ce este dăunător și în ce măsură.
Corpul uman este un sistem chimic complex care nu poate funcționa independent, fără legătură cu mediul. S-a dovedit că aproape toate elementele chimice sunt prezente într-un organism viu: unele sunt macroelemente, în timp ce conținutul altora este neglijabil, acestea sunt microelemente. Modalitățile în care elementele pătrund în corp sunt diferite, influența lor asupra corpului este variată, dar fiecare își realizează propria sa rol biologic.
În cadrul unei lucrări, este imposibil să studiezi semnificația fiecărui element. Am ales primul grup de elemente chimice din sistemul periodic al lui D.I. Mendeleev.
Ţintă acest studiu - pentru a studia rolul biologic al metalelor alcaline pentru corpul uman.
În acest sens, am decis să aflăm următoarele întrebări pentru fiecare metal din grupa IA:
caracteristicile generale și caracteristicile structurale ale atomilor fiecărui element, precum și proprietățile substanțelor pe care le formează;
găsirea unui element în organism;
nevoile organismului pentru aceasta;
influența excesului și deficienței unui element asupra sănătății umane;
surse naturale;
modalități de a găsi elementul.
1. Caracteristici generale ale elementelor grupei I A
Perioadă
grup
ÎN Grupa I A include elementele s - metale alcaline, extrem de importante pentru viața normală a animalelor și a oamenilor. Macroelementele sodiu și potasiu sunt de cea mai mare importanță pentru organisme.
3Li
11 Na
19K
37Rb
55Cs
87Fr
1.1. Istoria descoperirii și distribuției în natură
Metale alcaline
Denumirea „metale alcaline” se datorează faptului că hidroxizii celor doi reprezentanți principali ai acestui grup - sodiu și potasiu - sunt cunoscuți de mult timp ca alcaline. Dintre aceste alcaline, supunându-le electrolizei în stare topită, G. Davy în 1807. a primit pentru prima dată potasiu și sodiu gratuit. J. Berzelius a propus să numească elementul nr. 11 sodiu (din arabă natrun- sifon), iar elementul nr. 19, la sugestia lui Gilbert, a fost numit potasiu (din arabă alcaline- alcaline).
Metalele rămase au fost izolate de oamenii de știință din compuși mai târziu. Litiul a fost descoperit de chimistul suedez I. Arfvedson în 1817, iar la sugestia lui J. Berzelius a fost numit litiu (din greacă). lithos- piatră), pentru că. spre deosebire de potasiu, care până atunci se găsea doar în cenușa plantelor, se găsea în piatră.
Rubidiu a fost izolat în 1861, cesiu - în 1860. Franciu a fost obținut artificial în 1939. Cercetătorul francez M. Pere în timpul dezintegrarii actiniului, este un element radioactiv.
Datorită oxidabilității lor foarte ușoare, metalele alcaline apar în natură exclusiv sub formă de compuși. Unii dintre compușii lor naturali, în special sărurile de sodiu și potasiu, sunt destul de răspândiți; se găsesc în multe minerale, plante și ape naturale.
Sodiul și potasiul sunt elemente comune: conținutul fiecăruia dintre ele în scoarța terestră este de aproximativ 2% din masă. Ambele metale sunt incluse în compoziția diferitelor minerale și roci de vizuini de tip silicat.
Clorura de sodiu NaCl se găsește în apa de mare și formează, de asemenea, depozite groase de sare gemă în multe părți ale lumii. Straturile superioare ale acestor depozite conțin uneori cantități destul de importante de potasiu, în principal sub formă de clorură de KCl sau săruri duble cu KCl ∙MgCl 2 de sodiu și magneziu. Cu toate acestea, acumulările mari de săruri de potasiu de importanță industrială sunt rare. Cele mai importante dintre acestea sunt zăcămintele Solikamsk (sylvinite) din Rusia, zăcămintele Strassfurt din Germania și zăcămintele alsaciene din Franța.
Depozitele de azotat de sodiu NaNO 3 sunt situate în Chile. Apa multor lacuri conţine sifon Na 2 CO 3 . În cele din urmă, cantități uriașe de sulfat de sodiu Na 2 SO 4 se găsesc în Golful Kara-Bogaz-Gol din Marea Caspică, unde această sare se depune într-un strat gros pe fund în timpul lunilor de iarnă.
Litiul, rubidiul și cesiul sunt mult mai puțin frecvente decât sodiul și potasiul. Litiul este cel mai comun, dar mineralele care îl conțin rareori formează grupuri mari. Rubidiul și cesiul se găsesc în cantități mici în unele minerale de litiu.
Franciul se găsește în natură în cantități neglijabile (pe tot globul abia există 500 g din el), se obține artificial.
1.2. Structura și proprietățile atomilor de metale alcaline
Formula electronică a învelișului de valență a atomilor de metal alcalin este ns 1, adică. atomii acestor elemente au un electron de valență pe subnivelul s al nivelului energetic exterior. În consecință, starea de oxidare stabilă a metalelor alcaline este +1.
Toate elementele grupului IA sunt foarte asemănătoare ca proprietăți, ceea ce se explică prin același tip de structură nu numai a învelișului electronului de valență, ci și a celui exterior (cu excepția litiului).
Odată cu creșterea razei unui atom din grupul Li - Na - K - Rb - Cs - Fr, legătura dintre electronul de valență și nucleu se slăbește. În consecință, în această serie, energia de ionizare a atomilor de metale alcaline scade.
Având un electron pe învelișurile de valență situate la mare distanță de nucleu, atomii de metale alcaline donează cu ușurință un electron. Acest lucru are ca rezultat o energie de ionizare scăzută. Ca urmare a ionizării, se formează cationi E +, care au o configurație electronică stabilă a atomilor de gaz nobil.
Tabelul prezintă unele proprietăți ale atomilor de metale alcaline.
Caracteristică
3 Li
11 N / A
1 9K
37Rb
55Cs
87Fr
electroni de valență
2s 1
3s 1
4s 1
5s 1
6s 1
7s 1
Masa molara, g/mol
23,0
39,1
85,5
132,9
Raza atomică metalică, pm
Raza cristalină a unui atom, pm
Energie de ionizare,
kJ/mol
Metalele alcaline sunt cei mai tipici reprezentanți ai metalelor: proprietățile lor metalice sunt deosebit de pronunțate în ele.
1.3. Metalele alcaline sunt substanțe simple
Substanțe moi alb-argintii (tăiate cu un cuțit), cu un luciu caracteristic pe o suprafață proaspăt tăiată. În aer, suprafața strălucitoare a metalului se patează imediat din cauza oxidării.
Toate sunt ușoare și fuzibile și, de regulă, densitatea lor crește de la Li la Cs, în timp ce punctul de topire, dimpotrivă, scade.
Caracteristică
Li
N / A
K
Rb
Cs
pr
Densitate, g/cm 3
0,53
0,97
0,86
1,53
Duritate (Diamant = 10)
Conductivitate electrică (Hg = 1)
11,2
13,6
Punct de topire, C
Punct de fierbere, C
1350
Potențial electrod standard, V
3,05
2,71
2,92
2,93
2,92
număr de coordonare
4, 6
4, 6
6, 8
Toate metalele alcaline au potențiale redox standard negative, care sunt mari în valoare absolută. Acest lucru îi caracterizează ca fiind agenți reducători foarte puternici. Doar litiul este oarecum inferior multor metale în ceea ce privește reactivitatea.
În ciuda proprietăților comune, sodiul și în special litiul diferă de alte metale alcaline. Acesta din urmă se datorează în primul rând unei diferențe semnificative în razele atomilor lor și structurii învelișurilor de electroni.
Metalele alcaline sunt printre elementele cele mai active din punct de vedere chimic. Activitatea chimică a metalelor alcaline crește în mod natural odată cu creșterea razei atomice.
Li Na K Rb Cs Fr
Activitate chimică crescută
Raza atomului crește
Metalele alcaline interacționează activ cu aproape toate nemetalele.
Când interacționați cu oxigen litiul formează oxid de Li 2 O, iar metalele alcaline rămase - peroxizi Na 2 O 2 și superoxizi KO 2, RbO 2, CsO 2. De exemplu:
4Li (t) + O 2 (g) \u003d 2Li 2 O (t)
2Na (t) + O 2 (g) \u003d Na 2 O 2 (t)
K (t) + O 2 (g) \u003d KO 2 (t)
Metalele alcaline interacționează activ cu halogeni, formând halogenuri EG; cu sulf- cu formarea de sulfuri E 2 S. Metalele alcaline, cu excepția litiului, nu reacționează direct cu azotul.
2E(t) + Cl 2 (g) \u003d 2ECl (t)
2E(t) + S (t) \u003d E 2 S (t)
Toate metalele alcaline interacționează direct cu apă, formând hidroxizi EON - alcaline și reducând apa la hidrogen:
2E (t) + 2H 2 O (g) \u003d 2EON (r) + H 2 (g)
Intensitatea interacțiunii cu apa crește semnificativ în seria Li-Cs.
Capacitatea de reducere a metalelor alcaline este atât de mare încât pot reduce chiar atomii de hidrogen, transformându-i în ioni H - încărcați negativ. Astfel, atunci când metalele alcaline sunt încălzite într-un jet hidrogen hidrurile lor se obțin, de exemplu:
2E (t) + H 2 (g) \u003d 2EN
1.4. Aplicarea metalelor alcaline
Metalele alcaline și compușii lor sunt utilizați pe scară largă în inginerie.
Litiul este folosit în energie nucleara. În special, izotopul 6 Li servește ca sursă industrială pentru producția de tritiu, iar izotopul 7 Li este folosit ca agent de răcire în reactoarele cu uraniu. Datorită capacității litiului de a se combina ușor cu hidrogenul, azotul, oxigenul și sulful, este folosit în metalurgie pentru a îndepărta urmele acestor elemente din metale și aliaje.
Litiul și compușii săi sunt utilizați și ca combustibil pentru rachete. Lubrifianții care conțin compuși de litiu își păstrează proprietățile pe o gamă largă de temperaturi. Litiul este utilizat în industria ceramică, sticlă și în alte industrii chimice. În general, din punct de vedere al importanței tehnologie moderna acest metal este unul dintre cele mai importante elemente rare.
Cesiu și rubidiu sunt folosite pentru a face celule solare. Aceste dispozitive, care convertesc energia radiantă în energie de curent electric și se bazează pe fenomenul efectului fotoelectric, folosesc capacitatea atomilor de cesiu și rubidiu de a separa electronii de valență atunci când energia radiantă acționează asupra metalului.
Cele mai importante domenii de aplicare a sodiului sunt ingineria nucleară, metalurgia și industria sintezei organice.
În inginerie nucleară, sodiul și aliajul său cu potasiu sunt folosite ca lichide de răcire a metalelor. Un aliaj de sodiu și potasiu, care conține 77,2% potasiu, se află în stare lichidă într-un interval larg de temperatură, are un coeficient de transfer termic ridicat și nu interacționează cu majoritatea materialelor structurale.
În metalurgie se obțin un număr de metale refractare prin metoda sodiu-termică. În plus, sodiul este folosit ca aditiv de întărire pentru aliajele de plumb.
În industria sintezei organice, sodiul este utilizat în producerea multor substanțe. De asemenea, servește ca catalizator în prepararea anumitor polimeri organici.
Potasiul este unul dintre elementele necesare în cantități semnificative pentru nutriția plantelor. Deși există destul de multe săruri de potasiu în sol, există și multe duse de unele plante cultivate. Inul, cânepa și tutunul poartă în special mult potasiu. Pentru a reface pierderea de potasiu din sol, este necesar să se aplice îngrășăminte cu potasiu pe sol.
1.5. Compuși ai metalelor alcaline
E oxizi 2 DESPRE- solide. Au proprietăți de bază pronunțate: interacționează cu apa, acizii și oxizii acizi. De exemplu:
E 2 O (t) + H 2 O (g) \u003d 2EON (p)
Peroxizi și superoxizi E 2 DESPRE 2 și EO 2 metale alcaline - agenți oxidanți puternici. Peroxidul de sodiu și superoxidul de potasiu sunt folosite în obiecte închise (submarine, nave spațiale) pentru a absorbi dioxidul de carbon și a regenera oxigenul:
2Na 2 O 2 (t) + 2CO 2 (g) \u003d 2Na 2 CO 3 (t) + O 2 (g)
4KO 2 (t) + 2СO 2 (g) \u003d 2K 2 CO 3 (t) + 3O 2 (g)
Peroxidul de sodiu este, de asemenea, folosit pentru a înălbi țesăturile, lâna, mătasea etc.
alcalii- substante cristaline solide, albe, foarte higroscopice, relativ fuzibile si foarte solubile in apa (cu exceptia LiOH). Alcalii solide și soluțiile lor concentrate au un efect coroziv asupra țesuturilor, hârtiei și țesuturilor vii datorită deshidratării și hidrolizei alcaline a proteinelor. Prin urmare, lucrul cu ei necesită măsuri de protecție. Datorită efectului coroziv puternic, aceste alcaline sunt numite caustice (NaOH - sodă caustică, caustică, KOH - potasiu caustic).
Alcalii se dizolvă bine în apă cu eliberarea unei cantități mari de căldură, prezintă proprietăți pronunțate ale bazelor solubile puternice: interacționează cu acizi, oxizi acizi, săruri, oxizi amfoteri și hidroxizi.
Soda caustică este folosită în cantități mari pentru purificarea produselor petroliere. în industria hârtiei și textile, pentru producția de săpun și fibre.
Potasa caustică este mai scumpă și mai puțin utilizată. Domeniul său principal de aplicare este producția de săpun lichid.
Săruri de metale alcaline- substanţe cristaline solide de structură ionică. Cele mai importante dintre ele sunt carbonații, sulfații, clorurile.
Majoritatea sărurilor de metale alcaline sunt foarte solubile în apă (cu excepția sărurilor de litiu: Li 2 CO 3, LiF, Li 3 PO 4).
Cu acizii polibazici, metalele alcaline formează atât medii (E 2 SO 4, E 3 RO 4, E 2 CO 3, E 2 SO 3 etc.) cât și acide (ENSO 4, EN 2 RO 4, E 2 HPO 4, ENSO 3 etc.) săruri.
Na 2 CO 3 - carbonat de sodiu, formează un Na 2 CO 3 ∙10H 2 CO 3 cristalin, cunoscut sub numele de sodă cristalină, care este utilizat la fabricarea sticlei, hârtiei, săpunului. Aceasta este sare medie.
În viața de zi cu zi, sarea acidă este mai cunoscută - bicarbonatul de sodiu NaHCO 3, este folosită în industria alimentară (bicarbonat de sodiu) și în medicină (bicarbonat de sodiu).
K 2 CO 3 - carbonat de potasiu, denumire tehnică - potasiu, este utilizat în producerea săpunului lichid și pentru prepararea sticlei refractare, precum și îngrășământ.
Na 2 SO 4 ∙10H 2 O - sulfat de sodiu hidrat cristalin, denumirea tehnică a sării Glauber, este utilizat pentru producerea de sifon și sticlă, precum și ca laxativ.
NaCl - clorura de sodiu, sau sare de masă, este cea mai importantă materie primă din industria chimică, utilizată pe scară largă în viața de zi cu zi.

2. Rolul biologic al elementelor s ale grupului IA. Utilizarea lor în medicină
Element chimic, E
10 -4 %
0,08%
0,23%
10 -5 %
10 -4 %
Metalele alcaline sub formă de diferiți compuși fac parte din țesuturile oamenilor și animalelor.
Sodiul și potasiul sunt elemente esențiale care sunt prezente în mod constant în organism și sunt implicate în metabolism. Litiul, rubidiul și cesiul se găsesc în mod constant în organism, dar rolul lor fiziologic și biochimic este puțin înțeles. Ele pot fi atribuite microelementelor impurități.
În corpul uman, metalele alcaline sunt sub formă de cation E +.
similitudine structura electronica ioni de metale alcaline și, în consecință, proprietati fizice si chimice compușii determină și proximitatea acțiunii lor asupra proceselor biologice. Diferențele în structura electronică determină rolul lor biologic diferit. Pe această bază, este posibil să se prezică comportamentul metalelor alcaline în organismele vii.
Deci, sodiul și litiul se acumulează în lichidul extracelular, iar potasiu, rubidiu și cesiu - în lichidul intracelular. Litiul și sodiul sunt deosebit de apropiate ca acțiune biologică. De exemplu, ele sunt foarte asemănătoare ca proprietăți de activare a enzimelor.
Apropierea proprietăților sodiului și litiului determină interschimbabilitatea lor în organism. În acest sens, cu o introducere excesivă de ioni de sodiu sau litiu în organism, aceștia sunt capabili să se înlocuiască unul pe celălalt în mod echivalent. Aceasta este baza pentru introducerea clorurii de sodiu în caz de otrăvire cu săruri de litiu. În conformitate cu principiul lui Le Chatelier, echilibrul dintre ionii de sodiu și litiu din organism se deplasează spre excreția ionilor de Li +, ceea ce duce la scăderea concentrației acestuia și la obținerea unui efect terapeutic.
Rubidiul și cesiul sunt similare în proprietăți fizico-chimice cu ionul de potasiu, deci se comportă în mod similar în organismele vii. În sistemele studiate, potasiul, rubidiul și cesiul sunt sinergiști, iar cu litiul sunt antagonişti. Pe asemănarea rubidiului și potasiului se bazează introducerea în organism a sărurilor de potasiu în caz de otrăvire cu săruri de rubidiu.
Sodiul și potasiul, de regulă, sunt antagoniști, dar în unele cazuri apropierea multor proprietăți fizico-chimice determină schimbul lor în organismele vii. Deci, de exemplu, odată cu creșterea cantității de sodiu din organism, crește excreția de potasiu de către rinichi, adică apare hipokaliemia.
Litiu. Conținutul de litiu din corpul uman este de aproximativ 70 mg (10 mmol). Litiul este unul dintre cele mai valoroase oligoelemente sau, după cum se spune despre el, mini-metale. Litiul a fost folosit cândva pentru a trata guta și eczema. Și în 1971. un raport interesant a apărut în revista Medical News: în acele zone în care în bând apă conținea un numar mare de litiu, oamenii sunt mai amabili și mai calmi, printre ei sunt mai puțini oameni nepoliticoși și încăierați, cu atât mai puțin boală mintală. Proprietățile psihotrope ale acestui metal au fost dezvăluite. Litiul a început să fie folosit pentru depresie, ipocondrie, agresivitate și chiar pentru dependența de droguri.
Cu toate acestea, litiul poate fi atât „bun”, cât și „rău”. Au existat cazuri când, odată cu tratamentul injectabil cu litiu, a apărut o tulburare metabolică puternică, iar consecințele grave sunt inevitabile.
Compușii de litiu la animalele superioare sunt concentrați în ficat, rinichi, splină, plămâni, sânge și lapte. Cantitatea maximă de litiu se găsește în mușchii umani. Rolul biologic al litiului ca oligoelement nu a fost încă pe deplin elucidat.
S-a dovedit a fi la nivel membranele celulare ionii de litiu concurează cu ionii de sodiu la intrarea în celule. Evident, înlocuirea ionilor de sodiu în celule cu ioni de litiu este asociată cu o covalență mai mare a compușilor de litiu, drept urmare aceștia se dizolvă mai bine în fosfolipide.
S-a stabilit că unii compuși de litiu au un efect pozitiv asupra pacienților cu depresie maniacale. Absorbit din tract gastrointestinal, ionii de litiu se acumulează în sânge. Când concentrația ionilor de litiu atinge 0,6 mmol / l și mai mult, există o scădere a tensiunii emoționale și o slăbire a excitării maniacale. Cu toate acestea, conținutul de ioni de litiu din plasma sanguină trebuie controlat strict. În cazurile în care concentrația ionilor de litiu depășește 1,6 mmol/l, sunt posibile fenomene negative.
Acum se știe că, pe lângă efectul psihotrop, litiul are capacitatea de a preveni scleroza, bolile de inimă, într-o oarecare măsură diabetul și hipertensiunea arterială. „Ajută” magneziul în protecția sa anti-sclerotică.
La sfârşitul anului 1977 a publicat rezultatele studiilor efectuate în clinica de hematologie din Cracovia. Studiile au fost dedicate efectelor litiului asupra sistemului hematopoietic. S-a dovedit că acest microelement activează acțiunea celulelor măduvei osoase care nu sunt încă moarte. Descoperirea făcută poate juca rol importantîn lupta împotriva cancerului de sânge. Cercetările sunt încă în desfășurare. Vreau să cred că rezultatele lor vor aduce oamenilor un ajutor neprețuit.
Sodiu. Conținutul de sodiu dintr-un corp uman care cântărește 70 kg este de aproximativ 60 g (2610 mmol). Din această cantitate, 44% din sodiu se află în lichidul extracelular și 9% în lichidul intracelular.
Restul de sodiu se află în țesutul osos, care este locul de depunere a ionului Na + în organism. Aproximativ 40% din sodiul conținut în țesutul osos este implicat în procesele metabolice și datorită acestui fapt, scheletul este fie un donator, fie un acceptor de ioni de sodiu, ceea ce ajută la menținerea unei concentrații constante a ionilor de sodiu în lichidul extracelular.
Sodiul este principalul ion extracelular. Corpul uman conține sodiu sub formă de săruri solubile, în principal clorură de NaCl, fosfat de Na3PO4 și bicarbonat de NaHCO3.
Sodiul este distribuit în întreg organismul: în serul de sânge, lichidul cefalorahidian, lichidul ocular, sucuri digestive, bilă, rinichi, piele, țesut osos, plămâni și creier.
Ionii de sodiu joacă un rol important în asigurarea consistenței mediu intern al corpului uman, este implicat in mentinerea constanta a presiunii osmotice a biofluidului, asigura echilibrul acido-bazic al organismului. ionii de sodiu sunt implicați în reglarea schimbului de ioni și afectează funcționarea enzimelor. Împreună cu ionii de potasiu, magneziu, calciu, clor, ionul de sodiu este implicat în transmiterea impulsurilor nervoase prin membranele celulelor nervoase și menține excitabilitatea normală a celulelor musculare.
Când conținutul de sodiu din organism se modifică, există încălcări ale funcțiilor sistemului nervos, cardiovascular și a altor sisteme, netede și mușchi scheletic. Clorura de sodiu NaCl este principala sursă de acid clorhidric pentru sucul gastric.
Sodiul intră în corpul uman în principal sub formă de sare de masă NaCl. Adevăratul necesar zilnic de sodiu al organismului este de 1g, deși aportul mediu al acestui element ajunge la 4 - 7g.
Consumul continuu în exces de NaCI contribuie la apariția hipertensiunii arteriale. În organism persoana sanatoasa se mentine un echilibru intre cantitatea de sodiu consumata si excretata. Aproximativ 90% din sodiul consumat este excretat prin urină, iar restul este excretat prin transpirație și fecale.
Deci, pentru a rezuma: ionii de sodiu joacă un rol important:
pentru a asigura homeostazia osmotică
pentru a asigura echilibrul acido-bazic al organismului
în reglementarea schimbului de apă
în activitatea enzimelor
în transmiterea impulsurilor nervoase
în activitatea celulelor musculare
Soluție izotonicăNaCI (0,9%) pentru injectare, se administrează subcutanat, intravenos și în clisme în timpul deshidratării și intoxicației și este, de asemenea, utilizat pentru spălarea rănilor, ochilor, mucoasei nazale și, de asemenea, pentru dizolvarea diferitelor medicamente.
soluții hipertoniceNaCI (3-5-10%) utilizat extern sub formă de comprese și loțiuni în tratamentul rănilor purulente. Folosirea unor astfel de comprese favorizează, conform legii osmozei, separarea puroiului de răni și plasmoliza bacteriilor (acțiune antimicrobiană). O soluție de 2-5% de NaCI este prescrisă oral pentru spălarea gastrică în cazul intoxicației cu AgNO 3, care în acest caz se transformă într-o clorură de argint slab solubilă și netoxică:
Ag + + CI - = AgCI (t)
bea sifon(bicarbonat de sodiu, bicarbonat de sodiu) NaHCO3 este utilizat în diverse boliînsoțită de aciditate crescută - acidoză (diabet etc.). Mecanismul de reducere a acidității este interacțiunea NaHCO 3 cu produșii acizi. În acest caz, se formează săruri de sodiu ale acizilor organici, care sunt în mare parte excretate în urină și dioxid de carbon părăsind corpul cu aerul expirat:
NaHC03 (p) + RCOOH (p) → RCOONa(p) + H 2 O (l) + CO 2 (g)
Utilizați NaHCO 3 și cu aciditate crescută a sucului gastric, ulcer peptic al stomacului și duodenului. Când se ia NaHCO 3, are loc reacția de neutralizare a excesului de acid clorhidric:
NaHCO 3 (p) + HCl (p) \u003d NaCl (p) + H 2 O (g) + CO 2 (g)
Trebuie avut în vedere că utilizarea bicarbonatului de sodiu trebuie să fie atentă, deoarece. poate provoca o serie de reacții adverse.
Soluțiile de sifon sunt folosite sub formă de clătiri, spălări pentru boli inflamatorii ale ochilor, mucoase ale tractului respirator superior. Acțiunea NaHCO 3 ca antiseptic se bazează pe faptul că, ca urmare a hidrolizei, o soluție apoasă de sodă prezintă proprietăți ușor alcaline:
NaHCO3 + H2O ↔ NaOH + H2CO3
Sub influența alcalinelor asupra celulelor microbiene, are loc precipitarea proteinelor celulare și, ca urmare, moartea microorganismelor.
Sarea lui Glauber(sulfat de sodiu) Na 2 SO 4 ∙10H 2 O este folosit ca laxativ. Această sare este absorbită lent din intestin, ceea ce duce la menținerea presiunii osmotice crescute în cavitatea intestinală pentru o lungă perioadă de timp. Ca urmare a osmozei, apa se acumulează în intestine, conținutul ei este lichefiat, contracțiile intestinale sunt intensificate, iar masele fecale sunt excretate mai repede.
Bura(tetraborat de sodiu) Na 2 B 4 O 7 ∙10H 2 O se folosește extern ca antiseptic pentru clătire, dușare, lubrifiere. efectul antiseptic al boraxului este similar cu efectul consumului de sifon și este asociat cu o reacție alcalină a soluției apoase a acestei sări, precum și cu formarea acidului boric:
Na 2 B 4 O 7 + 7H 2 O ↔ 4H 3 BO 3 + 2NaOH
Hidroxid de sodiu sub forma unei solutii de NaOH 10%, face parte din silina folosita in practica ortopedica pentru turnarea modelelor refractare la fabricarea protezelor turnate dintr-o bucata dintr-un aliaj cobalt-crom.
Izotop radioactiv 24 Na este folosit ca marker pentru a determina rata fluxului sanguin și este, de asemenea, folosit pentru a trata unele forme de leucemie.
Potasiu. Conținutul C de potasiu dintr-un corp uman care cântărește 70 kg este de aproximativ 160 g (4090 mmol). Potasiul este principalul cation intracelular, reprezentând 2/3 din numărul total de cationi celulari activi. În cele mai multe cazuri, potasiul este un antagonist de sodiu.
Din cantitatea totală de potasiu conținută în organism, 98% se află în interiorul celulelor și doar aproximativ 2% se află în lichidul extracelular. Potasiul este distribuit pe tot corpul. Topografia sa: ficat, rinichi, inimă, țesut osos, mușchi, sânge, creier etc.
Ionii de potasiu K+ joacă un rol important în procese fiziologice:
contractie musculara
în funcționarea normală a inimii
implicate în transmiterea impulsurilor nervoase
în reacţii de schimb
activează activitatea unui număr de enzime situate în interiorul celulei
reglează echilibrul acido-bazic
Are proprietăți protectoare împotriva efectelor nedorite ale excesului de sodiu și normalizează tensiunea arterială. În organismul persoanelor care mănâncă multe legume bogate în potasiu - vegetarieni - cantitatea de potasiu și sodiu sunt în echilibru. Acești oameni au cel mai adesea valori mai mici ale tensiunii arteriale decât colegii lor care mănâncă carne.
Are efect anti-sclerotic
Potasiul are capacitatea de a crește producția de urină
Un adult consumă de obicei 2-3 g de potasiu pe zi cu alimente. Concentrația ionilor de potasiu în lichidul extracelular, inclusiv în plasmă, este în mod normal de 3,5 - 5,5 mmol / l, iar concentrația de potasiu intracelular este de 115 - 125 mmol / l.
rubidiu și cesiu.În funcție de conținutul din corpul uman, rubidiul și cesiul sunt microelemente. Sunt continuu continuu in organism, dar rolul lor biologic nu a fost inca elucidat.
Rubidiu și cesiu se găsesc în toate organele studiate ale mamiferelor și oamenilor. Intrând în organism cu alimente, acestea sunt absorbite rapid din tractul gastrointestinal în sânge. Nivelul mediu de rubidiu din sânge este de 2,3-2,7 mg/l, iar concentrația acestuia în eritrocite este de aproape trei ori mai mare decât în plasmă. Rubidiul și cesiul sunt distribuite foarte uniform în organe și țesuturi, în plus, rubidiul se acumulează în principal în mușchi, în timp ce cesiul pătrunde în intestin și este reabsorbit în secțiunile sale descendente.
Rolul rubidiului și cesiului în unele procese fiziologice este cunoscut. În prezent s-a stabilit efectul stimulator al acestor elemente asupra funcțiilor circulației sanguine și eficacitatea utilizării sărurilor acestora în hipotensiunea arterială de diverse origini. În laboratorul lui I.P. Pavlov, S.S. Botkin a constatat că clorurile de cesiu și rubidiu provoacă o creștere a tensiunii arteriale pentru o perioadă lungă de timp și că acest efect este asociat în principal cu creșterea activității cardiovasculare și îngustarea vaselor periferice.
Fiind un analog complet al potasiului, rubidiul se acumulează și în lichidul intracelular și poate înlocui o cantitate echivalentă de potasiu în diferite procese. Sinergism (chimic) - efectul combinat simultan a doi (sau mai mulți) factori, caracterizat prin faptul că o astfel de acțiune comună depășește semnificativ efectul fiecărei componente individuale. Rubidiul sinergic cu potasiu activează multe dintre aceleași enzime ca și potasiul.
Izotopii radioactivi 137 Cs și 87 Rb sunt utilizați în radioterapia tumorilor maligne, precum și în studiul metabolismului potasiului. Datorită defalcării lor rapide, ele pot fi chiar introduse în organism fără teama de efecte nocive pe termen lung.
Franţa. Acesta este un element chimic radioactiv obținut prin mijloace artificiale. Există dovezi că franciul se poate acumula selectiv în tumori în stadiile incipiente ale dezvoltării lor. Aceste observații pot fi utile în diagnosticul cancerului.
Prin urmare, Dintre elementele grupului IA, Li, Rb, Cs sunt active fiziologic, în timp ce Na și K sunt vitale. Apropierea proprietăților fizico-chimice ale Li și Na, datorită asemănării structurii electronice a atomilor lor, se manifestă și în acțiunea biologică a cationilor (acumulare în fluidul extracelular, interschimbabilitate). O natură similară a acțiunii biologice a cationilor elementelor de perioade mari - K + , Rb + , Cs + (acumulare în fluidul intracelular, interschimbabilitate) se datorează și asemănării structurii lor electronice și proprietăților fizico-chimice. Aceasta este baza pentru utilizarea preparatelor de sodiu și potasiu în caz de otrăvire cu săruri de litiu și rubidiu.
3. Căile metalelor alcaline
în corpul uman
Modalitățile prin care elementele chimice pătrund în corpul uman sunt diverse, ele sunt prezentate în diagramă:

Uman
În procesul de evoluţie din materie organică la bioorganic baza pentru utilizarea anumitor elemente chimice în crearea biosistemelor este selecția naturală.
Tabelul prezintă date privind conținutul de elemente din grupa I A - metale alcaline - în scoarța terestră, apa de mare, plante, organisme animale și în corpul uman (fracția de masă în %).
Tabelul arată că, cu cât abundența unui element din scoarța terestră este mai mare, cu atât este mai mare în corpul uman.
Li
N / A
K
Rb
Cs
Scoarta terestra
6,5∙10 -3
0,03
date precise
Nu
Pamantul
3∙10 -3
0,63
1,36
5∙10 -3
Apa de mare
1,5∙10 -5
1,06
0,038
2∙10 -5
Plante
1∙10 -5
0,02
5∙10 -4
Animale
10 -4
0,27
10 -5
Uman
10 -4
0,08
0,23
10 -5
10 -4
Cele mai esențiale metale alcaline pentru corpul uman sunt sodiul și potasiul. În corpul uman, aproape toate elementele vin în principal cu alimente.
Surse de litiu.
Litiul se găsește în unele ape minerale, precum și în sare de mare și gemă. Este, de asemenea, conținut în plante, dar concentrația sa, ca orice oligoelemente, depinde nu numai de tipul și partea de plantă, ci și de anotimp și chiar de zi, de condițiile de colectare și vreme, precum și de zona în care crește această plantă.
La noi, litiul a fost studiat de angajații Institutului de Geochimie care poartă numele acad. V. I. Vernadsky la Moscova. S-a constatat că părțile de pământ ale plantelor sunt mai bogate în litiu decât rădăcinile. Cea mai mare parte a litiului în plantele din familia roz, cuișoare, nuanțe de noapte, care includ roșii și cartofi. Deși în cadrul aceleiași familii, diferența de conținut poate fi uriașă - de câteva zeci de ori. Depinde de locație geograficăși conținutul de litiu din sol.
surse de sodiu.
Sodiul este prezent în diferite suplimente alimentare sub formă de glutamat monosodic (aromă), zaharină de sodiu (îndulcitor), nitrat de sodiu (conservant), ascorbat de sodiu (antioxidant) și bicarbonat de sodiu (bicarbonat de sodiu), precum și în unele medicamente (antiacide). ). Cu toate acestea, cea mai mare parte a sodiului din dietă se găsește în sare.
Nivelurile de NaCl sunt relativ scăzute în general Produse alimentare care nu au suferit un tratament special. Cu toate acestea, sarea a fost folosită ca conservant și agent de aromatizare de câteva secole. De asemenea, este folosit ca colorant, umplutură și pentru a controla procesul de fermentație (de exemplu, la coacerea pâinii). Din acest motiv, se adaugă la alimente precum șuncă, cârnați, slănină și alte produse din carne, pește și carne afumată, legume conservate, majoritatea tipurilor de unt, margarină, brânză, alimente sărate, gustări și cereale pe care le consumăm la micul dejun.
Cantitatea recomandată de sodiu este 1,5 grameîntr-o zi. Excesul de sare din dietă este asociat cu un risc crescut de cancer de stomac și este dăunător rinichilor, mai ales dacă au tulburări ale sistemului urinar. Excesul de sare este unul dintre principalii factori ai stilului de viață care duce la hipertensiune arterială. Dacă hipertensiunea arterială este asimptomatică, crește riscul de boli cardiovasculare și accident vascular cerebral. Recomandările actuale pentru prevenirea hipertensiunii arteriale au arătat că cea mai eficientă dietă pentru prevenirea și tratarea hipertensiunii arteriale ar trebui să fie săracă în sodiu și grăsimi și bogată în produse lactate cu conținut scăzut de grăsimi (o sursă de calciu) și fructe și legume (o sursă de potasiu). Astfel, este important să schimbați dieta în ansamblu și să nu vă concentrați asupra niciunei componente ale acesteia. Alți factori pozitivi importanți includ activitatea fizică, greutatea corporală normală.
Persoanele cu boli de rinichi și copiii foarte mici nu pot tolera cantități mari de sodiu, deoarece rinichii lor nu pot să-l excrete. Din acest motiv, nu trebuie să adăugați sare în mâncarea copiilor mici.
Etichetele alimentelor sunt obligate prin lege să enumere conținutul de sodiu, dar unii producători omit această regulă și enumera cantitatea de sare.
Tine minte: " Sarea poate fi sărată sănătatea noastră!»
Surse de potasiu.
Cea mai bună sursă de potasiu sunt alimentele vegetale. Acestea sunt pepeni verzi, pepeni, portocale, mandarine, banane, fructe uscate (smochine, caise, macese). Boabele bogate în potasiu sunt lingonberries, căpșunile, coacăzele negre și roșii. Există mult potasiu în legume (în special cartofi), leguminoase, produse din făină integrală și orez.
Răspunsul organismului la lipsa de potasiu.
Cu o lipsă de potasiu în organism, se observă slăbiciune musculară, letargie intestinală și tulburări cardiace.
„Nu m-am trezit încă - sunt deja obosit” - așa este deficiența de potasiu a medicului la figurat și accesibilă. Un conținut scăzut de potasiu în organism duce de obicei la astenie (epuizare mentală și fizică, oboseală), afectarea funcției renale și epuizarea funcției cortexului suprarenal. Există riscul încălcării proceselor metabolice și a conducerii în miocard.
Deficiența de potasiu reduce eficiența, încetinește vindecarea rănilor și duce la afectarea conducerii neuromusculare. Se notează uscăciunea pielii, slăbiciune și slăbiciune a părului (acesta este subiectul unor griji serioase, în special pentru femei și fete).
Poate veni moarte subita cu sarcini crescânde. Există o transmitere slabă a impulsurilor nervoase. Reduceți absorbția diureticelor de potasiu (diuretice). Când gătiți, este necesar să acordați atenție faptului că compușii de potasiu sunt solubili în apă. Această împrejurare obligă să spălați produsele care îl conțin înainte de a le măcina și să le fierbeți într-o cantitate mică de apă.
Apropo, medicina tradițională consideră că pofta de alcool este asociată cu o lipsă de potasiu în organism.
Folosit pentru epuizarea potasiului clorura de potasiu KCl 4 - 5 ori pe zi pentru 1g.
Răspunsul organismului la excesul de potasiu.
Cu un exces de potasiu în organism, funcțiile principale ale inimii sunt inhibate: o scădere a excitabilității mușchiului inimii, o scădere a ritmului contracțiilor inimii, o deteriorare a conductibilității și o slăbire a forței inimii. contractii. În concentrații mari, ionii de potasiu provoacă stop cardiac în diastolă (faza de contracție a ventriculilor inimii). Doza toxică de potasiu este de 6 g. Doza letală este de 14 g. Sărurile de potasiu pot fi toxice pentru organism datorită anionului asociat ionului de potasiu, de exemplu, KCN (cianura de potasiu).
Pentru reglarea conținutului acestor nutrienți pot fi luate în considerare datele prezentate în tabelul următor.

4. Partea practică
Experiența 1.Colorare la flacără cu compuși.
O modalitate de a detecta calitativ compușii metalelor alcaline se bazează pe capacitatea lor de a colora flacăra arzătorului.
Se toarnă soluții de săruri de metale alcaline în eprubete. Spălați firul de fier în acid clorhidric și apoi aprindeți-l într-o flacără a arzătorului.
Apoi este necesar să umeziți firul cu o soluție de sare studiată și să îl aduceți în flacără.
Săruri care conțin cationi de litiu, precum și el însuși litiu colorează flăcările roșu culoare, cationi de sodiu și metal sodiu- V galben, cationi de potasiu și metal potasiu colorează flăcările violet culoare. Pentru o supraveghere mai bună Puteți vedea culoarea prin sticla albastră.
Astfel, ionii Li + , Na + și K + au fost găsiți în soluții de săruri LiCl , NaCl , Na 2 CO 3 , Na 2 SO 4 , NaNO 3 , KCl , KNO 3 , K2CO 3 .
Experiența 2.Interacțiunea metalelor alcaline cu apa.
Într-un pahar cu apă se adaugă o bucată de metal curățată bine de pelicula de oxid. După dizolvarea metalului, mediul soluției a fost examinat folosind fenolftaleină.
Efectuați un astfel de experiment cu bucăți de litiu, sodiu și potasiu. Reacția cu potasiul a fost cea mai activă, a fost însoțită de arderea potasiului, s-au observat scântei violet și degajare de gaze. Sodiul a reacționat cu apa, dând scântei galbene, în timp ce litiul a reacționat cel mai calm.
Soluțiile rezultate cu fenolftaleină au devenit purpurie, indicând prezența alcaline în soluție.
2Li + 2H 2 O \u003d 2LiOH + H 2
2Na + 2H 2 O \u003d 2NaOH + H 2
2K + 2H2O = 2KOH + H2
Experienţă 3. Hidroliza sărurilor de sodiu și potasiu.
Natura mediului de soluții de sare este investigată folosind indicatori acido-bazici.
Hârtiile indicator universale, scufundate în soluții de săruri de metale alcaline formate din acizi slabi Na 2 CO 3 și K 2 CO 3, au devenit albastre, ceea ce indică o reacție alcalină a soluțiilor. hidroliza a avut loc în soluții - interacțiunea sărurilor cu moleculele de apă:
Na 2 CO 3 ↔ 2Na + + CO 3 2-
CO 3 2- + H 2 O ↔ HCO 3 - + OH -
Na 2 CO 3 + H 2 O ↔ NaHCO 3 + NaOH
Soluțiile de săruri ale acizilor tari NaNO 3 , KNO 3 , NaCl , KCl , LiCl au prezentat un mediu neutru (culoarea hârtiei indicator nu s-a schimbat), ceea ce înseamnă că hidroliza acestor săruri nu are loc

concluzii
De ce este atât de important să cunoaștem conținutul de elemente chimice din organism?
Elementele chimice nu sunt sintetizate, spre deosebire de multe substanțe organice, în organism, ci vin din exterior cu alimente, aer, prin piele și mucoase. Prin urmare, definiția elementelor chimice vă permite să aflați despre:
cum corpul tău corespunde idealului (apropo, aproximativ 20% dintre oameni nu au abateri și, astfel, trăiesc în armonie cu natura);
dacă mănânci corect, dacă dieta ta oferă setul necesar de nutrienți;
Obiceiurile proaste dăunează organismului?
cât de sigur este mediul în care trăiești; hrana pe care o consumi; locul tau de munca;
dacă stomacul, intestinele, ficatul, rinichii, pielea funcționează bine, reglând procesele de absorbție și excreție a nutrienților;
dacă aveți boli cronice sau predispoziție la acestea;
Ești tratat corect?
Ce boli sunt cel mai strâns asociate cu un dezechilibru de elemente?
În primul rând, acestea sunt:
scăderea imunității;
boli ale pielii, părului, unghiilor;
scolioză, osteoporoză, osteocondroză;
hipertensiune;
alergii, inclusiv astmul bronșic;
diabet, obezitate;
boli ale sistemului cardiovascular;
boli de sânge (anemie);
disbacterioză intestinală, gastrită cronică, colită;
infertilitate, scăderea potenței la bărbați;
tulburări de creștere și dezvoltare la copii.
Mulți ani de experiență a medicilor arată că peste 80% din populație prezintă un dezechilibru mai mult sau mai puțin pronunțat al oligoelementelor. Prin urmare, dacă aveți vreunul ar trebui să fii atent la el!
Mulți oameni de știință cred că nu numai toate elementele chimice sunt prezente într-un organism viu, dar fiecare dintre ele îndeplinește o anumită funcție biologică.
Am clarificat rolul biologic al unui singur grup de elemente chimice. Metalele alcaline sunt extrem de importante pentru sănătatea umană, ca majoritatea altora. Este foarte important pentru starea sănătății umane să mențină concentrația optimă a fiecărui element: atât deficiența elementului, cât și excesul acestuia sunt dăunătoare.
Stabilitate compoziție chimică organismul este una dintre cele mai importante și indispensabile condiții pentru funcționarea sa normală .
Există o opinie eronată, deși răspândită, despre posibilitatea corectării dezechilibrului compoziției elementare a corpului uman prin îmbogățirea alimentației cu anumite produse care conțin elementele minerale necesare. Cu toate acestea, trebuie luat în considerare faptul că prezența macro și microelementelor necesare în alimente și apă (ceea ce este evident mai ales pentru locuitorii zonelor rurale) depinde în mare măsură de așa-numitul „ciclu biogeochimic local” al elementelor. , care determină conținutul de macro și microelemente în plantele și animalele alimentare.
Deficiența sau excesul anumitor elemente din corpul uman, de regulă, este o consecință a unei deficiențe sau exces a acestor elemente care trec prin lanțul trofic: de la sol - la plante și animale - la om. Cu o deficiență în curs de dezvoltare a oricărui element, corecția nutrițională nu este suficientă, chiar dacă în acest scop sunt folosite produse din alte regiuni, ale căror soluri sunt îmbogățite cu oligoelementul necesar.
Doar o selecție individuală de minerale speciale și alte preparate care vizează normalizarea echilibrului microelementelor din organism va oferi asistență reală și eficientă în dezvoltarea unei stări patologice.
În concluzie, dăm poruncile medicinei tradiționale și științifice pe care toată lumea trebuie să le cunoască:
Totul este legat de tot.
Totul trebuie să meargă undeva.
Natura știe cel mai bine.
Nimic nu se dă gratis.
Cărți uzate
1. Gabrielyan O.S. Chimie, clasa a 9-a, Manual pentru instituții de învățământ. - M. Dropia, 2001
2. Glinka N.L. Chimie generală, Manual pentru licee. - L. „Chimie”, 1983
3. Chimie generală. Chimia elementelor biogene. Manual pentru miere. specialist. apel. Yu.A. Ershov și alții - M. „Școala superioară”, 1993
4. Sychev A.P., Fadeev G.N. Chimia metalelor. Tutorial. - M. „Iluminismul”, 1984
5. MHTML. Do c ument. lecție integrată „Metale alcaline”. Festivalul „Lecția deschisă”, 2003
6.
7.
Acestea sunt elementele grupei I a sistemului periodic: litiu (Li), sodiu (Na), potasiu (K), rubidiu (Rb), cesiu (Cs), franciu (Fr); foarte moale, ductil, fuzibil și ușor, de obicei alb argintiu; foarte activ din punct de vedere chimic; reacţionează violent cu apa pentru a se forma alcalii(de unde și numele).
 Toate metalele alcaline sunt extrem de active, prezintă proprietăți reducătoare în toate reacțiile chimice, renunță la singurul lor electron de valență, transformându-se într-un cation încărcat pozitiv și prezintă o singură stare de oxidare +1.
Toate metalele alcaline sunt extrem de active, prezintă proprietăți reducătoare în toate reacțiile chimice, renunță la singurul lor electron de valență, transformându-se într-un cation încărcat pozitiv și prezintă o singură stare de oxidare +1.
Capacitatea de reducere crește în seria ––Li–Na–K–Rb–Cs.
Toți compușii metalelor alcaline sunt de natură ionică.
Aproape toate sărurile sunt solubile în apă.
puncte de topire scăzute,
Valori mici ale densității,
Moale, tăiat cu un cuțit
Datorită activității lor, metalele alcaline sunt depozitate sub un strat de kerosen pentru a bloca accesul aerului și umidității. Litiul este foarte ușor și plutește la suprafață în kerosen, așa că este depozitat sub un strat de vaselină.
Proprietățile chimice ale metalelor alcaline
1. Metalele alcaline interacționează activ cu apa:

2Na + 2H2O → 2NaOH + H2
2Li + 2H2O → 2LiOH + H2
2. Reacția metalelor alcaline cu oxigenul:
4Li + O 2 → 2Li 2 O (oxid de litiu)
2Na + O 2 → Na 2 O 2 (peroxid de sodiu)
K + O 2 → KO 2 (superoxid de potasiu)
În aer, metalele alcaline se oxidează instantaneu. Prin urmare, acestea sunt depozitate sub un strat de solvenți organici (kerosen etc.).
3. În reacțiile metalelor alcaline cu alte nemetale se formează compuși binari:
2Li + Cl 2 → 2LiCl (halogenuri)
2Na + S → Na 2 S (sulfuri)
2Na + H2 → 2NaH (hidruri)
6Li + N 2 → 2Li 3 N (nitruri)
2Li + 2C → Li 2 C 2 (carburi)
4. Reacția metalelor alcaline cu acizii
(se desfășoară rar, există o reacție concurentă cu apa):
2Na + 2HCl → 2NaCI + H2
5. Interacțiunea metalelor alcaline cu amoniacul
(se formează amida de sodiu):
2Li + 2NH3 = 2LiNH2 + H2
6. Interacțiunea metalelor alcaline cu alcoolii și fenolii, care în acest caz prezintă proprietăți acide:
2Na + 2C 2 H 5 OH \u003d 2C 2 H 5 ONa + H 2;
2K + 2C6H5OH = 2C6H5OK + H2;
7. Reacția calitativă la cationii metalelor alcaline - colorarea flăcării în următoarele culori:
Li + - roșu carmin 
Na + - galben
K + , Rb + și Cs + - violet
Obținerea metalelor alcaline
Litiu, sodiu și potasiu metal a primi electroliza sărurilor topite (cloruri) și rubidiu și cesiu - reducerea în vid atunci când clorurile lor sunt încălzite cu calciu: 2CsCl + Ca \u003d 2Cs + CaCl 2
ÎN scară mică Producția termică în vid de sodiu și potasiu este, de asemenea, utilizată:
2NaCl + CaC2 \u003d 2Na + CaCl2 + 2C;
4KCl + 4CaO + Si \u003d 4K + 2CaCl 2 + Ca 2 SiO 4.
Metalele alcaline active sunt eliberate în procesele termice în vid datorită volatilității lor ridicate (vaporii lor sunt îndepărtați din zona de reacție).

 Caracteristicile proprietăților chimice ale elementelor s din grupa I și efectul lor fiziologic
Caracteristicile proprietăților chimice ale elementelor s din grupa I și efectul lor fiziologic
Configurația electronică a atomului de litiu este 1s 2 2s 1 . Are cea mai mare rază atomică în perioada a 2-a, ceea ce facilitează detașarea electronului de valență și apariția ionului Li + cu configurație stabilă de gaz inert (heliu). Prin urmare, compușii săi se formează odată cu transferul unui electron de la litiu la un alt atom și apariția unei legături ionice cu o cantitate mică de covalență. Litiul este un element metalic tipic. Sub formă de substanță, este un metal alcalin. Se deosebește de ceilalți membri ai grupului I prin dimensiunea sa mică și cea mai mică activitate, în comparație cu aceștia. În acest sens, seamănă cu elementul din grupa II, magneziul, situat în diagonală față de Li. În soluții, ionul Li + este puternic solvatat; este înconjurat de câteva zeci de molecule de apă. Litiul, în ceea ce privește energia de solvație - adăugarea de molecule de solvent, este mai aproape de un proton decât de cationii metalelor alcaline.
Dimensiunea mică a ionului Li +, sarcina nucleară mare și doar doi electroni creează condiții pentru apariția unui câmp de sarcină pozitiv destul de semnificativ în jurul acestei particule, prin urmare, în soluții, un număr semnificativ de molecule de solvent polar sunt atrase de acesta și numărul său de coordonare este mare, metalul este capabil să formeze un număr semnificativ de compuși organolitici.
Sodiul începe a 3-a perioadă, deci are doar 1e la nivel extern - , ocupând orbitalul 3s. Raza atomului de Na este cea mai mare în perioada a 3-a. Aceste două caracteristici determină natura elementului. Configurația sa electronică este 1s 2 2s 2 2p 6 3s 1 . Singura stare de oxidare a sodiului este +1. Electronegativitatea sa este foarte mică, prin urmare, sodiul este prezent în compuși numai sub formă de ion încărcat pozitiv și conferă legăturii chimice un caracter ionic. Dimensiunea ionului de Na + este mult mai mare decât Li +, iar solvatarea acestuia nu este atât de mare. Cu toate acestea, nu există în formă liberă în soluție.
Semnificația fiziologică a ionilor K + și Na + este asociată cu absorbabilitatea lor diferită pe suprafața componentelor care alcătuiesc scoarța terestră. Compușii de sodiu sunt doar puțin adsorbiți, în timp ce compușii de potasiu sunt reținuți puternic de argilă și alte substanțe. Membranele celulare, fiind interfața celulă-mediu, sunt permeabile la ionii de K +, drept urmare concentrația intracelulară de K + este mult mai mare decât cea a ionilor de Na +. În același timp, concentrația de Na + în plasma sanguină depășește conținutul de potasiu din aceasta. Această circumstanță este asociată cu apariția potențialului de membrană al celulelor. Ionii K + și Na + - una dintre componentele principale ale fazei lichide a corpului. Raportul lor cu ionii de Ca 2+ este strict definit, iar încălcarea acestuia duce la patologie. Introducerea ionilor de Na + în organism nu are un efect nociv vizibil. O creștere a conținutului de ioni K + este dăunătoare, dar în condiții normale, o creștere a concentrației acestuia nu atinge niciodată valori periculoase. Efectul ionilor Rb + , Cs + , Li + nu a fost încă suficient studiat.
Dintre diferitele leziuni asociate cu utilizarea compușilor de metale alcaline, arsurile cu soluții de hidroxid sunt cele mai frecvente. Acțiunea alcaline este asociată cu dizolvarea proteinelor pielii în ele și formarea albuminaților alcalini. Alcalii sunt eliberați din nou ca urmare a hidrolizei lor și acționează asupra straturilor mai profunde ale corpului, provocând apariția ulcerelor. Unghiile sub influența alcalinelor devin terne și casante. Leziunile oculare, chiar și cu soluții alcaline foarte diluate, sunt însoțite nu numai de distrugerea superficială, ci și de încălcări ale părților profunde ale ochiului (iris) și duce la orbire. În timpul hidrolizei amidelor metalelor alcaline, se formează simultan alcalii și amoniacul, provocând traheobronșită și pneumonie de tip fibrinos.
Potasiul a fost obținut de G. Davy aproape simultan cu sodiul în 1807 în timpul electrolizei hidroxidului de potasiu umed. De la numele acestui compus - „potasa caustică” și elementul și-a primit numele. Proprietățile potasiului diferă semnificativ de proprietățile sodiului, datorită diferenței dintre razele atomilor și ionilor lor. În compușii de potasiu, legătura este mai ionică, iar sub forma ionului K +, are un efect de polarizare mai mic decât sodiul, datorită dimensiunii sale mari. Amestecul natural este format din trei izotopi 39 K, 40 K, 41 K. Unul dintre ei este 40 K ‑ este radioactiv și o anumită proporție din radioactivitatea mineralelor și a solului este asociată cu prezența acestui izotop. Timpul său de înjumătățire este lung - 1,32 miliarde de ani. Determinarea prezenței potasiului într-o probă este destul de ușoară: vaporii metalului și ai compușilor săi transformă flacăra în roșu-violet. Spectrul elementului este destul de simplu și dovedește prezența lui 1e - pe orbitalul 4s. Studiul acestuia a servit drept unul dintre temeiurile pentru găsirea de modele generale în structura spectrelor.
În 1861, Robert Bunsen a descoperit un nou element în timp ce studia sarea izvoarelor minerale prin analiză spectrală. Prezența sa a fost dovedită de linii roșii închise din spectru, pe care alte elemente nu le-au dat. După culoarea acestor linii, elementul a fost numit rubidium (rubidus-roșu închis). În 1863, R. Bunsen a obținut acest metal în forma sa pură prin reducerea tartratului de rubidio (sare tartru) cu funingine. O caracteristică a elementului este ușoară excitabilitate a atomilor săi. Emisia de electroni din ea apare sub acțiunea razelor roșii din spectrul vizibil. Acest lucru se datorează unei mici diferențe în energiile orbitalilor atomici 4d și 5s. Dintre toate elementele alcaline cu izotopi stabili, rubidiul (cum ar fi cesiul) are una dintre cele mai mari raze atomice și un potențial de ionizare scăzut. Astfel de parametri determină natura elementului: electropozitivitate ridicată, activitate chimică extremă, punct de topire scăzut (39 0 C) și rezistență scăzută la influențele externe.
Descoperirea cesiului, ca și rubidiul, este asociată cu analiza spectrală. În 1860, R. Bunsen a descoperit două linii albastre strălucitoare în spectru care nu aparțineau niciunui element cunoscut în acel moment. De aici și numele „caesius” (caesius), care înseamnă albastru cerul. Este ultimul element al subgrupului de metale alcaline încă găsit în cantități măsurabile. Cea mai mare rază atomică și cele mai mici potențiale de ionizare determină natura și comportamentul acestui element. Are o electropozitivitate pronunțată și calități metalice pronunțate. Dorința de a dona electronul 6s exterior duce la faptul că toate reacțiile sale decurg extrem de violent. O mică diferență în energiile orbitalilor atomici 5d și 6s este responsabilă pentru ușoară excitabilitate a atomilor. Emisia electronică în cesiu se observă sub acțiunea razelor infraroșii invizibile (termice). Această caracteristică a structurii atomice determină buna conductivitate electrică a curentului. Toate acestea fac ca cesiul să fie indispensabil în dispozitivele electronice. Recent, din ce în ce mai multă atenție s-a acordat plasmei de cesiu ca combustibil al viitorului și în legătură cu soluționarea problemei fuziunii termonucleare.
În aer, litiul reacționează activ nu numai cu oxigenul, ci și cu azotul și este acoperit cu un film format din Li 3 N (până la 75%) și Li 2 O. Metalele alcaline rămase formează peroxizi (Na 2 O 2) și superoxizi (K 2 O 4 sau KO 2).
Următoarele substanțe reacționează cu apa:
Li 3 N + 3 H 2 O \u003d 3 LiOH + NH 3;
Na 2 O 2 + 2 H 2 O \u003d 2 NaOH + H 2 O 2;
K 2 O 4 + 2 H 2 O \u003d 2 KOH + H 2 O 2 + O 2.
Pentru regenerarea aerului pe submarine și nave spațiale, în măștile de gaz izolatoare și aparatele de respirație ale înotătorilor de luptă (sabotori submarini), a fost folosit un amestec de „oxon”:
Na 2 O 2 + CO 2 \u003d Na 2 CO 3 + 0,5 O 2;
K 2 O 4 + CO 2 \u003d K 2 CO 3 + 1,5 O 2.
Aceasta este în prezent umplerea standard a cartuşelor regeneratoare pentru măşti de gaz izolante pentru pompieri.
Metalele alcaline reacţionează când sunt încălzite cu hidrogen pentru a forma hidruri:
Hidrura de litiu este folosită ca agent reducător puternic.
Hidroxizi metalele alcaline corodează vasele din sticlă și porțelan, nu pot fi încălzite în vasele de cuarț:
SiO2 + 2NaOH \u003d Na2SiO3 + H2O.
Hidroxizii de sodiu și potasiu nu desprind apa atunci când sunt încălziți până la punctul lor de fierbere (mai mult de 1300 0 C). Unii compuși de sodiu sunt numiți sifon:
A) sodă, sifon anhidru, sifon pentru rufe sau doar sifon - carbonat de sodiu Na 2 CO 3;
b) sodă cristalină - carbonat de sodiu cristal hidrat Na 2 CO 3. 10H20;
c) bicarbonat sau de băut - bicarbonat de sodiu NaHCO 3;
d) hidroxidul de sodiu NaOH se numește sodă caustică sau caustică.
METALE ALCALINE
SUBGRUPA IA. METALE ALCALINE
LITIU, SODIU, POTASIU, RUBIDIU, CEZIU, FRANTA
Structura electronică a metalelor alcaline este caracterizată prin prezența unui electron pe învelișul exterior al electronilor, care este relativ slab legat de nucleu. Fiecare metal alcalin începe o nouă perioadă în tabelul periodic. Metalul alcalin este capabil să-și doneze electronul exterior mai ușor decât orice alt element din această perioadă. Tăierea unui metal alcalin într-un mediu inert are o strălucire argintie strălucitoare. Metalele alcaline se caracterizează prin densitate scăzută, conductivitate electrică bună și se topesc relativ temperaturi scăzute(Masa 2).
Datorită activității lor ridicate, metalele alcaline nu există în formă pură, ci apar în natură doar sub formă de compuși (excluzând franciul), de exemplu, cu oxigen (argile și silicați) sau cu halogeni (clorura de sodiu). Clorurile sunt materii prime pentru obținerea metalelor alcaline în stare liberă. Apa de mare conține METALE ALCALINE 3% NaCl și urme de alte săruri. Evident, lacurile și mările interioare, precum și zăcămintele subterane de sare și saramură, conțin halogenuri de metale alcaline în concentrații mai mari decât apa de mare. De exemplu, conținutul de sare din apele Marelui Lac Sărat (Utah, SUA) este de 13,827,7%, iar în Marea Moartă (Israel) până la 31%, în funcție de suprafața apei, care variază în funcție de sezon. Se poate presupune că conținutul nesemnificativ de KCl din apa de mare în comparație cu NaCl se explică prin asimilarea ionului K+ de către plantele marine.
În formă liberă, metalele alcaline sunt obținute prin electroliza topituri de săruri precum NaCl, CaCl2, CaF2 sau hidroxizi (NaOH), deoarece nu există un metal mai activ capabil să înlocuiască metalul alcalin din halogenură. În timpul electrolizei halogenurilor, este necesară izolarea metalului eliberat la catod, deoarece în același timp este eliberat halogen gazos la anod, care reacționează activ cu metalul eliberat.
Vezi și PRODUCTIE ALKALI
Deoarece metalele alcaline au un singur electron pe stratul exterior, fiecare dintre ele este cel mai activ în perioada sa, deci Li este metalul cel mai activ în prima perioadă de opt elemente, respectiv Na, în a doua, iar K este cel mai activ metal din perioada a treia, conținând 18 elemente (prima perioadă de tranziție). În subgrupul metalelor alcaline (IA), capacitatea de a dona un electron crește de sus în jos.
Proprietăți chimice. Toate metalele alcaline reacţionează activ cu oxigenul, formând oxizi sau peroxizi, care diferă unele de altele prin aceasta: Li se transformă în Li2O, iar alte metale alcaline într-un amestec de M2O2 şi MO2, în timp ce Rb şi Cs se aprind. Toate metalele alcaline formează cu hidrogen săruri, stabile termic la temperaturi ridicate, hidruri de compoziție M + H, care sunt agenți reducători activi; Hidrururile sunt descompuse de apă cu formarea de alcali și hidrogen și eliberarea de căldură, provocând aprinderea gazului, iar viteza acestei reacții pentru litiu este mai mare decât pentru Na și K.
Vezi și HIDROGEN; OXIGEN.
În amoniacul lichid, metalele alcaline se dizolvă pentru a forma soluții albastre și (spre deosebire de apă) pot fi izolate din nou prin evaporarea amoniacului sau prin adăugarea unei sări adecvate (de exemplu, NaCl din soluția sa de amoniac). Când reacționează cu amoniacul gazos, reacția decurge similar cu reacția cu apa:
Amidele metalelor alcaline prezintă proprietăți de bază similare hidroxizilor. Majoritatea compușilor metalelor alcaline, cu excepția unor compuși de litiu, sunt foarte solubili în apă. În ceea ce privește dimensiunea atomică și densitatea de sarcină, litiul este aproape de magneziu, astfel încât proprietățile compușilor acestor elemente sunt similare. În ceea ce privește solubilitatea și stabilitatea termică, carbonatul de litiu este similar carbonaților de magneziu și beriliu din subgrupa IIA; acești carbonați se descompun la temperaturi relativ scăzute datorită legăturii mai puternice a MO. Sărurile de litiu sunt mai solubile în solvenți organici (alcooli, eteri, solvenți din petrol) decât alte săruri de metale alcaline. Litiul (ca și magneziul) reacționează direct cu azotul pentru a forma Li3N (magneziul formează Mg3N2), în timp ce sodiul și alte metale alcaline pot forma nitruri numai în condiții severe. Metalele din subgrupa IA reacționează cu carbonul, dar cea mai ușoară reacție este cu litiul (aparent datorită razei sale mici) și cea mai puțin ușoară cu cesiu. În schimb, metalele alcaline active reacționează direct cu CO, formând carbonili (de exemplu, K(CO)x), în timp ce Li și Na sunt mai puțin activi numai în anumite condiții.
Aplicație. Metalele alcaline sunt folosite atât în industrie, cât și în laboratoarele chimice, de exemplu, pentru sinteze. Litiul este folosit pentru a produce aliaje ușoare dure, care diferă, totuși, prin fragilitate. Se consumă cantități mari de sodiu pentru a obține aliajul Na4Pb, din care se obține tetraetil plumb Pb(C2H5)4 ca benzină antidetonant. Litiul, sodiul și calciul sunt utilizate ca componente ale aliajelor moi pentru rulmenți. Singurul electron și, prin urmare, mobil de pe stratul exterior face metalele alcaline excelente conductoare de căldură și electricitate. Aliajele de potasiu și sodiu, care rămân lichide într-un interval larg de temperatură, sunt utilizate ca fluid de schimb de căldură în unele tipuri de reactoare nucleare și datorită temperaturilor ridicate din reactor nuclear folosit pentru producerea aburului. Sodiul metalic sub formă de bare de alimentare este folosit în tehnologia electrochimică pentru a transmite curenți de mare putere. Hidrura de litiu LiH este o sursă convenabilă de hidrogen eliberată ca rezultat al reacției hidrurei cu apa. Hidrura de litiu aluminiu LiAlH4 și hidrura de litiu sunt utilizate ca agenți reducători în sinteza organică și anorganică. Datorită razei ionice mici și a densității de încărcare în mod corespunzător, litiul este activ în reacțiile cu apa, prin urmare compușii de litiu sunt extrem de higroscopici, iar clorură de litiu LiCl este utilizată pentru a usca aerul în timpul funcționării dispozitivelor. Hidroxizii de metale alcaline sunt baze puternice, foarte solubile în apă; sunt folosite pentru a crea mediu alcalin. Hidroxidul de sodiu, ca cel mai ieftin alcalin, este utilizat pe scară largă (numai în SUA, se consumă peste 2,26 milioane de tone din acesta pe an).
Litiu. Cel mai ușor metal, are doi izotopi stabili cu masă atomică 6 și 7; izotopul greu este mai comun, conținutul său este de 92,6% din toți atomii de litiu. Litiul a fost descoperit de A. Arfvedson în 1817 și izolat de R. Bunsen și A. Mathisen în 1855. Este folosit în producția de arme termonucleare ( Bombă H), pentru a crește duritatea aliajelor și în produse farmaceutice. Sărurile de litiu sunt folosite pentru a crește duritatea și rezistența chimică a sticlei, în tehnologia bateriilor alcaline și pentru a lega oxigenul în timpul sudării.
Sodiu. Cunoscut încă din antichitate, a fost izolat de H. Davy în 1807. Este un metal moale, compușii săi precum alcalii (hidroxid de sodiu NaOH), bicarbonat de sodiu (bicarbonat de sodiu NaHCO3) și cenușă de sodiu (carbonat de sodiu Na2CO3) sunt folosiți pe scară largă. Metalul este, de asemenea, folosit sub formă de vapori în lămpile slabe cu descărcare în gaz pentru iluminatul stradal.
Potasiu. Cunoscut încă din antichitate, a fost identificat și de H. Davy în 1807. Sărurile de potasiu sunt binecunoscute: azotat de potasiu (nitrat de potasiu KNO3), potasiu (carbonat de potasiu K2CO3), potasiu caustic (hidroxid de potasiu KOH), etc. diverse aplicații în tehnologiile aliajelor schimbătoare de căldură.
Rubidiu a fost descoperit prin spectroscopie de R. Bunsen în 1861; conţine 27,85% rubidiu radioactiv Rb-87. Rubidiul, ca și alte metale din subgrupa IA, este foarte reactiv și trebuie depozitat sub un strat de ulei sau kerosen pentru a evita oxidarea de către oxigenul atmosferic. Rubidium găsește o varietate de aplicații, inclusiv tehnologia fotovoltaică, dispozitive de vid radio și produse farmaceutice.
cesiu. Compușii de cesiu sunt larg distribuiți în natură, de obicei în cantități mici împreună cu compușii altor metale alcaline. Silicatul de poluat mineral conține 34% oxid de cesiu Cs2O. Elementul a fost descoperit de R. Bunsen prin spectroscopie în 1860. Aplicația principală a cesiului este producerea de fotocelule și lămpi electronice, unul dintre izotopii radioactivi ai cesiului Cs-137 fiind folosit în radioterapie și cercetare științifică.
Franţa. Ultimul membru al familiei metalelor alcaline, franciul, este atât de radioactiv încât nu există în scoarța terestră în mai mult decât urme. Informațiile despre franciu și compușii săi se bazează pe studiul cantității sale nesemnificative, obținute artificial (la un accelerator de mare energie) în timpul descompunerii a a actiniului-227. Cel mai lung izotop 22387Fr se descompune în 21 de minute în 22388Ra și particule b. Conform unei estimări aproximative, raza metalică a franciului este de 2,7 . Franciul are cele mai multe proprietăți ale altor metale alcaline și este foarte donator de electroni. Formează săruri solubile și hidroxid. Franciul prezintă starea de oxidare I în toți compușii.
Enciclopedia Collier. - Societate deschisă. 2000 .