Offene und geschlossene Formen von Monosacchariden. Zyklische Formen von Monosacchariden, Heworth-Formeln
Die Hauptexistenzform von Kohlenhydraten in Lösungen ist, wie sich unerwartet herausstellte, zyklisch. Die zyklische Form von Kohlenhydraten entsteht als Ergebnis einer intramolekularen Bildungsreaktion Halbacetal wenn eine Carbonylgruppe mit einer der Hydroxylgruppen desselben Moleküls (meist der fünften) interagiert. Dadurch entsteht eine recht stabile sechsgliedrige zyklische Struktur, deren Konformationen denen von Cyclohexan sehr ähnlich sind. Da sauerstoffhaltige Sechsringe in ihrer Struktur sehr ähnlich sind Piran , sie werden Pyranoseformen oder einfach genannt Pyranosen . In kleineren Mengen in Lösungen enthalten Furanose Formen von Kohlenhydraten, die durch die Reaktion einer Carbonylgruppe mit der Hydroxylgruppe am vierten Kohlenstoffatom entstehen. Wenn kristalline D-Glucose in Wasser gelöst wird, ändert sich der Drehwinkel der Ebene des polarisierten Lichts mehr oder weniger schnell (abhängig von der Anwesenheit von Katalysatoren für die Bildung von Halbacetalen) von 112 Grad auf einen bestimmten Gleichgewichtswert (ca 53,8 Grad). Dieser Wert ist typisch für eine Mischung aller fünf in der Lösung vorhandenen D-Glucose-Formen (zwei Pyranose-, zwei Furanose- und lineare). Die lineare Form macht weniger als 1 Prozent aus. Durch die Zyklisierung entsteht zusätzliches Zentrum Asymmetrie, am Kohlenstoff Nummer 1. Die Konformation an diesem Kohlenstoffatom bestimmt nun eines von zwei neuen Isomeren, die genannt werden Anomere(a- und b-Anomere). Die gegenseitige Umwandlung von Glukoseformen ineinander durch Bildung einer linearen Konformation nennt man Mutarotation:
Die gebräuchlichste Form der Darstellung zyklischer Formen von Kohlenhydraten sind Strukturen Haworth. D-Isomere in diesem Bild haben eine CH 2 OH-Gruppe, an der sich das sechste (oder fünfte bei Ribose) Kohlenstoffatom befindet über dem Flugzeug Ringe. A-Anomere werden mit einer anomeren Hydroxylgruppe dargestellt unterhalb des Flugzeugs Ringe und B-Anomere- über dem Flugzeug Ringe.
So sehen zyklische Formen aus Fruktose Und Ribose(Furanose):
Alle vorkommenden zyklischen Formen von D-Fructose:
Die Pyranoseform von Ribose ist viel seltener:
Die Hydroxylgruppe im neuen Asymmetriezentrum ist Halbacetal, was sie deutlich unterscheidet chemische Eigenschaften aus den verbleibenden Hydroxylen im Molekül. Daher wird es anomeres (oder glykosidisches) Hydroxyl genannt. Unter milden Bedingungen der Säurekatalyse erfolgt die Bildung von Vollacetal (Glykosid)
durch Anlagerung eines Moleküls eines beliebigen Alkohols oder, allgemein gesprochen, durch Wechselwirkung mit einer Hydroxylgruppe eines Alkohols, einschließlich anderer anomerer Hydroxylgruppen. Typische Glykoside dieser Art sind Disaccharide.
Zyklische Formen von Galactose und Mannose:
Die Regeln für den Übergang von linearen Formen zu zyklischen Formen lauten, dass die Gruppierungen rechts in linearen Formen unter dem Ring in zyklischen Formen dargestellt werden und diejenigen auf der linken Seite über dem Ring.
Kohlenhydrate sind Bestandteil der Zellen und Gewebe aller pflanzlichen und tierischen Organismen. Sie haben sehr wichtig als Energiequellen in Stoffwechselprozessen.
Kohlenhydrate sind der Hauptbestandteil der Nahrung von Säugetieren. Ihr bekannter Vertreter – Glukose – kommt in Pflanzensäften, Früchten, Früchten und vor allem in Weintrauben vor (daher der Name – Traubenzucker). Es ist ein wesentlicher Bestandteil des Blutes und Gewebes von Tieren und eine direkte Energiequelle für zelluläre Reaktionen.
Kohlenhydrate entstehen in Pflanzen bei der Photosynthese aus Kohlendioxid und Wasser. Für den Menschen sind pflanzliche Lebensmittel die Hauptkohlenhydratquelle.
Kohlenhydrate werden unterteilt in Monosaccharide Und Polysaccharide. Monosaccharide hydrolysieren nicht zu einfacheren Kohlenhydraten. Hydrolysefähige Polysaccharide können als Polykondensationsprodukte von Monosacchariden betrachtet werden. Polysaccharide sind hochmolekulare Verbindungen, deren Makromoleküle Hunderte und Tausende von Monosaccharidresten enthalten. Die Zwischengruppe zwischen Mono- und Polysacchariden besteht aus Oligosaccharide(aus dem Griechischen Oligos- ein wenig) mit einem relativ kleinen Molekulargewicht.
Ein Bestandteil der oben genannten Namen - Saccharide- ist mit der heute noch gebräuchlichen gebräuchlichen Bezeichnung für Kohlenhydrate verbunden - Sahara.
11.1. Monosaccharide
11.1.1. Struktur und Stereoisomerie
Monosaccharide sind im Allgemeinen Feststoffe, die in Wasser gut löslich, in Alkohol schlecht löslich und in den meisten organischen Lösungsmitteln unlöslich sind. Fast alle Monosaccharide haben einen süßen Geschmack.
Monosaccharide können sowohl in offener (Oxo-Form) als auch in zyklischer Form vorliegen. In Lösung befinden sich diese isomeren Formen im dynamischen Gleichgewicht.
Offene Formulare.Monosaccharide (Monosen) sind heterofunktionelle Verbindungen. Ihre Moleküle enthalten gleichzeitig Carbonyl (Aldehyd oder Keton) und mehrere Hydroxylgruppen, d.h. Monosaccharide sind Polyhydroxycarbonylverbindungen – Polyhydroxyaldehyde Und Polyhydroxyketone. Sie haben eine unverzweigte Kohlenstoffkette.
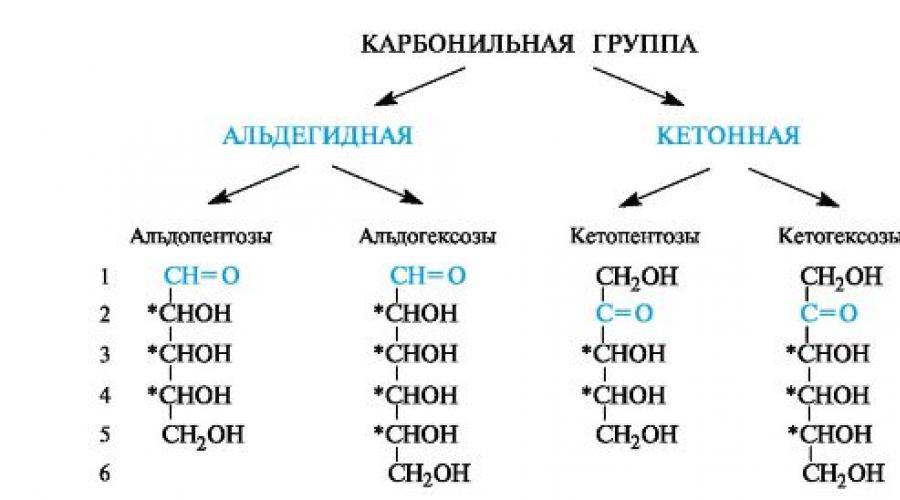
Monosaccharide werden anhand der Art der Carbonylgruppe und der Länge der Kohlenstoffkette klassifiziert. Als Monosaccharide werden Monosaccharide bezeichnet, die eine Aldehydgruppe enthalten Aldosen, und die Ketongruppe (normalerweise in Position 2) - Ketosen(Suffix -ose wird für die Namen von Monosacchariden verwendet: Glucose, Galactose, Fructose usw.). Allgemein lässt sich die Struktur von Aldosen und Ketosen darstellen auf die folgende Weise.
Abhängig von der Länge der Kohlenstoffkette (3-10 Atome) werden Monosaccharide in Triosen, Tetrosen, Pentosen, Hexosen, Heptosen usw. unterteilt. Am häufigsten sind Pentosen und Hexosen.
Stereoisomerie.Monosaccharidmoleküle enthalten mehrere Chiralitätszentren, weshalb es viele Stereoisomere gibt, die derselben Strukturformel entsprechen. Aldohexose hat beispielsweise vier asymmetrische Kohlenstoffatome und entspricht 16 Stereoisomeren (2 4), also 8 Enantiomerenpaaren. Im Vergleich zu den entsprechenden Aldosen enthalten Ketohexosen ein chirales Kohlenstoffatom weniger, sodass die Anzahl der Stereoisomere (2 3) auf 8 (4 Enantiomerenpaare) reduziert ist.
Offene (nichtzyklische) Formen von Monosacchariden werden in Form von Fischer-Projektionsformeln dargestellt (siehe 7.1.2). Die Kohlenstoffkette in ihnen ist vertikal geschrieben. Bei Aldosen befindet sich an der Spitze eine Aldehydgruppe, bei Ketosen befindet sich eine primäre Alkoholgruppe neben der Carbonylgruppe. Mit diesen Gruppen beginnt die Kettennummerierung.

Das D,L-System wird zur Angabe der Stereochemie verwendet. Die Zuordnung eines Monosaccharids zur D- oder L-Reihe erfolgt entsprechend der Konfiguration des Chiralitätszentrums, das am weitesten von der Oxogruppe entfernt ist. unabhängig von der Konfiguration anderer Zentren! Bei Pentosen ist ein solches „bestimmendes“ Zentrum das C-4-Atom, bei Hexosen ist es C-5. Die Position der OH-Gruppe am letzten Chiralitätszentrum rechts zeigt an, dass das Monosaccharid zur D-Reihe gehört, links zur L-Reihe, also in Analogie zum stereochemischen Standard – Glycerinaldehyd (siehe 7.1.2). ).
Es ist bekannt, dass das R,S-System universell zur Bezeichnung der stereochemischen Struktur von Verbindungen mit mehreren Chiralitätszentren geeignet ist (siehe 7.1.2). Allerdings schränkt die umständliche Natur der resultierenden Namen für Monosaccharide ihre praktische Anwendung ein.
Die meisten natürlichen Monosaccharide gehören zur D-Reihe. Unter Aldopentosen kommen häufig D-Ribose und D-Xylose vor, unter Ketopentosen häufig D-Ribulose und D-Xylulose.
Die gebräuchlichen Namen für Ketose werden durch die Einführung des Suffixes gebildet -Straße in den Namen der entsprechenden Aldosen: Ribose entspricht Ribulose, Xylose - Xylulose(Aus dieser Regel entfällt der Name „Fruktose“, der keinen Zusammenhang mit dem Namen der entsprechenden Aldose hat.)

Wie aus den obigen Formeln hervorgeht, handelt es sich bei stereoisomeren d-Aldohexosen sowie bei d-Aldopentosen und d-Ketopentosen um Diastereomere. Darunter gibt es solche, die sich in der Konfiguration nur eines Chiralitätszentrums unterscheiden. Als Diastereomere werden Diastereomere bezeichnet, die sich in der Konfiguration nur eines asymmetrischen Kohlenstoffatoms unterscheiden Epimere. Epimere sind ein Sonderfall der Diastereomere. Beispielsweise sind D-Glucose und D-Galactose unterschiedlich
unterscheiden sich nur durch die Konfiguration des C-4-Atoms, d. h. sie sind Epimere an C-4. Ebenso sind D-Glucose und D-Mannose Epimere an C-2 und D-Ribose und D-Xylose Epimere an C-3.
Jede Aldose der d-Serie entspricht einem Enantiomer der l-Serie mit der entgegengesetzten Konfiguration aller Chiralitätszentren.

Zyklische Formen. Die offenen Formen von Monosacchariden eignen sich gut zur Betrachtung der räumlichen Beziehungen zwischen stereoisomeren Monosacchariden. Tatsächlich sind Monosaccharide strukturell zyklische Halbacetale. Die Bildung zyklischer Formen von Monosacchariden kann als Ergebnis der intramolekularen Wechselwirkung von Carbonyl- und Hydroxylgruppen (siehe 9.2.2) dargestellt werden, die im Monosaccharidmolekül enthalten sind.

Die Hydroxylgruppe wird in der Kohlenhydratchemie als Halbacetal bezeichnetglykosidisch.Seine Eigenschaften unterscheiden sich deutlich von anderen (Alkohol-)Hydroxylgruppen.
Durch die Cyclisierung entstehen thermodynamisch stabilere Furanose- (fünfgliedrige) und Pyranose- (sechsgliedrige) Zyklen. Die Namen der Zyklen stammen von den Namen verwandter heterozyklischer Verbindungen – Furan und Pyran.

Die Bildung dieser Zyklen hängt mit der Fähigkeit der Kohlenstoffketten von Monosacchariden zusammen, eine recht günstige klauenförmige Konformation anzunehmen (siehe 7.2.1). Infolgedessen scheinen die Aldehyd- (oder Keton-) und Hydroxylgruppen an C-4 (oder an C-5), d. h. jene funktionellen Gruppen, in deren Wechselwirkung eine intramolekulare Cyclisierung stattfindet, räumlich nahe beieinander zu liegen. Reagiert die Hydroxylgruppe am C-5 von Aldohexosen, entsteht ein Halbacetal mit einem sechsgliedrigen Pyranosering. Ein ähnlicher Zyklus entsteht bei Ketohexosen unter Beteiligung der Hydroxylgruppe an C-6 an der Reaktion.

In den Namen zyklischer Formen wird neben dem Namen des Monosaccharids auch die Größe des Zyklus in Worten angegeben Pyranose oder Furanose. Beteiligt sich die Hydroxylgruppe an C-4 an der Cyclisierung bei Aldohexosen und an C-5 bei Ketohexosen, so erhält man Halbacetale mit einem fünfgliedrigen Furanosering.

In der zyklischen Form entsteht ein zusätzliches Chiralitätszentrum – ein Kohlenstoffatom, das zuvor Teil der Carbonylgruppe war (bei Aldosen ist dies C-1). Dieses Atom heißt anomer, und die beiden entsprechenden Stereoisomere sind α- und β-Anomere(Abb. 11.1). Anomere sind ein Sonderfall der Epimere.
Unterschiedliche Konfigurationen des anomeren Kohlenstoffatoms entstehen dadurch, dass die Aldehydgruppe aufgrund einer Rotation um die C-1-C-2-σ-Bindung vom nukleophilen Sauerstoffatom von nahezu unterschiedlichen Seiten angegriffen wird (siehe Abb. 11.1). . Dadurch entstehen Halbacetale mit entgegengesetzter Konfiguration des anomeren Zentrums.
Bei einem α-Anomer ist die Konfiguration des anomeren Zentrums dieselbe wie die Konfiguration des „terminalen“ Chiralitätszentrums, die seine Zugehörigkeit bestimmt d- oder l -Reihe, und für das β-Anomer ist es umgekehrt. In Fischer-Projektionsformeln für Monosaccharide D -Reihe im α-Anomer befindet sich die glykosidische Gruppe OH rechts, und im β-Anomer - links aus der Kohlenstoffkette.

Reis. 11.1.Bildung von α- und β-Anomeren am Beispiel D-Glukose
Haworths Formeln. Zyklische Formen von Monosacchariden werden in Form von Haworths perspektivischen Formeln dargestellt, in denen die Zyklen als flache Polygone dargestellt werden, die senkrecht zur Zeichenebene liegen. Das Sauerstoffatom befindet sich im Pyranose-Ring ganz rechts in der Ecke, im Furanose-Ring hinter der Ringebene. Die Symbole für Kohlenstoffatome in den Ringen geben keinen Hinweis darauf.

Um zu den Haworth-Formeln zu gelangen, wird die zyklische Fischer-Formel so transformiert, dass sich das Sauerstoffatom des Zyklus auf derselben geraden Linie wie die im Zyklus enthaltenen Kohlenstoffatome befindet. Dies wird im Folgenden für a-d-Glucopyranose durch zwei Umlagerungen am C-5-Atom veranschaulicht, die die Konfiguration dieses Asymmetriezentrums nicht verändern (siehe 7.1.2). Wenn die transformierte Fischer-Formel horizontal platziert wird, wie es die Regeln zum Schreiben von Haworth-Formeln erfordern, liegen die Substituenten rechts von der vertikalen Linie der Kohlenstoffkette unter der Ebene des Zyklus und diejenigen links davon über dieser Ebene.
d-Aldohexosen in der Pyranoseform (und d-Aldopentosen in der Furanoseform) haben die Gruppe CH 2 OH liegt immer oberhalb der Kreisebene, was als formales Zeichen der d-Reihe dient. Die glykosidische Hydroxylgruppe erscheint in a-Anomeren von d-Aldosen unterhalb der Ringebene und in β-Anomeren oberhalb der Ebene.

Aus Gründen der Vereinfachung werden in Haworths Formeln häufig die Symbole der Wasserstoffatome und ihrer Bindungen mit den Kohlenstoffatomen des Zyklus nicht dargestellt. Wenn es sich um eine Mischung von Anomeren oder ein Stereoisomer mit unbekannter Konfiguration des anomeren Zentrums handelt, wird die Position der glykosidischen Gruppe OH bezeichnet Schlangenlinie.
D-GLUCOPYRANOSE

Der Übergang erfolgt in Ketosen nach ähnlichen Regeln, wie unten am Beispiel eines der Anomere der Furanoseform von d-Fructose dargestellt.

11.1.2. Cyclo-Oxo-Tautomerie
Im festen Zustand liegen Monosaccharide in zyklischer Form vor. Abhängig vom Lösungsmittel, aus dem d-Glucose umkristallisiert wurde, wird sie entweder als a-d-Glucopyranose (aus Alkohol oder Wasser) oder als β-d-Glucopyranose (aus Pyridin) gewonnen. Sie unterscheiden sich im spezifischen Drehwinkel [a] D20, nämlich +112? bei a-anomer und +19? am β-Anomer. Für eine frisch zubereitete Lösung
Für jedes Anomer wird im Stehen eine Änderung der spezifischen Rotation beobachtet, bis ein konstanter Rotationswinkel von +52,5° erreicht wird, der für beide Lösungen gleich ist.
Die zeitliche Änderung des Drehwinkels der Polarisationsebene von Licht durch Kohlenhydratlösungen wird aufgerufenMutarotation.
Das chemische Wesen der Mutarotation ist die Fähigkeit von Monosacchariden, in Form einer Gleichgewichtsmischung von Tautomeren – offenen und zyklischen Formen – zu existieren. Diese Art der Tautomerie nennt man Cyclo-Oxo-Tautomerie.
In Lösungen wird das Gleichgewicht zwischen den vier zyklischen Tautomeren von Monosacchariden durch die offene Form – die Oxo-Form – hergestellt. Als Oxoform wird die gegenseitige Umwandlung von a- und β-Anomeren ineinander bezeichnet Anomerisierung.
Somit liegt d-Glucose in Lösung in Form von Tautomeren vor: Oxoformen und a- und β-Anomeren der zyklischen Pyranose- und Furanoseformen.

Die Tautomerenmischung wird von Pyranoseformen dominiert. Die Oxoform sowie Tautomere mit Furanoseringen kommen in geringen Mengen vor. Wichtig ist jedoch nicht der absolute Gehalt des einen oder anderen Tautomers, sondern die Möglichkeit ihres Übergangs ineinander, was dazu führt, dass sich die Menge der „notwendigen“ Form beim Verzehr wieder auffüllt –
tion in jedem Prozess. Beispielsweise geht Glucose trotz des unbedeutenden Gehalts an Oxoform Reaktionen ein, die für die Aldehydgruppe charakteristisch sind.
Ähnliche tautomere Umwandlungen treten in Lösungen mit allen Monosacchariden und den meisten bekannten Oligosacchariden auf. Nachfolgend finden Sie ein Diagramm der tautomeren Umwandlungen des wichtigsten Vertreters der Ketohexosen – d-Fructose, die in Früchten, Honig und auch in Saccharose enthalten ist (siehe 11.2.2).

11.1.3. Konformationen
Haworths visuelle Formeln spiegeln jedoch nicht die tatsächliche Geometrie von Monosaccharidmolekülen wider, da fünf- und sechsgliedrige Ringe nicht planar sind. Somit nimmt der sechsgliedrige Pyranosering wie Cyclohexan die günstigste Sesselkonformation ein (siehe 7.2.2). In gewöhnlichen Monosacchariden ist die sperrige primäre Alkoholgruppe CH 2 OH- und die meisten Hydroxylgruppen befinden sich in günstigeren äquatorialen Positionen.
Von den beiden Anomeren der d-Glucopyranose überwiegt in Lösung das β-Anomer, in dem alle Substituenten, einschließlich der Halbacetal-Hydroxylgruppe, äquatorial angeordnet sind.

Die hohe thermodynamische Stabilität von D-Glucopyranose aufgrund ihrer Konformationsstruktur erklärt die größte Verteilung von D-Glucose in der Natur unter Monosacchariden.
Die Konformationsstruktur von Monosacchariden bestimmt die räumliche Anordnung von Polysaccharidketten und bildet deren Sekundärstruktur.
11.1.4. Nichtklassische Monosaccharide
Nichtklassische Monosaccharide sind eine Reihe von Verbindungen, die eine gemeinsame strukturelle „Architektur“ mit gewöhnlichen, „klassischen“ Monosacchariden (Aldosen und Ketosen) haben, sich jedoch entweder in der Modifikation einer oder mehrerer funktioneller Gruppen oder im Fehlen einiger davon unterscheiden ihnen. Solchen Verbindungen fehlt oft die OH-Gruppe. Sie werden benannt, indem dem Namen des ursprünglichen Monosaccharids das Präfix hinzugefügt wird Desoxy- (bedeutet das Fehlen einer OH-Gruppe) und der Name des „neuen“ Substituenten.
Desoxyzucker.Der häufigste Desoxyzucker, 2-Desoxy-D-Ribose, ist ein Strukturbestandteil der DNA. Natürliche Herzglykoside (siehe 15.3.5), die in der Kardiologie eingesetzt werden, enthalten Reste von Didesoxyzuckern, beispielsweise Digitoxosen (Digitalis-Herzglykoside).
Aminozucker.Diese Derivate enthalten eine Aminogruppe anstelle einer Hydroxylgruppe (normalerweise an C-2), haben basische Eigenschaften und bilden mit Säuren kristalline Salze. Die wichtigsten Vertreter der Aminozucker sind Analoga von D-Glucose und D-Galactose, für die häufig semitriviale Zucker verwendet werden.

Die neuen Namen lauten D-Glucosamin bzw. D-Galactosamin. Die Aminogruppe in ihnen kann mit Essig- und manchmal Schwefelsäureresten acyliert werden.
Alditen.Alditen, auch genannt Zuckeralkohole, umfassen mehrwertige Alkohole, die eine Hydroxylgruppe anstelle einer Oxogruppe =O enthalten. Jede Aldose entspricht einem Alditol, dessen Name das Suffix verwendet -Es anstatt -Ozya, zum Beispiel D-Mannitol (aus D-Mannose). Alditole haben eine symmetrischere Struktur als Aldosen, daher gibt es unter ihnen Mesoverbindungen (innerlich symmetrisch) wie Xylit.

Saure Zucker.Monosaccharide, in denen anstelle einer CH-Einheit 2 OH enthält die COOH-Gruppe, haben gemeinsamen Namen Uronsäuren. Ihre Namen verwenden die Kombination -Uronsäure anstelle eines Suffixes -Ozya die entsprechende Aldose. Beachten Sie, dass die Kettennummerierung vom Aldehyd-Kohlenstoffatom und nicht vom Carboxyl-Kohlenstoffatom ausgeht, um die strukturelle Verwandtschaft mit dem ursprünglichen Monosaccharid zu bewahren.
Uronsäuren sind Bestandteile pflanzlicher und bakterieller Polysaccharide (siehe 13.3.2).
Saurer Zucker

Monosaccharide, die eine Carboxylgruppe anstelle einer Aldehydgruppe enthalten, werden klassifiziert als Aldonsäuren. Wenn an beiden Enden der Kohlenstoffkette Carboxylgruppen vorhanden sind, tragen solche Verbindungen den Trivialnamen Aldarsäuren. In der Nomenklatur dieser Säurearten werden jeweils Kombinationen verwendet -Onsäure Und - Aronsäure.
Aldonsäure und Aldarinsäure können keine tautomeren cyclischen Formen bilden, da ihnen eine Aldehydgruppe fehlt. Aldarinsäuren können wie Alditole in Form von Mesoverbindungen vorliegen (ein Beispiel ist Galaktarsäure).

Ascorbinsäure (Vitamin C). Dieses vielleicht älteste und beliebteste Vitamin hat eine ähnliche Struktur wie Monosaccharide und ist eine γ-Lactonsäure (I). Askorbinsäure
kommt in Früchten, insbesondere Zitrusfrüchten, Beeren (Hagebutten, schwarze Johannisbeeren), Gemüse, Milch vor. Industriell im großen Maßstab aus D-Glucose hergestellt.

Ascorbinsäure weist eine recht starke Wirkung auf saure Eigenschaften (pK a 4.2) aufgrund einer der Hydroxylgruppen des Endiolfragments. Bei der Bildung von Salzen öffnet sich der γ-Lacton-Ring nicht.
Ascorbinsäure hat stark reduzierende Eigenschaften. Entsteht während seiner Oxidation Dehydroascorbinsäure lässt sich leicht zu Ascorbinsäure reduzieren. Dieser Prozess führt zu einer Reihe von Redoxreaktionen im Körper.

11.1.5. Chemische Eigenschaften
Monosaccharide sind Substanzen mit hoher Reaktivität. Ihre Moleküle enthalten die folgenden wichtigsten Reaktionszentren:
Halbacetalhydroxyl (hervorgehoben);
Alkoholhydroxylgruppen (alle anderen außer Hemiacetal);
Carbonylgruppe in acyclischer Form.

Glykoside.Zu den Glykosiden gehören Derivate zyklischer Formen von Kohlenhydraten, bei denen die Halbacetal-Hydroxylgruppe durch eine OR-Gruppe ersetzt ist. Der Nicht-Kohlenhydrat-Anteil des Glykosids heißt Aglykon. Die Verbindung zwischen dem anomeren Zentrum (bei Aldosen ist es C-1, bei Ketosen ist es C-2) und der OR-Gruppe wird als glykosidisch bezeichnet. Glykoside sind Acetale zyklischer Formen von Aldosen oder Ketosen.

Abhängig von der Größe des Oxidzyklus werden Glykoside unterteilt Pyranoside Und Furanoside. Glucose-Glykoside werden Glukoside, Ribose-Riboside usw. genannt. Der vollständige Name von Glykosiden enthält den Namen des Rests R, die Konfiguration des anomeren Zentrums (α- oder β-) und den Namen des Kohlenhydratrests mit dem Ersatz von Das Suffix wird nacheinander angezeigt -ose An -Ozid (Siehe Beispiele im Reaktionsschema unten).
Glykoside entstehen durch die Wechselwirkung von Monosacchariden mit Alkoholen unter Säurekatalyse; in diesem Fall geht nur die OH-Gruppe des Halbacetals in die Reaktion ein.

Lösungen von Glykosiden mutarotieren nicht.
Die Umwandlung eines Monosaccharids in ein Glykosid ist ein komplexer Prozess, der durch eine Reihe aufeinanderfolgender Reaktionen abläuft. Im Allgemeinen ist es analog
ist für die Herstellung acyclischer Acetale logisch (siehe 5.3). Aufgrund der Reversibilität der Reaktion können jedoch tautomere Formen des ursprünglichen Monosaccharids und vier isomere Glykoside (α- und β-Anomere von Furanosiden und Pyranosiden) in Lösung im Gleichgewicht vorliegen.
Wie alle Acetale werden Glykoside durch verdünnte Säuren hydrolysiert, sind jedoch in leicht alkalischer Umgebung hydrolysebeständig. Die Hydrolyse von Glykosiden führt zu den entsprechenden Alkoholen und Monosacchariden und ist die Gegenreaktion zu deren Bildung. Die enzymatische Hydrolyse von Glykosiden liegt dem Abbau von Polysacchariden in tierischen Organismen zugrunde.
Ester.Monosaccharide lassen sich leicht durch Anhydride organischer Säuren acylieren und bilden unter Beteiligung aller Hydroxylgruppen Ester. Beispielsweise werden bei der Reaktion mit Essigsäureanhydrid Acetylderivate von Monosacchariden erhalten. Ester von Monosacchariden werden sowohl im sauren als auch im sauren Bereich hydrolysiert alkalische Umgebungen.

Von großer Bedeutung sind Ester anorganischer Säuren, insbesondere Ester der Phosphorsäure – Phosphate. Sie kommen in allen pflanzlichen und tierischen Organismen vor und sind stoffwechselaktive Formen von Monosacchariden. Am meisten wichtige Rolle gespielt von D-Glucose- und D-Fructose-Phosphaten.

Ester der Schwefelsäure – Sulfate – sind Bestandteil von Polysacchariden Bindegewebe(siehe 11.3.2).
Erholung.Wenn Monosaccharide (ihre Aldehyd- oder Ketongruppe) reduziert werden, entstehen Alditole.

Sechswertige Alkohole -D-Glucit(Sorbit) und D-Mannit- werden durch Reduktion von Glucose bzw. Mannose gewonnen. Alditole sind leicht wasserlöslich, haben einen süßen Geschmack und einige von ihnen (Xylitol und Sorbitol) werden als Zuckerersatz für Patienten mit Diabetes verwendet.
Bei der Reduktion von Aldosen wird nur ein Polyol erhalten, bei der Reduktion von Ketosen wird eine Mischung aus zwei Polyolen erhalten; zum Beispiel von D -Fruktose entsteht D-Glucit und D-Mannit.

Oxidation.Oxidationsreaktionen werden zum Nachweis von Monosacchariden, insbesondere Glucose, in biologischen Flüssigkeiten (Urin, Blut) eingesetzt.
Jedes Kohlenstoffatom in einem Monosaccharidmolekül kann oxidiert werden, aber die Aldehydgruppe von Aldosen in offener Form wird am leichtesten oxidiert.
Milde Oxidationsmittel (Bromwasser) können die Aldehydgruppe zu einer Carboxylgruppe oxidieren, ohne andere Gruppen zu beeinträchtigen. Bei
Dabei entstehen Aldonsäuren. Also während der Oxidation D -Glucose wird aus Bromwasser gewonnen D -Gluconsäure. Sein Calciumsalz, Calciumgluconat, wird in der Medizin verwendet.

Die Wirkung stärkerer Oxidationsmittel wie z Salpetersäure, Kaliumpermanganat und sogar Cu 2 + - oder Ag + -Ionen führen zu einer tiefgreifenden Zersetzung von Monosacchariden mit dem Aufbrechen von Kohlenstoff-Kohlenstoff-Bindungen. Die Kohlenstoffkette bleibt nur in bestimmten Fällen erhalten, beispielsweise bei der Oxidation D-Glucose in d -Glucarsäure oder D -Galaktose in Galaktarsäure (Schleimsäure).

Die entstehende Galaktarsäure ist in Wasser schwer löslich und fällt aus, was mit dieser Methode zum Nachweis von Galaktose verwendet wird.
Aldosen werden leicht durch Kupfer(11)- und Silberkomplexverbindungen – Fehling- bzw. Tollens-Reagenzien – oxidiert (siehe auch 5.5). Solche Reaktionen sind aufgrund der Anwesenheit der Aldehydform (offen) in der Tautomerenmischung möglich.

Aufgrund der Fähigkeit, Cu 2 + - oder Ag + -Ionen zu reduzieren, werden Monosaccharide und ihre Derivate, die eine potenzielle Aldehydgruppe enthalten, genannterholsam.
Glykoside zeigen keine reduzierende Wirkung und führen mit diesen Reagenzien nicht zu einem positiven Ergebnis. Ketosen sind jedoch in der Lage, Metallkationen zu reduzieren, da sie im alkalischen Milieu zu Aldosen isomerisieren.
Direkte Oxidation der CH-Einheit 2 OH von Monosacchariden in eine Carboxylgruppe ist aufgrund des Vorhandenseins einer Aldehydgruppe, die anfälliger für Oxidation ist, unmöglich; daher wird zur Umwandlung eines Monosaccharids in Uronsäure ein Monosaccharid mit einer geschützten Aldehydgruppe beispielsweise einer Oxidation unterzogen die Form eines Glykosids.

Bildung von Glucuronsäureglykosiden - Glucuronide- ist ein Beispiel für einen Biosyntheseprozess Konjugation, d.h. der Bindungsprozess Medikamente oder deren Metaboliten mit Nährstoffen sowie mit toxischen Substanzen, gefolgt von der Ausscheidung aus dem Körper über den Urin.

11.2. Oligosaccharide
Oligosaccharide sind Kohlenhydrate, die aus mehreren Monosaccharidresten (2 bis 10) bestehen, die durch eine glykosidische Bindung verbunden sind.
Die einfachsten Oligosaccharide sind Disaccharide (Biosen), die aus Resten zweier Monosaccharide bestehen und Glykoside (Vollacetale) sind, bei denen einer der Reste als Aglykon fungiert. Die Acetalnatur ist mit der Fähigkeit von Disacchariden verbunden, in einer sauren Umgebung zu Monosacchariden zu hydrolysieren.
Es gibt zwei Arten der Bindung von Monosaccharidresten:
Aufgrund der Halbacetalgruppe OH eines Monosaccharids und einer beliebigen Alkoholgruppe eines anderen (im Beispiel unten - Hydroxyl an C-4); Dies ist eine Gruppe reduzierender Disaccharide.
Unter Beteiligung halbacetaler OH-Gruppen beider Monosaccharide; Dies ist eine Gruppe nicht reduzierender Disaccharide.

11.2.1. Reduzierung von Disacchariden
In diesen Disacchariden ist einer der Monosaccharidreste aufgrund der Hydroxylgruppe (am häufigsten an C-4) an der Bildung einer glykosidischen Bindung beteiligt. Das Disaccharid enthält eine freie Halbacetal-Hydroxylgruppe, wodurch die Fähigkeit zur Ringöffnung erhalten bleibt.
Die reduzierenden Eigenschaften solcher Disaccharide und die Mutarotation ihrer Lösungen sind auf die Cyclo-Oxo-Tautomerie zurückzuführen.
Vertreter der reduzierenden Disaccharide sind Maltose, Cellobiose und Lactose.
Maltose.Dieses Disaccharid wird auch Malzzucker (von lat.) genannt. Maltum- Malz). Es ist das Hauptprodukt des Stärkeabbaus unter der Wirkung des Enzyms β-Amylase, das von der Speicheldrüse abgesondert wird und auch in Malz enthalten ist (gekeimte, dann getrocknete und zerkleinerte Getreidekörner). Maltose hat einen weniger süßen Geschmack als Saccharose.

Maltose ist ein Disaccharid, bei dem die Reste zweier D-Glucopyranose-Moleküle durch eine a(1^4)-glykosidische Bindung verbunden sind.
Das an der Bildung dieser Bindung beteiligte anomere Kohlenstoffatom hat eine a-Konfiguration, und ein anomeres Atom mit einer Halbacetal-Hydroxylgruppe kann sowohl eine α- als auch eine β-Konfiguration (a- bzw. β-Maltose) haben.
Im systematischen Namen eines Disaccharids erhält das „erste“ Molekül das Suffix -zil, und das „zweite“ behält das Suffix -osa. Darüber hinaus gibt der vollständige Name die Konfigurationen beider anomerer Kohlenstoffatome an.
Cellobiose.Dieses Disaccharid entsteht durch unvollständige Hydrolyse von Cellulosepolysaccharid.
Cellobiose ist ein Disaccharid, bei dem die Reste zweier D-Glucopyranose-Moleküle durch eine β(1-4)-glykosidische Bindung verbunden sind.
Der Unterschied zwischen Cellobiose und Maltose besteht darin, dass das anomere Kohlenstoffatom, das an der Bildung der glykosidischen Bindung beteiligt ist, eine β-Konfiguration aufweist.

Maltose wird durch das Enzym α-Glucosidase abgebaut, das gegen Cellobiose nicht aktiv ist. Cellobiose kann durch das Enzym β-Glucosidase abgebaut werden, dieses Enzym fehlt jedoch im menschlichen Körper, sodass Cellobiose und das entsprechende Polysaccharid Cellulose im menschlichen Körper nicht verarbeitet werden können. Wiederkäuer können sich von der Zellulose (Ballaststoffe) der Gräser ernähren, da diese enthalten Magen-Darmtrakt Bakterien besitzen β-Glucosidase.
Der Konfigurationsunterschied zwischen Maltose und Cellobiose bringt auch einen Konformationsunterschied mit sich: Die α-glykosidische Bindung in Maltose ist axial angeordnet, und die β-glykosidische Bindung in Cellobiose ist äquatorial. Der Konformationszustand von Disacchariden ist die Hauptursache für die lineare Struktur von Cellulose, zu der Cellobiose gehört, und für die knäuelartige Struktur von Amylose (Stärke), die aus Maltoseeinheiten aufgebaut ist.

Laktosekommt in der Milch vor (4-5 %) und wird nach Abtrennung des Quarks aus Molke gewonnen (daher der Name „Milchzucker“).
Laktose ist ein Disaccharid, in dem D-Galactopyranose- und D-Glucopyranose-Reste durch eine P(1-4)-glykosidische Bindung verbunden sind.
Das an der Bildung dieser Bindung beteiligte anomere Kohlenstoffatom der D-Galactopyranose weist eine β-Konfiguration auf. Das anomere Atom der Glucopyranose-Einheit kann sowohl eine α- als auch eine β-Konfiguration (α- bzw. β-Laktose) aufweisen.
11.2.2. Nicht reduzierende Disaccharide
Das wichtigste der nichtreduzierenden Disaccharide ist Saccharose. Seine Quellen sind Zuckerrohr, Zuckerrüben (bis zu 28 % der Trockenmasse), Pflanzen- und Fruchtsäfte.
Saccharose ist ein Disaccharid, bei dem die α-D-Glucopyranose- und β-D-Fructofuranose-Reste aufgrund der Halbacetal-Hydroxylgruppen jedes Monosaccharids durch glykosidische Bindungen verbunden sind.


Da dem Saccharosemolekül hemiacetale Hydroxylgruppen fehlen, ist es nicht zur Cyclooxo-Tautomerie fähig. Saccharoselösungen mutieren nicht.
11.2.3. Chemische Eigenschaften
Im chemischen Sinne sind Oligosaccharide Glykoside, und reduzierende Oligosaccharide haben auch die Eigenschaften von Monosacchariden, da sie eine potentielle Aldehydgruppe (in offener Form) und eine Halbacetalhydroxylgruppe enthalten. Dies bestimmt ihr chemisches Verhalten. Sie durchlaufen viele für Monosaccharide charakteristische Reaktionen: Sie bilden Ester und können unter dem Einfluss derselben Reagenzien oxidiert und reduziert werden.
Die charakteristischste Reaktion von Disacchariden ist die saure Hydrolyse, die zur Spaltung der glykosidischen Bindung unter Bildung von Monosacchariden (in allen tautomeren Formen) führt. Im Allgemeinen ähnelt diese Reaktion der Hydrolyse von Alkylglykosiden (siehe 11.1.5).

11.3. Polysaccharide
Polysaccharide machen den Großteil der organischen Substanz in der Biosphäre der Erde aus. Sie erfüllen drei wichtige biologische Funktionen Sie fungieren als Strukturbestandteile von Zellen und Geweben, als Energiereserven und als Schutzstoffe.
Polysaccharide (Glykane) sind Kohlenhydrate mit hohem Molekulargewicht. Aufgrund ihrer chemischen Natur handelt es sich um Polyglykoside (Polyacetale).
Vom Strukturprinzip her unterscheiden sich Polysaccharide nicht von reduzierenden Oligosacchariden (siehe 11.2). Jede Monosaccharideinheit ist durch glykosidische Bindungen mit der vorherigen und den nachfolgenden Einheiten verbunden. In diesem Fall ist eine Halbacetal-Hydroxylgruppe zur Verbindung mit der nachfolgenden Einheit und eine Alkoholgruppe mit der vorherigen Einheit vorgesehen. Der Unterschied liegt lediglich in der Anzahl der Monosaccharidreste: Polysaccharide können Hunderte oder sogar Tausende davon enthalten.
In Polysacchariden pflanzlichen Ursprungs Am häufigsten sind (1-4)-glycosidische Bindungen, und in Polysacchariden tierischen und bakteriellen Ursprungs gibt es Bindungen anderer Art. An einem Ende der Polymerkette befindet sich ein reduzierender Monosaccharidrest. Da sein Anteil am gesamten Makromolekül sehr gering ist, weisen Polysaccharide praktisch keine reduzierenden Eigenschaften auf.
Die glykosidische Natur von Polysacchariden bestimmt ihre Hydrolyse in sauren und ihre Stabilität in alkalischen Medien. Eine vollständige Hydrolyse führt zur Bildung von Monosacchariden oder deren Derivaten, während eine unvollständige Hydrolyse zu einer Reihe intermediärer Oligosaccharide, einschließlich Disacchariden, führt.
Polysaccharide haben ein großes Molekulargewicht. Sie zeichnen sich durch ein mehr aus hohes Niveau strukturelle Organisation von Makromolekülen. Neben der Primärstruktur, also einer bestimmten Abfolge von Monomerresten, spielt die Sekundärstruktur, die durch die räumliche Anordnung der makromolekularen Kette bestimmt wird, eine wichtige Rolle.
Polysaccharidketten können verzweigt oder unverzweigt (linear) sein.
Polysaccharide werden in Gruppen eingeteilt:
Homopolysaccharide, bestehend aus Resten eines Monosaccharids;
Heteropolysaccharide, bestehend aus Resten verschiedener Monosaccharide.
Homopolysaccharide umfassen viele Polysaccharide pflanzlichen (Stärke, Cellulose, Pektin), tierischen (Glykogen, Chitin) und bakteriellen (Dextrane) Ursprungs.
Heteropolysaccharide, zu denen viele tierische und bakterielle Polysaccharide gehören, wurden weniger untersucht, spielen aber eine wichtige biologische Rolle. Heteropolysaccharide sind im Körper mit Proteinen verbunden und bilden komplexe supramolekulare Komplexe.
11.3.1. Homopolysaccharide
Stärke.Dieses Polysaccharid besteht aus zwei Arten von Polymeren, die aus D-Glucopyranose aufgebaut sind: Amylose(10-20%) und Amylopektin(80-90 %). Stärke entsteht in Pflanzen bei der Photosynthese und wird in Knollen, Wurzeln und Samen „gespeichert“.
Stärke ist eine weiße, amorphe Substanz. IN kaltes Wasser unlöslich, quillt bei Hitze auf und löst sich teilweise allmählich auf. Wenn Stärke aufgrund der darin enthaltenen Feuchtigkeit (10–20 %) schnell erhitzt wird, kommt es zu einer hydrolytischen Spaltung der makromolekularen Kette in kleinere Fragmente und es entsteht eine sogenannte Polysaccharidmischung Dextrine. Dextrine sind in Wasser löslicher als Stärke.
Dieser Prozess des Stärkeabbaus bzw Dextrinisierung, beim Backen durchgeführt. In Dextrine umgewandelte Mehlstärke ist aufgrund ihrer besseren Löslichkeit leichter verdaulich.
Amylose ist ein Polysaccharid, bei dem D-Glucopyranose-Reste durch a(1-4)-glykosidische Bindungen verbunden sind, d. h. das Disaccharidfragment der Amylose ist Maltose.

Die Amylosekette ist unverzweigt, umfasst bis zu tausend Glucosereste und hat ein Molekulargewicht von bis zu 160.000.
Laut Röntgenbeugungsanalyse ist das Amylose-Makromolekül gewunden (Abb. 11.2). Für jede Windung der Helix gibt es sechs Monosaccharideinheiten. Moleküle entsprechender Größe, zum Beispiel Jodmoleküle, können in den inneren Kanal der Helix eindringen und sogenannte Komplexe bilden Schaltverbindungen. Der Komplex von Amylose mit Jod hat blaue Farbe. Dies wird zu analytischen Zwecken verwendet, um sowohl Stärke als auch Jod festzustellen (Stärke-Jod-Test).

Reis. 11.2.Helikale Struktur von Amylose (Blick entlang der Helixachse)
Amylopektin hat im Gegensatz zu Amylose eine verzweigte Struktur (Abb. 11.3). Sein Molekulargewicht erreicht 1-6 Millionen.

Reis. 11.3.Verzweigtes Makromolekül von Amylopektin (farbige Kreise sind Verzweigungsstellen der Seitenketten)
Amylopektin ist ein verzweigtes Polysaccharid, in dessen Ketten D-Glucopyranose-Reste durch a(1^4)-glycosidische Bindungen und an Verzweigungspunkten durch a(1^6)-Bindungen verknüpft sind. Zwischen den Verzweigungspunkten liegen 20–25 Glucosereste.

Die Hydrolyse von Stärke im Magen-Darm-Trakt erfolgt unter der Wirkung von Enzymen, die a(1-4)- und a(1-6)-glykosidische Bindungen abbauen. Die Endprodukte der Hydrolyse sind Glucose und Maltose.
Glykogen.In tierischen Organismen ist dieses Polysaccharid ein strukturelles und funktionelles Analogon der Pflanzenstärke. Es hat eine ähnliche Struktur wie Amylopektin, weist jedoch eine noch stärkere Kettenverzweigung auf. Typischerweise liegen zwischen den Verzweigungspunkten 10–12, manchmal sogar 6 Glukoseeinheiten. Konventionell kann man sagen, dass die Verzweigung des Glykogen-Makromoleküls doppelt so groß ist wie die von Amylopektin. Eine starke Verzweigung fördert die Leistung von Glykogen Energiefunktion, da nur mit einer Vielzahl terminaler Reste eine schnelle Eliminierung der erforderlichen Anzahl an Glucosemolekülen gewährleistet werden kann.
Das Molekulargewicht von Glykogen ist ungewöhnlich groß und erreicht 100 Millionen. Diese Größe von Makromolekülen trägt dazu bei, die Funktion eines Reservekohlenhydrats zu erfüllen. Somit passiert das Glykogen-Makromolekül aufgrund seiner Größe die Membran nicht und verbleibt in der Zelle, bis der Energiebedarf entsteht.
Die Hydrolyse von Glykogen in einer sauren Umgebung erfolgt sehr leicht mit einer quantitativen Ausbeute an Glukose. Dies wird bei der Gewebeanalyse auf Glykogengehalt basierend auf der gebildeten Glukosemenge verwendet.
Ähnlich wie Glykogen in tierischen Organismen spielt Amylopektin, das eine weniger verzweigte Struktur aufweist, in Pflanzen die gleiche Rolle als Reservepolysaccharid. Dies liegt daran, dass Stoffwechselprozesse in Pflanzen deutlich langsamer ablaufen und keine schnelle Energiezufuhr erfordern, wie dies manchmal für einen tierischen Organismus notwendig ist ( stressige Situationen, körperlicher oder geistiger Stress).
Zellulose.Dieses Polysaccharid, auch Ballaststoff genannt, ist das häufigste pflanzliche Polysaccharid. Zellulose hat eine große mechanische Festigkeit und dient als Stützmaterial für Pflanzen. Holz enthält 50–70 % Zellulose; Baumwolle besteht nahezu aus reiner Zellulose. Zellulose ist ein wichtiger Rohstoff für eine Reihe von Industrien (Zellstoff und Papier, Textilien usw.).
Cellulose ist ein lineares Polysaccharid, in dem D-Glucopyranose-Reste durch P(1-4)-glycosidische Bindungen verknüpft sind. Der Disaccharidanteil der Cellulose ist Cellobiose.
Die makromolekulare Kette hat keine Verzweigungen; sie enthält 2,5–12.000 Glucosereste, was einem Molekulargewicht von 400.000 bis 1–2 Millionen entspricht.

Die β-Konfiguration des anomeren Kohlenstoffatoms führt dazu, dass das Cellulosemakromolekül eine streng lineare Struktur aufweist. Dies wird durch die Bildung von Wasserstoffbrückenbindungen innerhalb der Kette sowie zwischen benachbarten Ketten erleichtert.

Diese Kettenverpackung bietet eine hohe mechanische Festigkeit, Faserigkeit, Wasserunlöslichkeit und chemische Inertheit, was Zellulose zu einem hervorragenden Baumaterial macht Zellwände Pflanzen. Zellulose wird nicht durch gewöhnliche Enzyme des Magen-Darm-Trakts abgebaut, ist aber als Ballaststoff für die normale Ernährung notwendig.
Von großer praktischer Bedeutung sind die ätherischen Derivate der Cellulose: Acetate (Kunstseide), Nitrate (Sprengstoffe, Kolloxylin) und andere (Viskosefaser, Cellophan).
11.3.2. Heteropolysaccharide
Bindegewebspolysaccharide. Unter den Polysacchariden des Bindegewebes sind Chondroitinsulfate (Haut, Knorpel, Sehnen), Hyaluronsäure (Glaskörper des Auges, Nabelschnur, Knorpel, Gelenkflüssigkeit) und Heparin (Leber) die am besten untersuchten. Die Struktur dieser Polysaccharide hat einige Gemeinsamkeiten: Ihre unverzweigten Ketten bestehen aus Disaccharidresten, zu denen Uronsäure (D-Glucuronsäure, D-Galacturonsäure, L-Iduronsäure – Epimer von D-Glucuronsäure an C-5) und Aminozucker (N-Acetylglucosamin, N-Acetylgalactosamin) gehören. Einige von ihnen enthalten Rückstände von Schwefelsäure.
Bindegewebspolysaccharide werden manchmal saure Mucopolysaccharide (aus dem Lateinischen) genannt. Schleim- Schleim), da sie Carboxylgruppen und Sulfogruppen enthalten.
Chondroitinsulfate. Sie bestehen aus Disaccharidresten von N-acetyliertem Chondrosin, die durch β(1-4)-glykosidische Bindungen verbunden sind.
N-Acetylchondrosin wird aus Rückständen aufgebaut D -Glucuronsäure und N-Acetyl-D -Galactosamin, verknüpft durch eine β(1-3)-glykosidische Bindung.

Wie der Name schon sagt, handelt es sich bei diesen Polysacchariden um Schwefelsäureester (Sulfate). Die Sulfatgruppe bildet eine Esterbindung mit der Hydroxylgruppe von N-Acetyl-D-galactosamin, die sich in Position 4 oder 6 befindet. Dementsprechend werden Chondroitin-4-sulfat und Chondroitin-6-sulfat unterschieden. Das Molekulargewicht von Chondroitinsulfaten beträgt 10-60.000.

Hyaluronsäure. Dieses Polysaccharid besteht aus Disaccharidresten, die durch β(1-4)-glykosidische Bindungen verbunden sind.

Das Disaccharidfragment besteht aus Resten D -Glucuronsäure und N-Acetyl-D-Glucosamin verknüpftβ (1-3)-glycosidische Bindung.
Heparin. In Heparin umfassen die sich wiederholenden Disaccharideinheiten Reste von D-Glucosamin und einer der Uronsäuren – D-Glucuronsäure oder L-Iduronsäure. Mengenmäßig überwiegt die L-Iduronsäure. Im Inneren des Disaccharidfragments gibt es eine α(1-4)-glykosidische Bindung, und zwischen den Disaccharidfragmenten gibt es eine α(1-4)-Bindung, wenn das Fragment mit l-Iduronsäure endet, und eine β(1-4)-Bindung. Bindung, wenn d-Glucuronsäure.
Die Aminogruppe der meisten Glucosaminreste ist sulfatiert und einige von ihnen sind acetyliert. Darüber hinaus finden sich Sulfatgruppen an einer Reihe von L-Iduronsäureresten (an Position 2) sowie an Glucosamin (an Position 6). Die D-Glucuronsäurereste sind nicht sulfatiert. Im Durchschnitt gibt es 2,5–3 Sulfatgruppen pro Disaccharidfragment. Das Molekulargewicht von Heparin beträgt 16-20.000.

Heparin verhindert die Blutgerinnung, weist also gerinnungshemmende Eigenschaften auf.
Viele Heteropolysaccharide, einschließlich der oben diskutierten, liegen nicht in freier Form vor, sondern in gebundener Form mit Polypeptidketten. Solche hochmolekularen Verbindungen werden als gemischte Biopolymere klassifiziert, für die derzeit der Begriff verwendet wird Glykokonjugate.
Monosaccharide: Klassifizierung; Stereoisomerie, D- und L-Reihe; offene und zyklische Formen am Beispiel von D-Glucose und 2-Desoxy-D-Ribose, Cyclooxotautomerie; Mutarotation. Vertreter: D-Xylose, D-Ribose, D-Glucose, 2-Desoxy-D-Ribose, D-Glucosamin.
Kohlenhydrate- heterofunktionelle Verbindungen, bei denen es sich um mehrwertige Aldehyd- oder Ketonalkohole oder deren Derivate handelt. Die Klasse der Kohlenhydrate umfasst eine Vielzahl von Verbindungen – von niedermolekularen Verbindungen mit 3 bis 10 Kohlenstoffatomen bis hin zu Polymeren mit einem Molekulargewicht von mehreren Millionen. In Bezug auf die Säurehydrolyse und nach physikalisch-chemischen Eigenschaften werden sie in drei große Gruppen eingeteilt: Monosaccharide, Oligosaccharide und Polysaccharide .
Monosaccharide(Monosen) – Kohlenhydrate, die nicht durch Säurehydrolyse zu einfacheren Zuckern umgewandelt werden können. Monosas klassifizieren durch die Anzahl der Kohlenstoffatome, die Art der funktionellen Gruppen, stereoisomeren Reihen und anomeren Formen. Von funktionelle Gruppen Monosaccharide werden unterteilt in Aldosen (enthalten eine Aldehydgruppe) und Ketose (enthalten eine Carbonylgruppe).


Von Anzahl der Kohlenstoffatome in der Kette: Triosen (3), Tetrosen (4), Pentosen (5), Hexosen (6), Heptosen (7) usw. bis 10. Die wichtigsten sind Pentosen und Hexosen. Von Konfiguration des letzten chiralen Atoms Kohlenstoffmonosaccharide werden in Stereoisomere der D- und L-Serie unterteilt. In der Regel nehmen Stereoisomere der D-Serie (D-Glucose, D-Fructose, D-Ribose, D-Desoxyribose usw.) an Stoffwechselreaktionen im Körper teil.
Im Allgemeinen umfasst der Name eines einzelnen Monosaccharids:
Ein Präfix, das die Konfiguration aller asymmetrischen Kohlenstoffatome beschreibt;
Eine digitale Silbe, die die Anzahl der Kohlenstoffatome in der Kette bestimmt;
Suffix - Oza - für Aldosen und - fangen - für Ketosen, und die locant Oxo-Gruppe wird nur angezeigt, wenn sie sich nicht am C-2-Atom befindet.
Struktur Und Stereoisomerie Monosaccharide.
Monosaccharidmoleküle enthalten mehrere Chiralitätszentren, also gibt es sie große Nummer Stereoisomere, die der gleichen Strukturformel entsprechen. Somit beträgt die Anzahl der Stereoisomere von Aldopentosen acht ( 2 N , Wo N = 3 ), einschließlich 4 Enantiomerenpaaren. Aldohexosen werden bereits 16 Stereoisomere, also 8 Enantiomerenpaare, aufweisen, da ihre Kohlenstoffkette 4 asymmetrische Kohlenstoffatome enthält. Dies sind Allose, Altrose, Galactose, Glucose, Gulose, Idose, Mannose, Talose. Ketohexosen enthalten im Vergleich zu den entsprechenden Aldosen ein chirales Kohlenstoffatom weniger, sodass die Anzahl der Stereoisomere (2 3) auf 8 (4 Enantiomerenpaare) reduziert ist.
Relative Konfiguration Monosaccharide werden durch die Konfiguration bestimmt das chirale Kohlenstoffatom, das am weitesten von der Carbonylgruppe entfernt ist im Vergleich zum Konfigurationsstandard - Glycerinaldehyd. Wenn die Konfiguration dieses Kohlenstoffatoms mit der Konfiguration von D-Glycerinaldehyd übereinstimmt, wird das Monosaccharid als Ganzes als D-Reihe klassifiziert. Und umgekehrt gilt das Monosaccharid, wenn es der Konfiguration von L-Glycerinaldehyd entspricht, als zur L-Reihe gehörend. Jede Aldose der D-Serie entspricht einem Enantiomer der L-Serie mit der entgegengesetzten Konfiguration aller Chiralitätszentren.
(! ) Die Position der Hydroxylgruppe am letzten Chiralitätszentrum rechts zeigt an, dass das Monosaccharid zur D-Reihe gehört, links - zur L-Reihe, also das gleiche wie im stereochemischen Standard - Glycerinaldehyd.

Natürliche Glucose ist ein Stereoisomer D-Reihe. Im Gleichgewicht haben Glukoselösungen eine Rechtsdrehung (+52,5°), weshalb Glukose manchmal auch Dextrose genannt wird. Glukose erhielt den Namen Traubenzucker, da sie am häufigsten im Traubensaft enthalten ist.
Epimere werden Diastereomere von Monosacchariden genannt, die sich in der Konfiguration nur eines asymmetrischen Kohlenstoffatoms unterscheiden. Das Epimer von D-Glucose an C4 ist D-Galactose und an C2 Mannose. Epimere können sich in einer alkalischen Umgebung durch die Enediol-Form ineinander umwandeln, dieser Vorgang wird als bezeichnet Epimerisierung .

Tautomerie von Monosacchariden. Immobilien studieren Glucose zeigte:
1) Die Absorptionsspektren von Glucoselösungen enthalten keine Bande, die der Aldehydgruppe entspricht;
2) Glucoselösungen führen nicht zu allen Reaktionen auf die Aldehydgruppe (sie interagieren nicht mit NaHSО 3 und fuchsulfitiger Säure);
3) Bei der Wechselwirkung mit Alkoholen in Gegenwart von „trockenem“ HCl fügt Glucose im Gegensatz zu Aldehyden nur ein Äquivalent Alkohol hinzu;
4) frisch zubereitete Glucoselösungen mutarotieren Innerhalb von 1,5–2 Stunden ändert sich der Drehwinkel der Ebene des polarisierten Lichts.

Zyklisch Die Formen der Monosaccharide sind chemischer Natur und zyklisch Halbacetale , die durch die Wechselwirkung einer Aldehyd- (oder Keton-)Gruppe mit der Alkoholgruppe eines Monosaccharids entstehen. Als Ergebnis der intramolekularen Wechselwirkung ( A N Mechanismus ) Das elektrophile Kohlenstoffatom der Carbonylgruppe wird vom nukleophilen Sauerstoffatom der Hydroxylgruppe angegriffen. Thermodynamisch stabileres fünfgliedriges ( Furanose ) und sechsgliedrig ( Pyranose ) Fahrräder. Die Bildung dieser Zyklen hängt mit der Fähigkeit der Kohlenstoffketten von Monosacchariden zusammen, eine klauenförmige Konformation anzunehmen.

Die unten dargestellten grafischen Darstellungen zyklischer Formen werden Fischer-Formeln genannt (man findet auch den Namen „Colley-Tollens-Formeln“).


Bei diesen Reaktionen wird das C 1-Atom von prochiral durch Cyclisierung chiral ( anomeres Zentrum).
Als Stereoisomere mit unterschiedlicher Konfiguration des C-1-Atoms werden Aldosen oder C-2-Ketosen in ihrer zyklischen Form bezeichnet Anomere , und die Kohlenstoffatome selbst werden genannt anomeres Zentrum .
Die aus der Cyclisierung resultierende OH-Gruppe ist Halbacetal. Sie wird auch als glykosidische Hydroxylgruppe bezeichnet. Seine Eigenschaften unterscheiden sich deutlich von anderen Alkoholgruppen des Monosaccharids.
Die Bildung eines zusätzlichen Chiralitätszentrums führt zur Entstehung neuer stereoisomerer (anomerer) α- und β-Formen. α-Anomere Form wird als eine bezeichnet, bei der sich die Halbacetal-Hydroxylgruppe auf der gleichen Seite befindet wie die Hydroxylgruppe am letzten Chiralitätszentrum, und β-Form - wenn sich die Hydroxylgruppe des Halbacetals auf der anderen Seite befindet als die Hydroxylgruppe am letzten Chiralitätszentrum. Es entstehen 5 gegenseitig umwandelbare tautomere Formen der Glucose. Diese Art der Tautomerie nennt man Cyclo-Oxo-Tautomerie . Tautomere Formen der Glucose befinden sich in Lösung im Gleichgewichtszustand.
In Lösungen von Monosacchariden überwiegt es zyklische Halbacetalform (99,99 %) als thermodynamisch günstiger. Der Anteil der azyklischen Form mit einer Aldehydgruppe beträgt weniger als 0,01 %; daher findet keine Reaktion mit NaHSO 3 , keine Reaktion mit fuchsiniger Säure statt und die Absorptionsspektren von Glucoselösungen zeigen nicht das Vorhandensein einer für diese charakteristischen Bande Aldehydgruppe.
Auf diese Weise, Monosaccharide - zyklische Halbacetale von mehrwertigen Aldehyd- oder Ketonalkoholen, die in Lösung im Gleichgewicht mit ihren tautomeren azyklischen Formen vorliegen.
In frisch zubereiteten Lösungen von Monosacchariden wird das Phänomen beobachtet Mutarotation - zeitliche Änderungen des Drehwinkels der Polarisationsebene des Lichts . Anomere α- und β-Formen haben unterschiedliche Rotationswinkel der Ebene des polarisierten Lichts. So hat kristalline α,D-Glucopyranose, wenn sie in Wasser gelöst wird, einen anfänglichen Rotationswinkel von +112,5° und nimmt dann allmählich auf +52,5° ab. Wenn β,D-Glucopyranose gelöst ist, beträgt sein anfänglicher Rotationswinkel +19,3° und erhöht sich dann auf +52,5°. Dies erklärt sich dadurch, dass sich für einige Zeit ein Gleichgewicht zwischen der α- und β-Form einstellt: 2/3 β-Form → 1/3 α-Form.
Die Präferenz für die Bildung des einen oder anderen Anomers wird weitgehend durch deren Konformationsstruktur bestimmt. Die günstigste Konformation für den Pyranosezyklus ist Sessel , und für den Furanosezyklus - Umschlag oder Twist -Konformation. Die wichtigsten Hexosen – D-Glucose, D-Galactose und D-Mannose – liegen ausschließlich in der 4 C 1-Konformation vor. Darüber hinaus enthält D-Glucose von allen Hexosen die größte Anzahl an äquatorialen Substituenten im Pyranosering (und ihr β-Anomer enthält sie alle).


Im β-Konformer befinden sich alle Substituenten in der günstigsten äquatorialen Position, sodass diese Form zu 64 % in Lösung vorliegt und das α-Konformer eine axiale Anordnung der Halbacetal-Hydroxylgruppe aufweist. Es ist das α-Konformer der Glukose, das im menschlichen Körper vorkommt und an Stoffwechselprozessen beteiligt ist. Aus dem β-Konformer der Glucose wird ein Polysaccharid, eine Faser, aufgebaut.
Heworths Formeln. Fischers zyklische Formeln beschreiben erfolgreich die Konfiguration von Monosacchariden, sind jedoch weit von der tatsächlichen Geometrie der Moleküle entfernt. In Haworths perspektivischen Formeln werden die Pyranose- und Furanose-Zyklen als flache, horizontal liegende regelmäßige Vielecke (Sechseck bzw. Fünfeck) dargestellt. Das Sauerstoffatom im Kreislauf befindet sich in einiger Entfernung vom Beobachter, bei Pyranosen in der rechten Ecke.

Wasserstoffatome und Substituenten (hauptsächlich CH 2 OH-Gruppen, falls vorhanden, und er) befinden sich oberhalb und unterhalb der Ringebene. Symbole für Kohlenstoffatome, wie sie beim Schreiben von Formeln für zyklische Verbindungen üblich sind, werden nicht angezeigt. In der Regel werden auch Wasserstoffatome mit Bindungen dazu weggelassen. C-C-Verbindungen, die näher am Betrachter liegen, werden der Übersichtlichkeit halber manchmal mit fetten Linien dargestellt, obwohl dies nicht notwendig ist.
Um von den zyklischen Fischer-Formeln zu den Haworth-Formeln zu gelangen, müssen letztere so transformiert werden, dass sich das Sauerstoffatom des Kreises auf derselben Geraden wie die im Kreis enthaltenen Kohlenstoffatome befindet. Wenn die transformierte Fischer-Formel horizontal platziert wird, wie es das Schreiben der Haworth-Formeln erfordert, erscheinen die Substituenten, die sich rechts von der vertikalen Linie der Kohlenstoffkette befinden, unter der Ebene des Zyklus, und die Substituenten links davon befinden sich über dieser Ebene .

Die oben beschriebenen Transformationen zeigen auch, dass sich die Halbacetalhydroxylgruppe in α-Anomeren der D-Reihe unterhalb der Ringebene und in β-Anomeren oberhalb der Ebene befindet. Darüber hinaus befindet sich die Seitenkette (bei Pyranosen an C-5 und bei Furanosen an C-4) oberhalb der Ringebene, wenn sie mit einem Kohlenstoffatom der D-Konfiguration verbunden ist, und darunter, wenn dieses Atom die L-Konfiguration aufweist .
Vertreter.
D -Xylose - „Holzzucker“, ein Monosaccharid aus der Pentosegruppe mit der Summenformel C 5 H 10 O 5, gehört zu den Aldosen. Kommt in Pflanzenembryonen als ergastische Substanz vor und ist auch eines der Monomere des Zellwandpolysaccharids Hemicellulose.
D–Ribose ist eine Art Einfachzucker, der das Kohlenhydratrückgrat der RNA bildet und so alle Lebensprozesse steuert. Ribose ist auch an der Produktion von Adenosintriphosphorsäure (ATP) beteiligt und einer ihrer Strukturbestandteile.



2-Desoxy-D-Ribose - Bestandteil der Desoxyribonukleinsäuren (DNA). Dieser historisch etablierte Name ist nicht streng nomenklatorisch, da das Molekül nur zwei Chiralitätszentren enthält (ohne Berücksichtigung des C-1-Atoms in der zyklischen Form), daher kann diese Verbindung gleichermaßen zu Recht als 2-Desoxy-D-Arabinose bezeichnet werden. Ein korrekterer Name für die offene Form ist 2-Desoxy-D-erythro-pentose (D-erythro-Konfiguration ist hervorgehoben).
D-Glucosamin – Stoff produziert Knorpelgewebe Gelenke, ist Bestandteil von Chondroitin und Teil der Gelenkflüssigkeit.
Monosaccharide: offene und zyklische Formen, zum Beispiel D-Galactose und D-Fructose, Furanose und Pyranose; – und β-Anomere; die stabilsten Konformationen der wichtigsten D-Hexopyranosen. Vertreter: D-Galactose, D-Mannose, D-Fructose, D-Galactosamin (Frage 1).
Tautomere Formen von Fruktose werden auf die gleiche Weise wie tautomere Formen der Glucose durch eine intramolekulare Wechselwirkungsreaktion (AN) gebildet. Das elektrophile Zentrum ist das Kohlenstoffatom der Carbonylgruppe an C2 und das Nukleophil ist der Sauerstoff der OH-Gruppe am 5. oder 6. Kohlenstoffatom.

Vertreter.



D-Galactose – in tierischen und pflanzlichen Organismen, einschließlich einiger Mikroorganismen. Es ist Teil der Disaccharide Lactose und Lactulose. Bei der Oxidation entstehen Galakton-, Galakturon- und Schleimsäuren.
D-Mannose – Bestandteil vieler Polysaccharide und gemischter Biopolymere pflanzlichen, tierischen und bakteriellen Ursprungs.
D-Fruktose - Monosaccharid, Ketohexose, in lebenden Organismen kommt nur das D-Isomer in freier Form vor - in fast allen süßen Beeren und Früchten - als Monosaccharideinheit ist es Bestandteil von Saccharose und Lactulose.
| " |
Es ist bekannt, dass Aldehyde und Ketone mit Alkoholen unter Bildung von Halbacetalen und Ketalen reagieren. Besonders leicht bilden sich cyclische Halbacetale. Dafür notwendige Voraussetzungen sind: 1) die Hydroxyl- und Carbonylgruppe müssen Teile desselben Moleküls sein; 2) ihre Wechselwirkung kann einen fünf- oder sechsgliedrigen Ring bilden.
Beispielsweise bildet 4-Hydroxypentanal ein fünfgliedriges cyclisches Halbacetal. In diesem Fall entsteht am Kohlenstoff C-1 ein neues Stereozentrum (alle vier Substituenten an C-1 sind unterschiedlich):
In ähnlicher Weise bildet 5-Hydroxyhexanal ein sechsgliedriges cyclisches Halbacetal, das ebenfalls ein neues Stereozentrum an C-1 erzeugt:
Hydroxyl- und Carbonylgruppen sind im selben Monosaccharidmolekül enthalten, sodass Monosaccharide fast ausschließlich in Form zyklischer Halbacetale vorliegen.
Zyklische Fischer-Projektionen. Die Größe des Halbacetalrings des Monosaccharids wird mit heterozyklischen Molekülen – Pyran und Furan – verglichen:

Sechsgliedrige Halbacetalringe werden „Pyran“ und fünfgliedrige Ringe „Furan“ genannt.
Bei Kristallisation aus Ethanol ergibt D-Glucose -D-Glucopyranose, T pl = 146 °C, spezifische optische Drehung D = +112,2°. Kristallisation aus wässrigem Ethanol ergibt -D-Glucopyranose, T pl = 150 °C, D = +18,7°. Diese – und – Isomere – sechsgliedrige cyclische Halbacetale – entstehen durch die Reaktion von Hydroxyl OH am Kohlenstoff C-5 mit einer Carbonylgruppe in Position 1. Das neue Stereozentrum, das beim Erhalt eines Halbacetals entsteht, wird aufgerufen anomerer Kohlenstoff. Die so entstandenen Diastereomere haben einen besonderen Namen – Anomere. Die Konfiguration eines anomeren Kohlenstoffs wird durch das Präfix bezeichnet, wenn sich seine Hydroxylgruppe auf derselben Seite der Fisher-Projektion befindet wie die OH-Gruppe am Stereozentrum mit der höchsten Nummer. Bei entgegengesetzter Ausrichtung dieser Hydroxylgruppen ist die Konfiguration des anomeren Kohlenstoffs .
Nach der 13 C-NMR-Methode von D-Glucose in wässriger Lösung gibt es: -Pyranose (38,8 %),
-Pyranose (60,9 %), -Furanose (0,14 %), -Furanose (0,15 %), offenes lineares Hydrat (0,0045 %).
Wir stellen die - und - Formen der Glucofuranose im Vergleich zu den zyklischen Formen der Fructose vor -
-Fructofuranose und -Fructofuranose.
Bei Aldosen ist ein Ringschluss aufgrund des 1. (Aldehyd-)Kohlenstoffs und Hydroxyl am 4. (oder 5.) C-Atom und bei Ketosen aufgrund des 2. (Carbonyl-)Kohlenstoffs und Hydroxyl an der 5. oder 6. Position möglich die Kette.
Haworths Formeln. Eine alternative Möglichkeit zur Darstellung der zyklischen Strukturen von Monosacchariden ist bekannt als Haworth-Projektionen und benannt nach dem englischen Chemiker Walter Haworth (Nobelpreisträger, 1937). In Haworths Formeln werden fünf- und sechsgliedrige cyclische Halbacetale in Form flacher Fünf- oder Sechsecke dargestellt, die so angeordnet sind, als ob sie senkrecht zur Ebene eines Blattes Papier wären. Die an den Kohlenstoffatomen des Rings befestigten Gruppen sind oberhalb oder unterhalb der Ringebene und parallel zur Ebene des Blattes Papier positioniert. In Haworths Formeln wird normalerweise rechts anomerer Kohlenstoff und dahinter halbacetaler Sauerstoff geschrieben. Haworths Projektionen der - und -pyranose-Formen von D-Glucose sind unten dargestellt.
ÜBUNGEN.
1. Was bedeutet der Begriff „zyklische Formen von Kohlenhydraten“?
2.
Geben Sie Fischers Struktur- und Projektionsformeln an für: a) Triose; b) Tetrosen;
c) Pentosen.
3. Was ist drin? chemische Formeln unterscheiden L - Und D- Isomere (am Beispiel Erythrose)?
4. Geben Sie Acetalbindungen und asymmetrische Kohlenstoffatome (Stereozentren) in den Verbindungen an:
5. Schreiben Sie die Strukturformeln der Pyran- und Furan-Heterocyclen und geben Sie dabei jedes Atom an.
6.
Erstellen Sie Schemata für die Bildung zyklischer Halbacetalformen aus:
Anzeige -Threoses; B) D -Ribose (Furanose- und Pyranoseformen).
7. Wandeln Sie die grafischen Formeln der Verbindungen a)–c) in Fisher-Projektionen um und weisen Sie diese Projektionen D zu - oder L -Glycerinaldehyd:
8. Wie lange ist Ketotetrose möglich? Zeichnen Sie jeweils die Fischer-Projektionen.
9. Verfassen Sie Haworths Formeln:
1) -D- Glucopyranosen; 2) -D- Glucofuranosen.
Antworten zu den Übungen zu Thema 2
Lektion 34
1. Zyklische Formen von Kohlenhydraten enthalten einen Kreislauf mit Sauerstoff im Ring. Normalerweise handelt es sich um ein zyklisches Halbacetal. In seinem Molekül gibt es keine freie Aldehydgruppe, aber eine Acetalbindung. Zum Beispiel für Erythrose:

3.
Um anhand chemischer Formeln zwischen den D- und L-Isomeren der Erythrose zu unterscheiden, sollten diese in Form von Fischer-Projektionen dargestellt werden. Die Hydroxylorientierung nach rechts am höchsten Stereozentrum C*-3 bedeutet
D-Isomer. Charakteristisch für das L-Isomer ist die Richtung der HO-Gruppe links von C*-3:

4. Acetalbindungen sind mit einem Pfeil () und Stereozentren mit einem Sternchen (*) gekennzeichnet:

c) zwei aufeinanderfolgende Umlagerungen von Substituenten verändern die Konfiguration (D oder L) am Stereozentrum nicht:
8. Es gibt zwei mögliche enantiomere Ketoterosen, für die die Fischer-Projektionen wie folgt lauten:

9. Haworth-Formeln:
Diastereomere– Stereoisomere, deren Moleküle keine Spiegelbilder voneinander sind.
Aldosen weisen nicht alle für Aldehyde charakteristischen Eigenschaften auf. Daher reagieren sie nicht mit fuchsiniger Säure und reagieren sehr langsam mit Natriumhydrosulfit. Gleichzeitig kommt es zu einer erhöhten Aktivität einer der Hydroxylgruppen, die Zahl der Aldose-Isomere ist doppelt so groß wie durch die Fischer-Formel vorhergesagt, außerdem sind Aldosen durch das Phänomen der Mutarotation – einer Winkeländerung – gekennzeichnet Rotation frisch zubereiteter Lösungen.
Um diese Widersprüche zu erklären Ende des 19. Jahrhunderts V. Es wurde vermutet, dass Monosaccharide nicht nur in linearer Form, sondern auch in Form zyklischer innerer Halbacetale ohne Carbonylgruppe existieren können. Anschließend wurde nachgewiesen, dass Monosaccharide dadurch gekennzeichnet sind Cycloketten-Tautomerie: Im kristallinen Zustand haben sie eine zyklische Struktur und in Lösungen liegen sie in Form zyklischer und offenkettiger Formen vor, die sich im dynamischen Gleichgewicht befinden.
Die Bildung zyklischer Formen von Monosacchariden erfolgt durch die intramolekulare Addition einer der Hydroxylgruppen an die Carbonylgruppe. Am stabilsten sind fünf- und sechsgliedrige Zyklen. Wenn daher zyklische Formen von Kohlenhydraten gebildet werden, Furanose(fünfgliedrig) und Pyranose(sechsgliedrige) Zyklen. Betrachten wir die Bildung zyklischer Formen am Beispiel von Glucose und Ribose.
Bei der Zyklisierung bildet Glucose überwiegend einen Pyranosezyklus. Der Pyranosezyklus besteht aus 5 Kohlenstoffatomen und 1 Sauerstoffatom. Bei seiner Bildung ist die Hydroxylgruppe des fünften (C 5) Kohlenstoffatoms an der Addition beteiligt.
Die Bildung zyklischer Formen von Monosacchariden beruht auf der Wechselwirkung der Aldehydgruppe mit der Hydroxylgruppe am C 5-, seltener am C 4-Atom: Die resultierende Verbindung ist ein internes zyklisches Halbacetal. Daher werden zyklische Formen von Monosen genannt Halbacetal.
Durch die Schließung des Zyklus entsteht im Molekül ein neues Asymmetriezentrum – dies führt zu einer Verdoppelung der Isomerenzahl:
Die Struktur der zyklischen Formen von Monosacchariden lässt sich anhand der „vielversprechenden“ Formeln von Haworth klarer darstellen:
 Die −OH-Gruppe am ersten Kohlenstoffatom in zyklischen Formen heißt glykosidisches Hydroxyl. Es ist viel reaktiver als andere Hydroxylgruppen und reagiert leicht mit Alkoholen oder mit dem zweiten Monosaccharidmolekül unter Bildung Glykoside.
Die −OH-Gruppe am ersten Kohlenstoffatom in zyklischen Formen heißt glykosidisches Hydroxyl. Es ist viel reaktiver als andere Hydroxylgruppen und reagiert leicht mit Alkoholen oder mit dem zweiten Monosaccharidmolekül unter Bildung Glykoside.
Der Übergang von Fisher-Projektionsformeln zu Haworth-Formeln erfolgt nach folgenden Regeln:
1) In der Fischer-Formel wird eine gerade Anzahl von Permutationen von Substituenten an dem Kohlenstoffatom durchgeführt, dessen Hydroxylgruppe an der Bildung eines cyclischen Halbacetals beteiligt ist. Die Umlagerung erfolgt so, dass diese OH−-Gruppe auf derselben Vertikalen wie die Carbonylgruppe steht und unten liegt.
Beispielsweise ist die OH-Gruppe an C5 an der Bildung des Pyranoserings von D-Glucose beteiligt. Wir führen zwei Permutationen durch und schreiben die zyklische Form in der Fischer-Projektion:

Ähnlich verfahren wir bei der Bildung eines Furanosezyklus. Nun ist die OH-Gruppe an C 4 an der Ringbildung beteiligt:

2) Je nach Aufbau des Zyklus wird der entsprechende „Blank“ genommen:
Alle Substituenten, die sich in der Fisher-Projektion rechts von der Kohlenstoffkettenlinie befinden, liegen unterhalb der Ringebene; dementsprechend liegen die links liegenden Substituenten oberhalb der Ebene.

Beachten Sie, dass sich in den Pyranoseformen von Monosacchariden der D-Serie die CH 2 OH-Gruppe immer oberhalb der Ringebene befindet. In a-Anomeren befindet sich die glykosidische OH-Gruppe unter der Ringebene und in
b−anomer – über der Ebene.
Die Namen zyklischer Formen sind wie folgt aufgebaut: Geben Sie zunächst die Position der glykosidischen Gruppe (a− oder b−) an, dann die Zugehörigkeit des Saccharids zur stereochemischen Reihe (D− oder L−) und dann den semantischen Teil des Name des Zyklus (−furan− oder −piran−), der mit dem Suffix − osa endet.
In Fällen, in denen die Anomerisierung nicht angegeben ist oder ein Gleichgewichtsgemisch von Anomeren vorliegt, wird die Position der glykosidischen Gruppe durch eine Wellenlinie angezeigt:

Mutarotation
Furanose- und Pyranoseringe sowie a- und b-Anomere weisen unterschiedliche thermodynamische Stabilität auf. In Lösung liegen Monosaccharide jedoch sowohl in offener Form als auch in allen möglichen zyklischen Formen vor. Das Verhältnis dieser Formen hängt von der Struktur der offenen Form des Monosaccharids, der Art des Lösungsmittels und anderen Faktoren ab. Im Allgemeinen sind Pyranoseringe stabiler als Furanoseringe, und b-Anomere sind aufgrund der äquatorialen Konformation der Substituenten in polaren Lösungsmitteln stabiler.
In einer wässrigen Lösung sind gegenseitige Umwandlungen von Furanoseringen in Pyranoseringe und von a-Anomeren in b-Anomere und umgekehrt möglich. Dieses dynamische Gleichgewicht zwischen offenen und zyklischen Formen eines Monosaccharids wird Cyclo-Oxo-Tautomerie genannt. Die gegenseitige Umwandlung von a− und b− Anomeren nennt man Anomerisierung.
Als Änderung des Drehwinkels frisch zubereiteter Zuckerlösungen, die mit dem Übergang einer tautomeren Form in eine andere vor dem Einsetzen des Gleichgewichts einhergeht, wird bezeichnet Mutarotation.
