Metanul este componenta principală. Gaze naturale - CH4 (metan)
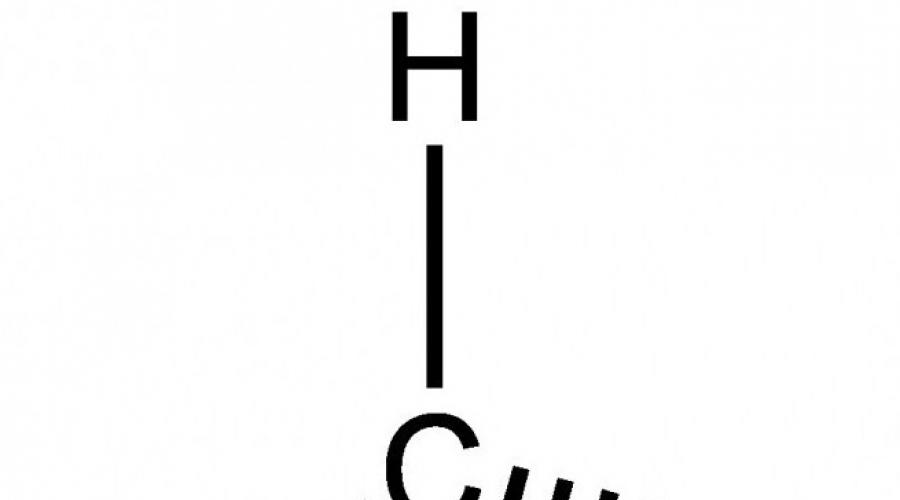
Citeste si
In apa
focare
combustie spontana
propan
clormetan
2. Structura moleculei
Formula moleculară CH 4. Formule structurale și electronice:
H | H-S-N | H
3. Proprietăți chimice
Primul membru al seriei omoloage de hidrocarburi saturate (metan). Metanul este o substanță inactivă din punct de vedere chimic. La conditii normale este destul de rezistent la acizi, alcalii si agenti oxidanti. Astfel, atunci când metanul este trecut printr-o soluție de KMnO 4, care este un agent oxidant destul de puternic, nu se oxidează și culoarea violetă a soluției nu dispare. Metanul nu intră în reacția de adăugare (mesaj), deoarece în molecula sa toate cele patru valențe ale atomului de carbon sunt complet saturate. Pentru metan, precum și pentru alte hidrocarburi saturate, sunt tipice reacțiile de substituție, în care atomii de hidrogen sunt înlocuiți cu atomi ai altor elemente sau grupări atomice. Caracteristica metanului este, de asemenea, o reacție cu clorul, care are loc la temperaturi obișnuite sub influența luminii difuze (poate avea loc o explozie în lumina directă a soarelui). În acest caz, atomii de hidrogen din molecula de metan sunt înlocuiți succesiv cu atomi de clor.
- CH 4 + Cl 2 \u003d CH 3 Cl + HCl
- CH 3 Cl + Cl 2 \u003d CH 2 Cl 2 + HCl
- CH 2 Cl 2 + Cl 2 \u003d CHCl 3 + HCl
- CHCI3 + CI2 = CC14 + HCI
Ca rezultat al reacției, se formează un amestec de metan cloropoid.
În aer, metanul arde cu o flacără incoloră cu eliberarea unei cantități semnificative de căldură:
- CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
Metanul formează cu aerul un amestec exploziv combustibil. Când metanul este încălzit fără acces la aer la o temperatură de peste 1000 C, se descompune în elemente - în carbon (funingine) și hidrogen:
- CH 4 \u003d C + 2H 2
4. Distribuția în natură
Metanul este componenta principală:
- gaze naturale combustibile (până la 99,5%),
- ulei asociat (39-91%),
- gaze de mlaștină (99%) și de mină (34-48%);
- prezente în gazele vulcanilor noroiosi (mai mult de 95%),
- apare sporadic în gazele vulcanice și în gazele rocilor magmatice și metamorfice.
O mare cantitate de metan este dizolvată în apele oceanelor, mărilor, lacurilor. Conținutul mediu de metan din apele Oceanului Mondial este de aproximativ 10 -2 cm 3 / l, cantitatea totală este de 14,10 12 m 3. Cantitatea de metan dizolvată în apele de formare este cu câteva ordine de mărime mai mare decât rezervele sale industriale.
Metanul este prezent și în atmosferele Pământului, Jupiter, Saturn, Uranus; în gazele de la suprafața solului Lunii. Cea mai mare parte a metanului din vara și hidrosfera Pământului s-a format în timpul distrugerii biochimice și catalitice termice a materiei organice dispersate, cărbunelui și petrolului. Metanul este produs prin descompunere anaerobă materie organică, în special celuloză (fermentația metanului).
În natura Pământului, metanul este destul de comun. Gazele naturale combustibile constau în 90-97% metan. Formează multe zăcăminte, din care este extras și alimentat prin conducte de gaz la locul de utilizare. Pe fundul mlaștinilor și iazurilor, metanul se formează ca urmare a descompunerii resturilor de plante fără acces la aer. Prin urmare, se mai numește și gaz de mlaștină. Sub denumirea de grisă, metanul se acumulează în minele de cărbune ca urmare a eliberării din straturile de cărbune și rocile asociate, în care se găsește sub formă liberă și legată. În minele de exploatare, eliberarea de metan din straturile de cărbune se observă în cantitate de până la 70-80 m / t s. b. m (t s. b. m. - o tonă de masă uscată fără cenușă), ceea ce face posibilă din punct de vedere economic extracția independentă sau însoțită (degazare) din zăcămintele de cărbune.
Gricea este foarte periculoasă deoarece poate forma un amestec exploziv cu aerul. Cele mai explozive concentrații de metan din aer sunt de 9-14%.
La temperaturi scăzute metanul formează compuși de incluziune - hidrați de gaz, larg răspândiți în natură.
Biocombustibili WWVS Gaze producătoare Cocs Combustibili pentru motoare
Energie Bioalimentare
Cantități mari de metan sunt folosite ca combustibil convenabil și ieftin. Arderea incompletă a metanului produce funingine, care este folosită la fabricarea cernelii de imprimare și ca umplutură pentru cauciuc, iar în timpul descompunerii termice (peste 1000 C) se obține funingine și hidrogen, care este folosit pentru sinteza amoniacului. Produsul clorării complete a metanului - tetraclorura de carbon CCl 4 - este un bun solvent pentru grăsimi și este folosit pentru extragerea grăsimilor din semințele oleaginoase. Metanul servește, de asemenea, ca materie primă pentru producția de acetilenă, alcool metilic și multe alte produse chimice.
7. Metanul ca factor în producția de cărbune
M. formează amestecuri explozive cu aerul. Când conținutul în aer este de până la 5-6%, M. arde lângă o sursă de căldură (temperatura de inflamație 650-750 C), la un conținut de 5-15,2 (16)% - explodează, mai mult de 16% - poate arde cu un aflux de oxigen, scădea în același timp concentrația M. exploziv. M. are un slab efect narcotic. MPC 300 mg/m 3. Alocarea lui M. în lucrări miniere creează un pericol deosebit în exploatarea cărbunelui. Există trei forme de eliberare a lui M. în minele: obișnuit, sufle și brusc. După abundența de metan, conform „Regulilor de siguranță în minele de cărbune și șist”, minele sunt împărțite în cinci categorii. Criteriul pentru o astfel de împărțire este abundența relativă de metan, adică. cantitatea de metan în metri cubi eliberată pe zi la 1 tonă de producție medie zilnică: cu eliberare de metan până la 5 m 3 / t, 5 - 10 m 3 / t, 10 - 15 m 3 / t; super-categorie - mai mult de 15 m 3 / t; periculos pentru secreţiile suflare. Minele care dezvoltă cusături periculoase sau amenințătoare din cauza izbucnirilor bruște de cărbune, gaz și rocă aparțin unei categorii speciale - periculoase din cauza izbucnirilor bruște. Extracția metanului din straturile de cărbune este considerată promițătoare (vezi conținutul de metan al stratului de cărbune, metanul din stratul de cărbune). La sfârşitul secolului al XX-lea. această problemă doar în SUA a fost tratată de oamenii de știință cca. 40 de universități, aprox. 100 de firme. Primele încercări industriale de utilizare a metanului asociat (în exploatarea cărbunelui) se fac tot în Ucraina, în Donbass. În industrie, metanul este folosit pentru a produce gaz de sinteză, acetilenă, cloroform, tetraclorură de carbon, negru de fum și altele.Produșii oxidării incomplete a metanului sunt materiile prime pentru fabricarea materialelor plastice utilizate în sinteza organică.
Vezi si
Surse
Metanul (gazul de mlaștină; CH 4) este cea mai simplă hidrocarbură saturată. Gaz incolor, inodor, punct de topire -182,48°. Metanul se aprinde ușor; Un amestec de metan și aer este exploziv.
Metanul este componenta principală a gazelor naturale (60-99%), a clapei de foc (35-40%), precum și a diverșilor produși de descompunere anaerobă a materiei organice, cum ar fi gazul de mlaștină, gazele de câmp de irigare. Metanul este produs în cantități mari în timpul cocsării cărbunelui, hidrogenării cărbunelui și a altor procese industriale.
Metanul este folosit ca combustibil pentru gazeificare, precum și pentru sinteza industrială a hidrocarburilor mari. greutate. Cu arderea incompletă sau oxidarea catalitică a metanului, formează metanol (vezi. Alcool metilic), (vezi), acetilenă (vezi). Metanul este, de asemenea, utilizat în producția de funingine, clorură de metil, clorobromobenzen, nitrometan și alte produse.
Metanul se găsește în gazele intestinale (ca urmare a fermentației metanului), în sângele animalelor și al oamenilor.
Metanul este compusul cel mai inert din grupul hidrocarburilor parafinice. Metanul fiziologic este indiferent și poate provoca intoxicații doar în concentrații foarte mari (datorită solubilității scăzute a metanului în apă și sânge). Totodată, efectul toxic al metanului se manifestă și la concentrații mai mici de metan din aer. Deci, atunci când conținutul de 25-30% metan în aer, apar primele semne (ritmul cardiac crescut, respirația crescută, coordonarea afectată a mișcărilor musculare fine etc.). Concentrațiile mai mari de metan în aer îi provoacă pe oameni durere de cap. Întreaga amploare a efectului toxic al metanului se manifestă numai atunci când tensiune arterială crescută(2-3 atm).
Primul ajutor pentru otrăvire acută: scoaterea victimei din atmosfera dăunătoare. Tampoane de încălzire. În lipsa respirației, imediat (înainte de sosirea medicului) respirația artificială, care se oprește numai după apariția semnelor de rigor mortis.
Acțiunea cronică a metanului. La lucrătorii din sau în industriile în care metanul și alte hidrocarburi din seria metanului sunt prezente în aer, sunt descrise schimbări vizibile din exterior (reflex pozitiv ochi-inima, test de atropină pronunțat). Cu toate acestea, expunerea cronică la metan nu provoacă modificări organice severe, deși unii cercetători atribuie apariția nistagmusului la mineri expunerii pe termen lung la metan.
Prevenirea intoxicației cu metan. În lucrări subterane nu este permis conținutul de metan peste 0,75% vol. Odată cu creșterea conținutului de metan, lucrătorii trebuie îndepărtați fără greș, iar spațiile trebuie ventilate. Principala măsură de prevenire a acumulărilor de metan în mine este prezența unei bune ventilații. La protectie personala este necesar să se folosească căști cu alimentare forțată cu aer sau aparate de respirație dotate cu alimentare cu aer.
Moleculare, structurale și formula electronica metanul sunt compilate pe baza teoriei lui Butlerov asupra structurii substanțelor organice. Înainte de a începe să scriem astfel de formule, să începem cu descriere scurta această hidrocarbură.
Caracteristicile metanului
Această substanță este explozivă, se mai numește și gaz „de mlaștină”. Mirosul specific al acestei hidrocarburi saturate este cunoscut tuturor. În procesul de ardere, nu rămân componente chimice din acesta, care au impact negativ asupra corpului uman. Metanul este un participant activ la formarea efectului de seră.
Proprietăți fizice
Primul reprezentant al seriei omoloage de alcani a fost descoperit de oamenii de știință în atmosfera lui Titan și Marte. Având în vedere faptul că metanul este asociat cu existența organismelor vii, a apărut o ipoteză despre existența vieții pe aceste planete. Pe Saturn, Jupiter, Neptun, Uranus, metanul a apărut ca produs al prelucrării chimice a substanțelor de origine anorganică. Pe suprafața planetei noastre, conținutul său este neglijabil.

caracteristici generale
Metanul nu are culoare, este aproape de două ori mai ușor decât aerul și este puțin solubil în apă. Ca parte a gazelor naturale, cantitatea acestuia ajunge la 98 la sută. Conține 30 până la 90 la sută metan. În mare măsură, metanul este de origine biologică.
Caprele și vacile erbivore cu copite emit o cantitate destul de semnificativă de metan în timpul procesării în stomacul bacteriilor. Printre sursele importante ale seriei omoloage de alcani, evidențiem mlaștinile, termitele, filtrarea gazelor naturale și procesul de fotosinteză a plantelor. Când se găsesc urme de metan pe planetă, putem vorbi despre existența vieții biologice pe aceasta.

Cum să obțineți
Formula structurală detaliată a metanului este o confirmare că molecula sa conține doar legături simple saturate formate din nori hibrizi. Printre opțiunile de laborator pentru obținerea acestei hidrocarburi, remarcăm fuziunea acetatului de sodiu cu alcalii solidi, precum și interacțiunea carburii de aluminiu cu apa.
Metanul arde cu o flacără albăstruie, eliberând aproximativ 39 MJ per metru cub. Această substanță formează amestecuri explozive cu aerul. Cel mai periculos este metanul, care este eliberat în timpul exploatării subterane a zăcămintelor minerale din minele de munte. Riscul unei explozii de metan este mare și la fabricile de prelucrare a cărbunelui și brichetelor, precum și la instalațiile de sortare.
Acțiune fiziologică
Dacă procentul de metan din aer este între 5 și 16 la sută, dacă intră oxigen, metanul se poate aprinde. În cazul unei creșteri semnificative a unui amestec dintr-o anumită substanță chimică, probabilitatea unei explozii crește.
Dacă concentrația acestui alcan în aer este de 43 la sută, provoacă asfixiere.
În timpul unei explozii, viteza de propagare este de la 500 la 700 de metri pe secundă. După ce metanul intră în contact cu sursa de căldură, procesul de aprindere al alcanului are loc cu o oarecare întârziere.
Pe această proprietate se bazează producția de echipamente electrice rezistente la explozie și componente explozive de siguranță.
Deoarece metanul este cel mai stabil din punct de vedere termic, este utilizat pe scară largă sub formă de combustibil industrial și casnic și este, de asemenea, folosit ca materie primă valoroasă pentru sinteza chimică. Formula structurală a tri-etil-metanului caracterizează caracteristicile structurale ale reprezentanților acestei clase de hidrocarburi.
În procesul interacțiunii sale chimice cu clorul sub influența iradierii ultraviolete, este posibilă formarea mai multor produse de reacție. În funcție de cantitatea de substanță inițială, în timpul substituției pot fi obținute clormetan, cloroform, tetraclorură de carbon.
În cazul arderii incomplete a metanului, se formează funingine. În cazul oxidării catalitice, se formează formaldehidă. Produsul final al interacțiunii cu sulful este disulfura de carbon.

Caracteristicile structurale ale metanului
Care este formula sa structurală? Metanul aparține hidrocarburilor saturate având formula generala CnH2n+2. Să luăm în considerare caracteristicile formării unei molecule pentru a explica cum se formează o formulă structurală.
Metanul este format dintr-un atom de carbon și patru atomi de hidrogen legați printr-o legătură chimică polară covalentă. Să explicăm formulele structurale pe baza structurii atomului de carbon.
Tip de hibridizare
Structura spațială a metanului este caracterizată de o structură tetraedrică. Deoarece carbonul are patru electroni de valență la nivelul exterior, atunci când atomul este încălzit, un electron se transferă de la al doilea orbital s la p. Drept urmare, în sfârșit nivel de energie carbonul are patru electroni nepereche ("liberi"). Formula structurală completă a metanului se bazează pe faptul că se formează patru nori hibrizi, care sunt orientați în spațiu la un unghi de 109 grade 28 de minute, formând o structură tetraedrică. În plus, vârfurile norilor hibrizi se suprapun cu norii nehibrizi de atomi de hidrogen.
Formula structurală completă și prescurtată a metanului corespunde pe deplin teoriei lui Butlerov. Între carbon și hidrogeni se formează o legătură simplă (unică), prin urmare, reacțiile de adiție nu sunt caracteristice acestei substanțe chimice.
Mai jos este formula structurală finală. Metanul este primul reprezentant al clasei de hidrocarburi saturate, are proprietati tipice alcan limitator. Formula structurală și electronică a metanului confirmă tipul de hibridizare a atomului de carbon din această substanță organică.

De la un curs școlar de chimie
Această clasă de hidrocarburi, reprezentativă pentru care este „gazul de mlaștină”, este studiată la cursul de clasa a X-a liceu. De exemplu, copiilor li se oferă sarcina de următoarea natură: „Scrieți formulele structurale ale metanului”. Trebuie înțeles că pentru această substanță, numai o configurație structurală extinsă poate fi descrisă conform teoriei lui Butlerov.
Formula sa prescurtată va coincide cu formula moleculară, scrisă ca CH4. Conform noilor standarde educaționale federale, care au fost introduse în legătură cu reorganizarea învățământului rusesc, în cursul de bază de chimie sunt revizuite toate aspectele legate de caracteristicile claselor de substanțe organice.
Sinteză industrială
Pe baza metanului, metodele industriale au fost dezvoltate pentru un astfel de important componenta chimica ca acetilena. Baza fisurii termice și electrice a fost tocmai formula sa structurală. Metanul oxidat catalitic cu amoniac pentru a forma acid cianhidric.
Această substanță organică este folosită pentru a produce gaz de sinteză. Când interacționează cu vaporii de apă, se obține un amestec monoxid de carbonși hidrogen, care este o materie primă pentru producerea de compuși carbonilici saturati.
De o importanță deosebită este interacțiunea cu acid azotic, rezultând nitrometan.

Aplicare ca combustibil pentru automobile
Din cauza lipsei surselor naturale de hidrocarburi, precum și a sărăcirii bazei de materie primă, problema găsirii de noi surse (alternative) pentru producția de combustibil este de o importanță deosebită. Una dintre aceste opțiuni este cea care include metanul.
Având în vedere diferența de densitate dintre combustibilul pe benzină și primul reprezentant al clasei alcanilor, există anumite caracteristici ale utilizării acestuia ca sursă de energie pentru motoare de automobile. Pentru a evita nevoia de a transporta cu tine o cantitate uriașă de metan, densitatea acestuia este crescută prin compresie (la o presiune de aproximativ 250 de atmosfere). Metanul este depozitat în stare lichefiată în cilindri instalați în mașini.
Impact asupra atmosferei
S-a discutat deja mai sus că metanul are un efect asupra Efect de sera. Dacă gradul de acțiune al monoxidului de carbon (4) asupra climei este luat în mod condiționat ca unitate, atunci ponderea „gazului de mlaștină” în acesta este de 23 de unități. În ultimele două secole, oamenii de știință au observat o creștere a conținutului cantitativ de metan din atmosfera pământului.
Pe acest moment cantitatea aproximativă de CH 4 este estimată la 1,8 părți per milion. În ciuda faptului că această cifră este de 200 de ori mai mică decât prezența dioxid de carbon, există o conversație între oamenii de știință despre risc posibil reținând căldura radiată de planetă.
Datorită puterii calorice excelente a „gazului de mlaștină”, este folosit nu numai ca materie primă în implementarea sintezei chimice, ci și ca sursă de energie.
De exemplu, diverse cazane pe gaz, coloane concepute pentru un sistem individual de încălzire în case particulare și cabane de țară.
O astfel de opțiune de încălzire autonomă este foarte benefică pentru proprietari, nu este asociată cu accidente care apar sistematic la sisteme de incalzire. Datorită unui cazan pe gaz care funcționează cu acest tip de combustibil, 15-20 de minute sunt suficiente pentru a încălzi complet o cabană cu două etaje.

Concluzie
Metanul, ale cărui formule structurale și moleculare au fost date mai sus, este sursă naturală energie. Datorită faptului că conține doar un atom de carbon și atomi de hidrogen, ecologistii recunosc siguranța ecologică a acestei hidrocarburi saturate.
În condiții standard (temperatura aerului 20 grade Celsius, presiune 101325 Pa), această substanță este gazoasă, netoxică, insolubilă în apă.
Dacă temperatura aerului scade la -161 de grade, metanul este comprimat, care este utilizat pe scară largă în industrie.
Metanul are un impact asupra sănătății umane. Nu este o substanță otrăvitoare, ci este considerată un gaz asfixiant. Există chiar norme limitative (MPC) pentru conținutul acestei substanțe chimice în atmosferă.
De exemplu, munca în mine este permisă numai în cazurile în care cantitatea sa nu depășește 300 de miligrame pe metru cub. Analizând caracteristicile structurale ale acestei substanțe organice, putem concluziona că este similară din punct de vedere chimic și proprietăți fizice cu toți ceilalți reprezentanți ai clasei de hidrocarburi saturate (limitatoare).
Am analizat formulele structurale, structura spațială a metanului. care pornește „gaz de mlaștină”, are un total formulă moleculară CnH2n+2.
Atomul de carbon din molecula de metan se află în starea de hibridizare sp3.Ca urmare a suprapunerii a patru orbitali hibrizi ai atomului de carbon cu orbitalii s ai atomilor de hidrogen, se formează o moleculă de metan foarte puternică.
Gazul metan este incolor și inodor, mai ușor decât aerul, ușor solubil în apă.Hidrocarburile saturate pot arde, formând monoxid de carbon (IV) și apă. Metanul arde cu o flacără albăstruie pal: CH4 + 2O2 \u003d 2H2O
Într-un amestec cu aer (sau oxigen, mai ales într-un raport de 1:2 în volum, după cum se poate observa din ecuația reacției), metanul formează amestecuri explozive, prin urmare, este periculos atât în viața de zi cu zi (scurgere de gaz prin robinete) iar in mine.In cazul metanului de ardere incompleta se formeaza funingine.Deci se obtine in conditii industriale.In prezenta catalizatorilor, in timpul oxidarii metanului se obtine alcool metilicși formaldehidă
Cu încălzire puternică, metanul se descompune conform ecuației: CH4 \u003d C + 2H2
În cuptoarele cu un design special, descompunerea metanului poate fi realizată într-un produs intermediar, acilenă:
2CH4=C2H2+3H2
Metanul se caracterizează prin reacții de substituție.La lumină sau la temperatură obișnuită, halogenii - clorul și bromul - deplasează treptat (în etape) hidrogenul din molecula de metan, formând așa-numiții derivați de halogen.Atomii de clor înlocuiesc atomii de hidrogen din ea cu formarea unui amestec de diferiți compuși:
CH3Cl-clormetan (clorură de metil), CH2Cl2-diclormetan, CHCl3-triclormetan, CCl4-tetraclormetan
Din acest amestec, fiecare compus poate fi izolat.Cloroformul și tetraclormetanul sunt importanți ca solvenți pentru rășini, grăsimi, cauciuc și alte substanțe organice.
Formarea derivaților de halogen ai metanului are loc printr-un mecanism de radical liber în lanț.Sub acțiunea luminii, moleculele de clor se descompun în radicali anorganici: Cl2 \u003d 2Cl
Radicalul anorganic Cl extrage un atom de hidrogen cu un electron din molecula de metan, formând HCI și radicalul liber CH3 H H
H:C_| H+CI=H:C+HCI
h| H
Radicalul liber interacționează cu molecula de clor Cl2, formând un derivat de halogen și un radical de clor:
CH3+Cl_| CI=CH3-CI+CI
Metanul la temperatură normală este mai rezistent la acizi, alcaline și mulți agenți oxidanți, însă reacţionează cu acidul azotic:
CH4+HNO3=CH3NO2+H2O
nitrometan
Metanul nu este capabil de reacții de adiție, deoarece toate valențele din molecula sa sunt saturate.
Reacțiile de substituție de mai sus sunt însoțite de ruperea legăturilor C-H. Cu toate acestea, sunt cunoscute procese în care are loc nu numai scindarea legăturilor CH, ci și lanțul de atomi de carbon (pentru omologii metanului).Aceste reacții au loc la temperaturi ridicate și în prezența catalizatorilor, de exemplu:
C4H10+H2 - proces de dehidrogenare
C4H10-|
C2H6 + C2H4 fisurare
Obține metan.
Metanul este larg răspândit în natură.Este principalul parte integrantă multe gaze combustibile, atât naturale (90-98%), cât și artificiale, eliberate în timpul distilării uscate a lemnului, turbei, cărbunelui, precum și cracarea petrolului
Metanul este emis din fundul mlaștinilor și din straturile de cărbune din mine, unde se formează prin descompunere lentă. reziduuri vegetale fără acces la aer, motiv pentru care metanul este adesea numit gaz de mlaștină sau ceniu
În condiții de laborator, metanul se obține prin încălzirea unui amestec de acetat de sodiu cu hidroxid de sodiu:
200*C
CH3|COONa +NaO|H=Na2CO3 + CH4|
sau când carbura de aluminiu interacționează cu apa:
Al4C3 +12H2O=4Al(OH)3 +3CH4|
În acest din urmă caz, metanul este foarte pur.
Metanul poate fi obtinut din substante simple prin incalzire in prezenta unui catalizator: Ni
C+2H2=CH4
La fel și sinteza bazată pe apă gazoasă
Ni
CO+3H2=CH4+H2O
Omologii metanului, precum metanul, se obțin în condiții de laborator prin calcinarea sărurilor acizilor organici corespunzători cu alcalii.O altă metodă este reacția Wurtz, adică. încălzirea derivaților monohalogen cu sodiu metalic, de exemplu
C2H5 |Br+2Na+Br|C2H5= C2H5-C2H5+2NaBr
În tehnica de producere a benzinei sintetice (un amestec de hidrocarburi care conține 6-10 atomi de carbon), sinteza este utilizată din monoxid de carbon (II) și hidrogen în prezența unui catalizator (compuși de cobalt) și la presiune ridicată.Procedeul poate fi exprimat prin ecuația:
200*С
nCO+(2n+1)H2=CnH2n+2+nH2O
Aplicarea alcanilor
Datorită puterii calorice ridicate, metanul este consumat în cantități mari ca combustibil (în gazele de uz casnic și în industrie. Substanțele obținute din acesta sunt utilizate pe scară largă: hidrogen, acilenă, funingine. Servește ca materie primă pentru producerea de formaldehidă, alcool metilic, precum și diverse produse sintetice
De mare importanță industrială este oxidarea hidrocarburilor de parafină cu un număr de atomi de carbon de 20-25. În acest fel se obțin acizi grași sintetici cu lungimi diferite de lanț, care sunt utilizați pentru producerea de săpunuri, diverși detergenți, lubrifianți, lacuri. si emailuri.
Hidrocarburile lichide sunt folosite drept combustibil (fac parte din benzină și kerosen).Alcanii sunt utilizați pe scară largă în sinteza organică.
Proprietăți fizico-chimice metan.
Impurități periculoase în aerul minei
Impuritățile toxice din aerul minei includ monoxid de carbon, oxizi de azot, dioxid de sulf și hidrogen sulfurat.
Monoxid de carbon (CO) - gaz incolor, insipid și inodor, cu o greutate specifică de 0,97. Arde și explodează la o concentrație de 12,5 până la 75%. Temperatura de aprindere, la o concentratie de 30%, 630-810 0 C. Foarte toxic. Concentrație letală - 0,4%. Concentrație admisăîn minele - 0,0017%. Principalul ajutor în caz de otrăvire este respirația artificială în lucrul cu aer proaspăt.
Sursele de monoxid de carbon sunt explozia, funcționarea motorului combustie interna, incendii de mine și explozii de metan și praf de cărbune.
oxizi de azot (NO) Sunt de culoare maro și au un miros înțepător caracteristic. Foarte otrăvitoare, provoacă iritații ale mucoaselor tractului respirator și ale ochilor, edem pulmonar. Concentrația letală, cu inhalare pe termen scurt, este de 0,025%. Conținutul limitator de oxizi de azot din aerul minei nu trebuie să depășească 0,00025% (în termeni de dioxid - NO 2). Pentru dioxid de azot - 0,0001%.
Dioxid de sulf (SO2)- incolor, cu miros puternic iritant si gust acru. Mai greu decât aerul de 2,3 ori. Foarte toxic: irită membranele mucoase ale căilor respiratorii și ochilor, provoacă inflamarea bronhiilor, umflarea laringelui și a bronhiilor.
Dioxidul de sulf se formează în timpul exploziilor (în rocile sulfuroase), incendiilor și este eliberat din roci.
Conținutul limitator din aerul minei este de 0,00038%. O concentrație de 0,05% pune viața în pericol.
Hidrogen sulfurat (H2S)- gaz fara culoare, cu gust dulceag si miros de oua putrezite. Gravitație specifică- 1.19. Hidrogenul sulfurat arde, iar la o concentrație de 6% explodează. Foarte toxic, irită mucoasele tractului respirator și ochilor. Concentrație letală - 0,1%. Primul ajutor în caz de otrăvire - respirație artificială pe un curent proaspăt, inhalare de clor (folosind o batistă umezită cu înălbitor).
Hidrogenul sulfurat este eliberat din roci și izvoare minerale. Se formează în timpul descompunerii materiei organice, incendiilor miniere și exploziilor.
Hidrogenul sulfurat este foarte solubil în apă. Acest lucru trebuie luat în considerare atunci când se deplasează oamenii de-a lungul lucrărilor abandonate.
Conținutul admis de H 2 S în aerul de mină nu trebuie să depășească 0,00071%.
Cursul 2
Metanul și proprietățile sale
Metanul este componenta principală, cea mai comună a cenionului. În literatura de specialitate și în practică, metanul este cel mai adesea identificat cu grindă. În ventilația minelor, acest gaz primește cea mai mare atenție datorită proprietăților sale explozive.
Proprietățile fizice și chimice ale metanului.
Metan (CH4) este un gaz incolor, insipid și inodor. Densitate - 0,0057. Metanul este inert, dar prin deplasarea oxigenului (deplasarea are loc în următoarea proporție: 5 unități de volum de metan înlocuiesc 1 unitate de volum de oxigen, adică 5:1), poate fi periculos pentru oameni. Se aprinde la o temperatură de 650-750 0 C. Metanul formează cu aerul amestecuri combustibile şi explozive. Când conținutul din aer este de până la 5-6%, arde la o sursă de căldură, de la 5-6% la 14-16% - explodează, mai mult de 14-16% - nu explodează. Cea mai mare putere explozie la o concentrație de 9,5%.
Una dintre proprietățile metanului este întârzierea fulgerului după contactul cu o sursă de aprindere. Se numește timpul de întârziere a blițului inducţie perioadă. Prezența acestei perioade creează condiții pentru prevenirea focarelor în timpul exploziilor, folosind explozivi de siguranță (BB).
Presiunea gazului la locul exploziei este de aproximativ 9 ori mai mare decât presiunea inițială a amestecului gaz-aer înainte de explozie. În acest caz, presiunea de până la 30 lași mai sus. Diverse obstacole în lucrare (îngustări, proeminențe etc.) contribuie la creșterea presiunii și la creșterea vitezei de propagare a undei de explozie în lucrările miniere.