Die Funktion von Proteinen wird von Aktin und Myosin übernommen. Molekulare Mechanismen der Muskelkontraktion
Lesen Sie auch
BIOCHEMIE DES SPORTS
Struktur und Funktion der Muskelfaser
Es gibt 3 Arten von Muskelgewebe:
Gestreiftes Skelett;
Gestreiftes Herz;
Glatt.
Funktionen des Muskelgewebes.
Quergestreiftes Skelettgewebe – macht etwa 40 % des gesamten Körpergewichts aus.
Seine Funktionen:
dynamisch;
statisch;
Rezeptor (z. B. Propriozeptoren in Sehnen – intrafusale Muskelfasern (fusiform));
Ablagerung - Wasser, Mineralien, Sauerstoff, Glykogen, Phosphate;
Thermoregulierung;
emotionale Reaktionen.
Gestreiftes Herzmuskelgewebe.
Die Hauptfunktion ist die Injektion.
Glatte Muskulatur – bildet die Wand von Hohlorganen und Blutgefäßen.
Seine Funktionen: - Aufrechterhaltung des Drucks in Hohlorganen; - hält den Blutdruck aufrecht;
Sorgt für die Bewegung des Inhalts durch den Magen-Darm-Trakt und die Harnleiter.
Chemische Zusammensetzung von Muskelgewebe
Die chemische Zusammensetzung des Muskelgewebes ist sehr komplex und verändert sich unter dem Einfluss verschiedener Faktoren. Die durchschnittliche chemische Zusammensetzung von gut vorbereitetem Muskelgewebe beträgt: Wasser – 70–75 % der Gewebemasse; Proteine – 18–22 %; Lipide – 0,5–3,5 %; stickstoffhaltige Extraktstoffe - 1,0-1,7 %; stickstofffreie Extraktstoffe – 0,7–1,4 %; Mineralien - 1,0-1,5 %.
Etwa 80 % des Trockenrückstands von Muskelgewebe bestehen aus Proteinen, deren Eigenschaften maßgeblich die Eigenschaften dieses Gewebes bestimmen.
MYOFIBRILLEN – kontraktile Elemente der Muskelfaser. Feinstruktur der Myofibrillen
Myofibrillen sind dünne Fasern (ihr Durchmesser beträgt 1–2 Mikrometer, die Länge 2–2,5 Mikrometer), die zwei Arten von kontraktilen Proteinen (Protofibrillen) enthalten: dünne Aktinfilamente und doppelt so dicke Myosinfilamente. Sie sind so angeordnet, dass sich um die Myosinfilamente 6 Aktinfilamente und um jedes Aktinfilament 3 Myosinfilamente befinden. Myofibrillen werden durch Z-Membranen in separate Abschnitte unterteilt – Sarkomere, in deren mittlerem Teil sich überwiegend Myosinfilamente befinden, Aaktinfilamente sind an Z-Membranen an den Seiten des Sarkomers befestigt. (Die unterschiedliche Fähigkeit von Aktin und Myosin, Licht zu brechen, verleiht dem Muskel im Ruhezustand im Lichtmikroskop ein gestreiftes Aussehen.)
Aktinfilamente machen etwa 20 % des Trockengewichts der Myofibrillen aus. Aktin besteht aus zwei Proteinformen: 1) kugelförmiger Form – in Form kugelförmiger Moleküle und 2) stäbchenförmigen Tronomyosinmolekülen, die in Form doppelsträngiger Helices zu einer langen Kette verdreht sind. Entlang dieses doppelten Aktinfilaments enthält jede Windung 14 Moleküle globuläres Aktin (7 Moleküle auf beiden Seiten), wie eine Perlenkette, sowie Ca2+-Bindungsstellen. Diese Zentren enthalten ein spezielles Protein (Troponin), das an der Bildung von Aktin-Myosin-Bindungen beteiligt ist.
Myosin besteht aus parallelen Proteinfilamenten (dieser Teil ist das sogenannte leichte Meromyosin). An beiden Enden befinden sich seitlich verlaufende Hälse mit Verdickungen – Köpfen (dieser Teil ist schweres Meromyosin), dank derer sich Querbrücken zwischen Myosin und Aktin bilden.
Physikalisch-chemische Eigenschaften und strukturelle Organisation kontraktiler Proteine (Myosin und Aktin). Tropomyosin und Troponin.
Zu den myofibrillären Proteinen gehören die kontraktilen Proteine Myosin, Aktin und Aktomyosin sowie die regulatorischen Proteine Tropomyosin, Troponin sowie Alpha- und Beta-Aktin. Myofibrilläre Proteine sorgen für die Muskelkontraktionsfunktion.
Myosin ist eines der wichtigsten kontraktilen Muskelproteine und macht etwa 55 % der gesamten Muskelproteine aus. Es besteht aus dicken Fäden (Filamenten) von Myofibrillen. Das Molekulargewicht dieses Proteins beträgt etwa 470.000. Das Myosinmolekül hat einen langen fibrillären Teil und kugelförmige Strukturen (Köpfe). Der fibrilläre Teil des Myosinmoleküls hat eine doppelhelikale Struktur. Das Molekül besteht aus sechs Untereinheiten: zwei schweren Polypeptidketten (Molekulargewicht 200.000) und vier leichten Ketten (Molekulargewicht 1500–2700), die sich im kugelförmigen Teil befinden. Die Hauptfunktion des fibrillären Teils des Myosinmoleküls ist die Fähigkeit, wohlgeordnete Bündel von Myosinfilamenten oder dicken Protofibrillen zu bilden. Das aktive Zentrum der ATPase und das Aktin-Bindungszentrum befinden sich an den Köpfen des Myosinmoleküls und sorgen so für die ATP-Hydrolyse und die Interaktion mit Aktinfilamenten.
Aktin ist das zweite kontraktile Muskelprotein, das die Grundlage dünner Filamente bildet. Zwei seiner Formen sind bekannt: globuläres G-Aktin und fibrilläres F-Aktin. Kugelförmiges Aktin ist ein kugelförmiges Protein mit einem Molekulargewicht von 42.000. Es macht etwa 25 % der Gesamtmasse des Muskelproteins aus. In Gegenwart von Magnesiumkationen unterliegt Aktin einer nichtkovalenten Polymerisation und bildet ein unlösliches Filament in Form einer Helix, genannt F-Aktin. Beide Aktinformen besitzen keine enzymatische Aktivität. Jedes G-Actin-Molekül ist in der Lage, ein Calciumion zu binden, das eine Rolle spielt wichtige Rolle bei der Einleitung einer Kontraktion. Darüber hinaus bindet das G-Aktin-Molekül fest ein Molekül ATP oder ADP. Die Bindung von ATP durch G-Actin geht üblicherweise mit seiner Polymerisation unter Bildung von F-Actin und der gleichzeitigen Spaltung von ATP in ADP und Phosphat einher. ADP bleibt an fibrilläres Aktin gebunden.
Tropomyosin ist ein Strukturprotein des Aktinfilaments, bei dem es sich um ein längliches Molekül in Form eines Strangs handelt. Seine beiden Polypeptidketten scheinen sich um Aktinfilamente zu wickeln. An den Enden jedes Tropomyosinmoleküls befinden sich Proteine des Troponinsystems, deren Vorhandensein für quergestreifte Muskeln charakteristisch ist.
Troponin ist regulatorisches Protein Aktinfilament. Es besteht aus drei Untereinheiten: TnT, Tnl und TnS. Troponin T (TnT) vermittelt die Bindung dieser Proteine an Tropomyosin. Troponin I (Tnl) blockiert (hemmt) die Wechselwirkung von Aktin mit Myosin. Troponin C (TnC) ist ein kalziumbindendes Protein mit einer Struktur und Funktion, die dem weit verbreiteten, natürlich vorkommenden Protein Calmodulin ähnelt. Troponin C bindet wie Calmodulin vier Calciumionen pro Proteinmolekül und hat ein Molekulargewicht von 17.000. In Gegenwart von Calcium verändert sich die Konformation von Troponin C, was zu einer Veränderung der Position von Tn im Verhältnis zu Aktin führt bei der Öffnung des Interaktionszentrums zwischen Aktin und Myosin.
Somit besteht das dünne Filament der Myofibrille der quergestreiften Muskulatur aus F-Aktin, Tropomyosin und drei Troponin-Komponenten. Zusätzlich zu diesen Proteinen ist das Protein Aktin an der Muskelkontraktion beteiligt. Es befindet sich in der Z-Linien-Zone, an der die Enden der F-Aktin-Moleküle der dünnen Filamente der Myofibrillen befestigt sind.
Die wichtigsten Muskelproteine sind Aktin und Myosin.
Die Masse der Muskelfibrillen besteht aus Wasser (75 %) und Proteinen (mehr als 20 %). Die Hauptvertreter der Muskelproteine sind Aktin und Myosin, wovon Myosin 55 % ausmacht.
Dieses Protein (MW 460 kDa) hat die Form eines asymmetrischen Hexamers. Das Myosinmolekül hat einen länglichen Teil, der aus zwei übereinander gewundenen Helices besteht. Jede Helix hat an einem Ende einen kugelförmigen Kopf. Das Hexamer (6 Untereinheiten) umfasst ein Paar schwere Ketten (MG 200 kDa) und zwei Paare leichte Ketten (MG 15–27 kDa). Schwere Ketten bestehen aus einer linear verlängerten, a-helikalen C-terminalen Domäne (1300 Aminosäurereste) und einer globulären N-terminalen Domäne (ca. 800 Aminosäurereste). Zwei a-helikale Domänen, die zu zwei schweren Ketten gehören, bilden zusammen eine stabile Superhelical-Struktur mit zwei kugelförmigen Köpfen (Abb. 17.8).
Das vollständige Myosinmolekül enthält außerdem 4 relativ kleine Polypeptidketten (MW 16–24 kDa), die mit kugelförmigen Köpfen verbunden sind. Im Gegensatz zu Aktin, Myosin Skelettmuskeln hat enzymatische Aktivität und katalysiert die Hydrolyse von ATP durch Bindung an F-Aktin. Alle leichten Ketten binden Ca 2+, werden durch eine spezielle Kinase phosphoryliert und sind im Allgemeinen an der Regulierung der Aktivität der Myosin-ATPase beteiligt.
Abb.17.8. Schematische Darstellung der Struktur dicker Filamente. Die räumliche Konfiguration von Myosin wird gezeigt.
Das Myosinmolekül enthält mehrere funktionell wichtige Regionen. Nicht weit von der Mitte der linearen Superspiralzone entfernt befindet sich eine Stelle, an der das Molekül durch Trypsin abgebaut wird. Dieses Enzym schneidet das Molekül sozusagen in zwei Teile: Der eine enthält kugelförmige Köpfe und einen Teil der Superspiralzone; der andere besteht aus dem verbleibenden Teil der superspiralisierten Zone am C-Terminus. Der Teil, der den Kopf enthält, wird „schweres Meromyosin“ (MW 350 kDa) genannt. Das C-terminale Fragment wird „leichtes Meromyosin“ (MW 125 kDa) genannt.
Die Bedeutung des Wirkorts von Trypsin auf dem Myosinmolekül besteht darin, dass er überraschenderweise mit der Stelle im Myosinmolekül zusammenfällt, die als eine Art Scharnier fungiert und die chemische Energie von ATP in ein rein mechanisches Phänomen der Kontraktion – Entspannung – umwandelt. Eine weitere wichtige Stelle, die eine ähnliche Rolle spielt, unterliegt der Wirkung eines anderen proteolytischen Enzyms, Papain. Papain schneidet das Myosinmolekül sehr nahe an den Kugelköpfen. Es stellt sich heraus, dass es sich um zwei Fragmente handelt, und es ist das Fragment, in dem sich der Kopf befindet, das ATPase-Aktivität aufweist.
Aus Myosin werden dicke Filamente gebildet. Das dicke Filament besteht aus etwa 400 Myosinmolekülen, 200 auf jeder Seite der M-Linie. Diese Moleküle werden durch das C-Protein (das „Clip“-Protein), das M-Linien-Protein und hydrophobe Wechselwirkungen untereinander zusammengehalten. An einem Punkt am Ort der Trypsinwirkung weicht schweres Meromyosin von der Hauptachse des dicken Filaments ab und bildet sich scharfe Ecke. Dadurch nähert sich der Kopf dem Aktin dünner Filamente, die im Raum zwischen den dicken Filamenten lokalisiert sind. Das wichtigste molekulare Ereignis vor der Muskelkontraktion ist die regulierte Bindung von Myosinköpfen an dünne Filamente Aktin. Anschließend kommt es zu einer schnellen Konformationsänderung des Myosins um die bereits erwähnten eigentümlichen „Scharnierpunkte“ und das gebundene Aktin bewegt sich in Richtung der M-Linie.
Der Anteil von Aktin an der Gesamtmasse der Muskelproteine beträgt 25 %. Dabei handelt es sich um ein kugelförmiges Proteinmonomer mit einem Molekulargewicht von 43 kDa, das als G-Aktin bezeichnet wird. In Gegenwart von Magnesiumionen und der physiologischen Ionenkonzentration in Lösung polymerisiert G-Actin zu einem unlöslichen Filament, das F-Actin genannt wird (Abb. 17.9). Zwei F-Aktin-Polymere wickeln sich helixförmig umeinander. So entsteht die Grundstruktur des dünnen Fadens. Die F-Aktinfaser hat eine Dicke von 6–7 nm und eine sich wiederholende Struktur mit einer Periodizität von 35,5 nm. Weder G- noch F-Actin haben irgendeine katalytische Aktivität.
Reis. 17.9. Struktur von F-Aktin
Jede G-Aktin-Untereinheit verfügt über eine ATP/ADP-Bindungsstelle, die an der Polymerisation des dünnen Filaments beteiligt ist. Nach Abschluss der Polymerisation wird das dünne Filament mit einem Protein – b-Actinin – beschichtet und stabilisiert. Zusätzlich zur Nukleotidbindungsstelle verfügt jedes G-Aktin-Molekül über eine hochaffine Myosin-Kopfbindungsstelle. Seine Arbeit in der Skelett- und Herzmuskulatur wird durch zusätzliche dünne Filamentproteine reguliert. Somit steuern zusätzliche Proteine den kontraktilen Zyklus.
Die Proteinzusammensetzung des Muskelgewebes ist sehr komplex. Es wird seit langem von vielen Wissenschaftlern untersucht. Der Begründer der russischen Biochemie, A. Ya. Danilevsky, vermittelte bei der Untersuchung der Proteine des Muskelgewebes eine korrekte Vorstellung von der physiologischen Rolle einer Reihe von Proteinen und der Bedeutung des in Myofibrillen enthaltenen kontraktilen Proteins Myosin.
Anschließend wurde Myosin von V. A. Engelhardt, I. I. Ivanov und anderen sowjetischen Wissenschaftlern untersucht. Der ungarische Wissenschaftler Szent-Georgyi leistete einen großen Beitrag zur Erforschung der Muskelkontraktion. Ein anderer ungarischer Wissenschaftler, Straub, entdeckte das Muskelprotein Aktin.
Die Untersuchung von Muskelgewebe sollte mit Proteinen beginnen, da sie etwa 80 % des Trockenrückstands von Muskelgewebe ausmachen. Entsprechend der morphologischen Struktur der Muskelfaser verteilen sich die Proteine wie folgt:
Aus dem obigen Diagramm ist ersichtlich, dass die Proteinzusammensetzung des Muskelgewebes sehr vielfältig ist. Sarkoplasma enthält vier Proteine: Myogen, Myoalbumin, Globulin X und Myoglobin. Myofibrillen enthalten einen Komplex aus Aktin und Myosin namens Actomyosin. Alle sarkoplasmatischen Proteine werden als intrazellulär bezeichnet, und Sarkolemma-Proteine werden als extrazellulär bezeichnet. Die Kerne enthalten Nukleoproteine und das Sarkolemma enthält Kollagen und Elastin. Wenn man bedenkt, dass Muskelgewebe darüber hinaus eine erhebliche Menge verschiedener Enzyme enthält und jedes davon ein spezielles Protein ist, dann stellt sich die Proteinzusammensetzung des Muskelgewebes als noch komplexer heraus.
Myosin
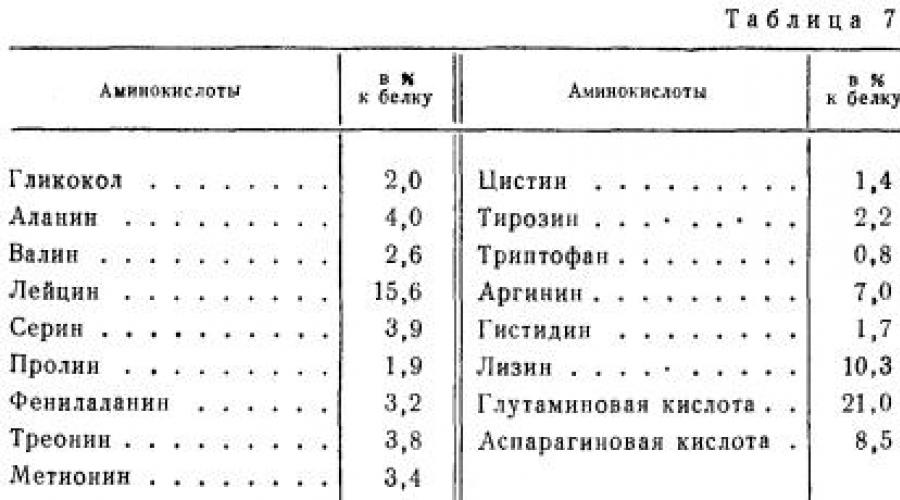
Das Hauptprotein des Muskelgewebes ist Myosin. Es macht fast die Hälfte aller Muskelgewebeproteine aus und kommt in den Muskeln aller Säugetiere, Vögel und Fische vor. Von Nährwert es ist ein vollständiges Protein. In der Tabelle Abbildung 7 zeigt die Aminosäurezusammensetzung von Rindermyosin.

Myosin wurde von sowjetischen Biochemikern eingehend untersucht und entdeckte, dass es sich nicht nur um ein Strukturprotein des Muskelgewebes handelt, also um ein Protein, das am Zellaufbau beteiligt ist, sondern auch um ein Enzym – Adenosintriphosphatase, das die Reaktion der ATP-Hydrolyse katalysiert. Dabei wird ADP (Adenosindiphosphorsäure) und Phosphorsäure gebildet und eine große Menge Energie freigesetzt, die für die Muskelarbeit genutzt wird.
Myosin wurde in reiner kristalliner Form erhalten. Molekulargewicht Es ist sehr groß, etwa 1,5 Millionen. Kristallines Myosin ist in völliger Abwesenheit von Salzen vollkommen wasserlöslich. Es reicht jedoch aus, dem Wasser eine unbedeutende Menge eines beliebigen Salzes, beispielsweise Natriumchlorid, zuzusetzen, da es seine Fähigkeit zur Lösung vollständig verliert und bereits bei einer Natriumchloridkonzentration von etwa 1 % eine Auflösung eintritt. Gegenüber Salzen, beispielsweise Ammoniumsulfat, verhält sich Myosin jedoch wie ein typisches Globulin.
Bei der Extraktion von Fleischproteinen mit Wasser geht Myosin nicht in Lösung. Bei der Verarbeitung von Fleisch mit Salzlösungen kommt es im Salzextrakt vor. Wenn eine Salzlösung von Myosin mit Wasser verdünnt wird, nimmt die Salzkonzentration ab und Myosin beginnt auszufallen. Myosin wird ausgesalzen, wenn es vollständig mit Natriumchlorid und Magnesiumsulfat gesättigt ist (das Aussalzen erfolgt mit kristallinem Salz, da sonst eine vollständige Sättigung nicht erreicht werden kann).
Der isoelektrische Punkt von Myosin liegt bei pH 5,4-5,5.
Myosin hat die Eigenschaft, mit ihm besondere Bindungen einzugehen verschiedene Stoffe, vor allem mit Proteinen, unter Bildung von Komplexen. Eine besondere Rolle bei der Muskelaktivität spielt der Komplex aus Myosin und Aktin – Actomyosin.
Aktin und Aktomyosin
Das Aktinprotein kann in zwei Formen vorliegen: fibrillär und globulär. Im ruhenden Muskel liegt Aktin in fibrillärer Form vor; bei Muskelkontraktion wird es kugelig. Sehr wichtig Adenosintriphosphorsäure und -salze wirken bei dieser Umwandlung mit.
Muskelgewebe enthält 12-15 % Aktin. Bei längerer Extraktion mit Salzlösungen geht es in Lösung; bei kurzfristiger Extraktion verbleibt es im Stroma. Das Molekulargewicht von Aktin beträgt etwa 75.000.
Wenn Lösungen von Aktin und Myosin gemischt werden, entsteht ein Komplex namens Aktomyosin, aus dem hauptsächlich Myofibrillen aufgebaut sind. Dieser Komplex zeichnet sich durch eine hohe Viskosität aus und kann bei bestimmten Konzentrationen von Kalium- und Magnesiumionen (0,05 m KCl > und 0,001 m MgCl2) in Gegenwart von Adenosintriphosphat stark kontrahieren. Bei höheren Salzkonzentrationen (0,6 m KCl) zerfällt Actomyosin bei Zugabe von ATP in Actin und Myosin. Die Viskosität der Lösung nimmt merklich ab.
Laut Szent-Georgia liegt die Kompression von Actomyosin unter dem Einfluss von ATP der Kontraktion lebender Muskeln zugrunde.
Actomyosin ist wie ein echtes Globulin wasserunlöslich. Bei der Verarbeitung von Fleisch mit Kochsalzlösungen gelangt je nach Extraktionsdauer Actomyosin mit einem unbestimmten Gehalt an Actin in die Lösung.
Globulin X
Muskelgewebe enthält etwa 20 % Globulin X des Gesamtproteins. Es ist ein typisches Globulin, das heißt, es löst sich nicht in Wasser, sondern in Salzlösungen mittlerer Konzentration; Fällt aus Lösungen bei halber Sättigung mit Ammoniumsulfat (1 Volumen Proteinlösung und 1 Volumen gesättigter Ammoniumsulfatlösung) aus, bei vollständig gesättigtem Natriumchlorid.
Miogen
Muskelgewebe enthält etwa 20 % Myogen des Gesamtproteins. Es kann nicht als typisches Albumin oder Globulin eingestuft werden, da es sich in Wasser löst, bei Sättigung mit Natriumchlorid und Magnesiumsulfat nicht ausreichend ausgesalzen wird (kristallines Salz) und gleichzeitig mit Ammoniumsulfat zu 2/3 ausgefällt wird der Sättigung (1 Volumenteil Proteinlösung und 2 Volumenteile gesättigte Ammoniumsulfatlösung). Dieses Protein wurde in kristalliner Form erhalten. Das Molekulargewicht von Myogen beträgt 150.000.
V. A. Engelhardt entdeckte die Fähigkeit von Myogen, eine der wichtigsten Reaktionen im Prozess der Glykolyse von Muskelgewebe zu katalysieren. Diese Entdeckung war die erste, die zeigte, dass Strukturproteine, also Proteine, die am Aufbau von Geweben beteiligt sind, enzymatische Aktivität haben können.
Myoalbumin
Muskelgewebe enthält etwa 1-2 % Myoalbumin des Gesamtproteins. Es ist ein typisches Albumin, d. h. es löst sich in Wasser und wird bei Sättigung nicht durch Natriumchlorid, sondern durch Ammoniumsulfat ausgefällt.
Myoglobin
Myoglobin ist ein komplexes Chromoprotein mit einem Molekulargewicht von 16.900. Bei der Hydrolyse zerfällt es in das Globin-Protein und die Nicht-Protein-Häm-Gruppe. Myoglobin färbt die Muskeln rot; Es unterscheidet sich vom Hämoglobin durch seinen Proteinanteil; Ihre Prothesengruppe ist dieselbe.
Bei der Oxidation wandelt sich Häm in Hämatin um, und zwar in Gegenwart Salzsäure- in Hämin. Der Hämingehalt kann zur Beurteilung der Myoglobinmenge im Muskelgewebe herangezogen werden.
Hämingehalt in den Muskeln des Großen Vieh reicht von 42 bis 60 mg pro 100 g Gewebe; In den Muskeln von Schweinen gibt es viel weniger davon – von 22 bis 42 mg pro 100 g Gewebe, daher sind sie weniger gefärbt.
Myoglobin verfügt wie Blutfarbstoffe über ein charakteristisches Absorptionsspektrum.
Das Prinzip der Aufnahme von Absorptionsspektren farbiger Substanzen, insbesondere von Fleisch- und Blutfarbstoffen, besteht darin, dass die durch eine Pigmentlösung hindurchtretende Lichtenergie von dieser Lösung absorbiert wird. Dabei kommt es zur sogenannten Absorption (Absorption) von Licht, die mit einem Spektroskop nachgewiesen werden kann.
Die charakteristischen Absorptionsbanden für Muskelgewebe und Blutfarbstoffe liegen zwischen 400 und 700 mm. In diesem Intervall werden Wellen von unserem Auge wahrgenommen und wir können mit einem Spektroskop dunkle Bänder im Spektrum erkennen, die durch die Absorption von Licht einer bestimmten Wellenlänge entstehen.

Die Absorption von Licht durch farbige Substanzen kann mit einem Spektralphotometer quantifiziert werden. Die erzielten Ergebnisse werden in der Regel grafisch dargestellt. In diesem Fall ist die Wellenlänge des Lichts auf der Abszissenachse und der Prozentsatz des durch die Lösung durchgelassenen Lichts auf der Ordinatenachse aufgetragen. Je weniger Licht durchgelassen wurde, desto mehr wurde von der farbigen Substanz absorbiert. Die Gesamtlichtdurchlässigkeit der Lösung wird mit 100 % angenommen.
In Abb. Abbildung 10 zeigt die Absorption (Absorption) von Licht durch eine Lösung von Oxymyoglobin; Es zeigt, dass Oxymyoglobin zwei ausgeprägte charakteristische Absorptionsbanden im sichtbaren Bereich des Spektrums aufweist, d. h. zwei Bereiche, in denen es das geringste Licht durchlässt und daher das meiste Licht absorbiert. Die Maxima dieser Abschnitte liegen bei zwei Wellenlängen; λ 585 mmk und λ 545 mmk,
In Abb. Abbildung 11 zeigt zum Vergleich eine spektrophotometrische Kurve von Oxyhämoglobin.
Myoglobin hat eine größere Fähigkeit, Sauerstoff zu binden als Bluthämoglobin. Über Myoglobin wird das Muskelgewebe mit Sauerstoff versorgt. Arbeitende Muskeln enthalten mehr Myoglobin, da in ihnen die Oxidation stärker erfolgt. Es ist bekannt, dass die Beinmuskulatur stärker gefärbt ist als die Rückenmuskulatur; Auch die Muskeln arbeitender Ochsen sind stärker gefärbt als die von nicht arbeitenden Tieren. Dies macht sich besonders bei Vögeln bemerkbar, Brustmuskeln die, da sie nicht funktionieren, fast nicht bemalt sind.
Kollagen und Elastin
Kollagen und Elastin sind Bindegewebsproteine, die in Wasser und Salzlösungen unlöslich sind. Sie bilden das Sarkolemm – die dünnste Hülle der Muskelfaser.
Nukleoproteine
Nukleoproteine sind Proteine, die den Zellkern bilden. Charakteristisches Merkmal ihre Fähigkeit, sich in Lösungen schwacher Alkalien aufzulösen. Dies erklärt sich aus der Tatsache, dass ihr Molekül eine prosthetische Gruppe mit sauren Eigenschaften enthält.
Trennung von Muskelproteinen
Wenn Muskelgewebe mit Kochsalzlösungen mittlerer Konzentration behandelt wird, können seine Proteine in Stromaproteine und Plasmaproteine unterteilt werden. Das Stroma bezeichnet die in Kochsalzlösung unlösliche Strukturbasis des Muskelgewebes, die hauptsächlich aus sarkolemmalen Proteinen besteht (siehe Abbildung).

Die Löslichkeit intrazellulärer Proteine im Muskelgewebe variiert. Beispielsweise sind Actomyosin und Globulin X in Wasser unlöslich und werden durch Ammoniumsulfat und Natriumchlorid leichter aus Salzlösungen ausgefällt als Myogen. Myogen löst sich wie Myoalbumin in Wasser auf, unterscheidet sich jedoch durch seine Salzeigenschaften.
Die Löslichkeit von Muskelgewebeproteinen in Salzlösungen bei neutraler Reaktion und deren Ausfällung sind in der Tabelle angegeben. 8.

Beim Salzen, Kochen und anderen Arten der technologischen Verarbeitung von Fleisch gehen Eiweißstoffe verloren. Das Ausmaß der Proteinverluste ist auf ihre unterschiedliche Löslichkeit und Sedimentierbarkeit zurückzuführen.
Wenn man die Eigenschaften von Proteinen kennt, ist es möglich, Bedingungen auszuwählen, unter denen die Verluste minimal sind. Deshalb zu studieren angegebenen Eigenschaften Proteinen muss besondere Aufmerksamkeit geschenkt werden.
Studieren chemische Zusammensetzung Myofibrillen zeigten, dass dicke und dünne Filamente nur aus Proteinen bestehen.
Dicke Filamente bestehen aus Protein Myosin. Myosin ist ein Protein mit einem Molekulargewicht von etwa 500 kDa, das zwei sehr lange Polypeptidketten enthält. Diese Ketten bilden eine Doppelhelix, aber an einem Ende laufen diese Fäden auseinander und bilden eine kugelförmige Formation – einen Kugelkopf. Daher besteht das Myosinmolekül aus zwei Teilen – dem kugelförmigen Kopf und dem Schwanz. Das dicke Filament enthält etwa 300 Myosinmoleküle und auf einem Querschnitt des dicken Filaments finden sich 18 Myosinmoleküle. Myosinmoleküle in dicken Filamenten sind mit ihren Schwänzen verflochten, und ihre Köpfe ragen in einer regelmäßigen Spirale aus dem dicken Filament heraus. In den Myosinköpfen gibt es zwei wichtige Bereiche (Zentren). Einer von ihnen katalysiert die hydrolytische Spaltung von ATP, entspricht also dem aktiven Zentrum des Enzyms. Die ATPase-Aktivität von Myosin wurde erstmals von den russischen Biochemikern Engelhardt und Lyubimova entdeckt. Der zweite Abschnitt des Myosinkopfes sorgt während der Muskelkontraktion für die Verbindung dicker Filamente mit dem Protein dünner Filamente – Aktin. Die dünnen Filamente bestehen aus drei Proteinen: Aktin, Troponin Und Tropomyosin.
Das Hauptprotein dünner Filamente ist Aktin. Aktin ist ein kugelförmiges Protein mit einem Molekulargewicht von 42 kDa. Dieses Protein hat zwei wichtige Eigenschaften. Erstens zeigt es hohe Fähigkeit zu langen Ketten polymerisieren genannt fibrilläres Aktin(kann mit einer Perlenkette verglichen werden). Zweitens kann sich Aktin, wie bereits erwähnt, mit Myosinköpfen verbinden, was zur Bildung von Querbrücken oder Adhäsionen zwischen dünnen und dicken Filamenten führt.
Die Basis des dünnen Filaments ist eine Doppelhelix aus zwei Ketten fibrillären Aktins, die etwa 300 Moleküle globuläres Aktin enthält (wie zwei Perlenstränge, die zu einer Doppelhelix verdreht sind, wobei jede Perle kugelförmigem Aktin entspricht).
Ein weiteres dünnes Filamentprotein - Tropomyosin– hat auch die Form Doppelhelix, aber diese Helix besteht aus Polypeptidketten und ist viel kleiner als die Aktin-Doppelhelix. Tropomyosin befindet sich in der Furche der Doppelhelix des fibrillären Aktins.
Drittes dünnes Filamentprotein - Troponin- bindet sich an Tropomyosin und fixiert seine Position in der Aktinfurche, wodurch die Wechselwirkung von Myosinköpfen mit globulären Aktinmolekülen dünner Filamente blockiert wird.
5. Technologische Techniken zur Beschleunigung der Fleischreifung
Nach dem Lebensende des Tieres (Synthese) kommt es zu einem Komplex von Veränderungen im Fleisch, die durch Enzyme beeinflusst werden. Der Selbstzerfall von Gewebe beginnt unter dem Einfluss von Enzymen aus den Geweben selbst. Dieser Vorgang wird Autolyse genannt. Dabei kommt es zu Veränderungen im Muskel-, Binde- und Fettgewebe. Veränderungen im Muskelgewebe während der Lagerung wirken sich auf die Qualität des Fleisches aus.
Während des Lebens eines Tieres ist die Hauptfunktion des Muskelgewebes die Motorik, wodurch chemische Energie in mechanische Energie umgewandelt wird. Diese komplexen Transformationen erfolgen aufgrund biochemischer, physiologischer, physikalischer und thermodynamischer Prozesse.
Der biochemische Aspekt äußert sich in Veränderungen der Myofibrillen von Proteinen, vor allem Myosin und Aktin (80 % der Proteine). Während der Kontraktion verbindet sich fibrilläres Aktin mit Myosin. Es entsteht ein starker Actomyosin-Komplex, bei dem pro Myosinmolekül 2-3 Actinmoleküle vorhanden sind.
Der Energiemechanismus der Kontraktion ist eine Änderung der freien Energie, die beim Abbau von ATP entsteht. ATP-Aktivität besitzt das Protein Myosin, das sich beim Abbau von ATP mit Aktin verbindet und den Aktinomyosin-Komplex bildet, d. h. Es kommt zum Prozess der Totenstarre. In diesem Fall ist Myosin nicht nur ein Protein, sondern ein eigenes Enzym.
Die Phase der eigenen Reifung des Fleisches ist durch einen intensiven Abbau von Muskelglykogen und eine Anreicherung von Milchsäure sowie eine Veränderung seiner chemischen Zusammensetzung gekennzeichnet, aber auch Härte ist Teil des Autolyseprozesses.
Ein charakteristisches Merkmal von Rigor ist eine Abnahme der Wasserhaltekapazität des Muskelgewebes, wodurch immer eine Absonderung von Muskelsaft beobachtet wird. Von äußere Zeichen Rigorisiertes Fleisch hat eine größere Elastizität; beim Garen wird es übermäßig zäh und aufgrund einer verminderten Wasserhaltefähigkeit wird es weniger saftig. Im Muskelsteifheitszustand sind die Muskeln weniger anfällig für die Wirkung proteometischer Enzyme und Fleisch ist schlechter verdaulich.
Durch die Anreicherung von Milch-, Phosphor- und anderen Säuren im Fleisch steigt die Konzentration an Wasserstoffionen, wodurch der pH-Wert am Ende der Trockenheit auf 5,8 bis 5,7 und manchmal auch niedriger sinkt. In einer sauren Umgebung kommt es beim Abbau von ATP und Phosphorsäure zu einer teilweisen Anreicherung von anorganischem Phosphor.
Die Reifungsphase bestimmt maßgeblich die Intensität physikalisch-kolloidaler Prozesse und mikrostruktureller Veränderungen in Muskelfasern. Aufgrund einer Reihe von Gründen (Wirkung proteometischer Enzyme, Bildung autolytischer Abbauprodukte, saures Milieu) kommt es zum Abbau von Muskelfasern. Eine tiefe Zersetzung weist bereits auf eine tiefe Autolyse hin, die häufiger beobachtet wird, wenn Fleisch verdirbt. Während der Phase des sanften Übergangs von der Härte zur Reifung wird das Fleisch weicher, lockerer und zarter, was bedeutet, dass Verdauungssäfte ungehindert in das Sarkoplasma eindringen können, was die Verdaulichkeit und Verdaulichkeit des Fleisches verbessert.
Die Zartheit des Fleischgewebes, in dem viel Bindegewebe vorhanden ist, ist gering und das Fleisch junger Tiere ist zarter als das Fleisch alter Tiere.
Bei einem Temperaturanstieg (bis zu 30 0 C) sowie bei längerer Reifung des Fleisches (über 20-26 Tage) bei niedrigen positiven Temperaturen (2-4 0 C) vertieft sich der enzymatische Reifungsprozess so stark, dass die Menge Der Proteinabbau im Fleisch nimmt in Form von kleinen Peptiden und freien Aminosäuren deutlich zu. In diesem Stadium nimmt das Fleisch eine braune Farbe an, der Gehalt an Amin- und Ammoniakstickstoff nimmt zu und es kommt zu einem spürbaren hydrolytischen Fettabbau, der sich negativ auf seine Nährwerteigenschaften und die Präsentation des Fleisches auswirkt.
Um die Reifung des Fleisches zu beschleunigen und so seine Qualität zu verbessern, werden verschiedene Verarbeitungsmethoden eingesetzt, darunter der Einsatz von Enzymen und Antibiotika.
Untersuchungen haben auch gezeigt, dass die Oberflächenbehandlung von Fleisch (durch Eintauchen in eine Lösung oder Aufsprühen von Pulver) keine ausreichende Wirkung hat.
Gute Ergebnisse werden durch die Fermentation von Fleisch erzielt, die gleichzeitig nach der Sublimationsreduktion durchgeführt wird.
Um qualitativ hochwertigere Produkte zu erhalten, wird Konserven ein enzymatisches Präparat zugesetzt. Es wird vorgeschlagen, minderwertigen Würsten Arzneimittel zuzusetzen.
Mit Enzympräparaten behandeltes Fleisch muss sein Aussehen, Farbe, Aroma unterscheiden sich nicht von nicht-enzymatisch und der Geschmack ist weicher, ohne den bitteren Geschmack, der durch die Produkte des tiefen Proteinabbaus durch Enzyme verursacht wird.