Oxizii bazici sunt doar oxizi ai metalelor. Oxizi
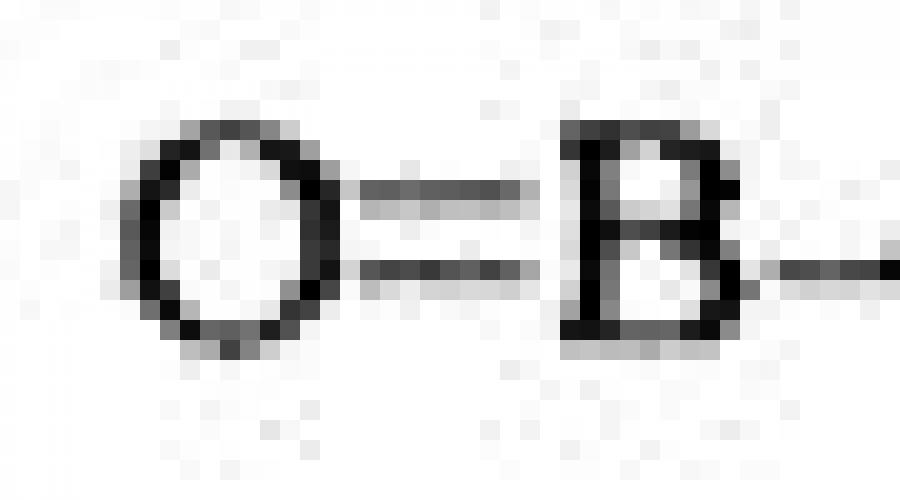
SECȚIUNEA II. CHIMIE ANORGANICĂ
7. Clasele principale compuși anorganici
7.1. Oxizi
Oxizii sunt compuși binari ai elementelor cu oxigen, în care prezintă o stare de oxidare- 2. Caracteristici caracteristice ale oxizilor:
starea de oxidare a oxigenului- - 2;
Atomii de oxigen nu sunt legați între ei, ci sunt legați doar de atomii altor elemente;
atomii elementului care formează oxidul au aceeași stare de oxidare 1.
Formule grafice ale oxizilor
|
Valenta elementelor |
Formula grafica |
|
|
|
|
|
Nu toți compușii binari de oxigen sunt oxizi:
|
Substanţă |
Formulă |
Formula grafica |
Starea de oxidare a oxigenului |
|
apă oxigenată |
H2O2 |
H-O-O-H |
|
|
peroxid de sodiu |
Na2O2 |
Na-O-O-Na |
|
|
fluorura de oxigen |
DIN 2 |
F-O-F |
Pe baza naturii lor chimice, oxizii sunt împărțiți în nesalini și salini.
Oxizi non-salini - NU, N2O, CO, SiO - aceștia sunt oxizi care sunt clasificați ca compuși reactivi, dar sărurile nu se formează în timpul reacțiilor. Nu reacţionează cu apa, acizii şi bazele când conditii normale(prin urmare, sunt clasificați condiționat ca oxizi).
Oxizii de sare sunt oxizi care formează săruri. Oxizii de sare sunt împărțiți în oxizii de bază (K 2 O, BaO, MgO, FeO), acid (SO2, SO3, N2O5, P2O5) și amfoter (ZnO, Al203, Cr2O3, BeO).
Nomenclatura oxizilor
Denumirea oxizilor constă din denumirea elementului, după care, atunci când elementul prezintă mai multe stări de oxidare, gradul de oxidare este indicat în paranteze cu cifre romane și se adaugă cuvântul „oxid”. De exemplu:
K 2 O - oxid de potasiu;
Fe2O3 - ferrum(III)oxid;
С u 2 O - oxid de cupru(I);
MgO - oxid de magneziu;
P2O5 - oxid de fosfor (V);
A l 2 O 3 - oxid de aluminiu;
CO - oxid de carbon(II).
Unii oxizi care sunt cunoscuți de multă vreme omului au denumiri banale: CaO - var nestins, C O2 - dioxid de carbon, SO 2 - dioxid de sulf.
Obținerea oxizilor
1. Interacțiunea substanțelor simple (metale și nemetale) cu oxigenul:

2. Oxidarea substanțelor complexe:

3. Descompunere termica:
bazele:

saruri:

hidroxizi amfoteri:
![]()
Unii acizi:

4. În timpul altor reacții:

______________________________________________________
1 „oxid” dublu ( FeFe2)O4 conține Ferum cu diferite stări de oxidare (+2 și +3) și, atunci când interacționează cu oxizii acizi, formează două săruri diferite.
7.1.1. Oxizii bazici
Oxizii bazici sunt oxizi ai căror hidrați sunt baze. Toți oxizii bazici sunt oxizi ai elementelor metalice care prezintă stări scăzute de oxidare (+1, +2). Principalii oxizi includ:
oxizii elementelor metalice din principalele subgrupe I și II grupe (cu excepția Fi);
oxizi ai elementelor monovalente, bivalente, cu excepția BeO, ZnO, Г b O, care sunt amfotere;
oxizi ai elementelor de metal de tranziție în stări de oxidare scăzută(NiO, FeO, MnO, CrO).
Oxizii bazici corespund bazelor:
Na20 - NaOH
MgO-Mg(OH)2
FeO - Fe (OH) 2
BaO - Ba (OH) 2
CrO - Cr (OH) 2
Tipul de legătură chimică în oxizii bazici este predominant ionic.
Proprietățile chimice ale oxizilor bazici
1. Interacțiunea cu acizii pentru a forma săruri:
![]()
2. Interacțiunea cu oxizii acizi pentru a forma săruri:
![]()
3. Interacțiunea cu apa. Doar oxizii elementelor de metal alcalino și alcalino-pământos reacţionează cu apa, formând alcalii:
![]()
4. Interacțiunea cu oxizii amfoteri. Reacția are loc în timpul fuziunii. Oxidul amfoter din această reacție prezintă proprietăți acide:
5. Interacțiunea cu baze amfotere. Reacția are loc în timpul fuziunii:
Există trei clase de compuși chimici anorganici în natură: săruri, hidroxizi și oxizi. Primii sunt compuși ai unui atom de metal cu un reziduu acid, de exemplu, CI-. Acestea din urmă sunt împărțite în acizi și baze. Moleculele primei dintre ele constau din cationi H+ și un reziduu acid, de exemplu, SO 4 -. Bazele conțin un cation metalic, de exemplu, K+ și un anion sub forma unei grupări hidroxil OH-. Și oxizii, în funcție de proprietățile lor, sunt împărțiți în acizi și bazici. Despre acesta din urmă vom vorbi în acest articol.
Definiție
Oxizii bazici sunt substanțe formate din două elemente chimice, dintre care unul este neapărat oxigen, iar al doilea este metal. Când se adaugă apă la substanțe de acest tip, se formează baze.
Proprietățile chimice ale oxizilor bazici
Substanțele din această clasă sunt în primul rând capabile să reacționeze cu apa, în urma căreia se obține o bază. De exemplu, putem da următoarea ecuație: CaO + H2O = Ca(OH)2.
Reacții cu acizi
Dacă oxizii bazici sunt amestecați cu acizi, se pot obține săruri și apă. De exemplu, dacă adăugați acid clorură la oxidul de potasiu, obțineți clorură de potasiu și apă. Ecuația reacției va arăta astfel: K 2 O + 2 HCI = 2 KSI + H 2 O.

Interacțiunea cu oxizii acizi
Aceste tipuri de reacții chimice duc la formarea de săruri. De exemplu, dacă adăugați dioxid de carbon la oxidul de calciu, obțineți carbonat de calciu. Această reacție poate fi exprimată sub forma următoarei ecuații: CaO + CO2 = CaCO3. Acest tip de interacțiune chimică poate avea loc numai sub influența temperaturii ridicate.
Oxizi amfoteri și bazici
Aceste substanțe pot, de asemenea, interacționa între ele. Acest lucru se întâmplă deoarece primii au proprietățile oxizilor acizi și bazici. Ca rezultat al unor astfel de interacțiuni chimice, se formează săruri complexe. Ca exemplu, dăm ecuația pentru reacția care are loc atunci când oxidul de potasiu (bazic) este amestecat cu oxidul de aluminiu (amfoter): K 2 O + AI 2 O 3 = 2KAIO 2. Substanța rezultată se numește aluminat de potasiu. Dacă amestecați aceiași reactivi, dar adăugați și apă, reacția va avea loc în felul următor: K20 + AI203 + 4H20 = 2K. Substanța care se formează se numește tetrahidroxoaluminat de potasiu.
Proprietăți fizice
Diferiții oxizi de bază diferă mult în proprietățile lor fizice, dar toți au în esență aceleași conditii normale sunt în stare solidă de agregare și au un punct de topire ridicat.

Să ne uităm la fiecare compus chimic individual. Oxidul de potasiu apare ca un solid galben deschis. Se topește la o temperatură de +740 de grade Celsius. Oxidul de sodiu este cristale incolore. Se transformă în lichid la o temperatură de +1132 de grade. Oxidul de calciu este reprezentat de cristale albe care se topesc la +2570 de grade. Dioxidul de fier apare ca o pulbere neagră. Ia lichid starea de agregare la o temperatură de +1377 grade Celsius. Oxidul de magneziu este similar cu compusul de calciu - este, de asemenea, cristale alb. Se topește la +2825 grade. Oxidul de litiu este un cristal transparent cu un punct de topire de +1570 de grade. Această substanță este foarte higroscopică. Oxidul de bariu arată la fel ca compusul chimic anterior, temperatura la care capătă o stare lichidă este puțin mai mare - +1920 de grade. Oxidul de mercur este o pulbere portocalie-roșu. La o temperatură de +500 de grade Celsius, această substanță chimică se descompune. Oxidul de crom este o pulbere roșu închis cu același punct de topire ca și compusul cu litiu. Oxidul de cesiu are aceeași culoare ca mercurul. Se descompune atunci când este expus energie solara. Oxidul de nichel este cristale verzi care se transformă în lichid la o temperatură de +1682 grade Celsius. După cum puteți vedea, proprietăți fizice toate substanțele din acest grup au multe caracteristici generale, deși au unele diferențe. Oxidul de cupru (cupru) arată ca niște cristale negre. Se transformă într-o stare lichidă de agregare la o temperatură de +1447 grade Celsius.

Cum se produc substanțele chimice din această clasă?
Oxizii bazici pot fi produși prin reacția unui metal cu oxigen la temperatură ridicată. Ecuația acestei interacțiuni este următoarea: 4K + O 2 = 2K 2 O. A doua modalitate de a obține compuși chimici din această clasă este descompunerea unei baze insolubile. Ecuația poate fi scrisă după cum urmează: Ca(OH) 2 = CaO + H 2 O. Pentru realizarea acestui gen de reacție sunt necesare condiții speciale sub formă de temperaturi ridicate. În plus, în timpul descompunerii anumitor săruri se formează și oxizi bazici. Un exemplu este următoarea ecuație: CaCO 3 = CaO + CO 2. Astfel, s-a format și un oxid acid.
Utilizarea oxizilor bazici

Compușii chimici din acest grup sunt utilizați pe scară largă în diverse industrii. În continuare, vom lua în considerare utilizarea fiecăruia dintre ele. Oxidul de aluminiu este folosit în stomatologie pentru a face proteze dentare. Este folosit și în producția de ceramică. Oxidul de calciu este unul dintre componentele implicate în producerea cărămizii nisipo-var. Poate acționa și ca material rezistent la foc. În industria alimentară, acesta este aditivul E529. Oxidul de potasiu - unul dintre ingredientele îngrășămintelor minerale pentru plante, sodiu - este utilizat în industria chimică, în principal la producerea hidroxidului aceluiași metal. Oxidul de magneziu este folosit și în industria alimentară ca aditiv sub numărul E530. În plus, este un remediu împotriva acidității crescute a sucului gastric. Oxidul de bariu este utilizat în reacții chimice ca catalizator. Dioxidul de fier este utilizat în producția de fontă, ceramică și vopsele. Este, de asemenea, un colorant alimentar numărul E172. Oxidul de nichel se transmite sticlei Culoarea verde. În plus, este utilizat în sinteza sărurilor și a catalizatorilor. Oxidul de litiu este unul dintre componentele în producția unor tipuri de sticlă; crește rezistența materialului. Compusul de cesiu acționează ca un catalizator pentru anumite reacții chimice. Oxidul de Cuprum, ca și alții, își găsește aplicația în fabricație tipuri speciale sticla, precum si pentru obtinerea cuprului pur. În producția de vopsele și emailuri, este folosit ca pigment care dă culoarea albastră.
Substanțe din această clasă în natură
În mediul natural, compușii chimici din acest grup se găsesc sub formă de minerale. Aceștia sunt în principal oxizi acizi, dar apar și printre alții. De exemplu, compusul de aluminiu este corindon.

In functie de impuritatile prezente in acesta, poate fi de diferite culori. Dintre variațiile bazate pe AI 2 O 3 se pot distinge rubinul, care are o culoare roșie, și safirul, un mineral care are o culoare albastră. Aceeași substanță chimică poate fi găsită și în natură sub formă de alumină. Compusul de cuprum cu oxigen apare în natură sub formă de tenorit mineral.
Concluzie
Ca o concluzie, putem spune că toate substanțele discutate în acest articol au proprietăți fizice și chimice similare. Își găsesc aplicația în multe industrii - de la farmaceutic la alimentar.
Oxizii sunt substanțe în care moleculele constau dintr-un atom de oxigen cu stare de oxidare - 2 și atomi ai unui al doilea element.
Oxizii se formează direct prin interacțiunea oxigenului cu o altă substanță sau indirect prin descompunerea bazelor, sărurilor și acizilor. Acest tip de compus este foarte comun în natură și poate exista sub formă de gaz, lichid sau B Scoarta terestra sunt si oxizi. Deci, nisip, rugină și chiar apă obișnuită - asta este tot
Există atât oxizi care formează sare, cât și oxizi care nu formează sare. Ca rezultat, formează sare reactie chimica da sare. Acestea includ oxizi de nemetale și metale, care în reacție cu apa formează un acid, iar în reacție cu o bază - săruri, normale și acide. Agenții care formează sare includ, de exemplu,
În consecință, este imposibil să se obțină sare din substanțe care nu formează sare. Exemplele includ oxid de dinazot și
Oxizii care formează sare sunt împărțiți, la rândul lor, în bazici, acizi și amfoteri. Să vorbim mai detaliat despre cele principale.
Deci, oxizii bazici sunt oxizi ai unor metale, hidroxizii corespunzători aparțin clasei bazelor. Adică, atunci când interacționează cu acidul, astfel de substanțe formează apă și sare. De exemplu, acestea sunt K2O, CaO, MgO etc. În condiții normale, oxizii bazici sunt formațiuni cristaline solide. Gradul de oxidare a metalelor în astfel de compuși, de regulă, nu depășește +2 sau rar +3.
Proprietățile chimice ale oxizilor bazici
1. Reacția cu acidul
În reacția cu un acid, oxidul își prezintă proprietățile de bază, așa că un experiment similar poate dovedi tipul unui anumit oxid. Dacă se formează sare și apă, atunci este un oxid bazic. Oxizii acizi într-o astfel de reacție formează un acid. Iar cele amfotere pot prezenta proprietăți fie acide, fie bazice - depinde de condiții. Acestea sunt principalele diferențe dintre oxizii care nu formează sare.
2. Reacția cu apa
Acei oxizi care sunt formați de metale din gama de tensiune electrică care se află în fața magneziului interacționează cu apa. Când reacţionează cu apa formează baze solubile. Acesta este un grup de oxizi alcalino-pământosi (oxid de bariu, oxid de litiu etc.). Oxizii acizi formează acid în apă, în timp ce oxizii amfoteri nu reacţionează la apă.
3. Reacția cu oxizi amfoteri și acizi
Substanțele opuse din punct de vedere chimic reacționează între ele, formând săruri. De exemplu, oxizii bazici pot interacționa cu cei acizi, dar nu reacționează cu alți reprezentanți ai grupului lor. Cei mai activi sunt oxizii metalelor alcaline, alcalino-pământoase și magneziul. Chiar și în condiții normale, ele fuzionează cu oxizi amfoteri solizi și cu oxizi acizi solizi și gazoși. Când reacţionează cu oxizii acizi, ei formează sărurile corespunzătoare.
Dar oxizii de bază ai altor metale sunt mai puțin activi și practic nu reacționează cu oxizii gazoși (acizi). Ele pot suferi doar o reacție de adiție atunci când sunt topite cu oxizi acizi solizi.
4. Proprietăți redox
Oxizii metalelor alcaline active nu prezintă proprietăți reducătoare sau oxidante pronunțate. Și, dimpotrivă, oxizii metalelor nu atât de active pot fi reduse cu cărbune, hidrogen, amoniac sau monoxid de carbon.
Prepararea oxizilor bazici
1. Descompunerea hidroxizilor: Când sunt încălzite, bazele insolubile se descompun în apă și un oxid bazic.
2. Oxidarea metalelor: metal alcalin atunci când este ars în oxigen, formează un peroxid, care apoi, la reducere, formează un oxid bazic.
Oxizi.
Acestea sunt substanțe complexe formate din DOUĂ elemente, dintre care unul este oxigenul. De exemplu:
CuO – oxid de cupru(II).
AI 2 O 3 – oxid de aluminiu
SO 3 – oxid de sulf (VI)
Oxizii sunt împărțiți (clasificați) în 4 grupe:
Na 2 O– Oxid de sodiu
CaO – oxid de calciu
Fe 2 O 3 – oxid de fier (III).
2). Acid– Aceștia sunt oxizi nemetale. Și uneori metale dacă starea de oxidare a metalului este > 4. De exemplu:
CO 2 – Monoxid de carbon (IV)
P 2 O 5 – Oxid de fosfor (V).
SO 3 – Oxid de sulf (VI)
3). Amfoter– Aceștia sunt oxizi care au proprietățile oxizilor bazici și acizi. Trebuie să cunoașteți cei mai comuni cinci oxizi amfoteri:
BeO-oxid de beriliu
ZnO – oxid de zinc
AI 2 O 3 – Oxid de aluminiu
Cr 2 O 3 – Oxid de crom (III).
Fe 2 O 3 – Oxid de fier (III).
4). care nu formează sare (indiferent)– Aceștia sunt oxizi care nu prezintă proprietățile oxizilor bazici sau acizi. Există trei oxizi de reținut:
CO – monoxid de carbon (II) monoxid de carbon
NO– oxid nitric (II)
N 2 O – protoxid de azot (I) gaz râd, protoxid de azot
Metode de producere a oxizilor.
1). Arderea, adică interacțiunea cu oxigenul unei substanțe simple:
4Na + O2 = 2Na2O
4P + 5O 2 = 2P 2 O 5
2). Arderea, adică interacțiunea cu oxigenul unei substanțe complexe (formată din două elemente) formându-se astfel doi oxizi.
2ZnS + 3O 2 = 2ZnO + 2SO 2
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
3). Descompunere Trei acizi slabi. Altele nu se descompun. În acest caz, se formează oxid acid și apă.
H2CO3 = H2O + CO2
H2S03 = H2O + SO2
H2SiO3 = H2O + Si02
4). Descompunere insolubil temeiuri. Se formează un oxid bazic și apă.
Mg(OH)2 = MgO + H2O
2Al(OH)3 = Al2O3 + 3H2O
5). Descompunere insolubil săruri Se formează un oxid bazic și un oxid acid.
CaCO3 = CaO + CO2
MgS03 = MgO + SO2
Proprietăți chimice.
eu. Oxizii bazici.
alcaline.
Na20 + H20 = 2NaOH
CaO + H2O = Ca(OH)2
СuO + H 2 O = reacția nu are loc, deoarece posibilă bază care conține cupru - insolubilă
2). Interacțiunea cu acizii, ducând la formarea de sare și apă. (Oxidul de bază și acizii reacționează ÎNTOTDEAUNA)
K2O + 2HCI = 2KCI + H2O
CaO + 2HNO3 = Ca(NO3)2 + H2O
3). Interacțiunea cu oxizii acizi, ducând la formarea de sare.
Li 2 O + CO 2 = Li 2 CO 3
3MgO + P2O5 = Mg3(P04)2
4). Interacțiunea cu hidrogenul produce metal și apă.
CuO + H2 = Cu + H2O
Fe2O3 + 3H2 = 2Fe + 3H2O
II.Oxizi acizi.
1). Ar trebui să se formeze interacțiunea cu apa acid.(NumaiSiO 2 nu interactioneaza cu apa)
CO2 + H2O = H2CO3
P2O5 + 3H20 = 2H3PO4
2). Interacțiune cu baze solubile (alcali). Aceasta produce sare și apă.
SO3 + 2KOH = K2SO4 + H2O
N2O5 + 2KOH = 2KNO3 + H2O
3). Interacțiunea cu oxizii bazici. În acest caz, se formează doar sare.
N2O5 + K2O = 2KNO3
Al2O3 + 3SO3 = Al2(SO4)3
Exerciții de bază.
1). Completați ecuația reacției. Determinați tipul acestuia.
K2O + P2O5 =
Soluţie.
Pentru a nota ceea ce se formează ca rezultat, este necesar să se determine ce substanțe au reacționat - aici este oxid de potasiu (bazic) și oxid de fosfor (acid) în funcție de proprietăți - rezultatul ar trebui să fie SARE (a se vedea proprietatea nr. 3). ) și sarea constă din atomi de metale (în cazul nostru potasiu) și un reziduu acid care include fosfor (adică PO 4 -3 - fosfat).
3K 2 O + P 2 O 5 = 2K 3 RO 4
tip de reacție - compus (deoarece două substanțe reacţionează, dar se formează una)
2). Efectuați transformări (lanț).
Ca → CaO → Ca(OH) 2 → CaCO 3 → CaO
Soluţie
Pentru a finaliza acest exercițiu, trebuie să vă amintiți că fiecare săgeată este o ecuație (o reacție chimică). Să numărăm fiecare săgeată. Prin urmare, este necesar să scrieți 4 ecuații. Substanța scrisă în stânga săgeții (substanța inițială) reacționează, iar substanța scrisă în dreapta se formează ca urmare a reacției (produsul de reacție). Să descifrăm prima parte a înregistrării:
Ca + …..→ CaO Observam ca o substanta simpla reactioneaza si se formeaza un oxid. Cunoscând metodele de producere a oxizilor (Nr. 1), ajungem la concluzia că în această reacție este necesar să se adauge -oxigen (O 2)
2Ca + O 2 → 2CaO
Să trecem la transformarea nr. 2
CaO → Ca(OH) 2
CaO + ……→ Ca(OH) 2
Ajungem la concluzia că aici este necesar să se aplice proprietatea oxizilor bazici - interacțiune cu apa, deoarece numai în acest caz se formează o bază din oxid.
CaO + H2O → Ca(OH)2
Să trecem la transformarea nr. 3
Ca(OH)2 → CaCO3
Ca(OH) 2 + ….. = CaCO 3 + …….
Ajungem la concluzia că aici vorbim de dioxid de carbon CO 2 deoarece numai atunci când interacționează cu alcalii formează o sare (vezi proprietatea nr. 2 a oxizilor acizi)
Ca(OH)2 + CO2 = CaC03 + H2O
Să trecem la transformarea nr. 4
CaCO3 → CaO
CaCO 3 = ….. CaO + ……
Ajungem la concluzia că aici se formează mai mult CO 2, deoarece CaCO 3 este o sare insolubilă și în timpul descompunerii unor astfel de substanțe se formează oxizi.
CaCO3 = CaO + CO2
3). Cu care dintre următoarele substanțe interacționează CO 2? Scrieți ecuațiile reacției.
A). Acid clorhidric B). hidroxid de sodiu B). Oxid de potasiu d). Apă
D). Hidrogenul E). Oxid de sulf (IV).
Determinăm că CO 2 este un oxid acid. Iar oxizii acizi reacţionează cu apa, alcalii şi oxizii bazici... Prin urmare, din lista dată, selectăm răspunsurile B, C, D, iar cu ele notăm ecuaţiile de reacţie:
1). CO2 + 2NaOH = Na2CO3 + H2O
2). CO2 + K2O = K2CO3
Proprietățile oxizilor
Oxizi- acestea sunt substanțe chimice complexe care sunt compuși chimici elemente simple cu oxigen. Sunt formatoare de sareȘi neformatoare de sare. În acest caz, există 3 tipuri de agenți formatori de sare: principal(din cuvântul „fundație”), acidȘi amfoter.
Un exemplu de oxizi care nu formează săruri sunt: NO (oxid nitric) - este un gaz incolor, inodor. Se formează în timpul unei furtuni în atmosferă. CO (monoxidul de carbon) este un gaz inodor produs prin arderea cărbunelui. Se numește în mod obișnuit monoxid de carbon. Există și alți oxizi care nu formează săruri. Acum să aruncăm o privire mai atentă asupra fiecărui tip de oxizi care formează sare.
Oxizii bazici
Oxizii bazici- Sunt substanțe chimice complexe legate de oxizi care formează săruri la reacția chimică cu acizi sau oxizi acizi și nu reacţionează cu baze sau oxizi bazici. De exemplu, principalele includ următoarele:
K 2 O (oxid de potasiu), CaO (oxid de calciu), FeO (oxid de fer).
Sa luam in considerare Proprietăți chimice oxizi cu exemple
1. Interacțiunea cu apa:
- interacțiunea cu apa pentru a forma o bază (sau alcali)
CaO+H 2 O → Ca(OH) 2 (reacție cunoscută de stingere a varului, care eliberează cantitati mari căldură!)
2. Interacțiunea cu acizii:
- interacțiunea cu acidul pentru a forma sare și apă (soluție de sare în apă)
CaO+H 2 SO 4 → CaSO 4 + H 2 O (Cristalele acestei substanțe CaSO 4 sunt cunoscute de toată lumea sub denumirea de „gips”).
3. Interacțiunea cu oxizii acizi: formarea de sare
CaO+CO 2 → CaCO 3 (Toată lumea știe această substanță - cretă obișnuită!)
Oxizi acizi
Oxizi acizi- sunt substanțe chimice complexe legate de oxizi care formează săruri la interacțiunea chimică cu baze sau oxizi bazici și nu interacționează cu oxizii acizi.
Exemple de oxizi acizi pot fi:
CO 2 (cunoscutul dioxid de carbon), P 2 O 5 - oxid de fosfor (format prin arderea fosforului alb în aer), SO 3 - trioxid de sulf - această substanță este folosită pentru a produce acid sulfuric.
Reacție chimică cu apa
CO 2 +H 2 O → H 2 CO 3 - această substanță este acidul carbonic - unul dintre acizii slabi, se adaugă în apa carbogazoasă pentru a crea „bule”. Odată cu creșterea temperaturii, solubilitatea gazului în apă scade, iar excesul său iese sub formă de bule.
Reacția cu alcalii (bazele):
CO 2 +2NaOH→ Na 2 CO 3 +H 2 O- substanța rezultată (sarea) este utilizată pe scară largă în gospodărie. Numele său - sodă sau sifon de spălat - excelent detergent pentru tigăi arse, grăsime, urme de ars. Cu mâinile goale Nu recomand munca!
Reacția cu oxizi bazici:
CO 2 +MgO→ MgCO 3 - sarea rezultată este carbonat de magneziu - numită și „sare amară”.
Oxizi amfoteri
Oxizi amfoteri- sunt substanțe chimice complexe, legate și de oxizi, care formează săruri în timpul interacțiunii chimice cu acizii (sau oxizi acizi) și motive (sau oxizi bazici). Cea mai frecventă utilizare a cuvântului „amfoter” în cazul nostru se referă la oxizi metalici.
Exemplu oxizi amfoteri poate fi:
ZnO - oxid de zinc (pulbere albă, folosită adesea în medicină pentru fabricarea măștilor și cremelor), Al 2 O 3 - oxid de aluminiu (numit și „alumină”).
Proprietățile chimice ale oxizilor amfoteri sunt unice prin faptul că pot intra în reacții chimice atât cu baze, cât și cu acizi. De exemplu:
Reacția cu oxidul acid:
ZnO+H 2 CO 3 → ZnCO 3 + H 2 O - Substanța rezultată este o soluție de sare „carbonat de zinc” în apă.
Reacția cu bazele:
ZnO+2NaOH→ Na 2 ZnO 2 +H 2 O - substanța rezultată este o sare dublă de sodiu și zinc.
Obținerea oxizilor
Obținerea oxizilor legume şi fructe căi diferite. Acest lucru se poate întâmpla fizic și prin mijloace chimice. Cel mai într-un mod simplu este interacțiunea chimică a elementelor simple cu oxigenul. De exemplu, rezultatul procesului de ardere sau unul dintre produsele acestei reacții chimice sunt oxizi. De exemplu, dacă o tijă de fier fierbinte, și nu numai fier (puteți lua zinc Zn, staniu Sn, plumb Pb, cupru Cu - practic orice este la îndemână) este plasat într-un balon cu oxigen, atunci o reacție chimică de oxidare a fierului va apărea, care este însoțită de un bliț strălucitor și scântei. Produsul de reacție va fi pulbere neagră de oxid de fier FeO:
2Fe+O 2 → 2FeO
Reacțiile chimice cu alte metale și nemetale sunt complet similare. Zincul arde în oxigen pentru a forma oxid de zinc
2Zn+O2 → 2ZnO
Arderea cărbunelui este însoțită de formarea a doi oxizi deodată: monoxid de carbon și dioxid de carbon
2C+O 2 → 2CO - formarea monoxidului de carbon.
C+O 2 → CO 2 - formarea dioxidului de carbon. Acest gaz se formează dacă există mai mult decât suficient oxigen, adică, în orice caz, reacția are loc mai întâi cu formarea de monoxid de carbon, iar apoi monoxidul de carbon este oxidat, transformându-se în dioxid de carbon.
Obținerea oxizilor se poate face în alt mod – printr-o reacție de descompunere chimică. De exemplu, pentru a obține oxid de fier sau oxid de aluminiu, este necesar să calci bazele corespunzătoare ale acestor metale la foc:
Fe(OH)2 → FeO+H2O
Oxid de aluminiu solid - corindon mineral  Oxid de fier (III). Suprafața planetei Marte este de culoare roșiatică-portocalie datorită prezenței oxidului de fier (III) în sol. Oxid de aluminiu solid - corindon
Oxid de fier (III). Suprafața planetei Marte este de culoare roșiatică-portocalie datorită prezenței oxidului de fier (III) în sol. Oxid de aluminiu solid - corindon
2Al(OH)3 → Al2O3 +3H2O,
precum și în timpul descompunerii acizilor individuali:
H 2 CO 3 → H 2 O+CO 2 - descompunerea acidului carbonic
H 2 SO 3 → H 2 O+SO 2 - descompunere acid sulfuros
Obținerea oxizilor poate fi făcut din săruri metalice cu încălzire puternică:
CaCO 3 → CaO+CO 2 - calcinarea cretei produce oxid de calciu (sau var nestins) și dioxid de carbon.
2Cu(NO 3) 2 → 2CuO + 4NO 2 + O 2 - în această reacție de descompunere se obțin doi oxizi deodată: cupru CuO (negru) și azot NO 2 (se mai numește și gaz brun datorită culorii sale cu adevărat maro).
Un alt mod în care pot fi produși oxizii este prin reacții redox.
Cu + 4HNO 3 (conc.) → Cu(NO 3) 2 + 2NO 2 + 2H 2 O
S + 2H 2 SO 4 (conc.) → 3SO 2 + 2H 2 O
Oxizi de clor
 molecula de ClO2
molecula de ClO2  Moleculă de CI2O7
Moleculă de CI2O7  Protoxid de azot N2O
Protoxid de azot N2O  Anhidridă de azot N2O3
Anhidridă de azot N2O3  Anhidridă nitrică N2O5
Anhidridă nitrică N2O5  Gaz brun NO 2
Gaz brun NO 2 Sunt cunoscute următoarele oxizi de clor: CI20, CI02, CI206, CI207. Toate acestea, cu excepția Cl 2 O 7, au culoare galbenă sau portocalie și nu sunt stabile, în special ClO 2, Cl 2 O 6. Toate oxizi de clor sunt explozive și sunt agenți oxidanți foarte puternici.
Reacționând cu apa, formează acizii corespunzători care conțin oxigen și clor:
Deci, Cl 2 O - oxid de clor acid acid hipocloros.
Cl2O + H2O → 2HClO - Acid hipocloros
ClO2 - oxid de clor acid acid hipocloros și acid hipocloros, deoarece în timpul unei reacții chimice cu apa formează doi dintre acești acizi simultan:
Cl02 + H20→ HCI02 + HCI03
Cl2O6 - de asemenea oxid de clor acid acizi percloric și percloric:
CI2O6 + H2O → HCIO3 + HCIO4
Și, în sfârșit, Cl 2 O 7 - un lichid incolor - oxid de clor acid acid percloric:
CI207 + H20 → 2HCIO4
Oxizi de azot
Azotul este un gaz care formează 5 compuși diferiți cu oxigenul - 5 oxizi de azot. Și anume:
N2O- oxid de azot. Celălalt nume este cunoscut în medicină ca gaz ilariant sau oxid de azot- Este incolor, dulceag si placut la gust de gaz.
- NU - monoxid de azot- un gaz incolor, inodor, insipid.
- N 2 O 3 - anhidridă de azot- incolor substanță cristalină
- NU 2 - dioxid de azot. Celălalt nume al său este gaz brun- gazul chiar are o culoare maro-maronie
- N 2 O 5 - anhidridă nitrică- lichid albastru, care fierbe la temperatura de 3,5 0 C
Dintre toți acești compuși de azot enumerați, NO - monoxidul de azot și NO 2 - dioxidul de azot sunt de cel mai mare interes în industrie. Monoxid de azot(NU) și oxid de azot N 2 O nu reacționează cu apa sau cu alcalii. (N 2 O 3) când reacționează cu apa, formează un acid azot slab și instabil HNO 2, care în aer se transformă treptat într-o substanță chimică mai stabilă, acidul azotic. Să ne uităm la câteva proprietățile chimice ale oxizilor de azot:
Reacția cu apa:
2NO 2 + H 2 O → HNO 3 + HNO 2 - 2 se formează deodată: Acid azotic HNO 3 și acid azotic.
Reacția cu alcalii:
2NO 2 + 2NaOH → NaNO 3 + NaNO 2 + H 2 O - se formează două săruri: azotat de sodiu NaNO 3 (sau azotat de sodiu) și azotat de sodiu (o sare a acidului azotat).
Reacția cu sărurile:
2NO 2 + Na 2 CO 3 → NaNO 3 + NaNO 2 + CO 2 - se formează două săruri: azotat de sodiu și azotat de sodiu și se eliberează dioxid de carbon.
Dioxidul de azot (NO2) se obține din monoxidul de azot (NO) folosind o reacție chimică de combinare cu oxigenul:
2NO + O 2 → 2NO 2
Oxizi de fier
Fier formează două oxid:FeO- oxid de fier(2-valent) - pulbere neagră, care se obține prin reducere oxid de fier monoxid de carbon (3-valent) prin următoarea reacție chimică:
Fe2O3 +CO→ 2FeO+CO2
Acesta este un oxid bazic care reacționează ușor cu acizii. Are proprietăți reducătoare și se oxidează rapid în oxid de fier(3-valent).
4FeO +O 2 → 2Fe 2 O 3
Oxid de fier(3-valent) - pulbere roșu-maro (hematit), care are proprietăți amfotere (poate interacționa atât cu acizii, cât și cu alcalii). Dar proprietățile acide ale acestui oxid sunt atât de slab exprimate încât este cel mai adesea folosit ca oxid bazic.
Există, de asemenea, așa-numitele oxid de fier mixt Fe3O4. Se formează atunci când fierul arde și conduce bine electricitate si are proprietăți magnetice(se numește minereu de fier magnetic sau magnetit). Dacă fierul arde, în urma reacției de ardere, se formează calamă, constând din doi oxizi: oxid de fier(III) și (II) valență.
Oxid de sulf
 Dioxid de sulf SO 2
Dioxid de sulf SO 2 Oxid de sulf SO 2 - sau dioxid de sulf se refera la oxizi acizi , dar nu formează acid, deși este perfect solubil în apă - 40 de litri de oxid de sulf în 1 litru de apă (pentru comoditatea întocmirii ecuațiilor chimice, o astfel de soluție se numește acid sulfuros).
În circumstanțe normale, este un gaz incolor cu un miros înțepător și sufocant de sulf ars. La o temperatură de numai -10 0 C poate fi transformat în stare lichidă.
În prezența unui catalizator - oxid de vanadiu (V 2 O 5) oxid de sulf ataseaza oxigenul si se transforma in trioxid de sulf
2SO 2 +O 2 → 2SO 3
Dizolvat în apă dioxid de sulf- oxid de sulf SO2 - se oxidează foarte lent, drept urmare soluția în sine se transformă în acid sulfuric
Dacă dioxid de sulf treceți un alcali, de exemplu, hidroxid de sodiu, printr-o soluție, apoi se formează sulfit de sodiu (sau hidrosulfit - în funcție de cât de mult alcali și dioxid de sulf luați)
NaOH + SO 2 → NaHSO 3 - dioxid de sulf luate în exces
2NaOH + SO2 → Na2SO3 + H2O
Dacă dioxidul de sulf nu reacționează cu apa, atunci de ce soluția sa apoasă dă o reacție acidă?! Da, nu reacționează, dar el însuși se oxidează în apă, adăugând oxigen. Și se dovedește că atomii de hidrogen liberi se acumulează în apă, care dau o reacție acidă (puteți verifica cu un indicator!)