Varusdeformität des Femurs bei der Behandlung von Kindern. Hüftdeformitäten
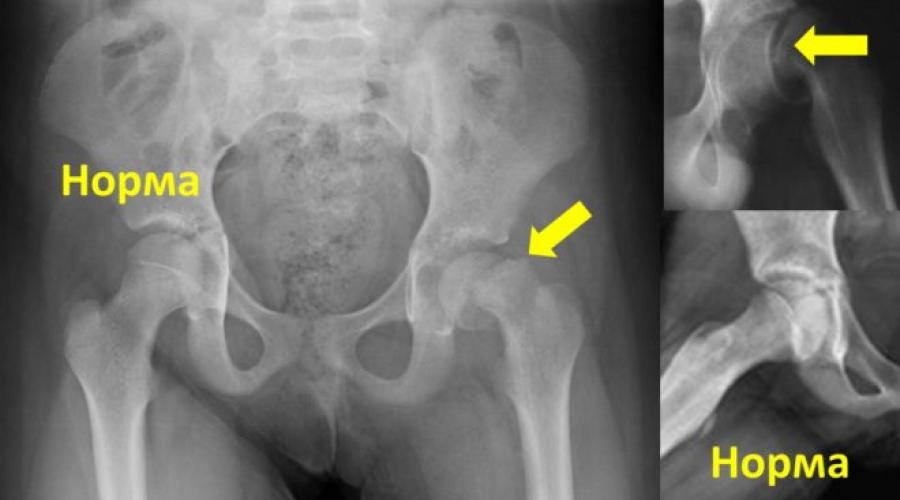
Eine der seltenen Entwicklungsanomalien der Femuren ist ihre Varusdeformität. Bei Neugeborenen tritt die Erkrankung höchstens in 0,3–0,8 % der Fälle auf. Zusammen mit der Valguskrümmung des proximalen Endes des Femurs ist die angeborene Varusdeformität des Femurs ein Skelettdefekt. Es kann zu schwerwiegenden Funktionsstörungen des Bewegungsapparates kommen.
Beschreibung der femoralen Varusdeformität
Im Herzen der Krümmung Hüftgelenke Beim Varustyp handelt es sich um eine Verkürzung des Schenkelhalses und eine Verringerung des Winkels zwischen Hals und Diaphyse. Ein anderer Name für die Krankheit ist juvenile Epiphysiolyse, obwohl es sich bei letzterer tatsächlich um eine Form der Hüftdeformität handelt und sehr selten, nur im Jugendalter, auftritt. Veränderungen in den Hüftgelenken bei dieser Pathologie sind erheblich - Degeneration des schwammigen Gewebes des Halses, Knochenzerstörung, Zystenbildung, Fibrosephänomene.
Die Varus-Hüftdeformität umfasst eine ganze Reihe von Symptomen der unteren Extremitäten. Diese Krankheit kann die folgenden Symptome kombinieren:
- Veränderung der Form der Gelenkköpfe der Beckenknochen;
- Verkürzung des Beins;
- Kontrakturen des Hüftgelenks;
- Dysplasie, Dystopie der Beinmuskulatur;
- Lendenlordose.
Bei einem Kind mit Hüftdeformation liegt eine schwerwiegende Verletzung der Rotation und Abduktion des Beins vor, sodass der Gang „entenartig“ wird. Wenn die Anomalie bei einem Neugeborenen auftritt, ist das Bein bereits von Geburt an kürzer als das zweite Bein und der Trochanter des Femurs liegt höher als er sein sollte. Wenn die Pathologie längere Zeit nicht behandelt wird, schreitet sie weiter voran und es kommt zu einer Verknöcherung. Der Schenkelhals beugt sich und die Diaphyse verkürzt sich.
Wenn im Alter von 3 bis 5 Jahren eine Gelenkdeformität vom Varustyp auftritt, erscheint ein dreieckiges Knochenfragment im Oberschenkelhals. Optisch ähneln Kopf und Hals des Femurs einem umgekehrten Buchstaben U. Der Gelenkspalt wird gewunden, die Knochenränder sind gezackt, uneben und es treten Skleroseherde auf. Danach weitet sich der Spalt des Hüftgelenks auf 1–1,2 cm, der Hals verkürzt sich und der Kopf entwickelt sich nicht mehr normal.
Wenn bei der kindlichen Form der Varuskrümmung Veränderungen in der Knochenzone beobachtet werden, liegen bei der juvenilen Form Störungen in der Wachstumszone vor. Letzterer lockert sich, der Knochen löst sich auf, der Kopf rutscht langsam nach unten. Daher wird die Pathologie als „Epiphysiolyse des Femurkopfes“ bezeichnet.

Ursachen der Krankheit
Typischerweise ist eine angeborene Varusdeformität eine Folge einer intrauterinen Schädigung des Femurknorpels oder einer Störung im Prozess ihrer Verdichtung. Bei 2/3 der Patienten ist der Defekt einseitig, in anderen Fällen beidseitig. Somit tritt die Krankheit aufgrund von auf verschiedene Probleme in der Embryonalperiode, was aus folgenden Gründen passieren kann:
- schwere mütterliche Infektionen während der Schwangerschaft;
- Alkoholmissbrauch, Drogenkonsum, giftige Medikamente;
- Vergiftung, Rausch;
- fortgeschrittenes mütterliches Alter;
- endokrine Erkrankungen;
- Einfluss von Strahlung.
Erworbene Formen können aus verschiedenen Gründen entstehen. So entwickelt sich die juvenile Epiphysiolyse im Alter von 11 bis 16 Jahren – während der Pubertät oder geht der Pubertät voraus. Der Femurkopf beginnt sich gerade vor dem Hintergrund einer allgemeinen Umstrukturierung des Körpers zu verformen, wenn einige Teile des Skeletts am anfälligsten sind. Es wird angenommen, dass die Ursache der Pathologie bei Jugendlichen hormonelle Störungen sind, weshalb bei Patienten häufig auch andere Phänomene auftreten:
- Fehlen sekundärer Geschlechtsmerkmale;
- Verzögerung der Menstruation bei Mädchen;
- zu groß;
- Fettleibigkeit.
Außerdem ist eine Varusdeformität des Femurs mit Traumata und Rachitis sowie einer Reihe systemischer Erkrankungen verbunden – pathologische Knochenbrüchigkeit, fibröse Osteodysplasie, Dyschondroplasie. Die Pathologie kann auch verursacht werden durch:
- erfolglose Hüftoperation;
- Osteomyelitis;
- Knochentuberkulose;
- Osteochondropathie.

Symptome der Krankheit
Die Kindheitsform der Pathologie beginnt sich normalerweise spätestens im Alter von 3 bis 5 Jahren zu entwickeln, da in diesem Zeitraum die Belastung der unteren Extremitäten zunimmt. Eltern können die folgenden Symptome bemerken:
- Lahmheit nach einem langen Spaziergang;
- Schmerzen in den Beinen am Nachmittag aufgrund von Müdigkeit;
- Unfähigkeit, längere Zeit zu laufen oder Spiele im Freien zu spielen;
- Beschwerden in der Hüfte und im Knie, im Kniekehlenbereich;
- Schmerzen im Kniegelenk.
Mit der Zeit wird das Bein auf der betroffenen Seite etwas dünner, die Abduktion der Hüfte wird schwieriger, vor allem auf der Innenseite (auf der Außenseite kann sie dagegen zunehmen). Bei einer Reihe von Kindern beginnen die Symptome mit Schmerzen im Knie, wobei nicht immer sofort ein Zusammenhang mit einer Schädigung der Hüfte hergestellt werden kann.

Juvenile Formen der Hüftdeformität machen oft überhaupt keine klinischen Symptome, erst in fortgeschrittenen Fällen beginnen sie sich zu manifestieren. Es kommt zu leichter Lahmheit und erhöhter Müdigkeit beim Gehen. Manche Teenager haben einen hervortretenden Bauch und eine pathologische Lordose der Wirbelsäule. Die Kraft und der Tonus der Gesäßmuskulatur nehmen ab. Bei beidseitiger Hüftschädigung beginnt das Kind entenartig zu laufen, zu watscheln und zu schwanken.
Klassifikation der Pathologie
Aufgrund des Aussehens und der radiologischen Anzeichen kann eine Verformung der Oberschenkelknochen in folgenden Formen vorliegen: kindlich, jugendlich, symptomatisch, rachitisch, tuberkulös. Die Erkrankung kann auch isoliert auftreten oder andere Gelenke und Füße des Kindes betreffen. Eine weitere Einteilung beinhaltet die Einteilung der Erkrankung in drei Stadien (Grade).
Erster Schweregrad
Im ersten Stadium beginnen pathologische Veränderungen im Wachstumsbereich des Femurs. Es lockert sich allmählich und dehnt sich aus, aber die Epiphyse verschiebt sich nicht.
Zweiter Schweregrad
Im zweiten Stadium wird das Fortschreiten der Prozesse der Umstrukturierung des Knochengewebes und der Verschiebung der Epiphyse beobachtet. Das Bild zeigt eine Ausdünnung des Schenkelhalses und eine unklare Struktur.
Dritter Schweregrad
Im dritten Stadium wird bereits eine Komplikation der Pathologie registriert – deformierende Arthrose. Außerdem kommt es zu einer Muskelatrophie der unteren Extremität und zu ausgeprägten Gangveränderungen.

Diagnose einer Varusdeformität
Die beliebteste und aussagekräftigste Diagnosemethode bleibt die Röntgenaufnahme des Hüftgelenks. Gleich zu Beginn der Hüftdeformation zeigt sich eine Heterogenität der Knochenmasse im Bereich des Schenkelhalses. Später treten weitere strukturelle Veränderungen sowie Störungen in der Anatomie des Hüftgelenks auf.
Bei der Untersuchung durch einen Orthopäden werden Störungen der Adduktion und Abduktion der Extremität auf einer oder beiden Seiten festgestellt. Gleichzeitig können Kyphose, Skoliose, Lordose, keilförmige Verformung der Wirbel und andere Erkrankungen der Knie, des Kreuzbeins und der Knöchel diagnostiziert werden.
Behandlung der Pathologie
Im Anfangsstadium hilft eine konservative Therapie gut, später kommt sie zum Einsatz chirurgische Behandlung. Zunächst wird der Patient in der Regel wegen einer Extremitätentraktion (Skeletttraktion) ins Krankenhaus eingeliefert, danach wird die Behandlung zu Hause fortgesetzt.
Konservative Behandlung
Bei einer angeborenen Form der Pathologie ist eine konservative Therapie für alle Babys bis zum Alter von 3 Monaten angezeigt. Ziel ist es, die Blutversorgung des Hüftgelenks zu normalisieren und die Knochenregeneration zu beschleunigen, den Tonus des Muskelgewebes zu verbessern und den Einfluss der Muskeln auf den Zustand des Gelenks zu verringern. Zu diesem Zweck werden folgende Behandlungsmethoden durchgeführt:
- 14 Tage lang weit wickeln, dann 2,5 Monate lang ein Freika-Kissen;
- Sollux, Paraffinanwendungen;
- von 6-8 Wochen - Elektrophorese im Gelenkbereich mit Kalzium, Phosphor, mit Vasodilatatoren - im Bereich der Kreuzbeinwirbelsäule.

Andere Formen der Varusdeformität werden durch vollständige Entlastung des Beins und strikte Bettruhe behandelt. Der Patient erhält einen Gipsverband und eine Traktion mit einer Belastung von bis zu 2 kg. Die Behandlung kann mehrere Monate dauern und wird daher häufig in spezialisierten Sanatorien durchgeführt.
Betrieb
Wenn die Prozesse des Knochenumbaus bereits abgeschlossen sind und eine ausgeprägte Varusdeformität des Femurs vorliegt, sollte eine chirurgische Behandlung geplant werden. Es hilft, die Extremität zu verlängern, die Integrität der Gelenkflächen wiederherzustellen und die Entwicklung einer Coxarthrose zu verhindern.
Bei Babys älter als 3 Monate mit Kontrakturen des Hüftgelenks ist ebenfalls eine Operation angezeigt. Ziel ist es, Bedingungen für eine ordnungsgemäße Entwicklung des Knochenkopfes zu schaffen und eine Verformung des Hals-Schaft-Winkels zu verhindern.
Bei der Operation werden die Adduktoren des Oberschenkels, die Fascia lata und eine Reihe von Sehnen durchtrennt. Faserstränge im Bereich der Gesäßmuskulatur werden entfernt. Bei Kindern ab 3 Jahren wird bei übermäßiger Verknöcherung des Schenkelhalses zusätzlich eine Korrekturosteotomie durchgeführt. Die Operation umfasst eine Zervikoplastik. Sie wird im zweiten Stadium nach der Heilung des Knochengewebes durchgeführt – mehrere Monate nach dem ersten Eingriff.
Rehabilitationsbehandlung
Nach der Operation muss dem Patienten ein Komplex aus Bewegungstherapie, Physiotherapie und allgemeiner restaurativer medikamentöser Behandlung verschrieben werden. Kinder nutzen Orthesen und andere orthopädische Hilfsmittel. So kann bei einer Hüftverkrümmung im Heranwachsenden der Einsatz von Orthesen mehrere Jahre anhalten. Die ärztliche Beobachtung erfolgt bis zur Vollendung des 18. Lebensjahres des Kindes.
Unbehandelt schreitet die Pathologie stetig voran, was zur Bildung eines falschen Schenkelhalsgelenks führt (in 50-70 % der Fälle). Es kommt dann zu einer Coxarthrose, die letztlich einen Gelenkersatz erforderlich macht. Wenn die Behandlung frühzeitig begonnen wird, ist das Ergebnis oft günstig.
/ Q65-Q79 Angeborene Anomalien, Fehlbildungen und Deformationen des Bewegungsapparates / Q68 Sonstige angeborene Deformationen des Bewegungsapparates
Angeborene Varusdeformität des Schenkelhalses
Die angeborene Varusdeformität des Schenkelhalses (Coxa vara congenita) ist ein Symptomkomplex von Entwicklungsanomalien. Die Hauptmanifestationen der Pathologie sind eine Varusdeformität des Schenkelhalses, eine Verkürzung der unteren Extremität, eine Kontraktur des Hüftgelenks sowie Dysplasie und Dystopie der Muskeln der betroffenen Extremität unterschiedlicher Schwere.
Epidemiologie
Die angeborene Varusdeformität des Schenkelhalses ist eine seltene Pathologie des Bewegungsapparates und macht 0,3–0,8 % aller Skelettfehlbildungen aus, wobei nicht mehr als ein Fall pro 52.000 Neugeborene auftritt.
Ätiologie, Pathogenese
Als Hauptursachen für die Entstehung der Erkrankung gelten Störungen der enchondralen Ossifikation der proximalen Metaepiphyse des Femurs und der Bildung der Beckengürtelmuskulatur in der Embryonalperiode sowie Anomalien in der Entwicklung des Gefäßbetts B. Veränderungen im Rückenmark wie Myelodysplasie, die sich in neurodystrophischen Erkrankungen von Knochen und Weichgewebe äußern.
Klinisches Bild und Diagnose
Charakteristische klinische Manifestationen einer angeborenen Varusdeformität des Schenkelhalses sind eine Verkürzung der unteren Extremität, hauptsächlich aufgrund des Oberschenkelsegments, eine Kontraktur des Hüftgelenks und eine Hypotrophie der Weichteile des Ober- und Unterschenkels.
Die Verkürzung der unteren Extremität auf der betroffenen Seite kann bereits bei Säuglingen erhebliche Ausmaße annehmen. Unter den radiologischen Anzeichen ist das Vorhandensein des sogenannten Gratian-Tuberkels hervorzuheben, eine Verringerung des Hals-Diaphysen-Winkels (CHA) auf 115° oder weniger, eine beeinträchtigte Verknöcherung des Kopfes und Halses des Femurs mit dem Vorliegen dystrophischer Prozesse in ihnen bis hin zur Bildung eines falschen Gelenks und eines Halsdefekts sowie einer Diskrepanz zwischen den Größen des proximalen und distalen Teils des verkürzten Femurs.
Eine wichtige Rolle bei der Diagnose dieser Pathologie spielt die Ultraschalluntersuchung (Ultraschall), die es ermöglicht, die Form, Größe des Kopfes und Halses des Femurs, ihre räumliche Position und das Vorhandensein oder Fehlen ihrer Verbindung untereinander zu bestimmen sowie die Dichte des Knochen- und Knorpelgewebes dieser anatomischen Formationen.
Behandlung
Die Behandlung von Kindern mit angeborener Varusdeformität des Schenkelhalses beginnt ab dem Zeitpunkt der Feststellung der Erkrankung.
a) Konservative Behandlung
Die konservative Behandlung wird bei allen Kindern bis zum Alter von 2-3 Monaten durchgeführt. Ziel ist es, die Blutversorgung zu verbessern und die Verknöcherung des Kopfes und Halses des Oberschenkelknochens zu beschleunigen, den Tonus der Adduktoren- und Subspinalmuskulatur zu reduzieren und deren Druckwirkung auf das Hüftgelenk zu verringern. Zu diesem Zweck wird Neugeborenen ein breites Wickeln für 2 Wochen und anschließend ein nicht starr fixierendes Freika-Kissen für einen Zeitraum von bis zu 2 bis 2,5 Monaten verschrieben. Indiziert sind Sollux, Paraffin und ab einem Alter von 6-8 Wochen - Elektrophorese mit Calcium- und Phosphorpräparaten am Hüftgelenk Nr. 10-15, Elektrophorese mit Aminophyllin und Pentoxifyllin am paravertebralen Lumbosakralwirbelsäule Nr. 10.
b) Chirurgische Behandlung
Bei Kindern, die älter als 2–3 Monate sind und an weichteilfixierten Kontrakturen des Hüftgelenks leiden, ist eine chirurgische Behandlung indiziert. Dadurch können günstige Bedingungen für die Entwicklung des Femurkopfes geschaffen und so die Bildung einer sekundären Verformung des Hals-Schaft-Winkels verhindert werden.
Die chirurgische Behandlung besteht aus einer Myotomie der M. adductorus longus, brevis und magnus des Oberschenkels, einer transversalen Dissektion der Fascia lata und des Sehnenteils des Tractus iliotibialis, einer Kreuzung von Fasersträngen im vorderen Teil des Musculus gluteus medius und einer Myotomie des Musculus gluteus medius subspinale und lumboiliakale Muskeln. Bei Kindern über 2-3 Jahren wird die Operation durch eine korrigierende Osteotomie des Femurs ergänzt.
Eine Korrekturosteotomie ist nur bei radiologischen Anzeichen einer Verknöcherung des Schenkelhalses indiziert. Sie sollte nicht durchgeführt werden, wenn eine Pseudarthrose des Halses oder eine gestörte Ossifikation vorliegt. In letzteren Fällen ist die erste Stufe der chirurgischen Behandlung eine plastische Operation des Schenkelhalses mit einem wandernden muskuloskelettalen Gewebekomplex aus dem Trochanter major (vorderer Teil des Musculus gluteus medius) oder dem Beckenkamm (Musculus sartorius). Die korrigierende Osteotomie des Oberschenkelknochens wird als zweite Stufe der chirurgischen Behandlung nach der Normalisierung der Struktur des Knochengewebes des Schenkelhalses durchgeführt.
c) Rehabilitationsbehandlung
Die Rehabilitationsbehandlung umfasst den Einsatz physiotherapeutischer Techniken, physikalischer Therapie, restaurativer Behandlung und Klimatherapie.
Die Wiederherstellung der Länge der unteren Extremität bei Kindern mit angeborener Varusdeformität des Schenkelhalses erfolgt mit der Methode der Distraktionsosteosynthese nur dann, wenn die normalen anatomischen Verhältnisse im Hüftgelenk wiederhergestellt sind.
Um sekundäre statische Verformungen zu verhindern, sollten Kinder orthopädische Produkte verwenden. In extrem schweren Fällen ist eine Prothetik indiziert.
Die Behandlung von Kindern mit angeborener Varusdeformität des Schenkelhalses ist langfristig, stufenweise und komplex. Sie werden jährlich bis zum 18. Lebensjahr überwacht.
Vorhersage
Ohne eine pathogenetisch gesicherte Behandlung schreitet die Varusdeformität des Schenkelhalses fort und führt in manchen Fällen zur Ausbildung einer Pseudarthrose des Schenkelhalses, in manchen Fällen auch zu deren Defekt. Die Zahl der ungünstigen Ergebnisse bei der Behandlung dieser Pathologie beträgt 40-80 %.
Valgusdeformität des Schenkelhalses (Coxa valga)
Die Valgusdeformität des Schenkelhalses ist eine Pathologie, die sich in einer Vergrößerung des Hals-Diaphysen-Winkels äußert. 80 % der Patienten tragen bilateraler Charakter, in der Regel verbunden mit einer Abweichung des proximalen Endes des Femurs zusammen mit dem Kopf nach vorne von der Frontalebene (transkondyläre Ebene) - Antetorsion.
Ätiologie
Die Ursachen der Verformung können sein:
Hüftdysplasie;
Intrauterine Schädigung des Epiphysenknorpels des Schenkelhalses;
Gestörte Verknöcherung des Schenkelhalses;
Muskelungleichgewicht aufgrund eines mesenchymalen Mangels;
Verzögerter Beginn des Gehens des Kindes;
Längere Bettruhe in Zeiten intensiven Wachstums.
Krankheitsbild
Normalerweise gibt es erhebliche individuelle Unterschiede in der Größe des Antetorsionswinkels. Eine isolierte Coxa valga (ohne zervikale Antetorsion) ist in der Regel asymptomatisch und kann ein Zufallsbefund bei einer Röntgenuntersuchung sein. Gleichzeitig hat die Coxa valga antetorta eine gewisse praktische Bedeutung und äußert sich in einer ausgeprägten Innenrotation der unteren Extremitäten beim Gehen; bei der klinischen Untersuchung fällt eine übermäßige Innenrotation der Hüften auf.
Diagnose
Röntgenuntersuchung
Bei der Diagnose einer Coxa valga antetorta, die aus einer Hüftdysplasie resultiert, ist eine eingehende Röntgenanalyse mit Interpretation der Röntgendaten in direkter, axialer und sagittaler Projektion erforderlich.
Behandlung
Eine Abweichung von der Norm der integralen radiologischen Parameter (Wieberg-Winkel, vorderer Abdeckungswinkel), begleitet von Beschwerden wie Müdigkeit am Ende des Tages, Schmerzen und einem positiven Impingementtest, erfordert eine chirurgische Korrektur. Dabei kommen Detorsion-Varus- und Detorsion-intertrochantäre medialisierende Osteotomien des Femurs zum Einsatz. Bei Anzeichen einer dysplastischen Coxarthrose ist eine Transposition des Acetabulums nach Beckenosteotomie indiziert (nach Salter doppelte, dreifache Beckenosteotomie).
15439 0
Schwierige Fälle der primären Hüftendoprothetik: Deformität des proximalen Femurs
Die normale Anatomie des proximalen Femurs ist sehr unterschiedlich, und in den allermeisten Fällen ist es möglich, mit Standardendoprothesen unter Einhaltung der üblichen Operationstechnik zurechtzukommen. Aus praktischer Sicht kann eine Hüfte als deformiert gelten, wenn ihre Form und Größe so ungewöhnlich sind, dass anatomische Anomalien durch den Einsatz spezieller Operationstechniken oder nicht standardmäßiger Implantate ausgeglichen werden müssen.
Deformitäten des proximalen Femurs kann angeboren (Dysplasie), posttraumatisch (nicht ordnungsgemäß verheilte Frakturen der Trochantärregion), iatrogen (therapeutisch korrigierende intertrochantäre oder subtrochantäre Osteotomien) sein und sich auch als Folge von Stoffwechselstörungen im Knochengewebe (Morbus Paget) entwickeln.
Hüftdeformitäten werden nach der anatomischen Lage klassifiziert, zu der der Trochanter major, der Oberschenkelhals, die Metaphyse und die Diaphyse gehören. Die Deformitäten in jeder der aufgeführten anatomischen Zonen können wiederum nach der Art der Verschiebung unterteilt werden: eckig (Varus, Valgus, Flexion, Extension), transversal, rotatorisch (mit Zunahme oder Abnahme der Anteversion des Schenkelhalses). Darüber hinaus sind Veränderungen der normalen Knochengröße und eine Kombination dieser Anzeichen möglich. Die größten Behandlungsschwierigkeiten stellen Verformungen des Femurs in zwei Ebenen und in mehreren Ebenen dar.
Allgemeine Behandlungsgrundsätze.
Bei Vorliegen einer Femurdeformität ist eine sorgfältige präoperative Planung erforderlich, um die Durchführbarkeit von Standardansätzen und -designs zu ermitteln. Bei einigen Deformitäten treten erhebliche Schwierigkeiten bei der Vorbereitung des Markkanals auf. Beispielsweise kann eine Breitenverschiebung der Diaphyse in der Sagittalebene beim Einsetzen einer Beinendoprothese zu einer Perforation der vorderen Kortikaliswand führen. Mit der intraoperativen Fluoroskopie oder Radiographie können Sie den Fortschritt der Kanalvorbereitung überwachen und das Risiko einer Perforation der Femurwand deutlich reduzieren. Der Chirurg muss entscheiden, ob er den Schaft durch Abweichung von der Standardposition installieren kann oder ob dies nicht möglich ist und auf eine femorale Osteotomie zurückgegriffen werden muss. Das Vorhandensein einer Verformung beeinflusst die Wahl der Beingeometrie und die Art ihrer Fixierung. Es gibt Arten von Deformitäten, die speziell entwickelte Femurkomponenten und in einigen Fällen maßgeschneiderte Femurkomponenten erfordern. Bei schweren Deformitäten ist häufig eine Osteotomie des Femurs und in einigen Fällen eine zweizeitige Operation erforderlich.
Auf diese Weise, ungünstige Faktoren Folgende Faktoren können während der Operation zu Schwierigkeiten führen und die Wahl der Beinprothese beeinflussen: Osteoporose, Deformation des Knochenmarkkanals in der Sagittal- und Frontalebene, Medialisierung und Rotation des Femurs, das Vorhandensein von nicht entfernten Beinen Metallkonstruktionen. Vor der Operation muss der Chirurg sorgfältig planen und über verschiedene Ausführungen endoprothetischer Beine mit unterschiedlichen Befestigungsarten verfügen. Der Chirurg steht vor folgenden Fragen:
- die Möglichkeit der sofortigen oder schrittweisen Beseitigung der Deformität und des Einbaus einer Endoprothese;
- Korrektur der Gliedmaßenlänge;
- Erholung Muskeltonus;
- Wahl des Endoprothesendesigns;
- Entfernung von Metallkonstruktionen, die bei früheren Operationen installiert wurden.
Wir verwenden die folgende Arbeitsklassifizierung von Verformungen:
- Je nach Verformungsgrad: Schenkelhals; Trochanterbereich; subtrochantäre Region (oberes Drittel des Oberschenkels); zweistufig.
- Nach Art der Verschiebung: einflächig; Zwei-Ebenen; multiplanar.
Auswahl der chirurgischen Behandlungsmethode abhängig vom Grad der Femurdeformität
Größere Trochanterdeformität.
Es gibt zwei Haupttypen der Verformung des Trochanter major, die die Durchführung der Arthroplastik erschweren: Überhang des Trochanter major mit Blockierung des Markkanaleingangs und seiner hohen Lage. Wenn der große Trochanter übersteht, wird die Vorbereitung des Kanals deutlich schwieriger und es besteht die reale Gefahr, dass er abbricht und die Endoprothese im Varusbereich eingesetzt wird. Das Problem der Endoprothetik mit hoher Lage des Trochanter major ist die Möglichkeit, dass der Trochanter auf dem Becken aufliegt („Impingement“-Syndrom), was zu einer hinteren Instabilität des Gelenks während der Beugung und Innenrotation der Hüfte führt und das Erscheinungsbild beeinträchtigt Lahmheit aufgrund einer Insuffizienz der Abduktionsmuskulatur der Hüfte. Um diesen Komplikationen vorzubeugen, empfiehlt es sich, beim Zugang zunächst eine Osteotomie des Trochanter major durchzuführen, was die Aufbereitung des Kanals erleichtert und es ermöglicht, die Kraft der Abduktorenmuskulatur durch Absenken des Trochanter major zu kompensieren.
Deformität des Schenkelhalses.
Es gibt drei Arten von Deformitäten: Valgus (zu großer Hals-Schaft-Winkel), Varus (verringerter Hals-Schaft-Winkel) und Torsion (übermäßige Anteversion oder Retroversion). Oft werden diese Verformungsarten miteinander kombiniert. Die Wahl der Behandlung einer Varusdeformität hängt vom Vorliegen beidseitiger oder einseitiger Läsionen sowie der Notwendigkeit einer Beinlängenänderung ab. Bei einer einseitigen Deformität ist das betroffene Bein in der Regel kürzer und es können Standardstrukturen verwendet werden. Wenn der Chirurg die Länge des Beins bei beidseitiger Deformität beibehalten möchte, muss die Verwendung eines Beins mit einem kleineren Hals-Schaft-Winkel (z. B. das Alloclassic-Bein hat einen Winkel von 131°) oder mit einem größeren „Offset“ in Betracht gezogen werden “ und einen Kopf mit verlängertem Hals. In diesem Fall ist es möglich, die Anatomie des Gelenks wiederherzustellen, ohne das Bein zu verlängern.
Eine Valgusdeformität des Schenkelhalses ist in der Regel mit einer schmalen Metaepiphyse verbunden und erfordert die Verwendung von Schäften mit einem schmalen proximalen Teil. Darüber hinaus empfiehlt es sich, Implantate mit einem Hals-Schaft-Winkel von 135° oder mehr zu verwenden.
Kleinere Torsionsverformungen des Schenkelhalses können durch die entsprechende Position des Endoprothesenschaftes ausgeglichen werden. Probleme treten auf, wenn der Anteversionswinkel größer als 30° ist.
Wenn das Bein in dieser Position platziert wird, führt dies zu einer eingeschränkten Außenrotation und kann mit einer Hüftluxation einhergehen. Sie können das Bein in der richtigen Position installieren, indem Sie es auf Knochenzement installieren oder konische Prothesen (Wagner-Typ) verwenden. Ein anderer Ausweg aus dieser Situation könnte darin bestehen, Beine mit modularem Aufbau (z. B. S-ROM, ZMR) zu verwenden. Bei schweren Rotationsdeformitäten, wenn andere chirurgische Methoden nicht anwendbar sind, wird eine Derotationsosteotomie des Femurs durchgeführt.
Deformationen der Trochanterregion des Femurs sind äußerst unterschiedlich und haben mehrere Ursachen. Grundsätzlich ist die Verwendung beider Beinarten möglich. In der präoperativen Phase ist eine sorgfältige Planung erforderlich, um die optimale Position des Schafts und die Größe des Zementmantels zu bestimmen. Zementierte Schäfte werden am häufigsten bei älteren Patienten mit Anzeichen einer Osteoporose verwendet. Darüber hinaus kommt diese Möglichkeit der Endoprothetik zum Einsatz, wenn es Schwierigkeiten bei der Installation eines zementfreien Fixationsschaftes gibt.
Röntgenaufnahmen der Beckenknochen von Patient V., 53 Jahre alt, mit linksseitiger dysplastischer Coxarthrose: a – 6 Jahre nach der therapeutischen intertrochantären Osteotomie wird ein Fortschreiten der Coxarthrose beobachtet; b - Endoprothetik des linken Hüftgelenks mit einer Standard-Hybrid-Endoprothese (Trilogy-Pfanne, Zimmer, Lubinus Classic Plus Bein, W.Link mit 126° Weitwinkel). Die Wahl des Schafts wird durch seine größtmögliche Übereinstimmung mit der Geometrie des Markkanals des Femurs bestimmt.
Es ist zu beachten, dass beim gleichzeitigen Entfernen der Platte (nach MWO) mit der Installation eines Zementfixierungsschafts Schwierigkeiten bei der guten Kompression des Zements auftreten. Um zu verhindern, dass Zement aus den Löchern, in denen sich die Schrauben befanden, austritt, müssen diese mit Knochentransplantaten in Form von Keilen fest verschlossen werden.

Röntgenaufnahmen des rechten Hüftgelenks des 70-jährigen Patienten M. mit Varusdeformität des Schenkelhalses: a - 12 Jahre nach therapeutischer intertrochantärer Osteotomie; b - Osteoporose des Femurs, ein breiter Markkanal bestimmte den Einbau eines keilförmigen Schafts mit Zementfixierung (CPT, Zimmer) nach Entfernung der Platte.
Die Verwendung standardmäßiger zementfreier Fixierungsschäfte ist nach Varus- und Varus-intertrochantären Osteotomien möglich, jedoch mit einer leichten Änderung des Hals-Diaphysen-Winkels und einer Medialisierung des distalen Femurs. In diesen Fällen ist es ratsam, vollständig bedeckte Beine zu verwenden. Manchmal ist die Valgusplatzierung des Endoprothesenschafts gerechtfertigt, es wird jedoch empfohlen, Implantate mit einem Halswinkel von 126 Zoll zu verwenden, um einer Instabilität vorzubeugen.

Röntgenaufnahmen des 54-jährigen Patienten S. mit linksseitiger dysplastischer Coxarthrose: a - Verformung der Metaepiphyse des Femurs nach derotational-valgusisierender intertrochantärer Osteotomie (8 Jahre nach der Operation); b – Eine leichte Medialisierung ermöglichte die Verwendung eines standardmäßigen zementfreien AML-Fixierungsschafts (DePuy); Die Wahl eines Schafts mit einer ausreichend ausgedehnten Kugelbeschichtung (5/8 der Länge) ist auf die Notwendigkeit einer distalen Fixierung der Endoprothese aufgrund der ausgeprägten Verdichtung des Knochengewebes an der MVO-Stelle zurückzuführen. c, d – 6 Jahre nach der Operation.

Röntgenaufnahmen des rechten Hüftgelenks von Patient F., 51 Jahre alt: a - aseptische Nekrose des Femurkopfes, verheilte Femurfraktur nach Valgus VIVO, durchgeführt vor 11 Jahren; b, c - Der zementfreie Fixierungsschaft VerSys ET (Zimmer) wird mit einer Valgusneigung entsprechend der Geometrie der Metaepiphyse des Femurs installiert, der Schnabelkanal der Platte wird mit spongiösem autologem Knochen gefüllt.
Eine übermäßige Medialisierung des distalen Teils des Femurs und eine Rotationsflexion-Valgus-Deformität der intertrochantären Region erschweren die Wahl des Implantats erheblich. In diesen Fällen wird sie durch die Form des Kanals unterhalb des Verformungsniveaus bestimmt. Bei einer konischen Form, meist in Kombination mit einem kleinen Durchmesser, ist das Implantat der Wahl der Wagner-Schaft, der eine gute Primärfixierung bietet und keine Probleme bei der Wahl der Rotationsinstallation bereitet.

Einebene Deformität der Trochanterregion mit starker Medialisierung des distalen Fragments und einer konischen Form des Femurkanals: a – vor der Operation; b – 2 Jahre nach der Installation des konischen Beins von Wagner (Zimmer).
Wenn der Knochenkanal eine runde Form hat, werden Revisionskonstruktionen mit runder Beinform bevorzugt, eine Option hierfür kann ein Bein mit „Kapkar“ sein. Ein besonderes Merkmal dieses Designs ist das Fehlen einer proximalen Ausdehnung, das Vorhandensein spezieller Flansche des proximalen Teils des Schafts in der Sagittalebene (um Rotationsstabilität der Prothese zu gewährleisten) und eine vollständige poröse Beschichtung des Schafts, die eine distale Fixierung gewährleistet der Prothese.

Röntgenaufnahmen des rechten Hüftgelenks von Patient B., 53 Jahre alt: a - Pseudarthrose des rechten Femurhalses, verheilte Femurfraktur nach mednalisierender therapeutischer intertrochantärer Osteotomie; b,c - Unter Berücksichtigung der übermäßigen Medialisierung der Femurdiaphyse wurde für die Endoprothetik ein Schaft mit „Calcar“ (Solution, DoPuy) gewählt, der über die gesamte Länge eine poröse Beschichtung aufweist, die eine distale Fixierung der Endoprothese gewährleistet.
Ein besonderes Merkmal der chirurgischen Eingriffstechnik ist die Notwendigkeit einer sorgfältigen Überprüfung des Markkanals und der gesamten Trochanterregion. Die Lateralisierung des Trochanter major führt zu einer falschen Vorstellung über die Lokalisierung des Kanals, und die Flexion-Extension-Deformation führt zu einer falschen Vorstellung über seine Richtung. Daher ist einer der häufigsten Fehler die Perforation der Femurwand an der Osteotomiestelle. Eine vorherige Derotation des proximalen Teils (normalerweise nach außen) kann dazu führen, dass die Prothese in einer Position übermäßiger Anteversion installiert wird.

Röntgenaufnahmen des rechten Hüftgelenks von Patient G., 52 Jahre alt: a - aseptische Nekrose des Femurkopfes, verheilte Fraktur nach medialer MBO; b - Perforation der Außenwand des Femurs mit dem Bein der Endoprothese an der Stelle der Osteotomie (intraoperatives Röntgenbild); c - Wiedereinsetzen des Beins in die richtige Position mit Fixierung des Trochanter major mit Cerclagen (1 Jahr nach der Operation).
Deformation der subtrochantären Region ohne ausgeprägte Deformation des Markkanals. Bei dieser Form der Deformation wird die Fixierung des Implantats unterhalb der Deformationsebene am meisten bevorzugt; bei einem runden Kanal empfiehlt sich die Verwendung eines runden, vollständig abgedeckten Schafts mit zementfreier Fixierung, bei einem keilförmigen Kanal schon Es empfiehlt sich, einen konischen Stiel zu verwenden.

Röntgenbilder des Patienten K., 53 Jahre alt, mit Hüftdeformität im subtrochantären Bereich, angeborener Hüftluxation (Grad C): a – vor der Operation; b - Die Trilogy-Pfanne (Zimmer) wird in anatomischer Position unter Berücksichtigung der Verformung des Femurs im mittleren Drittel eingebaut, ein kurzer konischer Wagner-Stiel (Zimmer) wird implantiert, plastische Chirurgie der Oberschenkelinnenseite auf Höhe des Hals der Prothese mit einem autogenen Knochentransplantat.
Bei starker Deformation der subtrochantären Region ist Folgendes erforderlich:
- Osteotomie auf der Ebene der Deformität; Installation der Hüftpfannenkomponente in einer anatomischen Position;
- Korrektur der Beinlänge durch die Position des Endoprothesenbeins;
- Wiederherstellung der Muskel-„Hebelwirkung“ durch Spannung und Fixierung des Trochanter major oder des proximalen Femurs;
- Gewährleistung einer stabilen Fixierung von Knochenfragmenten nach der Osteotomie.
Bei schweren Deformitäten ist eine grundlegend andere Operationstechnik erforderlich, einschließlich der Osteotomie des Femurs.

Röntgenbilder des Patienten T., 62 Jahre alt: a, b - angeborene Hüftluxation (Grad D), Verformung der subtrochantären Region nach Osteotomie mit dem Ziel, eine stützende Hüfte zu schaffen; c - Einbau der Hüftpfannenkomponente Trilogy (Zimmer) in anatomischer Position, keilförmige Osteotomie des Femurs auf Höhe der Deformität mit Implantation eines konischen Revisions-Wagner-Schafts (Zimmer), Refixation des Trochanter major mit Schrauben; d – Position des Implantats und des großen Trochanters 15 Monate nach der Operation.
Verformungen auf Höhe des Femurschafts führen zu komplexen Problemen bei der Implantatauswahl. Mittelschwere oder geringfügige Deformitäten können durch die Verwendung eines zementierten Schafts ausgeglichen werden, der in der Position zur Korrektur der Femurachse platziert wird. Es ist wichtig, einen ausreichenden Zementmantel um den Stamm herum zu erhalten. Bei großen Deformitäten ist die Durchführung einer Osteotomie des Femurs erforderlich. Es sind verschiedene Osteotomieoptionen möglich. Die transversale Durchschneidung des Knochens ist eine relativ einfache Manipulation, es muss jedoch berücksichtigt werden, dass dies eine starke Fixierung der Beinprothese sowohl im distalen als auch im proximalen Fragment erfordert, um eine Rotationsinstabilität zu verhindern. Die Stufenosteotomie stellt große technische Herausforderungen dar, bietet aber eine gute Stabilität der Knochenfragmente. Nach Durchführung einer Osteotomie können sowohl zementierte als auch zementfreie Fixationsschäfte verwendet werden. Da es jedoch schwierig ist, das Eindringen von Knochenzement in den Osteotomiebereich zu verhindern, werden in der Regel runde Schäfte mit zementfreier Fixierung mit vollständig poröser Beschichtung (für einen runden Kanal) oder konische Wagner-Schäfte für einen keilförmigen Kanal bevorzugt. geformter Kanal. Eine zusätzliche Fixierung der Fragmente ist in der Regel nicht erforderlich, in Zweifelsfällen empfiehlt sich jedoch eine Verstärkung der Osteotomielinie durch Allobone-Kortikalistransplantate und fixierte Cerclagenähte.
Unter Berücksichtigung des oben Gesagten haben wir bei der Kombination von Korrekturosteotomie und gleichzeitiger Endoprothetik folgende Anforderungen an die Operationstaktik ermittelt:
- ausreichende Spannung der Weichteile auf Höhe der Osteotomie mit möglicher freier Reposition des Endoprothesenkopfes;
- Rotationsstabilität des distalen Fragments und seine korrekte Ausrichtung;
- fester „Sitz“ des Endoprothesenschenkels sowohl im distalen als auch im proximalen Fragment;
- ausreichender Kontakt des Beins mit dem distalen Fragment (mindestens 6-8 cm);
- Schaffung einer stabilen Fixierung von Fragmenten aufgrund ihrer Fixierung nach dem Typ „Russische Burg“.
Zur Veranschaulichung präsentieren wir einen Auszug aus der Krankengeschichte eines Patienten mit einem Defekt im Knochengewebe der Hüftpfanne und einer Verformung der Femurdiaphyse.
Der 23-jährige Patient des Hüftgelenks und Verkürzung des Beines um 7 cm. In einer der medizinischen Einrichtungen des Patienten wurden ab 1999 nacheinander folgende Operationen durchgeführt: supraacetabuläre Acetabuloplastik, subtrochantäre Flexion-Derotationsosteotomie des Femurs. Durch den Kontakt des Femurkopfes mit der Metallendoprothese des Acetabulumdaches kam es zur Zerstörung des Femurkopfes und zu seiner hinteren Subluxation. In der Klinik wurde am 15. Januar 2001 folgende Operation durchgeführt: Das linke Hüftgelenk wurde über einen externen transglutealen Zugang freigelegt, die Endoprothese des Acetabulumdaches entfernt und der Femurkopf reseziert. Bei der Inspektion stellte sich heraus, dass die Hüftpfanne abgeflacht war, die hintere Wand geglättet war und an der Stelle der Metallplatte ein durchgehender Defekt bestand. Der Femur ist nach innen gedreht (an der Osteotomiestelle) und weist eine Winkeldeformität auf (der Winkel ist nach hinten offen und beträgt 35°). Es wurde eine Knochentransplantation des Acetabulumdefekts durchgeführt, ein Muller-Stützring implantiert und mit 4 Spongiosaschrauben fixiert, und ein Polyethylenliner wurde in der üblichen anatomischen Position auf Knochenzement mit Gentamicin installiert. Auf Höhe der Deformität wurde eine keilförmige Osteotomie des Femurs durchgeführt und der Femur neu positioniert (Extension, Derotation). Nach der Vorbereitung des Markkanals mit Bohrern und Raspeln wurde ein vollständig abgedeckter, zementfrei befestigter Schaft (AML, DePuy) installiert. Die Osteotomielinie wird mit kortikalen Allotransplantaten abgedeckt, die mit zervikalen Nähten fixiert werden. In der postoperativen Phase ging der Patient 4 Monate lang mit Hilfe von Krücken mit dosierter Belastung des Beins, gefolgt von einem Übergang auf einen Gehstock. Das Beinlängendefizit betrug 2 cm und wurde durch das Tragen von Schuhen ausgeglichen.

Röntgenaufnahmen des linken Hüftgelenks und Computertomogramme von Patient X., 28 Jahre alt(Erläuterungen im Text).
Die Nachteile der Verwendung runder, massiver Beine sind die Atrophie des Knochengewebes des proximalen Femurs, das „Stress-Shielding“-Syndrom, dessen klinische Manifestation das Auftreten von Schmerzen im mittleren Drittel des Oberschenkels auf Höhe der „Spitze“ ist ” der Endoprothese bei körperlicher Aktivität. Wenn der Knochenkanal kegelförmig ist, sollten vorzugsweise Wagner-Revisionsschäfte verwendet werden. Es ist jedoch zu beachten, dass diese Implantate keine Biegung aufweisen und daher eine sorgfältige Auswahl der Implantatlänge erforderlich ist.

Röntgenaufnahmen des Patienten T., 56 Jahre alt: a - linksseitige disilastische Coxarthrose mit Luxation des Femurkopfes (Grad D), Deformation des Femurs im oberen Drittel und nach korrigierender Osteotomie; b – ein Versuch, ohne Osteotomie auf dem Höhepunkt der Deformität in den Kanal einzudringen, war erfolglos (intraoperative Röntgenaufnahmen); c - Ein AML-Schaft (DePyu) wurde nach einer Z-förmigen Osteotomie des Femurs auf der Höhe der Deformität installiert, zusätzliche Fixierung der Osteotomielinie mit einem Knochenautotransplantat aus dem Femurkopf; d, e - Röntgenaufnahmen nach 18 Monaten: Konsolidierung im Osteotomiebereich, gute Osseointegration beider Komponenten, die Prothesenspitze liegt an der Vorderwand des Femurs an (angedeutet durch den Pfeil), was bei starker körperlicher Anstrengung Schmerzen verursacht

Röntgenbilder des Patienten K., 42 Jahre alt, mit rechtsseitiger dysplastischer Coxarthrose (Grad D), doppelter Deformität des proximalen Femurs: a – vor der Operation; b - Trilogie-Pfanne (Zimmer) in anatomischer Position installiert, Z-förmige Osteotomie des Femurs auf der Höhe der Verformung mit Fixierung von Fragmenten nach dem Typ „Russische Burg“, Revision des Wagner-Stiels (Zimmer); c - Stabile Fixierung beider Komponenten der Endoprothese, Konsolidierung im Osteotomiebereich nach 9 Monaten.
Azetabulumfrakturen stellen eine schwere Verletzung dar, sie treten in den meisten Fällen kombiniert auf und haben unabhängig von der Behandlungsmethode eine ungünstige Prognose. Im Laufe der Zeit kommt es bei 12 – 57 % der Betroffenen zu degenerativ-dystrophischen Veränderungen im Hüftgelenk. 20 % der Patienten entwickeln eine deformierende Arthrose Grad II–III und 10 % entwickeln eine aseptische Nekrose des Femurkopfes.
Die Ergebnisse des Hüftgelenkersatzes nach Frakturen der Hüftpfanne sind schlechter als die Ergebnisse dieser Operation bei deformierender Arthrose des Hüftgelenks. Die Häufigkeit einer aseptischen Lockerung der acetabulären Komponente der Zementfixierung im Langzeitverlauf (10 Jahre nach der Operation) beträgt bei posttraumatischer Coxarthrose 38,5 %, bei konventionellen Formen der Arthrose des Hüftgelenks 4,8 %. Auch die mechanische Instabilität zementfreier Fixierungsendoprothesen ist im betrachteten Patientenkollektiv hoch und beträgt 19 % für die Acetabulum- und bis zu 29 % für die Femurkomponenten. Zu den Gründen für die beobachteten Unterschiede zählen eine Verletzung anatomischer Verhältnisse, ein posttraumatischer Defekt im Knochengewebe der Hüftpfanne, eine chronische Hüftluxation sowie das Vorhandensein von Narben und Metallstrukturen nach früheren Operationen. Das frühere Auftreten einer aseptischen Lockerung kann durch das junge Alter der Patienten und dementsprechend ihre erhöhte körperliche Aktivität begünstigt werden.
Abhängig von den anatomischen Veränderungen nach einer Fraktur der Hüftpfanne und der Lage des Hüftkopfes wurde folgende Arbeitsklassifikation gebildet:
- I - die Anatomie der Hüftpfanne ist nicht wesentlich gestört, die Sphärizität bleibt erhalten, der Femurkopf befindet sich in seiner normalen Position;
- II – das Vorhandensein eines segmentalen oder kavitären Defekts der Hüftpfanne mit Luxation/Subluxation des Femurkopfes;
- III - Folgen einer komplexen Fraktur mit vollständiger Störung der Anatomie der Hüftpfanne und einem kombinierten Defekt (segmental und kavitär) des Knochengewebes mit vollständiger Luxation des Femurkopfes.
R.M. Tikhilov, V.M. Schapowalow
RNIITO im. R.R. Vredena, St. Petersburg
Eine Valgusdeformität der Hüftgelenke ist äußerst selten und am häufigsten wird diese Krankheit bei Kindern bei einer Routineuntersuchung durch einen Orthopäden nach zusätzlicher Untersuchung entdeckt Röntgenuntersuchung. Bei Jungen und Mädchen ist es gleich. Bei 1/3 der Patienten ist dieser angeborene Defekt beidseitig.
Als Ursache wird eine teilweise Schädigung des lateralen Teils des Epiphysenknorpels unter dem Kopf sowie eine Schädigung der Apophyse des Trochanter major angesehen. Eine Valgusdeformität des Schenkelhalses (Coxa valga) kommt häufig während des Kindeswachstums aufgrund einer unbehandelten Hüftdysplasie vor.
Bei der Geburt eines Kindes befinden sich Kopf und Hals des Oberschenkelknochens in physiologischer Valgusstellung und werden im Laufe des Wachstums des Kindes aufgrund der physiologischen Torsion (Rotation) allmählich nach hinten gedreht. Der Schaftwinkel beträgt durchschnittlich 127° und der Anteversionswinkel 8-10°. Bei den oben genannten Störungen der Epiphysenknorpel während des Wachstums des Kindes ist dies der Fall physiologischer Prozess wird verletzt, was zum Auftreten von Coxa valga führt.
Darüber hinaus kann eine Hallux-valgus-Deformität „symptomatisch“ sein:
- mit überwiegendem Anteil der Adduktoren (Adduktoren) des Oberschenkels;
- mit Morbus Little;
- nach Polio;
- mit fortschreitender Muskeldystrophie;
- sowie bei Tumoren und Exostosen, die das normale Wachstum des Epiphysenknorpels stören.
Sehr selten treten Valgusdeformitäten nach Rachitis, unsachgemäß behandelten Schenkelhalsbrüchen und unbehandelter Hüftdysplasie auf.
Das Wichtigste bei der Diagnose einer Coxa valga ist eine Röntgenuntersuchung, die notwendigerweise während der Innenrotation (Rotation) der Extremität durchgeführt wird, da die seitliche Drehung des Femurs auf einer Röntgenaufnahme immer den Winkel der Valgusabweichung vergrößert der Hals.
Klinik
Klinisch manifestiert sich die Hallux-valgus-Deformität möglicherweise nicht mit beidseitigen Läsionen, d. h. es liegen keine Symptome vor. Während eine einseitige Läsion zu Funktionsstörungen führen kann  Verlängerung der Extremität, was zu Gangstörungen und Lahmheit in einem Bein führt.
Verlängerung der Extremität, was zu Gangstörungen und Lahmheit in einem Bein führt.
Ein Schenkelhalsvalgus ist klinisch schwer zu erkennen, da die Funktion des Hüftgelenks erhalten bleibt.
In der Regel bei Menschen mit Minderjährigen Hallux-valgus-Deformität Es wird eine konservative Behandlung durchgeführt. Postrachitische Deformitäten korrigieren sich mit zunehmendem Wachstum des Kindes von selbst, was auch bei der korrekten Behandlung von Kindern bei Hüftdysplasie beobachtet wird, wenn der Kopf gut in der Hüftpfanne zentriert (fixiert) ist.
Auch bei Kindern wird die Coxa valga, die aufgrund einer Schädigung der Keimknorpel auftritt, konservativ behandelt. Da der Prozess einen langen Verlauf hat, wird die komplexe Behandlung in Kursen durchgeführt.
Varusdeformität des Schenkelhalses (Coxa vara)
Coxa vara Der Name „Coxa vara“ bezieht sich auf die Verformung des proximalen Endes des Femurs, bei der der Hals-Diaphysen-Winkel verringert wird, manchmal bis zu einer geraden Linie, bei gleichzeitiger Verkürzung des Halses.
Die Varusdeformität des proximalen Femurendes bei Kindern und Jugendlichen macht 5-9 % aller Erkrankungen des Hüftgelenks aus.
Varusdeformitäten des Schenkelhalses können angeboren oder erworben sein.
Diagnose
Im Röntgenbild sind bei der Geburt eines Kindes die Knorpelwirbel und Köpfe der Oberschenkelknochen nicht sichtbar. Erst nach 5-6 Monaten kommt es zu einer sekundären Verknöcherung der Verknöcherungskerne der Köpfe. Mit zunehmendem Wachstum des Kindes verknöchern diese Kerne zunehmend und der Oberschenkelhals wird länger. Dieser Vorgang hängt mit dem Epiphysenknorpel der Trochanter zusammen, der ebenfalls allmählich verknöchert.
Zwischen dem fünften und achten Lebensjahr ist das proximale Ende des Femurs vollständig ausgebildet. Der Hals-Schaft-Winkel, der bei der Geburt 150° beträgt, wird kleiner und beträgt 142°. Außerdem geht die Retroversion des Halses aufgrund der Torsion während des Wachstums in eine Anteversion (Position nach vorne) über. Diese physiologischen Veränderungen vollziehen sich langsam bis zum Ende des menschlichen Wachstums.
Angeborene Störungen der Verknöcherung des Schenkelhalses werden durch eine falsche Lage des Epiphysenknorpels (Gelenkknorpels) verursacht, während er normalerweise eher horizontal und senkrecht zur Achse des Halses und der Richtung seiner Belastung liegt. Dies führt zu einer Varusdeformierung des Halses und zu einem langsamen Längenwachstum.

Manchmal kann eine angeborene Varusdeformität des Halses kombiniert werden mit:
- mit Hypoplasie (Unterentwicklung) des Femurs;
- mit einem Mangel am proximalen Ende des Femurs;
- mit multipler epiphysärer Dysplasie.
Die dritte Gruppe kann eine erworbene Form der Zervixvarusdeformität haben:
- posttraumatisch in jungen Jahren;
- aufgrund von Rachitis;
- kombiniert mit Morbus Perthes;
- nach angeborener Luxation des Oberschenkelknochens oder Hüftdysplasie.
Es gibt auch eine Gruppe von Patienten mit isoliertem Zervixvarus, bei denen keine Kombination angeborener Defekte, Traumata oder Stoffwechselstörungen vorliegt, die die Zervixinsuffizienz oder das abnormale Knorpelwachstum erklären würden. Bei diesen Patienten ist die Verkürzung der Gliedmaßen bei der Geburt nicht sichtbar, sodass die Diagnose erst gestellt wird, wenn das Körpergewicht des Kindes zunimmt und die Ausdauer des Gebärmutterhalses abnimmt. Dies geschieht häufiger, wenn das Kind zu laufen beginnt.
Es gibt mehrere andere Klassifikationen der Varusdeformität des Schenkelhalses. Röntgenologisch werden beispielsweise vier Arten von Deformitäten unterschieden: 
- angeborene isolierte Varusdeformität (Coxa vara congenita);
- Deformation im Kindesalter (Coxa vara infantilis);
- jugendliche Deformation (Coxa vara jugendlichenium);
- symptomatische Deformation (Coxa vara sumpomatica).
(Coxa vara congenita) ohne jegliche Kombination mit anderen Skeletterkrankungen ist heute von jedem anerkannt. Es ist äußerst selten und wird sofort bei der Geburt erkannt, da eine Verkürzung des Femurs und ein hoher Stand des Trochanter major sichtbar sind. Manchmal kann in solchen Fällen eine angeborene Hüftluxation vermutet werden, daher klären zusätzliche Untersuchungen die Diagnose.
Bei der Untersuchung wird eine Verkürzung der unteren Extremität aufgrund der Hüfte festgestellt. Der größere Trochanter ist über dem gegenüberliegenden Trochanter tastbar. Die Hüfte ist belastbar, da sich der Femurkopf in der Hüftpfanne befindet.
Wenn das Kind zu laufen beginnt, tritt Lahmheit auf. Dann kann ein positives Trendelenburg-Zeichen festgestellt werden. Bei einem ein- bis zweijährigen Kind zeigen sich typische Anzeichen einer angeborenen Varusdeformität des Schenkelhalses im rechtwinklig nach unten gebogenen und etwas kürzeren Röntgenbild. Der Epiphysenknorpel liegt fast vertikal und der Femurkopf ist manchmal vergrößert, entfaltet und nach unten geneigt, befindet sich jedoch in der Trochanterhöhle. Die Trochanterhöhle ist flach und flach, wenn der Hals-Schaft-Winkel weniger als 110° beträgt. Wenn dieser Winkel auf 140° oder mehr korrigiert wird, entwickelt sich die Kavität normal. Der große Trochanter liegt oberhalb der Halshöhe und ist leicht nach medial geneigt. Mit fortschreitender Halsdeformität nimmt seine Größe zu.
Infantile Varusdeformität des Schenkelhalses(Coxa vara infantilis) tritt bei Kindern im Alter zwischen drei und fünf Jahren auf. Eltern konsultieren einen Arzt, weil das Kind im Bein zu hinken beginnt und beim Gehen schwankt, obwohl es keine Schmerzen im Bein verspürt. Aus der Anamnese geht vor allem hervor, dass das Kind normal zur Welt kam und das Bein vorher gesund war.
Die rechtzeitige Kontaktaufnahme mit einem orthopädischen Arzt zur Diagnosestellung und zum Beginn der Behandlung verkürzt die Genesungszeit erheblich. Die Behandlung ist sehr konservativ in seltenen Fällen eine Operation wird verordnet. Bleibt die Erkrankung unbehandelt, kommt es schließlich zu einem „Entengang“, bei dem man sich von einer Seite auf die andere rollt, was sich auf die verminderte Arbeitsfähigkeit und Ermüdung auswirkt. Daher muss die Behandlung bereits im Kindesalter beginnen.
Abstrakt
In den meisten Fällen weist ein Kleinkind einen einseitigen Varus der Tibia auf, wobei die Deformität meist etwas weiter distal als das Kniegelenk auftritt. Röntgenaufnahmen der fokalen fibrokartilaginären Dysplasie zeigen einen charakteristischen abrupten Varus am metaphysären - diaphysären Übergang der Tibia. Kortikale Sklerose tritt im und um den Bereich des abrupten Varus auf der medialen Kortikalis auf. Eine Strahlendurchlässigkeit kann direkt in der Nähe des Bereichs der kortikalen Sklerose auftreten. Die Ätiologie solcher Defekte und die Pathogenese der Deformität sind weitgehend unbekannt. Viele der damit verbundenen Faktoren deuten darauf hin, dass die Erkrankung zumindest teilweise auf eine mechanische Überlastung der medioproximalen Tibiafuge zurückzuführen ist.
Die Beurteilung eines Kindes mit Verdacht auf eine pathologische Tibia vara beginnt mit einer gründlichen Anamnese. Eine vollständige Geburts- und Entwicklungsgeschichte sollte das Alter umfassen, in dem das Kind mit dem Laufen begann. Die Anamnese sollte etwaige Nierenerkrankungen, Endokrinopathien oder bekannte Skelettdysplasien aufdecken. Die körperliche Untersuchung sollte auch die allgemeine Ausrichtung und Symmetrie der unteren Extremitäten des Kindes, die Hüft- und Kniebewegung, die Hyperlaxität der Bänder und die Torsion des Schienbeins umfassen.
Wir beschreiben ein 17-jähriges Mädchen, das eine schwere Kleinwuchsform aufweist, die mit mehreren orthopädischen Anomalien, nämlich beidseitiger Coxa vara und Tibia vara, einhergeht. Die radiologische Dokumentation zeigte eine bilaterale und symmetrische Beteiligung der unteren Extremitäten mit der ausgedehnten Form der faserknorpeligen Dysplasie, Osteoporose und osteolytischen Läsionen. Die Konstellation des Fehlbildungskomplexes aus osteolytischen Läsionen, faserknorpeligen Veränderungen und den faserknorpeligen Likemas stimmt nicht mit zuvor veröffentlichten Berichten über faserknorpelige Dysplasie überein. Nach unserem besten Wissen scheinen faserknorpelige Veränderungen Teil einer neuartigen Art von Skelettdysplasie zu sein.
Einführung
Die Knochenveränderungen bei unserem Patienten sind irgendwie ähnlich, aber nicht konsistent und/oder diagnostisch für eine polyostotische fibröse Dysplasie (FD). Eine fibrokartilaginäre Dysplasie (FCD) tritt häufig in den unteren Extremitäten auf, insbesondere im proximalen Femur, und führt zu einer behindernden Deformierung der Extremität. Bei der faserknorpeligen Dysplasie kann sich der Knorpel nur in einem oder mehreren Segmenten der betroffenen Knochen entwickeln. Die sogenannte fibrokartilaginäre Dysplasie (FCD) wird in den Fällen eingesetzt, in denen reichlich Knorpel vorhanden ist. Im letzteren Fall kann es zu einer ausgedehnten Deformierung des Knochens kommen, die zu erheblichen therapeutischen Problemen führen kann. Radiologisch wurde FCD als durchsichtige Läsion mit gut bis schlecht definierten Rändern beschrieben, die in der Regel vereinzelte punktförmige bis ringförmige ringförmige Verkalkungen enthält. Die Verkalkung kann so groß sein, dass sie einem Enchondrom oder Chondrosarkom ähnelt. Histologisch unterscheidet sich FCD von herkömmlichem FD nur durch seinen zusätzlichen Knorpelbestandteil, wobei in beiden das gutartig erscheinende Spindelzellstroma und unregelmäßig geformte Trabekel aus metaplastischem Geflechtknochen zu finden sind. Der Ursprung des Knorpels bei FCD ist umstritten. Einige glauben, dass er von Ablegern oder Resten der Epiphysenfuge herrührt, die sich vermehren und wachsen. Andere glauben, dass es durch direkte Stroma-Metaplasie entsteht oder dass es sich aus beiden Prozessen entwickelt. Das seltene Vorkommen von FCD im Schädeldach und im Wirbelkörper, also an Stellen ohne Epiphysenfuge, würde zumindest in einigen Fällen gegen Letztere als Ursprungsort sprechen. Allerdings sind die unregelmäßig begrenzten Epiphysenfugen in manchen Fällen von FCD mit langen Knorpelsäulen, die in die angrenzende Metaphyse strömen, ein Hinweis darauf, dass ein Teil des Knorpels dort ihren Ursprung hat. Keine der oben genannten klinischen Einheiten war mit unserem Patienten kompatibel. Generalisierte Osteoporose in Verbindung mit zahlreichen osteolytischen Veränderungen und Bändern faserknorpeliger Dysplasie waren die wichtigsten abnormalen Merkmale, die bei unserem Patienten beobachtet wurden.
Klinischer Bericht
Ein 17-jähriges Mädchen wurde zur klinischen Untersuchung an unsere Abteilung überwiesen. Sie war das Ergebnis einer ereignislosen Schwangerschaft. Bei der Geburt lagen ihre Wachstumsparameter um das 50. Perzentil. Die Mutter war eine 35-jährige gravida 2 abortus 0, verheiratet mit einem 43-jährigen, nicht verwandten Mann. Sie hatte keine ernsthaften Erkrankungen in der Vorgeschichte, abgesehen von zwei Oberschenkelfrakturen, die im Alter von 6 Jahren festgestellt wurden. Danach wurden keine Frakturen mehr registriert. Ihr weiterer Entwicklungsverlauf verlief in normalen Grenzen. Seit der Pubertät erreichte das Mädchen eine sehr geringe Statur, die mit einer beidseitigen Tibia vara einherging.
Die klinische Untersuchung im Alter von 17 Jahren ergab einen schweren Kleinwuchs von -3SD, ihr OFC lag um die 50. Perzentile, ebenso wie ihr Gewicht. Es wurden keine dysmorphen Gesichtszüge festgestellt. Die Untersuchung des Bewegungsapparates ergab eine leichte Erschlaffung der Bänder in den oberen Gliedmaßen, in den unteren Gliedmaßen wurden jedoch Einschränkungen der Gelenkbeweglichkeit beobachtet. Ihre oberen Gliedmaßen waren normal entwickelt und ihre Wirbelsäule wies bei normaler Rumpfentwicklung keine besonderen Deformationen auf. Ihre Hände und Füße waren normal. Die Untersuchung der unteren Gliedmaßen ergab ein sehr kurzes unteres Segment im Vergleich zu einem normal entwickelten oberen Segment. Muskelschwund war ein bemerkenswertes Merkmal. In ihrem frühen Leben wurde sie auf Myopathie untersucht. Serumkreatinkinase und Plasmalaktat waren normal. Die Elektromyographie zeigte minimale Veränderungen und frühere Muskel-Magnetresonanztomographien (MRT) zeigten unspezifische und nicht diagnostische Veränderungen. Auch die Muskelbiopsie und die Muskelatmungskette waren normal. Es konnte keine eindeutige Diagnose gestellt werden, da die Muskelbiopsie und die anderen Untersuchungen nicht mit einer Myopathie vereinbar waren. Zu den hormonellen Untersuchungen gehörten Schilddrüsenhormone; Adrenocorticotropes Hormon und Wachstumshormon waren ebenfalls negativ.
Röntgenuntersuchung: Die AP-Röntgenaufnahme des Beckens zeigte eine bilaterale Coxa vara in Verbindung mit einer expansilen lytischen Läsion mit Milchglasmatrix, die bilateral den proximalen Femurschaft und den Trochanter majus betraf, wobei im proximalen Femurbereich eine signifikante Deformierung zu sehen war. Eine ringförmige Verkalkung, die auf Knorpel hindeutet, wurde gut angenommen. Beachten Sie die hypoplastischen Epiphysen des Femurkapitals und die fehlerhafte Modellierung des Femurhalses. Es besteht eine Unterversorgung des Schenkelhalses mit einem pathologischen ATD (artikulärer Trochanterabstand) von (minus) 7 mm links und (minus) 5 mm rechts (Abb. 1).

Die seitliche Röntgenaufnahme der unteren Oberschenkelknochen und der oberen Schienbeine zeigte eine starke Verkalkung, vermischt mit Bereichen mit osteolytischen Läsionen. Beachten Sie mehrere transparente Läsionen mit Knocheninseln und linearen sklerotischen Veränderungen, die sich von den Epiphysen bis zu den Schäften erstrecken (Abb. 2).

AP-Röntgenaufnahmen der Knie und der unteren Oberschenkelknochen zeigten eine Kombination aus Osteoporose, osteolytischen Inseln entlang der Kortikalis und faserknorpeligen Veränderungen (Abb. 3).

Die Röntgenaufnahme des seitlichen Schädels zeigte Bereiche mit osteolytischen Veränderungen entlang der Stirn- und Schläfenknochen sowie einen osteolytischen Bereich, der den größten Teil der Lambdoidnähte bedeckte (Abb. 4).

Die AP-Röntgenaufnahme des Thorax zeigte Bereiche mit mehreren durchsichtigen Läsionen mit Knocheninseln und linearen sklerotischen Veränderungen entlang der Rippen (Abb. 5). Das seitliche Röntgenbild der Wirbelsäule zeigte eine normale Wirbelanatomie ohne Spuren osteogener Läsionen (Abb. 6).


Einige der Knochenläsionen waren auf Tc-99m-MDP-Knochenscans markierungsfähig. Knochenläsionen zeigten einen unspezifischen Anstieg des 99m-Tc-MDP. Die Knochenszintigraphie war in Verbindung mit der Radiographie hilfreich, um eine polyostotische Beteiligung an verschiedenen Knochen zu erkennen.
Diskussion
Die faserknorpelige Dysplasie ist eine Variante der fibrösen Dysplasie, die eine ausgedehnte Knorpeldifferenzierung (Enchondrom-ähnliche Bereiche) aufweist. Die Menge an Knorpel ist von Fall zu Fall unterschiedlich. Dies wurde häufiger bei polyostotischen Erkrankungen berichtet. Es ist allgemein bekannt, dass FD Knorpel enthalten kann, dessen Menge jedoch unterschiedlich ist. Lichtenstein und Jaffe waren in ihrem ursprünglichen Artikel über FD der Meinung, dass Knorpel ein integraler Bestandteil des dysplastischen Prozesses sei. Kyriakos et al. fanden 54 Fälle von FD, bei denen eine knorpelige Differenzierung beobachtet wurde. Manchmal ist dieser Knorpel reichlich vorhanden. Solche Fälle werden unter der Rubrik „Fibrochondrodysplasie“ bezeichnet, ein von Pelzmann et al. eingeführter Begriff. im Jahr 1980, oder häufiger als „fibrokartilaginäre Dysplasie“. Radiologisch ähnelt die FCD der konventionellen FD, wobei in den meisten Fällen zusätzlich ringförmige (ringförmige) oder verstreute punktförmige bis flockige Verkalkungen auftreten, die so groß sein können, dass sie eine primäre Knorpelläsion vortäuschen. Bei der polyostotischen FD kann das Auftreten von durchsichtigen Säulen unverkalkten Knorpels ein streifenförmiges radiologisches Muster erzeugen, das dem einer Enchondromatose (Morbus Ollier) ähnelt. Der reichlich vorhandene Knorpel hat gelegentlich auch zu einer histologischen Fehldiagnose eines Chondrosarkoms bei FD geführt. FCD hat keinen Zusammenhang mit der als fokale fibroknorpelige Dysplasie bezeichneten Anomalie, die den Pes anserinus betrifft und bei kleinen Kindern die Tibia vara verursacht.
Histologisch unterscheidet sich FCD von herkömmlichem FD nur durch seinen zusätzlichen Knorpelbestandteil, wobei in beiden Fällen ein gutartig erscheinendes Spindelzellstroma und unregelmäßig geformte Trabekel aus metaplastischem Geflechtknochen gefunden werden. Die Knorpelinseln sind gut umschriebene, runde Knötchen, die von einer Schicht aus gewebtem oder lamellarem Knochen umgeben sind, der sich durch enchondrale Ossifikation entwickelt. Manchmal können die großen Knorpelinseln eine erhöhte Zellularität, zweikernige Zellen und atypische Kerne aufweisen, was zu einer Fehldiagnose eines Chondrosarkoms führen kann. Die knorpelige Komponente kann so massiv sein, dass sie einem chondroiden Neoplasma ähnelt.
Der Schlüssel zur Diagnose ist die Identifizierung der klassischen Bereiche der FD. Eine maligne Transformation bei FCD ist eine seltene Erkrankung. Ozaki et al. berichteten über einen Fall eines dedifferenzierten Chondrosarkoms, das im Rahmen eines Albright-Syndroms auftrat und wahrscheinlich bei einer bereits bestehenden FCD auftrat.
Idiopathische Osteolyse oder „Knochenverschwindenskrankheit“ ist eine äußerst seltene Erkrankung, die durch den spontanen Beginn einer schnellen Zerstörung und Resorption eines einzelnen Knochens oder mehrerer Knochen gekennzeichnet ist. Die Folge sind schwere Deformitäten mit Gelenksubluxation und Instabilität. Hardegger et al. beschrieb die am häufigsten akzeptierte Klassifizierung; Typ 1, hereditäre multizentrische Osteolyse mit dominanter Übertragung; Typ 2, hereditäre multizentrische Osteolyse mit rezessiver Übertragung, Typ 3, nichthereditäre multizentrische Osteolyse mit Nephropathie; Typ 4, Gorham-Stout-Syndrom; und Typ 5, das Winchester-Syndrom, definiert als eine monozentrische Erkrankung mit autosomal-rezessiver Vererbung. Die Gorham-Krankheit gilt als die häufigste Form der idiopathischen Osteolyse. Es kann in jedem Teil des Skeletts auftreten und wurde in Schulter, Becken, proximalem Femur, Schädel und Wirbelsäule beschrieben. Oft sind mehrere aneinander angrenzende Knochen betroffen (Rippen und Wirbelsäule oder Becken, proximaler Femur und Kreuzbein). Die Symptome können Schmerzen oder Schwäche in den Gliedmaßen sein und hängen vom Ort der Erkrankung ab. Die massive Osteolyse resultiert aus einer Gefäßproliferation oder Angiomatose innerhalb der Befallene Knochen und das umgebende Weichgewebe sind charakteristische Merkmale im Zusammenhang mit der Gorham-Krankheit. Eine Nierenbeteiligung ist ein weiteres klinisches Krankheitsbild, das bei Typ 3 der Hardegger-Klassifikation schwerwiegender ist und häufiger auftritt.
Abschluss
FD kann knorpelige Herde aufweisen, deren Menge variiert und kein bilaterales oder symmetrisches Erscheinungsbild aufweist. Wie viele Autoren beobachten, ist das Vorhandensein von Knorpel ein Indikator für eine zukünftige fortschreitende Knochendeformität. Die Knorpeldifferenzierung bei FCD kann leicht mit einer gutartigen oder bösartigen chondroiden Neoplasie verwechselt werden. Bei diesem Patienten konnten wir aus logistischen Gründen keine histologischen Untersuchungen durchführen. Unsere Ergebnisse könnten jedoch auf eine neue Variante der FCD mit bilateraler und symmetrischer Beteiligung der unteren Gliedmaßen und einer geringeren Beteiligung des Brustkorbs hinweisen. Weder die Wirbelsäule noch die Hände waren an diesem pathologischen Prozess beteiligt. Die gesamten klinischen und radiologischen Phänotypen unseres aktuellen Patienten stimmten nicht mit den zuvor beschriebenen Zuständen faserknorpeliger Veränderungen überein. Es gibt eine weitere diagnostische Möglichkeit, nämlich die zystische Angiomatose. Aufgrund der generalisierten Osteopenie und der Kleinwüchsigkeit ist die Wahrscheinlichkeit dieser Möglichkeit natürlich geringer. Wir könnten postulieren, dass dieser Patient eine weitere Variante von Moog et al. ist. aber dennoch sind die von Moog et al. und die kortikalen Läsionen sind bis zu einem gewissen Grad unterschiedlich. Wir geben zu, dass es in diesem Artikel einige Einschränkungen gab; Erstens waren keine Bilder aus der Zeit vor der Pubertät verfügbar; Zweitens wurde die histologische Untersuchung aus logistischen Gründen nicht durchgeführt und aus dem gleichen Grund wurde die Exomsequenzierung der nächsten Generation nicht organisiert.
Weitere Informationen
Finanzierung. Es gibt keine Finanzierungsquelle.
Interessenskonflikte. Die Autoren erklären keine Interessenkonflikte.
Ethische Überprüfung. Die Erziehungsberechtigten des Patienten gaben eine informierte Zustimmung zu dem Verfahren und veröffentlichten personenbezogene Daten.
Wissen. Wir möchten Herrn danken. Hamza Al Kaissi, Student an der Slowakischen Medizinischen Universität Bratislava, für seine Hilfe bei der Übersetzung deutscher Literatur. Wir möchten auch der Familie der Patientin für ihre Zusammenarbeit und die Erlaubnis danken, die klinischen und radiologischen Daten ihrer Töchter zu veröffentlichen.
Ali Al Kaissi
Ludwig Boltzmann Institut für Osteologie, Hanusch-Krankenhaus, WGKK und AUVA Traumazentrum Meidling, Erste Medizinische Abteilung, Hanusch-Krankenhaus; Orthopädisches Krankenhaus Speising, Pädiatrische AbteilungMD, MSc, Ludwig-Boltzmann-Institut für Osteologie am Hanusch-Krankenhaus der WGKK und AUVA Traumazentrum Meidling, Erste Medizinische Abteilung und Orthopädische Klinik Speising, Kinderabteilung
Franz Grill
MD, Orthopädisches Krankenhaus Speising, Pädiatrische Abteilung
Rudolf Ganger
Orthopädisches Krankenhaus Speising, Pädiatrische AbteilungMD, PhD, Orthopädisches Krankenhaus Speising, Pädiatrische Abteilung
Susanne Gerit Kircher
Medizinische Universität, Abteilung für Medizinische GenetikMD, MSc, Medizinische Universität, Abteilung für Medizinische Genetik
- Muezzinoglu B, Oztop F. Fibrocartilaginous Dysplasie: eine Variante der fibrösen Dysplasie. Malaien J Pathol. 2001;23(1):35-39.
- Klassifikation von Tumoren, Pathologie und Genetik von Weichteil- und Knochentumoren durch die Weltgesundheitsorganisation. Herausgegeben von C.D.M. Fletcher, K.K. Unni, F. Mertens. Lyon: IARC-Presse; 2002.
- Harris WH, Dudley HR, Jr., Barry RJ. Der natürliche Verlauf der fibrösen Dysplasie. Eine orthopädische, pathologische und röntgenographische Studie. J Bone Joint Surg Am. 1962;44-A:207-233.
- Waggoner HA, Steinmetz R, Bethin KE, et al. Der Nachweis einer GNAS-Mutation hängt mit der Schwere der Erkrankung bei Mädchen mit McCune-Albright-Syndrom und vorzeitiger Pubertät zusammen. Pediatr Endocrinol Rev. 2007;4 Suppl 4: 395-400.
- Vargas-Gonzalez R, Sanchez-Sosa S. Fibrocartilaginous dysplasia (Fibröse Dysplasie mit ausgedehnter Knorpeldifferenzierung). Pathol Oncol Res. 2006;12(2):111-114. doi:10.1007/bf02893455.
- Lichtenstein L, Jaffe HL. Fibröse Knochendysplasie. Eine Erkrankung, die einen, mehrere oder mehrere Knochen betrifft und in schwerwiegenderen Fällen zu einer abnormalen Pigmentierung der Haut, einer vorzeitigen sexuellen Entwicklung, einer Schilddrüsenüberfunktion oder anderen extraskelettalen Anomalien führen kann. Arch Pathol. 1942;33:777-816.
- Forest M, Tomeno B, Vanel D. Orthopädische chirurgische Pathologie: Diagnose von Tumoren und pseudotumoralen Läsionen von Knochen und Gelenken. Edinburgh: Churchill Livingstone; 1998.
- Morioka H, Kamata Y, Nishimoto K, et al. Fibröse Dysplasie mit massiver Knorpeldifferenzierung (fibrokartilaginäre Dysplasie) im proximalen Femur: Ein Fallbericht und eine Überprüfung der Literatur. Fallbevollmächtigter Oncol. 2016;9(1):126-133. doi:10.1159/000443476.
- Hermann G, Klein M, Abdelwahab IF, Kenan S. Fibrocartilaginous dysplasia. Skelettradiol. 1996;25(5):509-511. doi:10.1007/s002560050126.
- Ishida T, Dorfman HD. Massive Chondroiddifferenzierung bei fibröser Knochendysplasie (fibroknorpelige Dysplasie). Bin J Surg Pathol. 1993;17(9):924-930.
- Kyriakos M, McDonald DJ, Sundaram M. Fibröse Dysplasie mit knorpeliger Differenzierung („fibrokartilaginäre Dysplasie“): eine Übersicht mit einem illustrativen Fall, der 18 Jahre lang verfolgt wurde. Skelettradiol. 2004;33(1):51-62. doi:10.1007/s00256-003-0718-x.
- Pelzmann KS, Nagel DZ, Salyer WR. Fallbericht 114. Skelettradiol. 1980;5(2):116-118. doi:10.1007/bf00347333.
- Bhaduri A, Deshpande RB. Fibroknorpeliges Mesenchymom versus fibroknorpelige Dysplasie: Handelt es sich um eine Einheit? Bin J Surg Pathol. 1995;19(12):1447-1448.
- Ozaki T, Lindner N, Blasius S. Dedifferenziertes Chondrosarkom beim Albright-Syndrom. Ein Fallbericht und eine Überprüfung der Literatur. J Bone Joint Surg Am. 1997;79(10):1545-1551.
- Hardegger F, Simpson LA, Segmueller G. Das Syndrom der idiopathischen Osteolyse. Klassifizierung, Überprüfung und Fallbericht. J Bone Joint Surg Br. 1985;67-B(1):88-93. doi: 10.1302/0301-620x.67b1.3968152.
- Al Kaissi A, Scholl-Buergi S, Biedermann R, et al. Die Diagnose und Behandlung von Patienten mit idiopathischer Osteolyse. Pädiatrisches Rheumatol. 2011;9(1):31. doi:10.1186/1546-0096-9-31.
- Moog U, Maroteaux P, Schrander-Stumpel CT, et al. Zwei Geschwister mit einem ungewöhnlichen Muster von Skelettfehlbildungen, die einer Osteogenesis imperfecta ähneln: eine neue Art von Skelettdysplasie? J Med Genet. 1999;36(11):856-858. doi: 10.1136/jmg.36.11.856.
Ergänzende Dateien
| Ergänzende Dateien | Aktion | ||
| 1. | Feige. 1. Die AP-Röntgenaufnahme des Beckens zeigte eine bilaterale Coxa vara in Verbindung mit einer expansilen lytischen Läsion mit Milchglasmatrix, die bilateral den proximalen Femurschaft und den Trochanter majus betraf, wobei im proximalen Femurbereich eine deutliche Deformierung zu sehen war. Eine ringförmige Verkalkung, die auf Knorpel hindeutet, wurde gut angenommen. Beachten Sie die hypoplastischen Epiphysen des Femurkapitals und die fehlerhafte Modellierung des Femurhalses. Es besteht eine Verknappung des Schenkelhalses mit einem pathologischen ATD (artikulärer Trochanterabstand) von (minus) 7 mm links und (minus) 5 mm rechts | (93 KB) | |
| 2. | Feige. 2. Die seitliche Röntgenaufnahme der unteren Oberschenkelknochen und der oberen Schienbeine zeigte reichlich Verkalkung, vermischt mit Bereichen mit osteolytischen Läsionen. Beachten Sie mehrere transparente Läsionen mit Knocheninseln und linearen sklerotischen Veränderungen, die sich von den Epiphysen bis zu den Schäften erstrecken | (102 KB) | |
| 3. | Feige. 3. AP-Röntgenaufnahmen der Knie und der unteren Oberschenkelknochen zeigten eine Kombination aus Osteoporose, osteolytischen Inseln entlang der Kortikalis und faserknorpeligen Veränderungen | (111 KB) | |
| 4. | Feige. 4. Die Röntgenaufnahme des seitlichen Schädels zeigte Bereiche mit osteolytischen Veränderungen entlang der Stirn- und Schläfenknochen sowie einen osteolytischen Bereich, der den größten Teil der Lambdoidnähte bedeckte | (90 KB) | |
| 5. | Feige. 5. Die AP-Röntgenaufnahme des Thorax zeigte Bereiche mit mehreren durchsichtigen Läsionen mit Knocheninseln und linearen sklerotischen Veränderungen entlang der Rippen | (92 KB) | |
| 6. | Feige. 6. Das seitliche Röntgenbild der Wirbelsäule zeigte eine normale Wirbelanatomie ohne Spuren osteogener Läsionen | (63 KB) |