Der Infektionsweg des Fötus mit einer Cytomegalovirus-Infektion. Symptome einer Exazerbation einer chronischen CMV-Infektion
Lesen Sie auch
Staatliche Gesundheitseinrichtung "Samara Regional Bureau of Forensic Medical Examination".
Leiter des Büros - Doktor der medizinischen Wissenschaften, Professor, Leiter der Abteilung für Gerichtsmedizin, Samara State Medical University of Roszdrav
Ardashkin Anatoly Panteleevich.
1. Filippenkova Elena Igorevna, Arzt - Gerichtsmediziner der histologischen Abteilung der staatlichen Gesundheitseinrichtung "Samara Regional Bureau of Forensic Medical Examination", Erfahrung in der Expertenarbeit 10 Jahre, 1 Qualifikationskategorie.
Glaspräparate wurden von der Abteilung für Gerichtsmedizin der Staatlichen Medizinischen Akademie Ischewsk bereitgestellt.
CYTOMEGALOVIRUS-INFEKTION.
Cytomegalovirus-Infektion in der Klinik für innere Krankheiten
V. V. Skvortsov, R. G. Myazin, D. N. Emelyanov
Staatliche Medizinische Universität Wolgograd, Wolgograd
Einer der führenden Plätze unter den Krankheiten, die durch Familienviren verursacht werden Herpesviridae, ist mit einer Cytomegalovirus-Infektion (CMVI) belegt, deren Prävalenz derzeit in allen Ländern der Welt zunimmt. In den letzten zehn Jahren hat sich die Liste der Krankheiten erheblich erweitert, zu deren Ursachen auch das Cytomegalovirus (CMV) gehört. Das Konzept von CMVI umfasst die Probleme der intrauterinen Infektion, seronegative Mononukleose, Hepatitis, Erkrankungen des Gastrointestinaltrakts, Posttransfusionssyndrom, Organ- und Gewebetransplantation, Onkogenese, HIV-Infektion, da CMVI von WHO-Experten als definiert wird AIDS-Indikatorkrankheit. Scheint am erfolgreichsten zu sein die folgende Definition dieser Krankheit: „Die Zytomegalievirus-Infektion ist eine weit verbreitete Viruserkrankung, hauptsächlich bei Kindern junges Alter, gekennzeichnet durch eine Vielzahl klinischer Manifestationen und ein morphologisches Standardbild aus zwei Komponenten, einschließlich eigentümlicher, dem Eulenauge ähnlicher Zytomegaliezellen und lymphohistiozytärer Infiltrate.
Ätiologie
CMVI wurde erstmals 1881 von dem deutschen Pathologen M. Ribbert beschrieben, der zytomegale Zellen (CMCs) im Nierengewebe bei angeborener Syphilis entdeckte. E. Goodpasture und F. Talbot schlugen 1921 den Namen "Kindercytomegalie" vor, der noch heute verwendet wird. CMV wurde 1956 von M. Smith aus Zellkulturen isoliert.
Der Durchmesser von CMV-Virionen beträgt 120-150 nm. Das Virion ist mit einer Glykoprotein-Lipid-Membran bedeckt. Das CMV-Virus hat die Form eines Ixaeders, dessen Proteinhülle (Kapsid) aus 162 symmetrisch angeordneten Kapsomeren besteht. Das CMV-Genom wird durch doppelsträngige DNA repräsentiert. CMV ist thermolabil, wird bei einer Temperatur von +56°C inaktiviert, sein optimaler pH-Wert liegt bei 7,2-8,0. Derzeit sind drei CMV-Stämme isoliert worden: Davis, AD 169, Kerr.
Epidemiologie
CMV-Reservoir in der Natur ist nur menschlich. Das Virus wird von einem infizierten Organismus ausgeschieden Urin, Speichel und Tränenflüssigkeit. CMV-Übertragungsfaktoren sein können Mutterblut, Zervix- und Vaginalsekret, Muttermilch und Sperma. Die Prävalenz von CMVI hängt von den sozioökonomischen und hygienischen Lebensbedingungen der Menschen ab. Screening-Studien mit ELISA (Enzyme-Linked Immunosorbent Assay) ergaben bei 33 % der Kinder unter 2 Jahren und bei 50 % der Erwachsenen in Ländern mit hohem Lebensstandard Antikörper gegen CMV. In Entwicklungsländern sind spezifische Antikörper bei 69 % der Kinder und 100 % der Erwachsenen vorhanden.
Die Hauptinfektionsquelle von Kindern sind Mütter - Trägerinnen von CMV. Eine intrauterine Infektion des Fötus kann zu jedem Zeitpunkt der vorgeburtlichen Entwicklung auftreten. Die transplazentare hämatogene Infektion des Fötus wird durch die Reaktivierung von CMVI bei schwangeren Frauen und eine unzureichende Barrierefunktion der Plazenta begünstigt. Das Risiko einer Infektion, die die Plazentaschranke durchdringt, steigt mit anhaltender Virämie und der chronischen Natur der Infektion. Im Zervixgeheimnis findet sich CMV im ersten Trimester der Schwangerschaft bei 2% der Frauen, im zweiten - bei 7%, im dritten - bei 12%. Der Fötus kann mit CMV infiziertes Fruchtwasser aspirieren, eine Schädigung der äußeren Haut des Fötus kann auch als Eintrittstor für eine CMV-Infektion dienen. 5 % der Neugeborenen infizieren sich intranatal. Eine Infektion des Fötus in den frühen Stadien der intrauterinen Entwicklung ist die größte Gefahr und oft begleitet von Spontanabort oder Störungen der Organo- und Histogenese. Bei denen, die später nach der Geburt mit CMV infiziert sind, gibt es Zytomegalie-Syndrom, vorübergehende Gelbsucht, Hepatosplenomegalie. Künftig leiden 10 bis 30 % dieser Kinder an Hirnschäden, ausgedrückt in Mikrozephalie mit Kammerverkalkung, Atrophie des Hörnervs und geistiger Retardierung.
Säuglinge können sich anstecken durch Muttermilch. Mit Muttermilch erhält das Kind jedoch sekretorisches IgA, das die Plazenta nicht passiert und in den ersten Monaten des Lebens nach der Geburt beim Kind nicht produziert wird. Sekretorisches IgA erhöht die Resistenz des Neugeborenen gegen virale und bakterielle Infektionen, daher leiden durch Muttermilch infizierte Kinder nur eine latente Form von CMVI.
Bei engem Kontakt zwischen Mutter und Kind kann der Faktor bei der Übertragung des Virus auf ihn sein Speichel. Es gibt Hinweise darauf, dass die Hälfte der Kinder unter 3 Jahren, die Kindergärten besuchen, von Gleichaltrigen mit CMV infiziert werden und dann ihre Mütter anstecken.
Die Quelle von CMV für Erwachsene und Kinder kann sein Urin eines Patienten oder Virusträgers.
Der häufigste Infektionsweg ist sexuell, da das Virus lange Zeit in hohen Konzentrationen im Sperma enthalten ist.
Es gibt auch luftgetragener Infektionsweg. Bei Patienten mit schwerem ARVI, das häufig durch CMVI verursacht wird, wird das Cytomegalovirus in Abstrichen aus dem Nasopharynx gefunden.
Bluttransfusionen, Infusionstherapie, Organ- und Gewebetransplantation sind ebenfalls gefährlich, da häufig biologische Präparate oder Gewebe von CMV-infizierten Spendern in den Körper des Empfängers eingebracht werden. Die Anwendung von Immunsuppressiva und Zytostatika bei Patienten nach Organtransplantation fördert nicht nur die Reaktivierung einer zuvor erworbenen latenten Infektion, sondern erhöht auch deren Anfälligkeit für eine primäre CMVI-Infektion.
Das Vorhandensein antigenisch unterschiedlicher CMV-Stämme erklärt die Möglichkeit einer Reinfektion mit der Entwicklung einer manifesten Form der Krankheit in jedem Alter.
Pathogenese
CMV hat ausgeprägter Tropismus zu den Geweben der Speicheldrüsen. Bei einer latenten Form natürlich das Virus gefunden nur im Epithel der Speichelkanälchen Daher wird CMVI manchmal zu Recht als „Kissing Disease“ bezeichnet.
CMV verursacht eine erhebliche Dysregulation der Immunantwort, die darauf beruht Schädigung des Interleukinsystems. In der Regel wird die Fähigkeit infizierter immunkompetenter Zellen, Interleukine zu synthetisieren, durch die übermäßige Produktion von Prostaglandinen unterdrückt, und auch die Reaktionen von Zielzellen auf IL-1 und IL-2 ändern sich. Entwicklung virusinduzierte Immunsuppression mit starker Hemmung der Funktion natürlicher Killer.
CMV drang ins Blut ein reproduziert sich in Leukozyten und dem System mononukleärer Phagozyten oder persistiert in lymphatischen Organen. CMV-Virionen werden an Zellmembranen adsorbiert, dringen in das Zytoplasma ein und induzieren die Metamorphose von Zytomegaliezellen. Virale RNA findet sich in T-Helfern und T-Suppressoren auch in der Langzeitrekonvaleszenz.
Pathoanatomie
Das charakteristische pathologische Zeichen von CMV ist Riesenzellen in Geweben, Speichel, Sputum, Urinsediment und Liquor cerebrospinalis. Zellen haben intranukleäre und zytoplasmatische Einschlüsse und enthalten ein sich vermehrendes Virus. Veränderungen im Kern der Zelle verleihen ihr eine Ähnlichkeit mit dem Auge einer Eule. Riesenzellen sind hauptsächlich im Epithel der Ausführungsgänge der Speicheldrüsen, im Epithel des distalen Nephrons in den Nieren, im Epithel der Gallenwege in der Leber und im Epithel der Ependymventrikel des Gehirns lokalisiert .
Als Reaktion auf die Exposition gegenüber CMV im umgebenden interstitiellen Gewebe, lymphohistiozytäre Infiltrate manchmal mit Knötchencharakter. In der generalisierten Form werden häufiger Lungen-, Nieren- und Darmschäden beobachtet, seltener - an der Leber und anderen Organen. Neben Riesenzellen und lymphohistiozytären Infiltraten findet sich ein Bild von interstitieller Pneumonie in der Lunge, interstitieller Nephritis in den Nieren, ulzerativer Enterokolitis im Darm und cholestatischer Hepatitis in der Leber.
Die angeborene generalisierte CMVI ist auch durch hämorrhagische Ausschläge auf Haut und Schleimhäuten, Blutungen in den inneren Organen und im Gehirn, signifikante Anämie und die Entwicklung von Myeloblastoseherden in Leber, Milz und Nieren gekennzeichnet. Augenschäden werden ebenfalls festgestellt - Uveitis, Linsentrübung und Subatrophie der Iris.





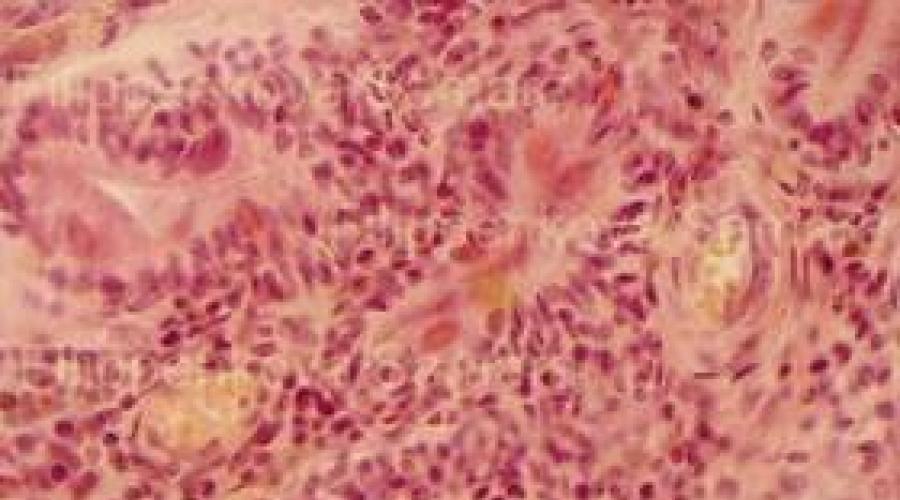
Reis. 1-6. Speicheldrüsengewebe. Fokale venös-kapillare Plethora. Im Stroma der Drüse finden sich fokale rundzellige (lymphoide) Infiltrate. Im Epithel der Gänge gibt es Gruppen von großen runden Zytomegaliezellen, ähnlich einem "Eulenauge", mit einem großen runden Kern und einem schmalen Rand aus hellem Zytoplasma. Färbung: Hämatoxylin-Eosin. 250-fache Vergrößerung, anschließende Computerverarbeitung des Bildes in Form eines Fragmentausschnitts.
CMVI-Klassifikation (A.P. Kazantsev, N.I. Popova, 1980):
- angeborene CMVI - akute Form, chronische Form;
- erworbenes CMVI - latente Form, akute Mononukleose-ähnliche Form, generalisierte Form.
Klinik für CMVI bei Kindern
Akute Form der angeborenen CMVI. Die Klinik der akuten Form der CMVI ist durch schwersten Verlauf mit schweren Toxikosezeichen, Leber- und Milzvergrößerung, Thrombozytopenie, hämorrhagischem Syndrom, Blutbildveränderungen und ZNS-Schäden gekennzeichnet. Diese Form der Krankheit wird oft genannt fetales Cytomegalovirus-Syndrom. Kinder werden geboren verfrüht, bei geringem Körpergewicht sind die Reflexe unterdrückt, manchmal treten Saug- und Schluckstörungen auf. Tritt in 60 % der Fälle auf Gelbsucht, mögliche Ursachen dafür können eine CMV-Hepatitis oder eine erhöhte Hämolyse der roten Blutkörperchen sein. Gelbsucht ähnelt physiologisch, aber die Intensität der Krankheit nimmt allmählich zu und hält 1-2 Monate an. Bei 90 % der Kinder ist die Leber vergrößert und ragt 3-5 cm unter den Rand des Rippenbogens. Die Milz ist in 42% der Fälle vergrößert, sie ist dicht, schmerzlos. Im Blut haben 70% der Kinder Thrombozytopenie, erhöhte Bilirubinspiegel sowie eine Erhöhung der Transaminaseaktivität - bis zu 150 IE / l und der alkalischen Phosphatase - bis zu 28 IE.
Die akute Form von CMVI tritt unter dem Deckmantel einer hämolytischen Erkrankung des Neugeborenen auf. Oft auch gefunden Magen-Darm-Läsionen, dominiert dyspeptisches Syndrom und progressive Dystrophie.
Bei der akuten Form der kongenitalen CMVI versterben die Kinder in den ersten Lebenswochen oder -monaten, meist durch assoziierte bakterielle Infektionen.
Chronische Form der angeborenen CMVI. Bei Kindern, die eine akute Form der Erkrankung durchgemacht haben, zeigt sich ein wellenförmiger Verlauf der chronischen Form von CMVI. Oft gebildet angeborene Fehlbildungen des zentralen Nervensystems, insbesondere Mikrozephalie- in 40% der Fälle. Kann sich entwickeln chronische Hepatitis, in seltenen Fällen in Zirrhose übergehend. Veränderungen in der Lunge bei 25% der Kinder sind durch die Entwicklung gekennzeichnet Pneumosklerose und Fibrose.
Die Differentialdiagnose der angeborenen CMVI wird bei Röteln, Listeriose, Toxoplasmose sowie bei hämolytischen Erkrankungen des Neugeborenen, angeborener Syphilis und Sepsis durchgeführt.
Latente Form des erworbenen CMVI. Die latente Form manifestiert sich klinisch in keiner Weise und wird nur bei einer virologischen Untersuchung nachgewiesen.
Akute Mononukleose-ähnliche Form der erworbenen CMVI. Die akute Form in klinischen Manifestationen bei älteren Kindern ähnelt einer infektiösen Mononukleose und tritt häufig nach Bluttransfusionen auf. Die Krankheit ist durch einen akuten Beginn mit Temperaturanstieg und das Auftreten von Vergiftungssymptomen gekennzeichnet. Lymphadenopathie, Empfindlichkeit beim Abtasten der Parotisregion, Symptome akuter Atemwegsinfektionen, Hepatomegalie werden aufgezeichnet. Charakterisiert durch Leukozytose, eine Zunahme der Anzahl neutrophiler Granulozyten und atypischer mononukleärer Zellen. Es wird empfohlen, die Paul-Bunnel- und Hoff-Bauer-Reaktionen einzustellen, die bei infektiöser Mononukleose positiv und bei Cytomegalovirus-Mononukleose-ähnlichem Syndrom negativ sind.
Generalisierte Form des erworbenen CMVI. Die generalisierte Form ist gekennzeichnet durch Lymphadenopathie, Intoxikation, Fieber. Zunächst werden Symptome einer Schädigung der Atmungsorgane festgestellt: trockener, quälender Husten, Atemnot gemischter Art. Die Auskultation der Lunge zeigte trockene und feuchte Rasselgeräusche. Eine sich entwickelnde Lungenentzündung ist durch einen langwierigen Verlauf gekennzeichnet, der die Schwere der Grunderkrankung bestimmt. Aufgrund der Schichtung von Bakterien- und Pilzinfektionen kann es schwierig sein, die Symptome einer generalisierten CMVI zu isolieren.
Häufig tritt CMVI in Verbindung mit anderen Erkrankungen viraler oder bakterieller Ätiologie auf. Besonders häufig ist die Kombination von CMVI und ARVI, bei der das Cytomegalovirus bei 30 % der erkrankten Kinder isoliert wird. Diese Grippe ist schwerer und trägt zur Aktivierung von CMVI bei, indem sie die Immunantwort unterdrückt.
Klinik für CMVI bei Erwachsenen
CMVI tritt bei Erwachsenen in latenter (lokalisierter) und generalisierter Form auf. latente Form zeigt in der Regel keine eindeutigen klinischen Symptome. Manchmal beobachtet leichte grippeähnliche Erkrankung, unklarer subfebriler Zustand. Die Diagnose dieser Form von CMVI basiert auf den Ergebnissen von Labortests.
Verallgemeinerte Form erworbene CMVI bei Erwachsenen wird beobachtet selten. In der Regel werden seine klinischen Anzeichen vor dem Hintergrund einer anderen Krankheit erkannt, die die Immunität stark reduziert: nach schweren chirurgische Eingriffe, vor dem Hintergrund von Leukämie oder Neubildungen. In diesen Fällen hat der Einsatz verschiedener Immunsuppressiva bei der Behandlung von Patienten pathogenetische Bedeutung. Die generalisierte CMVI bei Erwachsenen äußert sich in einer trägen Lungenentzündung oder einer Art akuter Infektionskrankheit, die durch Fieber, Vergrößerung und Empfindlichkeit der Leber, eine Zunahme der Anzahl mononukleärer Zellen im Blut (durch CMV verursachte Mononukleose) und eine Schädigung des Magen-Darm-Trakts gekennzeichnet ist Trakt. Lymphadenopathie und Tonsillitis fehlen.
Es ist schwierig, die Krankheit zu diagnostizieren. Bei Frauen kann eine latente CMVI vermutet werden wiederholte Fehlgeburten und Totgeburten. Die Diagnose basiert auf den Daten zytologischer und virologischer Studien.
Die Leberpathologie nimmt einen besonderen Platz in der CMVI ein. Cytomegalovirus-Hepatitis, die sich als Reaktion auf die Einführung von CMV entwickelt, ist durch die Degeneration des Epithels der Gallenwege und der Hepatozyten, der sternförmigen Endothelzellen und des vaskulären Endothels gekennzeichnet. Sie bilden zytomegale Zellen, die von entzündlichen mononukleären Infiltraten umgeben sind. Die Kombination dieser Veränderungen führt zu einer intrahepatischen Cholestase. Zytomegaliezellen werden abgeschuppt und füllen die Lücken der Gallenwege, Sein die Ursache für die mechanische Komponente der Gelbsucht. Gleichzeitig werden degenerierte CMV-Hepatozyten destruktiv verändert, bis hin zur Nekrose, was zur Entstehung führt Zytolyse-Syndrom. Zu beachten ist, dass bei der CMV Hepatitis, die einen verlängerten, subakuten oder chronischen Verlauf hat, die führende Rolle zukommt Cholestase-Syndrom. Bei der Diagnostik CMV-Hepatitis von großer Bedeutung sind die Ergebnisse einer Punktionsbiopsie der Leber (Nachweis im Punktat riesiger Zytomegaliezellen mit einem Durchmesser von 25-40 Mikrometern in Form eines Eulenauges mit einem riesigen Kern und einem schmalen Rand des Zytoplasmas), sowie zytologische (Nachweis von Zytomegaliezellen im Urinsediment) und serologische (Nachweis von Antikörpern IgM gegen CMVI) Methoden. Die Differentialdiagnose der CMV-Hepatitis wird mit anderen viralen Hepatitiden durchgeführt: B, Epstein-Barr, herpetische Hepatitis.
Mit CMVI, Speicheldrüsen sind in der Regel betroffen. Sie zeigen mononukleäre Infiltrate. Sialadenitis trägt chronisch. Gleichzeitig mit der Niederlage der Speicheldrüsen wird eine Degeneration des Magen- und Darmepithels mit der Entwicklung von Erosionen und Geschwüren und lymphohistiozytären Infiltraten in der Dicke der Darmwand beobachtet.
Die Niederlage der Lymphknoten ist charakteristisch für CMVI. Gleichzeitig bleiben alle für diese Infektion typischen Anzeichen erhalten. Es ist die Pathologie des lymphatischen Systems, die die organ- und systemischen Manifestationen von CMVI verschlimmert.
Die Niederlage des Atmungssystems bei CMVI ist durch die Entwicklung gekennzeichnet interstitielle Lungenentzündung, Bronchitis, Bronchiolitis. Gleichzeitig erfährt das Epithel der Alveolen, Bronchien, Bronchiolen und umgebenden Lymphknoten spezifische Veränderungen. Im peribronchialen Gewebe werden Infiltrate aus mononukleären Zellen, Makrophagen und Plasmazellen gebildet. Eine CMV-Pneumonie tritt häufig mit einer Staphylokokkenschicht auf, begleitet von einer eitrigen Bronchiolitis und Abszessbildung. Das Vorhandensein von CMV wird durch den Nachweis von Zytomegaliezellen bestätigt. Häufig ist eine CMV-Pneumonie mit einer Pneumozystose mit extrem schwerem Krankheitsverlauf kombiniert.
Auch Nierenschäden bei CMVI werden häufig beobachtet. Dabei erfahren Zellen des Epithels der gewundenen Tubuli, des Epithels der Kapseln der Glomeruli sowie der Harnleiter und der Blase eine spezifische ("Riesenzelle") Veränderung. Dies erklärt den Nachweis zytomegaler Zellen im Urinsediment.
ZNS-Beteiligung bei Erwachsenen ist selten und tritt in Form von auf subakute Enzephalitis.
Augenläsionen bei CMVI sind durch die Entwicklung gekennzeichnet Chorioretinitis. Chorioretinitis wird sehr oft mit einer CMV-Enzephalitis kombiniert.
Labordiagnostik
Derzeit gibt es mehrere zuverlässige Methoden zur Bestimmung von CMV.
- Traditionelle Isolierung des Virus über die Kultur embryonaler Fibroblasten und die Kultur menschlicher diploider Zellen, in denen CMV seine zytopathische Wirkung entfaltet. Die Methode ist die zuverlässigste und empfindlichste (Bestimmungszeit beträgt 2-3 Wochen).
- Beschleunigte Viruskulturmethode für 6 Stunden unter Verwendung von monoklonalen Antikörpern, um frühe Antigene anzuzeigen.
- Die Methode der Zytoskopie von Urin- und Speichelsedimenten sowie der Licht- und Elektronenmikroskopie histologischer Präparate, insbesondere der Leberbiopsie, die es ermöglicht, riesige CMV-Zellen in Form eines Eulenauges mit einem schmalen Zytoplasmarand zu identifizieren und ein großer Kern.
Zur Bestimmung von Antikörpern gegen CMV werden verschiedene Methoden verwendet.
- Komplementfixierungsreaktion (RSC). Die gebräuchlichste Art, die spezifische humorale Immunität bei CMVI zu untersuchen. Das Verfahren ist nicht empfindlich genug, da nur Gesamtantikörper. RSK mit einem Titer von 1:4 ist negativ, 1:8 ist schwach positiv, 1:16 ist positiv, 1:32 ist stark positiv.
- Immunfluoreszenzanalyse. Bestimmt die Erhöhung des Titers von Antikörpern der Ig-Klassen M und G gegen CMV. Diese Methode ist empfindlicher als RSC.
- ELISA (Peroxidase)-Analyse.
- Festphasen-Radioimmunoassay. Außerdem können Sie damit die Ig-Klassen M und G bestimmen.
- Immunoblot. Unter Verwendung von Polyacrylamid-Gelelektrophorese werden Antikörper gegen CMV verschiedener Klassen bewertet. Das die modernste Methode der spezifischen Diagnostik, kann damit das gesamte Spektrum der Antikörper gegen CMV bestimmt werden.
Bei angeborener CMVI mit ZNS-Schädigung ist die Prognose ungünstig, bei erworbener generalisierter CMVI wird sie durch die Grunderkrankung bestimmt. Bei einer latenten Form der erworbenen CMVI ist die Prognose günstig.
Verhütung
Der Kontakt von Schwangeren mit Kindern mit angeborenem CMVI muss ausgeschlossen werden. Wenn eine Frau ein Kind mit angeborenem CMVI zur Welt bringt nächste Schwangerschaft kann empfohlen werden frühestens 2 Jahre später(Dauer der Persistenz des Virus bei lokalisierter erworbener CMVI).
Derzeit wird aktiv nach Impfstoffen gegen CMVI gesucht. Bereits in den USA und Großbritannien etabliert Lebendimpfstoffe derzeit in klinischen Studien.
Es ist wichtig, sich daran zu erinnern, dass CMVI von Ärzten verlangt, sich verschiedener Bereiche der Medizin bewusst zu sein und kreativ zu suchen effektiver Einsatz bewährte Methoden der Diagnose, Behandlung und Prävention. Die Früherkennung von CMVI trägt dazu bei, die Wirksamkeit der Versorgung dieser Patientenkategorie zu erhöhen, ebenso wie die rechtzeitige Erkennung von Fällen von HIV-Infektionen und AIDS.
Literatur
- . Rakhmanova A. G., Isakov V. A., Chaika N. A. Cytomegalovirus-Infektion und AIDS. - L.: Forschungsinstitut für Epidemiologie und Mikrobiologie. Pasteur, 1990.
- Demidova S. A., Semenova E. I., Zhdanov V. M., Gavrilov V. I. Humane Cytomegalovirus-Infektion. — M.: Medizin, 1976.
- Farber N. A. Cytomegalovirus-Infektion in der klinischen Medizin //Ter. Archiv, 1989. - Nr. 11.
- Farber N. A. Cytomegalovirus-Infektion und Schwangerschaft // Geburtshilfe und Gynäkologie. - 1989. - Nr. 12.
- Samokhin P.A. Cytomegalovirus-Infektion bei Kindern. — M.: Medizin, 1987.
- Kazantsev A.P., Popova N.I. Intrauterine Infektionskrankheiten und ihre Prävention. - L.: Medizin, 1980.
- Bericht der wissenschaftlichen Gruppe der WHO "Immunologischer Mangel". — M.: Medizin, 1980.
- Kozlova S. I., Semanova E., Demikova N. S., Blinnikova O. E. Erbliche Syndrome und genetische Beratung. - L.: Medizin, 1987.
- Harrison J. Guide to Internal Medicine: In 10 Bänden - 1998. - V. 5.
- Lawlor Jr G, Fisher T, Adelman D. Klinische Immunologie und Allergologie. — M.: Praxis, 2000.
Die Struktur der tödlichen Folgen und die pathologische Anatomie
bei Patienten mit HIV-Infektion in Moskau
Infektiöses klinisches Krankenhaus Nr. 2
Bundeszentrum für Prävention und Bekämpfung von AIDS des Gesundheitsministeriums der Russischen Föderation, Institut für Humanmorphologie der Russischen Akademie der Medizinischen Wissenschaften, Moskau
Materialen und Methoden
Im Zeitraum von 1991 bis 2003. 537 Erwachsene mit HIV-Infektion starben und wurden in die pathoanatomische Abteilung des ICH Nr. 2 aufgenommen. Die Sterblichkeit wurde in allen Altersgruppen registriert, 65 % waren Personen unter 40 Jahren. Unter den toten Patienten waren 75 % Männer. Bei allen Autopsien wurde eine vollständige makroskopische und mikroskopische Untersuchung mit einer breiten Palette histologischer Färbungen, bakteriologischer und virologischer Methoden durchgeführt.
Die Cytomegalovirus-Infektion (CMVI) belegt den zweiten Platz in der Häufigkeit der Erkennung bei toten Patienten mit HIV-Infektion über einen 13-jährigen Beobachtungszeitraum - 85 Fälle (15,8%). Bis 1999 jährlich erkrankt mindestens ein Viertel der verstorbenen Patienten an einer CMV-Infektion. Der höchste Anteil an CMVI wurde gemäß Schnittstudien im Jahr 1997 verzeichnet. - 35,8 % der Fälle. Von 2000 bis 2002 die Häufigkeit von CMVI als Todesursache nahm ab und lag zwischen 9,7 % und 6,5 % pro Jahr, was möglicherweise das Ergebnis der rechtzeitigen Erkennung der Tatsache einer aktiven CMV-Replikation bei einem HIV-infizierten Patienten und der medikamentösen Prävention der manifesten Formen war der Erkrankung sowie - rechtzeitige ätiotrope Therapie von Patienten mit klinisch ausgeprägtem CMVI. In 2003 die CMVI-Häufigkeit bei toten Patienten stieg erneut auf 14,5 %, vor allem aufgrund von Erstantragstellern medizinische Versorgung bereits an einer schweren generalisierten Erkrankung mit Cytomegalovirus-Ätiologie leiden. Ein breites Spektrum von Organläsionen wurde mit CMVI in Verbindung gebracht, einschließlich der Pathologie der Lunge, des Darms, der Speiseröhre, der Nebennieren, der Netzhaut, des Gehirns und des Rückenmarks, der Leber, des Magens, der Lymphknoten, der Nieren, der Milz, des Herzens und der Bauchspeicheldrüse. Bei einer großen Vielfalt von Läsionen, Cytomegalovirus-Ätiologie, gibt es eine besondere Morphologie von Läsionen, die bei anderen bekannten Infektionskrankheiten nicht gefunden wird. Ein wichtiges Bindeglied in der Pathogenese von CMVI bei Patienten mit HIV-Infektion ist eine generalisierte Läsion des vaskulären Endothels durch Cytomegalovirus, die in allen betroffenen Organen auftritt und zu einer chronischen Ischämie führt. Auch ein charakteristisches Merkmal der Krankheit sollte die Entwicklung berücksichtigt werden ausgedehnte Fibrose mit verschiedenen Varianten dysregenerativer und präkanzeröser Veränderungen. Besonderes Augenmerk sollte darauf gelegt werden häufige und oft einzige nachweisbare ausgedehnte Läsion der Nebennieren bei Patienten mit CMVI bei der Autopsie. In allen Fällen hatte der pathologische Prozess bilateraler Natur , in einer Reihe von Beobachtungen, die alle Schichten der Rinde und des Marks mit vollständiger Zerstörung des Gewebes des Organs erfassen. Trotz der hohen Häufigkeit und Schwere von Nebennierenschäden wurde in keinem Fall eine klinische Diagnose einer Nebenniereninsuffizienz gestellt. Gleichzeitig war bei zwei Patienten eine akute Nebenniereninsuffizienz die direkte Todesursache.
Zytomegalievirus-Infektion- eine durch Cytomegalovirus verursachte Krankheit - ein Virus aus der Unterfamilie der Herpesviren, zu der auch die Herpes-simplex-Viren 1 und 2, das Varizella-Zoster-Virus, das Zoster-Virus, das Ebstein-Barr-Virus und die humanen Herpesviren Typ 6, 7 und 8 gehören.
Häufigkeit Cytomegalovirus-Infektion extrem hoch. Nach dem Eintritt in den Körper verlässt die Cytomegalovirus-Infektion ihn nicht - meistens existiert sie in latenter Form und manifestiert sich nur mit einer Abnahme der Immunität.
die Opfer Cytomegalovirus-Infektion HIV-infiziert werden, sowie Menschen, die sich einer Transplantation innerer Organe oder Knochenmark unterzogen haben und Medikamente einnehmen, die die Immunantwort unterdrücken.
Bei der Erstinfektion kann es jedoch zu einer akuten Infektionskrankheit kommen. Die Infektion erfolgt häufig während der Neugeborenenzeit und in der frühen Kindheit, insbesondere in Entwicklungsländern, wo die Prävalenz der Cytomegalovirus-Infektion bei jungen Menschen viel höher ist als in Industrieländern.
Das gefährlichste intrauterine Form der Cytomegalovirus-Infektion, was typisch für Kinder ist, deren Mütter während der Schwangerschaft eine primäre Cytomegalovirus-Infektion erlitten haben. Eine angeborene Cytomegalovirus-Infektion führt häufig zu Entwicklungsverzögerungen sowie zu zahlreichen unerwünschten Folgen, einschließlich geistiger Behinderung und Hörverlust.
Wie kommt es zu einer Cytomegalovirus-Infektion?
Zytomegalievirus-Infektion nicht sehr ansteckend. Seine Übertragung erfordert langfristige enge Kommunikation oder wiederholte Kontakte.
- In der Luft: beim Sprechen, Husten, Niesen, Küssen usw.
- Sexueller Weg: Beim sexuellen Kontakt ist das Risiko einer Übertragung des Virus sehr hoch, da das Virus in Sperma, Vaginal- und Zervixschleim ausgeschieden wird.
- Bei der Transfusion von Blut und seinen leukozytenhaltigen Bestandteilen.
- Von der Mutter zum Fötus - meistens in der Grundschule Cytomegalovirus-Infektion oder Reaktivierung einer latenten Infektion während der Schwangerschaft.
Wie funktioniert die Cytomegalovirus-Infektion?
Das Virus dringt in das Blut eines gesunden Menschen ein und verursacht eine ausgeprägte Immunantwort, die in der Bildung von Antikörpern - spezifischen Schutzproteinen - Immunglobulinen M (Anti - CMV - IgM) sowie der Hauptschutzreaktion gegen Viren - zellulär - besteht.
CD 4- und CD 8-Lymphozyten haben eine starke Aktivität gegen Cytomegaloviren. Wenn daher die zelluläre Immunantwort unterdrückt wird, beispielsweise unter Verletzung der Bildung von CD 4-Lymphozyten bei AIDS, entwickelt sich eine Cytomegalovirus-Infektion aktiv und führt zur Reaktivierung einer zuvor latenten Infektion.
Immunglobuline M gegen Cytomegalovirus werden etwa 4-7 Wochen nach der Infektion gebildet und sind 16-20 Wochen im Blut. Ihr Nachweis im Blut während dieser Zeiträume kann ein Hinweis auf eine primäre Cytomegalovirus-Infektion sein. Dann werden die Immunglobuline M durch Immunglobuline G (Anti-CMV-IgG) ersetzt, die in unterschiedlichem Maße während des gesamten restlichen Lebens im Blut vorhanden sind.
In den meisten Fällen ist die Cytomegalovirus-Infektion bei normaler Immunität asymptomatisch, obwohl sie lange Zeit in Form einer latenten Infektion im Körper verbleibt. Wo genau das Virus gespeichert ist, ist unbekannt, man geht davon aus, dass es in vielen Organen und Geweben vorhanden ist.
Vom Cytomegalovirus befallene Zellen haben ein charakteristisches Aussehen - sie nehmen an Größe zu (was den Namen des Virus bestimmte) und sehen unter dem Mikroskop wie ein "Eulenauge" aus.
Auch asymptomatische Träger können das Virus auf nicht infizierte Personen übertragen. Eine Ausnahme bildet die Übertragung des Virus von der Mutter auf den Fötus, die hauptsächlich nur bei einem aktiven Infektionsprozess auftritt, aber nur in 5% der Fälle zu einer angeborenen Zytomegalie führt, bei den übrigen Neugeborenen verläuft die Zytomegalovirus-Infektion ebenfalls asymptomatisch.
Mononukleose-ähnliches Syndrom
Mononukleose-ähnliches Syndrom ist die häufigste Form Cytomegalovirus-Infektion bei Personen mit normaler Immunität, die die Neugeborenenperiode verlassen haben. Das Mononukleose-ähnliche Syndrom kann in klinischen Manifestationen nicht von der infektiösen Mononukleose unterschieden werden, die durch ein anderes Herpesvirus, das Ebstein-Barr-Virus, verursacht wird.
Die Inkubationszeit beträgt 20-60 Tage. Die Krankheit verläuft in Form einer grippeähnlichen Erkrankung:
- Anhaltendes hohes Fieber, manchmal mit Schüttelfrost;
- Starke Müdigkeit, Unwohlsein;
- Schmerzen in Muskeln, Gelenken, Kopfschmerzen;
- Halsentzündung;
- Vergrößerte Lymphknoten;
- Röteln-ähnlicher Hautausschlag ist selten, häufiger bei einer Behandlung mit Ampicillin.
Manchmal wird eine primäre Cytomegalovirus-Infektion von Anzeichen einer Hepatitis begleitet; Gelbsucht ist selten, aber häufig ist ein Anstieg der Leberenzyme im Blut vorhanden.
Selten (in 0-6% der Fälle) wird das Mononukleose-ähnliche Syndrom durch eine Lungenentzündung kompliziert. Bei immunologisch gesunden Menschen ist es jedoch asymptomatisch und wird nur auf Röntgenaufnahmen des Brustkorbs nachgewiesen.
Die Krankheit dauert 9-60 Tage. Die meisten Patienten erholen sich vollständig, obwohl die Nachwirkungen in Form von Schwäche und Unwohlsein, manchmal geschwollenen Lymphknoten, mehrere Monate anhalten. Wiederkehrende Infektionen mit Fieber, Unwohlsein, Hitzewallungen und Schwitzen sind selten.
Angeborene Cytomegalovirus-Infektion
Eine intrauterine Infektion des Fötus ist nicht immer die Ursache für eine angeborene Zytomegalie, in den meisten Fällen ist sie asymptomatisch und führt nur bei 5% der Neugeborenen zur Entwicklung der Krankheit. Angeborenes Cytomegalovirus tritt bei Neugeborenen auf, deren Mütter eine primäre Cytomegalovirus-Infektion hatten.
Die Manifestationen der angeborenen Zytomegalie sind sehr unterschiedlich:
- Petechien - Hautausschläge, die kleine Blutungen sind, treten in 60-80% der Fälle auf;
- Gelbsucht;
- Intrauterine Entwicklungsverzögerung, Frühgeburt tritt in 30-50% der Fälle auf;
- Chorioretinitis - Entzündung der Netzhaut, die oft zu einer Abnahme und zum Verlust des Sehvermögens führt;
Die Sterblichkeit bei angeborener Cytomegalovirus-Infektion beträgt 20-30%. Die meisten überlebenden Kinder sind geistig zurückgeblieben oder schwerhörig.
Erworbene Cytomegalovirus-Infektion bei Neugeborenen
Bei einer Infektion mit dem Cytomegalovirus während der Geburt (während der Passage des Geburtskanals) oder nach der Geburt (beim Stillen oder bei normalem Kontakt) bleibt die Infektion in den meisten Fällen asymptomatisch.
Einige jedoch, insbesondere Frühgeborene und Säuglinge mit niedrigem Geburtsgewicht Cytomegalovirus-Infektion manifestiert sich durch die Entwicklung einer verlängerten Lungenentzündung, die oft von einer begleitenden bakteriellen Infektion begleitet wird.
Darüber hinaus ist es möglich, die körperliche Entwicklung, Hautausschlag, geschwollene Lymphknoten und Hepatitis zu verlangsamen.
Personen mit geschwächtem Immunsystem
Zu den immungeschwächten Personen gehören:
- Personen mit verschiedenen Arten von angeborener Immunschwäche.
- Personen mit erworbenem Immunschwächesyndrom (AIDS).
- Personen, die sich einer Transplantation innerer Organe unterzogen haben: Niere, Herz, Leber, Lunge und Knochenmark.
Die Schwere der klinischen Manifestationen hängt vom Grad der Immunsuppression ab, jedoch führt die chronische Anwendung von Immunsuppressiva zu schwereren Manifestationen.
Zytomegalievirus-Infektion nach Transplantation:
- Besonders häufig befällt das Cytomegalovirus die transplantierten Organe selbst und verursacht Hepatitis in der transplantierten Leber, Lungenentzündung in der transplantierten Lunge usw.
- Nach einer Knochenmarktransplantation entwickeln 15–20 % der Patienten eine Cytomegalovirus-Pneumonie, an der 84–88 % der Patienten sterben.
- Das größte Risiko einer Cytomegalovirus-Infektion besteht, wenn der Spender infiziert ist und der Empfänger nicht.
Zytomegalievirus-Infektion bei HIV-infizierten Patienten:
Zytomegalievirus-Infektion fast alle AIDS-Patienten leiden.
- Der Infektionsbeginn ist meist subakut: Fieber, Unwohlsein, Nachtschweiß, Muskel- und Gelenkschmerzen
- Lungenentzündung - Husten, Atemnot treten bei den ersten Anzeichen der Krankheit auf
- Geschwüre der Speiseröhre, des Magens, des Darms, die zu Blutungen und Wandrissen führen können
- Hepatitis
- Enzephalitis ist eine Entzündung der Substanz des Gehirns. Kann mit AIDS-Demenzsyndrom oder Schädigung der Hirnnerven, Schläfrigkeit, Orientierungslosigkeit, Nystagmus (rhythmische Bewegungen der Augäpfel) auftreten
- Retinitis, eine Entzündung der Netzhaut, ist eine häufige Ursache für Sehverlust bei immunsupprimierten Patienten.
- Eine multiple Organschädigung ist die Zerstörung fast aller Organe durch das Virus, was zu deren Funktionsstörung führt. Verursacht häufig den Tod durch eine Cytomegalovirus-Infektion.
Prävention einer Cytomegalovirus-Infektion
Verhütung Cytomegalovirus-Infektion Es ist ratsam, bei Personen durchzuführen, die zur Risikogruppe gehören. Dazu gehören HIV-infizierte Personen, insbesondere solche mit AIDS; Personen, die sich einer Transplantation innerer Organe unterzogen haben; Personen, die aufgrund anderer Ursachen an einer Immunschwäche leiden.
Die Einhaltung der Regeln der persönlichen Hygiene, selbst die gründlichsten, vermeidet eine Infektion mit Cytomegaloviren nicht, da Viren allgegenwärtig sind und durch Tröpfchen in der Luft übertragen werden. Daher wird die Prophylaxe bei Risikopatienten mit antiviralen Medikamenten durchgeführt: Ganciclovir, Foscarnet, Aciclovir.
Um die Wahrscheinlichkeit einer Cytomegalovirus-Infektion bei Empfängern von inneren Organen und Knochenmark zu verringern, wird außerdem eine sorgfältige Auswahl der Spender unter Berücksichtigung ihrer Infektion mit einer Cytomegalovirus-Infektion empfohlen.
Diagnose einer Cytomegalovirus-Infektion
Die Labordiagnostik einer Cytomegalovirus-Infektion basiert auf serologischen Untersuchungen - der Bestimmung von Antikörpern, die für Cytomegalovirus im Blut spezifisch sind.
- Immunglobuline M - Anti - CMV - IgM;
Sie sind Marker einer akuten Infektion: primäre Cytomegalovirus-Infektion oder Reaktivierung einer chronischen Infektion. Werden bei Schwangeren hohe Antikörpertiter nachgewiesen, besteht die Gefahr einer Infektion des Fötus. Erhöhung erst 4-7 Wochen nach Infektion. Bleiben Sie für 16-20 Wochen erhöht
- Immunglobuline G - Anti - CMV - IgG;
Der Titer dieser Art von Immunglobulin steigt bereits während der Abnahme der Aktivität des Infektionsprozesses an. Das Vorhandensein von Anti - CMV - IgG im Blut zeigt nur das Vorhandensein von Cytomegalovirus im Körper an, spiegelt jedoch in keiner Weise seine Aktivität wider.
- Polymerase Kettenreaktion;
Die PCR basiert auf der Bestimmung von Virus-DNA im Blut oder in Schleimhautzellen (in Abstrichen aus den Harnröhren-, Zervikalkanälen, sowie in Speichel, Sputum etc.). Es wird empfohlen, eine quantitative PCR-Reaktion durchzuführen, mit der Sie den Reproduktionsgrad des Virus und damit die Aktivität des Entzündungsprozesses beurteilen können.
Behandlung einer Cytomegalovirus-Infektion
Ein Mononukleose-ähnliches Syndrom mit unkompliziertem Verlauf bedarf keiner besonderen Behandlung. Eine herkömmliche Behandlung reicht aus, wie bei einer Erkältung. Hauptsache viel Flüssigkeit nicht vergessen.
Das Mittel der Wahl zur Behandlung von Cytomegalovirus-Infektionen bei Risikopatienten ist Ganciclovir (Cymeven). Zur Behandlung werden intravenöse Formen des Arzneimittels verwendet. Tabletten sind nur in Bezug auf die Prävention wirksam.
Nebenwirkungen von Ganciclovir:
- Hemmung der Bildung von Blutzellen (Neutropenie, Anämie, Thrombozytopenie). Entwickelt sich in 40% der Fälle.
- Durchfall (44 %), Erbrechen, Appetitlosigkeit.
- Temperaturanstieg (48% der Patienten), begleitet von Schüttelfrost, Schwitzen.
- Juckreiz der Haut.
Warnungen:
- Ganciclovir wird NICHT bei Menschen ohne Immunerkrankungen angewendet.
- Die Anwendung von Ganciclovir bei Schwangeren und Kindern ist nur in lebensbedrohlichen Situationen möglich.
- Bei Personen mit eingeschränkter Nierenfunktion sollte die Dosis angepasst werden.
Zur Behandlung wird auch Foscarnet verwendet, das bei Patienten mit einer HIV-Infektion als wirksamer gilt.
Nebenwirkungen:
- Elektrolytstörungen: Abnahme von Kalium und Magnesium im Blut.
- Geschwüre der Genitalien.
- Harnwegserkrankungen.
- Brechreiz.
- Nierenschäden: Das Medikament ist nephrotoxisch, daher ist bei Nierenversagen eine sorgfältige Anwendung und Dosisanpassung des Medikaments erforderlich.
Moderne Statistiken zeigen, dass jedes fünfte Kind im Alter von 1 Jahr mit einer Cytomegalovirus-Infektion infiziert wird. Unter den Infektionswegen ist die intrauterine Infektion die gefährlichste. Auf diese Weise infizieren sich 5 bis 7 Prozent der Kinder. Etwa 30 Prozent der Fälle, in denen das Virus auf das Kind übertragen wird, treten während des Stillens auf. Die restlichen Kinder infizieren sich in Kindergruppen mit der Infektion. BEI Jugend das Virus tritt bei 15 Prozent der Kinder auf. Im Alter von 35 Jahren sind mehr als 40 Prozent der Bevölkerung von der Krankheit betroffen, und im Alter von 50 Jahren infizieren sich 99 Prozent der Menschen mit dem Virus.
In den Vereinigten Staaten von Amerika wird bei 3 Prozent aller Neugeborenen eine angeborene Infektion diagnostiziert, von denen 80 Prozent klinische Manifestationen in Form verschiedener Pathologien aufweisen. Die Sterblichkeitsrate für angeborene Cytomegalieviren mit Komplikationen bei der Geburt liegt bei 20 Prozent, was zwischen 8.000 und 10.000 Kindern jährlich entspricht. Ohne Komplikationen bei der Geburt entwickeln 15 Prozent der während der fötalen Entwicklung infizierten Kinder später Krankheiten unterschiedlichen Schweregrades. Zwischen 3 und 5 Prozent der Kinder weltweit infizieren sich in den ersten 7 Lebenstagen.
Unter den schwangeren Frauen sind etwa 2 Prozent der Frauen einer Primärinfektion ausgesetzt. Die Übertragungswahrscheinlichkeit des Virus zum Zeitpunkt der Geburt eines Kindes mit Erstinfektion liegt bei 30 bis 50 Prozent. Solche Kinder werden mit den folgenden Abweichungen geboren - neurosensorische Störungen - von 5 bis 13 Prozent; geistige Behinderung - bis zu 13 Prozent; bilateraler Hörverlust - bis zu 8 Prozent.
Interessante Fakten zur Cytomegalovirus-Infektion
Einer der Namen des Cytomegalovirus ist der Ausdruck „Zivilisationskrankheit“, was die weite Verbreitung dieser Infektion erklärt. Es gibt auch Namen wie Viruserkrankung der Speicheldrüsen, Zytomegalie, Krankheit mit Einschlüssen. Zu Beginn des 19. Jahrhunderts wurde diese Krankheit romantisch als „Kissing Disease“ bezeichnet, da man damals glaubte, dass die Ansteckung mit diesem Virus durch Speichel beim Küssen erfolgt. Der wahre Erreger wurde 1956 von Margaret Gladys Smith entdeckt. Dieser Wissenschaftler konnte das Virus aus dem Urin eines infizierten Kindes isolieren. Ein Jahr später begann Wellers wissenschaftliche Gruppe, den Erreger der Infektion zu untersuchen, und nach weiteren drei Jahren wurde der Name „Cytomegalovirus“ eingeführt.Trotz der Tatsache, dass im Alter von 50 Jahren fast jeder Mensch auf der Erde diese Krankheit durchgemacht hat, empfiehlt kein Industrieland der Welt, bei schwangeren Frauen auf die übliche Weise Tests zum Nachweis von CMV durchzuführen. Die Veröffentlichungen des American College of Obstetricians und der American Academy of Pediatrics besagen, dass die Diagnose einer CMV-Infektion bei Schwangeren und Neugeborenen aufgrund des Fehlens eines Impfstoffs und einer speziell entwickelten Behandlung gegen dieses Virus nicht angemessen ist. Ähnliche Empfehlungen wurden 2003 vom Royal College of Obstetricians and Gynecologists im Vereinigten Königreich veröffentlicht. Laut Vertretern dieser Organisation ist die Diagnose einer Cytomegalovirus-Infektion bei schwangeren Frauen nicht erforderlich, da nicht vorhergesagt werden kann, welche Komplikationen bei einem Kind auftreten werden. Für diese Schlussfolgerung spricht auch die Tatsache, dass es bis heute keine ausreichende Verhinderung der Übertragung einer Infektion von der Mutter auf den Fötus gibt.
Die Schlussfolgerungen der Colleges of America und Great Britain laufen darauf hinaus, dass eine systematische Untersuchung zum Nachweis von Cytomegalovirus bei Schwangeren aufgrund der Vielzahl unerforschter Faktoren dieser Erkrankung nicht zu empfehlen ist. Eine zwingende Empfehlung besteht darin, allen schwangeren Frauen Informationen zur Verfügung zu stellen, die es ihnen ermöglichen, Vorsichts- und Hygienemaßnahmen zur Vorbeugung dieser Krankheit einzuhalten.
Was ist Cytomegalovirus?
 Das Cytomegalovirus ist einer der häufigsten menschlichen Krankheitserreger. Einmal im Körper angekommen, kann das Virus eine klinisch ausgeprägte Cytomegalovirus-Infektion verursachen oder lebenslang inaktiv bleiben. Bis heute gibt es keine Medikamente, die das Cytomegalovirus aus dem Körper entfernen könnten.
Das Cytomegalovirus ist einer der häufigsten menschlichen Krankheitserreger. Einmal im Körper angekommen, kann das Virus eine klinisch ausgeprägte Cytomegalovirus-Infektion verursachen oder lebenslang inaktiv bleiben. Bis heute gibt es keine Medikamente, die das Cytomegalovirus aus dem Körper entfernen könnten. Die Struktur des Cytomegalovirus
Cytomegalovirus ist eines der größten Viruspartikel. Sein Durchmesser beträgt 150 - 200 Nanometer. Daher auch ihr Name – aus dem Altgriechischen übersetzt – „große Viruszelle“.Ein erwachsenes reifes Cytomegalovirus-Viruspartikel wird als Virion bezeichnet. Das Virion hat eine Kugelform. Seine Struktur ist komplex und besteht aus mehreren Komponenten.
Die Komponenten des Cytomegalovirus-Virions sind:
- Virusgenom;
- Nukleokapsid;
- Protein ( Protein) Matrix;
- Superkapsid.
Das Cytomegalovirus-Genom befindet sich im Zellkern ( Ader) Virion. Es ist ein Bündel dicht gepackter doppelsträngiger DNA-Helix ( Desoxyribonukleinsäure), die alle genetischen Informationen des Virus enthält.
Nukleokapsid
„Nucleocapsid“ wird aus dem Altgriechischen als „Hülle des Zellkerns“ übersetzt. Es ist eine Proteinschicht, die das Virusgenom umgibt. Das Nukleokapsid besteht aus 162 Kapsomeren ( Shell-Protein-Fragmente). Kapsomere bilden eine geometrische Figur mit fünfeckigen und sechseckigen Flächen, die nach Art der kubischen Symmetrie angeordnet sind.
Proteinmatrix
Die Proteinmatrix nimmt den gesamten Raum zwischen dem Nukleokapsid und der äußeren Hülle des Virions ein. Proteine, aus denen die Proteinmatrix besteht, werden beim Eindringen des Virus in die Wirtszelle aktiviert und beteiligen sich an der Reproduktion neuer viraler Einheiten.
Superkapsid
Die äußere Hülle des Virions wird als Superkapsid bezeichnet. Es besteht aus einer Vielzahl von Glykoproteinen ( Komplexe Proteinstrukturen, die Kohlenhydratkomponenten enthalten). Glykoproteine sind im Supercapsid unterschiedlich lokalisiert. Einige von ihnen ragen über die Oberfläche der Hauptschicht von Glykoproteinen hinaus und bilden kleine "Spitzen". Mit Hilfe dieser Glykoproteine "fühlt" und analysiert das Virion die äußere Umgebung. Wenn das Virus mit einer Zelle des menschlichen Körpers in Kontakt kommt, heftet es sich mit Hilfe von "Spikes" an und dringt in sie ein.
Eigenschaften des Cytomegalovirus
Cytomegalovirus hat eine Reihe von wichtigen biologische Eigenschaften die seine Pathogenität bestimmen.Die Haupteigenschaften des Cytomegalovirus sind:
- geringe Virulenz ( Grad der Pathogenität);
- Latenz;
- langsame Wiedergabe;
- ausgeprägt zytopathisch ( zellzerstörend) Wirkung;
- Reaktivierung bei Immunsuppression des Wirts;
- Instabilität in der äußeren Umgebung;
- geringe Ansteckungsgefahr ( Fähigkeit zu infizieren).
Mehr als 60 - 70 Prozent der erwachsenen Bevölkerung unter 50 Jahren und mehr als 95 Prozent der Bevölkerung über 50 Jahren sind mit dem Cytomegalovirus infiziert. Die meisten Menschen wissen jedoch nicht einmal, dass sie Träger dieses Virus sind. Meistens liegt das Virus in einer latenten Form vor oder verursacht minimale klinische Manifestationen. Dies liegt an seiner geringen Virulenz.
Latenz
Einmal im menschlichen Körper, verbleibt das Cytomegalovirus lebenslang darin. Dank der körpereigenen Immunabwehr kann das Virus lange Zeit in einem latenten Ruhezustand existieren, ohne dass es zu klinischen Manifestationen der Krankheit kommt.
Mit Hilfe von Glykoprotein-"Dornen" erkennt das Virion und heftet sich an die Membran der Zelle, die es benötigt. Allmählich verschmilzt die äußere Membran des Virus mit der Zellmembran und das Nukleokapsid dringt in das Innere ein. Innerhalb der Wirtszelle fügt das Nukleokapsid seine DNA in den Kern ein und hinterlässt eine Proteinmatrix auf der Kernmembran. Mithilfe der Enzyme des Zellkerns vermehrt sich virale DNA. Die außerhalb des Zellkerns verbliebene Proteinmatrix des Virus synthetisiert neue Kapsidproteine. Dieser Vorgang ist der längste – er dauert durchschnittlich 15 Stunden. Die synthetisierten Proteine gelangen in den Zellkern und verbinden sich mit neuer viraler DNA, wodurch das Nukleokapsid gebildet wird. Allmählich werden Proteine einer neuen Matrix synthetisiert, die sich an das Nukleokapsid anlagert. Das Nukleokapsid verlässt den Zellkern, haftet an der inneren Oberfläche der Zellmembran und wird von dieser umhüllt, wodurch sich ein Superkapsid bildet. Kopien des Virions, die die Zelle verlassen haben, können zur weiteren Vermehrung in eine andere gesunde Zelle eindringen.
Reaktivierung bei der Immunsuppression des Wirts
Das Cytomegalovirus kann sich im menschlichen Körper lange Zeit in einem latenten Zustand befinden. Unter Bedingungen der Immunsuppression jedoch, wenn das menschliche Immunsystem geschwächt oder zerstört ist, wird das Virus aktiviert und beginnt, zur Reproduktion in die Wirtszellen einzudringen. Sobald sich das Immunsystem wieder normalisiert, wird das Virus unterdrückt und fällt in den „Winterschlaf“.
Hauptsächlich nachteilige Faktoren Umgebung für Cytomegalovirus sind:
- hohe Temperaturen ( mehr als 40 - 50 Grad Celsius);
- Einfrieren;
- Fettlöser ( Alkohol, Äther, Reinigungsmittel).
Bei einem einzigen Kontakt mit dem Virus ist es dank eines guten Immunsystems und der Schutzbarrieren des menschlichen Körpers fast unmöglich, sich mit einer Cytomegalovirus-Infektion zu infizieren. Eine Infektion mit dem Virus erfordert einen langfristigen ständigen Kontakt mit der Infektionsquelle.
Methoden der Infektion mit Cytomegalovirus
 Cytomegalovirus hat eine ziemlich geringe Ansteckungsgefahr, daher sind mehrere günstige Faktoren für eine Infektion erforderlich.
Cytomegalovirus hat eine ziemlich geringe Ansteckungsgefahr, daher sind mehrere günstige Faktoren für eine Infektion erforderlich. Begünstigende Faktoren für eine Infektion mit Cytomegalovirus sind:
- ständiger, langer und enger Kontakt mit der Infektionsquelle;
- Verletzung der biologischen Schutzbarriere - das Vorhandensein von Gewebeschäden ( Schnitte, Wunden, Mikrotrauma, Erosion) am Ort des Kontakts mit der Infektion;
- Funktionsstörungen des körpereigenen Immunsystems bei Unterkühlung, Stress, Infektionen und verschiedenen inneren Erkrankungen.
Methoden der Infektion mit Cytomegalovirus
| Übertragungswege | Was wird übertragen | Eingangstor |
| Haushalt kontaktieren |
|
|
| In der Luft |
|
|
| Kontakt-sexuell |
|
|
| Oral |
|
|
| Transplazentar |
|
|
| iatrogen |
|
|
| Transplantation |
|
|
Wenden Sie sich an den Haushalt
Der Kontakt-Haushalts-Infektionsweg mit Cytomegalovirus ist häufiger in geschlossenen Gruppen ( Familie, Kindergarten, Lager). Haushalts- und Körperpflegeartikel eines Virusträgers oder eines Patienten infizieren sich mit verschiedenen Körperflüssigkeiten ( Speichel, Urin, Blut). Bei ständiger Nichteinhaltung von Hygienestandards breitet sich eine Cytomegalovirus-Infektion leicht im gesamten Team aus.Luftweg
Cytomegalovirus wird aus dem Körper eines Patienten oder Trägers mit Sputum, Speichel, Tränen ausgeschieden. Beim Husten, Niesen werden diese Flüssigkeiten in Form von Mikropartikeln in der Luft verteilt. Ein gesunder Mensch infiziert sich mit dem Virus, indem er diese Mikropartikel einatmet. Die Eingangstore sind die Schleimhäute der oberen Atemwege und der Mundhöhle.Kontaktsexueller Weg
Einer der häufigsten Übertragungswege der Cytomegalovirus-Infektion ist der kontaktsexuelle Weg. Ungeschützter Geschlechtsverkehr mit einer erkrankten Person oder einem Virusträger führt zu einer Infektion mit dem Zytomegalievirus. Das Virus wird mit Sperma, Schleim des Gebärmutterhalses und der Vagina ausgeschieden und gelangt über die Schleimhäute der Geschlechtsorgane in den Körper eines gesunden Partners. Beim nicht-traditionellen Geschlechtsverkehr können die Schleimhäute des Anus und der Mundhöhle zum Eingangstor werden.oralem Weg
Bei Kindern ist der häufigste Infektionsweg mit dem Cytomegalovirus der orale Weg. Das Virus gelangt über kontaminierte Hände und Gegenstände, die Kinder ständig in den Mund nehmen, in den Körper.Die Infektion kann durch Küssen mit Speichel übertragen werden, was auch für den oralen Übertragungsweg gilt.
Transplazentarer Weg
Wenn bei schwangeren Frauen eine Cytomegalovirus-Infektion aktiviert wird, infiziert sich das Kind vor dem Hintergrund einer reduzierten Immunität. Das Virus kann mit dem Blut der Mutter durch die Nabelarterie in den Körper des Fötus gelangen und verschiedene Pathologien der fötalen Entwicklung verursachen.Auch während der Geburt ist eine Ansteckung möglich. Mit dem Blut einer Gebärenden gelangt das Virus in Haut und Schleimhäute des Fötus. Wenn ihre Integrität gebrochen ist, dringt das Virus in den Körper des Neugeborenen ein.
iatrogener Weg
Eine Infektion des Körpers mit Cytomegalovirus kann das Ergebnis einer Bluttransfusion sein ( Bluttransfusion) von einem infizierten Spender. Eine einzelne Bluttransfusion führt in der Regel nicht zur Ausbreitung einer Cytomegalovirus-Infektion. Am anfälligsten sind Patienten, die häufig oder ständig Bluttransfusionen benötigen. Dazu gehören Patienten mit verschiedenen Blutkrankheiten. Der Körper solcher Patienten ist geschwächt. Ihr Immunsystem ist mit der Grunderkrankung überfordert und kann das Virus nicht bekämpfen. Kontinuierliche Bluttransfusionen tragen zur Infektion mit Cytomegalovirus bei.Cytomegalovirus kann auch durch wiederholte Verwendung unsteriler medizinischer Geräte in den Körper gelangen.
Transplantationsweg
Cytomegalovirus kann lange in den Organen und Geweben des Spenders persistieren. Organtransplantierte Patienten erhalten eine immunsuppressive Therapie, um eine Abstoßung zu verhindern. Vor dem Hintergrund der Immunsuppression wird das Cytomegalovirus aktiviert und breitet sich im ganzen Körper des Patienten aus.Die Ausbreitung einer Cytomegalovirus-Infektion im Körper verläuft in mehreren Stufen.
Die Stadien der Ausbreitung einer Cytomegalovirus-Infektion sind:
- lokaler Zellschaden;
- Verteilung in regionalen Lymphknoten;
- primäre Immunantwort;
- Zirkulation im Kreislauf- und Lymphsystem;
- Verbreitung ( Verbreiten) in Organen und Geweben;
- sekundäre Immunantwort.
Eine Cytomegalovirus-Infektion dringt in den meisten Fällen durch die Haut oder Schleimhäute in den Körper ein, bei denen die Integrität beeinträchtigt ist.
Zu diesem Zeitpunkt wird im menschlichen Körper das Immunsystem aktiviert, das die Ausbreitung von Fremdpartikeln durch Blut und Lymphe unterdrückt. Das Immunsystem ist jedoch nicht in der Lage, die Infektion vollständig zu zerstören. Cytomegalovirus kann lange Zeit in den Lymphknoten latent verbleiben.
Bei einer Immunsuppression ist der Körper nicht in der Lage, die Vermehrung des Virus zu stoppen. Das Cytomegalovirus dringt in Blutzellen ein und breitet sich auf alle Organe und Gewebe aus und beeinflusst sie.
Die sekundäre Immunantwort produziert große Menge Antikörper gegen das Virus, die seine weitere Replikation hemmen ( Reproduktion). Der Patient erholt sich, wird aber Träger ( Virus persistiert in Lymphzellen).
Symptome einer Cytomegalovirus-Infektion bei Frauen
 Die Symptome einer Cytomegalovirus-Infektion bei Frauen hängen von der Form der Erkrankung ab. In 90 Prozent der Fälle haben Frauen eine latente Form der Erkrankung ohne ausgeprägte Symptome. In anderen Fällen tritt das Cytomegalovirus mit schweren Schäden an inneren Organen auf.
Die Symptome einer Cytomegalovirus-Infektion bei Frauen hängen von der Form der Erkrankung ab. In 90 Prozent der Fälle haben Frauen eine latente Form der Erkrankung ohne ausgeprägte Symptome. In anderen Fällen tritt das Cytomegalovirus mit schweren Schäden an inneren Organen auf. Nach dem Eindringen des Cytomegalovirus in den menschlichen Körper beginnt eine Inkubationszeit. Während dieser Zeit vermehrt sich das Virus aktiv im Körper, ohne jedoch Symptome zu zeigen. Bei einer Cytomegalovirus-Infektion dauert dieser Zeitraum 20 bis 60 Tage. Dann kommt die akute Phase der Krankheit. Frauen mit starkem Immunsystem können diese Phase mit leichten grippeähnlichen Symptomen erleben. Eine leichte Temperatur kann beobachtet werden ( 36,9 - 37,1 Grad Celsius), leichtes Unwohlsein, Schwäche. In der Regel vergeht diese Frist unmerklich. Für das Vorhandensein von Cytomegalovirus im Körper einer Frau spricht jedoch ein Anstieg des Titers von Antikörpern in ihrem Blut. Wenn sie in diesem Zeitraum eine serologische Diagnose stellt, werden Akut-Phase-Antikörper gegen dieses Virus nachgewiesen ( Anti-CMV-IgM).
Die akute Phase des Cytomegalovirus dauert 4 bis 6 Wochen. Danach lässt die Infektion nach und wird nur mit einer Abnahme der Immunität aktiviert. In dieser Form kann die Infektion lebenslang bestehen bleiben. Nur mit zufälliger oder geplanter Diagnose kann es erkannt werden. In diesem Fall werden im Blut einer Frau oder in einem Abstrich, wenn ein PCR-Abstrich durchgeführt wird, Antikörper in der chronischen Phase gegen Cytomegalovirus nachgewiesen ( Anti-CMV-IgG).
Es wird angenommen, dass 99 Prozent der Bevölkerung Träger einer latenten Cytomegalovirus-Infektion sind, und bei diesen Personen werden Anti-CMV-IgG nachgewiesen. Wenn sich die Infektion nicht manifestiert und die Immunität der Frau stark genug ist, dass das Virus in einer inaktiven Form bleibt, wird sie zur Virusträgerin. In der Regel ist der Virusträger nicht gefährlich. Gleichzeitig kann eine latente Cytomegalovirus-Infektion bei Frauen Fehlgeburten, die Geburt toter Kinder, verursachen.
Bei immungeschwächten Frauen ist die Infektion aktiv. In diesem Fall werden zwei Formen der Krankheit beobachtet - akute Mononukleose-ähnliche und generalisierte Form.
Akute Cytomegalovirus-Infektion
Diese Form der Infektion ähnelt der infektiösen Mononukleose. Es beginnt abrupt mit Fieber und Schüttelfrost. Das Hauptmerkmal dieser Periode ist die generalisierte Lymphadenopathie ( geschwollene Lymphknoten). Wie bei der infektiösen Mononukleose kommt es zu einer Zunahme der Lymphknoten von 0,5 auf 3 Zentimeter. Die Knoten sind schmerzhaft, aber nicht miteinander verlötet, sondern weich und elastisch.Zunächst nehmen die zervikalen Lymphknoten zu. Sie können sehr groß werden und 5 Zentimeter überschreiten. Außerdem nehmen die submandibulären, axillären und inguinalen Knoten zu. Auch die inneren Lymphknoten sind vergrößert. Die Lymphadenopathie tritt als erstes der Symptome auf und verschwindet als letztes.
Weitere Symptome der akuten Phase sind:
- Unwohlsein;
- Lebervergrößerung ( Hepatomegalie);
- Erhöhung der Leukozyten im Blut;
- das Auftreten atypischer mononukleärer Zellen im Blut.
Unterschiede zwischen Cytomegalovirus und infektiöser Mononukleose
Im Gegensatz zur infektiösen Mononukleose wird beim Cytomegalovirus keine Angina pectoris beobachtet. Es ist auch äußerst selten, eine Zunahme der okzipitalen Lymphknoten und der Milz zu beobachten ( Splenomegalie). In der Labordiagnostik ist die der infektiösen Mononukleose innewohnende Paul-Bunnel-Reaktion negativ.
Generalisierte Form der Cytomegalovirus-Infektion
Diese Form der Krankheit ist äußerst selten und sehr schwierig. In der Regel entwickelt es sich bei Frauen mit Immunschwäche oder vor dem Hintergrund anderer Infektionen. Immunschwächezustände können aus Chemotherapie, Strahlentherapie oder HIV-Infektion resultieren. Bei einer generalisierten Form können innere Organe, Blutgefäße, Nerven und Speicheldrüsen betroffen sein.Die häufigsten Manifestationen einer generalisierten Infektion sind:
- Leberschäden mit der Entwicklung einer Cytomegalovirus-Hepatitis;
- Lungenschäden mit der Entwicklung einer Lungenentzündung;
- Schädigung der Netzhaut mit der Entwicklung einer Retinitis;
- schädigung der Speicheldrüsen mit der Entwicklung einer Sialadenitis;
- Nierenschäden mit der Entwicklung einer Nephritis;
- schädigung der Organe des Fortpflanzungssystems.
Bei der Cytomegalovirus-Hepatitis sind sie als Hepatozyten ( Leberzellen) und die Gefäße der Leber. In der Leber entwickelt sich eine entzündliche Infiltration, das Phänomen der Nekrose ( Bereiche der Nekrose). Tote Zellen werden abgestoßen und füllen die Gallengänge. Es gibt eine Stagnation der Galle, was zu Gelbsucht führt. Die Hautfarbe wird gelblich. Es gibt Beschwerden wie Übelkeit, Erbrechen, Schwäche. Im Blut steigt der Spiegel von Bilirubin, hepatischen Transaminasen. Die Leber nimmt dabei zu, wird krankhaft. Leberversagen entwickelt sich.
Der Verlauf einer Hepatitis kann akut, subakut und chronisch sein. Im ersten Fall entwickelt sich die sogenannte fulminante Hepatitis, oft mit tödlichem Ausgang.
Die Diagnose einer Cytomegalovirus-Infektion wird auf eine Punktionsbiopsie reduziert. In diesem Fall wird mit Hilfe einer Punktion ein Stück Lebergewebe zur weiteren histologischen Untersuchung entnommen. Bei der Untersuchung des Gewebes werden riesige Zytomegaliezellen gefunden.
Cytomegalovirus-Pneumonie
Beim Cytomegalovirus entwickelt sich in der Regel zunächst eine interstitielle Pneumonie. Bei dieser Form der Lungenentzündung sind nicht die Lungenbläschen betroffen, sondern deren Wände, Kapillaren und Gewebe um die Lymphgefäße herum. Diese Lungenentzündung ist schwer zu behandeln, was zu einem langen Verlauf führt.
Sehr oft wird eine solche verlängerte Lungenentzündung durch das Hinzufügen einer bakteriellen Infektion kompliziert. In der Regel verbindet sich die Staphylokokkenflora mit der Entwicklung einer eitrigen Lungenentzündung. Die Körpertemperatur steigt auf 39 Grad Celsius, Fieber und Schüttelfrost entwickeln sich. Der Husten wird schnell nass mit einer großen Menge eitrigen Auswurfs. Kurzatmigkeit entwickelt sich, Brustschmerzen treten auf.
Neben einer Lungenentzündung kann eine Cytomegalovirus-Infektion Bronchitis, Bronchiolitis entwickeln. Auch die Lymphknoten der Lunge sind betroffen.
Cytomegalovirus-Retinitis
Retinitis betrifft die Netzhaut des Auges. Retinitis ist normalerweise bilateral und kann durch Erblindung kompliziert werden.
Die Symptome einer Retinitis sind:
- Photophobie;
- verschwommene Sicht;
- "fliegt" vor den Augen;
- das Erscheinen von Blitzen und Blitzen vor den Augen.
Cytomegalovirus-Sialadenitis
Sialoadenitis ist durch eine Schädigung der Speicheldrüsen gekennzeichnet. Häufig sind die Ohrspeicheldrüsen betroffen. Im akuten Verlauf der Sialadenitis steigt die Temperatur, im Bereich der Drüsen treten stechende Schmerzen auf, der Speichelfluss nimmt ab und im Mund wird Trockenheit empfunden ( Xerostomie).
Sehr häufig ist die Cytomegalovirus-Sialoadenitis durch einen chronischen Verlauf gekennzeichnet. In diesem Fall gibt es periodische Schmerzen, leichte Schwellungen in der Ohrspeicheldrüse. Das Hauptsymptom ist weiterhin der verminderte Speichelfluss.
Nierenschäden
Die Nieren sind bei Menschen mit einer aktiven Form der Cytomegalovirus-Infektion sehr häufig. In diesem Fall findet sich eine entzündliche Infiltration in den Tubuli der Niere, in ihrer Kapsel und in den Glomeruli. Neben den Nieren können auch die Harnleiter und die Blase betroffen sein. Die Krankheit schreitet mit der schnellen Entwicklung von Nierenversagen fort. Im Urin erscheint ein Sediment, das aus Epithel- und Cytomegalovirus-Zellen besteht. Manchmal gibt es Hämaturie ( Blut im Urin).
Schädigung der Organe des Fortpflanzungssystems
Bei Frauen tritt die Infektion sehr häufig in Form von Zervizitis, Endometritis und Salpingitis auf. Sie verlaufen in der Regel chronisch mit periodischen Exazerbationen. Eine Frau kann über wiederkehrende leichte Schmerzen im Unterbauch, Schmerzen beim Wasserlassen oder Schmerzen beim Geschlechtsverkehr klagen. Manchmal kann es zu Störungen beim Wasserlassen kommen.
Cytomegalovirus-Infektion bei Frauen mit AIDS
Es wird angenommen, dass 9 von 10 AIDS-Patienten an einer aktiven Form der Cytomegalovirus-Infektion leiden. In den meisten Fällen ist eine Cytomegalovirus-Infektion die Todesursache der Patienten. Studien haben gezeigt, dass das Cytomegalovirus reaktiviert wird, wenn die Anzahl der CD-4-Lymphozyten weniger als 50 pro Milliliter beträgt. Am häufigsten entwickeln sich Lungenentzündung und Enzephalitis.Patienten mit AIDS entwickeln eine bilaterale Lungenentzündung mit diffusen Läsionen des Lungengewebes. Die Lungenentzündung ist meistens verlängert, mit schmerzhaftem Husten und Kurzatmigkeit. Eine Lungenentzündung ist eine der häufigsten Todesursachen bei einer HIV-Infektion.
Außerdem entwickeln AIDS-Patienten eine Cytomegalovirus-Enzephalitis. Enzephalitis mit Enzephalopathie entwickelt schnell Demenz ( Demenz), was sich in einer Abnahme des Gedächtnisses, der Aufmerksamkeit und der Intelligenz manifestiert. Eine Form der Cytomegalovirus-Enzephalitis ist die Ventrikuloenzephalitis, die die Ventrikel des Gehirns und die Hirnnerven betrifft. Die Patienten klagen über Schläfrigkeit, starke Schwäche, Sehstörungen.
Verlust nervöses System bei einer Cytomegalovirus-Infektion wird sie manchmal von einer Polyradikulopathie begleitet. In diesem Fall sind die Nervenwurzeln wiederholt betroffen, was mit Schwäche und Schmerzen in den Beinen einhergeht. Cytomegalovirus-Retinitis bei Frauen mit einer HIV-Infektion führt häufig zu einem vollständigen Verlust des Sehvermögens.
Eine Cytomegalovirus-Infektion bei AIDS ist durch multiple Läsionen innerer Organe gekennzeichnet. In den letzten Stadien der Krankheit wird ein multiples Organversagen mit Schäden an Herz, Blutgefäßen, Leber und Augen festgestellt.
Pathologien, die Cytomegalovirus bei Frauen mit Immunschwäche verursachen, sind:
- Nierenschäden- akute und chronische Nephritis ( Nierenentzündung), Nekroseherde an den Nebennieren;
- Leber erkrankung Hepatitis, sklerosierende Cholangitis ( Entzündung und Verengung der intrahepatischen und extrahepatischen Gallengänge), Gelbsucht ( eine Krankheit, bei der Haut und Schleimhäute gelb werden), Leberversagen;
- Erkrankungen der Bauchspeicheldrüse- Bauchspeicheldrüsenentzündung ( Entzündung der Bauchspeicheldrüse);
- Erkrankungen des Magen-Darm-Traktes- Gastroenterokolitis ( Gelenkentzündung des Dünndarms, Dickdarms und Magens), Ösophagitis ( Schädigung der Speiseröhrenschleimhaut), Enterokolitis ( entzündliche Prozesse im Dünn- und Dickdarm), Kolitis ( Entzündung des Dickdarms);
- Lungenerkrankung- Lungenentzündung ( Lungenentzündung);
- Augenkrankheiten- Netzhautentzündung ( Netzhauterkrankung), Retinopathie ( Verlust Augapfel nicht entzündlicher Natur). Augenprobleme treten bei 70 Prozent der Patienten mit einer HIV-Infektion auf. Etwa ein Fünftel der Patienten verliert ihr Augenlicht;
- Rückenmarks- und Hirnschäden- Meningoenzephalitis ( Entzündung der Membranen und Substanzen des Gehirns), Enzephalitis ( Gehirnschaden), Myelitis ( Entzündung des Rückenmarks), Polyradikulopathie ( Schädigung der Nervenwurzeln des Rückenmarks), Polyneuropathie untere Extremitäten (Störungen im peripheren Nervensystem), Infarkt der Großhirnrinde;
- Erkrankungen des Urogenitalsystems- Gebärmutterhalskrebs, Läsionen der Eierstöcke, Eileiter, Endometrium.
Symptome einer Cytomegalovirus-Infektion bei Kindern
 Bei Kindern gibt es zwei Formen der Cytomegalovirus-Infektion - angeboren und erworben.
Bei Kindern gibt es zwei Formen der Cytomegalovirus-Infektion - angeboren und erworben. Angeborene Cytomegalovirus-Infektion bei Kindern
Fast immer erfolgt die Infektion von Kindern mit dem Cytomegalovirus in utero. Über die Plazenta gelangt das Virus aus dem Blut der Mutter in den Körper des Kindes. Gleichzeitig kann die Mutter an einer primären Cytomegalovirus-Infektion leiden oder eine chronische reaktivieren.Das Cytomegalovirus gehört zur Gruppe der TORCH-Infektionen, die zu schweren Fehlbildungen führen. Wenn ein Virus in das Blut eines Kindes gelangt, entwickelt sich nicht immer eine angeborene Infektion. Laut verschiedenen Quellen entwickeln sich 5 bis 10 Prozent der Kinder, deren Blut in das Virus gelangt ist Aktive Form Infektionen. In der Regel handelt es sich dabei um die Kinder jener Mütter, die während der Schwangerschaft eine primäre Cytomegalovirus-Infektion erlitten haben.
Bei der Reaktivierung einer chronischen Infektion während der Schwangerschaft überschreitet der Grad der intrauterinen Infektion 1-2 Prozent nicht. In Zukunft haben 20 Prozent dieser Kinder schwere Pathologien.
Klinische Manifestationen einer angeborenen Cytomegalovirus-Infektion sind:
- Fehlbildungen des Nervensystems - Mikrozephalie, Hydrozephalus, Meningitis; Meningoenzephalitis;
- Dandy-Walker-Syndrom;
- Herzfehler - Karditis, Myokarditis, Kardiomegalie, Klappenfehlbildungen;
- Hörverlust - angeborene Taubheit;
- Schädigung des Sehapparates - Katarakte, Retinitis, Chorioretinitis, Keratokonjunktivitis;
- Anomalien in der Zahnentwicklung.
Im Blut solcher Kinder gibt es einen Anstieg der Leberenzyme, Bilirubin, die Anzahl der Blutplättchen sinkt stark ( Thrombozytopenie). Die Sterblichkeit in dieser Zeit ist sehr hoch. Überlebende Kinder leiden anschließend unter geistiger Behinderung und Sprachstörungen. Die meisten Kinder mit angeborener Cytomegalovirus-Infektion leiden an Taubheit, und Blindheit ist seltener.
Aufgrund einer Schädigung des Nervensystems entwickeln sich Lähmungen, Epilepsie und das intrakranielle Hypertonie-Syndrom. In der Folge bleiben solche Kinder nicht nur geistig, sondern auch innerlich zurück körperliche Entwicklung.
Eine separate Variante der angeborenen Cytomegalovirus-Infektion ist das Dandy-Walker-Syndrom. Bei diesem Syndrom werden verschiedene Anomalien des Kleinhirns und eine Erweiterung der Ventrikel beobachtet. Die Sterblichkeit liegt in diesem Fall zwischen 30 und 50 Prozent.
Die Häufigkeit der Symptome bei intrauteriner CMV-Infektion bei Kindern ist wie folgt:
- Hautausschlag - von 60 bis 80 Prozent;
- Blutungen in Haut und Schleimhäuten - 76 Prozent;
- Gelbsucht, 67 Prozent;
- Vergrößerung der Leber und Milz - 60 Prozent;
- Verringerung der Größe des Schädels und des Gehirns - 53 Prozent;
- Störungen des Verdauungssystems - 50 Prozent;
- Frühgeburtlichkeit - 34 Prozent;
- Hepatitis, 20 Prozent;
- Entzündung des Gehirns - 15 Prozent;
- Entzündung der Blutgefäße und der Netzhaut - 12 Prozent.
Erworbene Cytomegalovirus-Infektion bei Kindern
Erworbene Cytomegalovirus-Infektion ist eine Infektion, mit der sich ein Kind nach der Geburt infiziert. Eine Infektion mit dem Cytomegalovirus kann sowohl intranatal als auch postnatal erfolgen. Eine intranatale Infektion tritt während der Geburt selbst auf. Eine Infektion mit Cytomegalovirus erfolgt auf diese Weise während der Passage des Kindes durch den Genitaltrakt. Postnatal ( nach der Geburt)-Infektion kann durch das Stillen oder durch Haushaltskontakt von anderen Familienmitgliedern erfolgen.Die Art der Folgen einer erworbenen Cytomegalovirus-Infektion hängt vom Alter des Kindes und dem Zustand seines Immunsystems ab. Die häufigste Folge des Virus sind akute Infektionen der Atemwege ( ORZ), die von einer Entzündung der Bronchien, des Rachens und des Kehlkopfes begleitet werden. Oft gibt es eine Läsion der Speicheldrüsen, meistens in den Parotiszonen. Eine charakteristische Komplikation einer erworbenen Infektion sind entzündliche Prozesse in Bindegewebe im Bereich der Lungenbläschen. Eine weitere Manifestation einer Cytomegalovirus-Infektion ist Hepatitis, die in einer subakuten oder chronischen Form auftritt. Eine seltene Komplikation des Virus ist eine solche Schädigung des zentralen Nervensystems wie Enzephalitis ( Entzündung des Gehirns).
Symptome einer erworbenen Cytomegalovirus-Infektion sind:
- Kinder unter 1 Jahr- Verzögerung in der körperlichen Entwicklung mit eingeschränkter motorischer Aktivität und häufigen Krämpfen. Es können Läsionen des Magen-Darm-Trakts, Sehstörungen, Blutungen auftreten;
- Kinder von 1 bis 2 Jahren- Am häufigsten manifestiert sich die Krankheit durch Mononukleose ( Virusinfektion), deren Folgen eine Zunahme der Lymphknoten, Schwellung der Rachenschleimhaut, Leberschäden, Veränderungen der Blutzusammensetzung sind;
- Kinder von 2 bis 5 Jahren- Das Immunsystem ist in diesem Alter nicht in der Lage, angemessen auf das Virus zu reagieren. Die Krankheit verursacht Komplikationen wie Kurzatmigkeit, Zyanose ( bläuliche Verfärbung der Haut), Lungenentzündung.
Erworbene Cytomegalovirus-Infektionen bei Kindern können auch durch Bluttransfusionen oder Organtransplantationen verursacht werden. In diesem Fall erfolgt das Eindringen des Virus in den Körper mit gespendetem Blut oder Organen. Eine solche Infektion verläuft normalerweise nach der Art des Mononukleose-Syndroms. Gleichzeitig steigt die Temperatur, Nasenausfluss und Halsschmerzen treten auf. Gleichzeitig werden bei Kindern die Lymphknoten vergrößert. Die Hauptmanifestation einer Zytomegalovirus-Infektion nach einer Transfusion ist Hepatitis.
In 20 Prozent der Fälle kommt es nach einer Organtransplantation zu einer Cytomegalovirus-Pneumonie. Nach einer Nieren- oder Herztransplantation verursacht das Virus Hepatitis, Retinitis und Colitis.
Bei Kindern mit Immunschwäche ( zum Beispiel bei Patienten mit bösartigen Erkrankungen) Cytomegalovirus-Infektion ist sehr schwierig. Wie bei Erwachsenen führt es zu verlängerter Lungenentzündung, fulminanter Hepatitis und Sehstörungen. Die Reaktivierung des Virus beginnt mit einem Temperaturanstieg und Schüttelfrost. Oft entwickeln Kinder einen hämorrhagischen Ausschlag, der den ganzen Körper betrifft. An dem pathologischen Prozess sind innere Organe wie Leber, Lunge und Zentralnervensystem beteiligt.
Symptome einer Cytomegalovirus-Infektion bei Frauen während der Schwangerschaft
 Schwangere Frauen sind am anfälligsten für die schädlichen Wirkungen des Cytomegalovirus, da das Immunsystem während der Schwangerschaft erheblich geschwächt ist. Sowohl das Risiko einer Primärinfektion als auch die Exazerbation des Virus steigen, wenn es sich bereits im Körper des Patienten befindet. Komplikationen können sich sowohl bei der Frau als auch beim Fötus entwickeln.
Schwangere Frauen sind am anfälligsten für die schädlichen Wirkungen des Cytomegalovirus, da das Immunsystem während der Schwangerschaft erheblich geschwächt ist. Sowohl das Risiko einer Primärinfektion als auch die Exazerbation des Virus steigen, wenn es sich bereits im Körper des Patienten befindet. Komplikationen können sich sowohl bei der Frau als auch beim Fötus entwickeln. Während der Erstinfektion mit dem Virus oder seiner Reaktivierung können bei Schwangeren eine Reihe von Symptomen auftreten, die sich einzeln oder in Kombination manifestieren können. Bei einigen Frauen wird ein erhöhter Uterustonus diagnostiziert, der nicht auf die Therapie anspricht.
Manifestationen einer CMV-Infektion bei schwangeren Frauen sind:
- Polyhydramnion;
- vorzeitiges Altern oder Plazentalösung;
- unsachgemäße Befestigung der Plazenta;
- großer Blutverlust während der Geburt;
- spontane Fehlgeburten.
Entzündungsprozesse im Urogenitalsystem bei Schwangeren mit CMV sind:
- Endometritis (entzündliche Prozesse in der Gebärmutter) - Bauchschmerzen ( unterer Teil). In einigen Fällen können Schmerzen in den unteren Rücken oder das Kreuzbein ausstrahlen. Außerdem klagen die Patienten über einen schlechten allgemeinen Gesundheitszustand, Appetitlosigkeit, Kopfschmerzen;
- Zervizitis (Schädigung des Gebärmutterhalses) - Beschwerden während der Intimität, Juckreiz in den Genitalien, schmerzende Schmerzen im Damm und Unterbauch;
- Vaginitis (Entzündung der Vagina) - Reizung der Geschlechtsorgane, Erhöhung der Körpertemperatur, leichte Schmerzen beim Geschlechtsverkehr schmerzende Schmerzen im Unterbauch, Rötung und Schwellung der äußeren Geschlechtsorgane, häufiges Wasserlassen;
- Oophoritis (Entzündung der Eierstöcke) - Schmerzen im Becken und im Unterbauch, Schmierblutungen nach dem Geschlechtsverkehr, Unwohlsein im Unterbauch, Schmerzen in der Nähe eines Mannes;
- Gebärmutterhalskrebs Erosion- das Auftreten von Blut im Ausfluss nach Intimität, reichlich vaginaler Ausfluss, manchmal kann es beim Geschlechtsverkehr zu Schmerzen kommen, die nicht sehr ausgeprägt sind.
Die Wirkung von CMV auf den Körper einer schwangeren Frau
Cytomegalovirus ist eine Virusinfektion, die am häufigsten schwangere Frauen betrifft.Die Folgen des Virus sind:
- Entzündung der Speicheldrüsen, Mandeln;
- Lungenentzündung, Rippenfellentzündung;
- Myokarditis.
Bei stark geschwächter Immunität kann das Virus eine generalisierte Form annehmen und den gesamten Körper des Patienten betreffen.
Komplikationen einer generalisierten Infektion bei Frauen während der Schwangerschaft sind:
- entzündliche Prozesse in den Nieren, Leber, Bauchspeicheldrüse, Nebennieren;
- Funktionsstörung des Verdauungssystems;
- Sichtprobleme;
- Lungenfunktionsstörung.
Diagnose einer Cytomegalovirus-Infektion
 Die Diagnose einer Cytomegalovirus-Infektion hängt von der Form der Pathologie ab. Daher ist es bei der angeborenen und akuten Form dieser Krankheit ratsam, das Virus in Zellkultur zu isolieren. Bei chronischen, periodisch verschlimmerten Formen wird eine serologische Diagnostik durchgeführt, die darauf abzielt, Antikörper gegen das Virus im Körper nachzuweisen. Es wird auch eine zytologische Untersuchung verschiedener Organe durchgeführt. Gleichzeitig finden sich in ihnen für eine Cytomegalovirus-Infektion typische Veränderungen.
Die Diagnose einer Cytomegalovirus-Infektion hängt von der Form der Pathologie ab. Daher ist es bei der angeborenen und akuten Form dieser Krankheit ratsam, das Virus in Zellkultur zu isolieren. Bei chronischen, periodisch verschlimmerten Formen wird eine serologische Diagnostik durchgeführt, die darauf abzielt, Antikörper gegen das Virus im Körper nachzuweisen. Es wird auch eine zytologische Untersuchung verschiedener Organe durchgeführt. Gleichzeitig finden sich in ihnen für eine Cytomegalovirus-Infektion typische Veränderungen. Diagnostische Methoden für eine Cytomegalovirus-Infektion sind:
- Isolierung des Virus durch Kultivierung in Zellkultur;
- Polymerase Kettenreaktion ( PCR);
- Linked Immunosorbent Assay ( ELISA);
- Zytologische Methode.
Virusisolierung
Die Virusisolierung ist die genaueste und zuverlässigste Methode zur Diagnose einer Cytomegalovirus-Infektion. Blut und andere Körperflüssigkeiten können verwendet werden, um das Virus zu isolieren. Der Nachweis eines Virus im Speichel ist keine Bestätigung einer akuten Infektion, da das Virus nach längerer Genesung ausgeschieden wird. Daher wird am häufigsten das Blut des Patienten untersucht.Die Virusisolierung erfolgt in Zellkultur. Am häufigsten werden Einschichtkulturen menschlicher Fibroblasten verwendet. Das untersuchte biologische Material wird zunächst zentrifugiert, um das Virus selbst zu isolieren. Als nächstes wird das Virus auf Zellkulturen aufgetragen und in einen Thermostat gestellt. Es gibt sozusagen eine Infektion von Zellen mit diesem Virus. Kulturen werden für 12 bis 24 Stunden inkubiert. In der Regel werden mehrere Zellkulturen infiziert und gleichzeitig inkubiert. Weiterhin werden die erhaltenen Kulturen unter Verwendung verschiedener Verfahren identifiziert. Am häufigsten werden Kulturen mit fluoreszierenden Antikörpern gefärbt und unter einem Mikroskop untersucht.
Die Nachteile dieser Methode ist der erhebliche Zeitaufwand für die Kultivierung des Virus. Die Dauer dieser Methode beträgt 2 bis 3 Wochen. Gleichzeitig wird frisches Material benötigt, um das Virus zu isolieren.
PCR
Ein wesentlicher Vorteil hat ein solches diagnostisches Verfahren wie eine Polymerase-Kettenreaktion ( PCR). Mit dieser Methode wird die DNA des Virus im Untersuchungsmaterial bestimmt. Der Vorteil dieser Methode besteht darin, dass für die DNA-Bestimmung eine geringe Anwesenheit des Virus im Körper notwendig ist. Es braucht nur ein DNA-Stück, um das Virus zu identifizieren. Somit werden sowohl akute als auch chronische Formen der Krankheit definiert. Der Nachteil dieser Methode sind die relativ hohen Kosten.biologisches Material
Für die PCR werden beliebige biologische Flüssigkeiten entnommen ( Blut, Speichel, Urin, Liquor cerebrospinalis), Abstriche aus Harnröhre und Vagina, Kot, Abstriche von Schleimhäuten.
PCR durchführen
Die Essenz der Analyse besteht darin, die DNA des Virus zu isolieren. Im Untersuchungsmaterial wird zunächst ein Fragment eines DNA-Strangs gefunden. Außerdem wird dieses Fragment mit Hilfe spezieller Enzyme viele Male geklont, um eine große Anzahl von DNA-Kopien zu erhalten. Die resultierenden Kopien werden identifiziert, dh es wird festgestellt, zu welchem Virus sie gehören. All diese Reaktionen finden in einem speziellen Apparat namens Verstärker statt. Die Genauigkeit dieser Methode liegt bei 95 - 99 Prozent. Das Verfahren wird schnell genug durchgeführt, was eine breite Anwendung ermöglicht. Am häufigsten wird es zur Diagnose von latenten Urogenitalinfektionen, Cytomegalovirus-Enzephalitis und zum Screening von TORCH-Infektionen eingesetzt.
ELISA
Linked Immunosorbent Assay ( ELISA) ist eine serologische Testmethode. Damit werden Antikörper gegen Cytomegalovirus bestimmt. Das Verfahren wird in der komplexen Diagnostik mit anderen Verfahren eingesetzt. Es wird angenommen, dass die Bestimmung eines hohen Antikörpertiters zusammen mit dem Nachweis des Virus selbst die genaueste Diagnose einer Cytomegalovirus-Infektion ist.biologisches Material
Das Blut des Patienten wird zum Nachweis von Antikörpern verwendet.
ELISA
Die Essenz der Methode besteht darin, Antikörper gegen Cytomegalovirus sowohl in der akuten als auch in der chronischen Phase nachzuweisen. Im ersten Fall werden Anti-CMV-IgM nachgewiesen, im zweiten Anti-CMV-IgG. Die Analyse basiert auf der Antigen-Antikörper-Reaktion. Die Essenz dieser Reaktion besteht darin, dass Antikörper ( vom Körper als Reaktion auf einen Virus produziert) binden spezifisch an Antigene ( Proteine auf der Oberfläche des Virus).
Die Analyse erfolgt in speziellen Tabletten mit Vertiefungen. Biologisches Material und Antigen werden in jede Vertiefung gegeben. Als nächstes wird die Tablette für eine bestimmte Zeit in einen Thermostat gestellt, während der die Bildung von Antigen-Antikörper-Komplexen stattfindet. Danach wird mit einer speziellen Substanz gewaschen, wonach die gebildeten Komplexe am Boden der Vertiefungen verbleiben und die nicht gebundenen Antikörper abgewaschen werden. Danach werden weitere mit einer fluoreszierenden Substanz behandelte Antikörper in die Vertiefungen gegeben. Es entsteht also ein „Sandwich“ aus zwei Antikörpern und einem Antigen in der Mitte, die mit einer speziellen Mischung verarbeitet werden. Wenn diese Mischung hinzugefügt wird, ändert sich die Farbe der Lösung in den Vertiefungen. Die Farbintensität ist direkt proportional zur Antikörpermenge im Testmaterial. Die Intensität wird wiederum mit einem Gerät wie einem Photometer bestimmt.
Zytologische Diagnostik
Eine zytologische Untersuchung besteht darin, Gewebestücke auf das Vorhandensein spezifischer Veränderungen des Zytomegalievirus zu untersuchen. So finden sich unter dem Mikroskop in den untersuchten Geweben Riesenzellen mit intranukleären Einschlüssen, die wie die Augen einer Eule aussehen. Solche Zellen sind ausschließlich für Cytomegalovirus charakteristisch, daher ist ihr Nachweis eine absolute Bestätigung der Diagnose. Das Verfahren wird verwendet, um Cytomegalovirus-Hepatitis, Nephritis zu diagnostizieren.Behandlung einer Cytomegalovirus-Infektion
 Ein wichtiges Bindeglied bei der Aktivierung und Ausbreitung einer Cytomegalovirus-Infektion im Körper des Patienten ist eine Abnahme der Immunabwehr. Zur Stimulierung und Aufrechterhaltung des Immunsystems hohes Level Bei einer Virusinfektion werden Immunpräparate - Interferone verwendet. Derzeit natürliche und rekombinante ( künstlich geschaffen) Interferone.
Ein wichtiges Bindeglied bei der Aktivierung und Ausbreitung einer Cytomegalovirus-Infektion im Körper des Patienten ist eine Abnahme der Immunabwehr. Zur Stimulierung und Aufrechterhaltung des Immunsystems hohes Level Bei einer Virusinfektion werden Immunpräparate - Interferone verwendet. Derzeit natürliche und rekombinante ( künstlich geschaffen) Interferone.
Mechanismus der therapeutischen Wirkung
Interferonpräparate haben bei der Behandlung einer Cytomegalovirus-Infektion keine direkte antivirale Wirkung. Sie sind am Kampf gegen das Virus beteiligt und wirken sich auf die betroffenen Körperzellen und das Immunsystem insgesamt aus. Interferone haben eine Reihe von Wirkungen bei der Bekämpfung von Infektionen.Aktivierung zellulärer Abwehrgene
Interferone aktivieren eine Reihe von Genen, die an der zellulären Abwehr des Virus beteiligt sind. Zellen werden weniger anfällig für das Eindringen von Viruspartikeln.
Aktivierung des p53-Proteins
Das p53-Protein ist ein spezielles Protein, das die Prozesse der Zellreparatur startet, wenn sie beschädigt sind. Wenn die Zellschädigung irreversibel ist, löst das p53-Protein den Prozess der Apoptose aus ( programmierter Tod) Zellen. In gesunden Zellen liegt dieses Protein in einer inaktiven Form vor. Interferone haben die Fähigkeit, das Protein p53 in Cytomegalovirus-infizierten Zellen zu aktivieren. Es bewertet den Zustand der infizierten Zelle und startet den Prozess der Apoptose. Infolgedessen stirbt die Zelle und das Virus hat keine Zeit, sich zu vermehren.
Stimulierung der Synthese spezieller Moleküle des Immunsystems
Interferone regen die Synthese spezieller Moleküle an, die dem Immunsystem helfen, Viruspartikel leichter und schneller zu erkennen. Diese Moleküle binden an Rezeptoren auf der Oberfläche des Cytomegalovirus. Killerzellen ( T-Lymphozyten und natürliche Killer) des Immunsystems finden diese Moleküle und greifen die Virionen an, an denen sie befestigt sind.
Stimulation von Zellen des Immunsystems
Interferone bewirken eine direkte Stimulierung bestimmter Zellen des Immunsystems. Zu diesen Zellen gehören Makrophagen und natürliche Killer. Unter dem Einfluss von Interferonen wandern sie zu den betroffenen Zellen, greifen sie an und zerstören sie zusammen mit dem intrazellulären Virus.
Bei der Behandlung einer Cytomegalovirus-Infektion werden verschiedene Medikamente auf Basis natürlicher Interferone eingesetzt.
Natürliche Interferone, die bei der Behandlung von Cytomegalovirus-Infektionen verwendet werden, sind:
- menschliches Leukozyten-Interferon;
- Leukinferon;
- Wellferon;
- Eisen.
Freisetzungsform und Methoden zur Verwendung einiger natürlicher Interferone bei Cytomegalovirus-Infektionen
| Name des Medikaments | Freigabe Formular | Art der Anwendung | Dauer der Therapie |
| Menschliches Leukozyten-Interferon | Trockenmix. | Destilliertes oder abgekochtes kaltes Wasser mit der Trockenmischung bis zur Markierung in die Ampulle geben. Schütteln, bis sich das Pulver vollständig aufgelöst hat. Die resultierende Flüssigkeit wird alle anderthalb bis zwei Stunden 5 Tropfen in die Nase geträufelt. | Zwei bis fünf Tage. |
| Leukinferon | Rektale Zäpfchen. | 1-2 Zäpfchen zweimal täglich für 10 Tage, dann wird die Dosis alle 10 Tage reduziert. | 2 - 3 Monate. |
| Wellferon | Injektion. | Es wird subkutan oder intramuskulär mit 500.000 - 1 Million IE ( Internationale Einheiten) pro Tag. | 10 bis 15 Tage. |
Der größte Nachteil natürlicher Präparate sind ihre hohen Kosten, weshalb sie seltener verwendet werden.
Derzeit gibt es eine große Anzahl rekombinanter Arzneimittel der Interferongruppe, die in der komplexen Therapie der Cytomegalovirus-Infektion eingesetzt werden.
Die Hauptvertreter rekombinanter Interferone sind die folgenden Medikamente:
- Viferon;
- Kipperon;
- Realdiron;
- referon;
- laferon.
Freisetzungsform und Anwendungsmethoden einiger rekombinanter Interferone bei Cytomegalovirus-Infektion
| Name des Medikaments | Freigabe Formular | Art der Anwendung | Dauer der Therapie |
| Viferon |
|
|
|
| Kipferon |
| Wenden Sie eine Kerze alle 12 Stunden täglich für 10 Tage an, dann jeden zweiten Tag für 20 Tage, dann nach 2 Tagen für weitere 20 bis 30 Tage. | Im Durchschnitt anderthalb bis zwei Monate. |
| realdiron |
| Es wird subkutan oder intramuskulär mit 1.000.000 IE pro Tag angewendet. | 10 bis 15 Tage. |
Bei der Behandlung einer Cytomegalovirus-Infektion wird eine korrekt ausgewählte komplexe Therapie mit notwendigen Dosen Drogen. Daher sollte eine Behandlung mit Interferonen nur auf Anweisung eines Spezialisten begonnen werden.
Bewertung der Behandlungsmethode
Die Beurteilung der Behandlung einer Cytomegalovirus-Infektion mit Interferonen basiert auf klinischen Anzeichen und Labordaten. Eine Abnahme der Schwere der klinischen Manifestationen bis zu ihrer vollständigen Abwesenheit zeigt die Wirksamkeit der Behandlung an. Die Bewertung der Therapie erfolgt auch auf der Grundlage von Labortests - dem Nachweis von Antikörpern gegen das Cytomegalovirus. Eine Abnahme des Immunglobulin-M-Spiegels oder dessen Abwesenheit zeigt den Übergang einer akuten Form einer Cytomegalovirus-Infektion in eine latente an.
Ist eine Behandlung bei einer asymptomatischen Cytomegalovirus-Infektion erforderlich?
Da eine latente Cytomegalovirus-Infektion bei guter Immunität ungefährlich ist, halten viele Experten eine Behandlung für nicht angebracht. Für die Unzweckmäßigkeit der Behandlung spricht auch die Tatsache, dass es keine spezifische Behandlung oder keinen Impfstoff gibt, der das Virus abtötet oder eine erneute Infektion verhindert. Daher besteht der Hauptpunkt bei der Behandlung einer asymptomatischen Cytomegalovirus-Infektion darin, die Immunität auf einem hohen Niveau zu halten.Dazu wird empfohlen, chronischen Infektionen vorzubeugen ( besonders urinausscheidend), die die Hauptursache für eine verminderte Immunität sind. Es wird auch empfohlen, Immunstimulanzien wie Echinacea Hexal, Derinat, Milife einzunehmen. Sie sollten nur nach Anweisung eines Arztes eingenommen werden.
Was sind die Folgen einer Cytomegalovirus-Infektion?
 Die Art der Folgen des Cytomegalovirus wird durch Faktoren wie das Alter des Patienten, den Infektionsweg und den Immunitätszustand beeinflusst. Je nach Schweregrad der Komplikationen können Patienten mit Cytomegalovirus-Infektion in mehrere Gruppen eingeteilt werden.
Die Art der Folgen des Cytomegalovirus wird durch Faktoren wie das Alter des Patienten, den Infektionsweg und den Immunitätszustand beeinflusst. Je nach Schweregrad der Komplikationen können Patienten mit Cytomegalovirus-Infektion in mehrere Gruppen eingeteilt werden. Die Folgen des Cytomegalovirus für Menschen mit normaler Immunität
Beim Eindringen in den menschlichen Körper dringt das Virus in die Zellen ein, was zu einem Entzündungsprozess und einer Verletzung der Funktionalität des betroffenen Organs führt. Außerdem wirkt die Infektion allgemein toxisch auf den Körper, stört Blutgerinnungsprozesse und hemmt die Funktion der Nebennierenrinde. Cytomegalovirus kann die Entwicklung sowohl systemischer Erkrankungen als auch Schäden an einzelnen Organen hervorrufen. In einigen Fällen kann CMV ( Cytomegalovirus);Folgen einer Cytomegalovirus-Infektion für den Fötus
Die Art der Komplikationen beim Fötus hängt davon ab, wann die Infektion mit dem Virus aufgetreten ist. Wenn die Infektion vor der Empfängnis stattfand, ist das Risiko schädlicher Folgen für den Embryo minimal, da im Körper der Frau Antikörper vorhanden sind, die ihn schützen. Die Wahrscheinlichkeit einer Infektion des Fötus beträgt nicht mehr als 2 Prozent.Die Möglichkeit, eine angeborene Cytomegalovirus-Infektion zu entwickeln, steigt, wenn sich eine Frau während der Schwangerschaft mit dem Virus infiziert. Das Risiko, die Krankheit auf den Fötus zu übertragen, liegt bei 30 bis 40 Prozent. Bei der Primärinfektion während der Geburt ist das Gestationsalter von großer Bedeutung.
Je nach Zeitpunkt der Infektion sind die Folgen einer Cytomegalovirus-Infektion für einen sich entwickelnden Fötus:
- Blastopathie(Missbildungen, die bei einer Infektion während des Zeitraums von 1 bis 15 Tagen der Schwangerschaft auftreten) - Tod des Embryos, sich nicht entwickelnde Schwangerschaft, spontane Abtreibung, verschiedene systemische Pathologien beim Fötus;
- Embryopathien(bei Ansteckung am 15. - 75. Trächtigkeitstag) - Pathologien lebenswichtig wichtige Systeme Organismus ( kardiovaskulär, verdauungsfördernd, respiratorisch, nervös). Einige dieser Missbildungen sind mit dem fötalen Leben nicht vereinbar;
- Fetopathie(mit Spätinfektion) - Die Infektion kann die Entwicklung von Gelbsucht, Leber-, Milz- und Lungenschäden hervorrufen.
Die Folgen einer Cytomegalovirus-Infektion für Kinder, die eine akute Form der Krankheit hatten
Am anfälligsten bei einer Cytomegalovirus-Infektion ist das zentrale Nervensystem, das Hirnschäden und eine Beeinträchtigung der motorischen und geistigen Aktivität verursacht. Daher entwickelt ein Drittel der infizierten Kinder eine Enzephalitis und eine Meningoenzephalitis. Die Manifestationen dieser Krankheiten sind nicht immer klar ausgedrückt.Die Folgen einer Infektion mit Cytomegalovirus bei Kindern sind:
- Gelbsucht ab den ersten Lebenstagen tritt es bei 50 - 80 Prozent der kranken Kinder auf;
- hämorrhagisches Syndrom wird bei 65 - 80 Prozent der Patienten registriert und äußert sich durch Blutungen in Haut, Schleimhäuten, Nebennieren. Blutungen aus der Nase oder Nabelwunde sind ebenfalls möglich;
- Hepatosplenomegalie ( Vergrößerung der Leber und Milz) bei 60-75 Prozent der Kinder diagnostiziert. Zusammen mit Gelbsucht und hämorrhagischem Syndrom ist diese Krankheit die häufigste Komplikation von CMV, die sich bei infizierten Kindern ab den ersten Lebenstagen entwickelt;
- interstitielle Pneumonie manifestiert durch Symptome von Atemwegserkrankungen;
- Nephritis ist eine Komplikation, die sich bei einem Drittel der kranken Kinder entwickelt;
- Gastroenterokolitis tritt in 30 Prozent der Fälle auf;
- Myokarditis ( Entzündung des Herzmuskels) bei 10 % der Patienten diagnostiziert.
Andere Komplikationen des Cytomegalovirus sind:
- Verzögerung in der psychomotorischen Entwicklung;
- Läsionen des Gastrointestinaltrakts;
- Pathologie des Sehorgans ( Chorioretinitis, Uveitis);
- Bluterkrankungen ( Anämie, Thrombozytopenie).
Die Cytomegalovirus-Infektion (CMVI oder Cytomegalie) ist eine chronische anthroponotische Erkrankung viralen Ursprungs, die durch eine Vielzahl von Formen des pathologischen Prozesses von einer latenten Infektion bis zu einer klinisch ausgeprägten generalisierten Erkrankung gekennzeichnet ist.
ICD-10-Codes
B25. Cytomegalovirus-Krankheit.
B27.1. Cytomegalovirus-Mononukleose.
P35.1. Angeborene Cytomegalovirus-Infektion.
B20.2. Durch HIV verursachte Krankheit mit Manifestationen einer Cytomegalovirus-Erkrankung.
Ätiologie (Ursachen) einer Cytomegalovirus-Infektion
In der Klassifizierung der Viren wird der CMVI-Erreger unter dem Artnamen Cytomegalovirus hominis der Familie Herpesviridae, Unterfamilie Betaherpesviridae, Gattung Cytomegalovirus zugeordnet.
CMV-Funktionen:
Großes DNA-Genom;
- geringe Zytopathogenität in Zellkultur;
- langsame Replikation;
- geringe Virulenz.
Das Virus wird bei einer Temperatur von 56 °C inaktiviert, lange bei Raumtemperatur gelagert und beim Einfrieren auf –20 °C schnell inaktiviert. CMV ist schwach empfindlich gegenüber der Wirkung von Interferon und nicht anfällig für Antibiotika. 3 Stämme des Virus wurden registriert: AD 169, Davis und Kerr.
Epidemiologie der Cytomegalovirus-Infektion
Zytomegalie ist eine weit verbreitete Infektion. Der Anteil seropositiver Personen an der erwachsenen Bevölkerung der Russischen Föderation beträgt 73-98%. Die Inzidenzrate von CMVI im Land im Jahr 2003 betrug 0,79 pro 100.000 Einwohner und bei Kindern unter 1 Jahr - 11,58; 1–2 Jahre - 1,01; 3–6 Jahre - 0,44 pro 100 000. In Moskau betrug die Inzidenzrate von CMVI im Jahr 2006 0,59 pro 100 000 Einwohner, bei Kindern unter 14 Jahren 3,24; und unter der erwachsenen Bevölkerung 0,24 pro 100.000 Menschen.
Quelle des Infektionserregers- Mensch. Eine Cytomegalovirus-Infektion ist durch einen Zustand der langfristigen latenten Übertragung des Virus mit seiner periodischen Freisetzung in die Umwelt gekennzeichnet. Das Virus kann in jeder biologischen Flüssigkeit sowie in Organen und Geweben gefunden werden, die für Transplantationen verwendet werden. Bei 20–30 % der gesunden Schwangeren ist das Cytomegalovirus im Speichel, 3–10 % im Urin, 5–20 % im Zervikalkanal oder im Vaginalsekret vorhanden. Das Virus findet sich in der Muttermilch von 20–60 % der seropositiven Mütter. Etwa 30 % der schwulen Männer und 15 % der Männer, die heiraten, haben das Virus in ihrem Sperma. Das Blut von etwa 1 % der Spender enthält CMV.
Infektionswege. Eine Infektion ist auf sexuellem, parenteralem, vertikalem Weg sowie durch Kontakthaushalt möglich, der durch den Aerosolmechanismus der Übertragung des Erregers durch Speichel bei engen Kontakten bereitgestellt wird.
Die Cytomegalovirus-Infektion ist eine klassische kongenitale Infektion mit einer Inzidenz von 0,3–3 % aller Neugeborenen. Das Risiko einer pränatalen Infektion des Fötus bei primärer CMVI bei Schwangeren beträgt 30-40 %. Bei einer Reaktivierung des Virus, die bei 2-20% der Mütter auftritt, ist das Infektionsrisiko des Kindes viel geringer (0,2-2% der Fälle). Eine intranatale Infektion eines Kindes in Gegenwart von CMV im Genitaltrakt bei schwangeren Frauen tritt in 50–57% der Fälle auf. Der Hauptinfektionsweg für ein Kind unter einem Jahr ist die Übertragung des Virus durch die Muttermilch.
Kinder seropositiver Mütter, Kinder die länger als einen Monat gestillt werden, infizieren sich in 40-76% der Fälle. Folglich infizieren sich bis zu 3 % aller Neugeborenen während der fötalen Entwicklung mit CMV, 4-5 % - intranatal; im ersten Lebensjahr beträgt die Zahl der infizierten Kinder 10–60 %. Der Kontakt-Haushalts-Übertragungsweg des Virus bei kleinen Kindern spielt eine bedeutende Rolle. Die Infektion mit dem Zytomegalievirus ist bei Kindern, die Vorschuleinrichtungen besuchen, signifikant höher (80 % der Fälle) als bei gleichaltrigen „Heim“-Schülern (20 %). Die Zahl der seropositiven Personen nimmt mit dem Alter zu. Etwa 40–80 % der Jugendlichen und 60–100 % der erwachsenen Bevölkerung haben IgG-Antikörper gegen CMV. Die Infektion eines Erwachsenen mit CMV erfolgt am wahrscheinlichsten durch sexuellen Kontakt, auch während Bluttransfusionen und parenteralen Manipulationen. Die Transfusion von Vollblut und seinen leukozytenhaltigen Bestandteilen führt zur Übertragung des Virus mit einer Häufigkeit von 0,14-10 pro 100 Dosen.
Bei wiederholten Bluttransfusionen von seropositiven Spendern auf Neugeborene, insbesondere Frühgeborene, besteht ein hohes Risiko, eine schwere Erkrankung zu entwickeln.
Die klinisch exprimierte CMVI ist eine der häufigsten und schwerwiegendsten infektiösen Komplikationen bei Organtransplantationen. Etwa 75 % der Empfänger haben in den ersten 3 Monaten nach der Transplantation Laborzeichen einer aktiven Cytomegalovirus-Infektion.
Bei 5–25 % der Patienten, die sich einer Nieren- oder Lebertransplantation unterzogen haben, 20–50 % der Patienten nach allogener Knochenmarktransplantation, 55–75 % der Lungen- und / oder Herzempfänger entwickeln eine CMV-Erkrankung der Ätiologie, eine Cytomegalovirus-Infektion erhöht das Risiko signifikant der Transplantatabstoßung. Die manifeste Infektion nimmt einen der ersten Plätze in der Struktur opportunistischer Erkrankungen bei HIV-infizierten Patienten ein und wird bei 20–40 % der AIDS-Patienten beobachtet, die keine HAART erhalten, und bei 3–7 % der HIV-infizierten Patienten, wenn dies der Fall ist vorgeschrieben. Die Entwicklung einer schweren Cytomegalovirus-Infektion wurde bei onkohämatologischen Patienten, Patienten mit Pneumocystis-Pneumonie, Tuberkulose, Strahlenkrankheit, Verbrennungsverletzungen, bei Personen unter Langzeit-Kortikosteroidtherapie, die sich verschiedenen Behandlungen unterzogen haben, beschrieben stressige Situationen. Cytomegalovirus kann die Ursache von Posttransfusion und chronischer Hepatitis, verschiedenen gynäkologischen Pathologien sein. Die Rolle des Cytomegalovirus als einer der Cofaktoren bei der Entwicklung von systemischer Vaskulitis, Atherosklerose bei chronisch disseminierten Lungenerkrankungen, Kryoglobulinämie, Tumorprozessen, Atherosklerose, Zerebralparese, Epilepsie, Guillain-Barré-Syndrom, chronischem Müdigkeitssyndrom wird angenommen. Saisonalität, Ausbrüche und Epidemien sind nicht charakteristisch für die mit einer Cytomegalovirus-Infektion assoziierte Krankheit.
Die Pathogenese der Cytomegalovirus-Infektion
Entscheidende Voraussetzung für die Entstehung einer pränatalen CMVI ist die maternale Virämie. Das Vorhandensein des Virus im Blut führt zu einer Infektion der Plazenta, ihrer Schädigung und Infektion des Fötus mit möglichen Folgen in Form von Fehlbildungen und intrauteriner Wachstumsverzögerung, einem pathologischen Prozess mit Schädigung innerer Organe, vor allem des Zentralnervensystems. Bei Vorliegen eines Virus im Zervikalkanal einer Schwangeren ist ein aufsteigender (transzervikaler) Infektionsweg des Fötus möglich, ohne dass der Erreger in die Blutbahn gelangt. Die Reaktivierung des Cytomegalovirus im Endometrium ist einer der Faktoren bei frühen Aborten. Eine intranatale Infektion mit dem Virus tritt auf, wenn der Fötus aufgrund einer Aspiration, die Cytomegalovirus enthält, den infizierten Geburtskanal passiert Fruchtwasser und / oder Geheimnisse des Geburtskanals oder durch geschädigte Haut und können auch zur Entwicklung einer klinisch signifikanten Erkrankung führen. Bei der postnatalen Cytomegalovirus-Infektion sind die Schleimhäute des Oropharynx, der Atemwege, des Verdauungs- und des Genitaltraktes das Eintrittstor für den Erreger. Nachdem das Virus die Eingangspforte und seine lokale Vermehrung überwunden hat, setzt eine kurzzeitige Virämie ein, Monozyten und Lymphozyten tragen das Virus zu verschiedenen Organen. Trotz der zellulären und humoralen Reaktion induziert das Cytomegalovirus eine chronische latente Infektion.
Das Reservoir viraler Partikel sind Monozyten, Lymphozyten, Endothel- und Epithelzellen. Zukünftig ist bei leichter Immunsuppression eine „lokale“ Aktivierung von CMVI mit Freisetzung des Virus aus Nasopharynx oder Urogenitaltrakt möglich. Bei tiefen immunologischen Erkrankungen mit erblicher Prädisposition für diese Pathologie kommt es zur Wiederaufnahme der aktiven Virusreplikation, Virämie, Ausbreitung des Erregers und Entwicklung einer klinisch ausgeprägten Erkrankung. Die Aktivität der Virusreplikation, das Risiko der Manifestation einer Cytomegalovirus-Infektion und die Schwere ihres Verlaufs werden weitgehend durch die Tiefe der Immunsuppression bestimmt, hauptsächlich durch das Ausmaß der Verringerung der Anzahl der CD4-Lymphozyten im Blut.
Eine Vielzahl von Organläsionen sind mit CMVI assoziiert: Lunge, Verdauungstrakt, Nebennieren, Nieren, Gehirn und Rückenmark, Netzhaut. Bei immunsupprimierten Patienten mit CMVI ist die pulmonale Fibroatelektase postmortal, manchmal mit Zysten und eingekapselten Abszessen; erosiv und ulzerativ mit schwerer Fibrose der submukösen Schicht der Speiseröhre, des Dickdarms, seltener des Magens und des Dünndarms; massive, oft beidseitige Nebennierennekrose; Enzephaloventriculitis, nekrotische Läsion des Rückenmarks, Netzhaut mit der Entwicklung einer nekrotischen Retinitis. Die Spezifität des morphologischen Bildes bei CMVI wird bestimmt durch große Cytomegalozellen, lymphohistiozytäre Infiltrate sowie produktiv-infiltrative Panvaskulitis mit zytomegaler Transformation von Zellen aller Wände kleiner Arterien und Venen mit dem Ausgang einer Sklerose. Eine solche Gefäßschädigung dient als Grundlage für Thrombose, führt zu chronischer Ischämie, gegen die sich destruktive Veränderungen, segmentale Nekrosen und Geschwüre und schwere Fibrose entwickeln. Eine weit verbreitete Fibrose ist ein charakteristisches Merkmal von CMV-Organschäden. Bei den meisten Patienten ist der mit CMV verbundene pathologische Prozess generalisiert.
Klinisches Bild (Symptome) einer Cytomegalovirus-Infektion
Die Inkubationszeit für eine CMV-Infektion beträgt 2-12 Wochen.
Einstufung
Es gibt keine allgemein akzeptierte Klassifikation von CMVI. Die folgende Klassifikation der Krankheit ist angemessen.
Angeborene CMVI:
- asymptomatische Form;
- manifeste Form (Cytomegalovirus-Erkrankung).
Erworbene CMVI.
- Akute CMVI.
- asymptomatische Form;
- Cytomegalovirus-Mononukleose;
- Latente CMVI.
- Aktives CMVI (Reaktivierung, Reinfektion):
- asymptomatische Form;
– CMV-assoziiertes Syndrom;
- manifeste Form (Cytomegalovirus-Erkrankung).
Die wichtigsten Symptome einer Cytomegalovirus-Infektion
Bei angeborener CMVI hängt die Art der fetalen Läsion von der Dauer der Infektion ab. Akute Zytomegalie bei der Mutter in den ersten 20 Schwangerschaftswochen kann zu schweren fetalen Pathologien führen, die zu spontanen Fehlgeburten, intrauterinem Fruchttod, Totgeburt und Fehlbildungen führen, die in den meisten Fällen mit dem Leben nicht vereinbar sind. Bei einer Infektion mit dem Cytomegalovirus in der späten Schwangerschaft ist die Prognose für das Leben und die normale Entwicklung des Kindes günstiger.
Eine klinisch ausgeprägte Pathologie in den ersten Lebenswochen tritt bei 10–15 % der mit CMV infizierten Neugeborenen auf. Die manifeste Form der angeborenen Cytomegalovirus-Infektion ist gekennzeichnet durch Hepatosplenomegalie, anhaltenden Ikterus, hämorrhagischen oder makulopapulösen Ausschlag, schwere Thrombozytopenie, erhöhte ALT-Aktivität und den Spiegel von direktem Bilirubin im Blut sowie erhöhte Hämolyse von Erythrozyten.
Kinder werden oft vorzeitig geboren, mit einem Mangel an Körpergewicht, Anzeichen einer intrauterinen Hypoxie. Die Pathologie des Zentralnervensystems in Form von Mikrozephalie ist charakteristisch, seltener Hydrozephalus, Enzephaloventrikulitis, Krampfsyndrom, Hörverlust. Cytomegalovirus-Infektion ist die Hauptursache für angeborene Taubheit. Mögliche Enterokolitis, Pankreasfibrose, interstitielle Nephritis, chronische Sialadenitis mit Fibrose der Speicheldrüsen, interstitielle Pneumonie, Optikusatrophie, angeborene Katarakte sowie generalisierte Organschäden mit Entwicklung von Schock, DIC und Tod des Kindes. Das Sterberisiko in den ersten 6 Lebenswochen von Neugeborenen mit symptomatischer CMVI beträgt 12 %. Etwa 90 % der überlebenden Kinder, die an offenkundiger CMVI leiden, haben langfristige Folgen der Krankheit in Form einer Abnahme der geistigen Entwicklung, sensorineuraler Taubheit oder beidseitigem Hörverlust, beeinträchtigter Sprachwahrnehmung bei Erhalt des Hörvermögens, Krampfsyndrom, Lähmungen und vermindertem Sehvermögen .
Bei einer intrauterinen Infektion mit Cytomegalovirus ist eine asymptomatische Infektionsform mit geringer Aktivität möglich, wenn das Virus nur im Urin oder Speichel vorhanden ist und ein hohes Maß Aktivität, wenn das Virus im Blut bestimmt wird. In 8-15% der Fälle führt die vorgeburtliche CMVI, ohne dass sich helle klinische Symptome zeigen, zur Bildung von Spätkomplikationen in Form von Hörverlust, Sehstörungen, Krampfstörungen, körperlicher und geistiger Behinderung. Ein Risikofaktor für die Entwicklung einer Erkrankung mit ZNS-Schädigung ist das persistierende Vorhandensein von CMV-DNA im Vollblut im Zeitraum von der Geburt bis zum 3. Lebensmonat. Kinder mit angeborener CMVI sollten 3–5 Jahre unter ärztlicher Aufsicht bleiben, da die Hörminderung in den ersten Lebensjahren fortschreiten kann und klinisch signifikante Komplikationen auch 5 Jahre nach der Geburt bestehen bleiben.
In Abwesenheit von erschwerenden Faktoren ist die intrapartale oder frühe postnatale CMVI asymptomatisch und manifestiert sich klinisch nur in 2-10% der Fälle, häufiger in Form einer Lungenentzündung. Geschwächte Frühgeborene mit niedrigem Geburtsgewicht, die während der Geburt oder in den ersten Lebenstagen durch Bluttransfusionen mit dem Cytomegalovirus infiziert wurden, entwickeln in der 3.–5. Lebenswoche eine generalisierte Erkrankung, deren Manifestationen Lungenentzündung, verlängerte Gelbsucht, Hepatosplenomegalie, Nephropathie sind , und Darmschäden. , Anämie, Thrombozytopenie. Die Krankheit hat einen langen rezidivierenden Charakter.
Die maximale Sterblichkeit durch CMVI tritt im Alter von 2–4 Monaten auf.
Das Krankheitsbild einer erworbenen Cytomegalovirus-Infektion bei älteren Kindern und Erwachsenen ist abhängig von der Infektionsform (Erstinfektion, Reinfektion, Reaktivierung des latenten Virus), den Infektionswegen, dem Vorliegen und der Schwere der Immunsuppression. Die primäre Cytomegalovirus-Infektion immunkompetenter Personen verläuft in der Regel asymptomatisch und nur in 5% der Fälle in Form eines Mononukleose-ähnlichen Syndroms, dessen Kennzeichen hohes Fieber, ausgeprägtes und anhaltendes asthenisches Syndrom im Blut sind - relative Lymphozytose, atypische Lymphozyten. Angina pectoris und geschwollene Lymphknoten sind nicht typisch. Die Infektion mit dem Virus durch Bluttransfusion oder Transplantation eines infizierten Organs führt zur Entwicklung einer akuten Form der Krankheit, einschließlich hohem Fieber, Asthenie, Halsschmerzen, Lymphadenopathie, Myalgie, Arthralgie, Neutropenie, Thrombozytopenie, interstitieller Pneumonie, Hepatitis, Nephritis und Myokarditis. Ohne ausgeprägte immunologische Störungen wird die akute CMVI mit lebenslanger Anwesenheit des Virus im menschlichen Körper latent. Die Entwicklung der Immunsuppression führt zur Wiederaufnahme der CMV-Replikation, zum Auftreten des Virus im Blut und zur möglichen Manifestation der Krankheit. Auch der Wiedereintritt des Virus in den menschlichen Körper vor dem Hintergrund einer Immunschwäche kann Ursache einer Virämie und der Entwicklung einer klinisch ausgeprägten CMVI sein. Bei einer Reinfektion tritt die Manifestation von CMVI häufiger auf und ist schwerer als bei einer Reaktivierung des Virus.
CMVI bei immunsupprimierten Personen ist gekennzeichnet durch eine allmähliche Entwicklung der Krankheit über mehrere Wochen, das Auftreten von Vorläufersymptomen in Form von schneller Müdigkeit, Schwäche, Appetitlosigkeit, erheblichem Gewichtsverlust, anhaltendem undulierendem Fieber des falschen Typs mit Anstieg der Körpertemperatur über 38,5 ° C, seltener - Nachtschweiß, Arthralgie und Myalgie.
Dieser Symptomkomplex wird als „CMV-assoziiertes Syndrom“ bezeichnet.
Bei kleinen Kindern kann der Ausbruch der Krankheit ohne ausgeprägte anfängliche Toxikose bei normaler oder subfebriler Temperatur erfolgen.
Ein breites Spektrum an Organschäden ist mit CMVI verbunden, wobei die Lungen zu den ersten gehören, die darunter leiden. Es tritt ein allmählich zunehmender trockener oder unproduktiver Husten auf, mäßige Atemnot, Vergiftungssymptome nehmen zu. Röntgenzeichen einer Lungenpathologie können fehlen, aber während des Höhepunkts der Erkrankung werden häufig bilaterale kleinfokale und infiltrative Schatten, die sich hauptsächlich in den mittleren und unteren Teilen der Lunge befinden, vor dem Hintergrund einer deformierten verstärkten Lunge festgestellt Muster. Bei vorzeitiger Diagnose ist die Entwicklung von DN, RDS und Tod möglich. Das Ausmaß der Lungenschädigung bei Patienten mit CMVI variiert von einer minimal schweren interstitiellen Pneumonie bis hin zu einer ausgedehnten fibrosierenden Bronchiolitis und Alveolitis mit der Bildung einer bilateralen polysegmentalen Lungenfibrose.
Oft infiziert das Virus den Verdauungstrakt. Cytomegalovirus ist der wichtigste ätiologische Faktor bei ulzerativen Defekten des Verdauungstraktes bei Patienten mit HIV-Infektion. Typische Anzeichen einer CMV-Ösophagitis sind Fieber, retrosternale Schmerzen während der Passage des Nahrungsbolus, das Ausbleiben der Wirkung einer antimykotischen Therapie, das Vorhandensein flacher runder Geschwüre und/oder Erosionen im distalen Ösophagus. Die Niederlage des Magens ist durch das Vorhandensein von akuten oder subakuten Geschwüren gekennzeichnet. Das klinische Bild einer CMV-Kolitis oder Enterokolitis umfasst Durchfall, anhaltende Bauchschmerzen, Druckschmerz im Dickdarm, erheblichen Gewichtsverlust, schwere Schwäche und Fieber. Die Koloskopie zeigt Erosionen und Ulzerationen der Darmschleimhaut. Hepatitis ist eine der wichtigsten klinischen Formen von CMVI im Falle einer transplazentaren Infektion eines Kindes, bei Empfängern nach einer Lebertransplantation, bei Patienten, die während Bluttransfusionen mit dem Virus infiziert wurden. Ein Merkmal der Leberschädigung bei CMVI ist die häufige Beteiligung der Gallenwege am pathologischen Prozess. Die CMV-Hepatitis ist durch einen milden klinischen Verlauf gekennzeichnet, aber mit der Entwicklung einer sklerosierenden Cholangitis treten Schmerzen im Oberbauch, Übelkeit, Durchfall, Leberempfindlichkeit, erhöhte Aktivität der alkalischen Phosphatase und GGTT und eine Cholestase auf.
Leberschäden liegen in der Natur der granulomatösen Hepatitis, in seltenen Fällen werden ausgeprägte Fibrose und sogar Leberzirrhose beobachtet. Die Pathologie der Bauchspeicheldrüse bei Patienten mit CMVI verläuft normalerweise asymptomatisch oder mit einem gelöschten Krankheitsbild mit einem Anstieg der Amylasekonzentration im Blut. Die Zellen des Epithels der kleinen Gänge der Speicheldrüsen, hauptsächlich der Ohrspeicheldrüsen, haben eine hohe Empfindlichkeit gegenüber CMV. Spezifische Veränderungen der Speicheldrüsen bei CMVI bei Kindern treten in den allermeisten Fällen auf. Für erwachsene Patienten mit CMVI ist eine Sialadenitis nicht typisch.
Cytomegalovirus ist eine der Ursachen der Nebennierenpathologie (häufig bei Patienten mit HIV-Infektion) und der Entwicklung einer sekundären Nebenniereninsuffizienz, die sich durch anhaltende Hypotonie, Schwäche, Gewichtsverlust, Anorexie, Darmerkrankungen, eine Reihe von psychischen Störungen, seltener - Hyperpigmentierung, manifestiert der Haut und Schleimhäute. Das Vorhandensein von CMV-DNA im Blut eines Patienten sowie anhaltende Hypotonie, Asthenie und Anorexie erfordern die Bestimmung des Kalium-, Natrium- und Chloridspiegels im Blut sowie die Durchführung von Hormonstudien zur Analyse der funktionellen Aktivität der Nebennieren. Die CMV-Adrenalitis ist gekennzeichnet durch eine anfängliche Läsion der Medulla mit dem Übergang des Prozesses in die Tiefe und später in alle Schichten der Kortikalis.
Eine manifeste CMVI tritt häufig bei einer Schädigung des Nervensystems in Form von Enzephaloventrikulitis, Myelitis, Polyradikulopathie, Polyneuropathie der unteren Extremitäten auf. Die CMV-Enzephalitis bei Patienten mit HIV-Infektion ist gekennzeichnet durch schlechte neurologische Symptome (intermittierende Kopfschmerzen, Schwindel, horizontaler Nystagmus, Paresen des N. oculomotorius, Neuropathie des N. facialis), aber ausgeprägte Veränderungen des mentalen Status (Persönlichkeitsveränderungen, schwere Gedächtnisstörungen, vermindert Fähigkeit zur intellektuellen Aktivität, eine starke Schwächung der geistigen und motorischen Aktivität, räumliche und zeitliche Orientierungslosigkeit, Anosognosie, verminderte Kontrolle über die Funktion der Beckenorgane). Mnestisch-intellektuelle Veränderungen erreichen oft den Grad einer Demenz. Bei Kindern, die eine CMV-Enzephalitis hatten, wird auch eine Verlangsamung der geistigen und geistigen Entwicklung festgestellt.
Untersuchungen der Cerebrospinalflüssigkeit (CSF) zeigen erhöhtes Protein, keine Entzündungsreaktion oder mononukleäre Pleozytose und normale Glukose- und Chloridspiegel. Das klinische Bild der Polyneuropathie und Polyradikulopathie ist gekennzeichnet durch Schmerzen in den distalen unteren Extremitäten, seltener in der Lendengegend, kombiniert mit Taubheit, Parästhesie, Hyperästhesie, Kausalgie, Hyperpathie. Bei Polyradikulopathie ist eine schlaffe Parese der unteren Extremitäten möglich, begleitet von einer Abnahme der Schmerzen und der Tastempfindlichkeit in den distalen Beinen. Im Liquor von Patienten mit Polyradikulopathie werden eine Erhöhung des Proteingehalts, lymphozytäre Pleozytose nachgewiesen.
Cytomegalovirus spielt eine führende Rolle bei der Entwicklung von Myelitis bei HIV-infizierten Patienten. Die Rückenmarksverletzung ist diffus und eine Spätmanifestation der CMVI. Zu Beginn weist die Krankheit ein klinisches Bild einer Polyneuropathie oder Polyradikulopathie auf, später entwickelt sich je nach vorherrschender Schädigung des Rückenmarks eine spastische Tetraplegie oder spastische Parese der unteren Extremitäten, es treten Pyramidenzeichen auf, insgesamt eine signifikante Abnahme Arten von Empfindlichkeit, hauptsächlich in den distalen Beinen; trophische Störungen. Alle Patienten leiden an schweren Störungen der Funktion der Beckenorgane, hauptsächlich vom zentralen Typ. Im Liquor wird ein mäßiger Anstieg des Proteingehalts, lymphozytäre Pleozytose festgestellt.
Die CMV-Retinitis ist die häufigste Ursache für Sehverlust bei Patienten mit HIV-Infektion. Diese Pathologie auch beschrieben bei Organempfängern, Kindern mit angeborener CMVI, in Einzelfällen - bei schwangeren Frauen. Die Patienten klagen über schwebende Punkte, Flecken, einen Schleier vor den Augen, eine Abnahme der Sehschärfe und Gesichtsfeldausfälle. Die Ophthalmoskopie auf der Netzhaut entlang der Fundusperipherie zeigt weiße Herde mit Blutungen entlang der Netzhautgefäße. Das Fortschreiten des Prozesses führt zur Bildung eines diffusen ausgedehnten Infiltrats mit Netzhautatrophiezonen und Blutungsherden entlang der Oberfläche der Läsion. Die anfängliche Pathologie eines Auges nimmt in 2-4 Monaten einen bilateralen Charakter an und führt ohne ätiotrope Therapie in den meisten Fällen zu Sehverlust. Patienten mit einer HIV-Infektion mit CMV-Retinitis in der Vorgeschichte können während der HAART eine Uveitis als Manifestation des Immunsystem-Erholungssyndroms entwickeln.
Schallempfindungsschwerhörigkeit tritt bei 60 % der Kinder mit klinisch ausgeprägter angeborener CMVI auf. Hörverlust ist auch bei erwachsenen HIV-infizierten Personen mit offener CMVI möglich. CMV-assoziierte Hörstörungen beruhen auf einer entzündlichen und ischämischen Schädigung der Cochlea und des Hörnervs.
Eine Reihe von Arbeiten zeigt die Rolle von CMV als ätiologischer Faktor bei der Pathologie des Herzens (Myokarditis, dilatative Kardiopathie), der Milz, der Lymphknoten, der Nieren und des Knochenmarks mit der Entwicklung einer Panzytopenie. Die durch CMVI verursachte interstitielle Nephritis verläuft in der Regel ohne klinische Manifestationen. Mikroproteinurie, Mikrohämaturie, Leukozyturie, selten sekundäres nephrotisches Syndrom und Nierenversagen sind möglich. Bei Patienten mit CMVI wird häufig eine Thrombozytopenie festgestellt, seltener eine mäßige Anämie, Leukopenie, Lymphopenie und Monozytose.
Diagnose einer Cytomegalovirus-Infektion
Die klinische Diagnose einer CMV-Erkrankung erfordert eine obligatorische Laborbestätigung.
Die Untersuchung des Blutes des Patienten auf das Vorhandensein spezifischer Antikörper der Klasse IgM und / oder der Klasse IgG reicht weder aus, um die Tatsache einer aktiven CMV-Replikation festzustellen, noch um die manifeste Form der Krankheit zu bestätigen. Das Vorhandensein von Anti-CMV-IgG im Blut bedeutet nur die Tatsache einer Begegnung mit dem Virus.
Das Neugeborene erhält von der Mutter IgG-Antikörper, die nicht als Nachweis einer CMV-Infektion dienen. Der quantitative Gehalt an IgG-Antikörpern im Blut korreliert nicht mit dem Vorhandensein der Krankheit oder mit der aktiven asymptomatischen Form der Infektion oder mit dem Risiko einer intrauterinen Infektion des Kindes. Nur ein 4-facher oder mehrfacher Anstieg der Anti-CMV-IgG-Menge in „gepaarten Seren“ während der Untersuchung im Abstand von 14–21 Tagen hat einen gewissen diagnostischen Wert.
Das Fehlen von Anti-CMV-IgG in Kombination mit dem Vorhandensein spezifischer IgM-Antikörper weist auf eine akute CMVI hin. Der Nachweis von Anti-CMV-IgM bei Kindern in den ersten Lebenswochen ist ein wichtiges Kriterium für eine intrauterine Infektion mit dem Virus. Ein schwerwiegender Nachteil der Bestimmung von IgM-Antikörpern ist jedoch das häufige Fehlen bei Vorhandensein eines aktiven Infektionsprozesses und häufige Fehlalarme Ergebnisse. Das Vorhandensein einer akuten CMVI wird durch die Neutralisierung von IgM-Antikörpern angezeigt, die nicht länger als 60 Tage nach der Infektion mit dem Virus im Blut vorhanden sind. Die Bestimmung des Anti-CMV-IgG-Aviditätsindex, der die Geschwindigkeit und Stärke der Antigenbindung an einen Antikörper charakterisiert, hat einen gewissen diagnostischen und prognostischen Wert. Der Nachweis eines niedrigen Antikörper-Aviditätsindex (weniger als 0,2 oder weniger als 30 %) bestätigt eine kürzliche (innerhalb von 3 Monaten) Primärinfektion mit dem Virus. Das Vorhandensein von Low-Avid-Antikörpern bei einer schwangeren Frau ist ein Marker für ein hohes Risiko einer Transplantationsübertragung des Erregers auf den Fötus. Gleichzeitig schließt das Fehlen von Low-Avid-Antikörpern eine frische Infektion nicht vollständig aus.
Das virologische Verfahren, das auf der Isolierung von CMV aus biologischen Flüssigkeiten in Zellkultur basiert, ist ein spezifisches, aber zeitraubendes, zeitraubendes, teures und unempfindliches Verfahren zur Diagnose von CMV.
In der praktischen Gesundheitspflege wird ein schnelles Kulturverfahren zum Nachweis viraler Antigene in biologischen Materialien verwendet, indem infizierte Kulturzellen analysiert werden. Der Nachweis von frühen und sehr frühen CMV-Antigenen zeigt das Vorhandensein eines aktiven Virus in einem Patienten.
Antigen-Nachweismethoden sind jedoch PCR-basierten molekularen Methoden, die einen direkten qualitativen und quantitativen Nachweis von CMV-DNA in biologischen Flüssigkeiten und Geweben ermöglichen, in Bezug auf die Empfindlichkeit unterlegen so bald wie möglich. Die klinische Bedeutung der Bestimmung von CMV-DNA oder -Antigen in verschiedenen biologischen Flüssigkeiten ist nicht gleich.
Das Vorhandensein des Erregers im Speichel ist nur ein Infektionsmarker und weist nicht auf eine signifikante Virusaktivität hin. Das Vorhandensein von CMV-DNA oder -Antigen im Urin beweist die Tatsache einer Infektion und eine gewisse virale Aktivität, was insbesondere bei der Untersuchung eines Kindes in den ersten Lebenswochen wichtig ist. Der wichtigste diagnostische Wert ist der Nachweis von DNA oder Antigen des Virus im Vollblut, was auf eine hochaktive Replikation des Virus und seine ätiologische Rolle in der bestehenden Organpathologie hinweist. Der Nachweis von CMV-DNA im Blut einer schwangeren Frau ist der Hauptmarker für ein hohes Risiko einer fetalen Infektion und der Entwicklung einer angeborenen CMVI. Die Tatsache der Infektion des Fötus wird durch das Vorhandensein von CMV-DNA im Fruchtwasser oder Nabelschnurblut nachgewiesen und nach der Geburt des Kindes durch den Nachweis von Virus-DNA in jeder biologischen Flüssigkeit in den ersten 2 Wochen bestätigt Leben. Eine manifeste CMVI bei Kindern der ersten Lebensmonate wird durch das Vorhandensein von CMV-DNA im Blut belegt, bei immunsupprimierten Personen (Empfänger von Organen mit HIV-Infektion) muss die Menge an Virus-DNA im Blut bestimmt werden. Der Gehalt an CMV-DNA im Vollblut, gleich 3,0 oder mehr log10 in 105 Leukozyten, zeigt zuverlässig die Cytomegalovirus-Natur der Krankheit an. Von großem prognostischem Wert ist auch die quantitative Bestimmung der CMV-DNA im Blut. Das Auftreten und die allmähliche Zunahme des Gehalts an CMV-DNA im Vollblut übertrifft die Entwicklung klinischer Symptome signifikant. Der Nachweis von Cytomegalozellulären Zellen bei der histologischen Untersuchung von Biopsie- und Autopsiematerialien bestätigt die Cytomegalovirus-Natur der Organpathologie.
Diagnostischer Standard
Untersuchung schwangerer Frauen zur Bestimmung des Vorhandenseins von aktivem CMVI und des Risikograds einer vertikalen Übertragung des Virus auf den Fötus.
Bestimmung der Menge an Anti-CMV-IgG im Blut im Abstand von 14–21 Tagen.
Untersuchung von Fruchtwasser oder Nabelschnurblut auf das Vorhandensein von CMV-DNA (falls angezeigt).
Blut- und Urintests auf das Vorhandensein von DNA oder Antigen des Virus werden routinemäßig mindestens zweimal während der Schwangerschaft oder nach klinischer Indikation durchgeführt.
Untersuchung von Neugeborenen zur Bestätigung einer vorgeburtlichen Infektion mit CMV (angeborenes CMVI).
Untersuchung von Urin oder Abstrichen der Mundschleimhaut auf das Vorhandensein von CMV-DNA oder Virusantigen in den ersten 2 Lebenswochen eines Kindes.
Die Untersuchung von Vollblut auf das Vorhandensein von CMV-DNA oder Virusantigen in den ersten 2 Lebenswochen eines Kindes, bei positivem Ergebnis ist eine quantitative Bestimmung von CMV-DNA im Vollblut angezeigt.
Bluttest auf Vorhandensein von IgM-Antikörpern gegen CMV durch ELISA.
Bestimmung der Menge an IgG-Antikörpern im Blut im Abstand von 14–21 Tagen.
Es ist möglich, eine Blutuntersuchung von Mutter und Kind auf Anti-CMV-IgG durchzuführen, um die Menge an IgG-Antikörpern in „gepaarten Seren“ zu vergleichen.
Untersuchung von Kindern zur Bestätigung einer intrapartalen oder frühen postnatalen CMV-Infektion und des Vorhandenseins von aktivem CMVI (in Abwesenheit des Virus in Blut, Urin oder Speichel, Anti-CMV-IgM während der ersten 2 Lebenswochen).
Untersuchung von Urin oder Speichel auf das Vorhandensein von CMV-DNA oder Virusantigen in den ersten 4-6 Lebenswochen eines Kindes.
Die Untersuchung von Vollblut auf das Vorhandensein von CMV-DNA oder Virusantigen in den ersten 4-6 Lebenswochen eines Kindes, bei positivem Ergebnis ist eine quantitative Bestimmung von CMV-DNA im Vollblut angezeigt.
Bluttest auf Vorhandensein von IgM-Antikörpern gegen CMV durch ELISA.
Untersuchung von Kleinkindern, Jugendlichen, Erwachsenen mit Verdacht auf akute CMVI.
Vollbluttest auf CMV-DNA oder Virusantigen.
Urinanalyse auf das Vorhandensein von CMV-DNA oder Virusantigen.
Bluttest auf Vorhandensein von IgM-Antikörpern gegen CMV durch ELISA.
Bestimmung des Aviditätsindex von IgG-Antikörpern gegen CMV durch ELISA.
Bestimmung der Menge an IgG-Antikörpern im Blut im Abstand von 14–21 Tagen.
Untersuchung von Patienten mit Verdacht auf eine aktive CMVI und einer manifesten Form der Erkrankung (CMV-Erkrankung).
Die Untersuchung von Vollblut auf das Vorhandensein von CMV-DNA oder CMV-Antigen mit der obligatorischen quantitativen Bestimmung des Gehalts an CMV-DNA im Blut.
Bestimmung von CMV-DNA in Liquor, Pleuraflüssigkeit, bronchoalveolärer Lavageflüssigkeit, Bronchial- und Organbiopsien bei Vorliegen einer geeigneten Organpathologie.
Histologische Untersuchung von Biopsie- und Autopsiematerial auf das Vorhandensein von Zytomegaliezellen (Färbung mit Hämatoxylin und Eosin).
Differentialdiagnose einer Cytomegalovirus-Infektion
Die Differentialdiagnose der angeborenen CMVI wird mit Röteln, Toxoplasmose, Neugeborenenherpes, Syphilis, bakterieller Infektion, hämolytischer Erkrankung des Neugeborenen, Geburtstrauma und erblichen Syndromen durchgeführt. Von entscheidender Bedeutung ist die spezifische Labordiagnostik der Erkrankung in den ersten Lebenswochen eines Kindes, die histologische Untersuchung der Plazenta mit molekulardiagnostischen Methoden. Bei einer Mononukleose-ähnlichen Erkrankung sind Infektionen durch EBV, Herpesvirus Typ 6 und 7, akute HIV-Infektion sowie Streptokokken-Tonsillitis und das Auftreten einer akuten Leukämie ausgeschlossen. Im Falle der Entwicklung einer CMV-Atemwegserkrankung bei Kleinkindern sollte eine Differentialdiagnose mit Keuchhusten, bakterieller Tracheitis oder Tracheobronchitis und herpetischer Tracheobronchitis durchgeführt werden. Bei Patienten mit Immunschwäche sollte eine manifeste CMVI von Pneumocystis-Pneumonie, Tuberkulose, Toxoplasmose, mykoplasmatischer Pneumonie, bakterieller Sepsis, Neurosyphilis, progressiver multifokaler Leukenzephalopathie, lymphoproliferativen Erkrankungen, Pilz- und Herpesinfektionen, HIV-Enzephalitis unterschieden werden. Polyneuropathie und Polyradikulopathie der CMV-Ätiologie erfordern eine Unterscheidung von Polyradikulopathie verursacht durch Herpesviren, Guillain-Barré-Syndrom, toxische Polyneuropathie im Zusammenhang mit der Verwendung von Drogen, Alkohol und narkotischen, psychotropen Substanzen. Um rechtzeitig eine ätiologische Diagnose zu stellen, wird zusammen mit einer Beurteilung des Immunstatus, Standardlabortests, MRT des Gehirns und des Rückenmarks ein Bluttest auf das Vorhandensein von CMV-DNA durchgeführt, instrumentelle Untersuchungen mit der Studie von Liquor, Spülflüssigkeit, Pleuraerguss, Biopsiematerial auf das Vorhandensein von DNA in ihnen Krankheitserreger.
Indikationen für die Konsultation anderer Spezialisten
Indikationen für die Konsultation von Spezialisten bei Patienten mit CMVI sind schwere Schädigungen der Lunge (Pneumologe und Phthisiater), des zentralen Nervensystems (Neurologe und Psychiater), des Sehvermögens (Augenarzt), der Hörorgane (HNO-Arzt) und des Knochenmarks (Onkohämatologe).
Diagnosebeispiel
Die Diagnose einer manifesten CMVI wird wie folgt formuliert:
Akute Cytomegalovirus-Infektion, Cytomegalovirus-Mononukleose;
- angeborene Cytomegalovirus-Infektion, manifeste Form;
- HIV-Infektion, Stadium der Folgeerkrankungen 4 B (AIDS): manifeste Cytomegalovirus-Infektion (Pneumonie, Colitis).
Indikationen für einen Krankenhausaufenthalt
Bei klinisch ausgeprägter CMV-Erkrankung ist ein Krankenhausaufenthalt angezeigt.
Behandlung einer Cytomegalovirus-Infektion
Modus. Diät
Eine spezielle Therapie und Diät für Patienten mit CMVI ist nicht erforderlich, Einschränkungen werden basierend auf dem Zustand des Patienten und dem Ort der Läsion festgelegt.
Medizinische Behandlung
Arzneimittel, deren Wirksamkeit durch kontrollierte Studien zur Behandlung und Vorbeugung von CMV-Erkrankungen nachgewiesen wurde, sind die antiviralen Arzneimittel Ganciclovir, Valganciclovir, Natrium-Foscarnet, Cidofovir. Interferonpräparate und Immunkorrektoren sind bei einer Cytomegalovirus-Infektion nicht wirksam.
Bei aktivem CMVI (Vorhandensein von CMV-DNA im Blut) bei Schwangeren ist das Medikament der Wahl humanes Anticytomegalovirus-Immunglobulin (Neocytotec). Um eine vertikale Infektion mit dem Virus des Fötus zu verhindern, wird dem Medikament 1 ml / kg pro Tag intravenös verschrieben, 3 Injektionen im Abstand von 1-2 Wochen.
Um die Manifestation der Krankheit bei Neugeborenen mit aktiver CMVI oder mit einer manifesten Form der Krankheit mit geringfügigen klinischen Manifestationen zu verhindern, ist Neocytotec mit 2-4 ml / kg pro Tag für 6 Injektionen (alle 1 oder 2 Tage) indiziert. Wenn Kinder zusätzlich zu CMVI andere infektiöse Komplikationen haben, ist es möglich, anstelle von Neocytotect Pentaglobin in einer Dosis von 5 ml / kg täglich für 3 Tage zu verwenden, gegebenenfalls mit einer Wiederholung eines Kurses oder anderer Immunglobuline für Intravenöse Verabreichung.
Die Anwendung von Neocytotect als Monotherapie bei Patienten mit offenen, lebensbedrohlichen oder schweren Folgen einer CMVI ist nicht indiziert.
Ganciclovir und Valganciclovir sind die Mittel der Wahl für die Behandlung, Sekundärprävention und Prävention einer manifesten CMVI. Die Behandlung einer manifesten CMVI mit Ganciclovir erfolgt nach folgendem Schema: 5 mg/kg intravenös 2-mal täglich im Abstand von 12 Stunden für 14–21 Tage bei Patienten mit Retinitis; 3-4 Wochen - mit Schädigung der Lunge oder des Verdauungstraktes; 6 Wochen oder mehr - mit Pathologie des Zentralnervensystems. Valganciclovir wird oral in einer therapeutischen Dosis von 900 mg zweimal täglich zur Behandlung von Retinitis, Lungenentzündung, Ösophagitis, Enterokolitis mit CMV-Ätiologie angewendet. Die Anwendungsdauer und Wirksamkeit von Valganciclovir sind identisch mit der parenteralen Therapie mit Ganciclovir. Die Kriterien für die Wirksamkeit der Behandlung sind die Normalisierung des Zustands des Patienten, ein klarer positiver Trend nach den Ergebnissen instrumenteller Studien, das Verschwinden von CMV-DNA aus dem Blut. Die Wirksamkeit von Ganciclovir bei Patienten mit CMV-Läsionen des Gehirns und des Rückenmarks ist geringer, hauptsächlich aufgrund der späten ätiologischen Diagnose und des vorzeitigen Therapiebeginns, wenn bereits irreversible Veränderungen im Zentralnervensystem vorliegen. Die Wirksamkeit von Ganciclovir sowie die Häufigkeit und Schwere von Nebenwirkungen bei der Behandlung von Kindern mit CMV-Erkrankung sind mit denen bei erwachsenen Patienten vergleichbar.
Mit der Entwicklung einer lebensbedrohlichen manifesten CMVI bei einem Kind ist die Anwendung von Ganciclovir erforderlich. Für die Behandlung von Kindern mit manifester neonataler CMVI wird Ganciclovir in einer Dosis von 6 mg/kg intravenös alle 12 Stunden für 2 Wochen verschrieben. Wenn es eine anfängliche Wirkung der Therapie gibt, wird das Medikament dann in einer Dosis von 10 mg verwendet /kg jeden zweiten Tag für 3 Monate.
Während der Zustand der Immunschwäche aufrechterhalten wird, sind Rückfälle der CMV-Erkrankung unvermeidlich. HIV-infizierten Patienten, die mit offener CMVI behandelt werden, wird eine Erhaltungstherapie (900 mg/Tag) oder Ganciclovir (5 mg/kg/Tag) verschrieben, um ein Wiederauftreten der Krankheit zu verhindern. Die Erhaltungsbehandlung bei Patienten mit HIV-Infektion, die sich einer CMV-Retinitis unterzogen haben, wird vor dem Hintergrund von HAART durchgeführt, bis die Anzahl der CD4-Lymphozyten um mehr als 100 Zellen pro 1 μl ansteigt, was mindestens 3 Monate anhält. Die Dauer der Erhaltungskur bei anderen klinischen Formen von CMVI sollte mindestens einen Monat betragen. Im Falle eines Wiederauftretens der Krankheit wird ein wiederholter therapeutischer Kurs verordnet. Die Behandlung einer Uveitis, die sich während der Wiederherstellung des Immunsystems entwickelt hat, beinhaltet die systemische oder periokulare Verabreichung von Steroiden.
Gegenwärtig wird bei Patienten mit aktiver Cytomegalovirus-Infektion eine Strategie der "präventiven" etiotropen Therapie empfohlen, um die Manifestation der Krankheit zu verhindern.
Die Kriterien für die Verschreibung einer vorbeugenden Therapie sind das Vorhandensein einer ausgeprägten Immunsuppression bei Patienten (bei einer HIV-Infektion beträgt die Anzahl der CD4-Lymphozyten im Blut weniger als 50 Zellen pro 1 μl) und die Bestimmung von CMV-DNA im Vollblut bei a Konzentration von mehr als 2,0 lg10-Gen/ml oder der Nachweis von DNA CMV im Plasma. Das Medikament der Wahl zur Prävention einer manifesten CMVI ist Valganciclovir, das in einer Dosis von 900 mg/Tag verwendet wird. Die Dauer des Kurses beträgt mindestens einen Monat. Das Kriterium für das Absetzen der Therapie ist das Verschwinden der CMV-DNA aus dem Blut. Bei Organempfängern wird eine präventive Therapie für mehrere Monate nach der Transplantation durchgeführt. Nebenwirkungen von Ganciclovir oder Valganciclovir: Neutropenie, Thrombozytopenie, Anämie, erhöhtes Serumkreatinin, Hautausschlag, Juckreiz, Dyspepsie, reaktive Pankreatitis.
Pflegestandard
Behandlungsverlauf: Ganciclovir 5 mg/kg 2-mal täglich oder Valganciclovir 900 mg 2-mal täglich, die Therapiedauer beträgt 14–21 Tage oder mehr, bis die Krankheitssymptome und die CMV-DNA aus dem Blut verschwinden. Im Falle eines Wiederauftretens der Krankheit wird eine wiederholte Behandlung durchgeführt.
Erhaltungstherapie: Valganciclovir 900 mg/Tag für mindestens einen Monat.
Vorbeugende Therapie gegen aktives CMVI bei immunsupprimierten Patienten, um die Entwicklung einer CMV-Erkrankung zu verhindern: Valganciclovir 900 mg/Tag für mindestens einen Monat, bis keine CMV-DNA mehr im Blut vorhanden ist.
Präventive Therapie mit aktivem CMVI während der Schwangerschaft, um eine vertikale Infektion des Fötus zu verhindern: Neocytotect 1 ml/kg pro Tag intravenös 3 Injektionen im Abstand von 2-3 Wochen.
Präventive Therapie von aktivem CMVI bei Neugeborenen, Kleinkindern zur Verhinderung der Entwicklung einer manifesten Form der Krankheit: neocytotect 2–4 ml/kg pro Tag intravenös, 6 Injektionen unter Kontrolle des Vorhandenseins von CMV-DNA im Blut.
Vorhersage
Bei frühzeitiger Diagnose einer CMV-Pneumonie, Ösophagitis, Colitis, Retinitis, Polyneuropathie und rechtzeitigem Beginn einer etiotropen Therapie ist die Prognose für das Leben und die Arbeitsfähigkeit günstig. Die späte Erkennung der Cytomegalovirus-Pathologie der Netzhaut und die Entwicklung ihrer ausgedehnten Schädigung führt zu einer anhaltenden Abnahme des Sehvermögens oder zu ihrem vollständigen Verlust. CMV-Schäden an Lunge, Darm, Nebennieren, Gehirn und Rückenmark können bei Patienten zu Behinderungen oder zum Tod führen.
Ungefähre Zeiten der Arbeitsunfähigkeit
Die Arbeitsfähigkeit von Patienten mit einer CMV-Erkrankung ist für mindestens 30 Tage beeinträchtigt.
Klinische Untersuchung
Frauen werden während der Schwangerschaft einer Laboruntersuchung unterzogen, um eine aktive Cytomegalovirus-Infektion auszuschließen. Kleinkinder, die vorgeburtlich mit CMVI infiziert sind, werden von einem Neuropathologen, HNO-Arzt und Augenarzt beobachtet.
Kinder, die sich einer klinisch ausgeprägten angeborenen CMVI unterzogen haben, sind bei einem Neurologen in der Apotheke registriert. Patienten nach einer Transplantation von Knochenmark und anderen Organen im ersten Jahr nach der Transplantation sollten mindestens einmal monatlich auf das Vorhandensein von CMV-DNA im Vollblut untersucht werden. Patienten mit einer HIV-Infektion mit einer CD4-Lymphozytenzahl von weniger als 100 Zellen pro 1 µl sollten mindestens einmal alle 3 Monate von einem Augenarzt untersucht und auf den quantitativen Gehalt an CMV-DNA in den Blutzellen getestet werden.
Prävention einer Cytomegalovirus-Infektion
Präventive Maßnahmen gegen CMVI sollten je nach Risikogruppe differenziert werden. Es ist notwendig, schwangere Frauen (insbesondere seronegative) über das Problem der Cytomegalovirus-Infektion und Empfehlungen zur Verwendung von Barriere-Kontrazeptiva während des Geschlechtsverkehrs und zur Einhaltung der persönlichen Hygieneregeln bei der Betreuung von Kleinkindern zu beraten. Es ist wünschenswert, schwangere seronegative Frauen, die in Waisenhäusern, stationären Kinderabteilungen und krippenähnlichen Einrichtungen arbeiten, vorübergehend an Arbeitsplätze zu versetzen, die nicht mit dem Risiko einer CMV-Infektion verbunden sind. Eine wichtige Maßnahme zur Prävention von CMVI in der Transplantologie ist die Auswahl eines seronegativen Spenders, wenn der Empfänger seronegativ ist. Derzeit gibt es keinen patentierten Impfstoff gegen das Zytomegalievirus.
Was ist eine Cytomegalovirus-Infektion?
Zytomegalievirus-Infektion(Humane Cytomegalovirus-Infektion, CMV-Infektion, Zytomegalie, Viruserkrankung der Speicheldrüsen, Einschlusszytomegalie, Krankheit mit Einschlüssen) ist eine anthroponotische opportunistische Infektion, die meist latent oder leicht auftritt. Es ist gefährlich bei verschiedenen Immunschwächezuständen und in der Schwangerschaft (aufgrund des Risikos einer intrauterinen Infektion des Fötus).Bereits 1882 entdeckte der deutsche Pathologe X. Ribbert in den Nierenkanälchen eines totgeborenen Kindes eigentümliche Riesenzellen mit Einschlüssen im Zellkern. Später wurden sie Zytomegaliezellen genannt (Goodpasture E., Talbot F., 1921). Später isolierten L. Smith und W. Rowe (1956) ein Virus, das eine Krankheit mit der Entwicklung einer charakteristischen Zytomegalie verursacht. Es wurde Cytomegalovirus (CMV) genannt und die Krankheit selbst wurde Cytomegalovirus-Infektion genannt.
Was verursacht eine Cytomegalovirus-Infektion?
Der Erreger der Cytomegalovirus-Infektion- DNA-genomisches Virus der Gattung Cytomegalovirus (Cytomegalievirus hominis) Unterfamilie Betaherpesvirinae der Familie Herpesviridae. Drei Stämme des Virus sind bekannt: Davis, AD-169 und Kerr. Eine langsame Vermehrung des Virus in der Zelle ist möglich, ohne diese zu schädigen. Das Virus wird durch Erhitzen und Einfrieren inaktiviert und ist bei Raumtemperatur gut haltbar. Bei -90 °C bleibt es lange erhalten, ist bei pH 5,0-9,0 relativ stabil und fällt bei pH 3,0 schnell zusammen.
Reservoir und Infektionsquelle- eine Person mit einer akuten oder latenten Form der Krankheit. Das Virus kann in verschiedenen biologischen Sekreten gefunden werden: Speichel, Nasen-Rachen-Sekret, Tränenflüssigkeit, Urin, Kot, Samenflüssigkeit und Zervixsekret.
Übertragungsmechanismen vielfältig, Übertragungswege- luftgetragen, Kontakt (direkt und indirekt - durch Haushaltsgegenstände) und transplazentar. Eine Ansteckung ist durch sexuellen Kontakt, während einer Transplantation innerer Organe (Niere oder Herz) und einer Bluttransfusion eines infizierten Spenders möglich. Eine intranatale Infektion des Kindes wird viel häufiger beobachtet als eine transplazentare. Am gefährlichsten für den Fötus ist die Infektion der Mutter im ersten Trimester der Schwangerschaft. In solchen Situationen ist die Häufigkeit intrauteriner Entwicklungsstörungen am höchsten.
Natürliche Empfänglichkeit des Menschen hohe, aber weit verbreitete latente Infektion. Klinische Manifestationen einer Infektion, die opportunistischen Erkrankungen zugeschrieben werden, sind bei Zuständen mit primärer oder sekundärer Immunschwäche möglich.
Die wichtigsten epidemiologischen Anzeichen einer Cytomegalovirus-Infektion. Die Krankheit wird überall registriert, ihre weite Verbreitung wird durch antivirale Antikörper belegt, die bei 50-80% der Erwachsenen nachgewiesen werden. Die Vielfalt der CMV-Infektionswege und die Polymorphie des Krankheitsbildes bestimmen die epidemiologische und gesellschaftliche Bedeutung der CMV-Infektion. Diese Krankheit spielt eine wichtige Rolle bei Transplantationen, Bluttransfusionen, perinatalen Pathologien, kann die Ursache für Frühgeburten, Totgeburten, Geburtsfehler Entwicklung. Bei Erwachsenen tritt eine CMV-Infektion als Begleiterkrankung bei verschiedenen Immunschwächezuständen auf. Anhaltende Verschmutzung Umfeld, tragen Zytostatika und Immunsuppressiva zu einer Erhöhung der CMV-Infektionshäufigkeit bei. In den letzten Jahren hat seine Exazerbation bei HIV-Infizierten an Bedeutung gewonnen. Bei Schwangeren mit latenter CMV-Infektion kommt es nicht immer zu fetalen Schäden. Die Wahrscheinlichkeit einer intrauterinen Infektion ist bei der Erstinfektion einer Frau während der Schwangerschaft wesentlich höher. Saisonale oder berufliche Merkmale der Morbidität wurden nicht identifiziert.
Pathogenese (was passiert?) während einer Cytomegalovirus-Infektion
Infektionspforten können bei verschiedenen Übertragungswegen die Schleimhäute der oberen Atemwege, des Magen-Darm-Traktes oder der Geschlechtsorgane sein. Das Virus gelangt ins Blut; Kurzfristige Virämie endet schnell mit der Lokalisierung des Erregers, wenn er in Leukozyten und mononukleäre Phagozyten eindringt und sich dort repliziert. Infizierte Zellen nehmen an Größe zu (Zytomegalie), nehmen eine typische Morphologie mit Kerneinschlüssen an, die Ansammlungen des Virus sind. Die Bildung von Zytomegaliezellen wird von interstitieller lymphohistiozytischer Infiltration, der Entwicklung von Knoteninfiltraten, Verkalkungen und Fibrose in verschiedenen Organen, Drüsenstrukturen im Gehirn begleitet.
Das Virus ist in der Lage, lange und latent in lymphatischen Organen zu persistieren, wobei es vor der Wirkung von Antikörpern und Interferon geschützt ist. Gleichzeitig kann es die zelluläre Immunität durch direkte Wirkung auf T-Lymphozyten unterdrücken. Bei verschiedenen Immunschwächezuständen (in der frühen Kindheit, während der Schwangerschaft, Einnahme von Zytostatika und Immunsuppressiva, HIV-Infektion) und vor allem bei Verletzungen der zellulären Immunität, die durch direkte Virusexposition weiter verstärkt werden, Reaktivierung des Erregers und seine hämatogene Generalisierung sind mit Schädigung fast aller Organe und Systeme möglich. In diesem Fall ist die Epitheliotropie des Virus von großer Bedeutung. Es ist besonders ausgeprägt in Bezug auf das Epithel der Speicheldrüsen, das sich unter dem Einfluss des Virus in Zytomegaliezellen verwandelt.
Eine aktive CMV-Infektion gilt als Indikator für Defekte in der zellulären Immunität und wird in die Gruppe der AIDS-assoziierten Zustände aufgenommen.
Symptome einer Cytomegalovirus-Infektion
Internationale Klassifikation der Krankheiten X Revision
Die Internationale statistische Klassifikation von Krankheiten und verwandten Gesundheitsproblemen, 10. Revisionsversion für 2006, klassifiziert eine Cytomegalovirus-Infektion nicht als sexuell übertragbare Infektion und unterscheidet zwischen den folgenden CMV-bedingten Krankheiten.
B25.0 Cytomegalovirus-Krankheit
B25.0 Cytomegalovirus-Pneumonitis
B25.1 Cytomegalovirus-Hepatitis
B25.2 Cytomegalovirus-Pankreatitis
B25.8 Andere Cytomegalovirus-Erkrankungen
B25.9 Cytomegalovirus-Erkrankung, unspezifisch
B27.1 Cytomegalovirus-Mononukleose
P35.1 Angeborene Cytomegalovirus-Infektion
Unter den verschiedenen Varianten des CMV-Infektionsverlaufs überwiegen subklinische Formen und latente Virusträger. Eine klinisch geäußerte Infektion wird unter Bedingungen einer Immunschwäche. Eine einheitliche klinische Klassifikation der CMV-Infektion wurde nicht entwickelt. Entsprechend einer der Klassifikationen wird die angeborene CMV-Infektion in akute und chronische Formen und die erworbene CMV-Infektion in latente, akute Mononukleose oder generalisierte Formen unterschieden.
Angeborene CMV-Infektion. In den meisten Fällen manifestiert es sich nicht klinisch in den frühen Stadien des Lebens eines Kindes, jedoch zeigen sich in den späteren Stadien seiner Entwicklung verschiedene Pathologien: Taubheit, Chorioretinitis mit Atrophie der Sehnerven, verminderte Intelligenz und Sprache Störungen. In 10-15% der Fälle mit angeborener CMV-Infektion entwickelt sich jedoch das sogenannte manifeste Cytomegalovirus-Syndrom. Seine Manifestationen hängen vom Zeitpunkt der Infektion des Fötus während der Schwangerschaft ab.
.
- In der Frühschwangerschaft führt zum intrauterinen Tod des Fötus oder zur Geburt eines Kindes mit einer Vielzahl von Fehlbildungen: Mikrozephalie, Mikro- und Makrogyrie, Lungenhypoplasie, Ösophagusatresie, Anomalien in der Nierenstruktur, Defekte in den Vorhof- und Zwischenkammersepten, Verengung von Lungenstamm und Aorta usw.
Wenn der Fötus infiziert ist in der Spätschwangerschaft Missbildungen werden nicht gebildet, Neugeborene zeigen jedoch ab den ersten Lebenstagen Anzeichen verschiedener Krankheiten: hämorrhagisches Syndrom, hämolytische Anämie, Gelbsucht verschiedener Herkunft (aufgrund angeborener Hepatitis, Leberzirrhose, Atresie der Gallenwege). Es sind verschiedene klinische Manifestationen möglich, die auf die Niederlage verschiedener Organe und Systeme hinweisen: interstitielle Pneumonie, Enteritis und Colitis, polyzystische Bauchspeicheldrüse, Nephritis, Meningoenzephalitis, Hydrozephalus.
- Akute angeborene CMV-Infektion mit der Entwicklung eines offensichtlichen Cytomegalovirus-Syndroms neigt es zur Generalisierung, einem schweren Verlauf mit Hinzufügung von Sekundärinfektionen. In den ersten Lebenswochen eines Kindes ist der Tod oft unvermeidlich.
Chronische angeborene CMV-Infektion. Gekennzeichnet durch Mikrogyrie, Hydrozephalus, Mikrozephalie, Trübung der Linse und des Glaskörpers.
Erworbene CMV-Infektion.
- Bei Erwachsenen und älteren Kindern meist verläuft sie latent in Form eines asymptomatischen Verlaufs oder einer subklinischen Form mit chronischem Verlauf.
- Akute Form der erworbenen CMV-Infektion. Oft hat es keine klaren klinischen Symptome, manchmal ähneln die wichtigsten klinischen Manifestationen der Influenza, der infektiösen Mononukleose oder der Virushepatitis.
- Bei immungeschwächten Erwachsenen unterschiedlicher Schwere (von der physiologischen Immunsuppression während der Schwangerschaft bis zur HIV-Infektion) sowie bei Kindern unter 3 Jahren manifestiert sich die CMV-Reaktivierung in Form einer generalisierten Form mit verschiedenen Läsionen von Organen und Systemen. Der Prozess kann das Zentralnervensystem, die Lunge, die Leber, die Nieren, den Magen-Darm-Trakt, das Urogenitalsystem usw. betreffen. Die am häufigsten diagnostizierte Hepatitis, interstitielle Pneumonie, Enterokolitis, entzündliche Prozesse verschiedener Teile der Geschlechtsorgane (häufiger bei Frauen), Enzephalitis. Bei multiplen Organläsionen ist die Erkrankung durch einen schweren Verlauf gekennzeichnet, sie kann Züge einer Sepsis annehmen. Das Ergebnis ist oft ungünstig.
Geschwüre der Speiseröhre, des Magens, des Darms (dick und dünn) können sich entwickeln. Geschwüre können zu Blutungen führen, bei Perforation entwickelt sich eine Peritonitis. Cytomegalovirus-Hepatitis entwickelt sich oft. Bei AIDS-Patienten führt eine Cytomegalovirus-Infektion häufig zu einer chronischen Enzephalitis oder einer subakuten Enzephalopathie. Apathie baut sich auf und geht nach einigen Wochen oder Monaten in Demenz über. Das Cytomegalie-Virus kann die Entwicklung einer Retinitis verursachen, die bei AIDS-Patienten sowie bei Menschen, die sich einer Organtransplantation unterzogen haben, zur Erblindung führt. Auf der Netzhaut erscheinen Nekrosebereiche, die sich allmählich ausdehnen.
Augenläsionen müssen von ähnlichen Veränderungen unterschieden werden, die bei Toxoplasmose, Candidiasis und Herpesinfektion beobachtet werden.
Neben HIV-infizierten Patienten ist die Cytomegalovirus-Infektion ein wichtiger pathogenetischer Faktor, der Organtransplantationen erschwert. Bei der Transplantation von Nieren, Herz, Leber verursacht das Cytomegalovirus Fieber, Leukopenie, Hepatitis, Lungenentzündung, Kolitis, Retinitis. Meistens tritt dies innerhalb von 1-4 Monaten nach der Operation auf. Zu beachten ist, dass bei einer Primärinfektion die Komplikation schwerwiegender ist als bei der Aktivierung einer latenten Cytomegalovirus-Infektion. Die Schwere des Verlaufs und die klinischen Manifestationen hängen sowohl vom Grad der Immunsuppression als auch von den verwendeten Immunsuppressiva ab.
Cytomegalovirus-Pneumonie entwickelt sich bei etwa 20% der Patienten; sich einer Knochenmarktransplantation unterziehen. Die Sterblichkeit in dieser Patientengruppe beträgt 88%. Das maximale Krankheitsrisiko wird von der 5. bis zur 13. Woche nach der Transplantation beobachtet. Eine schwerere Zytomegalie tritt bei älteren Menschen auf. Bei Empfängern von Nierentransplantaten kann eine Cytomegalovirus-Infektion zu einer Fehlfunktion des Transplantats führen.
- Manifestationen einer Cytomegalovirus-Infektion bei schwangeren Frauen. Bei Schwangeren hat CMVI verschiedene klinische Formen. Bei einer akuten Infektion können sich Schäden an Leber, Lunge und Gehirn entwickeln. In der Regel klagen die Patienten über allgemeines Unwohlsein, Kopfschmerzen, Müdigkeit, Schleimausfluss aus der Nase, weißlich-blauen Ausfluss aus den Genitalien, Vergrößerung und Schmerzen der submandibulären Speicheldrüsen. Einige charakteristische Symptome manifestieren sich in einem Komplex: ausgeprägte Hypertonie des Uteruskörpers, resistent gegen laufende Therapie, Vaginitis, Kolpitis, Hypertrophie, Zysten und vorzeitige Alterung der Plazenta, Polyhydramnion. Vor diesem Hintergrund übersteigt das Gewicht des Fötus oft das Gestationsalter, und es gibt auch eine innige Anhaftung des Choriongewebes der Plazenta, eine vorzeitige Ablösung einer normal lokalisierten Plazenta, einen Blutverlust während der Geburt, der 1% des Körpers der Frau erreicht Gewicht, eine Klinik für latente postpartale Endometritis mit der Entwicklung von Menstruationsstörungen in der Zukunft.
Am häufigsten tritt eine Cytomegalovirus-Infektion als latente Infektion mit periodischen Exazerbationen auf. Bei der Diagnosestellung sind die Ergebnisse einer Laboruntersuchung entscheidend. Eine Nebenrolle spielen das Vorhandensein einer belasteten geburtshilflichen Vorgeschichte, die Gefahr des Abbruchs einer früheren Schwangerschaft, Frühgeburten, die Geburt kranker Kinder mit Fehlbildungen. Bei Frauen mit chronischer CMVI werden häufiger Pseudoerosion des Gebärmutterhalses, Endometritis, Funktionsstörungen der Eierstöcke, extragenitale Erkrankungen (Hepatitis, chronische Cholezystitis, Pankreatitis, Urolithiasis, chronische Sinusitis, Lungenentzündung, chronische Erkrankungen der submandibulären und parotiden Speicheldrüsen) festgestellt.
Alle Manifestationen einer CMV-Infektion gelten als Hinweis auf eine HIV-Infektion. In diesem Fall muss der Patient auf Antikörper gegen HIV untersucht werden.
Komplikationen einer Cytomegalovirus-Infektion
Komplikationen sind vielfältig und hängen vom klinischen Verlauf der Erkrankung ab: interstitielle oder segmentale Pneumonie, Pleuritis, Myokarditis, Arthritis, Enzephalitis, Guillain-Barré-Syndrom, sind aber relativ selten. Nach der akuten Phase bestehen über viele Wochen Asthenie, manchmal vegetativ-vaskuläre Störungen.
Diagnose einer Cytomegalovirus-Infektion
Differentialdiagnose einer CMV-Infektion aufgrund des Fehlens oder der Vielfalt klinischer Manifestationen eher schwierig.
Für Diagnose einer CMV-Infektion Es ist notwendig, 2-3 Labortests gleichzeitig zu verwenden. Untersuchen Sie Speichel, Spülungen aus der bronchopulmonalen Lavage, Urin, Liquor cerebrospinalis, Blut, Muttermilch, Schnittmaterial, Biopsieproben. Aufgrund der Thermolabilität des Virus muss das Forschungsmaterial spätestens vier Stunden nach der Probenahme im Labor angeliefert werden.
Die Untersuchung erfolgt mit virologischen, zytologischen, serologischen Methoden. Der Nachweis spezifisch veränderter CMB-Zellen ist die am besten zugängliche Methode, ihre Aussagekraft liegt jedoch bei 50-70%. Der zuverlässigste Nachweis im Material des Virus selbst oder seiner DNA. Die virologische Methode ist nach wie vor der Goldstandard. Es ist am zuverlässigsten, aber seine Durchführung erfordert einen erheblichen Zeitaufwand, sodass die retrospektive Art der Diagnose keine angemessene Therapie und Prävention zulässt.
Für die Diagnose ist es nicht erforderlich, das Virus selbst zu isolieren, es reicht aus, sein Antigen zu isolieren. Dafür werden Immunfluoreszenzreaktion (RIF), Enzymimmunoassay (ELISA), DNA-CMV-Hybridisierung, Polymerase-Kettenreaktion (PCR) weithin verwendet.
PCR-Verfahren Aufgrund seiner hohen Sensitivität erkennt es sogar einen Abschnitt der CMV-DNA und gilt als sehr fortschrittlich. Sein wichtigster Vorteil ist die Diagnosefähigkeit frühe Stufen Prozess, latente und anhaltende Infektion, hat jedoch zwei wesentliche Nachteile. Erstens geringer Vorhersagewert aufgrund der Tatsache, dass die PCR Virus-DNA auch in einem latenten Zustand nachweist. Zweitens ist diese Methode nicht spezifisch genug.
In den letzten Jahren am weitesten verbreitet ELISA-Methode, der den Nachweis von CMV-Antigen und spezifischen Antikörpern der Klassen G und M erlaubt. Der Nachweis von IgG ist von untergeordneter Bedeutung. Sie sollte gleichzeitig mit dem IgM-Nachweis durchgeführt werden, insbesondere zur Diagnose einer Primärinfektion. Bei einem einzigen IgG-Nachweis kann die Analyse ihres Aviditätsgrades (Fähigkeit, Antigen zurückzuhalten) bei der Unterscheidung zwischen aktiver und persistierender Infektion helfen.
Zu beachten ist, dass bei Personen mit verminderter Immunität, bei Eiweißmangel etc. keine spezifischen Antikörper nachweisbar sein können. Die IgG-Bestimmung muss in gepaarten Seren im Abstand von mindestens 10 Tagen erfolgen.
Die rezidivierende Form von CMVI wird diagnostiziert, wenn das Virus bei seropositiven Personen erneut isoliert wird.
Die Diagnose einer intrauterinen CMVI wird in den ersten drei Lebenswochen gestellt. Das Vorhandensein von IgM bei einem Neugeborenen bis zu zwei Lebenswochen weist auf eine intrauterine Infektion hin, nach - einer erworbenen.
Affinität und Avidität von Antikörpern
Die Bedeutung der Diagnose einer primären Cytomegalovirus-Infektion bei schwangeren Frauen hat zur Untersuchung der Eigenschaften von Antikörpern geführt, die vom Körper als Reaktion auf eine Infektion produziert werden.
Zwei Haupteigenschaften von Antikörpern wurden festgestellt:
Affinität - der Grad der spezifischen Affinität eines Antikörpers für das Antigen des Pathogens
Avidität – der Grad der Bindungsstärke eines Antikörpermoleküls an ein Antigenmolekül
Es wurde eine enge Beziehung zwischen ihnen festgestellt, je höher die Affinität, desto stärker bindet der Antikörper an das Antigen (höhere Avidität). Affinitäts- und Aviditätsgrade ermöglichen eine Altersbestimmung von Klasse-G-Antikörpern sowie eine Beurteilung der Infektionsdauer und des Infektionsverlaufs (latenter Verlauf, Rezidiv). Die primäre Phase der Infektion wird anhand des Vorhandenseins virusspezifischer IgM-Antikörper beurteilt, deren Anwesenheitsdauer im Körper mehrere Wochen - Monate beträgt. Innerhalb weniger Wochen kommt es zu einem Anstieg der IgG-Spiegel. Zunächst werden niederaffine Antikörper gebildet, die während der aktiven Vermehrung des Virus im Körper gebildet werden und bis zu 1,5 Monate persistieren. ab Krankheitsbeginn. Außerdem produziert der Körper IgG-Antikörper mit hoher Affinität, die lange bestehen bleiben. Hochaffine Antikörper bleiben lange im Körper und bieten Immunität gegen Infektionen.
Um zwischen primärer und latenter Infektion zu unterscheiden, Avidität von Klasse-G-Antikörpern. Wird ein niedriges avides IgG im Blut nachgewiesen, deutet dies auf eine Primärinfektion hin. Der Nachweis hochavider G-Antikörper weist auf eine latente oder vergangene Infektion hin. Sind hochavide G- und IgM-Antikörper im Körper vorhanden, so ist von einer Reaktivierung einer latenten Infektion oder einem Wiedereintritt des Virus in den Körper auszugehen. spricht von einer sekundären Immunantwort bei Erregereintritt oder Exazerbation (Reaktivierung).
Quantitativ wird der sogenannte Aviditätsindex bestimmt.
Aviditätsindex Bis zu 30 % weisen auf das Vorhandensein von niedrig-aviden Antikörpern und dementsprechend auf eine Primärinfektion hin, 30–40 % weisen auf ein spätes Stadium einer Primärinfektion oder eine kürzlich erfolgte Infektion hin, ein Index über 40 % weist auf eine langjährige Infektion hin.
Behandlung einer Cytomegalovirus-Infektion
Behandlung einer Cytomegalovirus-Infektion stellt gewisse Schwierigkeiten dar, da Interferon und viele antivirale Mittel (Aciclovir, Vidarabin, Virazol) unwirksam waren und in einigen Fällen ihre Verwendung paradoxe Reaktionen hervorruft. Ganciclovir verlangsamt die Entwicklung einer Cytomegalovirus-Retinitis, hat aber nur geringe Auswirkungen auf Läsionen der Lunge, des Gehirns und des Magen-Darm-Trakts. Foscarnet hat gewisse Aussichten. Vielleicht die Verwendung von Anticytomegalovirus-Hyperimmun-Human-Immunglobulin. Für die Behandlung von Frauen mit einer belasteten geburtshilflichen Vorgeschichte wird vorgeschlagen, Immunmodulatoren (Levamisol, T-Aktivin) zu verschreiben.
Mononukleose-ähnliche Infektionsformen bedürfen keiner besonderen Behandlung.
Zur Behandlung schwerer Formen von CMVI bei immungeschwächten Personen und intrauteriner CMVI bei Neugeborenen wird Ganciclovir angewendet. Es verbindet sich mit dem Reproduktionszyklus des Virus und unterbricht ihn. Nach Absetzen von Ganciclovir sind Rückfälle möglich. Das Medikament hat eine Reihe von Nebenwirkungen in Form von Neutropenie, Thrombozytopenie, Leber- und Nierenschäden und wird daher Kindern aus gesundheitlichen Gründen verschrieben. Die Behandlung wird alle zwei Tage unter Kontrolle einer Blutuntersuchung durchgeführt.
Die Ernennung von Interferonen gilt als wirksam.
Auf gegenwärtige Stufe Es ist wichtig, antivirale Medikamente mit Interferonen zu kombinieren, was zur Eliminierung von CMV beiträgt (Kombination von Aciclovir mit a-Interferon) und auch die antivirale Wirkung gegenseitig potenziert, die Toxizität von Medikamenten verringert (Ganciclovir mit Interferon-Induktoren, seine erfolgreichste Kombination mit Amixin). Gleichzeitig werden Medikamente verschrieben, um eine Fehlfunktion des Immunsystems zu korrigieren.
Spezifisches Anticytomegalovirus-Immunglobulin wird intramuskulär in 3 ml täglich für 10 Tage verabreicht. Es enthält 60 % CMV-spezifische Antikörper.
Unspezifische Immunglobuline zur intravenösen Verabreichung (Sandoglobulin) werden zur Vorbeugung von CMVI bei immungeschwächten Personen verschrieben. Ihre Wirksamkeit ist geringer als bei spezifischen Immunglobulinen.
Wirksam zur Prävention von CMVI bei seronegativen Empfängern ist die Anwendung von Immunglobulinen in Kombination mit Aciclovir oder Valaciclovir.
Verwenden Sie 0,25 % Bonafton, Oxolin, Rhyodoxol, 0,5 % Tebrofen, Florenal, 1 % Interferon, 3-5 % Aciclovir-Salbe 3-5 mal täglich für 12-15 Tage vaginal (Salben müssen alle 10-14 Tage gewechselt werden).
Zur Behandlung der Mundhöhle werden die gleichen Präparate in Form von Lösungen sowie 0,5% Atonium, 1:5000 Furatsilin, 1-5% Aminocapronsäure; mit Pilzkomplikationen - 1% Jodinol und 0,25% Rhyodoxol-Salbe.
Bei Retinitis, ZNS-Läsionen, Lungenentzündung bei immungeschwächten Personen sind Ganciclovir oder Foscarnet am wirksamsten, die Behandlungsdauer beträgt 14-21 Tage.
Prävention einer Cytomegalovirus-Infektion
Spezifische Prophylaxe nicht entwickelt. Bei Bluttransfusionen sollten Sie das Blut gesunder Spender verwenden, die keine Antikörper gegen CMV enthalten, dies gilt auch für die Transplantation innerer Organe. Gezeigt für die Verwendung mit vorbeugender Zweck spezifisches Hyperimmun-Immunglobulin in Risikogruppen (Knochenmark-, Herz-, Nieren- und Leberempfänger; Patienten, die Zytostatika erhalten, Schwangere). Bei der Prävention angeborener Infektionen kommt der Kontaktvermeidung zwischen Schwangeren und Patienten eine große Bedeutung zu. strikte Einhaltung Antiepidemieregime in geburtshilflichen Einrichtungen. Kinder von Müttern mit CMV-Infektion, die keine Anzeichen einer Infektion zeigen, sollten nicht gestillt werden. Bei der Geburt eines Kindes mit CMV-Infektion kann eine zweite Schwangerschaft frühestens nach 2 Jahren empfohlen werden.
Maßnahmen zur Vorbeugung einer CMV-Infektion bei Schwangeren
Keine Maßnahme kann das Infektionsrisiko vollständig beseitigen, aber die Einhaltung dieser Regeln wird die Wahrscheinlichkeit einer CMV-Infektion verringern.
1. Waschen Sie Ihre Hände 15-20 Minuten lang gründlich mit Seife, insbesondere nach dem Wickeln (Pampers) für Säuglinge
2. Küssen Sie Kinder unter 5 Jahren niemals auf die Lippen.
3. Stellen Sie getrenntes Geschirr und Besteck für sich und Kleinkinder bereit
4. Wenn Sie in Kindereinrichtungen (Krippen, Kindergärten) arbeiten, während der Schwangerschaft Urlaub nehmen oder den Kontakt zu Kindern drastisch einschränken.
Welche Ärzte sollten Sie aufsuchen, wenn Sie eine Cytomegalovirus-Infektion haben?
Infektiös
Aktionen und Sonderangebote
medizinische Nachrichten
14.11.2019
Experten sind sich einig, dass es notwendig ist, die Aufmerksamkeit der Öffentlichkeit auf die Probleme von Herz-Kreislauf-Erkrankungen zu lenken. Einige von ihnen sind selten, fortschreitend und schwer zu diagnostizieren. Dazu gehört zum Beispiel die Transthyretin-Amyloid-Kardiomyopathie.
14.10.2019
Am 12., 13. und 14. Oktober veranstaltet Russland eine groß angelegte soziale Kampagne für einen kostenlosen Blutgerinnungstest – den „INR-Tag“. Die Aktion ist zeitlich auf den Weltthrombosetag abgestimmt.
07.05.2019
Die Inzidenz von Meningokokken-Infektionen in der Russischen Föderation im Jahr 2018 (im Vergleich zu 2017) stieg um 10 % (1). Eine der häufigsten Methoden zur Vorbeugung Infektionskrankheiten- Impfung. Moderne Konjugatimpfstoffe zielen darauf ab, das Auftreten von Meningokokken-Erkrankungen und Meningokokken-Meningitis bei Kindern (auch sehr jungen Kindern), Jugendlichen und Erwachsenen zu verhindern.
Fast 5 % aller bösartigen Tumoren sind Sarkome. Sie zeichnen sich durch hohe Aggressivität, schnelle hämatogene Ausbreitung und Rezidivneigung nach Behandlung aus. Manche Sarkome entwickeln sich jahrelang, ohne etwas zu zeigen ...
Viren schweben nicht nur in der Luft, sondern können auch auf Handläufe, Sitze und andere Oberflächen gelangen, während sie ihre Aktivität aufrechterhalten. Daher ist es ratsam, auf Reisen oder an öffentlichen Orten nicht nur die Kommunikation mit anderen Personen auszuschließen, sondern auch ...
Wieder gut sehen und sich für immer von Brille und Kontaktlinsen zu verabschieden, ist der Traum vieler Menschen. Jetzt kann es schnell und sicher Wirklichkeit werden. Durch eine völlig berührungslose Femto-LASIK-Technik werden neue Möglichkeiten der Augenlaserkorrektur eröffnet.
Kosmetische Präparate zur Pflege unserer Haut und Haare sind möglicherweise nicht so sicher, wie wir denken.