Methan ist der Hauptbestandteil. Erdgas - CH4 (Methan)
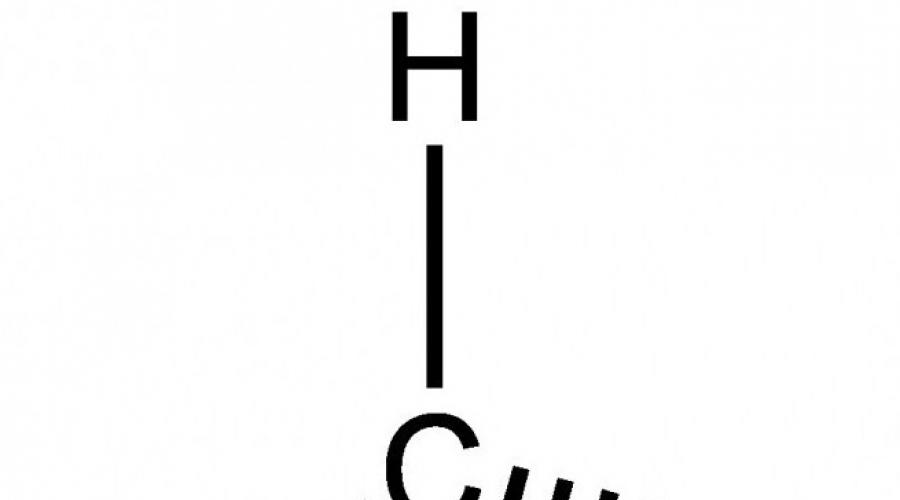
Lesen Sie auch
Im Wasser
blitzt
Selbstentzündung
Propan
Chlormethan
2. Molekülstruktur
Summenformel CH 4. Strukturelle und elektronische Formeln:
N | N-S-N | H
3. Chemische Eigenschaften
Das erste Mitglied der homologen Reihe gesättigter (Methan-)Kohlenwasserstoffe. Methan ist eine chemisch inaktive Substanz. Bei normale Bedingungen es ist recht beständig gegen Säuren, Laugen und Oxidationsmittel. Wenn also Methan durch eine Lösung von KMnO 4 geleitet wird, einem ziemlich starken Oxidationsmittel, oxidiert es nicht und die violette Farbe der Lösung verschwindet nicht. Methan geht keine Additionsreaktion (Botschaft) ein, da in seinem Molekül alle vier Valenzen des Kohlenstoffatoms vollständig gesättigt sind. Für Methan sind, wie auch für andere gesättigte Kohlenwasserstoffe, Substitutionsreaktionen typisch, bei denen Wasserstoffatome durch Atome anderer Elemente oder Atomgruppen ersetzt werden. Charakteristisch für Methan ist auch eine bei normalen Temperaturen unter Streulichteinfluss auftretende Reaktion mit Chlor (bei direkter Sonneneinstrahlung kann es zu einer Explosion kommen). Dabei werden die Wasserstoffatome im Methanmolekül sukzessive durch Chloratome ersetzt
- CH 4 + Cl 2 = CH 3 Cl + HCl
- CH 3 Cl + Cl 2 = CH 2 Cl 2 + HCl
- CH 2 Cl 2 + Cl 2 = CHCl 3 + HCl
- CHCl 3 + Cl 2 = CCl 4 + HCl
Als Ergebnis der Reaktion entsteht ein Gemisch aus Methanchloriden.
In der Luftatmosphäre verbrennt Methan mit einer farblosen Flamme und setzt dabei erhebliche Wärmemengen frei:
- CH 4 + 2O 2 = CO 2 + 2H 2 O
Methan bildet mit Luft ein brennbares, explosives Gemisch. Wenn Methan ohne Luftzugang auf eine Temperatur über 1000 °C erhitzt wird, zerfällt es in die Elemente Kohlenstoff (Ruß) und Wasserstoff:
- CH 4 = C + 2H 2
4. Verbreitung in der Natur
Methan ist der Hauptbestandteil:
- natürliche brennbare Gase (bis zu 99,5 %),
- zugehöriges Erdöl (39-91 %),
- Sumpf- (99 %) und Grubengase (34–48 %);
- in Gasen von Schlammvulkanen vorhanden (mehr als 95 %),
- kommt sporadisch in vulkanischen Gasen sowie in Gasen magmatischer und metamorpher Gesteine vor.
Im Wasser von Ozeanen, Meeren und Seen ist eine große Menge Methan gelöst. Der durchschnittliche Methangehalt in den Gewässern des Weltozeans beträgt etwa 10 -2 cm 3 / l, die Gesamtmenge beträgt 14,10 12 m 3. Die in Formationsgewässern gelöste Methanmenge ist mehrere Größenordnungen höher als ihre industriellen Reserven.
Methan kommt auch in der Atmosphäre der Erde, des Jupiter, des Saturn und des Uranus vor; in Gasen des Oberflächenbodens des Mondes. Der Großteil des Methans im Sommer und in der Hydrosphäre der Erde entstand bei der biochemischen und thermokatalytischen Zerstörung von dispergiertem organischem Material, Kohle und Öl. Bei der anaeroben Zersetzung entsteht Methan organische Substanz, insbesondere Zellulose (Methanfermentation).
In der Natur der Erde ist Methan weit verbreitet. Brennbare Erdgase bestehen zu 90-97 % aus Methan. Es bildet zahlreiche Lagerstätten, aus denen es gefördert und über Gasleitungen zum Einsatzort transportiert wird. Am Boden von Sümpfen und Teichen entsteht Methan durch die Zersetzung von Pflanzenresten ohne Luftzugang. Deshalb wird es auch Sumpfgas genannt. Unter dem Namen „Grubengas“ reichert sich Methan in Kohlebergwerken durch die Freisetzung aus Kohleschichten und Begleitgesteinen an, in denen es in freier und gebundener Form vorliegt. In aktiven Bergwerken wird die Freisetzung von Methan aus Kohleflözen in einer Menge von bis zu 70-80 m/t s beobachtet. B. m. (t s.b.m. - Tonne trockene aschefreie Masse), was eine eigenständige oder begleitende (Entgasung) Gewinnung aus Kohlevorkommen wirtschaftlich sinnvoll macht.
Brandgas ist sehr gefährlich, da es mit Luft ein explosionsfähiges Gemisch bilden kann. Die explosivsten Methankonzentrationen in der Luft liegen bei 9-14 %.
Bei niedrige Temperaturen Methan bildet Einschlussverbindungen – Gashydrate, die in der Natur weit verbreitet sind.
Biokraftstoffe VVVS Erzeugergase Koks Treibstoffe
Energie-Biorohstoffe
Methan wird in großen Mengen als praktischer und günstiger Treibstoff genutzt. Bei der unvollständigen Verbrennung von Methan entsteht Ruß, der zur Herstellung von Druckfarbe und als Gummifüllstoff verwendet wird, und bei der thermischen Zersetzung (über 1000 °C) entstehen Ruß und Wasserstoff, der zur Synthese von Ammoniak verwendet wird. Das Produkt der vollständigen Chlorierung von Methan – Tetrachlorkohlenstoff CCl 4 – ist ein gutes Lösungsmittel für Fette und wird zur Fettextraktion aus Ölsaatkörnern verwendet. Methan dient auch als Ausgangsstoff für die Herstellung von Acetylen, Methylalkohol und vielen anderen chemischen Produkten.
7. Methan als Faktor bei der Kohleförderung
M bildet mit Luft explosionsfähige Gemische. Bei einem Gehalt in der Luft von bis zu 5-6 % brennt M. in der Nähe einer Wärmequelle (Entzündungstemperatur beträgt 650-750 °C), bei einem Gehalt von 5-15,2 (16) % explodiert es, bei über 16 % kann es explodieren Bei Verbrennung unter Sauerstoffzufuhr ist eine Abnahme der M.-Konzentration explosionsartig. M. hat eine schwache narkotische Wirkung. MPC 300 mg/m3. Beim Kohleabbau stellt die Freisetzung von Metall in Grubenbaue eine besondere Gefahr dar. Es gibt drei Formen der Entlassung von M. in die Minen: regelmäßig, souffle und plötzlich. Basierend auf dem Methanvorkommen werden Minen gemäß den „Sicherheitsregeln für Kohle- und Schieferbergwerke“ in fünf Kategorien eingeteilt. Das Kriterium für eine solche Aufteilung ist die relative Methanhäufigkeit, d. h. die Methanmenge in Kubikmetern, die pro Tag pro 1 Tonne durchschnittlicher Tagesproduktion freigesetzt wird: bei Methanfreisetzung bis zu 5 m 3 / t, 5 - 10 m 3 / t, 10 - 15 m 3 / t; Superkategorie - mehr als 15 m 3 / t; gefährlich durch Soufflé-Sekrete. Minen, die gefährliche Flöze entwickeln oder plötzliche Ausbrüche von Kohle, Gas und Gestein bedrohen, gehören zu einer besonderen Kategorie – gefährlich aufgrund plötzlicher Ausbrüche. Die Gewinnung von Methan aus Kohleflözen gilt als vielversprechend (siehe Methangehalt eines Kohleflözes, Methan von Kohlevorkommen). Am Ende des zwanzigsten Jahrhunderts. Dieses Problem wurde erst in den USA von Wissenschaftlern vor ca. 40 Universitäten, ca. beteiligt. 100 Unternehmen. Auch in der Ukraine, im Donbass, gibt es erste industrielle Versuche, Begleitmethan (im Kohlebergbau) zu nutzen. In der Industrie wird Methan zur Herstellung von Synthesegas, Acetylen, Chloroform, Tetrachlorkohlenstoff, Ruß usw. verwendet. Die Produkte der partiellen Oxidation von Methan sind Ausgangsstoffe für die Herstellung von Kunststoffen für die organische Synthese.
Siehe auch
Quellen
Methan (Sumpfgas; CH 4) ist der einfachste gesättigte Kohlenwasserstoff. Farbloses, geruchloses Gas, Schmelzpunkt -182,48°. Methan entzündet sich leicht; Eine Mischung aus Methan und Luft ist explosiv.
Methan ist der Hauptbestandteil von Erdgas (60-99 %), Grubengas (35-40 %) sowie verschiedenen Produkten der anaeroben Zersetzung organischer Stoffe, wie Sumpfgas und Gase aus Bewässerungsfeldern. Methan entsteht in großen Mengen bei der Verkokung von Kohle, der Hydrierung von Kohle und anderen industriellen Prozessen.
Methan wird als Brennstoff für die Vergasung sowie für die industrielle Synthese von Kohlenwasserstoffen mit großen Molzahlen verwendet. Gewicht. Bei unvollständiger Verbrennung oder katalytischer Oxidation von Methan entsteht Methanol (siehe Methylalkohol), (siehe), Acetylen (siehe). Methan wird auch bei der Herstellung von Ruß, Methylchlorid, Chlorbrombenzol, Nitromethan und anderen Produkten verwendet.
Methan kommt in Darmgasen (als Folge der Methanvergärung) sowie im Blut von Tieren und Menschen vor.
Methan ist die reaktionsträgeste Verbindung aus der Gruppe der paraffinen Kohlenwasserstoffe. Physiologisch ist Methan indifferent und kann nur in sehr hohen Konzentrationen zu Vergiftungen führen (aufgrund der geringen Löslichkeit von Methan in Wasser und Blut). Allerdings tritt die toxische Wirkung von Methan auch bei geringeren Methankonzentrationen in der Luft auf. Wenn die Luft also 25–30 % Methan enthält, treten die ersten Anzeichen auf (erhöhte Herzfrequenz, erhöhtes Atemvolumen, beeinträchtigte Koordination feiner Muskelbewegungen usw.). Höhere Methankonzentrationen in der Luft verursachen Kopfschmerzen. Die volle toxische Wirkung von Methan tritt erst dann auf, wenn Bluthochdruck(2-3 atm).
Erste Hilfe für akute Vergiftung: Entfernen des Opfers aus der schädlichen Atmosphäre. Wärmflaschen. Bei Atemstillstand wird sofort (vor Eintreffen des Arztes) eine künstliche Beatmung durchgeführt, die erst nach Auftreten von Anzeichen einer Totenstarre beendet wird.
Chronische Wirkung von Methan. Bei Personen, die in oder in Industrien arbeiten, in denen Methan und andere Kohlenwasserstoffe der Methanreihe in der Luft vorhanden sind, wurden auffällige Veränderungen der Seite beschrieben (positiver Augen-Herz-Reflex, ausgeprägter Atropintest, ). Eine chronische Methanexposition verursacht jedoch keine schwerwiegenden organischen Veränderungen, obwohl einige Forscher das Auftreten von Nystagmus bei Bergleuten mit einer längeren Methanexposition in Verbindung bringen.
Vorbeugung einer Methanvergiftung. In Untertagebergwerken ist ein Methangehalt über 0,75 Vol.-% nicht zulässig. Bei einem Anstieg des Methangehalts müssen Arbeiter entfernt und die Räumlichkeiten gelüftet werden. Die wichtigste Maßnahme zur Verhinderung der Methanansammlung in Bergwerken ist eine gute Belüftung. Bei persönlicher Schutz Es ist erforderlich, Helme mit Zwangsluftversorgung oder Atemschutzgeräte mit Luftversorgung zu verwenden.
Molekulare, strukturelle und elektronische Formel Methan werden auf der Grundlage von Butlerovs Theorie der Struktur organischer Substanzen zusammengestellt. Bevor wir mit dem Schreiben solcher Formeln beginnen, beginnen wir mit kurze Beschreibung dieses Kohlenwasserstoffs.
Eigenschaften von Methan
Dieser Stoff ist explosiv und wird auch „Sumpfgas“ genannt. Der spezifische Geruch dieses gesättigten Kohlenwasserstoffs ist jedem bekannt. Beim Verbrennungsprozess bleiben keine chemischen Bestandteile zurück, die eine Wirkung haben negative Auswirkung auf den menschlichen Körper. Methan ist aktiv an der Entstehung des Treibhauseffekts beteiligt.
Physikalische Eigenschaften
Der erste Vertreter der homologen Reihe von Alkanen wurde von Wissenschaftlern in der Atmosphäre von Titan und Mars entdeckt. Angesichts der Tatsache, dass Methan mit der Existenz lebender Organismen in Verbindung gebracht wird, ist eine Hypothese über die Existenz von Leben auf diesen Planeten entstanden. Auf Saturn, Jupiter, Neptun und Uranus erschien Methan als Produkt der chemischen Verarbeitung von Stoffen anorganischen Ursprungs. Auf der Oberfläche unseres Planeten ist sein Inhalt unbedeutend.

allgemeine Charakteristiken
Methan hat keine Farbe, ist fast doppelt so leicht wie Luft und in Wasser schlecht löslich. Im Erdgas beträgt sein Anteil 98 Prozent. Es enthält 30 bis 90 Prozent Methan. Methan ist zu einem großen Teil biologischen Ursprungs.
Huftiere, Pflanzenfresser, Ziegen und Kühe, emittieren bei der Verarbeitung von Bakterien in ihrem Magen eine beträchtliche Menge Methan. Zu den wichtigen Quellen der homologen Reihe von Alkanen zählen Sümpfe, Termiten, die Filterung von Erdgas und der Prozess der pflanzlichen Photosynthese. Wenn auf einem Planeten Spuren von Methan nachgewiesen werden, können wir von der Existenz biologischen Lebens auf diesem Planeten sprechen.

Methoden zur Beschaffung
Die erweiterte Strukturformel von Methan bestätigt, dass sein Molekül nur gesättigte Einfachbindungen enthält, die durch Hybridwolken gebildet werden. Zu den Labormöglichkeiten zur Herstellung dieses Kohlenwasserstoffs zählen die Fusion von Natriumacetat mit festem Alkali sowie die Wechselwirkung von Aluminiumcarbid mit Wasser.
Methan verbrennt mit bläulicher Flamme und setzt dabei etwa 39 MJ pro Jahr frei Kubikmeter. Dieser Stoff bildet mit Luft explosionsfähige Gemische. Am gefährlichsten ist Methan, das beim Untertageabbau von Mineralvorkommen in Bergminen freigesetzt wird. In Kohleaufbereitungs- und Brikettfabriken sowie in Sortieranlagen besteht ein hohes Risiko einer Methanexplosion.
Physiologische Wirkung
Liegt der Methananteil in der Luft zwischen 5 und 16 Prozent, kann die Einwirkung von Sauerstoff zur Entzündung des Methans führen. Bei einem deutlichen Anstieg dieser Chemikalie im Gemisch steigt die Wahrscheinlichkeit einer Explosion.
Wenn die Konzentration dieses Alkans in der Luft 43 Prozent beträgt, kommt es zum Ersticken.
Bei einer Explosion beträgt die Ausbreitungsgeschwindigkeit 500 bis 700 Meter pro Sekunde. Nachdem Methan mit einer Wärmequelle in Kontakt gekommen ist, erfolgt die Entzündung des Alkans mit einiger Verzögerung.
Auf dieser Eigenschaft basiert die Produktion explosionsgeschützter elektrischer Geräte und sicherheitsexplosiver Komponenten.
Da Methan thermisch am stabilsten ist, wird es häufig in Form von Industrie- und Haushaltsbrennstoffen verwendet und wird auch als wertvoller Rohstoff für die chemische Synthese verwendet. Die Strukturformel von Triethylmethan charakterisiert die Strukturmerkmale von Vertretern dieser Kohlenwasserstoffklasse.
Bei seiner chemischen Wechselwirkung mit Chlor bei Einwirkung von ultravioletter Strahlung ist die Bildung mehrerer Reaktionsprodukte möglich. Abhängig von der Menge des Ausgangsstoffs ist es möglich, bei der Substitution Chlormethan, Chloroform oder Tetrachlorkohlenstoff zu erhalten.
Bei unvollständiger Verbrennung von Methan entsteht Ruß. Bei der katalytischen Oxidation entsteht Formaldehyd. Das Endprodukt der Wechselwirkung mit Schwefel ist Schwefelkohlenstoff.

Merkmale der Struktur von Methan
Wie lautet seine Strukturformel? Methan ist ein gesättigter Kohlenwasserstoff mit allgemeine Formel C n H 2n+2 . Betrachten wir die Merkmale der Bildung des Moleküls, um zu erklären, wie die Strukturformel gebildet wird.
Methan besteht aus einem Kohlenstoffatom und vier Wasserstoffatomen, die durch eine kovalente polare chemische Bindung miteinander verbunden sind. Lassen Sie uns die Strukturformeln anhand der Struktur des Kohlenstoffatoms erklären.
Art der Hybridisierung
Die räumliche Struktur von Methan ist durch eine tetraedrische Struktur gekennzeichnet. Da Kohlenstoff auf seiner äußeren Ebene über vier Valenzelektronen verfügt, wechselt beim Erhitzen des Atoms ein Elektron vom zweiten s-Orbital zum p. Als Ergebnis endlich Energielevel Kohlenstoff hat vier ungepaarte („freie“) Elektronen. Die vollständige Strukturformel von Methan basiert auf der Bildung von vier Hybridwolken, die im Raum in einem Winkel von 109 Grad 28 Minuten ausgerichtet sind und eine Tetraederstruktur bilden. Als nächstes überlappen sich die Spitzen der Hybridwolken mit Nicht-Hybridwolken aus Wasserstoffatomen.
Die vollständige und abgekürzte Strukturformel von Methan entspricht vollständig der Theorie von Butlerov. Zwischen Kohlenstoff und Wasserstoff entsteht eine einfache (Einfach-)Bindung, daher sind Additionsreaktionen für diesen chemischen Stoff nicht typisch.
Die endgültige Strukturformel ist unten dargestellt. Methan ist der erste Vertreter der Klasse der gesättigten Kohlenwasserstoffe typische Eigenschaften gesättigtes Alkan. Die Struktur- und Elektronenformel von Methan bestätigt die Art der Hybridisierung des Kohlenstoffatoms in dieser organischen Substanz.

Aus einem Schulchemiekurs
Diese Klasse von Kohlenwasserstoffen, für die „Sumpfgas“ ein Vertreter ist, wird im Kurs der 10. Klasse untersucht weiterführende Schule. Den Kindern wird beispielsweise folgende Aufgabe gestellt: „Schreiben Sie die Strukturformeln von Methan.“ Es ist notwendig zu verstehen, dass für diese Substanz nach Butlerovs Theorie nur eine detaillierte Strukturkonfiguration beschrieben werden kann.
Seine abgekürzte Formel wird mit der molekularen Formel übereinstimmen, geschrieben als CH4. Gemäß den neuen föderalen Bildungsstandards, die im Zusammenhang mit der Neuordnung des russischen Bildungswesens eingeführt wurden, werden im Grundkurs Chemie alle Fragen im Zusammenhang mit den Eigenschaften von Klassen organischer Substanzen behandelt.
Industrielle Synthese
Basierend auf Methan sind industrielle Methoden für eine solche wichtige chemische Komponente, wie Acetylen. Die Grundlage des thermischen und elektrischen Crackens war genau seine Strukturformel. Methan bildet bei der katalytischen Oxidation mit Ammoniak Blausäure.
Dieser organische Stoff wird zur Herstellung von Synthesegas verwendet. Bei der Wechselwirkung mit Wasserdampf entsteht eine Mischung Kohlenmonoxid und Wasserstoff, der der Rohstoff für die Herstellung gesättigter Carbonylverbindungen ist.
Von besonderer Bedeutung ist die Interaktion mit Salpetersäure, was zu Nitromethan führt.

Anwendung in Form von Autokraftstoff
Aufgrund der Verknappung natürlicher Kohlenwasserstoffquellen sowie der Erschöpfung der Rohstoffbasis ist die Frage nach der Suche nach neuen (alternativen) Quellen zur Kraftstoffgewinnung von besonderer Relevanz. Eine dieser Optionen enthält Methan.
Angesichts des Dichteunterschieds zwischen Benzinkraftstoff und dem ersten Vertreter der Alkanklasse gibt es bestimmte Merkmale seiner Verwendung als Energiequelle Automotoren. Um den Transport großer Methanmengen zu vermeiden, wird seine Dichte durch Kompression (bei einem Druck von etwa 250 Atmosphären) erhöht. Methan wird in verflüssigtem Zustand in in Autos eingebauten Zylindern gespeichert.
Auswirkungen auf die Atmosphäre
Oben bereits erwähnt wurde, dass Methan einen Einfluss hat Treibhauseffekt. Nimmt man den Grad der Klimawirkung von Kohlenmonoxid (4) konventionell als eins an, so beträgt der Anteil des „Sumpfgases“ daran 23 Einheiten. Wissenschaftler haben in den letzten zwei Jahrhunderten einen Anstieg des quantitativen Methangehalts in der Erdatmosphäre beobachtet.
An dieser Moment die ungefähre Menge an CH4 wird auf 1,8 ppm geschätzt. Trotz der Tatsache, dass diese Zahl 200-mal geringer ist als die Präsenz Kohlendioxid, darüber gibt es ein Gespräch zwischen Wissenschaftlern mögliches Risiko die vom Planeten abgegebene Wärme zurückzuhalten.
Aufgrund des hervorragenden Heizwerts von „Sumpfgas“ wird es nicht nur als Ausgangsstoff für die chemische Synthese, sondern auch als Energiequelle genutzt.
Zum Beispiel verschiedene Gaskessel, Lautsprecher für individuelle Heizsysteme in Privathäusern und Landhäusern.
Diese autonome Heizoption ist für Hausbesitzer sehr vorteilhaft und nicht mit Unfällen verbunden, die in Zentralheizungen systematisch passieren Heizsysteme. Dank eines Gaskessels, der mit diesem Brennstoff betrieben wird, reichen 15 bis 20 Minuten aus, um ein zweistöckiges Häuschen vollständig zu heizen.

Abschluss
Methan, dessen Struktur- und Molekularformeln oben angegeben wurden, ist natürliche Quelle Energie. Aufgrund der Tatsache, dass er nur ein Kohlenstoffatom und Wasserstoffatome enthält, erkennen Umweltschützer die Umweltsicherheit dieses gesättigten Kohlenwasserstoffs an.
Unter Standardbedingungen (Lufttemperatur 20 Grad Celsius, Druck 101325 Pa) ist dieser Stoff gasförmig, ungiftig und wasserunlöslich.
Wenn die Lufttemperatur auf -161 Grad sinkt, wird Methan komprimiert, das in der Industrie weit verbreitet ist.
Methan beeinträchtigt die menschliche Gesundheit. Es ist keine giftige Substanz, gilt aber als erstickendes Gas. Für den Gehalt dieser Chemikalie in der Atmosphäre gibt es sogar Höchstnormen (Grenzwerte für die maximale Konzentration).
Beispielsweise ist die Arbeit in Bergwerken nur dann erlaubt, wenn die Menge 300 Milligramm pro Kubikmeter nicht überschreitet. Wenn wir die Strukturmerkmale dieser organischen Substanz analysieren, können wir den Schluss ziehen, dass sie chemisch und ähnlich ist physikalische Eigenschaften mit allen anderen Vertretern der Klasse der gesättigten (gesättigten) Kohlenwasserstoffe.
Wir haben die Strukturformeln und die räumliche Struktur von Methan analysiert. was mit „Sumpfgas“ beginnt, hat eine Gemeinsamkeit Molekularformel C n H 2n+2 .
Das Kohlenstoffatom im Methanmolekül befindet sich im Zustand der sp3-Hybridisierung. Durch die Überlappung der vier Hybridorbitale des Kohlenstoffatoms mit den s-Orbitalen der Wasserstoffatome entsteht ein sehr starkes Methanmolekül.
Methangas ist farb- und geruchlos, leichter als Luft und schwer wasserlöslich. Gesättigte Kohlenwasserstoffe können brennen und dabei Kohlenmonoxid (IV) und Wasser bilden. Methan brennt mit einer blassblauen Flamme: CH4 + 2O2 = 2H2O
Beim Mischen mit Luft (oder mit Sauerstoff, insbesondere im Volumenverhältnis 1:2, wie aus der Reaktionsgleichung hervorgeht) bildet Methan explosive Gemische. Daher ist es sowohl im Alltag (Gasaustritt durch Wasserhähne) als auch gefährlich in Bergwerken. Bei unvollständiger Verbrennung entsteht aus Methan Ruß. So entsteht es unter industriellen Bedingungen. In Gegenwart von Katalysatoren wird es bei der Oxidation von Methan gewonnen Methylalkohol und Formaldehyd
Bei starker Erhitzung zersetzt sich Methan nach der Gleichung: CH4=C+2H2
In speziell konstruierten Öfen kann die Zersetzung von Methan zum Zwischenprodukt Acitelen durchgeführt werden:
2CH4=C2H 2+3H2
Methan zeichnet sich durch Substitutionsreaktionen aus. Im Licht oder bei normaler Temperatur verdrängen Halogene – Chlor und Brom – nach und nach (in Stufen) Wasserstoff aus dem Methanmolekül und bilden sogenannte Halogenderivate. Chloratome ersetzen darin Wasserstoffatome und bilden ein Mischung verschiedener Verbindungen:
CH3Cl-Chlormethan (Methylchlorid),CH2Cl2-Dichlormethan, CHCl3-Trichlormethan, CCl4-Tetrachlormethan
Aus dieser Mischung kann jede Verbindung isoliert werden. Chloroform und Tetrachlorkohlenstoff sind wichtig als Lösungsmittel für Harze, Fette, Gummi und andere organische Substanzen.
Die Bildung von Halogenderivaten von Methan erfolgt über einen Kettenmechanismus freier Radikale. Unter dem Einfluss von Licht zerfallen Chlormoleküle in anorganische Radikale: Cl2 = 2Cl
Das anorganische Radikal Cl entfernt ein Wasserstoffatom mit einem Elektron aus dem Methanmolekül und bildet HCl und das freie Radikal CH3 H H
H:C_| H+Cl=H:C +HCl
H| H
Das freie Radikal interagiert mit dem Chlormolekül Cl2 und bildet ein Halogenderivat und ein Chlorradikal:
CH3+Cl_| Cl=CH3-Cl+Cl
Methan ist bei normalen Temperaturen beständiger gegen Säuren, Laugen und viele Oxidationsmittel. Allerdings reagiert es mit Salpetersäure:
CH4+HNO3=CH3NO2 +H2O
Nitromethan
Methan ist nicht zu Additionsreaktionen fähig, da alle Valenzen in seinem Molekül gesättigt sind.
Die oben genannten Substitutionsreaktionen gehen mit der Spaltung von C-H-Bindungen einher. Es sind jedoch Prozesse bekannt, bei denen nicht nur die Spaltung von C-H-Bindungen, sondern auch der Bruch der Kette von Kohlenstoffatomen (in Methan-Homologen) erfolgt. Diese Reaktionen laufen bei hohen Temperaturen ab Temperaturen und in Gegenwart von Katalysatoren. Zum Beispiel:
C4H10+H2 – Dehydrierungsprozess
C4H10-|
C2H6 + C2H4 Rissbildung
Methan produzieren.
Methan ist in der Natur weit verbreitet. Es ist das Hauptgas Bestandteil Viele brennbare Gase, sowohl natürliche (90-98 %) als auch künstliche, werden bei der Trockendestillation von Holz, Torf, Kohle sowie beim Ölcracken freigesetzt
Methan wird vom Boden von Sümpfen und aus Kohleflözen in Bergwerken freigesetzt, wo es bei langsamer Zersetzung entsteht Pflanzenreste ohne Luftzugang. Daher wird Methan oft als Sumpfgas oder Schlagwetter bezeichnet
Unter Laborbedingungen wird Methan durch Erhitzen einer Mischung aus Natriumacetat und Natriumhydroxid gewonnen:
200 *C
CH3|COONa +NaO|H=Na2CO3 + CH4|
oder wenn Aluminiumcarbid mit Wasser interagiert:
Al4C3 +12H2O=4Al(OH)3 +3CH4|
Im letzteren Fall erweist sich das Methan als sehr rein.
Methan kann aus einfachen Stoffen durch Erhitzen in Gegenwart eines Katalysators hergestellt werden: Ni
C+2H2=CH4
Und auch durch Synthese auf Basis von Wassergas
Ni
CO+3H2 =CH4 +H2O
Homologe von Methan werden wie Methan unter Laborbedingungen durch Kalzinierung von Salzen der entsprechenden organischen Säuren mit Alkalien erhalten. Eine andere Methode ist die Wurtz-Reaktion, d.h. Erhitzen von Monohalogenderivaten mit Natriummetall, z.B.
C2H5 |Br+2Na+Br|C2H5= C2H5-C2H5+2NaBr
In der Technik wird zur Herstellung von synthetischem Benzin (einem Kohlenwasserstoffgemisch mit 6–10 Kohlenstoffatomen) eine Synthese aus Kohlenmonoxid (II) und Wasserstoff in Gegenwart eines Katalysators (Kobaltverbindung) und bei erhöhtem Druck eingesetzt. Das Verfahren kann sein ausgedrückt durch die Gleichung:
200*С
nCO+(2n+1)H2=CnH2n+2+nH2O
Anwendungen von Alkanen
Aufgrund seines hohen Heizwerts wird Methan in großen Mengen als Brennstoff (in Haushaltsgas und in der Industrie) verbraucht. Die daraus gewonnenen Stoffe sind weit verbreitet: Wasserstoff, Acitelen, Ruß. Es dient als Ausgangsrohstoff für die Herstellung von Formaldehyd, Methylalkohol sowie verschiedene synthetische Produkte
Von großer industrieller Bedeutung ist die Oxidation höher gesättigter Kohlenwasserstoffe – Paraffine mit einer Kohlenstoffzahl von 20–25. Auf diese Weise werden synthetische Fettsäuren mit unterschiedlichen Kettenlängen gewonnen, die zur Herstellung von Seifen, verschiedenen Waschmitteln und Schmiermitteln verwendet werden , Lacke und Emails.
Als Kraftstoff werden flüssige Kohlenwasserstoffe verwendet (sie sind Bestandteil von Benzin und Kerosin). Alkane werden häufig in der organischen Synthese verwendet.
Physikalisch-chemische Eigenschaften Methan
Gefährliche Verunreinigungen in der Grubenluft
Zu den giftigen Verunreinigungen der Grubenluft zählen Kohlenmonoxid, Stickoxide, Schwefeldioxid und Schwefelwasserstoff.
Kohlenmonoxid (CO) – ein farb-, geschmacks- und geruchloses Gas mit einem spezifischen Gewicht von 0,97. Brennt und explodiert bei Konzentrationen von 12,5 bis 75 %. Zündtemperatur, bei einer Konzentration von 30 %, 630-810 0 C. Sehr giftig. Tödliche Konzentration – 0,4 %. Zulässige Konzentration in Bergwerken - 0,0017 %. Die wichtigste Hilfe bei Vergiftungen ist die künstliche Beatmung mit frischer Luft.
Kohlenmonoxidquellen sind Sprengungen und Motorbetrieb Verbrennungs, Minenbrände und Explosionen von Methan und Kohlenstaub.
Stickoxide (NO)- haben eine braune Farbe und einen charakteristischen stechenden Geruch. Sehr giftig, verursacht Reizungen der Schleimhäute der Atemwege und Augen sowie Lungenödeme. Die tödliche Konzentration beträgt bei kurzfristiger Inhalation 0,025 %. Der maximale Gehalt an Stickoxiden in der Grubenluft sollte 0,00025 % (bezogen auf Dioxid - NO 2) nicht überschreiten. Für Stickstoffdioxid – 0,0001 %.
Schwefeldioxid (SO 2)– farblos, mit stark reizendem Geruch und saurer Geschmack. 2,3-mal schwerer als Luft. Sehr giftig: Reizt die Schleimhäute der Atemwege und der Augen, verursacht Entzündungen der Bronchien, Schwellungen des Kehlkopfes und der Bronchien.
Schwefeldioxid entsteht bei Sprengungen (in schwefelhaltigen Gesteinen) und Bränden und wird aus Gesteinen freigesetzt.
Der maximale Gehalt in der Grubenluft beträgt 0,00038 %. Eine Konzentration von 0,05 % ist lebensgefährlich.
Schwefelwasserstoff (H 2 S)- ein farbloses Gas mit süßlichem Geschmack und dem Geruch von faulen Eiern. Spezifisches Gewicht– 1.19. Schwefelwasserstoff brennt und explodiert bei einer Konzentration von 6 %. Sehr giftig, reizt die Schleimhäute der Atemwege und der Augen. Tödliche Konzentration – 0,1 %. Erste Hilfe bei Vergiftungen ist künstliche Beatmung mit einem frischen Strahl, Inhalation von Chlor (mit einem in Bleichmittel getränkten Taschentuch).
Schwefelwasserstoff wird aus Gesteinen und Mineralquellen freigesetzt. Es entsteht beim Zerfall organischer Stoffe, bei Bergwerksbränden und bei Sprengungen.
Schwefelwasserstoff ist in Wasser gut löslich. Dies muss berücksichtigt werden, wenn sich Menschen durch verlassene Betriebe bewegen.
Der zulässige Gehalt an H 2 S in der Grubenluft sollte 0,00071 % nicht überschreiten.
Vorlesung 2
Methan und seine Eigenschaften
Methan ist der wichtigste und häufigste Bestandteil von Schlagwetter. In der Literatur und in der Praxis wird Methan am häufigsten mit Schlagwettergas gleichgesetzt. In der Grubenbelüftung findet dieses Gas aufgrund seiner explosiven Eigenschaften die größte Beachtung.
Physikalisch-chemische Eigenschaften von Methan.
Methan (CH 4)– ein Gas ohne Farbe, Geschmack und Geruch. Dichte – 0,0057. Methan ist inert, kann aber durch die Verdrängung von Sauerstoff (die Verdrängung erfolgt im folgenden Verhältnis: 5 Volumeneinheiten Methan ersetzen 1 Volumeneinheit Sauerstoff, also 5:1) eine Gefahr für den Menschen darstellen. Es entzündet sich bei einer Temperatur von 650-750 0 C. Methan bildet mit Luft brennbare und explosionsfähige Gemische. Wenn es bis zu 5-6 % in der Luft enthalten ist, verbrennt es an einer Wärmequelle, von 5-6 % bis 14-16 % explodiert es, über 14-16 % explodiert es nicht. Größte Stärke Explosion bei einer Konzentration von 9,5 %.
Eine der Eigenschaften von Methan ist die Verzögerung des Blitzes nach Kontakt mit der Zündquelle. Die Blitzverzögerungszeit wird aufgerufen induktiv Zeitraum. Das Vorhandensein dieses Zeitraums schafft Voraussetzungen für die Verhinderung von Ausbrüchen bei Sprengungen mit Sicherheitssprengstoffen (HE).
Der Gasdruck am Explosionsort ist etwa neunmal höher als der Anfangsdruck des Gas-Luft-Gemisches vor der Explosion. Dadurch kann ein Druck von bis zu 30 entstehen bei und höher. Verschiedene Hindernisse im Grubenbau (Verengungen, Vorsprünge etc.) tragen zu einer Druckerhöhung bei und erhöhen die Ausbreitungsgeschwindigkeit der Druckwelle im Grubenbau.