L'apoptose est la mort cellulaire génétiquement programmée. apoptose
Lire aussi
Lorsque l'apoptose se produit peut être divisé en quatre étapes.
Initiation -> Programmation -> Mise en œuvre du programme -> Élimination des cellules mortes
Stades de l'apoptose Stade d'initiation
A ce stade, les informations les signaux sont reçus par la cellule. Un agent pathogène est soit lui-même un signal, soit provoque la génération d'un signal dans la cellule et sa conduction vers des structures et des molécules régulatrices intracellulaires.
Initier l'apoptose les stimuli peuvent être transmembranaires ou intracellulaires.
Signaux transmembranaires subdivisé en négatif, positif et mixte.
- Signaux négatifs: l'absence ou la cessation de l'effet sur la cellule des facteurs de croissance, des cytokines qui régulent la division et la maturation cellulaire, ainsi que des hormones qui contrôlent le développement cellulaire. Normalement, l'action des groupes ci-dessus de substances biologiquement actives sur les récepteurs membranaires assure la suppression programmes de mort cellulaire et leurs activités normales. Au contraire, leur absence ou leurs effets réduits « libèrent » le programme apoptotique. Ainsi, pour le fonctionnement normal d'un certain nombre de neurones, la présence constante de facteurs neurotrophiques est nécessaire. Leur élimination ou réduction des effets sur les cellules nerveuses peut conduire à l'activation du programme de mort neuronale. - Des signaux positifs finissent par générer démarrer le programme d'apoptose. Ainsi, la liaison de FIO (FasL) à son récepteur membranaire CD95 (Fas) active le programme de mort cellulaire. - signaux mixtes sont une combinaison des effets des signaux des premier et deuxième groupes. Ainsi, des lymphocytes stimulés par un mitogène, mais non exposés à un Ag étranger, subissent une apoptose. Les lymphocytes qui ont été affectés par l'antigène, mais qui n'ont pas reçu d'autres signaux, tels que mitogène ou de HLA, meurent également.
Parmi les intracellulaires stimuli d'apoptose un excès de H +, des radicaux libres de lipides et d'autres substances, de la fièvre, des virus intracellulaires et des hormones qui réalisent leur effet via des récepteurs nucléaires (par exemple, les glucocorticoïdes) ont été enregistrés.
Apoptose : le stade de l'initiation.
Phase de programmation
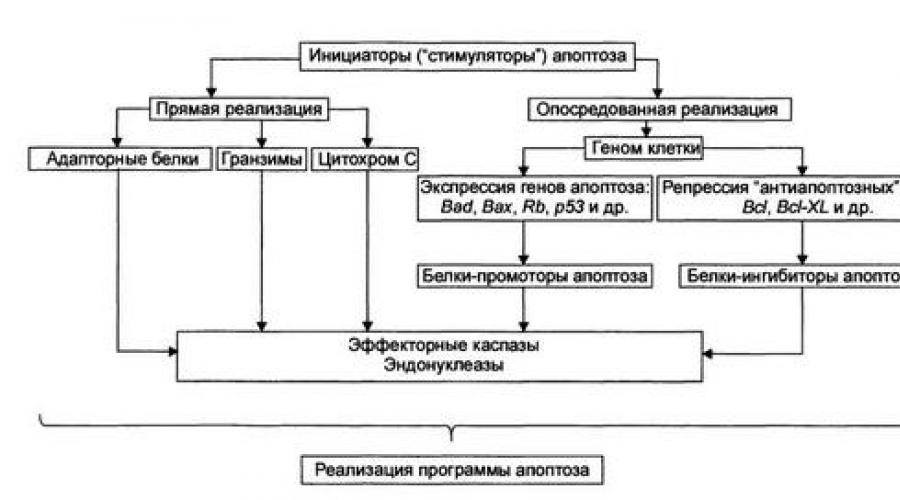
Phase de programmation(contrôle et intégration des processus d'apoptose) est représenté sur la figure.
A ce stade, des protéines spécialisées soit signal d'apoptose en activant le programme exécutif (ses effecteurs sont les protéases à cystéine - caspases et endonucléases), ou en bloquant un signal potentiellement mortel.
Il y a deux (non exclusifs) mise en place des étapes de programmation: 1) par activation directe des caspases et endonucléases effectrices (contournant le génome cellulaire) et 2) transduction du signal médiée par le génome en caspases et endonucléases effectrices.
Transmission directe des signaux réalisée à travers des protéines adaptatrices, des granzymes et du cytochrome C.
Protéines adaptatrices. Par exemple, la caspase-8 agit comme une protéine adaptatrice. C'est ainsi que les cytokines des lymphocytes T tueurs vis-à-vis des cellules étrangères, TNF et autres ligands du CD95 réalisent leur action.
Cytochrome C. Libéré des mitochondries, le cytochrome C, avec la protéine Apaf-1 et la caspase-9, forme un complexe d'activation (apoptosome) des caspases effectrices. La caspase-8 et la caspase-9 activent les caspases effectrices (par exemple, la caspase-3), qui sont impliquées dans la protéolyse des protéines.
Granzymes. Ces protéases sécrètent des lymphocytes T cytotoxiques, les protéases pénètrent dans les cellules cibles par les pores cytoplasmiques préalablement formés par les perforines. Les granzymes activent les protéases à cystéine spécifiques de l'aspartate de la cellule cible en apoptose.
Transmission directe des signaux Il est généralement observé dans les cellules non nucléaires, par exemple dans les érythrocytes.

Apoptose : la phase de programmation.
Transmission indirecte du signal implique la répression des gènes codant pour les inhibiteurs de l'apoptose et l'activation des gènes codant pour les promoteurs de l'apoptose.
Protéines inhibitrices de l'apoptose(par exemple, les produits d'expression des gènes anti-apoptotique Bcl-2, Bcl-XL) bloquent l'apoptose (par exemple, en réduisant la perméabilité des membranes mitochondriales, réduisant ainsi la probabilité de l'un des facteurs déclenchant de l'apoptose, le cytochrome C, entrant dans le cytosol).
Protéines promotrices de l'apoptose(par exemple, les protéines dont la synthèse est contrôlée par les gènes Bad, Box, les anti-oncogènes Rb ou /t53) activent les caspases effectrices et les endonucléases.
Définition de l'apoptose. L'apoptose est un phénomène de mort cellulaire héréditairement programmée. Chaque cellule à sa naissance est, pour ainsi dire, programmée pour s'autodétruire. La condition de sa vie est de bloquer ce programme suicidaire.
L'apoptose est réalisée pour les cellules :
Vieux, obsolète;
Cellules à différenciation altérée ;
Cellules atteintes de troubles de l'appareil génétique;
Cellules infectées par des virus.
Signes morphologiques de l'apoptose.
Rides de la cellule ;
Condensation et fragmentation du noyau;
Destruction du cytosquelette ;
saillie bulleuse membrane cellulaire.
Une caractéristique de l'apoptose est l'apoptose ne provoque pas d'inflammation dans les tissus environnants.La raison en est la sécurité de la membrane et → l'isolement des facteurs dommageables du cytoplasme jusqu'à ce que le processus soit terminé (O 2 -, H 2 O 2, enzymes lysosomales). Cette caractéristique est une caractéristique positive importante de l'apoptose, contrairement à la nécrose. Dans la nécrose, la membrane est endommagée (ou rompue) immédiatement. Par conséquent, lors de la nécrose, le contenu du cytoplasme est libéré (O 2 -, H 2 O 2, enzymes lysosomales). Il y a des dommages aux cellules voisines et un processus inflammatoire. Caractéristique importante apoptose - l'élimination des cellules mourantes se produit sans développement d'inflammation.
Le processus d'apoptose peut être divisé en 2 (deux) phases :
1. Formation et conduction des signaux apoptotiques - la phase de prise de décision.
2. Démantèlement des structures cellulaires - phase effectrice.
1ère phase - prise de décision (= formation et acceptation des signaux apoptotiques). C'est la phase d'acceptation des stimuli pour l'apoptose. Selon la nature des stimuli, il peut y avoir 2 (deux) types de voies de signalisation :
1) Dommages à l'ADN sous l'effet des rayonnements, de l'action d'agents toxiques, de glucocorticoïdes, etc.
2) activation des récepteurs de la "région de la mort cellulaire". Les récepteurs de la région de la mort cellulaire sont un groupe de récepteurs sur les membranes de toutes les cellules qui perçoivent des stimuli pro-apoptotiques. Si le nombre et l'activité de ces récepteurs augmentent, alors le nombre de cellules mourantes par apoptie augmente. Les récepteurs de la région de mort cellulaire comprennent : a) le TNF-R (se lie au facteur de nécrose tumorale et active l'apoptose) ; b) Fas-R (j); c) CD45-R (se lie aux anticorps et active l'apoptose).
Selon le type de signal, il existe 2 (deux) voies principales d'apoptose : a) à la suite de dommages à l'ADN ;
b) à la suite de l'auto-activation des récepteurs de la "région de la mort cellulaire" sans dommage à l'ADN.
2ème phase - effecteur (= démantèlement des structures cellulaires. Les principales personnes impliquées dans la phase effectrice :
Protéases à cystéine (caspases);
endonucléases ;
Sérine et protéases lysosomales ;
Protéases activées par Ca++ (calpéine)
Mais! Parmi eux, les principaux effecteurs du démantèlement des structures cellulaires sont les caspases.
Classification Caspase - 3 (trois) groupes :
Caspases effectrices - caspases 3, 6, 7.
Inducteurs d'activation des caspases effectrices - caspases 2, 8, 9, 10. = Activateurs de cytokines - caspases 1, 4, 5, 13.
Caspases effectrices - caspases 3, 6, 7. Ce sont des exécuteurs directs de l'apoptose. Ces caspases sont inactives dans la cellule. Les caspases effectrices activées déclenchent une chaîne d'événements protéolytiques visant à démanteler la cellule. Ils sont activés par des inducteurs d'activation des caspases effectrices.
Inducteurs d'activation des caspases effectrices - caspases 2, 8, 9, 10. Les principaux inducteurs sont les caspases 8 et 9. Ils activent les caspases effectrices. Le mécanisme est le clivage des bases aspartiques suivi d'une dimérisation des sous-unités actives. Ces caspases sont normalement inactives dans les cellules et existent sous forme de procaspases.
L'activation de certains inducteurs dépend du type de voie de signalisation :
1. Lorsque l'ADN est endommagé, la voie de signalisation n°1 est activée, la caspase n°9 est activée.
2. Lorsque les récepteurs de mort cellulaire sont activés, la voie de signalisation n° 2 est activée, la caspase n° 8 est activée.
Voie de signalisation #1 (associée à des dommages à l'ADN)
Dommages à l'ADN
Activation du gène p53 et production de la protéine correspondante
Activation des gènes pro-apoptotiques de la famille BCL-2 (BAX et BID)
Formation des protéines de ces gènes
Activation de la caspase 9
Activation de la caspase 3
Chemin du signal #2
(associé à l'activation de la "région de la mort cellulaire")
Ligand + récepteurs de la "région de la mort cellulaire"
Activation de la caspase #8
Activation indépendante de la caspase #3
Activation d'autres caspases et protéases
régulation de l'apoptose. Rechercher ces dernières années conduit à la création d'un modèle d'apoptose. Selon ce modèle, chaque cellule à sa naissance est programmée pour s'autodétruire. Par conséquent, la condition de sa vie est de bloquer ce programme suicidaire. La tâche principale de la régulation de l'apoptose est de maintenir les caspases effectrices dans un état inactif, mais de les transférer rapidement vers forme active en réponse à l'action minimale des inducteurs correspondants.
D'où le concept d'inhibiteurs et d'activateurs de l'apoptose.
Inhibiteurs de l'apoptose (=facteurs anti-apoptotique). Les facteurs de croissance sont parmi les inhibiteurs les plus sérieux de l'apoptose. Autres : acides aminés neutres, zinc, œstrogènes, androgènes, certaines protéines.
Exemple : Protéines de la famille IAP - inhibent l'activité des caspases 3 et 9. Rappel : une de ces protéines (Survin) se trouve dans les cellules tumorales. Elle est associée à la résistance des cellules tumorales à la chimiothérapie.
Activateurs de l'apoptose (=facteurs pro-apoptotiques). Il s'agit de gènes pro-apoptotiques et de leurs produits : a) gènes de la famille BCL-2 (BAX et BID) ; b) Gènes Rb et P53 (déclenchent l'apoptose si la cellule est retardée par le mécanisme de point de contrôle.
Sommaire. La pathogenèse de nombreuses maladies, y compris les tumeurs, est associée à une diminution de la capacité des cellules à subir une apoptose. D'où l'accumulation de cellules endommagées et la formation d'une tumeur.
PHYSIOPATHOLOGIE DE LA DIVISION CELLULAIRE
La principale différence entre la division des cellules saines et tumorales:
La division d'une cellule saine est régulée par des méthodes paracrines et endocrines. La cellule obéit à ces signaux et ne se divise que si le corps a besoin de la formation de nouvelles cellules de ce type.
La division des cellules tumorales est régulée de manière autocrine. La cellule tumorale elle-même forme des stimulants mitogènes et se divise sous leur influence. Il ne répond pas aux stimuli paracrines et endocrines.
Il existe 2 (deux) mécanismes de transformation tumorale des cellules :
1. Activation des oncogènes.
2. Inactivation des gènes suppresseurs.
ACTIVATION DES ONCOGENES
Tout d'abord, 2 (deux) concepts principaux : = proto-oncogènes ;
Oncogènes.
Les proto-oncogènes sont des gènes normaux et intacts qui contrôlent la division cellulaire saine.
Les proto-oncogènes comprennent des gènes qui contrôlent la formation et le travail de :
1. Facteurs de croissance.
2. Récepteurs membranaires pour les facteurs de croissance, tels que les récepteurs tyrosine kinase.
3. Protéines Ras.
4. Les MAP kinases, membres de la cascade des MAP kinases.
5. Facteurs de transcription AP-1.
Les oncogènes sont des proto-oncogènes endommagés. Le processus d'endommagement d'un proto-oncogène et de sa transformation en oncogène est appelé activation oncogène.
Mécanismes d'activation des oncogènes.
1. Inclusion (insertion) du promoteur. Un promoteur est une région d'ADN à laquelle se lie l'ARN polymérase d'un proto-oncogène. Condition nécessaire– le promoteur doit être à proximité immédiate du proto-oncogène. D'où les options : a) promoteur - copie d'ADN d'oncornavirus ; b) "gènes sauteurs" - sections d'ADN qui peuvent se déplacer et s'intégrer dans différentes parties du génome cellulaire.
2. Amplification - augmentation du nombre de proto-oncogènes ou apparition de copies de proto-oncogènes. Les proto-oncogènes ont normalement peu d'activité. Avec une augmentation du nombre ou de l'apparition de copies, leur activité totale augmente de manière significative et cela peut conduire à une transformation tumorale de la cellule.
3. Translocation de proto-oncogènes. Il s'agit du mouvement d'un proto-oncogène vers un locus avec un promoteur fonctionnel.
4. Mutations de proto-oncogènes.
production d'oncogènes. Les oncogènes fabriquent leurs propres protéines. Ces protéines sont appelées "oncoprotéines".
La synthèse d'oncoprotéines est appelée "expression d'oncogènes cellulaires actifs".
Oncoprotéines - fondamentalement, il existe des analogues de protéines proto-oncogènes: facteurs de croissance, protéines Ras, MAP kinases, facteurs de transcription. Mais il existe des différences quantitatives et qualitatives entre les oncogènes et les protéines proto-oncogènes.
Différences des oncoprotéines par rapport à la production normale de proto-oncogènes :
1. Une augmentation de la synthèse des oncoprotéines par rapport à la synthèse des protéines des proto-oncogènes.
2. Les oncoprotéines ont des différences structurelles par rapport aux protéines protooncogènes.
Mécanisme d'action des oncoprotéines.
1. Les oncoprotéines se lient aux récepteurs des facteurs de croissance et forment des complexes qui génèrent constamment des signaux pour la division cellulaire.
2. Les oncoprotéines augmentent la sensibilité des récepteurs aux facteurs de croissance ou diminuent la sensibilité aux inhibiteurs de croissance.
3. Les oncoprotéines peuvent elles-mêmes agir comme facteurs de croissance.
INACTIVATION DES GÈNES SUPPRESSEURS
Gènes suppresseurs : Rb et p53.
Leurs produits sont les protéines correspondantes.
L'inactivation des gènes suppresseurs (héréditaires ou acquis) entraîne le passage des cellules à l'ADN endommagé en mitose, la reproduction et l'accumulation de ces cellules. Ce - raison possible formation tumorale.
CROISSANCE TUMEURALE : DÉFINITION, RAISONS DE L'AUGMENTATION DU NOMBRE DE MALADIES MALIGNES
Une tumeur est une croissance pathologique qui diffère des autres croissances pathologiques par sa capacité héréditairement fixée à une croissance incontrôlée illimitée.
D'autres excroissances pathologiques sont l'hyperplasie, l'hypertrophie, la régénération après des dommages.
Les raisons de l'augmentation du nombre de maladies malignes parmi la population:
1. Augmentation de l'espérance de vie.
2. Améliorer la qualité des diagnostics → augmenter la détection des cancers.
3. Détérioration situation environnementale, une augmentation de la teneur en facteurs cancérigènes dans l'environnement.
TUMEURS BENIGNES ET MALIGNES
Une classification unique des tumeurs n'a pas encore été créée. Cause:
1. Une grande variété de caractéristiques caractéristiques de diverses tumeurs.
2. Manque de connaissances sur leur étiologie et leur pathogenèse.
Les classifications modernes sont basées sur les principaux signes morphologiques et cliniques des tumeurs.
Sur la base des caractéristiques cliniques, toutes les tumeurs sont divisées en bénignes et malignes.
Tumeurs bénignes :
1. Les cellules tumorales sont morphologiquement identiques ou similaires aux cellules précurseurs normales.
2. Le degré de différenciation des cellules tumorales est assez élevé.
3. Le taux de croissance est lent, sur de nombreuses années.
4. La nature de la croissance est expansive, c'est-à-dire pendant la croissance tumorale, les tissus adjacents s'écartent, parfois comprimés, mais généralement pas endommagés.
5. La délimitation des tissus environnants est claire.
6. Capacité à métastaser - absente.
7. L'absence d'effet indésirable prononcé sur le corps. Exception : tumeurs situées à proximité des centres vitaux. Exemple : une tumeur au cerveau qui comprime les centres nerveux.
Tumeurs malignes.
1. Les cellules tumorales sont morphologiquement différentes de la cellule progénitrice normale (souvent au-delà de la reconnaissance).
2. Le degré de différenciation des cellules tumorales est faible.
3. Le taux de croissance est rapide.
4. La nature de la croissance est envahissante, c'est-à-dire la tumeur se développe dans les structures voisines. Facteurs contributifs:
L'acquisition par les cellules tumorales de la capacité de se détacher du nœud tumoral et de se déplacer activement ;
La capacité des cellules tumorales à produire des "carcinoaggressines". Ce sont des protéines qui pénètrent dans les tissus normaux environnants et stimulent la chimiotaxie des cellules tumorales.
Diminution des forces d'adhésion cellulaire. Cela facilite le détachement des cellules tumorales du nœud primaire et leur mouvement ultérieur.
Diminution de l'inhibition de contact.
5. Délimitation des tissus environnants - non.
6. La capacité de métastaser - exprimée.
7. Impact sur le corps - défavorable, généralisé.
Phénomènes la mort cellulaire programmée connu depuis plus de 100 ans, mais est resté "dans l'ombre" des processus nécrobiotiques, qui pendant des décennies ont été étudiés beaucoup plus activement que la mort programmée. Ce type de mort cellulaire est le composant intégral le plus important de l'embryogenèse, de la morphogenèse et de la croissance tissulaire, ainsi que de l'involution hormono-dépendante. Il, avec lysosomal autophagie, est impliqué dans les mécanismes d'adaptations cellulaires telles que atrophie(réduction de la taille des cellules et du nombre de structures fonctionnelles dans celles-ci tout en maintenant la viabilité cellulaire) et hypoplasie(réduction d'un organe due à une diminution du nombre de cellules qu'il contient tout en maintenant sa viabilité).
Par exemple, il a été montré que les modifications involutives du cortex surrénalien après hypophysectomie sont inhibées par l'actinomycine D et, par conséquent, elles représentent un processus actif de mise en œuvre d'un certain programme d'auto-désassemblage cellulaire.
Pour désigner le processus de mort cellulaire programmée, morphologiquement et pathochimiquement différent de la nécrobiose, le terme "apoptose". Les fondateurs de la doctrine de l'apoptose, notamment J. Kerr et al., considéraient comme équivalentes les notions de "mort cellulaire programmée" et d'"apoptose". À Ces derniers temps on a tendance à appliquer le premier terme aux processus d'élimination cellulaire au début de l'ontogenèse, alors que le concept d'apoptose se réfère uniquement à la mort programmée de cellules différenciées matures. Ainsi, ils indiquent la présence d'autophagie et l'absence de cassures de l'ADN lors de la mort cellulaire embryonnaire, contrairement à l'apoptose des cellules matures.
La question de la relation entre la nécrobiose et l'apoptose et l'association de ces mécanismes avec la mort cellulaire naturelle ou violente doit être discutée. Ce serait une simplification de dire que l'apoptose est exclusivement un processus de mort cellulaire naturelle, alors que la nécrobiose est violente. La division en ces deux processus est loin d'être absolue. Ci-dessus, lors de la discussion des modèles de nécrobiose, nous avons déjà dû mentionner l'apoptose à plusieurs reprises, car il existe de nombreuses similitudes entre ces processus. Le fait est qu'en réponse à des dommages minimes ou à des dommages qui ne provoquent pas le développement rapide d'une hypoxie profonde et d'un déficit énergétique prononcé, les cellules peuvent activer un programme spécial d'autodestruction et réagir par l'apoptose. Dans ce cas, par exemple, lorsque rayonnement ionisant ou le virus du SIDA, la mort cellulaire est violente, mais son mécanisme n'est pas nécrobiotique, mais apoptotique. Les corps des conseillers municipaux, trouvés dans l'hépatite virale dans le foie, sont le résultat de l'apoptose des hépatocytes sous l'influence de dommages induits par le virus. C'est aussi une mort violente, mais son mécanisme n'est pas associé à une hypoxie rapidement progressive et permet à la cellule d'avoir le temps d'activer le programme d'auto-désassemblage. Le caractère violent de la mort des cellules cibles sous l'influence du facteur de nécrose tumorale ne fait aucun doute. Cependant, malgré son nom catégorique, ce biorégulateur provoque non seulement une nécrose, mais également une apoptose dans les cellules cibles. Lors de la mise en place de la nécrobiose et de l'apoptose, de nombreux mécanismes communs opèrent, par exemple, une augmentation de la concentration cytoplasmique de calcium ionisé et la formation de radicaux libres d'oxygène actif. De plus, avec une plus grande force et intensité d'action, le stimulus apoptogène peut provoquer une nécrobiose, apparemment due au fait que la déficience énergétique progressive ne permet pas aux cellules de réaliser la dynamique énergétiquement "coûteuse" de l'apoptose.
Tableau 1
Caractéristiques typiques des principaux modes de mort cellulaire.
|
Nécrobiose et nécrose |
||
|
Image morphologique |
Condensation et fragmentation du cytoplasme, condensation et rexis du noyau, autophagie des mitochondries, les membranes restent longtemps stables. Il n'y a pas d'inflammation périfocale ni de démarcation. Des corps apoptotiques se forment, qui sont phagocytés. |
Caryopycnose ou caryolyse, gonflement suivi de rides et de calcifications dans les mitochondries, destruction précoce de la membrane, autolyse cellulaire, inflammation périfocale, paroi de démarcation |
|
pathochimie |
Pas de déficit énergétique prononcé, ruptures ordonnées de l'ADN internucléosomal, synthèse de HSP, APO-1 et d'autres protéines spéciales, activation des endonucléases. Fragmentation du cytoplasme avec la participation du cytosquelette. Elle est inhibée par les inhibiteurs calciques et l'actinomycine D-1. |
Carence énergétique sévère, hyperhydratation cellulaire, acidose, hydrolyse, dégradation diffuse de la chromatine. Arrêt de la synthèse des protéines. Parésie et agrégation d'éléments du cytosquelette. |
|
Étiologie |
Exposition à des dommages modérément graves et à des signaux déclencheurs spéciaux non dommageables (hormones, cytokines) |
Impact de puissants facteurs extrêmes |
Si la nécrobiose s'accompagne toujours de la libération dans les tissus environnants, et en cas de lésion massive dans la circulation systémique, de médiateurs inflammatoires, en particulier de produits lipidiques de la destruction des membranes cellulaires, alors l'apoptose se déroule sans démarcation leucocytaire ni inflammation périfocale , puisque son mécanisme permet d'éviter une libération importante de médiateurs des dommages cellulaires. La publication en 1996 d'une monographie complète sur l'apoptose facilite notre tâche et permet de caractériser dans ce livre seulement les aspects les plus généraux et physiopathologiquement importants de ce problème.
1. Élimination des cellules au début de l'ontogenèse.
2. Involution physiologique et équilibrage des mitoses dans les tissus matures et les populations cellulaires
3. Réalisation des processus d'atrophie et régression de l'hyperplasie
4. Suicide altruiste de cellules mutantes et infectées par des virus
5. La mort cellulaire après une faible exposition à des agents qui provoquent une nécrose avec une lésion massive.
Pour présenter plus clairement les différences entre nécrobiose et apoptose, les auteurs proposent d'étudier le tableau en détail.
Il est important de noter que la nécrose survient après la mort cellulaire violente à la suite de toutes les causes qui provoquent une hypoxie des tissus profonds et contient toujours un composant lytique sous la forme d'une autolyse lysosomale ou d'une hétérolyse causée par des hydrolases phagocytaires. Selon les concepts modernes, l'autolyse au cours de la mort cellulaire est post-mortem et n'est pas un élément de la nécrobiose. Cependant, des dommages précoces et importants aux membranes cellulaires font partie intégrante des processus de nécrobiose et ne sont pratiquement pas observés pendant l'apoptose.
L'apoptose est un processus génétiquement contrôlé qui peut être activé par divers déclencheurs sans aucun dommage préliminaire significatif à l'appareil exécutif de la cellule, bien qu'il puisse être activé après des dommages modérés comme un suicide altruiste. L'élimination des cellules sans dommage est également possible lorsque l'antigène des cellules sénescentes est exprimé. Il est possible que ces mécanismes de « sortie sans scandale » se combinent et/ou interagissent.
Il est fondamentalement important qu'en cas d'incapacité à entrer en apoptose, un clone de cellules à prolifération illimitée se produise, ce qui entraîne de graves perturbations dans un organisme multicellulaire et est observé, par exemple, dans les maladies oncologiques. Jusqu'à présent dans ce livre, nous avons souvent fait référence à l'utilité relative et à la pathogénicité potentielle de divers processus de défense programmés et donné des exemples d'une telle "mauvaise utilité". Dans ce cas, nous voyons la principale contradiction de la physiopathologie, pour ainsi dire, dans la perspective opposée. En d'autres termes, l'apoptose dans le cycle cellulaire agit comme un mal programmé minimal et illustre également l'essentiel de notre raisonnement, puisqu'il s'agit d'une mort adaptative, d'une mort selon le programme et d'une sorte de « dommage bénéfique » dans forme pure. En tout cas, les observations de cellules malignes ayant perdu la capacité d'apoptose sous l'action d'oncogènes prouvent que pour les cellules la perte de la capacité de mourir à temps est un grand mal.
L'apoptose peut commencer comme une réponse de gènes programmant l'auto-assemblage cellulaire à un signal médié par un récepteur (par exemple, lors de la stimulation des récepteurs du TNFα ou du récepteur des glucocorticoïdes des lymphocytes par des biorégulateurs appropriés).
Non seulement le TNF et les glucocorticoïdes, mais aussi presque toutes les cytokines, dont 13 interleukines et 3 interférons, peuvent être des signaux de code pour l'apoptose, et dans certaines cellules, ils la déclenchent, tandis que dans d'autres, ils l'inhibent. Les facteurs de croissance spécifiques aux tissus et les hématopoïétines sont des inhibiteurs de l'apoptose de leurs cellules cibles. Les hormones tropiques de l'hypophyse exercent leur effet trophique sur les glandes cibles également en inhibant l'apoptose.
Le signal peut avoir un effet multidirectionnel sur la cellule vis-à-vis de l'apoptose, selon l'état initial de la cible, comme décrit ci-dessus pour le TNF.
Les gènes FAS/APO-1, c-myc, max, p53, ced-3 et d'autres peuvent agir comme inducteurs génétiques de l'apoptose déclenchée en réponse à un signal de récepteur. La suppression de l'expression de certains gènes, tels que bcl-2, provoque également l'apoptose. L'étude détaillée des mécanismes par lesquels les produits de ces gènes déclenchent ou inhibent l'apoptose ne fait que commencer. Cependant, il a déjà été découvert qu'ils peuvent favoriser la formation de radicaux oxygénés actifs (comme la protéine APO-1, homologue du récepteur du facteur de nécrose tumorale), réguler le transfert de calcium dans le cytoplasme (en tant que produit du bcl- 2), et déclenchent des protéases neutres du cytosol (en tant que produit de geneaced-3), se lient à l'ADN (en tant que dimère de protéines mus-max).
Il est d'une importance fondamentale que l'apoptose puisse être induite même dans des structures postcellulaires dépourvues de noyau. Par conséquent, le lien principal de l'apoptose peut être non seulement des événements nucléaires, mais également certains changements métaboliques dans le cytoplasme ou l'activation d'ARN messagers à longue durée de vie, comme c'est le cas avec l'antigène des cellules sénescentes.
Les radicaux réactifs de l'oxygène (AR) peuvent initier l'apoptose. Avec des dommages cellulaires modérés en l'absence d'hypoxie, le potentiel transmembranaire des mitochondries est réduit et l'AKR est généré par elles. Si les systèmes antioxydants de la cellule ne compensent pas le déplacement du potentiel redox, le processus progresse. En l'absence d'un déficit énergétique prononcé et de la préservation de l'appareil génétique, l'apoptose est réalisée, mais une hypoxie profonde et des dommages prononcés à l'ADN initient la nécrobiose. Avec le développement de l'apoptose, l'AKR modifie les conditions d'interaction du calcium avec la calmoduline et contribue à une augmentation de l'activité cytoplasmique et intranucléaire (et en cas de blocage du gène bcl-2, à une augmentation de la concentration intracellulaire) du calcium.
Le lien dépendant du calcium dans le mécanisme de l'apoptose active les calpaïnes, ce qui conduit à la protéolyse des protéines du cytosquelette, à la formation de protubérances cytoplasmiques et à la destruction des liaisons internucléosomales dans le noyau. L'endonucléase calcium-dépendante est activée. Cela provoque des cassures ordonnées de la chromatine internucléosomale et une fragmentation nucléaire. La transglutaminase dépendante du calcium agrège les protéines cytosoliques. La dernière étape du processus est la désintégration de la cellule en corps apoptotiques et leur autophagocytose.
apoptose
La mort cellulaire dans le corps peut se produire de 2 façons : nécrose et apoptose.
apoptose- il s'agit d'un type de mort cellulaire dans lequel la cellule elle-même est activement impliquée dans le processus de sa mort, c'est-à-dire la cellule s'autodétruit. L'apoptose, contrairement à la nécrose, est un processus actif ; après exposition à des facteurs étiologiques, une cascade de réactions génétiquement programmées se déclenche, accompagnée de l'activation de certains gènes, de la synthèse de protéines, d'enzymes, conduisant à l'élimination efficace et rapide de la cellule du tissu.
Causes de l'apoptose.
1. Au cours de l'embryogenèse, l'apoptose joue un rôle important dans la destruction de divers primordiums tissulaires et la formation d'organes.
2. L'apoptose subit des cellules sénescentes qui ont terminé leur cycle de développement, par exemple, des lymphocytes qui ont épuisé leur réserve de cytokines.
3. Dans les tissus en croissance, une certaine partie des cellules filles subit l'apoptose. Le pourcentage de cellules mourantes peut être régulé par des hormones systémiques et locales.
4. La cause de l'apoptose peut être un faible effet de facteurs nocifs qui, à plus forte intensité, peuvent entraîner une nécrose (hypoxie, rayonnements ionisants, toxines, etc.)
Pathogenèse de l'apoptose :
Une cellule subit une apoptose si des dommages à l'ADN se produisent dans le noyau et ne peuvent pas être réparés par le système de réparation. Ce processus est contrôlé par une protéine codée par le gène p53. S'il est impossible d'éliminer le défaut d'ADN sous l'action de la protéine p53, le programme d'apoptose est activé.
De nombreuses cellules possèdent des récepteurs dont l'impact provoque l'activation de l'apoptose. Les mieux étudiés sont le récepteur Fas, présent sur les lymphocytes, et le récepteur du facteur de nécrose tumorale alpha (TNF-α), présent sur de nombreuses cellules. Ces récepteurs jouent un rôle important dans l'élimination des lymphocytes autoréactifs et la régulation de la constance de la taille de la population cellulaire de manière rétroactive.
Divers métabolites et hormones peuvent activer l'apoptose : cytokines anti-inflammatoires, hormones stéroïdiennes, monoxyde d'azote (NO) et radicaux libres.
L'apoptose cellulaire est activée lorsqu'il y a un manque d'oxygène dans les tissus. La raison de son activation peut être l'action des radicaux libres, la perturbation des processus de réparation de l'ADN dépendant de l'énergie, etc.
L'apoptose subit des cellules qui ont perdu le contact avec la matrice intercellulaire, la membrane basale ou les cellules voisines. La perte de ce mécanisme d'apoptose dans les cellules tumorales conduit à l'apparition de la capacité à métastaser.
Certaines protéines virales peuvent activer l'apoptose cellulaire après l'auto-assemblage du virus dans une cellule infectée. L'absorption des corps apoptotiques par les cellules voisines conduit à leur infection par le virus. Le virus du SIDA peut également activer l'apoptose des cellules non infectées qui possèdent un récepteur CD4 à leur surface.
Il existe également des facteurs qui empêchent l'apoptose. De nombreux métabolites et hormones, comme les hormones sexuelles et les cytokines pro-inflammatoires, peuvent ralentir l'apoptose. L'apoptose peut être considérablement ralentie par des défauts dans le mécanisme de la mort cellulaire, par exemple, par une mutation du gène p53 ou l'activation de gènes qui inhibent l'apoptose (bcl-2). De nombreux virus ont la capacité d'inhiber l'apoptose après avoir intégré leur propre ADN dans le génome cellulaire pendant la période de synthèse de leurs propres protéines structurales.
Manifestations morphologiques de l'apoptose
L'apoptose a ses propres caractéristiques morphologiques distinctives, tant au niveau optique qu'ultrastructural. Les caractéristiques morphologiques les plus claires sont détectées par microscopie électronique. Une cellule en apoptose est caractérisée par :
Contraction cellulaire. La cellule est réduite en taille; le cytoplasme s'épaissit ; les organites qui semblent relativement normaux sont plus compacts. On suppose que la violation de la forme et du volume de la cellule résulte de l'activation de la transglutaminase et des protéases à cystéine (caspases) dans les cellules apoptotiques. Le premier groupe d'enzymes provoque la formation de liaisons croisées dans les protéines cytoplasmiques, ce qui conduit à la formation d'une sorte de coquille sous la membrane cellulaire, semblable aux cellules épithéliales kératinisantes, et le deuxième groupe d'enzymes détruit les protéines dans le cytosol.
condensation de la chromatine. C'est la manifestation la plus caractéristique de l'apoptose. L'ADN est clivé par des endonucléases aux sites qui lient les nucléosomes individuels, ce qui entraîne la formation d'un grand nombre de fragments dans lesquels le nombre de paires de bases est divisible par 180-200, qui se condensent ensuite sous la membrane nucléaire. Le noyau peut être divisé en deux fragments ou plus.
Formation de corps apoptotiques. Dans une cellule apoptotique, des invaginations profondes de la membrane cellulaire se forment, ce qui conduit au détachement de fragments cellulaires, c'est-à-dire la formation de corps apoptotiques entourés de membranes, constitués de cytoplasme et d'organites densément emballés, avec ou sans fragments nucléaires.
Phagocytose l'apoptose des cellules ou corps est réalisée par les cellules saines environnantes, macrophages et parenchymateuses. Les corps apoptotiques sont rapidement détruits dans les lysosomes et les cellules environnantes migrent ou se divisent pour remplir l'espace libéré après la mort cellulaire.
Lorsqu'elle est colorée avec de l'hématoxyline et de l'éosine, l'apoptose est déterminée dans des cellules individuelles ou de petits groupes de cellules. Les cellules apoptotiques ont une forme ronde ou ovale, un cytoplasme intensément éosinophile avec des fragments denses de chromatine nucléaire. Comme la contraction cellulaire et la formation de corps apoptotiques se produisent rapidement et qu'ils sont également rapidement phagocytés, désintégrés ou éjectés dans la lumière de l'organe, l'apoptose est détectée sur des préparations histologiques dans les cas de sa gravité importante. De plus, l'apoptose, contrairement à la nécrose, ne s'accompagne jamais d'une réaction inflammatoire, ce qui rend également difficile sa détection histologique.
Pour identifier les cellules aux premiers stades de l'apoptose, des études immunohistochimiques spéciales sont utilisées, par exemple, la détermination des caspases activées ou la méthode TUNEL, qui visualise l'ADN cassé par des endonucléases.
Signification de l'apoptose.
1. L'apoptose est d'une grande importance dans l'embryogenèse (y compris l'implantation et l'organogenèse). La violation de la mort cellulaire dans les espaces interdigitaux peut entraîner une syndactylie et l'absence d'apoptose de l'excès d'épithélium lors de la fusion des processus palatins ou des tissus environnants. tube neural, conduit à une violation de la fusion tissulaire des deux côtés, qui se manifeste par une division du palais dur et un défaut dans les tissus qui limitent le canal rachidien (spina bifida), respectivement.
2. L'apoptose joue un rôle important dans la persistance composition cellulaire en particulier dans les tissus hormono-sensibles. La décélération de l'apoptose conduit à une hyperplasie tissulaire, l'accélération conduit à une atrophie. Il participe au rejet de l'endomètre lors de cycle menstruel, atrésie des follicules ovariens à la ménopause et régression du tissu mammaire après arrêt de la lactation.
3. Dans ce moment un grand nombre de médicaments visant à réguler l'apoptose dans certains tissus sont à l'étude. Ainsi, l'accélération de l'apoptose des cellules immunocompétentes peut être utilisée pour traiter les maladies auto-immunes et prévenir le rejet de greffe, le ralentissement de l'apoptose peut être utilisé pour prévenir l'apoptose dans les tissus présentant une ischémie, une pression externe accrue ou des tissus temporairement inactifs. Le ralentissement de l'apoptose dans les infections virales empêche l'infection de se propager aux cellules voisines.
4. Dans toutes les tumeurs, il y a une violation de l'apoptose dans les cellules tumorales. Cette panne peut se produire à différents stades de l'apoptose, par exemple, une mutation du gène p53 peut se produire, ce qui conduit au fait que la protéine p53 mutante s'accumulera dans la cellule en excès, mais ne provoquera pas l'apoptose malgré les défauts de la cellule génome, ce qui conduira à la prolifération de cellules avec un génome perturbé, et à chaque division ultérieure, les violations de l'ADN s'accumuleront. Parfois, la protéine p53 normale ou "sauvage" peut également s'accumuler dans les cellules tumorales si la rupture du mécanisme d'apoptose se produit à d'autres niveaux. Dans la leucémie lymphoïde chronique, on observe une accumulation de produits du gène bcl-2, ce qui entraîne une prolongation pathologique de la durée de vie des cellules tumorales et une résistance cellulaire à divers facteurs pro-apoptotiques. Parfois, la signalisation des récepteurs de mort cellulaire, tels que le récepteur TNF-α, est perturbée. Le TNF-α est impliqué dans la régulation de la population cellulaire par le type de rétroaction. Toutes les cellules de la population sécrètent du TNF-α en petites quantités ; plus il y a de cellules dans le tissu, plus la concentration de TNF-α est élevée, et donc le niveau d'apoptose. Ainsi, un équilibre est atteint entre la prolifération et la mort cellulaire. Les cellules tumorales perdent leur capacité à subir l'apoptose sous l'action de cette cytokine, alors qu'elle s'accumule en grande quantité dans le tissu tumoral. En conséquence, le TNF-α commence à en grand nombre pénètrent dans la circulation sanguine et provoquent l'apoptose des cellules parenchymateuses dans de nombreux organes, entraînant une cachexie.
Le processus par lequel une cellule peut se tuer est appelé mort cellulaire programmée (PCD). Ce mécanisme a plusieurs variétés et joue rôle essentiel en physiologie divers organismes notamment multicellulaires. L'apoptose est la forme de PCD la plus courante et la mieux étudiée.
Qu'est-ce que l'apoptose
L'apoptose est contrôlée processus physiologique autodestruction de la cellule, caractérisée par la destruction progressive et la fragmentation de son contenu avec formation de vésicules membranaires (corps apoptotiques), ensuite absorbées par les phagocytes. Ce mécanisme génétiquement incorporé est activé sous l'influence de certains facteurs internes ou externes.
Avec cette variante de la mort, le contenu cellulaire ne dépasse pas la membrane et ne provoque pas d'inflammation. Les perturbations de la régulation de l'apoptose entraînent des pathologies graves telles que des divisions cellulaires ou dégénérescence tissulaire.
L'apoptose n'est qu'une des nombreuses formes de mort cellulaire programmée (PCD), il est donc erroné d'identifier ces concepts. À espèce connue l'autodestruction cellulaire comprend également la catastrophe mitotique, l'autophagie et la nécrose programmée. D'autres mécanismes de PCD n'ont pas encore été étudiés.
Causes de l'apoptose cellulaire
La raison du déclenchement du mécanisme de mort cellulaire programmée peut être à la fois des processus physiologiques naturels et des changements pathologiques causés par des défauts internes ou une exposition à des facteurs externes indésirables.
Normalement, l'apoptose équilibre le processus de division cellulaire, régule leur nombre et favorise le renouvellement tissulaire. Dans ce cas, la cause de HGC est certains signaux qui font partie du système de contrôle de l'homéostasie. Avec l'aide de l'apoptose, les cellules jetables ou les cellules qui ont rempli leur fonction sont détruites. Ainsi, la teneur accrue en leucocytes, neutrophiles et autres éléments de l'immunité cellulaire après la fin de la lutte contre l'infection est éliminée précisément en raison de l'apoptose.
La mort programmée fait partie du cycle physiologique systèmes reproducteurs. L'apoptose est impliquée dans le processus d'ovogenèse et contribue également à la mort de l'œuf en l'absence de fécondation.
Un exemple classique de l'implication de l'apoptose cellulaire dans cycle de la vie systèmes végétatifs est la chute des feuilles d'automne. Le terme lui-même vient du mot grec apoptosis, qui se traduit littéralement par "chute".
L'apoptose joue un rôle important dans l'embryogenèse et l'ontogenèse, lorsque les tissus changent dans le corps et que certains organes s'atrophient. Un exemple est la disparition des membranes entre les doigts des membres de certains mammifères ou la mort de la queue lors de la métamorphose d'une grenouille.
L'apoptose peut être déclenchée par l'accumulation de changements défectueux dans la cellule résultant de mutations, du vieillissement ou d'erreurs mitotiques. La raison du lancement de CHG peut être un environnement défavorable (manque de nutriments, manque d'oxygène) et pathologique influences externes médiée par des virus, des bactéries, des toxines, etc. De plus, si l'effet néfaste est trop intense, la cellule n'a pas le temps d'effectuer le mécanisme de l'apoptose et meurt à la suite du développement du processus pathologique - la nécrose.

Changements morphologiques et biochimiques structurels dans la cellule pendant l'apoptose
Le processus d'apoptose est caractérisé par un certain ensemble de changements morphologiques, qui peuvent être observés à l'aide de la microscopie dans une préparation tissulaire in vitro.

Les principales caractéristiques caractéristiques de l'apoptose cellulaire comprennent :
- réarrangement du cytosquelette;
- compactage du contenu cellulaire;
- condensation de la chromatine;
- fragmentation du noyau;
- réduction du volume cellulaire;
- plissement du contour de la membrane;
- formation de vésicules à la surface des cellules,
- destruction des organites.
Chez les animaux, ces processus aboutissent à la formation d'apoptocytes, qui peuvent être engloutis à la fois par les macrophages et les cellules des tissus voisins. Chez les plantes, la formation de corps apoptotiques ne se produit pas et après la dégradation du protoplaste, le squelette reste sous la forme paroi cellulaire.

En plus des changements morphologiques, l'apoptose s'accompagne d'un certain nombre de réarrangements au niveau moléculaire. Il y a une augmentation des activités lipase et nucléase, ce qui entraîne la fragmentation de la chromatine et de nombreuses protéines. La teneur en AMPc augmente fortement, la structure de la membrane cellulaire change. À cellules végétales des vacuoles géantes sont observées.
En quoi l'apoptose est-elle différente de la nécrose ?

La principale différence entre l'apoptose et la nécrose réside dans la cause de la dégradation cellulaire. Dans le premier cas, la source de destruction est les outils moléculaires de la cellule elle-même, qui fonctionnent sous contrôle strict et nécessitent la dépense d'énergie ATP. Avec la nécrose, la cessation passive de la vie se produit en raison d'effets néfastes externes.
L'apoptose est un processus physiologique naturel conçu de manière à ne pas nuire aux cellules environnantes. La nécrose est un phénomène pathologique incontrôlé résultant de blessures critiques. Par conséquent, il n'est pas surprenant que le mécanisme, la morphologie et les conséquences de l'apoptose et de la nécrose soient à bien des égards opposés. Cependant, il existe également des caractéristiques communes.
En cas de lésion, les cellules déclenchent le mécanisme de la mort programmée, notamment pour empêcher le développement nécrotique. Cependant, des études récentes ont montré qu'il existe une autre forme de nécrose non pathologique, également appelée PCD.
Signification biologique de l'apoptose
Malgré le fait que l'apoptose entraîne la mort cellulaire, son rôle dans le maintien du fonctionnement normal de l'ensemble de l'organisme est très important. Les fonctions physiologiques suivantes sont réalisées en raison du mécanisme de PCG :
- maintenir un équilibre entre la prolifération cellulaire et la mort ;
- renouvellement des tissus et des organes;
- élimination des cellules défectueuses et "vieilles" ;
- protection contre le développement de nécrose pathogène;
- modification des tissus et des organes au cours de l'embryogenèse et de l'ontogenèse ;
- suppression des éléments inutiles qui ont rempli leur fonction ;
- élimination des cellules indésirables ou dangereuses pour l'organisme (mutantes, tumorales, infectées par un virus) ;
- prévenir le développement de l'infection.
Ainsi, l'apoptose est l'un des moyens de maintenir l'homéostasie cellule-tissu.

Les étapes de la mort cellulaire
Ce qui arrive à une cellule pendant l'apoptose est le résultat d'une chaîne complexe d'interactions moléculaires entre différentes enzymes. Les réactions se déroulent en cascade, lorsque certaines protéines en activent d'autres, contribuant au développement progressif du scénario de la mort. Ce processus peut être divisé en plusieurs étapes :
- Induction.
- Activation des protéines pro-apoptotiques.
- Activation de la caspase.
- Destruction et restructuration des organites cellulaires.
- Formation d'apoptocytes.
- Préparation de fragments cellulaires pour la phagocytose.
La synthèse de tous les composants nécessaires pour lancer, mettre en œuvre et contrôler chaque étape est basée sur la génétique, c'est pourquoi l'apoptose est appelée mort cellulaire programmée. L'activation de ce processus est sous le contrôle strict des systèmes de réglementation, y compris divers inhibiteurs de PCG.
Mécanismes moléculaires de l'apoptose cellulaire
Le développement de l'apoptose est déterminé par l'action combinée de deux systèmes moléculaires : induction et effecteur. Le premier bloc est responsable du lancement contrôlé du ZGK. Il comprend les soi-disant récepteurs de mort, les protéases Cys-Asp (caspases), un certain nombre de composants mitochondriaux et des protéines pro-apoptotiques. Tous les éléments de la phase d'induction peuvent être divisés en déclencheurs (participent à l'induction) et en modulateurs qui assurent la transduction du signal de mort.
Le système effecteur est constitué d'outils moléculaires qui assurent la dégradation et le réarrangement des composants cellulaires. La transition entre les première et deuxième phases se produit au stade de la cascade de caspases protéolytiques. C'est grâce aux composants du bloc effecteur que la mort cellulaire se produit lors de l'apoptose.
Facteurs d'apoptose
Les modifications structurales, morphologiques et biochimiques au cours de l'apoptose sont réalisées par un certain ensemble d'outils cellulaires spécialisés, parmi lesquels les plus importants sont les caspases, les nucléases et les modificateurs membranaires.
Les caspases sont un groupe d'enzymes qui coupent les liaisons peptidiques au niveau des résidus d'asparagine, fragmentant les protéines en gros peptides. Avant le début de l'apoptose, ils sont présents dans la cellule à l'état inactif en raison d'inhibiteurs. Les principales cibles des caspases sont les protéines nucléaires.
Les nucléases sont responsables de la coupe des molécules d'ADN. L'endonucléase active CAD, qui brise les régions de la chromatine dans les régions des séquences de liaison, est particulièrement importante dans le développement de l'apoptose. En conséquence, des fragments d'une longueur de 120 à 180 paires de nucléotides sont formés. L'effet complexe des caspases protéolytiques et des nucléases conduit à la déformation et à la fragmentation du noyau.

Modificateurs de la membrane cellulaire - violent l'asymétrie de la couche bilipidique, la transformant en une cible pour les cellules phagocytaires.
Le rôle clé dans le développement de l'apoptose appartient aux caspases, qui activent progressivement tous les mécanismes ultérieurs de dégradation et de réarrangement morphologique.
Le rôle des caspases dans la mort cellulaire
La famille des caspases comprend 14 protéines. Certaines d'entre elles ne sont pas impliquées dans l'apoptose, tandis que les autres sont divisées en 2 groupes : initiatique (2, 8, 9, 10, 12) et effectrice (3, 6 et 7), autrement appelées caspases de second rang. Toutes ces protéines sont synthétisées sous forme de précurseurs - les procaspases, activées par clivage protéolytique, dont l'essence est le détachement du domaine N-terminal et la séparation de la molécule restante en deux parties, qui sont ensuite associées en dimères et tétramères.
Les caspases initiatrices sont nécessaires pour activer un groupe effecteur qui présente une activité protéolytique contre diverses protéines cellulaires vitales. Les substrats de caspase de deuxième niveau comprennent :
- enzymes de réparation de l'ADN;
- inhibiteur de protéine p-53;
- poly-(ADP-ribose) polymérase;
- Inhibiteur de la DNase DFF (la destruction de cette protéine entraîne l'activation de l'endonucléase CAD), etc.
Le nombre total de cibles des caspases effectrices comprend plus de 60 protéines.
L'inhibition de l'apoptose cellulaire est encore possible au stade de l'activation des procaspases initiatrices. Lorsque les caspases effectrices entrent en action, le processus devient irréversible.
Voies d'activation de l'apoptose
La transmission d'un signal pour déclencher l'apoptose cellulaire peut s'effectuer de deux manières : réceptrice (ou externe) et mitochondriale. Dans le premier cas, le processus est activé par des récepteurs de mort spécifiques qui perçoivent des signaux externes, qui sont des protéines de la famille TNF ou des ligands Fas situés à la surface des T-killers.
Le récepteur comprend 2 domaines fonctionnels : un domaine transmembranaire (destiné à se lier au ligand) et un "domaine de la mort" orienté à l'intérieur de la cellule, qui induit l'apoptose. Le mécanisme de la voie des récepteurs repose sur la formation d'un complexe DISC qui active les caspases initiatrices 8 ou 10.
L'assemblage commence par l'interaction du domaine de mort avec les protéines adaptatrices intracellulaires, qui à leur tour se lient aux procaspases initiatrices. Dans le cadre du complexe, ces dernières sont converties en caspases fonctionnellement actives et déclenchent une nouvelle cascade apoptotique.
Le mécanisme de la voie interne repose sur l'activation de la cascade protéolytique par des protéines mitochondriales spécifiques dont la libération est contrôlée par des signaux intracellulaires. La libération des composants des organites s'effectue par la formation d'énormes pores.
Un rôle particulier dans le lancement appartient au cytochrome c. Une fois dans le cytoplasme, ce composant de la chaîne d'électrotransport se lie à la protéine Apaf1 (apoptotic protease activating factor), ce qui conduit à l'activation de cette dernière. Apaf1 est alors lié par les procaspases initiatrices 9, qui déclenchent l'apoptose par un mécanisme en cascade.
La voie interne est contrôlée par un groupe spécial de protéines de la famille Bcl12, qui régulent la libération des composants intermembranaires des mitochondries dans le cytoplasme. La famille contient à la fois des protéines pro-apoptotiques et anti-apoptotiques, dont l'équilibre détermine si le processus sera lancé.
L'un des puissants facteurs déclenchant l'apoptose par le mécanisme mitochondrial est les espèces réactives de l'oxygène. Un autre inducteur important est la protéine p53, qui active la voie mitochondriale en présence de dommages à l'ADN.
Parfois, le déclenchement de l'apoptose cellulaire combine deux voies à la fois : externe et interne. Ce dernier sert généralement à améliorer l'activation des récepteurs.