Apoptose ist der genetisch programmierte Zelltod. Apoptose
Lesen Sie auch
Wenn Apoptose auftritt Grob lassen sich vier Stadien unterscheiden.
Initiierung -> Programmierung -> Programmimplementierung -> Entfernung toter Zellen
Stadien der Apoptose: Initiationsstadium
Zu diesem Zeitpunkt Informationen Signale werden von der Zelle empfangen. Der Krankheitserreger ist entweder selbst ein Signal oder bewirkt die Erzeugung eines Signals in der Zelle und dessen Weiterleitung an intrazelluläre regulatorische Strukturen und Moleküle.
Apoptose einleiten Reize können transmembranös oder intrazellulär sein.
Transmembransignale unterteilt in negativ, positiv und gemischt.
- Negative Signale: Fehlen oder Aufhören des Einflusses von Wachstumsfaktoren, Zytokinen, die die Zellteilung und -reifung regulieren, sowie Hormonen, die die Zellentwicklung steuern, auf die Zelle. Normalerweise sorgt die Wirkung der oben genannten Gruppen biologisch aktiver Substanzen auf Membranrezeptoren für eine Unterdrückung Zelltodprogramme und ihre normalen Lebensaktivitäten. Im Gegenteil, ihr Fehlen oder die Verringerung der Wirkung „löst“ das Apoptoseprogramm aus. Daher ist für die normale Funktion einer Reihe von Neuronen das ständige Vorhandensein neurotropher Faktoren notwendig. Ihre Beseitigung oder Verringerung der Wirkung auf Nervenzellen kann zur Aktivierung des Neuronen-Todprogramms führen. - Letztendlich werden positive Signale generiert Start des Apoptose-Programms. Somit aktiviert die Bindung von FIO (FasL) an seinen Membranrezeptor CD95 (Fas) das Zelltodprogramm. - Gemischte Signale sind eine Kombination der Wirkungen von Signalen der ersten und zweiten Gruppe. Somit unterliegen Lymphozyten, die durch Mitogen stimuliert werden, aber nicht mit fremdem Ag in Kontakt kommen, der Apoptose. Auch diejenigen Lymphozyten, die von Ag betroffen waren, aber keine anderen Signale, wie zum Beispiel mitogen oder HLA, empfingen, sterben ab.
Unter intrazellulär ApoptosereizeÜberschüssiges H+, freie Radikale von Lipiden und anderen Substanzen, erhöhte Temperatur, intrazelluläre Viren und Hormone, die ihre Wirkung über Kernrezeptoren ausüben (z. B. Glukokortikoide), wurden aufgezeichnet.
Apoptose: Initiationsstadium.
Programmierphase
Programmierphase(Kontrolle und Integration von Apoptoseprozessen) ist in der Abbildung dargestellt.
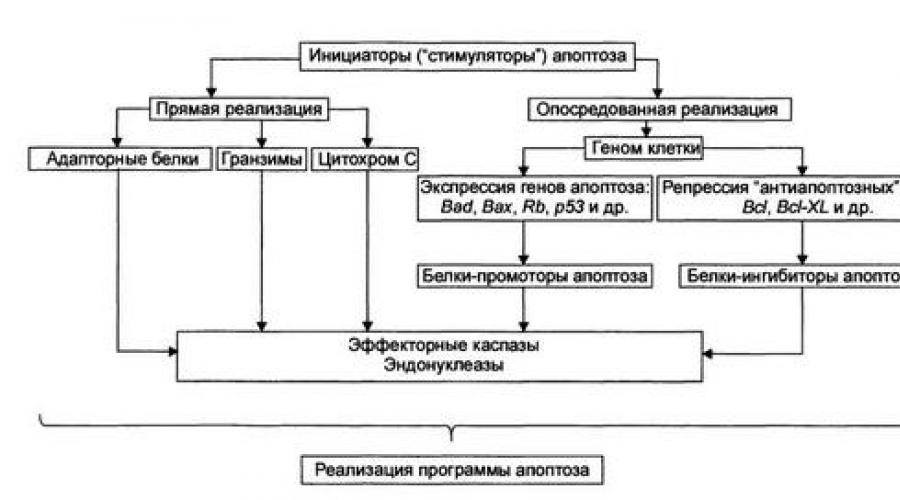
In diesem Stadium sind entweder spezialisierte Proteine vorhanden ein Signal für Apoptose umsetzen durch Aktivierung des Exekutivprogramms (seine Effektoren sind Cysteinproteasen – Caspasen und Endonukleasen) oder Blockierung eines potenziell tödlichen Signals.
Es gibt zwei (die sich nicht gegenseitig ausschließen) Implementierungsmöglichkeiten für Programmierschritte: 1) durch direkte Aktivierung von Effektor-Caspasen und Endonukleasen (unter Umgehung des Zellgenoms) und 2) durch genomvermittelte Signalübertragung an Effektor-Caspasen und Endonukleasen.
Direkte Signalübertragung erfolgt über Adapterproteine, Granzyme und Cytochrom C.
Adapterproteine. Caspase-8 fungiert beispielsweise als Adapterprotein. Auf diese Weise entfalten Killer-T-Lymphozyten-Zytokine, TNF und andere CD95-Liganden ihre Wirkung gegen fremde Zellen.
Cytochrom C. Aus Mitochondrien freigesetzt, bildet Cytochrom C zusammen mit dem Apaf-1-Protein und Caspase-9 einen Aktivierungskomplex (Apoptosom) von Effektor-Caspasen. Caspase-8 und Caspase-9 aktivieren Effektorcaspasen (z. B. Caspase-3), die an der Proteinproteolyse beteiligt sind.
Granzyme. Diese Proteasen werden von zytotoxischen T-Lymphozyten sezerniert und gelangen durch zytoplasmatische Poren, die durch Perforine gebildet werden, in die Zielzellen. Granzyme aktivieren Aspartat-spezifische Cysteinproteasen der Zielzelle, die Apoptose durchläuft.
Direkte Signalübertragung Wird normalerweise in nichtnukleären Zellen beobachtet, beispielsweise in Erythrozyten.

Apoptose: Programmierphase.
Indirekte Signalübertragung beinhaltet die Unterdrückung von Genen, die für Apoptose-Inhibitoren kodieren, und die Aktivierung von Genen, die für Apoptose-Promotoren kodieren.
Apoptose-Inhibitor-Proteine(z. B. Expressionsprodukte der anti-apoptotischen Gene Bcl-2, Bcl-XL) blockieren die Apoptose (z. B. durch Verringerung der Permeabilität der Mitochondrienmembranen, wodurch die Wahrscheinlichkeit verringert wird, dass einer der auslösenden Faktoren der Apoptose, Cytochrom C, ins Zytosol freigesetzt).
Apoptose-Promotorproteine(z. B. Proteine, deren Synthese durch die Bad-, Box-, Rb- oder /t53-Antionkogene gesteuert wird) aktivieren Effektorcasasen und Endonukleasen.
Definition von Apoptose. Apoptose ist ein Phänomen des erblich programmierten Zelltods. Jede Zelle ist bei ihrer Geburt sozusagen auf Selbstzerstörung programmiert. Die Bedingung ihres Lebens besteht darin, dieses Selbstmordprogramm zu blockieren.
Apoptose tritt in Zellen auf:
Alte, die ihre Nützlichkeit überlebt haben;
Zellen mit gestörter Differenzierung;
Zellen mit genetischen Störungen;
Mit Viren infizierte Zellen.
Morphologische Anzeichen der Apoptose.
Zellschrumpfung;
Kondensation und Fragmentierung des Kerns;
Zerstörung des Zytoskeletts;
Bullöser Vorsprung Zellmembran.
Merkmale der Apoptose - Apoptose verursacht keine Entzündung im umliegenden Gewebe. Der Grund ist der Erhalt der Membran und → die Isolierung schädigender Faktoren im Zytoplasma bis zum Abschluss des Prozesses (O 2 -, H 2 O 2, lysosomale Enzyme). Dieses Merkmal ist im Gegensatz zur Nekrose ein wichtiges positives Merkmal der Apoptose. Bei einer Nekrose wird die Membran sofort beschädigt (oder gerissen). Daher wird bei der Nekrose der Inhalt des Zytoplasmas freigesetzt (O 2 -, H 2 O 2, lysosomale Enzyme). Es kommt zu einer Schädigung benachbarter Zellen und einem Entzündungsprozess. Wichtiges Merkmal Apoptose – die Entfernung absterbender Zellen erfolgt ohne die Entwicklung einer Entzündung.
Apoptose-Prozess - kann in 2 (zwei) Phasen unterteilt werden:
1. Bildung und Weiterleitung apoptotischer Signale – Entscheidungsphase.
2. Abbau zellulärer Strukturen – Effektorphase.
1. Phase – Entscheidungsfindung (=Bildung und Akzeptanz apoptotischer Signale). Dies ist die Phase der Annahme von Reizen für die Apoptose. Abhängig von der Art der Reize kann es zwei (2) Arten von Signalwegen geben:
1) DNA-Schaden durch Strahlung, Einwirkung toxischer Stoffe, Glukokortikoide etc.
2) Aktivierung von Rezeptoren der „Zelltodregion“.. Rezeptoren der Zelltodregion sind eine Gruppe von Rezeptoren auf den Membranen aller Zellen, die proapoptotische Reize wahrnehmen. Steigt die Zahl und Aktivität solcher Rezeptoren, steigt auch die Zahl der apoptisch absterbenden Zellen. Zu den Rezeptoren der „Zelltodregion“ gehören: a) TNF-R (bindet an den Tumornekrosefaktor und aktiviert die Apoptose); b) Fas-R (k); c) CD45-R (bindet an Antikörper und aktiviert Apoptose).
Abhängig von der Art des Signals gibt es zwei (zwei) Hauptmethoden der Apoptose: a) als Folge einer DNA-Schädigung;
b) als Ergebnis einer unabhängigen Aktivierung der Rezeptoren der „Zelltodregion“ ohne DNA-Schädigung.
2. Phase – Effektor (= Abbau zellulärer Strukturen. Die Hauptakteure der Effektorphase:
Cysteinproteasen (Caspasen);
Endonukleasen;
Serin- und lysosomale Proteasen;
Ca++ aktivierte Proteasen (Calpein)
Aber! Unter ihnen sind Caspasen die wichtigsten Effektoren für den Abbau zellulärer Strukturen.
Klassifizierung von Caspasen – 3 (drei) Gruppen:
Effektor-Caspasen – Caspasen 3, 6, 7.
Induktoren der Aktivierung von Effektor-Caspasen – Caspasen 2, 8, 9, 10. = Aktivatoren von Zytokinen – Caspasen 1, 4, 5, 13.
Effektor-Caspasen sind die Caspasen 3, 6, 7. Dies sind die direkten Ausführer der Apoptose. Diese Caspasen befinden sich in der Zelle in einem inaktiven Zustand. Aktivierte Effektor-Caspasen starten eine Kette proteolytischer Ereignisse, deren Zweck darin besteht, die Zelle zu „zerlegen“. Sie werden durch Induktoren der Aktivierung von Effektor-Caspasen aktiviert.
Induktoren der Aktivierung von Effektor-Caspasen – Caspasen 2, 8, 9, 10. Die Hauptinduktoren sind die Caspasen 8 und 9. Sie aktivieren Effektor-Caspasen. Der Mechanismus besteht in der Abspaltung von Asparaginsäurebasen und der anschließenden Dimerisierung der aktiven Untereinheiten. Diese Caspasen sind normalerweise in Zellen inaktiv und liegen in Form von Procaspasen vor.
Die Aktivierung bestimmter Induktoren hängt von der Art des Signalwegs ab:
1. Wenn eine DNA-Schädigung auftritt, wird der Signalweg Nr. 1 aktiviert, Caspase Nr. 9 wird aktiviert.
2. Bei der Aktivierung von Zelltodrezeptoren ist der Signalweg Nr. 2 beteiligt, Caspase Nr. 8 wird aktiviert.
Signalweg Nr. 1 (assoziiert mit DNA-Schäden)
DNA-Schaden
Aktivierung des p53-Gens und Produktion des entsprechenden Proteins
Aktivierung proapoptotischer Gene der BCL-2-Familie (BAX und BID)
Bildung von Proteinen dieser Gene
Caspase 9-Aktivierung
Caspase 3-Aktivierung
Signalweg Nr. 2
(verbunden mit der Aktivierung der „Zelltodregion“)
Ligand + Rezeptoren der „Zelltodregion“
Aktivierung von Caspase Nummer 8
Unabhängige Aktivierung von Caspase Nummer 3
Aktivierung anderer Caspasen und Proteasen
Regulierung der Apoptose. Forschung den letzten Jahren führte zur Schaffung eines Apoptosemodells. Nach diesem Modell ist jede Zelle bei ihrer Geburt auf Selbstzerstörung programmiert. Daher besteht ihre Lebensbedingung darin, dieses Selbstmordprogramm zu blockieren. Die Hauptaufgabe der Apoptoseregulation besteht darin, Effektorcaspasen in einem inaktiven Zustand zu halten, sie aber schnell in einen inaktiven Zustand umzuwandeln Aktive Form als Reaktion auf die minimale Wirkung der entsprechenden Induktoren.
Daher das Konzept der Inhibitoren und Aktivatoren der Apoptose.
Apoptosehemmer (=anti-apoptotische Faktoren). Zu den schwerwiegendsten Apoptose-Inhibitoren zählen Wachstumsfaktoren. Andere: neutrale Aminosäuren, Zink, Östrogene, Androgene, einige Proteine.
Beispiel: Proteine der IAP-Familie unterdrücken die Aktivität der Caspasen 3 und 9. Denken Sie daran: Eines dieser Proteine (Survin) kommt in Tumorzellen vor. Es ist mit der Resistenz von Tumorzellen gegenüber Chemotherapie verbunden
Aktivatoren der Apoptose (=proapoptotische Faktoren). Dies sind proapoptotische Gene und ihre Produkte: a) Gene der BCL-2-Familie (BAX und BID); b) Rb- und P53-Gene (lösen Apoptose aus, wenn die Zelle durch den Checkpoint-Mechanismus festgehalten wird).
Zusammenfassung. Die Pathogenese vieler Krankheiten, einschließlich Tumoren, ist mit einer verminderten Fähigkeit von Zellen zur Apoptose verbunden. Daher die Ansammlung beschädigter Zellen und die Bildung eines Tumors.
PATHOPHYSIOLOGIE DER ZELLTEILUNG
Der Hauptunterschied zwischen der Teilung einer gesunden und einer Tumorzelle:
Die Teilung einer gesunden Zelle wird parakrin und endokrin reguliert. Die Zelle gehorcht diesen Signalen und teilt sich nur, wenn der Körper die Bildung neuer Zellen eines bestimmten Typs benötigt.
Die Zellteilung von Tumoren wird autokrin reguliert. Die Tumorzelle selbst produziert mitogene Stimulanzien und teilt sich unter deren Einfluss. Es reagiert nicht auf parakrine und endokrine Reize.
Es gibt 2 (zwei) Mechanismen der Tumorzelltransformation:
1. Aktivierung von Onkogenen.
2. Inaktivierung von Suppressorgenen.
ONKOGEN-AKTIVIERUNG
Zunächst einmal 2 (zwei) Hauptkonzepte: = Protoonkogene;
Onkogene.
Protoonkogene sind normale, intakte Gene, die eine gesunde Zellteilung steuern.
Zu den Protoonkogenen gehören Gene, die Bildung und Arbeit steuern:
1. Wachstumsfaktoren.
2. Membranrezeptoren für Wachstumsfaktoren, beispielsweise Tyrosinkinaserezeptoren.
3. Ras-Proteine.
4. MAP-Kinasen, Teilnehmer der MAP-Kinase-Kaskade.
5. AP-1-Transkriptionsfaktoren.
Onkogene sind beschädigte Protoonkogene. Der Prozess der Schädigung eines Protoonkogens und seiner Umwandlung in ein Onkogen wird Onkogenaktivierung genannt.
Mechanismen der Onkogenaktivierung.
1. Einbeziehung (Einfügung) des Promoters. Ein Promotor ist eine DNA-Region, an die die Protoonkogen-RNA-Polymerase bindet. Voraussetzung– Der Promotor muss sich in unmittelbarer Nähe zum Protoonkogen befinden. Daher die Optionen: a) Promotor – eine DNA-Kopie von Oncornaviren; b) „springende Gene“ – DNA-Abschnitte, die sich bewegen und in verschiedene Teile des Zellgenoms integrieren können.
2. Amplifikation – eine Erhöhung der Anzahl von Protoonkogenen oder das Auftreten von Kopien von Protoonkogenen. Protoonkogene haben normalerweise eine geringe Aktivität. Mit einer Zunahme der Anzahl oder des Auftretens von Kopien nimmt deren Gesamtaktivität deutlich zu, was zu einer Tumortransformation der Zelle führen kann.
3. Translokation von Protoonkogenen. Dies ist die Bewegung eines Protoonkogens zu einem Ort mit einem funktionierenden Promotor.
4. Mutationen von Protoonkogenen.
Produktion von Onkogenen. Onkogene bilden ihre eigenen Proteine. Diese Proteine werden „Onkoproteine“ genannt.
Die Synthese von Onkoproteinen wird als „Expression aktiver zellulärer Onkogene“ bezeichnet.
Onkoproteine sind im Grunde Analoga von protoonkogenen Proteinen: Wachstumsfaktoren, Ras-Proteine, MAP-Kinasen, Transkriptionsfaktoren. Es gibt jedoch quantitative und qualitative Unterschiede zwischen Onkogenen und protoonkogenen Proteinen.
Unterschiede zwischen Onkoproteinen und normaler Protoonkogenproduktion:
1. Erhöhte Synthese von Onkoproteinen im Vergleich zur Synthese von Protoonkogenproteinen.
2. Onkoproteine weisen strukturelle Unterschiede zu protoonkogenen Proteinen auf.
Wirkmechanismus von Onkoproteinen.
1. Onkoproteine binden an Rezeptoren für Wachstumsfaktoren und bilden Komplexe, die ständig Signale für die Zellteilung erzeugen.
2. Onkoproteine erhöhen die Empfindlichkeit von Rezeptoren gegenüber Wachstumsfaktoren oder verringern die Empfindlichkeit gegenüber Wachstumshemmern.
3. Onkoproteine können selbst als Wachstumsfaktoren wirken.
INAKTIVIERUNG VON SUPPRESSOR-GENEN
Suppressorgene: Rb Und S. 53.
Ihre Produkte sind die entsprechenden Proteine.
Die Inaktivierung von Suppressorgenen (erblich oder erworben) führt dazu, dass Zellen mit beschädigter DNA in die Mitose übergehen, sich vermehren und ansammeln. Das - möglicher Grund Tumorbildung.
TUMORWACHSTUM: DEFINITION, URSACHEN FÜR DIE ERHÖHUNG DER ZAHL BÖSARTIGER ERKRANKUNGEN
Ein Tumor ist eine pathologische Wucherung, die sich von anderen pathologischen Wucherungen durch ihre erblich festgelegte Fähigkeit zu unbegrenztem unkontrolliertem Wachstum unterscheidet.
Andere pathologische Wucherungen sind Hyperplasie, Hypertrophie und Regeneration nach Schäden.
Gründe für den Anstieg der Zahl bösartiger Erkrankungen in der Bevölkerung:
1. Erhöhte Lebenserwartung.
2. Verbesserung der Qualität der Diagnostik → Erhöhung der Krebserkennung.
3. Verschlechterung Umweltsituation, Erhöhung des Gehalts an krebserregenden Faktoren in der Umwelt.
GUT- UND BÖSARTIGE TUMOREN
Eine einheitliche Klassifizierung von Tumoren wurde bisher nicht erstellt. Ursache:
1. Eine Vielzahl von Anzeichen, die für verschiedene Tumoren charakteristisch sind.
2. Unzureichende Kenntnisse über ihre Ätiologie und Pathogenese.
Moderne Klassifikationen basieren auf den wichtigsten morphologischen und klinischen Anzeichen von Tumoren.
Basierend auf den klinischen Merkmalen werden alle Tumoren in gutartige und bösartige unterteilt.
Gutartige Tumoren:
1. Tumorzellen sind morphologisch identisch oder ähnlich zu normalen Vorläuferzellen.
2. Der Differenzierungsgrad von Tumorzellen ist recht hoch.
3. Die Wachstumsrate ist über viele Jahre hinweg langsam.
4. Die Natur des Wachstums ist expansiv, d.h. Während des Tumorwachstums werden benachbarte Gewebe auseinanderbewegt, manchmal komprimiert, aber normalerweise nicht beschädigt.
5. Die Abgrenzung zum umgebenden Gewebe ist klar.
6. Die Fähigkeit zur Metastasierung fehlt.
7. Keine ausgeprägten negativen Auswirkungen auf den Körper. Ausnahme: Tumoren in der Nähe lebenswichtiger Zentren. Beispiel: Ein Gehirntumor, der die Nervenzentren komprimiert.
Bösartige Tumore.
1. Tumorzellen unterscheiden sich morphologisch von normalen Vorläuferzellen (oft bis zur Unkenntlichkeit).
2. Der Differenzierungsgrad der Tumorzellen ist gering.
3. Die Wachstumsrate ist schnell.
4. Die Natur des Wachstums ist invasiv, d. h. der Tumor wächst in benachbarte Strukturen hinein. Ausschlaggebende Faktoren:
Tumorzellen erlangen die Fähigkeit, sich vom Tumorknoten zu lösen und sich aktiv zu bewegen;
Die Fähigkeit von Tumorzellen, „Karzinoaggressine“ zu produzieren. Hierbei handelt es sich um Proteine, die in das umgebende normale Gewebe eindringen und die Chemotaxis für Tumorzellen stimulieren.
Reduzierte Zelladhäsionskräfte. Dies erleichtert die Ablösung der Tumorzellen vom Primärknoten und deren anschließende Bewegung.
Reduzierung der Kontaktbremsung.
5. Abgrenzung zum umliegenden Gewebe – nein.
6. Die Fähigkeit zur Metastasierung ist ausgeprägt.
7. Die Wirkung auf den Körper ist ungünstig und allgemein.
Phänomene programmierter Zelltod sind seit mehr als 100 Jahren bekannt, blieben jedoch „im Schatten“ nekrobiotischer Prozesse, die seit Jahrzehnten viel aktiver untersucht werden als der programmierte Tod. Diese Art des Zelltods ist der wichtigste integrale Bestandteil der Embryogenese, Morphogenese und des Gewebewachstums sowie der hormonabhängigen Involution. Er, zusammen mit lysosomalen Autophagie ist an den Mechanismen solcher zellulärer Anpassungen beteiligt wie Atrophie(Verringerung der Zellgröße und der Anzahl funktionierender Strukturen in ihnen bei gleichzeitiger Aufrechterhaltung der Zelllebensfähigkeit) und Hypoplasie(Verkleinerung eines Organs aufgrund einer Verringerung der Anzahl seiner Zellen unter Beibehaltung seiner Lebensfähigkeit).
Beispielsweise wurde gezeigt, dass involutive Veränderungen in der Nebennierenrinde nach einer Hypophysektomie durch Actinomycin D gehemmt werden und daher einen aktiven Prozess zur Umsetzung eines bestimmten Programms zur Selbstzerlegung von Zellen darstellen.
Der Begriff bezeichnet den Prozess des programmierten Zelltods, der sich morphologisch und pathochemisch von der Nekrobiose unterscheidet „Apoptose“. Die Begründer der Apoptoselehre, insbesondere J. Kerr et al., hielten die Konzepte „programmierter Zelltod“ und „Apoptose“ für gleichwertig. IN In letzter Zeit Es besteht die Tendenz, den ersten Begriff auf die Prozesse der Zelleliminierung in der frühen Ontogenese anzuwenden und das Konzept der Apoptose nur auf den programmierten Tod reifer differenzierter Zellen zu beziehen. Somit weisen sie auf das Vorhandensein von Autophagie und das Fehlen von DNA-Brüchen während des Zelltods embryonaler Zellen hin, im Gegensatz zur Apoptose reifer Zellen.
Die Frage nach dem Zusammenhang zwischen Nekrobiose und Apoptose und ob diese Mechanismen mit natürlichem oder gewaltsamem Zelltod verbunden sind, bedarf der Diskussion. Es wäre eine Vereinfachung zu sagen, dass Apoptose ausschließlich ein Prozess des natürlichen Zelltods ist und Nekrobiose ein gewaltsamer Prozess ist. Die Aufteilung in diese beiden Prozesse ist alles andere als absolut. Wenn wir oben über Muster der Nekrobiose sprechen, mussten wir bereits mehrfach die Apoptose erwähnen, da diese Prozesse viele Gemeinsamkeiten aufweisen. Tatsache ist, dass Zellen als Reaktion auf minimale Schäden oder Schäden, die nicht zu einer schnellen Entwicklung einer tiefen Hypoxie und eines ausgeprägten Energiemangels führen, ein spezielles Selbstzerstörungsprogramm einschalten und mit Apoptose reagieren können. In diesem Fall zum Beispiel beim Handeln ionisierende Strahlung oder dem AIDS-Virus, der Zelltod ist gewaltsam, aber sein Mechanismus ist nicht nekrobiotisch, sondern apoptotisch. Stier Stadtrat, B. bei Virushepatitis in der Leber, sind das Ergebnis der Apoptose von Hepatozyten unter dem Einfluss einer virusinduzierten Schädigung. Dies ist ebenfalls ein gewaltsamer Tod, aber sein Mechanismus ist nicht mit einer schnell fortschreitenden Hypoxie verbunden und gibt der Zelle Zeit, das Selbstzerlegungsprogramm einzuschalten. Es besteht kein Zweifel an der gewaltsamen Natur des Todes von Zielzellen unter dem Einfluss des Tumornekrosefaktors. Trotz seines kategorischen Namens verursacht dieser Bioregulator jedoch nicht nur Nekrose, sondern auch Apoptose in Zielzellen. Bei der Umsetzung von Nekrobiose und Apoptose wirken viele gemeinsame Mechanismen, beispielsweise ein Anstieg der zytoplasmatischen Konzentration von ionisiertem Kalzium und die Bildung freier reaktiver Sauerstoffradikale. Darüber hinaus kann ein apoptogener Reiz bei größerer Stärke und Intensität der Wirkung eine Nekrobiose verursachen, was offenbar auf die Tatsache zurückzuführen ist, dass der fortschreitende Energiemangel es den Zellen nicht ermöglicht, die energetisch „teure“ Dynamik der Apoptose umzusetzen.
Tabelle 1
Typische Merkmale der wichtigsten Methoden des Zelltods.
|
Nekrobiose und Nekrose |
||
|
Morphologisches Bild |
Kondensation und Fragmentierung des Zytoplasmas, Kondensation und Rexis des Zellkerns, Autophagie der Mitochondrien, Membranen bleiben lange stabil. Es liegt keine perifokale Entzündung oder Abgrenzung vor. Apoptotische Körper werden gebildet und phagozytiert. |
Karyopyknose oder Karyolyse, Schwellung und anschließende Schrumpfung und Verkalkung der Mitochondrien, frühe Membranzerstörung, Zellautolyse, perifokale Entzündung, Abgrenzungsschaft |
|
Pathochemie |
Es besteht kein ausgeprägter Energiemangel, geordnete internukleosomale DNA-Brüche, Synthese von HSP, APO-1 und anderen speziellen Proteinen, Aktivierung der Endonuklease. Fragmentierung des Zytoplasmas unter Beteiligung des Zytoskeletts. Hemmung durch Kalziumkanalblocker und Actinomycin D-1. |
Schwerer Energiemangel, Zellhyperhydratation, Azidose, Hydrolyse, diffuser Chromatinabbau. Stoppen der Proteinsynthese. Parese und Aggregation von Zytoskelettelementen. |
|
Ätiologie |
Exposition gegenüber mittelschweren Schäden und spezifischen, nicht schädigenden Auslösesignalen (Hormone, Zytokine) |
Exposition gegenüber starken Extremfaktoren |
Wenn die Nekrobiose immer mit der Freisetzung von Entzündungsmediatoren, insbesondere Lipidprodukten der Zellmembranzerstörung, in das umliegende Gewebe und bei massiver Schädigung in den systemischen Kreislauf einhergeht, erfolgt die Apoptose ohne Leukozytenabgrenzung und perifokale Entzündung , da sein Mechanismus eine signifikante Freisetzung von Mediatoren für Zellschäden vermeidet. Die Veröffentlichung einer umfassenden Monographie über Apoptose im Jahr 1996 erleichtert unsere Aufgabe und ermöglicht es, in diesem Buch nur die allgemeinsten und pathophysiologisch wichtigsten Aspekte dieses Problems zu charakterisieren.
1. Eliminierung von Zellen in der frühen Ontogenese.
2. Physiologische Rückbildung und Ausgleich von Mitosen in reifen Geweben und Zellpopulationen
3. Umsetzung von Atrophieprozessen und Rückbildung der Hyperplasie
4. Altruistischer Selbstmord mutierter und virusinfizierter Zellen
5. Zelltod nach schwacher Einwirkung von Stoffen, die bei massiven Läsionen Nekrose verursachen.
Um die Unterschiede zwischen Nekrobiose und Apoptose deutlicher darzustellen, schlagen die Autoren vor, die folgende Tabelle im Detail zu studieren.
Es ist wichtig zu beachten, dass eine Nekrose nach einem gewaltsamen Zelltod aus allen Gründen auftritt, die eine tiefe Gewebehypoxie verursachen, und immer eine lytische Komponente in Form einer lysosomalen Autolyse oder einer durch Phagozytenhydrolasen verursachten Heterolyse enthält. Nach modernen Konzepten ist die Autolyse beim Zelltod postmortaler Natur und kein Element der Nekrobiose. Eine frühe und erhebliche Schädigung der Zellmembranen ist jedoch ein wesentlicher Bestandteil der Nekrobioseprozesse und wird bei der Apoptose praktisch nicht beobachtet.
Apoptose ist ein genetisch kontrollierter Prozess, der durch verschiedene Auslöser ohne nennenswerte vorherige Schädigung des Exekutivapparats der Zelle ausgelöst werden kann, obwohl er nach mäßiger Schädigung wie altruistischer Selbstmord ausgelöst werden kann. Durch die Expression von seneszenten Zellantigenen ist auch eine Eliminierung von Zellen ohne Schädigung möglich. Es ist möglich, dass diese Mechanismen des „Austritts ohne Skandal“ kombiniert sind und/oder interagieren.
Grundsätzlich ist es wichtig, dass, wenn sie nicht in die Apoptose eintreten können, ein sich unbegrenzt vermehrender Zellklon entsteht, der zu schwerwiegenden Störungen in einem vielzelligen Organismus führt und beispielsweise bei Krebs beobachtet wird. Bisher haben wir in diesem Buch oft auf den relativen Nutzen und die potenzielle Pathogenität verschiedener programmierter Abwehrprozesse hingewiesen und Beispiele für eine solche „Nützlichkeit“ genannt. In diesem Fall sehen wir den Hauptwiderspruch der Pathophysiologie sozusagen aus der entgegengesetzten Perspektive. Mit anderen Worten, Apoptose im Zellzyklus fungiert als minimales programmiertes Übel und veranschaulicht auch den Hauptpunkt unserer Überlegungen, da es sich um adaptiven Tod, Tod gemäß dem Programm und eine Art „nützlichen Schaden“ handelt reiner Form. Beobachtungen an bösartigen Zellen, die unter dem Einfluss von Onkogenen die Fähigkeit zur Apoptose verloren haben, beweisen jedenfalls, dass der Verlust der Fähigkeit, rechtzeitig abzusterben, für Zellen ein großes Übel darstellt.
Apoptose kann als Reaktion von Genen, die die Selbstzerlegung der Zelle programmieren, auf ein rezeptorvermitteltes Signal beginnen (z. B. bei Stimulation von TNF-Rezeptoren oder des Glukokortikoidrezeptors von Lymphozyten durch geeignete Bioregulatoren).
Nicht nur TNF und Glukokortikoide, sondern fast alle Zytokine, darunter 13 Interleukine und 3 Interferone, können Codesignale für die Apoptose sein und in manchen Zellen sie auslösen, in anderen hemmen sie sie. Gewebespezifische Wachstumsfaktoren und Hämatopoetine hemmen die Apoptose ihrer Zielzellen. Tropische Hormone der Hypophyse üben ihre trophische Wirkung auch auf Zieldrüsen aus, indem sie die Apoptose hemmen.
Das Signal kann je nach Ausgangszustand des Ziels eine multidirektionale Wirkung auf die Zelle hinsichtlich der Apoptose haben, wie oben für TNF beschrieben.
Die Gene FAS/APO-1, c-myc, max, p53, ced-3 und andere können als genetische Auslöser der Apoptose fungieren, die als Reaktion auf ein Rezeptorsignal ausgelöst wird. Auch die Unterdrückung der Expression bestimmter Gene wie bcl-2 führt zur Apoptose. Detaillierte Untersuchungen der Mechanismen, durch die diese Genprodukte Apoptose auslösen oder hemmen, haben gerade erst begonnen. Es wurde jedoch bereits festgestellt, dass sie die Bildung reaktiver Sauerstoffradikale verstärken können (als APO-1-Protein, homolog zum Tumor-Nekrose-Faktor-Rezeptor), den Transport von Kalzium in das Zytoplasma regulieren (als Produkt der Bcl- 2-Gen) und lösen neutrale Proteasen des Zytosols aus (als Produkt des ced-3-Gens), binden an DNA (als Dimer von Mus-Mah-Proteinen).
Grundsätzlich ist es wichtig, dass Apoptose auch in nicht-nuklearen postzellulären Strukturen induziert werden kann. Folglich können der primäre Zusammenhang der Apoptose nicht nur nukleare Ereignisse sein, sondern auch bestimmte metabolische Veränderungen im Zytoplasma oder die Aktivierung langlebiger Boten-RNAs, wie es beim Antigen seneszenter Zellen der Fall ist.
Reaktive Sauerstoffradikale (RORs) können Apoptose auslösen. Bei mäßiger Zellschädigung ohne Hypoxie wird das Transmembranpotential der Mitochondrien verringert und sie erzeugen ACR. Wenn die Antioxidationssysteme der Zelle die Verschiebung des Redoxpotentials nicht kompensieren, schreitet der Prozess voran. Ohne ausgeprägten Energiemangel und ohne Erhaltung des genetischen Apparats kommt es zur Apoptose, tiefe Hypoxie und schwere DNA-Schäden lösen jedoch eine Nekrobiose aus. Mit der Entwicklung der Apoptose verändern ACRs die Bedingungen der Wechselwirkung von Calcium mit Calmodulin und tragen zu einer Erhöhung der zytoplasmatischen und intranukleären Aktivität (und bei Blockade des bcl-2-Gens zu einer Erhöhung der intrazellulären Konzentration) von Calcium bei.
Die kalziumabhängige Komponente des Apoptosemechanismus aktiviert Calpaine, was zur Proteolyse von Zytoskelettproteinen, zur Bildung von Zytoplasmavorsprüngen und zur Zerstörung internukleosomaler Bindungen im Zellkern führt. Die kalziumabhängige Endonuklease wird aktiviert. Dies führt zu geordneten internukleosomalen Chromatinbrüchen und einer Kernfragmentierung. Calciumabhängige Transglutaminase aggregiert zytosolische Proteine. Die letzte Phase des Prozesses ist der Zerfall der Zellen in apoptotische Körper und deren Autophagozytose.
Apoptose
Der Zelltod im Körper kann auf zwei Arten eintreten: Nekrose Und Apoptose.
Apoptose– Hierbei handelt es sich um eine Form des Zelltods, bei dem die Zelle selbst aktiv am Prozess ihres Absterbens beteiligt ist, d. h. Es kommt zur Selbstzerstörung der Zelle. Apoptose ist im Gegensatz zu Nekrose ein aktiver Prozess; nach Einwirkung ätiologischer Faktoren wird eine genetisch programmierte Reaktionskaskade ausgelöst, die mit der Aktivierung bestimmter Gene, der Synthese von Proteinen und Enzymen einhergeht und zu einer wirksamen und schnellen Entfernung von Zellen führt das Gewebe.
Ursachen der Apoptose.
1. Während der Embryogenese spielt die Apoptose eine wichtige Rolle bei der Zerstörung verschiedener Gewebeprimordien und der Organbildung.
2. Alternde Zellen, die ihren Entwicklungszyklus abgeschlossen haben, beispielsweise Lymphozyten, deren Zytokinvorrat erschöpft ist, unterliegen der Apoptose.
3. In wachsenden Geweben unterliegt ein bestimmter Teil der Tochterzellen der Apoptose. Der Prozentsatz absterbender Zellen kann durch systemische und lokale Hormone reguliert werden.
4. Die Ursache der Apoptose kann eine schwache Einwirkung schädlicher Faktoren sein, die bei größerer Intensität zu Nekrose (Hypoxie, ionisierende Strahlung, Toxine usw.) führen können.
Pathogenese der Apoptose:
Eine Zelle erleidet Apoptose, wenn im Zellkern ein DNA-Schaden auftritt, der durch das Reparatursystem nicht korrigiert werden kann. Dieser Prozess wird durch ein Protein überwacht, das vom p53-Gen kodiert wird. Gelingt es nicht, den DNA-Defekt zu beseitigen, wird unter dem Einfluss des p53-Proteins das Apoptoseprogramm aktiviert.
Viele Zellen verfügen über Rezeptoren, deren Wirkung eine Aktivierung der Apoptose bewirkt. Am besten untersucht sind der Fas-Rezeptor, der auf Lymphozyten vorkommt, und der Tumornekrosefaktor-alpha (TNF-α)-Rezeptor, der auf vielen Zellen vorkommt. Diese Rezeptoren spielen eine wichtige Rolle bei der Entfernung autoreaktiver Lymphozyten und der Regulierung der Konstanz der Zellpopulationsgröße durch Feedback.
Apoptose kann durch verschiedene Metaboliten und Hormone aktiviert werden: entzündungshemmende Zytokine, Steroidhormone, Stickoxid (NO) und freie Radikale.
Bei Sauerstoffmangel im Gewebe wird die Zellapoptose aktiviert. Der Grund für seine Aktivierung kann die Wirkung freier Radikale, die Störung energieabhängiger DNA-Reparaturprozesse usw. sein.
Zellen, die den Kontakt zur extrazellulären Matrix, zur Basalmembran oder zu benachbarten Zellen verloren haben, unterliegen der Apoptose. Der Verlust dieses Apoptosemechanismus in Tumorzellen führt zur Entstehung der Fähigkeit zur Metastasierung.
Einige virale Proteine können die Zellapoptose nach der Selbstorganisation des Virus in einer infizierten Zelle aktivieren. Die Aufnahme apoptotischer Körper durch benachbarte Zellen führt zu deren Infektion mit dem Virus. Das AIDS-Virus kann auch die Apoptose nicht infizierter Zellen aktivieren, die einen CD4-Rezeptor auf ihrer Oberfläche haben.
Es gibt auch Faktoren, die die Apoptose verhindern. Viele Metaboliten und Hormone, beispielsweise Sexualhormone und proinflammatorische Zytokine, können die Apoptose verlangsamen. Die Apoptose kann aufgrund von Defekten im Zelltodmechanismus, beispielsweise durch eine Mutation im p53-Gen oder die Aktivierung von Genen, die die Apoptose hemmen (bcl-2), stark verlangsamt werden. Viele Viren haben die Fähigkeit, die Apoptose zu hemmen, nachdem sie für die Zeit der Synthese ihrer eigenen Strukturproteine ihre eigene DNA in das Zellgenom integriert haben.
Morphologische Manifestationen der Apoptose
Apoptose weist ihre eigenen charakteristischen morphologischen Merkmale auf, sowohl auf lichtoptischer als auch auf ultrastruktureller Ebene. Die deutlichsten morphologischen Merkmale werden durch Elektronenmikroskopie sichtbar. Eine Zelle, die Apoptose durchläuft, ist gekennzeichnet durch:
Zellkomprimierung. Die Größe der Zelle nimmt ab; das Zytoplasma wird dichter; Organellen, die relativ normal erscheinen, sind kompakter angeordnet. Es wird angenommen, dass es durch die Aktivierung von Transglutaminase und Cysteinproteasen (Caspasen) in apoptotischen Zellen zu einer Störung der Zellform und des Zellvolumens kommt. Die erste Gruppe von Enzymen bewirkt die Bildung von Vernetzungen in zytoplasmatischen Proteinen, was zur Bildung einer Art Membran unter der Zellmembran führt, ähnlich wie bei der Verhornung von Epithelzellen, und die zweite Gruppe von Enzymen zerstört Proteine im Zytosol.
Chromatinkondensation. Dies ist die charakteristischste Manifestation der Apoptose. DNA wird durch Endonukleasen an den Bindungsstellen einzelner Nukleosomen gespalten, wodurch eine große Anzahl von Fragmenten entsteht, in denen die Anzahl der Basenpaare durch 180–200 geteilt ist, die dann unter der Kernmembran kondensieren. Der Kern kann in zwei oder mehr Fragmente zerfallen.
Bildung apoptotischer Körper. In einer apoptotischen Zelle kommt es zu tiefen Einstülpungen der Zellmembran, die zur Ablösung von Zellfragmenten, d.h. die Bildung membranumschlossener apoptotischer Körper, bestehend aus Zytoplasma und dicht angeordneten Organellen, mit oder ohne Kernfragmente.
Phagozytose Apoptotische Zellen oder Körper werden von umgebenden gesunden Zellen, sowohl Makrophagen als auch Parenchymzellen, ausgeführt. Apoptotische Körper werden in Lysosomen schnell zerstört und umliegende Zellen wandern entweder oder teilen sich, um den durch den Zelltod frei gewordenen Raum zu füllen.
Bei Färbung mit Hämatoxylin und Eosin wird Apoptose in einzelnen Zellen oder kleinen Zellgruppen nachgewiesen. Apoptotische Zellen haben eine runde oder ovale Form, ein stark eosinophiles Zytoplasma mit dichten Fragmenten von Kernchromatin. Da die Zellkompression und die Bildung apoptotischer Körper schnell erfolgen und ebenso schnell phagozytiert, zersetzt oder in das Lumen des Organs freigesetzt werden, wird in histologischen Präparaten bei signifikantem Schweregrad eine Apoptose nachgewiesen. Darüber hinaus geht die Apoptose – anders als die Nekrose – nie mit einer Entzündungsreaktion einher, was den histologischen Nachweis zusätzlich erschwert.
Zur Identifizierung von Zellen im Frühstadium der Apoptose werden spezielle immunhistochemische Untersuchungen eingesetzt, beispielsweise der Nachweis aktivierter Caspasen oder die TUNEL-Methode, die durch Endonukleasen gebrochene DNA sichtbar macht.
Die Bedeutung von Apoptose.
1. Apoptose ist in der Embryogenese (einschließlich Implantation und Organogenese) von großer Bedeutung. Ein beeinträchtigter Zelltod in den Interdigitalräumen kann zu Syndaktylie und dem Ausbleiben der Apoptose von überschüssigem Epithel während der Fusion der Gaumenfortsätze oder umgebenden Gewebe führen Neuralrohr, führt zu einer Verletzung der Gewebeverschmelzung auf beiden Seiten, die sich in einer Spalte des harten Gaumens bzw. einem Defekt des den Wirbelkanal begrenzenden Gewebes (Spina bifida) äußert.
2. Apoptose spielt eine wichtige Rolle bei der Aufrechterhaltung der Persistenz Zellzusammensetzung, insbesondere in hormonempfindlichen Geweben. Eine Verlangsamung der Apoptose führt zu Gewebehyperplasie, eine Beschleunigung – zu Atrophie. Es ist an der Ausscheidung des Endometriums beteiligt Menstruationszyklus, Atresie der Follikel in den Eierstöcken während der Menopause und Rückbildung des Brustgewebes nach Beendigung der Stillzeit.
3. B dieser Moment Derzeit werden zahlreiche Medikamente untersucht, die die Apoptose in bestimmten Geweben regulieren sollen. Somit kann die Beschleunigung der Apoptose immunkompetenter Zellen zur Behandlung von Autoimmunerkrankungen und zur Verhinderung einer Transplantatabstoßung eingesetzt werden, und die Verlangsamung der Apoptose kann zur Verhinderung der Apoptose in Geweben eingesetzt werden, die unter Ischämie, erhöhtem Außendruck oder vorübergehend inaktiven Geweben leiden. Die Verlangsamung der Apoptose bei Virusinfektionen verhindert die Ausbreitung der Infektion auf benachbarte Zellen.
4. Bei allen Tumoren ist die Apoptose in Tumorzellen beeinträchtigt. Dieser Abbau kann in verschiedenen Stadien der Apoptose erfolgen, beispielsweise kann es zu einer Mutation des p53-Gens kommen, die dazu führt, dass sich das mutierte p53-Protein in überschüssigen Mengen in der Zelle ansammelt, aber trotz Defekten in der Zelle keine Apoptose auslöst Zellgenom, was zur Vermehrung von Zellen mit gestörtem Genom führt, und mit jeder weiteren Teilung kommt es zu einer Häufung von DNA-Verletzungen. Manchmal kann sich normales oder „wildes“ p53-Protein in Tumorzellen ansammeln, wenn auf anderen Ebenen ein Zusammenbruch des Apoptosemechanismus auftritt. Bei der chronischen lymphatischen Leukämie wird eine Akkumulation von bcl-2-Genprodukten beobachtet, die zu einer pathologischen Verlängerung der Lebensdauer von Tumorzellen und einer Zellresistenz gegenüber verschiedenen proapoptotischen Faktoren führt. Manchmal ist die Übertragung von Signalen von Zelltodrezeptoren, beispielsweise vom TNF-α-Rezeptor, gestört. TNF-α ist an der Feedback-Regulation von Zellpopulationen beteiligt. Alle Zellen in der Population sezernieren TNF-α in geringen Mengen; Je mehr Zellen im Gewebe vorhanden sind, desto höher ist die TNF-α-Konzentration und damit der Grad der Apoptose. Auf diese Weise wird ein Gleichgewicht zwischen Zellproliferation und Zelltod erreicht. Tumorzellen verlieren unter dem Einfluss dieses Zytokins die Fähigkeit zur Apoptose und es reichert sich in großen Mengen im Tumorgewebe an. Infolgedessen beginnt TNF-α zu wachsen große Mengen gelangen in den Blutkreislauf und verursachen in vielen Organen eine Apoptose der Parenchymzellen, was zu Kachexie führt.
Der Prozess, durch den eine Zelle sich selbst töten kann, wird als programmierter Zelltod (PCD) bezeichnet. Dieser Mechanismus hat mehrere Varianten und Spiele entscheidende Rolle in der Physiologie verschiedene Organismen, insbesondere mehrzellige. Die häufigste und am besten untersuchte Form der PGC ist die Apoptose.
Was ist Apoptose?
Apoptose wird kontrolliert physiologischer Prozess Selbstzerstörung der Zelle, gekennzeichnet durch die allmähliche Zerstörung und Fragmentierung ihres Inhalts unter Bildung von Membranvesikeln (apoptotischen Körpern), die anschließend von Phagozyten absorbiert werden. Dieser genetisch bedingte Mechanismus wird unter dem Einfluss bestimmter interner oder externer Faktoren aktiviert.
Bei dieser Todesart reicht der Zellinhalt nicht über die Membran hinaus und verursacht keine Entzündung. Störungen in der Regulation der Apoptose führen zu schwerwiegenden Pathologien, beispielsweise zu unkontrollierten Zellteilung oder Gewebedegeneration.
Apoptose ist nur eine von mehreren Formen des programmierten Zelltods (PCD), daher ist es irreführend, diese Konzepte gleichzusetzen. ZU bekannte Arten Zur zellulären Selbstzerstörung gehören auch mitotische Katastrophen, Autophagie und programmierte Nekrose. Andere Mechanismen der PGC wurden noch nicht untersucht.
Ursachen der Zellapoptose
Auslöser für den Mechanismus des programmierten Zelltods können sowohl natürliche physiologische Prozesse als auch pathologische Veränderungen sein, die durch innere Defekte oder die Einwirkung äußerer ungünstiger Faktoren verursacht werden.
Normalerweise gleicht Apoptose den Prozess der Zellteilung aus, reguliert deren Anzahl und fördert die Gewebeerneuerung. In diesem Fall sind bestimmte Signale im Homöostase-Kontrollsystem die Ursache für PCD. Mit Hilfe der Apoptose werden Zellen zerstört, die entsorgt werden oder ihre Funktion erfüllt haben. Somit wird der erhöhte Gehalt an Leukozyten, Neutrophilen und anderen Elementen der zellulären Immunität nach dem Ende der Infektionsbekämpfung gerade durch Apoptose eliminiert.
Der programmierte Tod ist Teil des physiologischen Zyklus Fortpflanzungssysteme. Apoptose ist am Prozess der Oogenese beteiligt und trägt auch zum Absterben der Eizelle ohne Befruchtung bei.
Ein klassisches Beispiel für die Beteiligung der Zellapoptose an Lebenszyklus vegetative Systeme ist Herbstlaubfall. Der Begriff selbst leitet sich vom griechischen Wort „apoptosis“ ab, was wörtlich übersetzt „Abfallen“ bedeutet.
Apoptose spielt eine entscheidende Rolle bei der Embryogenese und Ontogenese, wenn Gewebe im Körper ersetzt werden und bestimmte Organe verkümmern. Ein Beispiel ist das Verschwinden der Membranen zwischen den Zehen einiger Säugetiere oder das Absterben des Schwanzes während der Metamorphose eines Frosches.
Apoptose kann durch die Anhäufung fehlerhafter Veränderungen in der Zelle ausgelöst werden, die auf Mutationen, Alterung oder mitotische Fehler zurückzuführen sind. Die Ursache für das Auftreten von PCD kann eine ungünstige Umgebung (Mangel an Nahrungsbestandteilen, Sauerstoffmangel) und pathologisch sein äußere Einflüsse vermittelt durch Viren, Bakterien, Toxine usw. Wenn die schädigende Wirkung außerdem zu stark ist, hat die Zelle keine Zeit, den Apoptosemechanismus auszuführen und stirbt infolge der Entwicklung eines pathologischen Prozesses – der Nekrose.

Morphologische und strukturell-biochemische Veränderungen in Zellen während der Apoptose
Der Prozess der Apoptose ist durch eine Reihe morphologischer Veränderungen gekennzeichnet, die in einem Gewebepräparat in vitro mithilfe der Mikroskopie beobachtet werden können.

Zu den Hauptsymptomen der Zellapoptose gehören:
- Umstrukturierung des Zytoskeletts;
- Verdichtung des Zellinhalts;
- Chromatinkondensation;
- Kernfragmentierung;
- Verringerung des Zellvolumens;
- Faltenbildung der Membrankontur;
- Bildung von Vesikeln auf der Zelloberfläche,
- Zerstörung von Organellen.
Bei Tieren gipfeln diese Prozesse in der Bildung von Apoptozyten, die sowohl von Makrophagen als auch von benachbarten Gewebezellen aufgenommen werden können. Bei Pflanzen kommt es nicht zur Bildung apoptotischer Körper, und nach dem Abbau des Protoplasten bleibt das Skelett in seiner Form Zellenwand.

Neben morphologischen Veränderungen geht die Apoptose mit einer Reihe von Umlagerungen auf molekularer Ebene einher. Es kommt zu einem Anstieg der Lipase- und Nukleaseaktivitäten, was eine Fragmentierung von Chromatin und vielen Proteinen zur Folge hat. Der cAMP-Gehalt steigt stark an, die Struktur der Zellmembran verändert sich. IN Pflanzenzellen Es wird die Bildung riesiger Vakuolen beobachtet.
Wie unterscheidet sich Apoptose von Nekrose?

Der Hauptunterschied zwischen Apoptose und Nekrose ist die Ursache des Zellabbaus. Im ersten Fall sind die molekularen Werkzeuge der Zelle selbst die Quelle der Zerstörung, die unter strenger Kontrolle arbeiten und ATP-Energie benötigen. Bei der Nekrose kommt es aufgrund äußerer schädigender Einflüsse zu einem passiven Stillstand der Lebenstätigkeit.
Apoptose ist ein natürlicher physiologischer Prozess, der darauf abzielt, umliegende Zellen nicht zu schädigen. Nekrose ist ein unkontrolliertes pathologisches Phänomen, das als Folge kritischer Verletzungen auftritt. Es ist daher nicht verwunderlich, dass Mechanismus, Morphologie und Folgen von Apoptose und Nekrose weitgehend gegensätzlich sind. Allerdings gibt es auch Gemeinsamkeiten.
Im Schadensfall lösen Zellen den Mechanismus des programmierten Todes aus, auch um die Entwicklung nekrotischer Zellen zu verhindern. Neuere Studien haben jedoch gezeigt, dass es eine andere nicht pathologische Form der Nekrose gibt, die ebenfalls als PCC klassifiziert wurde.
Biologische Bedeutung der Apoptose
Obwohl Apoptose zum Zelltod führt, ist ihre Rolle bei der Aufrechterhaltung der normalen Funktion des gesamten Organismus sehr wichtig. Dank des PGC-Mechanismus werden folgende physiologische Funktionen ausgeführt:
- Aufrechterhaltung eines Gleichgewichts zwischen Zellproliferation und Zelltod;
- Erneuerung von Geweben und Organen;
- Beseitigung defekter und „alter“ Zellen;
- Schutz vor der Entwicklung pathogener Nekrose;
- Veränderung von Geweben und Organen während der Embryo- und Ontogenese;
- Entfernen unnötiger Elemente, die ihre Funktion erfüllt haben;
- Eliminierung unerwünschter oder gefährlicher Zellen für den Körper (Mutante, Tumor, mit einem Virus infiziert);
- Verhinderung der Entwicklung einer Infektion.
Somit ist Apoptose eine der Möglichkeiten, die Homöostase des Zellgewebes aufrechtzuerhalten.

Stadien des Zelltods
Was bei der Apoptose mit einer Zelle passiert, ist das Ergebnis einer komplexen Kette molekularer Wechselwirkungen zwischen verschiedenen Enzymen. Die Reaktionen laufen kaskadenartig ab, wenn einige Proteine andere aktivieren und so zur allmählichen Entwicklung des Todesszenarios beitragen. Dieser Prozess kann in mehrere Phasen unterteilt werden:
- Induktion.
- Aktivierung proapoptotischer Proteine.
- Aktivierung von Caspasen.
- Zerstörung und Umstrukturierung zellulärer Organellen.
- Bildung von Apoptozyten.
- Vorbereitung von Zellfragmenten für die Phagozytose.
Die Synthese aller für den Start, die Durchführung und die Kontrolle jedes Stadiums notwendigen Komponenten ist genetisch bedingt, weshalb Apoptose als programmierter Zelltod bezeichnet wird. Die Aktivierung dieses Prozesses unterliegt einer strengen Kontrolle durch Regulierungssysteme, einschließlich verschiedener PGC-Inhibitoren.
Molekulare Mechanismen der Zellapoptose
Die Entwicklung der Apoptose wird durch die kombinierte Wirkung zweier molekularer Systeme bestimmt: induktiv und effektorisch. Der erste Block ist für den kontrollierten Start des ZGK verantwortlich. Es umfasst sogenannte Todesrezeptoren, Cys-Asp-Proteasen (Caspasen), eine Reihe mitochondrialer Komponenten und proapoptotische Proteine. Alle Elemente der Induktionsphase können in Auslöser (die an der Induktion beteiligt sind) und Modulatoren unterteilt werden, die für die Weiterleitung des Todessignals sorgen.
Das Effektorsystem besteht aus molekularen Werkzeugen, die für den Abbau und die Umstrukturierung zellulärer Bestandteile sorgen. Der Übergang zwischen der ersten und zweiten Phase erfolgt im Stadium der proteolytischen Caspase-Kaskade. Es ist den Komponenten des Effektorblocks zu verdanken, dass es während der Apoptose zum Zelltod kommt.
Apoptosefaktoren
Strukturelle, morphologische und biochemische Veränderungen während der Apoptose werden durch eine Reihe spezialisierter zellulärer Werkzeuge durchgeführt, darunter Caspasen, Nukleasen und Membranmodifikatoren.
Caspasen sind eine Gruppe von Enzymen, die Peptidbindungen an Asparaginresten durchtrennen und so Proteine in große Peptide fragmentieren. Vor Beginn der Apoptose liegen sie aufgrund von Hemmstoffen in einem inaktiven Zustand in der Zelle vor. Die Hauptziele von Caspasen sind Kernproteine.
Nukleasen sind für das Schneiden von DNA-Molekülen verantwortlich. Besonders wichtig bei der Entwicklung der Apoptose ist die aktive Endonuklease CAD, die Abschnitte des Chromatins in den Bereichen der Linkersequenzen aufbricht. Dadurch entstehen Fragmente mit einer Länge von 120–180 Nukleotidpaaren. Die komplexe Wirkung proteolytischer Caspasen und Nukleasen führt zu einer Verformung und Fragmentierung des Kerns.

Zellmembranmodifikatoren – stören die Asymmetrie der Bilipidschicht und machen sie zu einem Ziel für phagozytische Zellen.
Die Schlüsselrolle bei der Entwicklung der Apoptose kommt Caspasen zu, die nach und nach alle nachfolgenden Mechanismen des Abbaus und der morphologischen Umstrukturierung aktivieren.
Rolle von Caspasen beim Zelltod
Die Caspase-Familie umfasst 14 Proteine. Einige von ihnen sind nicht an der Apoptose beteiligt, der Rest wird in zwei Gruppen eingeteilt: Initiator (2, 8, 9, 10, 12) und Effektor (3, 6 und 7), die auch Caspasen der zweiten Stufe genannt werden. Alle diese Proteine werden als Vorläufer synthetisiert – Procaspasen, die durch proteolytische Spaltung aktiviert werden und deren Kern in der Ablösung der N-terminalen Domäne und der Aufteilung des verbleibenden Moleküls in zwei Teile besteht, die anschließend in Dimere und Tetramere assoziiert werden.
Initiator-Caspasen sind für die Aktivierung der Effektorgruppe notwendig, die proteolytische Aktivität gegen verschiedene lebenswichtige Zellproteine zeigt. Zu den Substraten von Caspasen der zweiten Stufe gehören:
- DNA-Reparaturenzyme;
- p-53-Proteininhibitor;
- Poly(ADP-Ribose)-Polymerase;
- DNase-Inhibitor DFF (Zerstörung dieses Proteins führt zur Aktivierung der CAD-Endonuklease) usw.
Die Gesamtzahl der Ziele von Effektor-Caspasen umfasst mehr als 60 Proteine.
Eine Hemmung der Zellapoptose ist auch im Stadium der Aktivierung von Initiator-Procaspasen noch möglich. Wenn Effektor-Caspasen in Aktion treten, wird der Prozess irreversibel.
Wege der Apoptoseaktivierung
Die Signalübertragung zur Auslösung der Zellapoptose kann auf zwei Arten erfolgen: rezeptorisch (oder extern) und mitochondrial. Im ersten Fall wird der Prozess durch spezifische Todesrezeptoren aktiviert, die externe Signale wahrnehmen. Dabei handelt es sich um Proteine der TNF-Familie oder Fas-Liganden, die sich auf der Oberfläche von Killer-T-Zellen befinden.
Der Rezeptor umfasst zwei funktionelle Domänen: eine Transmembrandomäne (für die Kommunikation mit dem Liganden vorgesehen) und eine „Todesdomäne“, die innerhalb der Zelle ausgerichtet ist und Apoptose induziert. Der Mechanismus des Rezeptorwegs basiert auf der Bildung des DISC-Komplexes, der die Initiator-Caspasen 8 oder 10 aktiviert.
Der Aufbau beginnt mit der Interaktion der Todesdomäne mit intrazellulären Adapterproteinen, die wiederum Initiator-Procaspasen binden. Letztere werden im Rahmen des Komplexes in funktionell aktive Caspasen umgewandelt und lösen eine weitere apoptotische Kaskade aus.
Der Mechanismus des internen Weges basiert auf der Aktivierung der proteolytischen Kaskade durch spezielle mitochondriale Proteine, deren Freisetzung durch intrazelluläre Signale gesteuert wird. Der Austritt von Organellenbestandteilen erfolgt durch die Bildung riesiger Poren.
Eine besondere Rolle bei der Einführung kommt Cytochrom c zu. Im Zytoplasma angekommen, bindet dieser Bestandteil der elektrischen Transportkette an das Apaf1-Protein (Apoptotic Factor Activating Proteases), was zu dessen Aktivierung führt. Apaf1 bindet dann die Initiator-Procaspasen 9, die über einen Kaskadenmechanismus Apoptose auslösen.
Der interne Weg wird durch eine spezielle Gruppe von Proteinen der Bcl12-Familie gesteuert, die die Freisetzung von Intermembrankomponenten der Mitochondrien in das Zytoplasma regulieren. Die Familie enthält sowohl pro-apoptotische als auch anti-apoptotische Proteine, deren Ausgewogenheit darüber entscheidet, ob der Prozess in Gang gesetzt wird.
Einer der starken Faktoren, die über den mitochondrialen Mechanismus Apoptose auslösen, sind reaktive Sauerstoffspezies. Ein weiterer wichtiger Induktor ist das p53-Protein, das den mitochondrialen Signalweg bei DNA-Schäden aktiviert.
Manchmal kombiniert die Auslösung der Zellapoptose zwei Wege gleichzeitig: sowohl äußere als auch innere. Letzteres dient in der Regel der Verstärkung der Rezeptoraktivierung.