Funcția proteinelor este asigurată de actina miozina. Mecanismele moleculare ale contracției musculare
Citeste si
BIOCHIMIA SPORTULUI
Structura și funcția fibrelor musculare
Există 3 tipuri de țesut muscular:
Scheletul striat;
cardiac striat;
Neted.
Funcțiile țesutului muscular.
Țesutul scheletic striat - reprezintă aproximativ 40% din greutatea corporală totală.
Funcțiile sale:
dinamic;
static;
receptor (de exemplu, proprioceptori în tendoane - fibre musculare intrafusale (fusiforme));
depunerea - apă, minerale, oxigen, glicogen, fosfați;
termoreglare;
reacții emoționale.
Țesut muscular cardiac striat.
Funcția principală este injecția.
Mușchii netezi - formează peretele organelor goale și al vaselor de sânge.
Funcțiile sale: - menține presiunea în organele goale; - mentine valoarea tensiunii arteriale;
Asigură promovarea conținutului prin tractul gastrointestinal, uretere.
Compoziția chimică a țesutului muscular
Compoziția chimică a țesutului muscular este foarte complexă și se modifică sub influența diverșilor factori. Compoziția chimică medie a unui țesut muscular bine pregătit este: apă - 70-75% din masa țesutului; proteine - 18-22%; lipide - 0,5-3,5%; extractive azotate - 1,0-1,7%; extractive fără azot - 0,7-1,4%; minerale - 1,0-1,5 %.
Aproximativ 80% din reziduul uscat al țesutului muscular sunt proteine, ale căror proprietăți determină în mare măsură proprietățile acestui țesut.
Miofibrilele sunt elementele contractile ale unei fibre musculare. Structura fină a miofibrilelor
Miofibrilele sunt fibre subțiri (diametrul lor este de 1-2 microni, lungimea este de 2-2,5 microni), care conțin 2 tipuri de proteine contractile (protofibrile): filamente subțiri de actină și filamente de miozină de două ori mai groase. Ele sunt dispuse astfel încât să existe 6 filamente de actină în jurul filamentelor de miozină și 3 filamente de miozină în jurul fiecărui filament de actină. Miofibrilele sunt separate de membrane Z în secțiuni separate - sarcomere, în mijlocul cărora există în principal filamente de miozină, filamentele de aactină sunt atașate de membranele Z pe părțile laterale ale sarcomerului. (Abilitatea diferită a actinei și a miozinei de a refracta lumina creează un aspect striat într-un mușchi în repaus într-un microscop cu lumină).
Filamentele de actină reprezintă aproximativ 20% din greutatea uscată a miofibrilelor. Actina constă din două forme ale proteinei: 1) o formă globulară - sub formă de molecule sferice și 2) molecule de tronomiozină în formă de tijă răsucite sub formă de elice dublu catenare într-un lanț lung. De-a lungul acestui filament dublu de actină, fiecare tură conține 14 molecule de actină globulară (7 molecule pe ambele părți), ca un fir cu mărgele, precum și centre de legare pentru ionii de Ca2+. Acești centri conțin o proteină specială (troponină), care este implicată în formarea legăturii dintre actină și miozină.
Miozina este compusă din filamente proteice paralele (această parte este așa-numita meromiozină ușoară). La ambele capete ale acestuia există gâturi care se extind pe părțile laterale cu îngroșări - capete (această parte este meromiozină grea), datorită cărora se formează punți transversale între miozină și actină.
Caracteristici fizico-chimiceși organizarea structurală a proteinelor contractile (miozina și actina). Tropomiozina și troponina.
Proteinele miofibrilare includ proteinele contractile miozină, actină și actomiozină, precum și proteinele reglatoare tropomiozina, troponina și actinele alfa și beta. Proteinele miofibrilare asigură funcția contractilă a mușchilor.
Miozina este una dintre principalele proteine contractile din mușchi, reprezentând aproximativ 55% din totalul proteinelor musculare. Este format din filamente groase (filamente) de miofibrile. Greutatea moleculară a acestei proteine este de aproximativ 470 000. În molecula de miozină se disting o parte fibrilă lungă și structuri globulare (capete). Partea fibrilară a moleculei de miozină are o structură cu dublu helix. Molecula conține șase subunități: două lanțuri polipeptidice grele (greutate moleculară 200.000) și patru lanțuri ușoare (greutate moleculară 1500-2700) situate în partea globulară. Funcția principală a părții fibrilare a moleculei de miozină este capacitatea de a forma mănunchiuri bine ordonate de filamente de miozină sau protofibrile groase. Centrul activ al ATPazei și centrul de legare a actinei sunt situate pe capetele moleculei de miozină, prin urmare asigură hidroliza ATP și interacțiunea cu filamentele de actină.
Actina este a doua proteină musculară contractilă care formează baza filamentelor subțiri. Cele două forme ale sale sunt cunoscute - G-actina globulară și F-actina fibrilă. Actina globulară este o proteină sferică cu o greutate moleculară de 42 000. Reprezintă aproximativ 25% din masa totală a proteinelor musculare. În prezența cationilor de magneziu, actina suferă o polimerizare necovalentă pentru a forma un filament elicoidal insolubil numit F-actină. Ambele forme de actină nu au activitate enzimatică. Fiecare moleculă de actină G este capabilă să lege un ion de calciu, care joacă rol important la initierea contractiei. În plus, o moleculă de G-actină leagă strâns o moleculă de ATP sau ADP. Legarea ATP de către G-actina este de obicei însoțită de polimerizarea sa cu formarea de F-actină și scindarea simultană a ATP la ADP și fosfat. ADP rămâne legat de actina fibrilară.
Tropomiozina este o proteină structurală a filamentului de actină, care este o moleculă alungită sub forma unui fir. Cele două lanțuri polipeptidice par să se înfășoare în jurul filamentelor de actină. La capetele fiecărei molecule de tropomiozină se află proteine ale sistemului troponinică, a căror prezență este caracteristică mușchilor striați.
Troponina este proteina reglatoare filament de actină. Este format din trei subunități: TnT, Tnl și TnC. Troponina T (TnT) leagă aceste proteine de tropomiozină. Troponina I (Tnl) blochează (inhibă) interacțiunea actinei cu miozina. Troponina C (TnC) este o proteină care leagă calciul a cărei structură și funcție sunt similare cu proteina calmodulină naturală. Troponina C, ca și calmodulina, leagă patru ioni de calciu per moleculă de proteină și are o greutate moleculară de 17 000. În prezența calciului, conformația troponinei C se modifică, ceea ce duce la o modificare a poziției Tn față de actina, ca un rezultat al căruia se deschide centrul de interacțiune actină-miozină.
Astfel, filamentul subțire al miofibrilei striate este format din F-actină, tropomiozină și trei componente de troponină. Pe lângă aceste proteine, proteina actina este implicată în contracția musculară. Se găsește în zona liniei Z, de care sunt atașate capetele moleculelor F-actină ale filamentelor subțiri de miofibrile.
Principalele proteine musculare sunt actina și miozina.
Masa fibrilelor musculare este apă (75%) și proteine (mai mult de 20%). Principalii reprezentanți ai proteinelor musculare sunt actina și miozina, dintre care miozina reprezintă 55%.
Această proteină (MM 460 kDa) are forma unui hexamer asimetric. Molecula de miozină are o parte alungită, formată din două spirale înfăşurate una peste alta. Fiecare helix are un cap globular la un capăt. Hexamerul (6 subunități) include o pereche de lanțuri grele (MM 200 kDa) și două perechi de lanțuri ușoare (MM 15-27 kDa). Lanțurile grele constau dintr-un domeniu C-terminal a-helical extins liniar (1300 de resturi de aminoacizi) și un domeniu N-terminal globular (aproximativ 800 de resturi de aminoacizi). Două domenii a-helicoidale aparținând două lanțuri grele formează împreună o structură supercoilată stabilă cu două capete globulare (Fig. 17.8).
O moleculă de miozină completă conține, de asemenea, 4 lanțuri polipeptidice relativ mici (MM 16-24 kDa), care sunt asociate cu capete globulare. Spre deosebire de actină, miozina mușchi scheletic are activitate enzimatică și catalizează hidroliza ATP prin legarea de F-actină. Toate lanțurile ușoare leagă Ca2+, sunt fosforilate de o kinază specială și, în general, participă la reglarea activității miozin-ATPazei.
Fig.17.8. Reprezentarea schematică a structurii filamentelor groase. Este prezentată configurația spațială a miozinei.
Există mai multe regiuni importante din punct de vedere funcțional în molecula de miozină. Nu departe de mijlocul zonei supercoilate liniare, există un loc în care molecula este scindată sub acțiunea tripsinei. Această enzimă, așa cum spune, taie molecula în 2 părți: una conține capete globulare și o parte a zonei supraînvăluite; celălalt constă din porțiunea rămasă a zonei supraînfăşurate din partea capătului C-terminal. Partea care conținea capul a fost numită „meromiozină grea” (MM 350 kDa). Fragmentul C-terminal este numit „meromiozină ușoară” (MM 125 kDa).
Semnificația locului de acțiune al tripsinei asupra moleculei de miozină constă în faptul că coincide în mod surprinzător cu locul din molecula de miozină care funcționează ca un fel de balama, transformând energia chimică a ATP într-un fenomen pur mecanic de contracție- relaxare. Un alt loc important care îndeplinește un rol similar este supus acțiunii unei alte enzime proteolitice - papaina. Papaina taie molecula de miozină foarte aproape de capetele globulare. Se obțin două fragmente și este cel în care se află capul care prezintă activitate ATPazei.
Din miozină se formează filamente groase. Filamentul gros este format din aproximativ 400 de molecule de miozină, câte 200 pe fiecare parte a liniei M. Aceste molecule sunt ținute împreună de proteina C (proteina „clip”), proteina M-line și interacțiunea hidrofobă dintre ele. Într-un punct localizat la locul de acțiune al tripsinei, meromiozina grea se abate de la axa principală a filamentului gros, formând colt ascutit. Datorită acestui fapt, capul se apropie îndeaproape de actina filamentelor subțiri localizate în spațiul dintre filamentele groase. Cel mai important eveniment molecular care precede contracția musculară este legarea reglată a capetelor de miozină de actina filamentului subțire. Ulterior, are loc o schimbare rapidă a conformației miozinei în jurul punctelor „balama” deja menționate, iar actina legată se mișcă în direcția liniei M.
Ponderea actinei în masa totală a proteinelor musculare este de 25%. Este o proteină monomer globulară cu un MM de 43 kDa, numită G-actină. În prezența ionilor de magneziu și a concentrației fiziologice a ionilor în soluție, G-actina polimerizează pentru a forma un fir insolubil, care se numește F-actină (Fig. 17.9). Doi polimeri F-actină sunt înfășurați unul pe celălalt sub formă de spirală. Așa se formează structura de bază a unui fir subțire. Fibra F-actină are o grosime de 6-7 nm și o structură repetată cu o frecvență de 35,5 nm. Nici G- și nici F-actina nu au activitate catalitică.
Orez. 17.9. Structura actinei F
Fiecare subunitate G-actină are un situs de legare ATP/ADP care participă la polimerizarea filamentului subțire. După finalizarea polimerizării, firul subțire este acoperit și stabilizat de o proteină - b-actinină. În plus față de situsul de legare a nucleotidelor, fiecare moleculă de G-actină are un situs de legare de mare afinitate pentru capul miozinei. Reglarea activității sale în mușchii scheletici și cardiaci este realizată de proteine suplimentare dintr-un fir subțire. Astfel, proteine suplimentare controlează ciclul contractil.
Compoziția proteică a țesutului muscular este foarte complexă. A fost studiat de mulți oameni de știință de mult timp. Fondatorul biochimiei interne, A. Ya. Danilevsky, studiind proteinele țesutului muscular, a dat o idee corectă despre rolul fiziologic al unui număr de proteine și despre semnificația proteinei contractile miozinei conținute în miofibrile.
Mai târziu, miozina a fost studiată de V. A. Engelgardt, I. I. Ivanov și alți oameni de știință sovietici. O mare contribuție la studiul contracției musculare a avut-o omul de știință ungur Szent-Jorgyi. Un alt om de știință maghiar, Straub, a descoperit proteina musculară actina.
Studiul țesutului muscular ar trebui să înceapă cu proteine, deoarece acestea reprezintă aproximativ 80% din reziduul uscat al țesutului muscular. În conformitate cu structura morfologică a fibrei musculare, proteinele sunt distribuite după cum urmează:
Din diagrama de mai sus se poate observa că compoziția proteică a țesutului muscular este foarte diversă. Sarcoplasma conține patru proteine: miogen, mioalbumină, globulină X și mioglobină. Miofibrilele conțin un complex de actină și miozină numit actomiozină. Toate proteinele sarcoplasmei se numesc intracelulare, iar proteinele sarcolemei sunt numite extracelulare.Nucleii contin nucleoproteine, sarcolema contine colagen si elastina. Dacă luăm în considerare că în țesutul muscular, în plus, există încă o cantitate semnificativă de diverse enzime și fiecare dintre ele este o proteină specială, atunci compoziția proteică a țesutului muscular se dovedește a fi și mai complexă.
Miozina
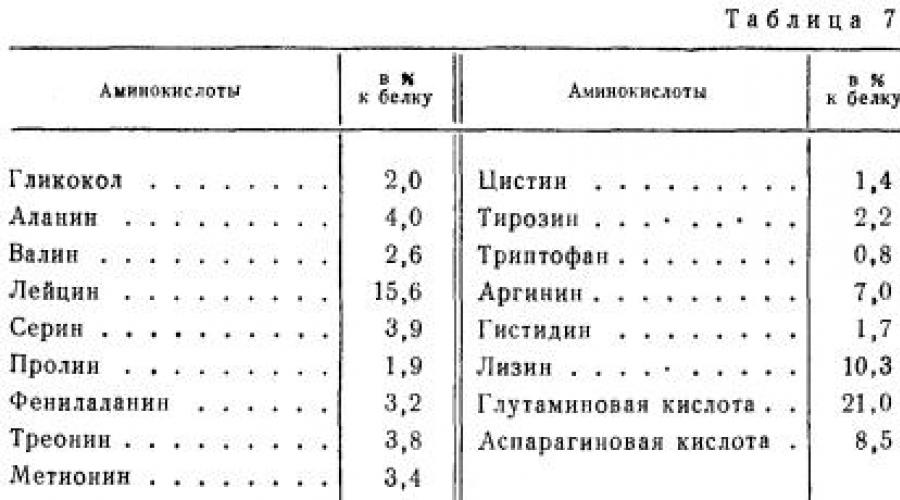
Miozina este principala proteină din țesutul muscular. Reprezintă aproape jumătate din toate proteinele musculare și se găsește în mușchii tuturor mamiferelor, păsărilor și peștilor. De valoare nutritionala este o proteină completă. În tabel. 7 prezintă compoziţia de aminoacizi a miozinei bovine.

Miozina a fost studiată în detaliu de biochimiștii sovietici, care au descoperit că nu este doar o proteină structurală a țesutului muscular, adică o proteină implicată în construirea unei celule, ci și o enzimă, adenozin trifosfataza, care catalizează reacția de hidroliză a ATP. Aceasta produce ADP (acid adenozin difosforic) și acid fosforic și eliberează o cantitate mare de energie utilizată în munca musculară.
Miozina a fost obținută sub formă cristalină pură. Greutate moleculară este foarte mare, aproximativ 1,5 milioane.Miozina cristalină în absența completă a sărurilor este perfect solubilă în apă. Ho, este suficient să adăugați o cantitate nesemnificativă de orice sare în apă, de exemplu clorură de sodiu, deoarece își pierde complet capacitatea de a se dizolva și dizolvarea are loc deja la o concentrație de clorură de sodiu de aproximativ 1%. Cu toate acestea, în raport cu sărurile, cum ar fi sulfatul de amoniu, miozina se comportă ca o globulină tipică.
La extragerea proteinelor din carne cu apă, miozina nu intră în soluție. La prelucrarea cărnii cu soluții saline, aceasta se găsește în extractul de sare. Când soluția salină de miozină este diluată cu apă, concentrația de sare scade și miozina începe să precipite. Miozina este sărată la saturație completă cu clorură de sodiu și sulfat de magneziu (sărarea se face cu sare cristalină, altfel este imposibil să se obțină o saturație completă).
Punctul izoelectric al miozinei este la pH 5,4-5,5.
Miozina are capacitatea de a intra în legături speciale cu diverse substanțe, în primul rând cu proteine, cu formarea de complexe. Un rol deosebit în activitatea mușchilor îl joacă complexul miozină cu actină - actomiozina.
actina si actomiozina
Proteina actină poate exista sub două forme: fibrilară și globulară. În mușchiul în repaus, actina este sub formă fibrilă; cu contractia musculara devine globuloasa. Mare importanțăîn această transformare au acid adenozin trifosforic și săruri.
Țesutul muscular conține 12-15% actină. Trece în soluție în timpul extracției prelungite cu soluții saline; cu extractie pe termen scurt, ramane in stroma. Greutatea moleculară a actinei este de aproximativ 75.000.
Când soluțiile de actină și miozină sunt amestecate, se formează un complex, numit actomiozină, din care sunt construite în principal miofibrile. Acest complex este foarte vâscos, capabil să se micșoreze brusc la anumite concentrații de ioni de potasiu și magneziu (0,05 m KCl > și 0,001 m MgCl2) în prezența adenozin trifosfat. La concentrații mai mari de sare (0,6 M KCl), actomiozina se descompune în actină și miozină atunci când se adaugă ATP. Vâscozitatea soluției este semnificativ redusă.
Potrivit lui Szent Giorgi, contracția actomiozinei sub acțiunea ATP stă la baza contracției unui mușchi viu.
Actomiozina, ca o adevărată globulină, este insolubilă în apă. La prelucrarea cărnii cu soluții saline, actomiozina cu un conținut nedeterminat de actină trece în soluție, în funcție de durata extracției.
Globulina X
Țesutul muscular conține aproximativ 20% globulină X din cantitatea totală de proteine. Este o globulină tipică, adică nu se dizolvă în apă, ci se dizolvă în soluții saline de concentrație medie; precipită din soluții la jumătate de saturație cu sulfat de amoniu (1 volum de soluție proteică și 1 volum de soluție saturată de sulfat de amoniu), clorură de sodiu la saturație completă.
Myogen
Țesutul muscular conține aproximativ 20% din miogen din cantitatea totală de proteine. Nu poate fi atribuită albuminelor sau globulinelor tipice, deoarece se dizolvă în apă, nu este suficient sărată cu clorură de sodiu și sulfat de magneziu când este saturată (sare cristalină), în același timp este precipitată cu sulfat de amoniu la 2/3 de saturație ( 1 volum de soluție proteică și 2 volume de soluție saturată de sulfat de amoniu). Această proteină a fost obținută sub formă cristalină. Greutatea moleculară a miogenului este de 150.000.
V. A. Engelgardt a descoperit la myogen capacitatea de a cataliza una dintre cele mai importante reacții care apar în procesul de glicoliză a țesutului muscular. Această descoperire a fost prima care a arătat că proteinele structurale, adică proteinele implicate în construcția țesuturilor, pot avea activitate enzimatică.
Mioalbumina
Țesutul muscular conține aproximativ 1-2% mioalbumină din cantitatea totală de proteine. Este o albumină tipică, adică se dizolvă în apă, nu precipită cu clorură de sodiu când este saturată, ci precipită cu sulfat de amoniu.
Mioglobina
Mioglobina este o proteină cromoproteică complexă cu o greutate moleculară de 16 900. La hidroliză, se descompune în proteina globină și grupul hem non-proteic. Mioglobina colorează mușchii în roșu; diferă de hemoglobină în partea sa proteică; au acelasi grup protetic.
Când este oxidat, hemul trece în hematină și în prezența de acid clorhidric- în gemeni. După conținutul de hemină, se poate aprecia cantitatea de mioglobină din țesutul muscular.
Conținutul de hemin în mușchii mari bovine variază de la 42 la 60 mg la 100 g de țesut; în mușchii porcilor este mult mai puțin - de la 22 la 42 mg la 100 g de țesut, deci sunt mai puțin colorați.
Mioglobina, ca și pigmenții din sânge, are un spectru de absorbție caracteristic.
Principiul obținerii spectrelor de absorbție ale substanțelor colorate, în special pigmenților din carne și sânge, este că energia luminoasă care trece printr-o soluție de pigment este absorbită de această soluție. În acest caz, are loc așa-numita absorbție (absorbție) a luminii, care poate fi detectată cu un spectroscop.
Benzile caracteristice de absorbție pentru țesutul muscular și pigmenții din sânge variază de la 400 la 700 de microni. În acest interval, undele sunt percepute de ochiul nostru, iar prin spectroscop putem vedea benzi întunecate în spectru, rezultate din absorbția luminii cu o anumită lungime de undă.

Absorbția luminii de către substanțele colorate poate fi cuantificată cu un spectrofotometru. Rezultatele obţinute sunt de obicei exprimate grafic. În acest caz, lungimea de undă a luminii este reprezentată de-a lungul axei absciselor, iar procentul de lumină care a trecut prin soluție de-a lungul axei ordonatelor. Cu cât trecea mai puțină lumină, cu atât mai mult era absorbită de substanța sa colorată. Transmisia totală a luminii de către soluție este considerată 100%.
Pe fig. 10 prezintă absorbția (absorbția) luminii de către o soluție de oximioglobină; arată că oximioglobina are două benzi de absorbție caracteristice pronunțate în regiunea vizibilă a spectrului, adică două regiuni în care transmite cel mai puțin lumină și, prin urmare, absoarbe lumina cel mai mult. Maximele acestor secțiuni sunt la două lungimi de undă; λ 585 mmk și λ 545 mmk,
Pe fig. 11 prezintă curba spectrofotometrică a oxihemoglobinei pentru comparație.
Mioglobina are o capacitate mai mare de a se lega de oxigen decât hemoglobina din sânge. Mioglobina furnizează oxigen țesutului muscular. Mușchii care lucrează conțin mai multă mioglobină, deoarece oxidarea are loc mai intens în ei. Se știe că mușchii picioarelor sunt mai puternic colorați decât mușchiul dorsal; mușchii boilor de lucru sunt, de asemenea, mai puternic colorați decât animalele care nu lucrează. Acest lucru este vizibil mai ales la păsări, muşchii pectorali care, fiind nefuncționale, aproape că nu sunt pictate.
colagen si elastina
Colagenul și elastina sunt proteine ale țesutului conjunctiv care sunt insolubile în apă și soluții saline. Ele formează sarcolema - cea mai subțire coajă a fibrei musculare.
Nucleoproteine
Nucleoproteinele sunt proteine care alcătuiesc nucleul celular. trăsătură caracteristică capacitatea lor de a se dizolva în soluții de alcali slabi. Acest lucru se datorează faptului că molecula lor conține un grup protetic care are proprietăți acide.
Separarea proteinelor musculare
Când țesutul muscular este tratat cu soluții saline de concentrație medie, proteinele sale pot fi împărțite în proteine stromale și proteine plasmatice. Stroma este înțeleasă ca baza structurală a țesutului muscular, insolubil în soluție salină, care constă în principal din proteine sarcolemale (vezi diagrama).

Solubilitatea proteinelor intracelulare ale țesutului muscular este diferită. De exemplu, actomiozina și globulina X nu se dizolvă în apă și sunt mai ușor precipitate din soluții saline prin sulfat de amoniu și clorură de sodiu decât miogen. Myogenul se dizolvă în apă ca mioalbumina, dar diferă de acesta prin sărare.
Solubilitatea proteinelor din țesutul muscular în soluții de sare cu reacție neutră și sedimentarea lor sunt prezentate în tabel. 8.

În timpul sărării, gătirii și altor tipuri de prelucrare tehnologică a cărnii, are loc o pierdere de substanțe proteice. Valorile pierderilor de proteine se datorează solubilității și sedimentării lor diferite.
Cunoscând proprietățile proteinelor, este posibil să alegeți astfel de condiții în care pierderile vor fi cele mai mici. Prin urmare, să studiez proprietățile specificate proteinelor ar trebui să li se acorde o atenție deosebită.
Studiu compoziție chimică miofibrilele au arătat că filamentele groase și subțiri sunt compuse numai din proteine.
Filamentele groase sunt formate din proteine miozina. Miozina este o proteină cu o greutate moleculară de aproximativ 500 kDa, care conține două lanțuri polipeptidice foarte lungi. Aceste lanțuri formează o dublă spirală, dar la un capăt aceste fire diverg și formează o formațiune sferică - un cap globular. Prin urmare, în molecula de miozină se disting două părți - un cap globular și o coadă. Filamentul gros conține aproximativ 300 de molecule de miozină, iar pe secțiunea transversală a filamentului gros se găsesc 18 molecule de miozină. Moleculele de miozină din filamente groase se împletesc cu cozile lor, iar capetele lor ies din filamentul gros într-o spirală regulată. Există două locuri (centre) importante în capetele de miozină. Una dintre ele catalizează scindarea hidrolitică a ATP, adică corespunde situsului activ al enzimei. Activitatea ATPazei miozinei a fost descoperită pentru prima dată de biochimiștii ruși Engelhardt și Lyubimova. A doua secțiune a capului de miozină asigură conectarea filamentelor groase cu proteina filamentelor subțiri în timpul contracției musculare - actina. Filamentele subțiri sunt formate din trei proteine: actină, troponinăȘi tropomiozina.
Principala proteină a filamentelor subțiri - actina. Actina este o proteină globulară cu o greutate moleculară de 42 kDa. Această proteină are două proprietăți importante. În primul rând, se vede capacitate mare la polimerizare pentru a forma lanțuri lungi numite actina fibrilara(poate fi comparat cu un șir de mărgele). În al doilea rând, după cum sa menționat deja, actina se poate conecta cu capete de miozină, ceea ce duce la formarea de punți transversale, sau aderențe, între filamentele subțiri și groase.
Baza unui fir subțire este un dublu helix format din două lanțuri de actină fibrilă, care conține aproximativ 300 de molecule de actină globulară (ca două fire de margele răsucite într-un dublu helix, fiecare mărgele corespunde actinei globulare).
O altă proteină din filamente subțiri - tropomiozina are si forma dublu helix, dar acest helix este format din lanțuri polipeptidice și este mult mai mic decât dublu helix de actină. Tropomiozina este situată în șanțul dublei helix a actinei fibrilare.
A treia proteină a filamentelor subțiri - troponina- se atașează de tropomiozină și își fixează poziția în șanțul de actină, care blochează interacțiunea capetelor de miozină cu moleculele de actină globulară a filamentelor subțiri.
5. Metode tehnologice de accelerare a maturării cărnii
După încetarea vieții animalului (sinteză), în carne are loc un complex de modificări, care sunt influențate de enzime. Autodezintegrarea țesuturilor începe sub acțiunea enzimelor țesuturilor înseși. Acest proces se numește autoliză. În acest caz, țesuturile musculare, conjunctive și adipoase suferă modificări. Modificările în țesutul muscular în timpul depozitării afectează calitatea cărnii.
În timpul vieții unui animal, principala funcție a țesutului muscular este motorie, ca urmare a căreia energia chimică este transformată în energie mecanică. Aceste transformări complexe apar prin procese biochimice, fiziologice, fizice și termodinamice.
Aspectul biochimic se exprimă în modificarea miofibrilelor proteinelor, în primul rând miozina și actina (80% din proteine). În timpul contracției, actina fibrilară se combină cu miozina. Se formează un complex de actomiozină puternic, în care există 2-3 molecule de actină per moleculă de miozină.
Mecanismul energetic al contracției este de a schimba energia liberă formată în timpul descompunerii ATP. Activitatea ATP este deținută de proteina miozină, care se combină cu actina în timpul descompunerii ATP, formând un complex de actinomiozină, adică. are loc procesul de întărire. În acest caz, miozina nu este doar o proteină, ci, în felul său, o enzimă.
Faza de maturare adecvată a cărnii se caracterizează prin descompunerea intensă a glicogenului muscular și acumularea de acid lactic, precum și o modificare a compoziției sale chimice, dar rigoarea este inclusă în procesul de autoliză.
O trăsătură caracteristică a rigoarei este o scădere a capacității de reținere a apei a țesutului muscular, ca urmare a căreia există întotdeauna o separare a sucului muscular. De semne exterioare carnea întărită are o elasticitate mai mare, în timpul tratamentului termic - rigiditate excesivă, iar datorită scăderii capacității de reținere a umidității, devine mai puțin suculentă. În starea de rigiditate, mușchii sunt mai puțin sensibili la acțiunea enzimelor proteometice, iar carnea este mai puțin digerabilă.
Ca urmare a acumulării de acizi lactic, fosforic și alți acizi în carne, crește concentrația de ioni de hidrogen, drept urmare, la sfârșitul rigoarei, pH-ul scade la 5,8-5,7 și uneori chiar mai mic. Într-un mediu acid, descompunerea ATP și a acidului fosforic are ca rezultat o acumulare parțială de fosfor anorganic.
Faza de maturare determină în mare măsură intensitatea cursului proceselor fizico-coloide și modificările microstructurale ale fibrelor musculare. Ca urmare a unui complex de motive (acțiunea enzimelor proteometice, formarea de produse de degradare autolitică, un mediu acid), are loc defalcarea fibrelor musculare. Degradarea profundă indică deja autoliza profundă, care se observă mai des cu alterarea cărnii. În faza de trecere lină de la rigiditate la coacere, carnea se înmoaie, se slăbește, apare frăgezimea, ceea ce înseamnă că sucurile digestive pătrund liber în sarcoplasmă, ceea ce îmbunătățește digestibilitatea și digestibilitatea cărnii.
Frăgezimea țesuturilor de carne, unde există mult țesut conjunctiv, este mică, iar carnea animalelor tinere este mai fragedă decât a celor bătrâne.
Odată cu creșterea temperaturii (până la 30 0 C), precum și cu îmbătrânirea prelungită a cărnii (peste 20-26 zile) la temperaturi pozitive scăzute (2-4 0 C), procesul de coacere enzimatică se adâncește atât de mult încât cantitatea defalcarea proteinelor din carne crește considerabil peptidele mici și aminoacizii liberi. În această etapă, carnea capătă o culoare maro, cantitatea de amine și azot amoniac din ea crește, are loc o descompunere hidrolitică vizibilă a grăsimilor, care îi afectează negativ proprietățile nutritive și prezentarea cărnii.
Pentru a accelera maturarea cărnii, ceea ce îi îmbunătățește calitatea, se folosesc diverse metode de procesare, inclusiv utilizarea de enzime și antibiotice.
De asemenea, studiile au arătat că tratarea suprafeței cărnii (prin scufundare într-o soluție sau prin pulverizare cu pulbere) nu dă un efect suficient.
Rezultate bune se obțin prin fermentarea cărnii, efectuată simultan după reducerea sublimării.
La conserve se adaugă un preparat enzimatic pentru a obține produse de calitate superioară. Se propune adăugarea de preparate la cârnații de grade inferioare.
Carnea tratată cu preparate enzimatice ar trebui să fie aspect, culoarea, aroma nu diferă de cele neenzimatice, dar la gust - să fie mai moale, fără un gust amar cauzat de produsele de descompunere profundă a proteinelor de către enzime.