Des questions. Facteurs de risque pour le développement du diabète sucré diabète de type 1 risque de paralysie cérébrale
Lire aussi
Le site fournit des informations de référence à titre informatif uniquement. Le diagnostic et le traitement des maladies doivent être effectués sous la supervision d'un spécialiste. Tous les médicaments ont des contre-indications. L'avis d'un expert s'impose !
Nuria demande :
Bonjour, j'ai 25 ans. A la 16ème semaine de grossesse, j'ai réussi le test pour AFP 30.70/0.99 maman/ et pour hCG 64.50/3.00 maman/. Veuillez me dire ce que signifient les chiffres. Quelle est ma chance d'avoir le diabète ? Ma grossesse est de 27-28 semaines. Je viens de prendre connaissance des résultats du dépistage. Je prenais du Duphaston à l'époque. Dites-moi à quel point le risque est élevé. Merci.
D'après les données que vous avez fournies, le risque qu'un enfant ait une pathologie génétique du syndrome de Down est faible.
Nuria demande :
Merci pour la clarification. Mais on m'a donné un seuil de risque au centre, donc je suis très inquiet Quelles autres données sont prises en compte pour identifier le risque de diabète ? TVP-1.5, ADN-3.2. Échographie à 20 semaines bonne. Merci encore.
Très probablement, le degré de risque a été calculé en tenant compte de la valeur accrue de l'hCG, puisque le reste des indicateurs d'enquête que vous avez présentés correspondent à la norme.
Nathalie demande :
Bonjour. Au secours, s'il vous plaît J'ai reçu le résultat du dépistage et j'étais contrarié. Mettre:
Risque lié à l'âge de DM 1:371
Valeur de risque DM 1:306
AFP 26,04 Mohms 0,86, HCGb 29,74 Mohms 1,87
Plein de 35 ans, deuxième grossesse, dépistage pendant une période de 15 semaines 6 jours, avec une différence - ils ont fait une échographie et après 2 jours, ils ont pris du sang.
Conclusion - seuil de risque.
Dire que c'est mauvais ? Merci
Le risque de pathologie génétique peut être évalué comme légèrement supérieur à la moyenne. Il n'y a aucune raison de paniquer. Le dépistage évalue uniquement la probabilité d'avoir un enfant atteint d'une pathologie génétique.
Nathalie demande :
en plus du précédent.
Une échographie a été réalisée à 16 semaines. TVP 4 mm (j'ai lu qu'ils mesurent généralement jusqu'à 14 semaines).
à 17,5 semaines os du nez 6,3 mm
Apparemment, sur la base de TVP, un seuil pour SD a été fixé. Est-ce que ça vaut le coup d'avoir peur ? Merci.
La taille de l'os nasal est en effet normale, l'épaisseur de la TVP est mesurée avant la 14e semaine de grossesse, avec le KTR du fœtus (taille coccyx-pariétale) ne dépassant pas 84 mm, plus tard que cette période ou à un KTR supérieur , les résultats de l'étude cessent d'être informatifs. Donc, dans votre cas, il n'y a pas lieu de s'inquiéter. Le seuil de risque a été fixé pour vous non pas en analysant les résultats du dépistage et de l'échographie, mais en fonction de votre âge.
Hélène demande :
Bonjour, dites-moi, s'il vous plaît Résultats du dépistage prénatal : risque de trisomie 21 1er trimestre 1:2472 ; 2e trimestre 1:29 Comment est-ce possible Risque complexe 1:208 Résultats de l'étude 13 semaines : St. bêta hCG 74,53 ng/ml (1,74 MoM) PaPP-A5684.00Mu|L (1,67 MoM) TVP1,80 mm (1,05 MoM) ) 17 semaines : AFP 32,39 UI/ml (1,16 MoM) hCG 207,00 UI/l (6,44 MoM) 2 échographie sera 12,09 (21 semaines), la première à 12 semaines. 4 jours aucun écart constaté, que faire ? J'ai 34 ans et j'ai un foetus.
Dans les résultats du deuxième dépistage, une forte augmentation niveau d'hCG, veuillez préciser, avez-vous pris des médicaments avant de prélever du sang pour analyse ?
Oksana demande :
dépistage 18 semaines 4 jours
risque d'âge 1:135, valeur de risque 1:322
AFP 51,99 MoM 1,16
HCGb 15,60 MoM 1,61
Fixer un seuil de risque, que faire ?
J'ai 39 ans, deuxième enfant, échographie à 21,3 semaines. sans déviation
Chère Oksana, les paramètres biochimiques du dépistage sont tout à fait normaux. Si, selon les résultats du diagnostic par ultrasons, il n'y a pas d'écarts, il n'y a pas non plus d'indications pour un diagnostic invasif. Habituellement, dans une telle situation, à une période de 22 semaines de grossesse, une échographie experte est effectuée ; pour cet examen, le spécialiste le plus qualifié ayant une expérience dans le diagnostic prénatal des malformations congénitales est choisi. Cependant, si vous faites confiance aux qualifications du spécialiste qui a effectué la dernière échographie à 21,3 semaines, vous n'avez pas besoin de répéter l'examen. Vous pouvez en savoir plus sur l'interprétation des résultats du dépistage biochimique du deuxième trimestre de la grossesse dans notre section d'information médicale sur cette méthode diagnostic, du même nom : Dépistage. .
Nathalie demande :
Bonjour! S'il vous plaît, aidez-moi à comprendre les résultats de 1 dépistage, dans les 10 semaines. J'ai 41 ans, je pèse 48 kg. L'accouchement vient en premier.
KTR 31mm
TVP jusqu'à 2 mm
marqueur hCGb : conc. 100,1 ng/mL corr. Prise de force 1.28
Marqueur PAPP-A : conc. 623,9 mU/L, correction PTO 0,58
Ils mettent un risque élevé de syndrome de Down, risque d'âge 1:70, risque calculé 1:65
Autant que je sache, les limites des normes pour la prise de force sont de 0,5 à 2,0. Mes lectures POM ne sont-elles pas normales ? Ai-je raison de m'inquiéter ? Dans la famille, ni moi ni mon mari n'avons de pathologies congénitales. Je serais très reconnaissant d'avoir une réponse.
Malheureusement, lors de la détermination du risque d'anomalies chromosomiques, ils sont guidés non seulement par les indicateurs MOM, mais évaluent également les résultats de toutes les études dans leur ensemble. Dans le cas où le risque est élevé, il est recommandé de consulter un généticien qui, avec le gynécologue traitant, peut décider d'une intervention diagnostique telle qu'une amniocentèse. Vous pouvez obtenir plus d'informations à ce sujet dans la section thématique de notre site Web : Syndrome de Down
En savoir plus sur ce sujet :
- Test sanguin pour les anticorps - détection de maladies infectieuses (rougeole, hépatite, Helicobacter pylori, tuberculose, Giardia, tréponème, etc.). Test sanguin pour la présence d'anticorps Rh pendant la grossesse
- Test sanguin pour les anticorps - types (ELISA, RIA, immunotransfert, méthodes sérologiques), norme, interprétation des résultats. Où pouvez-vous soumettre? Prix de recherche.
- Test sanguin biochimique - normes, signification et interprétation des indicateurs chez les hommes, les femmes et les enfants (par âge). La concentration des ions (électrolytes) dans le sang : potassium, sodium, chlore, calcium, magnésium, phosphore
- Test sanguin biochimique - normes, signification et interprétation des indicateurs chez les hommes, les femmes et les enfants (par âge). Indicateurs du métabolisme du fer : fer total, transferrine, ferritine, haptoglobine, céruloplasmine
Le diabète sucré est une maladie complexe difficile à traiter. Avec son développement dans le corps, il y a une violation du métabolisme des glucides et une diminution de la synthèse de l'insuline par le pancréas, à la suite de quoi le glucose cesse d'être absorbé par les cellules et se dépose dans le sang sous forme d'éléments microcristallins.
Les raisons exactes pour lesquelles cette maladie commence à se développer, les scientifiques n'ont pas encore été en mesure d'établir. Mais ils ont identifié des facteurs de risque Diabète, ce qui peut provoquer l'apparition de cette maladie chez les personnes âgées et les jeunes.
Quelques mots sur la pathologie
Avant d'examiner les facteurs de risque de développer le diabète, il faut dire que cette maladie a deux types, et chacun d'eux a ses propres caractéristiques. Le diabète de type 1 se caractérise par des changements systémiques dans le corps, dans lesquels non seulement le métabolisme des glucides est perturbé, mais également la fonctionnalité du pancréas. Pour une raison quelconque, ses cellules cessent de produire de l'insuline en quantité suffisante, de sorte que le sucre qui pénètre dans le corps avec de la nourriture ne subit pas de processus de clivage et, par conséquent, ne peut pas être absorbé par les cellules.
Le diabète sucré de type 2 est une maladie dans laquelle la fonctionnalité du pancréas est préservée, mais en raison d'un métabolisme altéré, les cellules du corps perdent leur sensibilité à l'insuline. Dans ce contexte, le glucose cesse simplement d'être transporté dans les cellules et se dépose dans le sang.
Mais quels que soient les processus qui se produisent dans le diabète sucré, le résultat de cette maladie est le même - un taux élevé de glucose dans le sang, ce qui entraîne de graves problèmes de santé.
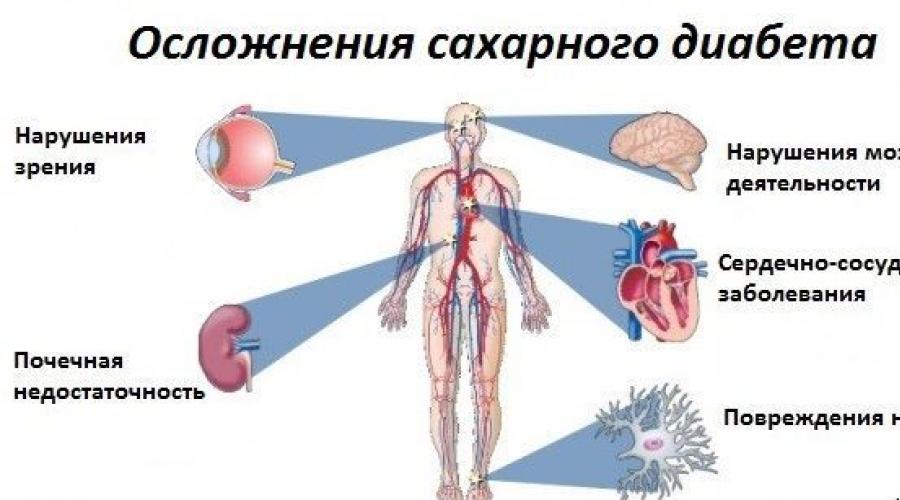
Les complications les plus courantes de cette maladie sont les conditions suivantes:
- hyperglycémie - une augmentation de la glycémie au-delà de la plage normale (plus de 7 mmol / l);
- hypoglycémie - une diminution de la glycémie au-delà de la plage normale (inférieure à 3,3 mmol / l);
- coma hyperglycémique - une augmentation de la glycémie supérieure à 30 mmol / l;
- coma hypoglycémique - une diminution de la glycémie inférieure à 2,1 mmol / l;
- pied diabétique - sensation diminuée membres inférieurs et leur déformation
- rétinopathie diabétique - diminution de l'acuité visuelle;
- thrombophlébite - la formation de plaques dans les parois des vaisseaux sanguins;
- hypertension - augmentation de la pression artérielle;
- gangrène - nécrose des tissus des membres inférieurs avec développement ultérieur d'un abcès;
- accident vasculaire cérébral et infarctus du myocarde.

Complications courantes du diabète
Ce sont loin de toutes les complications que le développement du diabète sucré entraîne pour une personne de tout âge. Et pour prévenir cette maladie, il est nécessaire de savoir exactement quels facteurs peuvent provoquer l'apparition du diabète et quelles mesures sont incluses dans la prévention de son développement.
Le diabète de type 1 et ses facteurs de risque
Le diabète sucré de type 1 (DM1) est le plus souvent diagnostiqué chez les enfants et les jeunes âgés de 20 à 30 ans. On pense que les principaux facteurs de son développement sont:
- maladies virales;
- intoxication du corps;
- malnutrition;
- stress fréquent.
Dans la survenue de DM1, le rôle principal est joué par la prédisposition héréditaire. Si l'un des membres de la famille souffre de cette maladie, les risques de son développement dans la génération suivante sont d'environ 10 à 20 %.
En même temps, il convient de noter que dans ce cas, nous ne parlons pas d'un fait établi, mais d'une prédisposition. Autrement dit, si une mère ou un père est atteint de diabète de type 1, cela ne signifie pas du tout que leurs enfants seront également diagnostiqués avec cette maladie. La prédisposition suggère que si une personne ne prend pas de mesures préventives et mène le mauvais mode de vie, elle a un risque élevé de devenir diabétique en quelques années.

Lors du diagnostic de diabète chez les deux parents à la fois, les risques de développer la maladie chez leurs enfants augmentent plusieurs fois.
Cependant, dans ce cas, il faut garder à l'esprit que si les deux parents souffrent de diabète en même temps, la probabilité que leur enfant le développe est considérablement augmentée. Et c'est souvent dans de telles situations que cette maladie est diagnostiquée chez les enfants dès âge scolaire bien qu'ils n'aient pas encore mauvaises habitudes et mener une vie active.
On pense que le diabète est le plus souvent «transmis» par la lignée masculine. Mais si seule la mère est diabétique, alors les risques d'avoir un bébé atteint de cette maladie sont très faibles (pas plus de 10%).
Maladies virales
Les maladies virales sont une autre raison pour laquelle le diabète de type 1 peut se développer. Les maladies telles que la parotidite et la rubéole sont particulièrement dangereuses dans ce cas. Les scientifiques ont depuis longtemps prouvé que ces maladies nuisent au travail du pancréas et endommagent ses cellules, réduisant ainsi le taux d'insuline dans le sang.
Il convient de noter que cela s'applique non seulement aux enfants déjà nés, mais également à ceux qui sont encore dans l'utérus. Toute maladie virale dont souffre une femme enceinte peut déclencher le développement du diabète de type 1 chez son enfant.
Intoxication corporelle
De nombreuses personnes travaillent dans des usines et des entreprises où des produits chimiques sont utilisés, dont l'action affecte négativement le fonctionnement de tout l'organisme, y compris la fonctionnalité du pancréas.
La chimiothérapie, qui est pratiquée pour traiter diverses maladies oncologiques, a également un effet toxique sur les cellules du corps, de sorte que leur conduite augmente également de plusieurs fois la probabilité de développer un diabète de type 1 chez l'homme.
Une mauvaise alimentation
La malnutrition est l'une des causes les plus fréquentes de DT1. L'alimentation quotidienne d'une personne moderne contient une énorme quantité de graisses et de glucides, ce qui pèse lourdement sur le système digestif, y compris le pancréas. Au fil du temps, ses cellules sont endommagées et la synthèse d'insuline est perturbée.

Une mauvaise nutrition est dangereuse non seulement pour le développement de l'obésité, mais aussi pour la violation du pancréas
Il convient également de noter qu'en raison de la malnutrition, la DM1 peut également se développer chez les enfants âgés de 1 à 2 ans. Et la raison en est l'introduction précoce du lait de vache et des céréales dans l'alimentation du bébé.
Stress fréquent
Le stress est un provocateur de diverses maladies, dont le diabète de type 1. Si une personne est stressée, une grande quantité d'adrénaline est produite dans son corps, ce qui contribue au traitement rapide du sucre dans le sang, entraînant une hypoglycémie. Cette condition est temporaire, mais si elle survient systématiquement, les risques de DT1 augmentent plusieurs fois.
Le diabète de type 2 et ses facteurs de risque
Comme mentionné ci-dessus, le diabète sucré de type 2 (DM2) se développe à la suite d'une diminution de la sensibilité cellulaire à l'insuline. Cela peut aussi arriver pour plusieurs raisons :
- prédisposition héréditaire;
- changements liés à l'âge dans le corps;
- obésité;
- diabète gestationnel.
prédisposition héréditaire
Dans le développement de la DM2, la prédisposition héréditaire joue un rôle encore plus important que dans la DM1. Comme le montrent les statistiques, les risques de cette maladie chez la progéniture dans ce cas sont de 50% si la DM2 n'a été diagnostiquée que chez la mère et de 80% si cette maladie a été détectée chez les deux parents à la fois.

Lorsque la DM2 est détectée chez les parents, la probabilité d'avoir un enfant malade est significativement plus élevée que dans la DM1
Changements corporels liés à l'âge
Les médecins considèrent la DM2 comme une maladie des personnes âgées, car c'est chez elles qu'elle est le plus souvent détectée. La raison en est les changements liés à l'âge dans le corps. Malheureusement, avec l'âge, sous l'influence de facteurs internes et externes, les organes internes «s'usent» et leur fonctionnalité est altérée. De plus, avec l'âge, de nombreuses personnes développent une hypertension, ce qui augmente encore le risque de développer un diabète de type 2.
Important! Compte tenu de tout cela, les médecins recommandent fortement à toutes les personnes de plus de 50 ans, quel que soit leur état de santé général et leur sexe, de passer régulièrement des tests pour déterminer leur glycémie. Et en cas de détection de tout écart, commencez immédiatement le traitement.
L'obésité est la principale cause de DT2 chez les personnes âgées et les jeunes. La raison en est l'accumulation excessive de graisse dans les cellules du corps, à la suite de quoi elles commencent à en tirer de l'énergie et le sucre devient inutile pour elles. Par conséquent, avec l'obésité, les cellules cessent d'absorber le glucose et celui-ci se dépose dans le sang. Et si une personne, en présence de surpoids, mène également une vie passive, cela augmente encore la probabilité de développer la DM2 à tout âge.

L'obésité provoque l'apparition non seulement du diabète de type 2, mais aussi d'autres problèmes de santé
Diabète gestationnel
Le diabète gestationnel est également appelé diabète gestationnel car il se développe pendant la grossesse. Son apparition est causée par des troubles hormonaux dans le corps et une activité excessive du pancréas (elle doit travailler pendant "deux"). En raison de charges accrues, il s'use et cesse de produire de l'insuline en quantité suffisante.
Après l'accouchement, cette maladie disparaît, mais laisse une marque sérieuse sur la santé de l'enfant. Du fait que le pancréas de la mère cesse de produire de l'insuline en quantité suffisante, le pancréas du bébé commence à fonctionner en mode accéléré, ce qui endommage ses cellules. De plus, avec le développement du diabète gestationnel, le risque d'obésité chez le fœtus augmente, ce qui augmente également le risque de développer un diabète de type 2.
La prévention
Le diabète sucré est une maladie qui peut être facilement évitée. Pour ce faire, il suffit de mener constamment sa prévention, qui comprend les activités suivantes :
- Nutrition adéquat. La nutrition humaine devrait inclure de nombreuses vitamines, minéraux et protéines. Les graisses et les glucides doivent également être présents dans l'alimentation, car sans eux, le corps ne peut pas fonctionner normalement, mais avec modération. Il faut surtout se méfier des glucides faciles à digérer et des gras trans, car ils sont la principale cause de surpoids et la poursuite du développement DAKOTA DU SUD. Comme pour les bébés, les parents doivent s'assurer que les aliments complémentaires introduits sont les plus bénéfiques possible pour leur organisme. Et quoi et dans quel mois vous pouvez donner au bébé, vous pouvez vous renseigner auprès du pédiatre.
- Mode de vie actif. Si vous négligez le sport et menez une vie passive, vous pouvez aussi facilement "gagner" du SD. L'activité humaine contribue à la combustion rapide des graisses et à la consommation d'énergie, ce qui entraîne un besoin accru de cellules en glucose. Chez les personnes passives, le métabolisme ralentit, ce qui augmente les risques de développer un diabète.
- Surveiller régulièrement les niveaux de sucre dans le sang. Cette règle est particulièrement vraie pour ceux qui ont une prédisposition héréditaire à cette maladie, et les personnes qui ont "frappé" 50 ans. Pour surveiller la glycémie, il n'est pas du tout nécessaire d'aller constamment à la clinique et de passer des tests. Il suffit d'acheter un glucomètre et d'effectuer vous-même des tests sanguins à la maison.
Il faut comprendre que le diabète est une maladie qui ne se guérit pas. Avec son développement, vous devez constamment prendre des médicaments et vous injecter de l'insuline. Par conséquent, si vous ne voulez pas toujours avoir peur pour votre santé, dirigez mode de vie sain de la vie et traitez promptement les maladies qui surgissent en vous. C'est le seul moyen de prévenir l'apparition du diabète et de maintenir votre santé pendant de nombreuses années !
Dernière mise à jour: 18 avril 2018
7.1. CLASSIFICATION DU DIABÈTE SUCRÉ
Diabète(DM) - un groupe de maladies métaboliques caractérisées par une hyperglycémie due à une altération de la sécrétion et/ou de l'efficacité de l'action de l'insuline. L'hyperglycémie chronique qui se développe dans le diabète s'accompagne du développement de complications de nombreux organes et systèmes, principalement du cœur, des vaisseaux sanguins, des yeux, des reins et des nerfs. Le DM au total touche 5 à 6 % de la population. Dans les pays économiquement développés du monde, tous les 10 à 15 ans, le nombre de patients atteints de diabète augmente de 2 fois. L'espérance de vie en DM est réduite de 10 à 15 %.
Les causes du DM varient considérablement. Dans la grande majorité des cas, le diabète se développe soit à la suite d'une carence absolue en insuline. (diabète de type 1) CD-1), ou en raison d'une diminution de la sensibilité des tissus périphériques à l'insuline en combinaison avec un dysfonctionnement sécrétoire des cellules β pancréatiques (diabète sucré de type 2 - SD-2). Dans certains cas, il est difficile d'affecter un patient à DM-1 ou DM-2, cependant, dans la pratique, la compensation du DM est plus importante qu'une détermination précise de son type. La classification étiologique distingue quatre grandes classes cliniques de diabète (tableau 7.1).
Le DM-1 (section 7.5), le DM-2 (section 7.6) et le DM gestationnel (section 7.9) les plus courants sont traités dans des chapitres distincts. Sur le autres types spécifiques ne représente qu'environ 1% des cas de DM. L'étiologie et la pathogenèse de ces types de DM semblent être plus étudiées par rapport à la DM-1 et surtout la DM-2. Un certain nombre de variantes de DM sont dues à une transmission monogénique défauts génétiques de la fonctionβ -cellules. Cela inclut diverses variantes du syndrome MODY à transmission autosomique dominante (Eng. diabète d'apparition du jeune- diabète de type adulte chez les jeunes), qui se caractérisent par une violation, mais pas l'absence de sécrétion d'insuline avec une sensibilité normale des tissus périphériques à celle-ci.
Languette. 7.1. Classification du diabète
D'ailleurs rare défauts génétiques dans l'action de l'insuline, associée à une mutation du récepteur de l'insuline (lépréchaunisme, syndrome de Rabson-Mandehall). DM se développe naturellement avec maladies du pancréas exocrine, entraînant la destruction des cellules β (pancréatite, pancréatectomie, fibrose kystique, hémochromatose), ainsi que dans un certain nombre de maladies endocriniennes caractérisées par une production excessive d'hormones contre-insulaires (acromégalie, syndrome de Cushing). Médicaments et produits chimiques(Vacor, pentamidine, acide nicotinique, diazoxide, etc.) sont rarement à l'origine du DM, mais peuvent contribuer à la manifestation et à la décompensation de la maladie chez les personnes insulino-résistantes. Ligne maladies infectieuses(rubéole, cytomégalie, infection à coxsackie et à adénovirus) peut s'accompagner d'une destruction des cellules β, tandis que chez la plupart des patients, des marqueurs immunogénétiques de CD-1 sont déterminés. À formes rares de diabète à médiation immunitaire comprennent le diabète qui se développe chez les patients atteints du syndrome "raideur" (une maladie neurologique auto-immune), ainsi que le diabète dû à l'exposition aux auto-anticorps dirigés contre les récepteurs de l'insuline. Diverses variantes de DM avec une fréquence accrue se produisent avec
de nombreux syndromes génétiques, en particulier avec le syndrome de Down, Klinefelter, Turner, Wolfram, Prader-Willi et un certain nombre d'autres.
7.2. ASPECTS CLINIQUES DE LA PHYSIOLOGIE DU MÉTABOLISME DES GLUCIDES
Insuline synthétisé et sécrété par les cellules β des îlots de Langerhans du pancréas (PZhZh). De plus, les îlots de Langerhans sécrètent du glucagon (cellules α), de la somatostatine (cellules δ) et du polypeptide pancréatique (cellules PP). Les hormones des cellules des îlots interagissent entre elles : le glucagon stimule normalement la sécrétion d'insuline et la somatostatine supprime la sécrétion d'insuline et de glucagon. La molécule d'insuline est constituée de deux chaînes polypeptidiques (chaîne A - 21 acides aminés ; chaîne B - 30 acides aminés) (Fig. 7.1). La synthèse de l'insuline commence par la formation de préproinsuline, qui est clivée par une protéase pour former proinsuline. Dans les granules de sécrétion de l'appareil de Golgi, la proinsuline est décomposée en insuline et C-peptide, qui sont libérés dans le sang lors de l'exocytose (Fig. 7.2).
Le principal stimulateur de la sécrétion d'insuline est le glucose. L'insuline est libérée en réponse à une augmentation de la glycémie biphasé(Fig. 7.3). La première phase, ou phase aiguë, dure quelques minutes et est associée à la libération des
 Riz. 7.1. Schéma de la structure primaire de la molécule d'insuline
Riz. 7.1. Schéma de la structure primaire de la molécule d'insuline
 Riz. 7.2. Schéma de biosynthèse de l'insuline
Riz. 7.2. Schéma de biosynthèse de l'insuline
Insuline des cellules β dans la période entre les repas. La deuxième phase se poursuit jusqu'à ce que le niveau de glycémie atteigne la normale à jeun (3,3-5,5 mmol/l). La cellule β est affectée de la même manière par les sulfonylurées.
Grâce au système portail, l'insuline atteint foie- son organe cible principal. Les récepteurs hépatiques lient la moitié de l'hormone sécrétée. L'autre moitié, pénétrant dans la circulation systémique, atteint les muscles et le tissu adipeux. La majeure partie de l'insuline (80%) subit une dégradation protéolytique dans le foie, le reste dans les reins, et seule une petite quantité est métabolisée directement par les cellules musculaires et adipeuses. PZhZh normal
 Riz. 7.3. Libération biphasique d'insuline sous l'influence du glucose
Riz. 7.3. Libération biphasique d'insuline sous l'influence du glucose
un adulte sécrète 35 à 50 unités d'insuline par jour, soit 0,6 à 1,2 unités pour 1 kg de poids corporel. Cette sécrétion est divisée en nourriture et basale. sécrétion alimentaire l'insuline correspond à l'élévation postprandiale de la glycémie, c'est-à-dire grâce à cela, la neutralisation de l'effet hyperglycémiant des aliments est assurée. La quantité d'insuline alimentaire correspond approximativement à la quantité de glucides consommée - environ 1 à 2,5 unités
pour 10-12 g de glucides (1 unité de pain - XE). Sécrétion basale d'insuline assure un niveau optimal de glycémie et d'anabolisme dans les intervalles entre les repas et pendant le sommeil. L'insuline basale est sécrétée à un taux d'environ 1 U / h, avec un effort physique prolongé ou un jeûne prolongé, elle diminue de manière significative. L'insuline alimentaire représente au moins 50 à 70 % de la production quotidienne d'insuline (Fig. 7.4).
La sécrétion d'insuline est soumise non seulement à l'alimentation, mais aussi du quotidien-
 Riz. sept .4.
Le diagramme de la production quotidienne d'insuline est normal
Riz. sept .4.
Le diagramme de la production quotidienne d'insuline est normal
fluctuation : le besoin d'insuline augmente tôt le matin, puis diminue progressivement au cours de la journée. Ainsi, pour le petit-déjeuner, 2,0 à 2,5 U d'insuline sont sécrétées pour 1 XE, pour le déjeuner - 1,0 à 1,5 U et pour le dîner - 1,0 U. L'une des raisons de cette modification de la sensibilité à l'insuline est le niveau élevé d'un certain nombre d'hormones contrasulaires (principalement le cortisol) le matin, qui diminue progressivement jusqu'à un minimum en début de nuit.
Principal effets physiologiques de l'insuline sont la stimulation du transfert de glucose à travers les membranes cellulaires des tissus insulino-dépendants. Les principaux organes cibles de l'insuline sont le foie, le tissu adipeux et les muscles. Les tissus insulino-indépendants, dont l'apport en glucose ne dépend pas des effets de l'insuline, comprennent principalement le système nerveux central et périphérique, l'endothélium vasculaire, les cellules sanguines, etc. L'insuline stimule la synthèse du glycogène dans le foie et les muscles, la synthèse des graisses dans le foie et le tissu adipeux, la synthèse des protéines dans le foie, les muscles et d'autres organes. Tous ces changements visent l'utilisation du glucose, ce qui entraîne une diminution de son taux dans le sang. L'antagoniste physiologique de l'insuline est glucagon, qui stimule la mobilisation du glycogène et des graisses du dépôt ; Normalement, les niveaux de glucagon changent réciproquement avec la production d'insuline.
Les effets biologiques de l'insuline sont médiés par son récepteurs situé sur les cellules cibles. Le récepteur de l'insuline est une glycoprotéine composée de quatre sous-unités. Avec un taux élevé d'insuline dans le sang, le nombre de ses récepteurs diminue selon le principe de la régulation à la baisse, ce qui s'accompagne d'une diminution de la sensibilité de la cellule à l'insuline. Une fois que l'insuline se lie au récepteur cellulaire, le complexe résultant pénètre dans la cellule. Plus à l'intérieur des cellules musculaires et adipeuses, l'insuline provoque la mobilisation de vésicules intracellulaires qui contiennent transporteur de glucose GLUT-4. En conséquence, les vésicules se déplacent vers la surface cellulaire, où GLUT-4 agit comme une entrée pour le glucose. L'activité physique a un effet similaire sur GLUT-4.
7.3. DIAGNOSTIC DE LABORATOIRE ET CRITÈRES DE COMPENSATION DU DIABÈTE SUCRÉ
Le diagnostic de laboratoire du diabète repose sur la détermination de la glycémie, alors que les critères de diagnostic sont les mêmes pour tous
types et variantes de DS (tableau 7.2). Les données d'autres études de laboratoire (taux de glucosurie, détermination du taux d'hémoglobine glyquée) ne doivent pas être utilisées pour vérifier le diagnostic de diabète. Le diagnostic de DM peut être établi sur la base de deux détections de l'un des trois critères :
1. Avec des symptômes évidents de diabète (polyurie, polydipsie) et des taux de glucose dans le sang capillaire total supérieurs à 11,1 mmol/l, quelle que soit l'heure de la journée et le repas précédent.
2. Lorsque le taux de glucose dans le sang capillaire total à jeun est supérieur à 6,1 mmol / l.
3. Lorsque le taux de glucose dans le sang total capillaire 2 heures après l'ingestion de 75 grammes de glucose (test oral de tolérance au glucose) est supérieur à 11,1 mmol/l.
Languette. 7.2. Critères de diagnostic du diabète
 Le plus important et test significatif dans le diagnostic du diabète consiste à déterminer le niveau de glycémie à jeun (au moins 8 heures de jeûne). En Fédération de Russie, le niveau de glycémie est généralement estimé dans le sang total. Les tests de glycémie sont largement utilisés dans de nombreux pays
Le plus important et test significatif dans le diagnostic du diabète consiste à déterminer le niveau de glycémie à jeun (au moins 8 heures de jeûne). En Fédération de Russie, le niveau de glycémie est généralement estimé dans le sang total. Les tests de glycémie sont largement utilisés dans de nombreux pays
dans le plasma sanguin. Test oral de tolérance au glucose(OGTT ; détermination du taux de glucose 2 heures après l'ingestion de 75 grammes de glucose dissous dans de l'eau) a moins d'importance à cet égard. Cependant, sur la base de l'OGTT, il est diagnostiqué altération de la tolérance au glucose(NTG). La NTG est diagnostiquée si le niveau de glycémie capillaire à jeun dans le sang total ne dépasse pas 6,1 mmol/l, et 2 heures après la charge de glucose est supérieure à 7,8 mmol/l, mais inférieure à 11,1 mmol/l. Une autre variante du trouble du métabolisme des glucides est glycémie à jeun perturbée(NGNT). Ce dernier est défini si le niveau de glycémie du sang capillaire total à jeun est compris entre 5,6 et 6,0 mmol/l, et 2 heures après la charge de glucose est inférieure à 7,8 mmol/l). NTG et NGNT sont actuellement combinés par le terme prédiabète, car les deux catégories de patients présentent un risque élevé de manifestation du diabète et de développement d'une macroangiopathie diabétique.
Pour le diagnostic du diabète, le niveau de glycémie doit être déterminé par des méthodes de laboratoire standard. Lors de l'interprétation des valeurs glycémiques, il convient de garder à l'esprit qu'à jeun, le taux de glucose dans le sang veineux total correspond à son taux dans le sang capillaire total. Après un repas ou une HGPO, son taux dans le sang veineux est inférieur d'environ 1,1 mmol/l à celui du sang capillaire. La glycémie plasmatique est supérieure d'environ 0,84 mmol/l à celle du sang total. Afin d'évaluer la compensation et l'adéquation du traitement du diabète, le niveau de glycémie est évalué dans le sang capillaire à l'aide d'appareils portables glucomètres les patients eux-mêmes, leurs proches ou le personnel médical.
Avec tout type de DM, ainsi qu'avec une charge importante de glucose, glucosurie, qui est une conséquence du dépassement du seuil de réabsorption du glucose à partir de l'urine primaire. Le seuil de réabsorption du glucose varie significativement individuellement (≈ 9-10 mmol/l). En tant qu'indicateur unique, la glycosurie ne doit pas être utilisée pour poser un diagnostic de DM. Normalement, à l'exception des cas de charge alimentaire importante en glucides raffinés, la glucosurie ne se produit pas.
Des produits corps cétoniques(acétone, acétoacétate, β-hydroxybutyrate) est significativement intensifiée en cas de déficit absolu en insuline. Avec la décompensation de SD-1, un prononcé cétonurie(examiné à l'aide de bandelettes de test qui tombent dans l'urine). Une cétonurie légère (trace) peut être déterminée dans personnes en bonne santé avec la famine et un régime sans glucides.
Le niveau de C-peptide. Le niveau de peptide C dans le sang peut indirectement juger de la capacité de sécrétion d'insuline des cellules β du pancréas. Ces derniers produisent de la proinsuline, à partir de laquelle le peptide C est clivé avant la sécrétion, qui pénètre dans le sang en quantités égales avec l'insuline. L'insuline est liée à 50 % dans le foie et a une demi-vie dans le sang périphérique d'environ 4 minutes. Le peptide C n'est pas éliminé de la circulation sanguine par le foie et a une demi-vie sanguine d'environ 30 minutes. De plus, il ne se lie pas aux récepteurs cellulaires en périphérie. Par conséquent, la détermination du niveau de peptide C est un test plus fiable pour évaluer la fonction de l'appareil insulaire. Le niveau de peptide C est le plus informatif à étudier dans le contexte des tests de stimulation (après un repas ou l'administration de glucagon). Le test n'est pas informatif s'il est effectué dans le contexte d'une décompensation sévère du diabète, car l'hyperglycémie sévère a un effet toxique sur les cellules β (toxicité du glucose). L'insulinothérapie au cours des derniers jours n'affectera en rien les résultats du test.
De base objectif du traitement de tout type de DM est la prévention de ses complications tardives, qui peut être obtenue dans le contexte de sa compensation stable pour un certain nombre de paramètres (tableau 7.3). Le principal critère de qualité de la compensation du métabolisme glucidique dans le DM est le niveau hémoglobine glyquée (glycosylée) (HbA1c). Ce dernier est l'hémoglobine liée de manière non covalente au glucose. Le glucose pénètre dans les érythrocytes indépendamment de l'insuline, et la glycosylation de l'hémoglobine est un processus irréversible, et son degré est directement proportionnel à la concentration de glucose avec laquelle il a été en contact pendant 120 jours de son existence. Une petite partie de l'hémoglobine est glycosylée et est normale ; avec DM, il peut être considérablement augmenté. Le niveau d'HbA1c, contrairement au niveau de glucose, qui change constamment, reflète intégralement la glycémie au cours des 3-4 derniers mois. C'est avec cet intervalle qu'il est recommandé de déterminer le taux d'HbA1c afin d'évaluer la compensation du diabète.
L'hyperglycémie chronique est loin d'être le seul facteur de risque de développement et de progression des complications tardives du DM. Concernant évaluation de la rémunération du DM basé sur le complexe
méthodes de recherche en laboratoire et instrumentales (tableau 7.3). Outre les indicateurs caractérisant l'état du métabolisme des glucides, les plus importants sont le niveau de pression artérielle et le spectre lipidique du sang.
Languette. 7.3. Critères d'indemnisation du diabète sucré
 En plus des critères de compensation ci-dessus, lors de la planification des objectifs pour le traitement du diabète, il est nécessaire de approche individuelle. La probabilité de développement et de progression des complications tardives du DM (en particulier la microangiopathie) augmente avec la durée de la maladie. Ainsi, si chez les enfants et les jeunes patients, dont l'expérience du diabète peut atteindre plusieurs décennies dans le futur, il est nécessaire d'atteindre des indices glycémiques optimaux, alors chez les patients chez lesquels le DM s'est manifesté à l'âge âgé et sénile, une compensation euglycémique rigide, qui augmente considérablement le risque d'hypoglycémie, pas toujours approprié.
En plus des critères de compensation ci-dessus, lors de la planification des objectifs pour le traitement du diabète, il est nécessaire de approche individuelle. La probabilité de développement et de progression des complications tardives du DM (en particulier la microangiopathie) augmente avec la durée de la maladie. Ainsi, si chez les enfants et les jeunes patients, dont l'expérience du diabète peut atteindre plusieurs décennies dans le futur, il est nécessaire d'atteindre des indices glycémiques optimaux, alors chez les patients chez lesquels le DM s'est manifesté à l'âge âgé et sénile, une compensation euglycémique rigide, qui augmente considérablement le risque d'hypoglycémie, pas toujours approprié.
7.4. INSULINE ET INSULINOTHERAPIE
Les préparations d'insuline sont vitales pour les patients atteints de diabète de type 1; de plus, jusqu'à 40 % des patients atteints de diabète de type 2 en reçoivent. Au général indications pour la nomination de l'insulinothérapie dans le diabète, dont beaucoup se chevauchent en fait:
1. Diabète de type 1
2. Pancréatectomie
3. Coma cétoacidotique et hyperosmolaire
4. Pour le diabète de type 2 :
Signes manifestes de carence en insuline tels qu'une perte de poids progressive et une cétose, une hyperglycémie sévère ;
Interventions chirurgicales majeures ;
Complications macrovasculaires aiguës (accident vasculaire cérébral, infarctus du myocarde, gangrène, etc.) et maladies infectieuses graves accompagnées d'une décompensation du métabolisme des glucides ;
Le niveau de glycémie à jeun est supérieur à 15-18 mmol / l;
L'absence de compensation stable, malgré la nomination des doses quotidiennes maximales de divers médicaments hypoglycémiants en comprimés ;
Stades avancés des complications tardives du diabète (polyneuropathie et rétinopathie sévères, insuffisance rénale chronique).
5. Incapacité à obtenir une compensation pour le diabète gestationnel à l'aide d'une thérapie diététique.
Origine Les préparations d'insuline peuvent être classées en trois groupes :
Insulines animales (porc);
Insulines humaines (semi-synthétiques, génétiquement modifiées);
Analogues de l'insuline (lispro, aspart, glargine, détémir).
Les progrès de la technologie pour la production d'insuline humaine ont conduit au fait que l'utilisation de insuline porcine(diffère de l'humain par un acide aminé) a récemment diminué de manière significative. L'insuline de porc peut être utilisée pour fabriquer de l'insuline humaine méthode semi-synthétique, qui implique le remplacement d'un acide aminé différent dans sa molécule. Plus haute qualité différent ingénierie génétique insulines humaines. Pour les obtenir, la région du génome humain responsable de la synthèse de l'insuline est associée au génome E. coli ou culture de levure, à la suite de laquelle ces dernières commencent à produire de l'insuline humaine. Création analogues de l'insulineà l'aide de permutations de divers acides aminés, le but était d'obtenir des médicaments avec une pharmacocinétique donnée et la plus favorable. Ainsi, l'insuline lispro (Humalog) est un analogue
insuline à action ultracourte, tandis que son effet hypoglycémiant se développe déjà 15 minutes après l'injection. En revanche, l'analogue de l'insuline glargine (Lantus) se caractérise par un effet à long terme qui dure toute la journée, tandis que la cinétique du médicament se caractérise par l'absence de pics prononcés de concentration plasmatique. La plupart des préparations d'insuline actuellement utilisées et de ses analogues sont produites en concentration 100U/ml. Par durée d'action les insulines sont divisées en 4 groupes principaux (tableau 7.4) :
Languette. 7.4. Pharmacocinétique des médicaments et des analogues de l'insuline
 1.
Action ultracourte (lispro, aspart).
1.
Action ultracourte (lispro, aspart).
2. Action courte (insuline humaine simple).
3. Durée d'action moyenne (insulines sur protamine neutre Hagedorn).
4. Longue durée d'action (glargine, détémir).
5. Mélanges d'insulines de différentes durées d'action (Novomix-30, Humulin-MZ, Humalog-Mix-25).
Les préparatifs action ultra courte[lispro (Humalog), aspart (Novorapid)] sont des analogues de l'insuline. Leurs avantages sont le développement rapide de l'effet hypoglycémiant après injection (après 15 minutes), ce qui permet une injection juste avant les repas voire immédiatement après les repas, ainsi qu'une courte durée d'action (moins de 3 heures), ce qui réduit le risque d'hypoglycémie. . Les préparatifs action courte(insuline simple, insuline régulière) sont une solution contenant de l'insuline à une concentration de 100 U/ml. Une simple injection d'insuline est administrée 30 minutes avant un repas; la durée d'action est d'environ 4 à 6 heures. Les préparations à action ultracourte et courte peuvent être administrées par voie sous-cutanée, intramusculaire et intraveineuse.
Parmi les médicaments durée moyenne d'action les préparations les plus couramment utilisées sur la protamine neutre Hagedorn (NPH). La NPH est une protéine qui adsorbe l'insuline de manière non covalente, ralentissant son absorption à partir du dépôt sous-cutané. La durée d'action effective des insulines NPH est généralement d'environ 12 heures ; ils sont administrés par voie sous-cutanée uniquement. L'insuline NPH est une suspension et, par conséquent, contrairement à l'insuline ordinaire, elle est trouble dans le flacon et une suspension se forme pendant une station debout prolongée, qui doit être soigneusement mélangée avant l'injection. Les insulines NPH, contrairement à d'autres médicaments à action prolongée, peuvent être mélangées dans n'importe quel rapport avec l'insuline à action courte (insuline simple), tandis que la pharmacocinétique des composants du mélange ne changera pas, car la NPH ne se liera pas à des quantités supplémentaires d'insuline simple ( figure 7.5). De plus, la protamine est utilisée pour préparer des mélanges standard d'analogues de l'insuline (Novomix-30, Humalog-Mix-25).
Parmi les médicaments à action prolongée, les analogues de l'insuline sont actuellement activement utilisés. glargine(Lantus) et détémir(Levemir). Une caractéristique favorable de la pharmacocinétique de ces médicaments est que, contrairement aux insulines NPH, ils fournissent une absorption plus uniforme et prolongée du médicament à partir du dépôt sous-cutané. À cet égard, la glargine ne peut être administrée qu'une seule fois par jour et presque quelle que soit l'heure de la journée.
 Riz. 7.5. Pharmacocinétique de diverses préparations d'insuline :
Riz. 7.5. Pharmacocinétique de diverses préparations d'insuline :
a) monocomposant ; b) mélanges standards d'insulines
En plus des préparations d'insuline monocomposant, dans la pratique clinique sont largement utilisés mélanges standards. En règle générale, on parle de mélanges d'insuline courte ou ultra-courte avec de l'insuline d'une durée d'action moyenne. Par exemple, le médicament "Humulin-MZ" contient dans un flacon 30% d'insuline simple et 70% d'insuline NPH; Novomix-30 contient 30 % d'insuline asparte et 70 % de suspension de protamine cristalline d'insuline asparte ; Humalog-Mix-25 contient 25 % d'insuline lispro et 75 % d'insuline lispro protamine en suspension. avantage
les mélanges standard d'insulines sont le remplacement de deux injections par une et une précision un peu plus grande du dosage des composants du mélange; l'inconvénient est l'impossibilité d'un dosage individuel des composants individuels du mélange. Cela détermine la préférence pour l'utilisation de mélanges d'insuline standard pour le traitement du DM-2 ou avec le soi-disant l'insulinothérapie traditionnelle(prescrivant des doses fixes d'insuline), alors que pour insulinothérapie intensive(sélection de dose flexible en fonction des indicateurs glycémiques et de la quantité de glucides dans les aliments), l'utilisation de préparations monocomposant est préférable.
La clé d'une insulinothérapie réussie est le strict respect des technique d'injection. Il existe plusieurs façons d'administrer l'insuline. La méthode la plus simple et la plus fiable consiste à injecter de l'insuline seringue. Un moyen plus pratique d'administrer de l'insuline consiste à faire des injections. stylos à seringue, lequel est appareil combiné contenant un réservoir d'insuline (cartouche), un système de dosage et une aiguille avec un injecteur.
Pour le traitement d'entretien (quand on ne parle pas de décompensation sévère du diabète ou d'états critiques), l'insuline est administrée par voie sous-cutanée. Il est recommandé d'injecter de l'insuline à action brève dans le tissu adipeux sous-cutané de l'abdomen, de l'insuline à action prolongée - dans le tissu de la cuisse ou de l'épaule (Fig. 7.6 a). Les injections sont faites profondément dans le tissu sous-cutané à travers une peau largement comprimée sous un angle de 45 ° (Fig. 7.6 b). Il doit être conseillé au patient de changer de site d'injection quotidienne d'insuline dans la même zone afin de prévenir le développement d'une lipodystrophie.
À facteurs affectant le taux d'absorption de l'insulineà partir du dépôt sous-cutané, il convient d'attribuer la dose d'insuline (augmenter la dose augmente la durée d'absorption), le site d'injection (l'absorption est plus rapide à partir du tissu abdominal), la température ambiante (réchauffer et masser le site d'injection accélère l'absorption).
Une méthode d'administration plus complexe, qui, cependant, chez de nombreux patients permet d'obtenir de bons résultats de traitement, est l'utilisation de distributeur d'insuline, ou des systèmes d'administration sous-cutanée continue d'insuline. Le distributeur est un appareil portable composé d'un ordinateur qui définit le mode d'administration de l'insuline, ainsi que d'un système d'administration d'insuline via un cathéter et une aiguille hypodermique miniature.
 Riz. 7.6. Injections d'insuline : a) sites d'injection typiques ; b) la position de l'aiguille de la seringue à insuline pendant l'injection
Riz. 7.6. Injections d'insuline : a) sites d'injection typiques ; b) la position de l'aiguille de la seringue à insuline pendant l'injection
tissu adipeux. À l'aide du distributeur, une administration basale continue d'insuline à action courte ou ultra-courte est effectuée (vitesse de l'ordre de 0,5-1 U / heure), et avant de manger, en fonction de la teneur en glucides qu'elle contient et le niveau de glycémie, le patient injecte la dose bolus nécessaire de la même insuline à action brève. L'avantage de l'insulinothérapie avec un distributeur est l'introduction d'insuline à action courte (voire ultra-courte) uniquement, ce qui en soi est un peu plus physiologique, car l'absorption de préparations prolongées d'insuline est sujette à de fortes fluctuations; à cet égard, l'administration continue d'insuline à action brève est plus gérable. L'inconvénient de l'insulinothérapie à l'aide d'un distributeur est la nécessité de porter constamment l'appareil, ainsi que le long séjour de l'aiguille d'injection dans le tissu sous-cutané, ce qui nécessite une surveillance périodique du processus d'alimentation en insuline. L'insulinothérapie à l'aide d'un distributeur est principalement indiquée pour les patients atteints de diabète de type 1 qui sont prêts à maîtriser la technique de son administration. Surtout à cet égard, une attention particulière doit être portée aux patientes présentant un phénomène prononcé de «l'aube», ainsi qu'aux patientes enceintes et en planification de grossesse atteintes de DM-1 et aux patientes
Ent ayant une hygiène de vie désordonnée (possibilité d'une alimentation plus souple).
7.5. DIABÈTE DE TYPE 1
CD-1 - spécifique à un organe auto-immune une maladie entraînant la destruction des cellules β productrices d'insuline des îlots du pancréas, se manifestant par une carence absolue en insuline. Dans certains cas, les patients atteints manifestement de DM-1 n'ont pas de marqueurs de dommages auto-immuns aux cellules β. (CD-1 idiopathique).
Étiologie
Le CD-1 est une maladie à prédisposition héréditaire, mais sa contribution au développement de la maladie est faible (détermine son développement d'environ 1/3). La concordance chez les vrais jumeaux pour CD-1 n'est que de 36 %. La probabilité de développer le DM-1 chez un enfant dont la mère est malade est de 1 à 2%, le père de 3 à 6%, le frère ou la sœur de 6%. Un ou plusieurs marqueurs humoraux des lésions auto-immunes des cellules β, qui comprennent des anticorps contre les îlots pancréatiques, des anticorps contre la glutamate décarboxylase (GAD65) et des anticorps contre la tyrosine phosphatase (IA-2 et ΙΑ-2β), sont présents dans 85 à 90 % des malades. Néanmoins, les facteurs de l'immunité cellulaire sont de première importance dans la destruction des cellules β. CD-1 est associé à des haplotypes HLA tels que AQD et DQB, tandis que certains allèles HLA-DR/DQ peuvent prédisposer au développement de la maladie, tandis que d'autres sont protecteurs. Avec une fréquence accrue, le CD-1 est associé à d'autres maladies endocriniennes auto-immunes (thyroïdite auto-immune, maladie d'Addison) et non endocriniennes, telles que l'alopécie, le vitiligo, la maladie de Crohn, les maladies rhumatismales (tableau 7.5).
Pathogénèse
Le CD-1 se manifeste lorsque 80 à 90 % des cellules β sont détruites par le processus auto-immun. La vitesse et l'intensité de ce processus peuvent varier considérablement. Le plus souvent quand cours typique maladies chez les enfants et les jeunes, ce processus se déroule assez rapidement, suivi d'une manifestation rapide de la maladie, au cours de laquelle quelques semaines seulement peuvent s'écouler entre l'apparition des premiers symptômes cliniques et le développement de l'acidocétose (jusqu'au coma acidocétose).
Languette. 7.5. Diabète de type 1
 Suite du tableau. 7.5
Suite du tableau. 7.5
 Dans d'autres cas beaucoup plus rares, généralement chez des adultes de plus de 40 ans, la maladie peut être latente. (diabète auto-immun latent de l'adulte - LADA), dans le même temps, au début de la maladie, ces patients reçoivent souvent un diagnostic de DM-2 et, pendant plusieurs années, une compensation du DM peut être obtenue en prescrivant des sulfonylurées. Mais à l'avenir, généralement après 3 ans, il y a des signes de carence absolue en insuline (perte de poids, cétonurie, hyperglycémie sévère, malgré la prise de comprimés hypoglycémiants).
Dans d'autres cas beaucoup plus rares, généralement chez des adultes de plus de 40 ans, la maladie peut être latente. (diabète auto-immun latent de l'adulte - LADA), dans le même temps, au début de la maladie, ces patients reçoivent souvent un diagnostic de DM-2 et, pendant plusieurs années, une compensation du DM peut être obtenue en prescrivant des sulfonylurées. Mais à l'avenir, généralement après 3 ans, il y a des signes de carence absolue en insuline (perte de poids, cétonurie, hyperglycémie sévère, malgré la prise de comprimés hypoglycémiants).
Au cœur de la pathogenèse de la DM-1, comme mentionné, se trouve la carence absolue en insuline. L'impossibilité d'entrée du glucose dans les tissus insulino-dépendants (graisse et muscle) entraîne une insuffisance énergétique, à la suite de laquelle la lipolyse et la protéolyse sont intensifiées, associées à une perte de poids. Une augmentation du niveau de glycémie provoque une hyperosmolarité, qui s'accompagne d'une diurèse osmotique et d'une déshydratation sévère. Dans des conditions de carence en insuline et de carence énergétique, la production d'hormones contrasulaires (glucagon, cortisol, hormone de croissance) est inhibée, ce qui, malgré l'augmentation de la glycémie, provoque une stimulation de la gluconéogenèse. L'augmentation de la lipolyse dans le tissu adipeux entraîne une augmentation significative de la concentration en acides gras libres. Avec une carence en insuline, la capacité liposynthétique du foie est supprimée et libre
les acides gras de nye commencent à être inclus dans la cétogenèse. L'accumulation de corps cétoniques conduit au développement de la cétose diabétique, et plus tard - de l'acidocétose. Avec une augmentation progressive de la déshydratation et de l'acidose, un coma se développe (voir paragraphe 7.7.1), qui, en l'absence d'insulinothérapie et de réhydratation, se termine inévitablement par la mort.
Épidémiologie
Le DM-1 représente environ 1,5 à 2 % de tous les cas de diabète, et ce chiffre relatif continuera de diminuer en raison de l'augmentation rapide de l'incidence du DM-2. Le risque à vie de développer le CD-1 dans une race blanche est d'environ 0,4 %. L'incidence de la DM-1 augmente de 3 % par an : de 1,5 % en raison de nouveaux cas et de 1,5 % supplémentaires en raison d'une augmentation de l'espérance de vie des patients. La prévalence du CD-1 varie en fonction de la composition ethnique de la population. En 2000, il était de 0,02 % en Afrique, de 0,1 % en Asie du Sud et en Amérique du Sud et centrale et de 0,2 % en Europe et en Amérique du Nord. L'incidence la plus élevée de DM-1 se trouve en Finlande et en Suède (30 à 35 cas pour 100 000 habitants par an) et la plus faible au Japon, en Chine et en Corée (0,5 à 2,0 cas, respectivement). Le pic d'âge de manifestation du CD-1 correspond à environ 10-13 ans. Dans la grande majorité des cas, le CD-1 se manifeste avant l'âge de 40 ans.
Manifestations cliniques
À cas typiques en particulier chez les enfants et les jeunes, CD-1 fait ses débuts avec un tableau clinique vif qui se développe sur plusieurs mois, voire plusieurs semaines. La manifestation de CD-1 peut être provoquée par des maladies infectieuses et autres maladies concomitantes. Caractéristique symptômes communs à tous les types de diabète, associés à l'hyperglycémie : polydipsie, polyurie, prurit, mais avec SD-1 ils sont très prononcés. Ainsi, tout au long de la journée, les patients peuvent boire et excréter jusqu'à 5 à 10 litres de liquide. spécifique pour le DM-1, un symptôme causé par une carence absolue en insuline est la perte de poids, atteignant 10 à 15 kg en 1 à 2 mois. La faiblesse exprimée totale et musculaire, la diminution de la capacité de travail, la somnolence est caractéristique. Au début de la maladie, certains patients peuvent ressentir une augmentation de l'appétit, qui est remplacée par une anorexie à mesure que l'acidocétose se développe. Ce dernier se caractérise par l'apparition de l'odeur d'acétone (ou odeur fruitée) de la bouche,
note, vomissements, souvent douleurs abdominales (pseudopéritonite), déshydratation sévère et se termine avec le développement coma(voir clause 7.7.1). Dans certains cas, la première manifestation de CD-1 chez les enfants est une altération progressive de la conscience jusqu'au coma dans le contexte de maladies concomitantes, généralement infectieuses ou de pathologie chirurgicale aiguë.
Dans des cas relativement rares de développement de CD-1 chez les personnes âgées de 35 à 40 ans (diabète auto-immun latent chez l'adulte) la maladie peut ne pas se manifester aussi clairement (polydipsie et polyurie modérées, pas de perte de poids) et même être détectée fortuitement lors de la mesure de routine du niveau de glycémie. Dans ces cas, le patient est souvent diagnostiqué avec DM-2 au début et prescrit des médicaments hypoglycémiants oraux (TSP), qui pendant un certain temps offrent une compensation acceptable pour le DM. Néanmoins, sur plusieurs années (souvent en moins d'un an), le patient développe des symptômes dus à un déficit absolu croissant en insuline : amaigrissement, incapacité à maintenir une glycémie normale sur fond d'HFT, cétose, acidocétose.
Diagnostique
Considérant que le DM-1 a un tableau clinique vif et est également une maladie relativement rare, la détermination par dépistage du niveau de glycémie dans le but de diagnostiquer le DM-1 n'est pas indiquée. La probabilité de développer la maladie chez les parents les plus proches des patients est faible, ce qui, associé au manque de méthodes efficaces de prévention primaire du DM-1, détermine l'inadéquation de l'étude des marqueurs immunogénétiques de la maladie chez eux. Le diagnostic de DM-1 dans la grande majorité des cas repose sur la détection d'une hyperglycémie importante chez des patients présentant des manifestations cliniques sévères de carence absolue en insuline. L'OGTT dans le but de diagnostiquer la DM-1 doit être pratiquée très rarement.
Diagnostic différentiel
Dans les cas douteux (détection d'une hyperglycémie modérée en l'absence de manifestations cliniques évidentes, manifestation à un âge relativement moyen), ainsi qu'à des fins de diagnostic différentiel avec d'autres types de DM, la détermination du niveau Peptide C(basal et 2 heures après un repas). La valeur diagnostique indirecte dans les cas douteux peut avoir une définition marqueurs immunologiques CD-1 - anticorps contre les îlots
PZhZh, à la glutamate décarboxylase (GAD65) et à la tyrosine phosphatase (IA-2 et IA-2β). Le diagnostic différentiel de CD-1 et CD-2 est présenté dans le tableau. 7.6.
Languette. 7.6. Diagnostic différentiel et différences entre CD-1 et CD-2
 Traitement
Traitement
Le traitement de tout type de DM repose sur trois grands principes : l'hypoglycémiant (dans le DM-1 - insulinothérapie), l'alimentation et l'éducation du patient. insulinothérapie avec SD-1 porte substitution et son objectif est d'imiter au maximum la production physiologique de l'hormone afin d'atteindre les critères de compensation acceptés (tableau 7.3). Au plus proche de la sécrétion physiologique d'insuline insulinothérapie intensive. Le besoin en insuline correspondant à son sécrétion basale, deux injections d'insuline à action intermédiaire (matin et soir) ou une injection d'insuline à action prolongée (glargine). La dose totale d'insuline basale
ne doit pas dépasser la moitié des besoins quotidiens totaux en médicament. Repas ou bolus de sécrétion d'insuline est remplacé par des injections d'insuline courte ou ultra-rapide avant chaque repas, tandis que sa dose est calculée en fonction de la quantité de glucides qu'il est prévu de prendre au cours du repas à venir et du niveau de glycémie existant, déterminé par le patient à l'aide d'un glucomètre avant chaque injection d'insuline (Fig. 7.7 ).
Estimé régime intensif d'insuline, qui changera presque tous les jours, peut être représenté comme suit. On suppose que les besoins quotidiens en insuline sont d'environ 0,5 à 0,7 U pour 1 kg de poids corporel (pour un patient pesant 70 kg, environ 35 à 50 U). Environ 1/s - 1/2 de cette dose sera de l'insuline à action prolongée (20-25 U), 1/2 - 2/s de l'insuline à action courte ou ultra-courte. La dose d'insuline NPH est divisée en 2 injections: le matin 2 / s de sa dose (12 U), le soir - 1 / s (8-10 U).
objectif première étape sélection de l'insulinothérapie est la normalisation des niveaux de glucose à jeun. La dose du soir d'insuline NPH est généralement administrée entre 22 h et 23 h, suivie d'une dose matinale d'insuline à action brève avant le petit-déjeuner. Lors du choix d'une dose du soir d'insuline NPH, il est nécessaire de garder à l'esprit la possibilité de développer un certain nombre de
 Riz. 7.7. Schéma d'insulinothérapie intensive
Riz. 7.7. Schéma d'insulinothérapie intensive
phénomènes tout à fait typiques. La cause de l'hyperglycémie matinale peut être une dose insuffisante d'insuline à action prolongée, car le matin, les besoins en insuline augmentent considérablement (phénomène de "l'aube"). Outre l'insuffisance de la dose, son excès peut entraîner une hyperglycémie matinale - Phénomène Somoji(Somogyi), hyperglycémie posthypoglycémique. Ce phénomène s'explique par le fait que la sensibilité maximale des tissus à l'insuline se situe entre 2 et 4 heures du matin. C'est à ce moment que le taux des principales hormones contre-insulaires (cortisol, hormone de croissance, etc.) est normalement le plus bas. Si la dose du soir d'insuline à action prolongée est excessive, alors se développe à ce moment hypoglycémie. Cliniquement, cela peut se manifester par un mauvais sommeil avec des cauchemars, des activités de sommeil inconscientes, des maux de tête matinaux et de la fatigue. Le développement de l'hypoglycémie à ce moment provoque une importante libération compensatoire de glucagon et d'autres hormones contrasulaires, suivie d'une hyperglycémie le matin. Si dans cette situation la dose d'insuline à action prolongée administrée le soir n'est pas réduite, mais augmentée, l'hypoglycémie nocturne et l'hyperglycémie matinale vont s'aggraver, ce qui peut éventuellement conduire au syndrome de surdosage chronique à l'insuline (syndrome de Somogyi), qui est une combinaison d'obésité avec décompensation chronique du diabète, hypoglycémies fréquentes et complications tardives progressives. Pour diagnostiquer le phénomène de Somogyi, il est nécessaire d'étudier le niveau de glycémie vers 3 heures du matin, qui fait partie intégrante du choix de l'insulinothérapie. Si une diminution de la dose du soir de NPH vers une hypoglycémie nocturne sûre s'accompagne d'une hyperglycémie le matin (phénomène de l'aube), il faut conseiller au patient de se réveiller plus tôt (6-7 heures du matin), alors que l'insuline administrée la nuit continue à maintenir une glycémie normale.
Une deuxième injection d'insuline NPH est généralement administrée avant le petit-déjeuner, ainsi qu'une injection d'insuline à action courte (ultra-courte) le matin. Dans ce cas, la dose est choisie principalement en fonction des indicateurs du niveau de glycémie avant les principaux repas quotidiens (déjeuner, dîner) ; de plus, elle peut être limitée par le développement d'hypoglycémies entre les repas, par exemple à midi, entre le petit-déjeuner et le déjeuner.
dose entière d'insuline action prolongée(glargine) est administré une fois par jour, peu importe à quelle heure. Cinétique
les insulines glargine et détémir sont plus favorables sur le risque de développer des hypoglycémies, y compris nocturnes.
La dose d'insuline à action courte ou ultra-courte, même le premier jour d'administration d'insuline pour le patient, dépendra de la quantité de glucides (unités de pain) consommée et du niveau de glycémie avant l'injection. Classiquement, sur la base du rythme quotidien de sécrétion d'insuline dans la norme, environ 1/4 de dose d'insuline à action brève (6-8 UI) est prise pour le dîner, la dose restante est à peu près également répartie entre le petit-déjeuner et le déjeuner (10-12 UI). Plus le niveau initial de glycémie est élevé, moins il diminuera par unité d'insuline administrée. L'insuline à action courte est administrée 30 minutes avant les repas, l'insuline à action ultra-courte est administrée juste avant un repas, voire immédiatement après un repas. L'adéquation de la dose d'insuline à action brève est évaluée par des indicateurs de glycémie 2 heures après un repas et avant le repas suivant.
Pour calculer la dose d'insuline pendant une insulinothérapie intensive, il suffit de calculer le nombre de XE, basé uniquement sur le composant glucidique. Dans le même temps, tous les produits contenant des glucides ne sont pas pris en compte, mais uniquement ceux dits comptables. Ces derniers comprennent les pommes de terre, les produits céréaliers, les fruits, les produits laitiers liquides et les aliments sucrés. Les produits contenant des glucides non digestibles (la plupart des légumes) ne sont pas pris en compte. Des tables d'échange spéciales ont été développées, à l'aide desquelles, en exprimant la quantité de glucides en XE, il est possible de calculer la dose d'insuline requise. Un XE correspond à 10-12 g de glucides (tableau 10.7).
Après un repas contenant 1 XE, le niveau de glycémie augmente de 1,6-2,2 mmol/l, c'est-à-dire à peu près autant que le niveau de glucose diminue avec l'introduction d'une unité d'insuline. En d'autres termes, pour chaque UCE contenue dans l'aliment qu'il est prévu de consommer, il est nécessaire de pré-administrer (selon l'heure de la journée) environ 1 unité d'insuline. De plus, il faut tenir compte des résultats de l'autosurveillance du niveau de glycémie, qui est effectuée avant chaque injection, et de l'heure de la journée (environ 2 UI d'insuline pour 1 XE le matin et le midi, 1 UI pour 1 XE pour le dîner). Ainsi, si une hyperglycémie est détectée, la dose d'insuline, calculée en fonction du repas à venir (en fonction du nombre de XE), doit être augmentée, et inversement, si une hypoglycémie est détectée, moins d'insuline est administrée.
Languette. 7.7. Substitution équivalente des produits qui composent 1 XE
 Par exemple, si un patient a une glycémie de 7 mmol/l 30 minutes avant le dîner prévu contenant 5 XE, il doit s'injecter 1 unité d'insuline pour que la glycémie redescende à un niveau normal : de 7 mmol/l à environ 5 mmol/l. De plus, 5 unités d'insuline doivent être administrées pour couvrir 5 XE. Ainsi, le patient dans ce cas injectera 6 unités d'insuline à action courte ou ultra-rapide.
Par exemple, si un patient a une glycémie de 7 mmol/l 30 minutes avant le dîner prévu contenant 5 XE, il doit s'injecter 1 unité d'insuline pour que la glycémie redescende à un niveau normal : de 7 mmol/l à environ 5 mmol/l. De plus, 5 unités d'insuline doivent être administrées pour couvrir 5 XE. Ainsi, le patient dans ce cas injectera 6 unités d'insuline à action courte ou ultra-rapide.
Après la manifestation du CD-1 et le début de l'insulinothérapie pendant une durée suffisamment longue, le besoin en insuline peut être faible et être inférieur à 0,3-0,4 U / kg. Cette période est appelée phase de rémission, ou "Voyage de noces". Après une période d'hyperglycémie et d'acidocétose, qui suppriment la sécrétion d'insuline de 10 à 15 % des cellules β restantes, la compensation des troubles hormonaux et métaboliques par l'administration d'insuline restaure la fonction de ces cellules, qui prennent alors le relais en fournissant le corps avec de l'insuline à un niveau minimum. Cette période peut durer de plusieurs semaines à plusieurs années, mais finalement, en raison de la destruction auto-immune des cellules β restantes, la "lune de miel" se termine.
Diète avec DM-1 chez des patients formés qui ont les compétences de maîtrise de soi et de sélection de la dose d'insuline, il peut être libéralisé, c'est-à-dire approche libre. Si le patient n'est pas en surpoids ou en insuffisance pondérale, le régime doit être
isocalorique. Le principal composant de la nourriture dans DM-1 est les glucides, qui devraient représenter environ 65 % des calories quotidiennes. La préférence doit être donnée aux aliments contenant des glucides complexes à absorption lente, ainsi qu'aux aliments riches en fibres alimentaires. Les aliments contenant des glucides facilement digestibles (farine, sucré) sont à éviter. La proportion de protéines doit être réduite à 10-35%, ce qui contribue à réduire le risque de développer une microangiopathie, et la proportion de graisses à 25-35%, tandis que la limitation des graisses doit représenter jusqu'à 7% des calories, ce qui réduit le risque de développer une athérosclérose. De plus, vous devez éviter de prendre boissons alcoolisées surtout les plus forts.
Une partie intégrante du travail avec un patient atteint de DM-1 et la clé de sa compensation efficace est éducation du patient. Tout au long de la vie, le patient doit modifier indépendamment la dose d'insuline quotidienne, en fonction de nombreux facteurs. Évidemment, cela nécessite la possession de certaines compétences que le patient doit apprendre. L'"École du patient atteint de SD-1" est organisée dans les hôpitaux d'endocrinologie ou les consultations externes et consiste en 5 à 7 séances structurées, au cours desquelles un médecin ou une infirmière spécialement formée, en mode interactif, à l'aide de diverses aides visuelles, enseigne aux patients les des principes maîtrise de soi.
Prévoir
En l'absence d'insulinothérapie, un patient atteint de DM-1 meurt inévitablement d'un coma acidocétotique. Avec une insulinothérapie inadéquate, par rapport à laquelle les critères de compensation du diabète ne sont pas atteints et le patient est dans un état d'hyperglycémie chronique (tableau 7.3), des complications tardives commencent à se développer et à progresser (section 7.8). Dans la DM-1, les manifestations de la microangiopathie diabétique (néphropathie et rétinopathie) et de la neuropathie (syndrome du pied diabétique) ont la plus grande signification clinique à cet égard. La macroangiopathie dans la DM-1 apparaît relativement rarement.
7.6. DIABÈTE SUCRÉ DE TYPE 2
Diabète de type 2- une maladie chronique se manifestant par une violation du métabolisme des glucides avec le développement d'une hyperglycémie due à la résistance à l'insuline et au dysfonctionnement de la sécrétion des cellules β,
ainsi que le métabolisme des lipides avec le développement de l'athérosclérose. Étant donné que la principale cause de décès et d'invalidité des patients sont les complications de l'athérosclérose systémique, le CD-2 est parfois appelé maladie cardiovasculaire.
Languette. 7.8. Diabète de type 2
 Étiologie
Étiologie
Le CD-2 est une maladie multifactorielle à prédisposition héréditaire. La concordance pour le CD-2 chez les vrais jumeaux atteint 80 % ou plus. La plupart des patients atteints de CD-2 indiquent la présence de CD-2 chez le plus proche parent ; en présence de CD-2 chez l'un des parents, la probabilité de son développement chez la progéniture tout au long de la vie est de 40%. Aucun gène dont le polymorphisme détermine la prédisposition au CD-2 n'a été trouvé. Grande importance dans la mise en œuvre de la prédisposition héréditaire au CD-2, les facteurs environnementaux jouent, tout d'abord, les caractéristiques du mode de vie. Les facteurs de risque pour le développement de CD-2 sont :
Obésité, notamment viscérale (voir rubrique 11.2) ;
L'ethnicité (en particulier lors du changement du mode de vie traditionnel vers le mode de vie occidental);
Mode de vie sédentaire;
Caractéristiques du régime (consommation élevée de glucides raffinés et faible teneur en fibres);
Hypertension artérielle.
Pathogénèse
Sur le plan pathogénétique, le CD-2 est un groupe hétérogène de troubles métaboliques, et c'est précisément ce qui détermine son importante hétérogénéité clinique. Sa pathogénie est basée sur la résistance à l'insuline (une diminution de l'utilisation du glucose induite par l'insuline par les tissus), qui est réalisée dans le contexte d'un dysfonctionnement sécrétoire des cellules β. Ainsi, il existe un déséquilibre entre la sensibilité à l'insuline et la sécrétion d'insuline. Dysfonctionnement sécrétoireβ -cellules Elle consiste à ralentir la sécrétion "précoce" d'insuline en réponse à une augmentation de la glycémie. Dans le même temps, la 1ère phase (rapide) de sécrétion, qui consiste à vider les vésicules avec l'insuline accumulée, est quasiment absente ; La 2ème phase (lente) de sécrétion est réalisée en réponse à une hyperglycémie stabilisante constante, sur un mode tonique, et, malgré une sécrétion excessive d'insuline, le niveau de glycémie dans le contexte de la résistance à l'insuline ne se normalise pas (Fig. 7.8).
La conséquence de l'hyperinsulinémie est une diminution de la sensibilité et du nombre de récepteurs à l'insuline, ainsi qu'une suppression
mécanismes post-récepteurs médiant les effets de l'insuline (résistance à l'insuline). Le contenu du principal transporteur de glucose dans les cellules musculaires et adipeuses (GLUT-4) est réduit de 40 % chez les personnes atteintes d'obésité viscérale et de 80 % chez les personnes atteintes de DM-2. En raison de la résistance à l'insuline des hépatocytes et de l'hyperinsulinémie portale, hyperproduction de glucose par le foie, et une hyperglycémie à jeun se développe, qui est détectée chez la plupart des patients atteints de DM-2, y compris dans les premiers stades de la maladie.
En soi, l'hyperglycémie affecte négativement la nature et le niveau d'activité sécrétoire des cellules β (toxicité du glucose). À long terme, sur de nombreuses années et décennies, l'hyperglycémie existante conduit finalement à l'épuisement de la production d'insuline par les cellules β et le patient peut développer certains symptômes. carence en insuline- perte de poids, cétose avec maladies infectieuses concomitantes. Cependant, la production résiduelle d'insuline, suffisante pour prévenir l'acidocétose, est presque toujours préservée dans le DM-2.
Épidémiologie
Le CD-2 détermine l'épidémiologie du diabète en général, puisqu'il représente environ 98 % des cas de cette maladie. La prévalence de CD-2 varie selon les pays et les groupes ethniques. En Europe
 Riz. 7.8. Dysfonctionnement sécrétoire des cellules β dans le diabète sucré de type 2 (perte de la 1ère phase rapide de sécrétion d'insuline)
Riz. 7.8. Dysfonctionnement sécrétoire des cellules β dans le diabète sucré de type 2 (perte de la 1ère phase rapide de sécrétion d'insuline)
pays, les États-Unis et la Fédération de Russie, il représente environ 5 à 6% de la population. Avec l'âge, l'incidence du DM-2 augmente : chez l'adulte, la prévalence du DM-2 est de 10 %, chez les personnes de plus de 65 ans elle atteint 20 %. L'incidence du CD-2 est 2,5 fois plus élevée chez les habitants natifs d'Amérique et des îles hawaïennes ; chez les Indiens de la tribu Pima (Arizona), il atteint 50 %. Parmi la population rurale de l'Inde, de la Chine, du Chili et des pays africains qui mènent un mode de vie traditionnel, la prévalence de CD-2 est très faible (moins de 1%). En revanche, parmi les migrants vers les pays industriels occidentaux, il atteint un niveau significatif. Ainsi, parmi les immigrants d'Inde et de Chine, vivant aux États-Unis et en Grande-Bretagne, la prévalence du CD-2 atteint 12 à 15 %.
L'OMS prévoit une augmentation du nombre de personnes atteintes de diabète dans le monde de 122 % au cours des 20 prochaines années (de 135 à 300 millions). Cela est dû à la fois au vieillissement progressif de la population et à la propagation et à l'aggravation du mode de vie urbanisé. À dernières années il y a un « rajeunissement » significatif du CD-2 et une augmentation de son incidence chez les enfants.
Manifestations cliniques
Dans la plupart des cas, il n'y a pas de manifestations cliniques prononcées, et le diagnostic est établi par des tests glycémiques de routine. La maladie se manifeste généralement après l'âge de 40 ans, alors que la grande majorité des patients présentent une obésité et d'autres composantes du syndrome métabolique (voir rubrique 11.2). Les patients ne se plaignent pas d'une diminution des performances, s'il n'y a pas d'autres raisons à cela. Les plaintes de soif et de polyurie atteignent rarement une gravité significative. Très souvent, les patientes s'inquiètent des démangeaisons cutanées et vaginales et se tournent donc vers les dermatologues et les gynécologues. Étant donné que de nombreuses années s'écoulent souvent de la manifestation réelle de CD-2 au diagnostic (en moyenne, environ 7 ans), chez de nombreux patients au moment de la détection de la maladie, le tableau clinique est dominé par symptômes et manifestations des complications tardives du diabète. De plus, la première visite d'un patient avec CD-2 pour des soins médicaux se produit très souvent en raison de complications tardives. Ainsi, les patients peuvent être hospitalisés dans des hôpitaux chirurgicaux avec des ulcères de jambe. (syndrome du pied diabétique) contacter un ophtalmologiste dans le cadre d'une baisse progressive de la vision (la rétinopathie diabétique),être hospitalisé pour des crises cardiaques, des accidents vasculaires cérébraux
avec lésion oblitérante des vaisseaux des jambes dans les établissements où l'hyperglycémie y est détectée pour la première fois.
Diagnostique
Les critères diagnostiques, communs à tous les types de diabète, sont présentés au paragraphe 7.3. Le diagnostic de DM-2 repose dans la grande majorité des cas sur la détection d'une hyperglycémie chez des individus présentant des signes cliniques typiques de DM-2 (obésité, âge supérieur à 40-45 ans, antécédents familiaux positifs de DM-2, autres composants du syndrome métabolique), en l'absence de signes cliniques et biologiques carence absolue en insuline (perte de poids prononcée, cétose). La combinaison de la prévalence élevée de DM-2, de sa longue évolution asymptomatique inhérente et de la possibilité de prévenir ses complications graves, à condition qu'un diagnostic précoce prédétermine la nécessité dépistage, ceux. mener une enquête pour exclure le CD-2 chez les personnes ne présentant aucun symptôme de la maladie. Le test principal, comme mentionné, est la détermination taux de glycémie à jeun. Il se manifeste dans les situations suivantes :
1. Chez toutes les personnes de plus de 45 ans, en particulier en surpoids (IMC supérieur à 25 kg/m2) avec un intervalle d'une fois tous les 3 ans.
2. À un âge plus jeune, en présence d'un excès de poids (IMC supérieur à 25 kg / m 2) et de facteurs de risque supplémentaires, notamment:
Mode de vie sédentaire;
CD-2 chez le plus proche parent ;
Appartenir à des nationalités à haut risque de développer des CD-2 (Afro-américains, Hispaniques, Amérindiens, etc.) ;
Femmes ayant donné naissance à un enfant pesant plus de 4 kg et/ou ayant des antécédents de diabète gestationnel ;
Hypertension artérielle (≥ 140/90 mm Hg);
HDL > 0,9 mmol/l et/ou triglycérides > 2,8 mmol/l ;
syndrome des ovaires polykystiques;
NTG et NGNT ;
Maladies cardiovasculaires.
Une augmentation significative de l'incidence de DM-2 chez les enfants dicte la nécessité d'une détermination de dépistage du niveau de glycémie chez les enfants et les adolescents(à partir de 10 ans avec un intervalle de 2 ans ou avec le début
puberté, si elle est survenue à un âge plus précoce), appartenant à des groupes à haut risque, dont les enfants en surpoids(IMC et/ou poids > 85 percentile pour l'âge, ou poids supérieur à 120 % du poids idéal) et deux des facteurs de risque supplémentaires suivants :
CD-2 parmi les parents de la première ou de la deuxième ligne de parenté ;
Appartenir à des nationalités à haut risque ;
Manifestations cliniques associées à la résistance à l'insuline (acanthosis nigricans, hypertension artérielle, dyslipidémie);
Diabète, y compris gestationnel, chez la mère.
Diagnostic différentiel
La plus grande signification clinique est le diagnostic différentiel de CD-2 et CD-1, dont les principes sont décrits au paragraphe 7.5 (tableau 7.6). Comme mentionné, dans la plupart des cas, il est basé sur les données du tableau clinique. Dans les cas où le type de diabète est difficile à établir, ou si une variante rare du diabète est suspectée, y compris dans les syndromes héréditaires, la question pratique la plus importante à laquelle il faut répondre est de savoir si le patient a besoin d'une insulinothérapie.
Traitement
Les principales composantes du traitement du DM-2 sont les suivantes : la thérapie diététique, l'augmentation de l'activité physique, la thérapie hypoglycémique, la prévention et le traitement des complications tardives du DM. Comme la plupart des patients atteints de DM-2 sont obèses, le régime doit viser la perte de poids (hypocalorique) et la prévention des complications tardives, principalement la macroangiopathie (athérosclérose). régime hypocalorique nécessaire pour tous les patients présentant un excès de poids (IMC 25-29 kg / m 2) ou une obésité (IMC> 30 kg / m 2). Dans la plupart des cas, il convient de recommander de réduire l'apport calorique quotidien des aliments à 1000-1200 kcal pour les femmes et à 1200-1600 kcal pour les hommes. Le rapport recommandé des principaux composants alimentaires dans le DM-2 est similaire à celui du DM-1 (glucides - 65 %, protéines 10-35 %, graisses jusqu'à 25-35 %). Utilisation de l'alcool devrait être limité en raison du fait qu'il s'agit d'une source importante de calories supplémentaires, en plus de la consommation d'alcool dans le contexte de la thérapie
Les IIP associées aux sulfonylurées et à l'insuline peuvent provoquer le développement d'une hypoglycémie (voir rubrique 7.7.3).
Recommandations pour augmentation de l'activité physique doit être individualisé. Au début, un exercice aérobie (marche, natation) d'intensité modérée est recommandé pendant 30 à 45 minutes 3 à 5 fois par jour (environ 150 minutes par semaine). À l'avenir, une augmentation progressive de l'activité physique est nécessaire, ce qui contribue de manière significative à la réduction et à la normalisation du poids corporel. De plus, l'activité physique aide à réduire la résistance à l'insuline et a un effet hypoglycémiant. La combinaison d'une thérapie diététique et d'une activité physique accrue sans prescription d'hypoglycémiants permet de maintenir la compensation du DM conformément aux objectifs établis (tableau 7.3) chez environ 5 % des patients atteints de DM-2.
Préparatifs pour thérapie hypoglycémiante avec CD-2 peuvent être divisés en quatre groupes principaux.
I. Médicaments qui aident à réduire la résistance à l'insuline (sensibilisateurs). Ce groupe comprend la metformine et les thiazolidinediones. Metformine est le seul médicament actuellement utilisé du groupe biguanides. Les principaux composants de son mécanisme d'action sont:
1. Suppression de la gluconéogenèse hépatique (diminution de la production de glucose hépatique), ce qui entraîne une diminution de la glycémie à jeun.
2. Diminution de la résistance à l'insuline (utilisation accrue du glucose par les tissus périphériques, principalement les muscles).
3. Activation de la glycolyse anaérobie et réduction de l'absorption du glucose dans l'intestin grêle.
Metformine est le médicament de premier choix pour le traitement hypoglycémiant chez les patients atteints de diabète de type 2, d'obésité et d'hyperglycémie à jeun. La dose initiale est de 500 mg le soir ou pendant le dîner. À l'avenir, la dose augmente progressivement jusqu'à 2-3 grammes pour 2-3 doses. Parmi les effets secondaires, les symptômes dyspeptiques (diarrhée) sont relativement fréquents, généralement transitoires et disparaissent d'eux-mêmes après 1 à 2 semaines de prise du médicament. La metformine n'ayant pas d'effet stimulant sur la production d'insuline, aucune hypoglycémie ne survient pendant la monothérapie avec ce médicament.
développer (son action sera qualifiée d'antihyperglycémiante, et non d'hypoglycémiante). Les contre-indications à la nomination de la metformine sont la grossesse, l'insuffisance cardiaque, hépatique, rénale et d'autres organes graves, ainsi que les conditions hypoxiques d'une autre origine. Une complication extrêmement rare qui survient lors de la prescription de metformine sans tenir compte des contre-indications ci-dessus est l'acidose lactique, qui est une conséquence de l'hyperactivation de la glycolyse anaérobie.
Thiazolidinediones(pioglitazone, rosiglitazone) sont des agonistes des récepteurs activés par les proliférateurs de peroxysomes (PPAR-γ). Les thiazolidinediones activent le métabolisme du glucose et des lipides dans les tissus musculaires et adipeux, ce qui entraîne une augmentation de l'activité de l'insuline endogène, c'est-à-dire Pour éliminer la résistance à l'insuline (sensibilisants à l'insuline). La dose quotidienne de pioglitazone est de 15 à 30 mg / jour, de rosiglitazone à 4 à 8 mg (pour 1 à 2 doses). L'association des thiazolidinediones avec la metformine est très efficace. Une contre-indication à la nomination de thiazolidinediones est une augmentation (de 2,5 fois ou plus) du niveau des transaminases hépatiques. En plus de l'hépatotoxicité, les effets secondaires des thiazolidinediones comprennent la rétention d'eau et l'œdème, qui sont plus fréquents lorsqu'ils sont associés à l'insuline.
II. Les médicaments qui agissent surβ cellule et augmenter la sécrétion d'insuline. Ce groupe comprend les sulfonylurées et les glinides (régulateurs glycémiques prandiaux), qui sont principalement utilisés pour normaliser la glycémie après les repas. cible principale médicaments sulfonylurées(PSM) sont les cellules β des îlots pancréatiques. Les PSM se lient à des récepteurs spécifiques sur la membrane des cellules β. Cela conduit à la fermeture des canaux potassiques dépendants de l'ATP et à la dépolarisation membrane cellulaire qui à son tour favorise l'ouverture des canaux calciques. L'entrée de calcium dans les cellules β entraîne leur dégranulation et la libération d'insuline dans le sang. En pratique clinique, de nombreux PSM sont utilisés, qui diffèrent par la durée et la gravité de l'effet hypoglycémique (tableau 7.9).
Languette. 7.9. Sulfonylurées
 Le principal et assez commun effet secondaire La PSM est une hypoglycémie (voir rubrique 7.7.3). Elle peut survenir avec un surdosage du médicament, son cumul (insuffisance rénale),
Le principal et assez commun effet secondaire La PSM est une hypoglycémie (voir rubrique 7.7.3). Elle peut survenir avec un surdosage du médicament, son cumul (insuffisance rénale),
non-respect du régime (sauter des repas, boire de l'alcool) ou du régime (activité physique importante, avant laquelle la dose de PSM n'est pas réduite ou les glucides ne sont pas pris).
Au groupe glinides(régulateurs glycémiques prandiaux) sont répaglinide(dérivé de l'acide benzoïque; dose quotidienne 0,5-16 mg/jour) et natéglinide(Dérivé de la D-phénylalanine ; dose quotidienne 180-540 mg/jour). Après administration, les médicaments interagissent rapidement et de manière réversible avec le récepteur de la sulfonylurée sur la cellule β, entraînant une courte augmentation des taux d'insuline qui imite normalement la première phase de sa sécrétion. Les médicaments sont pris 10 à 20 minutes avant les repas principaux, généralement 3 fois par jour.
III. Médicaments qui réduisent l'absorption du glucose dans l'intestin.
Ce groupe comprend l'acarbose et la gomme de guar. Le mécanisme d'action de l'acarbose est un blocage réversible des α-glycosidases de l'intestin grêle, qui ralentit les processus de fermentation séquentielle et d'absorption des glucides, réduit le taux de résorption et d'entrée du glucose dans le foie et réduit le niveau de glycémie postprandiale. La dose initiale d'acarbose est de 50 mg 3 fois par jour, à l'avenir la dose peut être augmentée à 100 mg 3 fois par jour; le médicament est pris immédiatement avant les repas ou pendant les repas. Le principal effet secondaire de l'acarbose est la dyspepsie intestinale (diarrhée, flatulence), qui est associée à l'entrée de glucides non absorbés dans le côlon. L'effet hypoglycémiant de l'acarbose est très modéré (tableau 7.10).
Dans la pratique clinique, les comprimés hypoglycémiants sont efficacement combinés entre eux et avec des préparations d'insuline, car la plupart des patients souffrent à la fois d'hyperglycémie à jeun et postprandiale. Il existe de nombreux combinaisons fixes médicaments dans un seul comprimé. Le plus souvent, la metformine est associée à divers PSM dans un seul comprimé, ainsi qu'à la metformine et aux thiazolidinediones.
Languette. 7.10. Mécanisme d'action et efficacité potentielle des antidiabétiques sous forme de comprimés
 IV. Insulines et analogues de l'insuline
IV. Insulines et analogues de l'insuline
À un certain stade, jusqu'à 30 à 40 % des patients atteints de diabète de type 2 commencent à recevoir des préparations d'insuline. Les indications de l'insulinothérapie dans le DM-2 sont données au début du paragraphe 7.4. L'option la plus courante pour faire passer les patients atteints de diabète de type 2 à l'insulinothérapie consiste à prescrire une insuline à action prolongée (insuline NPH, glargine ou détémir) en association avec les comprimés hypoglycémiants pris. Dans une situation où le niveau de glycémie à jeun ne peut pas être contrôlé par la prise de metformine ou si cette dernière est contre-indiquée, le patient se voit prescrire une injection d'insuline le soir (la nuit). S'il est impossible de contrôler à la fois la glycémie à jeun et la glycémie postprandiale à l'aide de préparations de comprimés, le patient est transféré vers un traitement par monoinsuline. Habituellement, avec DM-2, l'insulinothérapie est effectuée selon le soi-disant régime "traditionnel" qui implique la nomination de doses fixes d'insuline à action prolongée et à action brève. Dans ce régime
mélanges d'insuline standard pratiques contenant de l'insuline à action courte (ultra-courte) et à action prolongée dans un flacon. Le choix de l'insulinothérapie traditionnelle est déterminé par le fait qu'avec le DM-2, il est souvent prescrit aux patients âgés, dont la formation pour modifier indépendamment la dose d'insuline est difficile. De plus, l'insulinothérapie intensive, dont le but est de maintenir la compensation du métabolisme glucidique à un niveau proche de la normoglycémie, comporte un risque accru d'hypoglycémie. Alors que l'hypoglycémie légère ne pose pas de risque sérieux chez les jeunes patients, chez les patients plus âgés avec un seuil d'hypoglycémie réduit, elle peut avoir des effets très néfastes sur le système cardiovasculaire. Les jeunes patients atteints de diabète de type 2, ainsi que les patients prometteurs en termes de possibilité d'apprentissage efficace, peuvent se voir prescrire une version intensive de l'insulinothérapie.
Prévoir
La principale cause d'invalidité et de décès chez les patients atteints de DM-2 sont les complications tardives (voir rubrique 7.8), le plus souvent la macroangiopathie diabétique. Le risque de développer des complications tardives individuelles est déterminé par un ensemble de facteurs qui sont discutés dans les chapitres pertinents. Un facteur de risque universel pour leur développement est l'hyperglycémie chronique. Ainsi, une diminution de 1% du taux d'HbA1c chez les patients atteints de diabète de type 2 entraîne une diminution de la mortalité globale d'environ 20%, de 2% et de 3% - d'environ 40%, respectivement.
7.7. COMPLICATIONS AIGUËS DU DIABÈTE SUCRÉ
7.7.1. acidocétose diabétique
Acidocétose diabétique (ACD)- décompensation du DM-1, causée par une carence absolue en insuline, en l'absence de traitement opportun, se terminant par un coma céto-acidotique (CK) et la mort.
Étiologie
La cause de l'ACD est une carence absolue en insuline. Telle ou cette gravité de l'ACD est déterminée chez la plupart des patients au moment de la manifestation du DM-1 (10 à 20 % de tous les cas d'ACD).
Chez un patient ayant un diagnostic établi de diabète de type 1, l'ACD peut se développer à l'arrêt de l'administration d'insuline, souvent par le patient lui-même (13 % des cas d'ACD), dans un contexte de pathologies concomitantes, principalement infectieuses, en l'absence d'une augmentation de la dose d'insuline
Languette. 7.11. acidocétose diabétique
 Jusqu'à 20% des cas d'ACD chez les jeunes patients atteints de diabète de type 1 sont associés à des problèmes psychologiques et/ou des troubles alimentaires (peur de prendre du poids, peur de l'hypoglycémie, problèmes d'adolescence). Une cause assez fréquente d'ACD dans un certain nombre de pays est
Jusqu'à 20% des cas d'ACD chez les jeunes patients atteints de diabète de type 1 sont associés à des problèmes psychologiques et/ou des troubles alimentaires (peur de prendre du poids, peur de l'hypoglycémie, problèmes d'adolescence). Une cause assez fréquente d'ACD dans un certain nombre de pays est
annulation de l'insuline par le patient lui-même en raison du coût élevé des médicaments pour certains segments de la population (tableau 7.11).
Pathogénèse
La pathogenèse de l'ACD est basée sur une carence absolue en insuline associée à une augmentation de la production d'hormones contrasulaires, telles que le glucagon, les catécholamines et le cortisol. En conséquence, il y a une augmentation significative de la production de glucose par le foie et une violation de son utilisation par les tissus périphériques, une augmentation de l'hyperglycémie et une violation de l'osmolarité de l'espace extracellulaire. La carence en insuline associée à un excès relatif d'hormones contrasulaires dans l'ACD entraîne la libération d'acides gras libres dans la circulation (lipolyse) et leur oxydation incontrôlée dans le foie en corps cétoniques (β-hydroxybutyrate, acétoacétate, acétone), entraînant une hypercétonémie , et une acidose métabolique supplémentaire. À la suite d'une glucosurie sévère, une diurèse osmotique, une déshydratation, une perte de sodium, de potassium et d'autres électrolytes se développent (Fig. 7.9).
Épidémiologie
La fréquence des nouveaux cas d'ACD est de 5 à 8 pour 1000 patients atteints de DM-1 par an et dépend directement du niveau d'organisation des soins médicaux pour les patients atteints de DM. Environ 100 000 hospitalisations pour ACD surviennent aux États-Unis chaque année, et avec un coût de 13 000 $ par patient et par hospitalisation, plus d'un milliard de dollars par an sont dépensés chaque année pour le traitement de l'ACD en milieu hospitalier. En Fédération de Russie en 2005, l'ACD a été enregistrée chez 4,31 % des enfants, 4,75 % des adolescents et 0,33 % des patients adultes atteints de DM-1.
Manifestations cliniques
Le développement de l'ACD, selon la cause qui l'a provoqué, peut prendre de plusieurs semaines à quelques jours. Dans la plupart des cas, l'ACD est précédée de symptômes de diabète décompensé, mais parfois ils n'ont pas le temps de se développer. Les symptômes cliniques de l'ACD comprennent la polyurie, la polydipsie, la perte de poids, des douleurs abdominales généralisées ("pseudopéritonite diabétique"), la déshydratation, une faiblesse sévère, une haleine d'acétone (ou une odeur fruitée) et une opacification progressive de la conscience. Le véritable coma dans l'ACD s'est récemment développé relativement rarement en raison d'un diagnostic précoce. L'examen physique révèle des signes de déshydratation : diminution
 Riz. 7.9. La pathogenèse du coma acidocétotique
Riz. 7.9. La pathogenèse du coma acidocétotique
turgescence et densité de la peau globes oculaires, tachycardie, hypotension. Dans les cas avancés, la respiration de Kussmaul se développe. Plus de 25% des patients atteints d'ACD développent des vomissements, qui peuvent ressembler à du marc de café en couleur.
Diagnostique
Il est basé sur les données du tableau clinique, les indications de la présence de CD-1 chez le patient, ainsi que les données de laboratoire. L'ACD est caractérisée par une hyperglycémie (dans certains cas insignifiante), une cétonurie, une acidose métabolique, une hyperosmolarité (tableau 7.12).
Languette. 7.12. Diagnostic en laboratoire des complications aiguës du diabète sucré
 Lors de l'examen de patients atteints de décompensation aiguë du diabète, il est nécessaire de déterminer le niveau de glycémie, de créatinine et d'urée, les électrolytes, sur la base desquels l'osmolarité effective est calculée. De plus, une évaluation de l'état acido-basique est nécessaire. Osmolarité efficace(EO) est calculé selon la formule suivante : 2 *. L'OE normale est de 285 à 295 mOsm / l.
Lors de l'examen de patients atteints de décompensation aiguë du diabète, il est nécessaire de déterminer le niveau de glycémie, de créatinine et d'urée, les électrolytes, sur la base desquels l'osmolarité effective est calculée. De plus, une évaluation de l'état acido-basique est nécessaire. Osmolarité efficace(EO) est calculé selon la formule suivante : 2 *. L'OE normale est de 285 à 295 mOsm / l.
La plupart des patients atteints d'ACD ont leucocytose, dont la sévérité est proportionnelle au taux de corps cétoniques dans le sang. Niveau sodium, en règle générale, il est réduit en raison de l'écoulement osmotique de liquide des espaces intracellulaires vers les espaces extracellulaires en réponse à l'hyperglycémie. Rarement, les niveaux de sodium peuvent être faussement positifs à la suite d'une hyperthyroïdie sévère.
triglycéridémie. Niveau potassium Le sérum peut initialement être élevé en raison de son mouvement depuis les espaces extracellulaires.
Diagnostic différentiel
Autres causes de perte de conscience chez les patients diabétiques. Le diagnostic différentiel avec le coma hyperosmolaire, en règle générale, ne pose pas de difficultés (il se développe chez les patients âgés atteints de diabète de type 2) et n'a pas une grande importance clinique, car Les principes de traitement pour les deux conditions sont similaires. S'il est impossible de déterminer rapidement la cause de la perte de conscience chez un patient diabétique, on lui montre l'introduction de glucose, car. les états hypoglycémiques sont beaucoup plus fréquents et la dynamique positive rapide dans le contexte de l'administration de glucose permet en elle-même de découvrir la cause de la perte de conscience.
Traitement
Le traitement de l'ACD comprend la réhydratation, la correction de l'hyperglycémie, les troubles électrolytiques et le traitement des maladies qui ont causé la décompensation du diabète. Le traitement est effectué de manière optimale dans l'unité de soins intensifs d'un établissement médical spécialisé. Chez les patients adultes sans pathologie cardiaque concomitante grave, déjà au stade préhospitalier, comme mesure primaire pour réhydratation il est recommandé d'administrer une solution isotonique (0,9% NaCl) à environ un litre par heure (environ 15-20 ml par kilogramme de poids corporel par heure). Le remplacement complet de la carence hydrique, qui dans l'ACD est de 100 à 200 ml par kg de poids corporel, doit être réalisé au cours du premier jour de traitement. En cas d'insuffisance cardiaque ou rénale concomitante, cette période de temps doit être augmentée. Pour les enfants, le volume recommandé de solution isotonique pour la thérapie de réhydratation est de 10 à 20 ml par kg de poids corporel par heure, tandis qu'au cours des 4 premières heures, il ne doit pas dépasser 50 ml par kg de poids corporel. Il est recommandé de réaliser une réhydratation complète en 48 heures environ. Après que le niveau de glycémie ait diminué à environ 14 mmol / l dans le contexte d'une insulinothérapie parallèle, ils passent à la transfusion d'une solution de glucose à 10%, qui poursuit la réhydratation.
Le concept de "petites doses" a maintenant été adopté insuline dans le traitement de l'ACD. Seule l'insuline à action brève est utilisée. L'utilisation la plus optimale de l'insuline intraveineuse
ligne. L'administration intramusculaire d'insuline, qui est moins efficace, n'est possible qu'en cas d'ACD de sévérité modérée, avec une hémodynamique stable et lorsque la thérapie intraveineuse n'est pas possible. Dans ce dernier cas, les injections sont faites dans le muscle droit de l'abdomen, tandis qu'une aiguille d'injection intramusculaire est placée sur la seringue à insuline (pour une injection intramusculaire fiable), et l'insuline est aspirée du flacon dans la seringue à travers cette aiguille.
Plusieurs options d'administration intraveineuse d'insuline sont possibles. Premièrement, l'insuline peut être injectée "dans la gencive" du système de perfusion, tandis que la quantité d'insuline requise est aspirée dans la seringue à insuline, après quoi 1 ml de solution isotonique y est aspiré. Jusqu'à ce que le niveau de glycémie atteigne 14 mmol / l, le patient reçoit une injection horaire de 6 à 10 unités d'insuline à action brève; plus loin (en parallèle du passage de la solution de réhydratation isotonique à 10% glucose) en fonction des indicateurs horaires de glycémie, la dose d'insuline est réduite à 4-8 unités par heure. Le taux de déclin glycémique recommandé ne doit pas dépasser 5 mmol/l par heure. Une autre option pour l'insulinothérapie intraveineuse implique l'utilisation d'un perfuseur. Pour préparer une solution pour un perfuseur, le rapport suivant est pris: 2 ml d'une solution d'albumine humaine à 20% sont ajoutés à 50 unités d'insuline à action brève, après quoi 50 mg d'une solution isotonique à 0,9% sont ajoutés. Si la voie intramusculaire d'administration d'insuline est choisie, on administre initialement 20 unités d'insuline à action brève, puis 6 unités toutes les heures, et après avoir atteint un niveau de glycémie de 14 mmol/l, la dose est réduite à 4 unités par heure. Après stabilisation complète de l'hémodynamique et compensation des troubles acido-basiques, le patient est transféré vers des injections sous-cutanées d'insuline.
Comme indiqué, malgré d'importantes carence en potassium dans le corps (perte totale de 3 à 6 mmol / kg), avec l'ACD, son niveau avant le début de l'insulinothérapie peut être légèrement augmenté. Cependant, l'initiation d'une transfusion de solution de chlorure de potassium est recommandée en même temps que l'initiation de l'insulinothérapie si la kaliémie est inférieure à 5,5 mmol/L. Une correction réussie de la carence en potassium ne se produit que dans le contexte de la normalisation du pH. À faible pH, l'apport de potassium dans la cellule est considérablement réduit. Dans ce contexte, il est souhaitable, si possible, d'adapter la dose de chlorure de potassium transfusé à un indicateur de pH spécifique (tableau 7.13).
Languette. 7.13. Régime de correction des carences en potassium
 * Les données suivantes sont utilisées pour le calcul :
* Les données suivantes sont utilisées pour le calcul :
1 g de KCl = 13,4 mmoles ; 1 mmol KCl \u003d 0,075 g Dans une solution à 4% de KC1: dans 100 ml - 4 g de KC1, dans 25 ml - 1 g de KC1, dans 10 ml 0,4 g de KC1.
La cause de la décompensation du diabète est souvent maladies infectieuses(pyélonéphrite, ulcère infecté dans le syndrome du pied diabétique, pneumonie, sinusite, etc.). Il existe une règle selon laquelle, dans l'ACD, une antibiothérapie est prescrite à presque tous les patients présentant une fièvre légère ou de la fièvre, même en l'absence de foyer d'infection visible, car une augmentation de la température corporelle n'est pas typique de l'ACD elle-même .
Prévoir
La mortalité dans l'ACD est de 0,5 à 5 %, la plupart des cas étant dus à des soins médicaux tardifs et non qualifiés. La mortalité est la plus élevée (jusqu'à 50 %) chez les patients âgés.
7.7.2. Coma hyperosmolaire
Coma hyperosmolaire(GOK) est une complication aiguë rare du DM-2, qui se développe à la suite d'une déshydratation sévère et d'une hyperglycémie en l'absence de carence absolue en insuline, accompagnée d'une mortalité élevée (tableau 7.14).
Étiologie
GOK, en règle générale, se développe chez les patients âgés atteints de diabète de type 2. Ces patients sont le plus souvent seuls, vivent sans soins, négligent leur état et leur maîtrise de soi et ne prennent pas assez de liquides. Les infections entraînent souvent une décompensation (syndrome du pied diabétique, pneumonie, pyélonéphrite aiguë), des troubles cérébraux
les conditions circulatoires et autres, à la suite desquelles les patients bougent mal, ne prennent pas de médicaments et de liquides hypoglycémiants.
Languette. 7.14. Coma hyperosmolaire (GOC)
 Pathogénèse
Pathogénèse
L'hyperglycémie croissante et la diurèse osmotique provoquent une déshydratation sévère qui, pour les raisons ci-dessus, n'est pas reconstituée de l'extérieur. Le résultat de l'hyperglycémie et de la déshydratation est l'hyperosmolarité plasmatique. Une partie intégrante de la pathogenèse du GOC est une carence relative en insuline et un excès d'hormones contre-insulaires, cependant, la sécrétion résiduelle d'insuline restant dans le DM-2 est suffisante pour supprimer la lipolyse et la cétogenèse, à la suite de quoi le développement d'acidocétose ne se produit pas.
Dans certains cas, une acidose modérée peut être déterminée à la suite d'une hyperlactatémie dans le contexte d'une hypoperfusion tissulaire. Dans l'hyperglycémie sévère, pour maintenir l'équilibre osmotique dans le liquide céphalo-rachidien, la teneur en sodium provenant des cellules augmente. cerveau où le potassium est échangé. Le potentiel transmembranaire des cellules nerveuses est perturbé. Un trouble progressif de la conscience se développe en association avec un syndrome convulsif (Fig. 7.10).
Épidémiologie
Les GOC représentent 10 à 30 % des états hyperglycémiques aigus chez les patients adultes et âgés atteints de diabète de type 2. Environ 2/3 des cas de GOK se développent chez des personnes atteintes de diabète non diagnostiqué auparavant.
Manifestations cliniques
Les caractéristiques du tableau clinique du coma hyperosmolaire sont les suivantes :
Un ensemble de signes et de complications de déshydratation et d'hypoperfusion : soif, sécheresse des muqueuses, tachycardie, hypotension artérielle, nausées, faiblesse, état de choc ;
Crises focales et généralisées ;
Fièvre, nausées et vomissements (40 à 65 % des cas) ;
Parmi les maladies et complications concomitantes, la thrombose veineuse profonde, la pneumonie, les accidents vasculaires cérébraux et la gastroparésie sont courants.
Diagnostique
Il est basé sur les données du tableau clinique, l'âge du patient et l'anamnèse du CD-2, une hyperglycémie sévère en l'absence de cétonurie et d'acidocétose. Les signes de laboratoire typiques de GOK sont présentés dans le tableau. 7.12.
 Riz. sept .10.
La pathogenèse du coma hyperosmolaire
Riz. sept .10.
La pathogenèse du coma hyperosmolaire
Diagnostic différentiel
D'autres affections aiguës qui se développent chez les patients atteints de DM, le plus souvent avec une pathologie concomitante, qui ont conduit à une décompensation sévère du DM.
Traitement
Le traitement et la surveillance du GOC, à l'exception de certaines caractéristiques, ne diffèrent pas de ceux décrits pour le coma diabétique acidocétotique (section 7.7.1) :
Plus grand volume de réhydratation initiale 1,5-2 litres par 1 heure ; 1 l - pour la 2e et la 3e heure, puis 500 ml/h de solution isotonique de chlorure de sodium ;
En règle générale, la nécessité d'introduire des solutions contenant du potassium est plus importante qu'avec le coma acidocétose;
L'insulinothérapie est similaire à celle du QC, mais le besoin en insuline est moindre et le niveau de glycémie ne doit pas être réduit plus rapidement que 5 mmol / l par heure pour éviter le développement d'un œdème cérébral;
L'introduction d'une solution hypotonique (NaCl 0,45 %) est à éviter (uniquement en cas d'hypernatrémie sévère : > 155 mmol/l et/ou d'osmolarité effective > 320 mOsm/l) ;
Il n'est pas nécessaire d'administrer du bicarbonate (uniquement dans les unités de soins intensifs spécialisées pour acidose avec pH< 7,1).
Prévoir
La mortalité en GOK est élevée et s'élève à 15-60%. Le pire pronostic concerne les patients âgés présentant une comorbidité sévère, souvent à l'origine d'une décompensation du DM et du développement d'un GOC.
7.7.3. hypoglycémie
hypoglycémie- Diminution de la glycémie<2,2- 2,8 ммоль/л), сопровождающее клинический синдром, характеризующийся признаками активации симпатической нервной системы и/или дисфункцией центральной нервной системы. Гипогликемия как лабораторный феномен не тождественен понятию «гипогликемическая симптоматика», поскольку лабораторные данные и клиническая картина не всегда совпадают.
Étiologie
Surdosage de préparations d'insuline et de ses analogues, ainsi que de préparations de sulfonylurées ;
Apport alimentaire insuffisant dans le contexte d'un traitement hypoglycémique inchangé ;
Réception de boissons alcoolisées ;
Activité physique dans le contexte d'un traitement hypoglycémiant inchangé et / ou sans apport supplémentaire de glucides;
Le développement de complications tardives du diabète (neuropathie autonome avec gastroparésie, insuffisance rénale) et d'un certain nombre d'autres maladies (insuffisance surrénalienne, hypothyroïdie, insuffisance hépatique, tumeurs malignes) avec un traitement hypoglycémique inchangé (poursuite et accumulation de TSP dans le contexte d'une insuffisance rénale , en maintenant la même dose d'insuline);
Violation de la technique d'administration de l'insuline (injection intramusculaire au lieu de sous-cutanée);
Hypoglycémie artificielle (surdosage conscient de médicaments hypoglycémiants par le patient);
Hyperinsulinisme organique - insulinome (voir rubrique 10.3).
Pathogénèse
La pathogenèse de l'hypoglycémie consiste en un déséquilibre entre l'entrée du glucose dans le sang, son utilisation, le taux d'insuline et d'hormones contrasulaires. Normalement, à un niveau de glycémie compris entre 4,2 et 4,7 mmol/l, la production et la libération d'insuline par les cellules β sont supprimées. Une diminution du taux de glycémie inférieur à 3,9 mmol/l s'accompagne d'une stimulation de la production d'hormones contrasulaires (glucagon, cortisol, hormone de croissance, adrénaline). Les symptômes neuroglycopéniques se développent avec une diminution du niveau de glycémie inférieure à 2,5-2,8 mmol / l. Surdosage insuline et/ou de la drogue sulfonylurée l'hypoglycémie se développe en raison de l'action hypoglycémiante directe d'une hormone exogène ou endogène. En cas de surdosage de sulfonylurées, les symptômes hypoglycémiques peuvent se reproduire plusieurs fois après le soulagement de la crise, car la durée d'action d'un certain nombre de médicaments peut atteindre un jour ou plus. Les TSP qui n'ont pas d'effet stimulant sur la production d'insuline (metformine, thiazolidinediones) ne peuvent à eux seuls provoquer d'hypoglycémie, mais lorsqu'ils sont ajoutés à des sulfamides hypoglycémiants ou à de l'insuline, la prise de ces dernières à la même dose peut provoquer une hypoglycémie par cumul de l'effet hypoglycémiant de thérapie combinée (Tableau .7.15).
Languette. 7.15. hypoglycémie
 Le bout du tableau. 7.15
Le bout du tableau. 7.15
 Lorsque vous recevez de l'alcool il y a une suppression de la gluconéogenèse dans le foie, qui est le facteur le plus important contre l'hypoglycémie. Exercice physique contribuent à l'utilisation du glucose indépendante de l'insuline, grâce à laquelle, dans le contexte d'un traitement hypoglycémiant inchangé et / ou en l'absence d'apport supplémentaire de glucides, ils peuvent provoquer une hypoglycémie.
Lorsque vous recevez de l'alcool il y a une suppression de la gluconéogenèse dans le foie, qui est le facteur le plus important contre l'hypoglycémie. Exercice physique contribuent à l'utilisation du glucose indépendante de l'insuline, grâce à laquelle, dans le contexte d'un traitement hypoglycémiant inchangé et / ou en l'absence d'apport supplémentaire de glucides, ils peuvent provoquer une hypoglycémie.
Épidémiologie
Une hypoglycémie légère et rapidement réversible chez les patients atteints de diabète de type 1 recevant une insulinothérapie intensive peut se développer plusieurs fois par semaine et est relativement inoffensive. Pour un patient sous insulinothérapie intensive, il y a 1 cas d'hypoglycémie sévère par an. Dans la plupart des cas, l'hypoglycémie se développe la nuit. Dans le DT2, 20 % des patients recevant de l'insuline et 6 % des patients recevant des sulfonylurées développent au moins un épisode d'hypoglycémie sévère sur 10 ans.
Manifestations cliniques
Il existe deux principaux groupes de symptômes: adrénergiques, associés à l'activation du système nerveux sympathique et à la libération d'adrénaline par les glandes surrénales, et neuroglycopéniques, associés à une altération du fonctionnement du système nerveux central dans le contexte d'une déficience de son principal substrat énergétique. À adrénergique les symptômes incluent : tachycardie, mydriase ; anxiété, agressivité; frissons, sueurs froides, paresthésie ; nausées, faim intense, hypersalivation; diarrhée, miction excessive. À neuroglycopénique les symptômes comprennent l'asthénie,
diminution de la concentration, maux de tête, peur, confusion, désorientation, hallucinations ; troubles de la parole, de la vue, du comportement, amnésie, troubles de la conscience, convulsions, paralysie passagère, à qui. Il peut ne pas y avoir de relation claire entre la gravité et la séquence des symptômes à mesure que l'hypoglycémie s'aggrave. Seuls des symptômes adrénergiques ou neuroglycopéniques peuvent survenir. Dans certains cas, malgré la restauration de la normoglycémie et la poursuite du traitement, les patients peuvent rester dans un état stuporeux voire comateux pendant plusieurs heures voire plusieurs jours. L'hypoglycémie prolongée ou ses épisodes fréquents peuvent entraîner des modifications irréversibles du système nerveux central (principalement dans le cortex cérébral), dont les manifestations varient considérablement, allant d'épisodes délirants et hallucinatoires-paranoïaques à des crises d'épilepsie typiques, dont l'issue inévitable est une démence persistante. .
L'hyperglycémie est subjectivement tolérée par les patients plus facilement que les épisodes d'hypoglycémie, même légère. De ce fait, de nombreux patients, par peur de l'hypoglycémie, jugent nécessaire de maintenir la glycémie à un niveau relativement élevé, ce qui correspond en fait à la décompensation de la maladie. Dépasser ce stéréotype demande parfois des efforts considérables de la part des médecins et du personnel enseignant.
Diagnostique
Le tableau clinique de l'hypoglycémie chez un patient diabétique en combinaison avec la détection en laboratoire (généralement à l'aide d'un glucomètre) d'un faible taux de glucose dans le sang.
Diagnostic différentiel
Autres causes entraînant une perte de conscience. Si la cause de la perte de conscience d'un patient diabétique est inconnue et qu'il est impossible de procéder à une analyse expresse du niveau de glycémie, on lui montre l'introduction de glucose. Il est souvent nécessaire de rechercher la cause du développement d'hypoglycémies fréquentes chez les patients diabétiques. Elles résultent le plus souvent d'un traitement hypoglycémiant inadéquat et d'un faible niveau de connaissance du patient sur sa maladie. Il convient de rappeler qu'un certain nombre de maladies (insuffisance surrénalienne, hypothyroïdie, insuffisance rénale et hépatique), y compris les tumeurs malignes, peuvent entraîner une diminution du besoin d'un traitement hypoglycémiant jusqu'à son annulation complète ("diabète disparu").
Traitement
Pour le traitement de l'hypoglycémie légère, dans laquelle le patient est conscient et peut s'aider lui-même, il suffit généralement de prendre des aliments ou des liquides contenant des glucides à raison de 1 à 2 unités de pain (10 à 20 g de glucose). Cette quantité est contenue, par exemple, dans 200 ml de jus de fruit sucré. Les boissons sont plus efficaces pour arrêter l'hypoglycémie, car le glucose est absorbé beaucoup plus rapidement sous forme liquide. Si les symptômes continuent de s'aggraver malgré un apport continu en glucides, du glucose intraveineux ou du glucagon intramusculaire est nécessaire. L'hypoglycémie sévère avec perte de conscience est traitée de la même manière. Dans ce cas, le patient est injecté avec environ 50 ml solution de glucose à 40% par voie intraveineuse. L'introduction de glucose doit être poursuivie jusqu'à ce que l'attaque soit soulagée et que la glycémie se normalise, bien qu'une dose plus importante - jusqu'à 100 ml ou plus, en règle générale, ne soit pas nécessaire. Glucagon administré (généralement par une seringue remplie et préparée en usine) par voie intramusculaire ou sous-cutanée. Après quelques minutes, le niveau de glycémie dû à l'induction de la glycogénolyse par le glucagon revient à la normale. Cependant, cela ne se produit pas toujours : avec un taux élevé d'insuline dans le sang, le glucagon est inefficace. La demi-vie du glucagon est plus courte que celle de l'insuline. Avec l'alcoolisme et les maladies du foie, la synthèse du glycogène est altérée et l'administration de glucagon peut être inefficace. Un effet secondaire de l'administration de glucagon peut être des vomissements, ce qui crée un risque d'aspiration. Il est souhaitable que les proches du patient maîtrisent la technique d'injection de glucagon.
Prévoir
Une hypoglycémie légère chez des patients entraînés avec une bonne compensation de la maladie est sans danger. Les hypoglycémies fréquentes sont le signe d'une mauvaise compensation du DM ; dans la plupart des cas, ces patients présentent une hyperglycémie plus ou moins prononcée et un taux élevé d'hémoglobine glyquée le reste de la journée. Chez les patients âgés présentant des complications tardives du diabète, l'hypoglycémie peut provoquer des complications vasculaires telles qu'un infarctus du myocarde, un accident vasculaire cérébral, une hémorragie rétinienne. Un coma hypoglycémique pouvant durer jusqu'à 30 minutes avec un traitement adéquat et un retour rapide de la conscience, en règle générale, n'a pas de complications ni de conséquences.
7.8. COMPLICATIONS TARDIVES DU DIABÈTE SUCRÉ
Des complications tardives se développent dans les deux types de DM. On distingue cliniquement cinq principales complications tardives du DM : la macroangiopathie, la néphropathie, la rétinopathie, la neuropathie et le syndrome du pied diabétique. La non-spécificité des complications tardives pour certains types de DM est déterminée par le fait que leur lien pathogénique principal est l'hyperglycémie chronique. À cet égard, au moment de la manifestation de la DM-1, les complications tardives chez les patients ne se produisent presque jamais, se développant au fil des années et des décennies, en fonction de l'efficacité de la thérapie. La plus grande signification clinique dans DM-1, en règle générale, acquiert microangiopathie diabétique(néphropathie, rétinopathie) et neuropathie (syndrome du pied diabétique). Dans la DM-2, au contraire, les complications tardives sont souvent détectées déjà au moment du diagnostic. Premièrement, cela est dû au fait que le CD-2 se manifeste bien avant que le diagnostic ne soit posé. Deuxièmement, l'athérosclérose, qui se manifeste cliniquement par la macroangiopathie, a de nombreux liens de pathogenèse en commun avec le DM. Dans DM-2, la plus grande signification clinique, en règle générale, acquiert le diabète macroangiopathie, qui, au moment du diagnostic, est détecté chez la grande majorité des patients. Dans chaque cas, l'ensemble et la gravité des complications tardives individuelles varient de leur absence complète paradoxale, malgré la durée importante de la maladie, jusqu'à une combinaison de toutes les options possibles dans une forme sévère.
Les complications tardives sont principale cause de décès patients atteints de diabète, et compte tenu de sa prévalence - le problème de santé médico-social le plus important dans la plupart des pays. Concernant objectif principal du traitement et le suivi des patients diabétiques est la prévention (primaire, secondaire, tertiaire) de ses complications tardives.
7.8.1. Macroangiopathie diabétique
Macroangiopathie diabétique- un concept collectif qui fédère les lésions athérosclérotiques des grosses artères du diabète,
cliniquement manifestée par une maladie coronarienne (CHD), une athérosclérose oblitérante des vaisseaux cérébraux, des membres inférieurs, des organes internes et une hypertension artérielle (tableau 7.16).
Languette. 7.16. Macroangiopathie diabétique
 Étiologie et pathogenèse
Étiologie et pathogenèse
Probablement similaire à l'étiologie et à la pathogenèse de l'athérosclérose chez les individus sans diabète. Les plaques d'athérosclérose ne diffèrent pas dans leur structure microscopique chez les individus avec et sans DM. Cependant, dans le DM, des facteurs de risque supplémentaires peuvent apparaître, ou le DM exacerbe des facteurs non spécifiques connus. Ceux avec SD devraient inclure:
1. Hyperglycémie. C'est un facteur de risque pour le développement de l'athérosclérose. Une augmentation du taux d'HbA1c de 1 % chez les patients atteints de DM-2 augmente
Le risque de développer un infarctus du myocarde est de 15 %. Le mécanisme de l'effet athérogène de l'hyperglycémie n'est pas entièrement clair ; il peut être associé à la glycosylation des produits finaux du métabolisme des LDL et du collagène de la paroi vasculaire.
2. hypertension artérielle(AG). Dans la pathogenèse, une grande importance est attachée à la composante rénale (néphropathie diabétique). L'hypertension dans le DM-2 n'est pas un facteur de risque moins important de crise cardiaque et d'accident vasculaire cérébral que l'hyperglycémie.
3. Dyslipidémie. L'hyperinsulinémie, qui fait partie intégrante de la résistance à l'insuline dans le DT2, entraîne une diminution des taux de HDL, une augmentation des triglycérides et une diminution de la densité, c'est-à-dire augmentation de l'athérogénicité des LDL.
4. Obésité, qui affecte la majorité des patients atteints de CD-2, est un facteur de risque indépendant d'athérosclérose, d'infarctus du myocarde et d'accident vasculaire cérébral (voir rubrique 11.2).
5. résistance à l'insuline. L'hyperinsulinémie et des taux élevés de molécules analogues à l'insuline et à la proinsuline augmentent le risque d'athérosclérose, éventuellement associée à un dysfonctionnement endothélial.
6. Violation de la coagulation sanguine. Dans le diabète, une augmentation du taux de fibrinogène, d'activateur d'inhibiteur plaquettaire et de facteur von Willebrand est déterminée, entraînant la formation d'un état prothrombotique du système de coagulation sanguine.
7. le dysfonctionnement endothélial, caractérisée par une expression accrue de l'activateur inhibiteur du plasminogène et des molécules d'adhésion cellulaire.
8. stress oxydatif, entraînant une augmentation de la concentration en LDL oxydées et en isoprostanes F2.
9. inflammation systémique,à laquelle il y a une augmentation de l'expression du fibrinogène et de la protéine C-réactive.
Les facteurs de risque les plus significatifs pour le développement de la maladie coronarienne dans le DM-2 sont le LDL élevé, le HDL bas, l'hypertension artérielle, l'hyperglycémie et le tabagisme. L'une des différences entre le processus athéroscléreux dans le DM est le plus courant et nature distale de la lésion occlusive, ceux. Des artères relativement plus petites sont souvent impliquées dans le processus, ce qui complique le traitement chirurgical et aggrave le pronostic.
Épidémiologie
Le risque de développer une maladie coronarienne chez les personnes atteintes de diabète de type 2 est 6 fois plus élevé que chez les personnes non diabétiques, alors qu'il est le même pour les hommes et les femmes. L'hypertension artérielle est détectée chez 20 % des patients atteints de DM-1 et chez 75 % des patients atteints de DM-2. En général, il survient deux fois plus souvent chez les patients atteints de DM que chez ceux qui n'en sont pas atteints. L'athérosclérose oblitérante des vaisseaux périphériques se développe chez 10 % des patients atteints de diabète. Une thromboembolie des vaisseaux cérébraux se développe chez 8% des patients diabétiques (2 à 4 fois plus souvent que chez les personnes non diabétiques).
Manifestations cliniques
Fondamentalement, ne diffèrent pas de celles des individus sans DM. Dans le tableau clinique de la DM-2, les complications macrovasculaires (infarctus du myocarde, accident vasculaire cérébral, lésion occlusive des vaisseaux des jambes) sont souvent mises en évidence, et c'est au cours de leur évolution que l'hyperglycémie est souvent détectée pour la première fois chez un patient. Peut-être en raison d'une neuropathie autonome concomitante, jusqu'à 30 % des infarctus du myocarde chez les personnes atteintes de diabète surviennent sans crise angineuse typique (infarctus indolore).
Diagnostique
Les principes de diagnostic des complications de l'athérosclérose (CHD, accident vasculaire cérébral, lésions occlusives des artères des jambes) ne diffèrent pas de ceux des personnes sans diabète. La mesure pression artérielle(BP) doit être effectuée à chaque visite d'un patient diabétique chez un médecin, et la détermination des indicateurs spectre lipidique sang (cholestérol total, triglycérides, LDL, HDL) dans le diabète doit être effectué au moins une fois par an.
Diagnostic différentiel
Autres maladies cardiovasculaires, hypertension artérielle symptomatique, dyslipidémie secondaire.
Traitement
♦ Contrôle de la tension artérielle. Le niveau approprié de pression artérielle systolique chez les diabétiques est inférieur à 130 mmHg et diastolique à 80 mmHg (tableau 7.3). La plupart des patients auront besoin de plusieurs médicaments antihypertenseurs pour atteindre cet objectif. Les médicaments de choix pour le traitement antihypertenseur du diabète sont les inhibiteurs de l'ECA et les inhibiteurs des récepteurs de l'angiotensine, qui, si nécessaire, sont complétés par des diurétiques thiazidiques. Les médicaments de choix pour les patients diabétiques ayant subi un infarctus du myocarde sont les β-bloquants.
♦ Correction de la dyslipidémie. Les niveaux cibles des indicateurs du spectre lipidique sont présentés dans le tableau. 7.3. Les médicaments de choix pour le traitement hypolipidémiant sont les inhibiteurs de la 3-hydroxy-3-méthylglutaryl-CoA réductase (statines).
♦ thérapie antiplaquettaire. Le traitement par aspirine (75-100 mg/jour) est indiqué chez les patients diabétiques de plus de 40 ans présentant un risque accru de développer une maladie cardiovasculaire (antécédents familiaux compliqués, hypertension artérielle, tabagisme, dyslipidémie, microalbuminurie), ainsi que chez tous les patients avec des manifestations cliniques de l'athérosclérose comme prévention secondaire.
♦ Dépistage et traitement de la maladie coronarienne. Les tests d'effort pour exclure une maladie coronarienne sont indiqués pour les patients présentant des symptômes de maladie cardiovasculaire, ainsi que pour la détection d'une pathologie dans l'ECG.
Prévoir
75 % des patients atteints de DM-2 et 35 % des patients atteints de DM-1 meurent de maladies cardiovasculaires. Environ 50 % des patients atteints de diabète de type 2 meurent de complications d'une maladie coronarienne, 15 % d'une thromboembolie cérébrale. La mortalité par infarctus du myocarde chez les personnes atteintes de diabète dépasse 50 %.
7.8.2. la rétinopathie diabétique
la rétinopathie diabétique(DR) - microangiopathie des vaisseaux rétiniens, caractérisée par le développement de microanévrismes, d'hémorragies, de modifications exsudatives et de prolifération de vaisseaux nouvellement formés, entraînant une perte partielle ou totale de la vision (tableau 7.17).
Étiologie
Le principal facteur étiologique dans le développement de la RD est l'hyperglycémie chronique. D'autres facteurs (hypertension artérielle, dyslipidémie, tabagisme, grossesse, etc.) sont moins importants.
Pathogénèse
Les principaux liens dans la pathogenèse de la RD sont :
Microangiopathie des vaisseaux rétiniens, entraînant un rétrécissement de la lumière des vaisseaux avec le développement d'une hypoperfusion ;
Dégénérescence des vaisseaux avec formation de microanévrismes;
Hypoxie progressive, stimulant la prolifération vasculaire et entraînant une dégénérescence graisseuse et un dépôt de sels de calcium dans la rétine ;
Languette. 7.17. la rétinopathie diabétique
 micro-infarctus avec exsudation, conduisant à la formation de "taches de coton" molles ;
micro-infarctus avec exsudation, conduisant à la formation de "taches de coton" molles ;
Dépôt de lipides avec formation d'exsudats denses;
Croissance dans la rétine de vaisseaux proliférants avec formation de shunts et d'anévrismes, entraînant une dilatation des veines et une aggravation de l'hypoperfusion rétinienne ;
Le phénomène de vol avec progression ultérieure de l'ischémie, qui est à l'origine de la formation d'infiltrats et de cicatrices;
Décollement de la rétine à la suite de sa désintégration ischémique et de la formation de tractions vitréo-rétiniennes ;
Hémorragies vitreuses à la suite d'infarctus hémorragiques, d'invasion vasculaire massive et de rupture d'anévrisme ;
Prolifération des vaisseaux de l'iris (rubéose diabétique), entraînant le développement d'un glaucome secondaire ;
Maculopathie avec œdème rétinien.
Épidémiologie
La RD est la cause la plus fréquente de cécité parmi la population en âge de travailler dans les pays développés, et le risque de développer la cécité chez les patients atteints de diabète est 10 à 20 fois plus élevé que dans la population générale. Au moment du diagnostic de DM-1, la RD n'est retrouvée chez presque aucun des patients, après 5 ans, la maladie est détectée chez 8% des patients et avec des antécédents de diabète de trente ans - chez 98% des patients. Au moment du diagnostic de CD-2, la RD est détectée chez 20 à 40 % des patients, et chez les patients ayant une expérience de quinze ans de CD-2 - chez 85 %. Avec SD-1, la rétinopathie proliférative est relativement plus fréquente, et avec SD-2, la maculopathie (75 % des cas de maculopathie).
Manifestations cliniques
Selon la classification généralement acceptée, il y a 3 étapes de DR
(Tableau 7.18).
Diagnostique
Un examen ophtalmologique complet, comprenant une ophtalmoscopie directe avec photographie rétinienne, est indiqué pour les patients atteints de DM-1 3 à 5 ans après le début de la maladie et pour les patients atteints de DM-2 immédiatement après sa détection. À l'avenir, ces études devraient être répétées chaque année.
Languette. 7.18. Classification de la rétinopathie diabétique
 Diagnostic différentiel
Diagnostic différentiel
Autres maladies oculaires chez les patients diabétiques.
Traitement
Le principe de base du traitement de la rétinopathie diabétique, ainsi que d'autres complications tardives, est la compensation optimale du DM. Le traitement le plus efficace pour la rétinopathie diabétique et la prévention de la cécité est photocoagulation au laser. objectif
 Riz. 7.11. La rétinopathie diabétique:
Riz. 7.11. La rétinopathie diabétique:
a) non proliférative ; b) préprolifératif; c) prolifératif
la photocoagulation au laser est l'arrêt du fonctionnement des vaisseaux nouvellement formés, qui constituent la principale menace pour le développement de complications aussi graves que l'hémophtalmie, le décollement de la rétine par traction, la rubéose de l'iris et le glaucome secondaire.
Prévoir
La cécité est enregistrée chez 2 % des patients atteints de DM (3 à 4 % des patients atteints de DM-1 et 1,5 à 2 % des patients atteints de DM-2). Le taux approximatif de nouveaux cas de cécité associés à la RD est de 3,3 cas pour 100 000 habitants par an. Avec la DM-1, une diminution de l'HbA1c à 7,0 % entraîne une diminution du risque de développer une RD de 75 % et une diminution du risque de progression de la RD de 60 %. Avec le DM-2, une diminution de 1 % de l'HbA1c entraîne une diminution de 20 % du risque de développer une RD.
7.8.3. néphropathie diabétique
néphropathie diabétique(DNF) se définit comme une albuminurie (plus de 300 mg d'albumine par jour ou une protéinurie de plus de 0,5 g de protéines par jour) et/ou une diminution de la fonction de filtration des reins chez les personnes diabétiques en l'absence d'infections urinaires , une insuffisance cardiaque ou d'autres maladies rénales. La microalbuminurie est définie comme une excrétion d'albumine de 30 à 300 mg/jour ou de 20 à 200 mcg/min.
Étiologie et pathogenèse
Les principaux facteurs de risque de DNF sont la durée du diabète, l'hyperglycémie chronique, l'hypertension artérielle, la dyslipidémie et les maladies rénales chez les parents. Dans DNF, il est principalement affecté appareil glomérulaire reins.
1. L'un des mécanismes possibles par lesquels hyperglycémie contribue au développement des lésions glomérulaires, est l'accumulation de sorbitol due à l'activation de la voie polyol du métabolisme du glucose, ainsi qu'un certain nombre de produits finaux de glycation avancée.
2. Troubles hémodynamiques, à savoir hypertension artérielle intraglomérulaire(augmentation de la pression artérielle à l'intérieur des glomérules du rein) est un élément essentiel de la pathogenèse
La cause de l'hypertension intraglomérulaire est une violation du tonus des artérioles: expansion de l'afférence et rétrécissement de l'efférent.
Languette. 7.19. néphropathie diabétique
 Ceci, à son tour, se produit sous l'influence d'un certain nombre de facteurs humoraux, tels que l'angiotensine-2 et l'endothéline, ainsi qu'en raison d'une violation des propriétés électrolytiques de la membrane basale glomérulaire. De plus, l'hypertension systémique contribue à l'hypertension intraglomérulaire, qui est présente chez la plupart des patients atteints de DNF. En raison de l'hypertension intraglomérulaire, les membranes basales et les pores de filtration sont endommagés,
Ceci, à son tour, se produit sous l'influence d'un certain nombre de facteurs humoraux, tels que l'angiotensine-2 et l'endothéline, ainsi qu'en raison d'une violation des propriétés électrolytiques de la membrane basale glomérulaire. De plus, l'hypertension systémique contribue à l'hypertension intraglomérulaire, qui est présente chez la plupart des patients atteints de DNF. En raison de l'hypertension intraglomérulaire, les membranes basales et les pores de filtration sont endommagés,
par où les traces commencent à pénétrer (microalbuminurie), suivi de quantités importantes d'albumine (protéinurie). L'épaississement des membranes basales provoque une modification de leurs propriétés électrolytiques, ce qui en soi conduit à plus d'albumine entrant dans l'ultrafiltrat même en l'absence de modification de la taille des pores de filtration.
3. Prédisposition génétique. Chez les parents de patients atteints de DNF, l'hypertension artérielle survient avec une fréquence accrue. Il existe des preuves d'une relation entre le polymorphisme des gènes DNP et ACE. Au microscope, le DNF révèle un épaississement des membranes basales des glomérules, une expansion du mésangium, ainsi que des modifications fibrotiques des artérioles afférentes et efférentes. Au stade ultime, qui correspond cliniquement à l'insuffisance rénale chronique (IRC), une glomérulosclérose focale (Kimmelstiel-Wilson) puis diffuse est déterminée.
Épidémiologie
La microalbuminurie est déterminée chez 6 à 60 % des patients atteints de DM-1 5 à 15 ans après sa manifestation. Le DNF est déterminé chez 35 % des personnes atteintes de DM-1, plus souvent chez les hommes et chez les personnes qui ont développé la DM-1 à l'âge de moins de 15 ans. Avec DM-2, DNF se développe chez 25% des représentants de la race européenne et chez 50% de la race asiatique. La prévalence globale du DNF dans le DT2 est de 4 à 30 %.
Manifestations cliniques
Une manifestation clinique relativement précoce qui est indirectement associée au DNF est l'hypertension artérielle. Les autres manifestations cliniquement évidentes sont tardives. Il s'agit notamment des manifestations du syndrome néphrotique et de l'insuffisance rénale chronique.
Diagnostique
Le dépistage du DNF chez les personnes atteintes de DM implique des tests annuels pour microalbuminurie avec DM-1 5 ans après la manifestation de la maladie et avec DM-2 - immédiatement après sa détection. De plus, au moins une détermination annuelle du taux de créatinine est nécessaire pour calculer débit de filtration glomérulaire (DFG). Le DFG peut être calculé à l'aide de diverses formules, telles que la formule de Cockcroft-Gault :
Pour les hommes : a = 1,23 (norme GFR 100 - 150 ml/min) Pour les femmes : a = 1,05 (norme GFR 85 - 130 ml/min)
Sur le étapes initiales Le DNF peut montrer une augmentation du DFG, qui diminue progressivement à mesure que le CRF progresse. La microalbuminurie commence à être déterminée 5 à 15 ans après la manifestation de CD-1 ; dans la DM-2 dans 8 à 10 % des cas, elle est détectée immédiatement après sa détection, probablement en raison de la longue évolution asymptomatique de la maladie avant le diagnostic. Le pic de protéinurie ou d'albuminurie manifeste dans le DT1 survient entre 15 et 20 ans après son apparition. La protéinurie indique irréversibilité DNF, qui tôt ou tard conduira à CRF. L'urémie se développe en moyenne 7 à 10 ans après le début de la protéinurie manifeste. Il convient de noter que le DFG n'est pas corrélé à la protéinurie.
Diagnostic différentiel
Autres causes de protéinurie et d'insuffisance rénale chez les personnes atteintes de diabète. Dans la plupart des cas, le DNF est associé à une hypertension artérielle, une rétinopathie diabétique ou une neuropathie, en l'absence desquelles le diagnostic différentiel doit être particulièrement prudent. Dans 10 % des cas de DM-1 et dans 30 % des cas de DM-2, la protéinurie n'est pas associée au DNF.
Traitement
♦ Conditions de base pour le primaire et le secondaire la prévention
DNF sont la compensation du diabète et le maintien d'une pression artérielle systémique normale. De plus, la prévention primaire du DNF implique une réduction de l'apport en protéines - moins de 35% des calories quotidiennes.
♦ Par étapes microalbuminurie et protéinurie on montre aux patients la nomination d'inhibiteurs de l'ECA ou de bloqueurs des récepteurs de l'angiotensine. En cas d'hypertension artérielle concomitante, ils sont prescrits à doses antihypertensives, si nécessaire en association avec d'autres antihypertenseurs. Avec une pression artérielle normale, ces médicaments sont prescrits à des doses qui ne conduisent pas au développement d'une hypotension. Les inhibiteurs de l'ECA (dans DM-1 et DM-2) et les bloqueurs des récepteurs de l'angiotensine (dans DM-2) aident à prévenir la transition de la microalbuminurie vers la protéinurie. Dans certains cas, la microalbuminurie est éliminée dans le contexte de cette thérapie en combinaison avec une compensation du diabète selon d'autres paramètres. De plus, à partir du stade de la microalbuminurie, il faut
réduire l'apport en protéines à moins de 10 % des calories quotidiennes (soit moins de 0,8 gramme par kg de poids) et le sel à moins de 3 grammes par jour.
♦ Sur scène CKD, en règle générale, une correction du traitement hypoglycémique est nécessaire. La plupart des patients atteints de diabète de type 2 doivent passer à l'insulinothérapie, car l'accumulation de TSP comporte le risque de développer une hypoglycémie sévère. Chez la plupart des patients atteints de diabète de type 1, on observe une diminution des besoins en insuline, puisque le rein est l'un des principaux sites de son métabolisme. Avec une augmentation de la créatinine sérique à 500 µmol/l ou plus, il est nécessaire de se poser la question de la préparation du patient à une méthode de traitement extracorporelle (hémodialyse, dialyse péritonéale) ou chirurgicale (transplantation rénale). La transplantation rénale est indiquée à des niveaux de créatinine jusqu'à 600-700 µmol/l et une diminution du débit de filtration glomérulaire inférieure à 25 ml/min, une hémodialyse - 1000-1200 µmol/l et moins de 10 ml/min, respectivement.
Prévoir
Chez 50 % des patients atteints de diabète de type 1 et 10 % des patients atteints de diabète de type 2 qui présentent une protéinurie, l'IRC se développe au cours des 10 années suivantes. 15 % de tous les décès chez les patients atteints de diabète de type 1 de moins de 50 ans sont associés à une IRC due à un DNF.
7.8.4. Neuropathie diabétique
Neuropathie diabétique(DNE) est une combinaison de syndromes d'atteinte du système nerveux, qui peuvent être classés en fonction de l'implication prédominante dans le processus de ses différents départements (sensoriel-moteur, autonome), ainsi que de la prévalence et de la gravité de la lésion ( Tableau 7.20).
JE. Neuropathie sensorimotrice :
symétrique;
Focale (mononeuropathie) ou polyfocale (mononeuropathie crânienne, motrice proximale, des membres et du tronc).
II. Neuropathie autonome (végétative):
Cardiovasculaire (hypotension orthostatique, syndrome de dénervation cardiaque);
Gastro-intestinal (atonie gastrique, dyskinésie biliaire, entéropathie diabétique);
Urogénital (avec dysfonctionnement de la vessie et de la fonction sexuelle);
Altération de la capacité du patient à reconnaître l'hypoglycémie ;
Fonction pupillaire altérée;
Violation des fonctions des glandes sudoripares (anhidrose distale, hyperhidrose en mangeant).
Languette. 7.20. Neuropathie diabétique
 Étiologie et pathogenèse
Étiologie et pathogenèse
La principale cause de DNE est l'hyperglycémie. Plusieurs mécanismes de sa pathogenèse sont proposés :
Activation de la voie polyol du métabolisme du glucose, entraînant l'accumulation de sorbitol et de fructose dans les cellules nerveuses et une diminution de la teneur en myoinositol et en glutathion. Ceci, à son tour, conduit à l'activation des processus radicalaires et à une diminution du niveau d'oxyde nitrique;
Glycosylation non enzymatique des protéines membranaires et cytoplasmiques des cellules nerveuses ;
Microangiopathie vasa nervorum, ce qui entraîne un ralentissement du flux sanguin capillaire et une hypoxie nerveuse.
Épidémiologie
La prévalence du DNE dans les deux types de DM est d'environ 30 %. Avec DM-1, 5 ans après le début de la maladie, il commence à être détecté chez 10% des patients. La fréquence des nouveaux cas de DNE dans la DM-2 est d'environ 6 % des patients par an. La variante la plus courante est la NNE sensorimotrice symétrique distale.
Manifestations cliniques
Sensorimoteur DNE se manifeste par un complexe de troubles moteurs et sensoriels. Un symptôme courant de la forme distale de DNE est paresthésie, qui se manifestent par une sensation de « ramper », d'engourdissement. Les patients se plaignent souvent de froideur des jambes, bien qu'elles restent chaudes au toucher, ce qui est un signe qui distingue la polyneuropathie des modifications ischémiques lorsque les jambes sont froides au toucher. La sensibilité aux vibrations est une manifestation précoce de la neuropathie sensorielle. Caractéristique est le syndrome des "jambes sans repos", qui est une combinaison de paresthésie nocturne et d'hypersensibilité. Douleur dans les jambes plus souvent dérangé la nuit, alors que parfois le patient ne supporte pas le contact d'une couverture. Dans un cas typique, la douleur, contrairement à celle des maladies oblitérantes des artères, peut être soulagée par la marche. Des années plus tard, la douleur peut s'arrêter spontanément en raison de la mort de petites fibres nerveuses responsables de la sensibilité à la douleur. Hypoesthésie se manifeste par une perte de sensibilité de type "bas" et "gants". La violation de la sensibilité proprioceptive profonde entraîne une altération de la coordination et des difficultés de mouvement (ataxie sensorielle). Le patient se plaint des "jambes de quelqu'un d'autre", d'une sensation de "se tenir debout sur du coton". La violation de l'innervation trophique entraîne des modifications dégénératives de la peau, des os et des tendons. La violation de la sensibilité à la douleur entraîne des microtraumatismes fréquents et inaperçus des pieds du patient, qui s'infectent facilement. La violation de la coordination et de la marche entraîne une redistribution non physiologique de la charge sur les articulations du pied. En conséquence, les relations anatomiques dans le système musculo-squelettique de la jambe sont perturbées.
La voûte plantaire est déformée, un gonflement, des fractures, des processus purulents chroniques se développent (voir paragraphe 7.8.5).
Il existe plusieurs formes de DNE autonomes. Cause forme cardiovasculaire- violation de l'innervation du complexe cardio-pulmonaire et des gros vaisseaux. Le nerf vague est le nerf le plus long et il est donc affecté plus tôt que les autres. En raison de la prédominance des influences sympathiques se développe tachycardie au repos. Une réponse inadéquate à l'orthostase se manifeste hypotension orthostatique et syncope. La dénervation autonome du complexe pulmonaire-cardiaque conduit à l'absence de variabilité de la fréquence cardiaque. Une prévalence accrue d'infarctus du myocarde indolore chez les patients diabétiques est associée à la neuropathie autonome.
Les symptômes forme gastro-intestinale Les DNE sont des gastroparésies avec vidange retardée ou au contraire rapide de l'estomac, ce qui peut créer des difficultés dans le choix de l'insulinothérapie, puisque le temps et le volume d'absorption des glucides varient indéfiniment ; atonie de l'œsophage, œsophagite par reflux, dysphagie; diarrhée liquide. Pour forme urogénitale La DNE se caractérise par une atonie des uretères et de la vessie, entraînant une tendance aux infections urinaires ; dysfonction érectile (environ 50% des patients diabétiques); éjaculation rétrograde.
D'autres manifestations possibles de DNE autonome sont une altération de la capacité à reconnaître l'hypoglycémie, une altération de la fonction pupillaire, une altération de la fonction des glandes sudoripares (anhidrose) et une amyotrophie diabétique.
Diagnostique
L'examen neurologique des patients atteints de DM doit être effectué chaque année. Au minimum, cela implique des tests pour détecter une neuropathie sensitivomotrice distale. Pour cela, la sensibilité aux vibrations est évaluée à l'aide d'un diapason gradué, la sensibilité tactile à l'aide d'un monofilament, ainsi que la sensibilité à la température et à la douleur. Selon les indications, l'état du système nerveux autonome est étudié: un certain nombre de tests fonctionnels sont utilisés pour diagnostiquer l'insuffisance de l'innervation parasympathique du cœur, comme la mesure de la fréquence cardiaque pendant la respiration profonde avec une évaluation de la variabilité
fréquence cardiaque et test de Valsalva ; un test orthostatique est utilisé pour diagnostiquer l'insuffisance de l'innervation sympathique du cœur.
Diagnostic différentiel
Neuropathie d'une autre origine (alcoolique, urémique, avec anémie par carence en B 12, etc.). Le diagnostic de dysfonctionnement de l'un ou l'autre organe à la suite d'une neuropathie autonome n'est établi qu'après l'exclusion de la pathologie organique.
Traitement
1. Optimisation de la thérapie hypoglycémiante.
2. Soins des pieds (voir paragraphe 7.8.5).
3. L'efficacité des médicaments neurotropes (acide α-lipoïque) n'est pas confirmée dans toutes les études.
4. Thérapie symptomatique (analgésique, sildénafil pour la dysfonction érectile, fludrocortisone pour l'hypotension orthostatique, etc.).
Prévoir
Dans les premiers stades, DNE peut être réversible dans le contexte d'une compensation stable pour DM. Le DNE est déterminé chez 80 % des patients souffrant d'ulcères et constitue le principal facteur de risque d'amputation de la jambe.
7.8.5. syndrome du pied diabétique
syndrome du pied diabétique(SDS) - un état pathologique du pied dans le DM qui survient dans le contexte de lésions des nerfs périphériques, de la peau et des tissus mous, des os et des articulations et se manifeste par des ulcères aigus et chroniques, des lésions ostéoarticulaires et des processus nécrotiques purulents (tableau 7.21) .
Étiologie et pathogenèse
La pathogenèse de la DFS est à plusieurs composants et est représentée par une combinaison de troubles neuropathiques et de perfusion avec une tendance prononcée à l'infection. Sur la base de la prédominance dans la pathogenèse de l'un ou l'autre des facteurs énumérés, il existe 3 formes principales
Languette. 7.21. syndrome du pied diabétique
 I. Forme neuropathique(60-70 %):
I. Forme neuropathique(60-70 %):
Sans ostéoarthropathie;
avec ostéoarthropathie diabétique.
II. Forme neuroischémique (mixte)(15-20 %).
III. Forme ischémique(3-7 %).
forme neuropathique du SDS. Dans la neuropathie diabétique, les parties distales des nerfs les plus longs sont principalement touchées. Une déficience prolongée des impulsions trophiques entraîne une hypotrophie de la peau, des os, des ligaments, des tendons et des muscles. Le résultat de l'hypotrophie des structures conjonctives est la déformation du pied avec une redistribution non physiologique de la charge d'appui et son augmentation excessive dans certaines zones. Dans ces endroits, par exemple, dans la projection des têtes des os métatarsiens, on note un épaississement de la peau et la formation d'une hyperkératose. Une pression constante sur ces zones conduit à une autolyse inflammatoire des tissus mous sous-jacents, ce qui crée les conditions préalables à la formation d'un ulcère. En raison de l'atrophie et de la transpiration altérée, la peau devient sèche et facilement craquelée. En raison de la diminution de la sensibilité à la douleur, le patient ne fait souvent pas attention aux changements en cours. Il ne peut pas détecter à temps les inconvénients des chaussures, ce qui entraîne la formation d'éraflures et de callosités, ne remarque pas l'introduction de corps étrangers, de petites plaies aux endroits de fissuration. La situation est exacerbée par une violation de la sensibilité profonde, se manifestant par une violation de la démarche, une installation incorrecte du pied. Le plus souvent, un ulcère peptique est infecté par des staphylocoques, des streptocoques, des bactéries du groupe intestinal; la flore anaérobie se joint souvent. L'ostéoarthropathie neuropathique est le résultat de modifications dystrophiques prononcées de l'appareil ostéoarticulaire du pied (ostéoporose, ostéolyse, hyperostose).
Forme ischémique du SDS est une conséquence de l'athérosclérose des artères des membres inférieurs, entraînant une violation du flux sanguin principal, c'est-à-dire est l'une des variantes de la macroangiopathie diabétique.
Épidémiologie
Le SDS est observé chez 10 à 25% et, selon certaines données, sous une forme ou une autre chez 30 à 80% des patients diabétiques. Aux États-Unis, le coût annuel du traitement des patients diabétiques atteints de SSM est de 1 milliard de dollars.
Manifestations cliniques
À forme neuropathique Le SDS distingue les deux types de lésions les plus courants : l'ulcère neuropathique et l'ostéoarthropathie (avec le développement
 Riz. 7.12. Ulcère neuropathique dans le syndrome du pied diabétique
Riz. 7.12. Ulcère neuropathique dans le syndrome du pied diabétique
 Riz. 7.13. Articulation de Charcot dans le syndrome du pied diabétique
Riz. 7.13. Articulation de Charcot dans le syndrome du pied diabétique
joint de Charcot). ulcères neuropathiques, en règle générale, ils sont localisés dans le domaine des espaces uniques et interdigitaux, c'est-à-dire sur les zones du pied les plus sollicitées (Fig. 7.12).
Des modifications destructrices de l'appareil osseux et ligamentaire du pied peuvent progresser sur plusieurs mois et entraîner de graves déformations osseuses - ostéoarthropathie diabétique et formation rôti de charcot, en même temps, le pied est comparé au sens figuré à un "sac d'os"
À forme ischémique du SDS
la peau des pieds est froide, pâle ou cyanosée; a rarement une teinte rouge rosé due à l'expansion des capillaires superficiels en réponse à l'ischémie. Les défauts ulcéreux se présentent sous forme de nécrose acrale - sur le bout des doigts, la surface marginale des talons (Fig. 7.14).
Le pouls sur les artères du pied, les artères poplitées et fémorales est affaibli ou non palpable.
Dans les cas typiques, les patients se plaignent de "claudication intermittente". La gravité des lésions ischémiques du membre est déterminée par trois facteurs principaux: la gravité de la sténose, le développement du flux sanguin collatéral, l'état du système de coagulation sanguine.
Diagnostique
L'examen des jambes d'un patient diabétique doit être effectué à chaque visite chez le médecin, au moins une fois tous les six mois. Le diagnostic du SDS comprend :
 Riz. 7.14. Nécrose acrale dans la forme ischémique du syndrome du pied diabétique
Riz. 7.14. Nécrose acrale dans la forme ischémique du syndrome du pied diabétique
Examen des jambes ;
Évaluation de l'état neurologique - divers types de sensibilité, réflexes tendineux, électromyographie ;
Évaluation de l'état du flux sanguin artériel - angiographie, dopplerographie, dopplerographie;
Radiographie des pieds et des chevilles ;
Examen bactériologique de l'écoulement de la plaie.
Diagnostic différentiel
Elle est réalisée avec des plaies sur les pieds d'origine différente, ainsi que d'autres maladies occlusives des vaisseaux des membres inférieurs et de la pathologie des articulations du pied. De plus, il est nécessaire de différencier les formes cliniques de SDS (tableau 7.22).
Traitement
Traitement infecté neuropathiquement Les formulaires VTS incluent un ensemble des activités suivantes :
Optimisation de la compensation DM, en règle générale, augmentation de la dose d'insuline et, en cas de DM-2 - transfert vers celle-ci;
Antibiothérapie systémique ;
Décharge complète du pied (cela peut entraîner la guérison d'ulcères qui existent depuis des années en quelques semaines);
Traitement local de la plaie avec élimination des zones d'hyperkératose;
Soins des pieds, sélection appropriée et port de chaussures spéciales. Une thérapie conservatrice opportune permet
éviter la chirurgie dans 95% des cas.
Languette. 7.22. Diagnostic différentiel des formes cliniques de SDS
 Traitement ischémique Les formulaires VTS comprennent :
Traitement ischémique Les formulaires VTS comprennent :
Optimisation de la compensation DM, en règle générale, augmentation de la dose d'insuline et, en cas de DM-2 - transfert vers celle-ci;
En l'absence de lésions ulcéro-nécrotiques, ergothérapie (1 à 2 heures de marche par jour, qui contribue au développement du flux sanguin collatéral) ;
Opérations de revascularisation sur les vaisseaux touchés ;
Thérapie conservatrice: anticoagulants, aspirine (jusqu'à 100 mg / jour), si nécessaire - fibrinolytiques, prostaglandine E1 et préparations de prostacycline.
Avec le développement d'une lésion purulente-nécrotique étendue dans toutes les variantes de SDS, la question de l'amputation est soulevée.
Prévoir
De 50 à 70 % du nombre total d'amputations de jambe pratiquées concernent des patients atteints de diabète sucré. Les amputations de jambe sont 20 à 40 fois plus fréquentes chez les patients diabétiques que chez les patients non diabétiques.
7.9. DIABÈTE ET GROSSESSE
Diabète sucré gestationnel(DSG) est une intolérance au glucose identifiée pour la première fois pendant la grossesse (tableau 7.23). Cette définition n'exclut pas la possibilité que la pathologie du métabolisme glucidique puisse précéder le début de la grossesse. Le DG doit être distingué des situations où une femme atteinte de diabète précédemment diagnostiqué (en raison de son âge, plus souvent du diabète de type 1) tombe enceinte.
Étiologie et pathogenèse
Avec GDM, ils sont similaires à ceux avec SD-2. Des niveaux élevés de stéroïdes ovariens et placentaires, ainsi qu'une augmentation de la formation de cortisol par le cortex surrénalien, conduisent au développement d'une résistance physiologique à l'insuline pendant la grossesse. Le développement du DG est associé au fait que la résistance à l'insuline, qui se développe naturellement pendant la grossesse, et, par conséquent, un besoin accru d'insuline chez les personnes prédisposées, dépasse la capacité fonctionnelle des cellules β pancréatiques. Après l'accouchement, avec le retour des relations hormonales et métaboliques au niveau initial, il disparaît généralement.
Languette. 7.23. Diabète sucré gestationnel
 Le DG se développe généralement au milieu du 2ème trimestre, entre 4 et 8 mois de grossesse. La grande majorité des patients ont un excès de poids corporel et une histoire chargée de CD-2. Les facteurs de risque pour le développement du DG, ainsi que les groupes de femmes à faible risque de développer un DG, sont indiqués dans le tableau. 7.24.
Le DG se développe généralement au milieu du 2ème trimestre, entre 4 et 8 mois de grossesse. La grande majorité des patients ont un excès de poids corporel et une histoire chargée de CD-2. Les facteurs de risque pour le développement du DG, ainsi que les groupes de femmes à faible risque de développer un DG, sont indiqués dans le tableau. 7.24.
Languette. 7.24. Facteurs de risque du diabète sucré gestationnel
 L'hyperglycémie maternelle entraîne une hyperglycémie dans le système circulatoire du bébé. Le glucose traverse facilement le placenta et passe continuellement au fœtus à partir du sang de la mère. Le transport actif des acides aminés et le transfert des corps cétoniques au fœtus se produisent également. En revanche, l'insuline, le glucagon et les acides gras libres de la mère ne pénètrent pas dans le sang du fœtus. Au cours des 9 à 12 premières semaines de grossesse, le pancréas du fœtus ne produit pas encore sa propre insuline. Ce temps correspond à la phase d'organogenèse fœtale où, avec une hyperglycémie constante, diverses malformations (cœur, colonne vertébrale, moelle épinière, tube digestif) peuvent se former chez la mère. À partir de la 12e semaine de grossesse, le pancréas fœtal commence à synthétiser l'insuline et, en réponse à l'hyperglycémie, une hypertrophie réactive et une hyperplasie des cellules β du pancréas fœtal se développent. En raison de l'hyperinsulinémie, une macrosomie fœtale se développe, ainsi qu'une inhibition de la synthèse de lécithine, ce qui explique la forte incidence du syndrome de détresse respiratoire chez les nouveau-nés. En raison de l'hyperplasie des cellules β et de l'hyperinsulinémie, il existe une tendance à l'hypoglycémie sévère et prolongée.
L'hyperglycémie maternelle entraîne une hyperglycémie dans le système circulatoire du bébé. Le glucose traverse facilement le placenta et passe continuellement au fœtus à partir du sang de la mère. Le transport actif des acides aminés et le transfert des corps cétoniques au fœtus se produisent également. En revanche, l'insuline, le glucagon et les acides gras libres de la mère ne pénètrent pas dans le sang du fœtus. Au cours des 9 à 12 premières semaines de grossesse, le pancréas du fœtus ne produit pas encore sa propre insuline. Ce temps correspond à la phase d'organogenèse fœtale où, avec une hyperglycémie constante, diverses malformations (cœur, colonne vertébrale, moelle épinière, tube digestif) peuvent se former chez la mère. À partir de la 12e semaine de grossesse, le pancréas fœtal commence à synthétiser l'insuline et, en réponse à l'hyperglycémie, une hypertrophie réactive et une hyperplasie des cellules β du pancréas fœtal se développent. En raison de l'hyperinsulinémie, une macrosomie fœtale se développe, ainsi qu'une inhibition de la synthèse de lécithine, ce qui explique la forte incidence du syndrome de détresse respiratoire chez les nouveau-nés. En raison de l'hyperplasie des cellules β et de l'hyperinsulinémie, il existe une tendance à l'hypoglycémie sévère et prolongée.
Épidémiologie
Le DM affecte 0,3 % de toutes les femmes en âge de procréer, 0,2 à 0,3 % des femmes enceintes ont déjà initialement un DM et 1 à 14 % des grossesses développent un DG ou manifestent un véritable DM. La prévalence du DG varie selon les populations. Par exemple, aux États-Unis, il est détecté chez environ 4 % des femmes enceintes (135 000 cas par an).
Manifestations cliniques
Non présent dans GSD. Il peut y avoir des symptômes non spécifiques du diabète décompensé.
Diagnostique
Les taux de glycémie à jeun sont indiqués pour toutes les femmes enceintes dans le cadre d'un test sanguin biochimique. Les femmes appartenant au groupe à risque (tableau 7.24) présentent test oral de tolérance au glucose(OGTT). De nombreuses variantes de sa mise en œuvre chez la femme enceinte sont décrites. La plus simple d'entre elles implique les règles suivantes :
3 jours avant l'examen, la femme suit un régime alimentaire normal et adhère à son activité physique habituelle ;
Le test est réalisé le matin à jeun, après une nuit de jeûne d'au moins 8 heures ;
Après avoir prélevé un échantillon de sang à jeun, une femme boit une solution pendant 5 minutes, composée de 75 grammes de glucose sec dissous dans 250 à 300 ml d'eau; la détermination répétée du niveau de glycémie est effectuée après 2 heures.
Le diagnostic de DG est basé sur les éléments suivants Critères:
Glycémie du sang total (veineux, capillaire) à jeun > 6,1 mmol/l ou
Glycémie plasmatique veineuse ≥ 7 mmol/l ou
Glucose dans le sang total capillaire ou le plasma veineux 2 heures après une charge de 75 g de glucose ≥ 7,8 mmol/l.
Si les résultats de l'étude sont normaux chez une femme appartenant au groupe à risque, le test est répété à 24-28 semaines de grossesse.
Diagnostic différentiel
GSD et vrai SD ; glycosurie pendant la grossesse.
Traitement
Le risque pour la mère et le fœtus, ainsi que les approches du traitement du diabète et les caractéristiques de son contrôle dans le DG et dans le vrai diabète sont les mêmes. Les complications tardives du diabète pendant la grossesse peuvent progresser de manière significative, cependant, avec une compensation de haute qualité pour le diabète, il n'y a aucune indication d'interruption de grossesse. Une femme atteinte de diabète (généralement DM-1) devrait planifier une grossesse à un jeune âge, lorsque le risque de complications est le plus faible. Si une grossesse est prévue, il est recommandé d'annuler la con-
réception quelques mois après avoir atteint une compensation optimale. Les contre-indications à la planification de la grossesse sont une néphropathie sévère avec insuffisance rénale progressive, une cardiopathie ischémique sévère, une rétinopathie proliférative sévère non corrigible, une acidocétose en début de grossesse (les corps cétoniques sont des facteurs tératogènes).
Le but du traitement Le DG et le vrai diabète pendant la grossesse est la réalisation des paramètres de laboratoire suivants :
glycémie à jeun< 5-5,8 ммоль/л;
Glycémie 1h après avoir mangé< 7,8 ммоль/л;
Glycémie 2 heures après avoir mangé< 6,7 ммоль/л;
Profil glycémique quotidien moyen< 5,5 ммоль/л;
Le niveau d'HbA1c au contrôle mensuel, comme chez les personnes en bonne santé (4-6%).
Avec DM-1, ainsi qu'en dehors de la grossesse, une femme doit recevoir une insulinothérapie intensive, cependant, il est recommandé d'évaluer le niveau de glycémie pendant la grossesse 7 à 8 fois par jour. S'il est impossible d'obtenir une compensation normoglycémique dans le contexte des injections conventionnelles, il est nécessaire d'envisager de transférer le patient vers une insulinothérapie à l'aide d'un distributeur d'insuline.
Au premier stade traitement du DG une thérapie diététique est prescrite, qui consiste à limiter l'apport calorique quotidien à environ 25 kcal / kg de poids réel, principalement en raison de glucides facilement digestibles et de graisses d'origine animale, ainsi qu'à développer l'activité physique. Si la thérapie diététique ne parvient pas à atteindre les objectifs du traitement, le patient doit se voir prescrire une insulinothérapie intensive. Tout médicament antidiabétique en comprimé (TSP) pendant la grossesse contre-indiqué. Environ 15 % des femmes doivent être transférées vers une insulinothérapie.
Prévoir
Avec une compensation insatisfaisante du DG et du DM pendant la grossesse, la probabilité de développer diverses pathologies chez le fœtus est de 30% (le risque est 12 fois plus élevé que dans la population générale). Plus de 50 % des femmes qui développent un DG pendant la grossesse développent des CD-2 au cours des 15 prochaines années.
Salut tout le monde! Les filles qui ont été dans des situations similaires, répondez ! Le 27 mai, la première projection a eu lieu. D'ailleurs, tout était en ordre. Ils ont écrit le téléphone au cas où, mais je ne m'attendais pas à ce qu'ils puissent rappeler, et maintenant une semaine plus tard, un appel - venez pour un renvoi au cpsir, vous avez un risque élevé. Je ne me souviens pas de moi, je suis arrivé en larmes, les jambes rembourrées, j'ai pris tous les papiers. Risque 1:53. Le lendemain, je suis allé passer un examen. L'uziste a regardé l'abdomen et le vagin pendant très longtemps, a allumé le doppler plusieurs fois, et tout semblait aller bien, mais il n'a pas aimé DOPLEROMETRIE DE LA VALVE TRISCUPITALE: REGURGITATION. J'ai entré les données de la nouvelle échographie dans le programme et les résultats du dépistage il y a une semaine, l'ordinateur a émis un risque de DM 1:6. Envoyé à un généticien. Après avoir regardé la conclusion, elle m'a expliqué que cette régurgitation peut simplement être une caractéristique du fœtus, mais couplée à une valeur PAPP-A sous-estimée de 0,232 MoM, c'est un marqueur anomalies chromosomiques. Tout le reste est dans la fourchette normale. Ils ont suggéré une biopsie des villosités choriales. J'ai jusqu'à présent refusé, l'infirmière a failli tomber de sa chaise, comme le risque est si élevé et XA n'est pas traité, et à ma place, elle ne penserait même pas une minute. J'ai questionné la généticienne sur l'analyse Panorama (prise de sang maternelle terriblement chère), elle m'a répondu que bien sûr on peut le faire, mais ça n'exclut que 5 CA principaux et quelques très rares, ça ne peut pas complètement exclure les anomalies, et dans ma cas, il est recommandé d'invasion. J'ai déjà lu une tonne d'articles, de questions et tout comme ça sur ce sujet, et je ne comprends tout simplement pas ce qu'ils ont trouvé de si terrible dans mes analyses ? Il s'est avéré que la régurgitation est physiologique à ce moment et disparaît à 18-20 semaines (si elle ne disparaît pas, cela indique un risque de malformations cardiaques, beaucoup disparaissent après l'accouchement, et certaines vivent avec et n'affectent pas Surtout depuis que mon mari a un prolapsus de la valve mitrale, qui a été hérité de ma mère, peut-être que c'est en quelque sorte interconnecté). Les hormones en général peuvent ne pas être indicatives, car. Je prends du duphaston depuis le début de la grossesse, j'ai mangé 2 heures avant l'analyse (il s'avère que vous ne pouvez pas manger 4 heures avant, ils ne m'en ont pas parlé), j'ai bu du café, j'étais nerveux et inquiet pour l'échographie et j'ai peur de donner du sang, et récemment la fatigue chronique , avec l'enfant plus âgé, je me fatigue. Et tout cela affecte les résultats. Le généticien n'a rien demandé de tel, il n'était pas intéressé, ils ont généralement une sorte de chaîne de montage là-bas, et c'était comme si pour des statistiques ils m'avaient poussé là-bas. Mais ils ont semé un peu le doute en moi, j'ai fondu en larmes, j'étais inquiet pour un an à venir. Le mari demande une biopsie. J'ai terriblement peur des conséquences, j'ai peur de perdre ou de blesser l'enfant, surtout s'il est en bonne santé. D'un côté, si tout va bien, je pousserai un soupir de soulagement et renverrai tous les médecins. Par contre, si tout va mal, que faire ? Est-ce que je pourrai interrompre la grossesse, laisser mon enfant se démembrer en moi, surtout maintenant que je pense que je commence à le ressentir. Mais une autre option est de savoir si je peux élever un tel enfant qui a besoin d'une approche particulière et de beaucoup d'attention, alors que parfois vous voulez fuir une fille en parfaite santé ... Merde, toutes ces pensées me rongent. Je ne sais pas quoi faire ... Au cas où, je donnerai les données de dépistage:
Terme B-ty : 13 semaines
Fréquence cardiaque 161 bpm
Canal veineux PI 1.160
Chorion/Planceta bas sur la paroi antérieure
Cordon ombilical 3 vaisseaux
Anatomie du fœtus : tout est déterminé, tout est normal
b-hCG 1,091 MoM
PAPP-A 0,232 MoM
Artère utérine PI 1 240 MoM
Trisomie 21 1:6
Trisomie 18 1:311
Trisomie 13 1:205
Prééclampsie jusqu'à 34 semaines b-ti 1:529
Pré-éclampsie jusqu'à 37 semaines b-ti 1:524
Le diabète est une maladie grave et grave. plage la société moderne. Chaque année, il y a de plus en plus de cas de cette maladie, et le plus triste est qu'elle touche aussi les enfants.
Il est de deux types : SD type 1 et type 2. Le diabète de type 2 touche principalement les personnes âgées ou en surpoids. Leur principal traitement est une alimentation équilibrée et un peu d'activité physique.
Le premier type de diabète est diagnostiqué dans l'enfance ou l'adolescence, lorsque le développement hormonal d'un adolescent est en cours, mais peut-être plus tard. Avec un tel diabète, l'essentiel est des injections d'insuline tous les jours, ainsi qu'une routine stricte et une maîtrise de soi.
Le pancréas du premier type de diabète « s'épuise lentement », la production d'insuline diminue, le glucose pénètre dans le sang en grand nombre et en partie il est excrété par l'urine humaine.

Les médecins doivent tester le sang pour le glucose et l'urine pour établir un diagnostic. L'apparition du diabète sucré de type 1 a certaines conditions préalables ou, plus simplement, des facteurs qui affectent cette maladie. Ces facteurs doivent être connus afin d'éviter la maladie et les complications possibles.
Facteurs contribuant à l'apparition du diabète de type 1

- Hérédité. Si un parent proche (mère, père, frère, sœur), les chances que le bébé tombe malade augmentent de 3 %, et si l'un des parents et une sœur (ou un frère) sont diabétiques, alors le risque augmente de 30 %.
- Obésité. Aux premiers stades de l'obésité, le risque d'apparition de la maladie augmente de trois à cinq fois, et du troisième au quatrième degré, de 10 à 30 fois.
- Athérosclérose des vaisseaux, hypertension. Traitement chirurgical ou une intervention chirurgicale aidera à éviter les complications.
- Pancréatite. Dans la pancréatite chronique, qui dure longtemps dans le corps, des modifications graves et irréversibles apparaissent dans les tissus du pancréas, qui affectent également l'appareil à insuline.
- Les maladies endocriniennes de nature différente inhibent la production d'insuline et déclenchent le processus pathologique.
- Maladies cardiaques. Avec cette pathologie, les médecins recommandent de surveiller strictement la glycémie et de s'adapter au bon mode de vie.
- Mauvaise écologie. Complexe situation écologique, la propagation des virus (varicelle, oreillons, rubéole) à un organisme affaibli perturbe le système immunitaire système et, dans finalement conduire à cette maladie.
- Lieu de résidence. En Suède et en Finlande, ils tombent beaucoup plus souvent malades que dans d'autres pays.
- Course. Les Latino-Américains et les représentants des pays asiatiques ont moins de cas de fixation que les Européens.
- Diète. alimentation précoce lait maternel, des céréales bébé, le manque de vitamine D que les pédiatres appellent un autre facteur de risque supplémentaire pour le phénomène.
- Accouchement tardif, prééclampsie (complications pendant la grossesse).
- Anticorps dans le sang contre les cellules des îlots. Si, en plus du facteur héréditaire, ces anticorps sont présents dans le sang d'une personne, alors il y aura plus de chances de l'obtenir.
- La sclérose en plaques, l'anémie, peuvent être des facteurs supplémentaires dans le développement de la maladie.
- Stress, dépression prolongée. La glycémie augmente brusquement avec des le stress et le corpsà un moment donné, il ne peut pas faire face à une telle charge.
- Vaccination en enfance peut conduire au diabète de type 1.
Vidéo : Facteurs de risque du diabète
Malheureusement, il n'existe pas de remède complet contre le diabète. Le principal traitement est l'insulinothérapie. De nombreux guérisseurs traditionnels recommandent de pratiquer une gymnastique spéciale, qui consiste à sauter à la perche, à courir, à sauter en longueur et contribue à l'élimination optimale des glucides du corps. Et bien sûr, vous devez établir une nutrition adéquate.
Malheureusement, aucune raison évidente de l'apparition n'a été identifiée jusqu'à présent, mais si elle est détectée à un stade précoce et connaissant tous les facteurs de risque de son apparition, à l'avenir, des complications ou même la maladie elle-même peuvent être évitées.
Sincèrement,