Reproduktives und therapeutisches Klonen von Menschen. Klonen aus ärztlicher Sicht
Lesen Sie auch
IN In letzter Zeit In Politik, Wissenschaft und Medien wird rege über die beiden Arten des Klonens, das therapeutische und das reproduktive Klonen, sowie über die sogenannten „Stammzellen“ und ihre Bedeutung für die Weiterentwicklung der modernen Medizin diskutiert.
Was bedeutet das alles aus Sicht eines Spezialisten?
Reproduktives Klonen
Dabei handelt es sich um eine künstliche Reproduktion einer genetisch korrekten Kopie eines beliebigen Lebewesens unter Laborbedingungen. Dolly, das Schaf, geboren am Roslin Institute in Edinburgh, ist ein Beispiel für das erste Klonen eines großen Tieres dieser Art.
Der Prozess ist in mehrere Phasen unterteilt. Zuerst um weiblich Dazu wird eine Eizelle entnommen und mit einer mikroskopischen Pipette der Kern herausgezogen. Dann wird jede Zelle, die die DNA des geklonten Organismus enthält, in die kernlose Eizelle injiziert. Tatsächlich ahmt es die Rolle von Spermien bei der Befruchtung einer Eizelle nach. Von dem Moment an, in dem die Zelle mit der Eizelle verschmilzt, beginnt der Prozess der Zellreproduktion und des Embryowachstums (Schema 1).
In vielen Ländern auf der ganzen Welt, darunter auch im Vereinigten Königreich, ist das reproduktive Klonen von Menschen mit dem Ziel, geklonte Kinder zu zeugen, gesetzlich verboten.
Therapeutisches Klonen
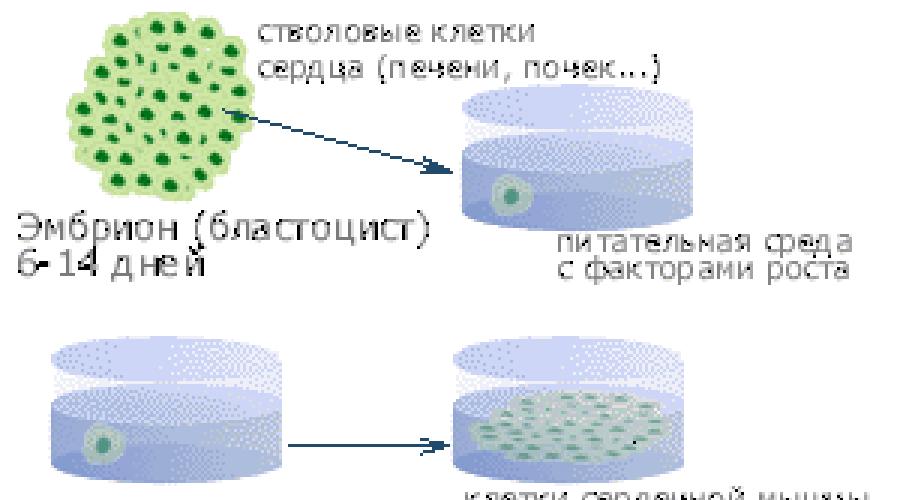
Dabei handelt es sich um das gleiche reproduktive Klonen, allerdings ist die Wachstumsphase des Embryos auf 14 Tage begrenzt, oder, wie Experten sagen, eine „Blastozyste“. Nach zwei Wochen wird der Prozess der Zellreproduktion unterbrochen.
Den meisten Wissenschaftlern zufolge beginnt sich der zentrale Kern in embryonalen Zellen nach 14 Tagen zu entwickeln. Nervensystem und ein Konglomerat von Zellen (Embryo, Blastozyste) sollte bereits als Lebewesen betrachtet werden.
Ein solches Klonen wird nur deshalb als therapeutisch bezeichnet, weil die in den ersten 14 Tagen gebildeten embryonalen Zellen in der Lage sind, sich anschließend in spezifische Gewebezellen einzelner Organe umzuwandeln: Herz, Nieren, Leber, Bauchspeicheldrüse usw. - und in der Medizin zur Behandlung vieler Krankheiten eingesetzt.
Solche Zellen zukünftiger Organe werden „embryonale Stammzellen“ genannt.
Im Vereinigten Königreich ist es Wissenschaftlern gestattet, das therapeutische Klonen zu nutzen und Stammzellenforschung für medizinische Zwecke durchzuführen.
In Russland verwenden viele Wissenschaftler (zum Beispiel der Akademiker der Russischen Akademie der Medizinischen Wissenschaften N.P. Bochkov, Professor V.Z. Tarantul vom Institut für Molekulargenetik) den Ausdruck „therapeutisches Klonen“ nicht gerne und nennen diesen Prozess lieber „Zellreproduktion“. .“
Embryonische Stammzellen
Sie werden in den ersten Tagen der Fortpflanzung im Embryo (Blastozyste) gebildet. Dies sind die Vorfahren der Zellen fast aller Gewebe und Organe eines Erwachsenen.
Sie sind Embryologen seit langem bekannt, aber in der Vergangenheit wurden solche Zellen aufgrund des Mangels an Biotechnologie für ihre Laborkultivierung und -konservierung zerstört (z. B. in Abtreibungskliniken).
In den letzten Jahrzehnten wurde nicht nur die Biotechnologie entwickelt künstliche Produktion durch Klonen embryonaler Stammzellen, schuf aber auch spezielle Nährmedien, um daraus lebendes Gewebe zu züchten.
Zukunftsmedizin - Medizin der „Ersatzteile“
Die Entwicklung vieler Bereiche der Medizin im nächsten Jahrhundert wird auf der Nutzung embryonaler Stammzellen basieren.
Aus diesem Grund wird den Themen des therapeutischen Klonens und der Stammzellforschung für medizinische Zwecke heute in wissenschaftlichen und politischen Kreisen große Aufmerksamkeit geschenkt.
Was sind die praktischen Vorteile?
 Entwicklung der Biotechnologie zur Gewinnung große Mengen Stammzellen werden es Ärzten ermöglichen, viele bisher unheilbare Krankheiten zu behandeln. Zuallererst - Diabetes (insulinabhängig), Parkinson-Krankheit, Alzheimer-Krankheit (senile Demenz), Herzmuskelerkrankungen (Myokardinfarkt), Nierenerkrankungen, Lebererkrankungen, Knochenerkrankungen, Bluterkrankungen und andere.
Entwicklung der Biotechnologie zur Gewinnung große Mengen Stammzellen werden es Ärzten ermöglichen, viele bisher unheilbare Krankheiten zu behandeln. Zuallererst - Diabetes (insulinabhängig), Parkinson-Krankheit, Alzheimer-Krankheit (senile Demenz), Herzmuskelerkrankungen (Myokardinfarkt), Nierenerkrankungen, Lebererkrankungen, Knochenerkrankungen, Bluterkrankungen und andere.
Die neue Medizin wird auf zwei Hauptprozessen basieren: der Züchtung von gesundem Gewebe aus Stammzellen und der Transplantation dieses Gewebes an die Stelle von beschädigtem oder erkranktem Gewebe.
Die Methode zur Schaffung gesunder Gewebe basiert auf zwei komplexen biologischen Prozessen: dem anfänglichen Klonen menschlicher Embryonen bis zum Auftreten von „Stammzellen“ und der anschließenden Kultivierung dieser Zellen sowie der Kultivierung der erforderlichen Gewebe und möglicherweise Organe in Nährmedien.
Professor Vyacheslav Tarantul vom Moskauer Institut für Molekulargenetik der Russischen Akademie der Wissenschaften schlägt sogar vor, ab dem Zeitpunkt der Geburt eines Kindes für jedes Kind eine Stammzellenbank aus embryonalen Zellen (zum Beispiel seiner eigenen Nabelschnur) zu erstellen. . Wenn nach 40-50 Jahren Organe oder Gewebe erkranken oder beschädigt werden, ist es immer möglich, aus dieser Bank einen Ersatz für das beschädigte Gewebe zu züchten, der genetisch völlig identisch mit dieser Person ist. In diesem Fall sind keine fremden Spenderorgane oder Transplantate erforderlich (Schema 2).
Was ist die Gefahr?
Wenn der Prozess der Vermehrung von durch Klonen gewonnenen Zellen (auch zu therapeutischen Zwecken) nicht nach 14 Tagen endet und der Embryo in die Gebärmutter der Frau eingesetzt wird, verwandelt sich dieser Embryo in einen Fötus und anschließend in ein Kind. So kann sich das „therapeutische“ Klonen unter bestimmten Bedingungen in ein „reproduktives“ Klonen verwandeln.
Einige Spezialisten versuchen bereits, die Klon-Biotechnologie zu nutzen, um beispielsweise Unfruchtbarkeit in kinderlosen Familien zu behandeln, indem sie Kinderklone unfruchtbarer Eltern erzeugen (italienischer Professor Severino Antinori, Amerikanischer Professor Panos Zavos und andere).
In Großbritannien wird das reproduktive Klonen von Kindern mit bis zu zehn Jahren Gefängnis bestraft.
), die darin besteht, eine Eizelle (Oozyte) zu entnehmen, deren Kern entfernt wurde, und diesen Kern durch die DNA eines anderen Organismus zu ersetzen. Nach vielen mitotischen Teilungen der Kultur (Kulturmitosen) bildet diese Zelle eine Blastozyste ( frühen Zeitpunkt Embryo, der aus etwa 100 Zellen besteht) mit einer DNA, die fast identisch mit der des ursprünglichen Organismus ist.
Der Zweck dieses Verfahrens besteht darin, Stammzellen zu gewinnen, die genetisch mit dem Spenderorganismus kompatibel sind. Beispielsweise können aus der DNA eines an Parkinson erkrankten Patienten embryonale Stammzellen gewonnen werden, die zur Behandlung der Parkinson-Krankheit eingesetzt werden können und die vom Immunsystem des Patienten nicht abgestoßen werden. Derzeit ist eine solche Therapie in Russland nicht verfügbar und die Entwicklung der Klontechnologie wurde ausgesetzt, bis die Regierung schließlich beschließt, Forschung in diesem Bereich zuzulassen.
Anwendung
Durch therapeutisches Klonen gewonnene Stammzellen werden zur Behandlung vieler Krankheiten eingesetzt. Darüber hinaus befinden sich derzeit eine Reihe von Methoden in der Entwicklung (Behandlung bestimmter Arten von Blindheit, Rückenmarksverletzungen, Parkinson-Krankheit usw.).
Diskussionen über therapeutisches Klonen
Diese Methode löst in der wissenschaftlichen Gemeinschaft häufig Kontroversen aus und der Begriff, der die erzeugte Blastozyste beschreibt, wird in Frage gestellt. Einige glauben, dass es falsch ist, es Blastozyste oder Embryo zu nennen, da es nicht durch Befruchtung entstanden ist, andere argumentieren jedoch, dass es sich unter den richtigen Bedingungen zu einem Fötus und letztendlich zu einem Kind entwickeln kann – daher ist es angemessener Nennen Sie das Ergebnis einen Embryo.
Das Potenzial des therapeutischen Klonens im medizinischen Bereich ist enorm. Einige Gegner des therapeutischen Klonens wenden ein, dass bei dem Verfahren menschliche Embryonen verwendet und diese dabei zerstört werden. Andere meinen, dass ein solcher Ansatz menschliches Leben instrumentalisiert oder dass es schwierig wäre, therapeutisches Klonen zuzulassen, ohne reproduktives Klonen zuzulassen.
Rechtlicher Status der Technologie
Daten aus dem Jahr 2006 zufolge wird das Klonen zu therapeutischen Zwecken in Großbritannien, Belgien und Schweden eingesetzt. Forschung in diesem Bereich ist in Japan, Singapur, Israel und Korea erlaubt.
In vielen anderen Ländern ist das therapeutische Klonen verboten, obwohl die Gesetze ständig diskutiert und geändert werden. Am 8. Dezember 2003 stimmten die UN-Länder gegen ein von Costa Rica vorgeschlagenes Verbot des reproduktiven und therapeutischen Klonens.
Siehe auch
Links
Anmerkungen
Wikimedia-Stiftung. 2010.
Sehen Sie in anderen Wörterbüchern, was „therapeutisches Klonen“ ist:
Inhalt 1 Technologie 2 Ansätze zum Klonen von Menschen ... Wikipedia
Dieser Begriff hat andere Bedeutungen, siehe Klonen. Klonen (in der Biologie) das Auftreten natürlicher oder die Produktion mehrerer genetisch identischer Organismen durch asexuelle (einschließlich vegetative) Fortpflanzung.... ... Wikipedia
Dieser Begriff hat andere Bedeutungen, siehe Klonen. Klonen ist in der Biologie eine Methode zur Gewinnung mehrerer genetisch identischer Organismen durch asexuelle (einschließlich vegetative) Reproduktion. Dolly ist ein weibliches Schaf, zunächst ... Wikipedia
Hauptartikel: Klonen (Biologie) Klonen (englisches Klonen aus dem Griechischen κλών „Zweig, Spross, Nachwuchs“) im allgemeinsten Sinne ist die exakte Reproduktion eines beliebigen Objekts beliebig oft. Objekte, ... ... Wikipedia
Klonen- Beim KLONEN werden genetisch identische Kopien lebender Organismen (oder ihrer Fragmente: Moleküle, Zellen, Gewebe, Organe usw.) erstellt. Der Begriff „K.“ kommt vom griechischen Wort klon, was Zweig, Trieb, Stiel bedeutet. Mit dem Prozess... ... Enzyklopädie der Erkenntnistheorie und Wissenschaftstheorie
Klonen ist in der Biologie eine Methode zur Gewinnung mehrerer identischer Organismen durch asexuelle (einschließlich vegetative) Reproduktion. Der Begriff Klonen kam aus dem Englischen ins Russische. Nachdem er seinen Ton und seine Schreibweise nur geringfügig geändert hatte,... ... Wikipedia
Beim therapeutischen Klonen kommt ein Prozess zum Einsatz, der als somatischer Zellkerntransfer (Zellkerntransfer, Forschungsklonen und Embryonenklonen) bekannt ist und in der Entnahme einer Eizelle (Oozyte) besteht, aus der... ... Wikipedia
Die Anfrage nach „Dolly“ wird hierher weitergeleitet; siehe auch andere Bedeutungen. Dolly das Schaf (englisch Dolly, 5. Juli 1996, 14. Februar 2003) ist das erste geklonte Säugetier, das durch Transplantation des Kerns einer Körperzelle in ... ... Wikipedia gewonnen wurde
Englisch Snuppy-Rasse: Afghanischer Windhund Geschlecht: männlich Geburtsdatum: 24. April 2005 ... Wikipedia
- (englisch Polly und Molly) die ersten geklonten Schafe, denen ein menschliches Gen für eine mögliche Verwendung in der Medizin eingebracht wurde. Zu diesem Zweck wurde eine spezielle von Keith Campbell entwickelte Technologie eingesetzt. Erfolgreiches Klonen war ... Wikipedia
Es gibt drei Arten des Klonens: Genklonen, reproduktives Klonen und therapeutisches Klonen.
Durch das Klonen von Genen werden Kopien von Genen erzeugt. Dies ist die häufigste und häufigste Art des Klonens, die von Forschern des National Human Gene Research Institute (NHRI) durchgeführt wird.
NHH-Forscher haben keine Säugetiere geklont und klonen auch keine Menschen. Typischerweise werden Klonierungstechnologien verwendet, um Kopien der Gene anzufertigen, die untersucht werden sollen. Das Verfahren besteht darin, ein Gen eines Organismus, oft als „fremde DNA“ bezeichnet, in das genetische Material eines Kuriers, einen sogenannten Vektor, einzufügen. Beispiele für Vektoren sind Bakterien, Hefezellen, Viren usw.; sie haben kleine DNA-Kreise. Sobald das Gen eingefügt ist, wird der Vektor Laborbedingungen ausgesetzt, die ihn zur Vermehrung anregen, und schließlich wird das Gen so oft wie nötig kopiert. Das Klonen von Genen wird auch als DNA-Klonen bezeichnet. Dieser Prozess unterscheidet sich stark vom reproduktiven und therapeutischen Klonen.
Beim reproduktiven und therapeutischen Klonen gibt es viele der gleichen Techniken, sie werden jedoch für unterschiedliche Zwecke entwickelt.
Beim therapeutischen Klonen wird ein geklonter Embryo mit dem alleinigen Zweck erzeugt, embryonale Stammzellen mit derselben DNA wie die Spenderzelle zu erzeugen. Diese Stammzellen können in Experimenten zur Erforschung der Krankheit und zur Entwicklung neuer Methoden zur Behandlung der Krankheit verwendet werden.
Die reichhaltigste Quelle embryonaler Stammzellen ist das Gewebe, das in den ersten fünf Tagen nach Beginn der Eizellenteilung gebildet wird. In diesem Entwicklungsstadium, der Blastoidperiode genannt, besteht der Embryo aus einer Gruppe von etwa 100 Zellen, die sich zu jedem Zelltyp entwickeln können. In diesem Entwicklungsstadium werden Stammzellen aus geklonten Embryonen gewonnen, was mit der Zerstörung des Embryos endet, während er sich noch im Reagenzglas befindet. Forscher hoffen, embryonale Stammzellen, die die einzigartige Fähigkeit besitzen, sich in praktisch jeden Zelltyp im Körper umzuwandeln, in einem Labor zu züchten, mit dem gesundes Gewebe gezüchtet werden kann, um beschädigtes Gewebe zu ersetzen. Es ist auch möglich, mehr über die molekularen Ursachen von Krankheiten zu erfahren, indem man embryonale Stammzelllinien aus geklonten Embryonen untersucht, die von Tieren oder Menschen mit verschiedenen Krankheiten stammen.
Viele Wissenschaftler glauben, dass die Stammzellenforschung höchste Aufmerksamkeit verdient, da sie dazu beitragen kann, einen Menschen von vielen Krankheiten zu heilen. Einige Experten befürchten jedoch, dass Stammzellen und Krebszellen in ihrer Struktur sehr ähnlich sind. Und beide Zelltypen haben die Fähigkeit, sich unbegrenzt zu verbreiten, und einige Studien zeigen, dass Stammzellen nach 60 Zellteilungszyklen Mutationen ansammeln können, die zu Krebs führen können. Daher muss die Beziehung zwischen Stammzellen und Krebszellen vollständig verstanden werden, bevor diese Behandlungstechnik angewendet wird.
Darüber hinaus wirft das therapeutische Klonen eine weitere Frage im Zusammenhang mit der Technologie seiner Umsetzung auf. Die derzeit einzig mögliche Technologie ist das Klonen, bei dem ein Klon bis zu einem gewissen Grad in vivo gezüchtet wird. Dies gilt natürlich nicht für den Menschen – eine Frau kann nicht als Brutstätte für therapeutisches Material betrachtet werden. Dieses Problem wird durch die Entwicklung von Geräten für die In-vitro-Züchtung von Embryonen gelöst. Das Problem der „Tötung“ des Embryos bleibt jedoch bestehen. Seit wann wird aus einem Fötus ein Mensch? Es gibt die Meinung, dass ein neuer Mensch im Moment der Empfängnis entsteht (im Falle eines Klons im Moment der Kerntransplantation). In diesem Fall ist die Verwendung des Embryos für die Züchtung von Transplantaten nicht akzeptabel. Dem wird entgegengehalten, dass der Embryo bis zu einem bestimmten Zeitraum nur eine Ansammlung von Zellen, aber keineswegs eine menschliche Persönlichkeit darstelle. Um dieses Problem zu lösen, versuchen Wissenschaftler, so früh wie möglich mit der Arbeit mit dem Embryo zu beginnen.
Gentechnik ist eine stark regulierte Technologie, die heute weitgehend untersucht wird und in vielen Labors auf der ganzen Welt eingesetzt wird. Allerdings werfen sowohl das reproduktive als auch das therapeutische Klonen wichtige ethische Fragen auf, da diese Klontechnologien auf Menschen angewendet werden können.
Durch reproduktives Klonen entstehen Kopien ganzer Tiere.
Es bietet auch die Möglichkeit, eine Person zu erschaffen, die genetisch mit einer anderen Person identisch ist, die einmal existierte oder derzeit existiert. Dies steht in gewissem Maße im Widerspruch zu den seit langem bestehenden religiösen und gesellschaftlichen Werten Menschenwürde. Viele glauben, dass dies gegen alle Grundsätze der individuellen Freiheit und Individualität verstößt. Einige argumentieren jedoch, dass das reproduktive Klonen kinderlosen Paaren dabei helfen könnte, ihren Traum, Eltern zu werden, Wirklichkeit werden zu lassen. Andere sehen im Klonen von Menschen eine Möglichkeit, die Vererbung eines „schädlichen“ Gens zu stoppen. Wir müssen jedoch bedenken, dass bei dieser Art des Klonens dem im Versuchsröhrchen befindlichen Embryo Stammzellen entnommen, also abgetötet werden. Und Gegner argumentieren, dass der Einsatz des therapeutischen Klonens falsch ist, unabhängig davon, ob diese Zellen zum Nutzen kranker oder verletzter Menschen verwendet werden, weil es falsch ist, das Leben eines Menschen zu nehmen, um es einem anderen zu geben.
Therapeutisches Klonen. Moderne Ansätze zur Gewinnung patientenspezifischer embryonaler Stammzelllinien
T. A. Sviridova-Chailakhyan, L. M. Chailakhyan
Institut für Theoretische und Experimentelle Biophysik RAS, Pushchino
Therapeutisches Klonen. Moderne Ansätze zur Gewinnung patientenspezifischer embryonaler Stammzelllinien
T.A. Sviridova-Chailakhyan, \ L.M. Chailakhyan\
Institut für Theoretische und Experimentelle Biophysik, Russische Akademie der Wissenschaften, Puschtschino
Der Aufsatz widmet sich der aktuellen biomedizinischen Richtung in der Zellersatztherapie – dem therapeutischen Klonen, dem universellsten Ansatz zur Gewinnung patientenspezifischer Linien embryonaler Stammzellen (ESCs) mit enormem Potenzial zur Erhaltung und Wiederherstellung der menschlichen Gesundheit. Die Übersicht stellt auch alternative Ansätze und Trends bei der Gewinnung menschlicher ESCs vor, die im Gegensatz zum therapeutischen Klonen noch weit von der klinischen Praxis entfernt sind. Der einzigartige Wert von ESCs für medizinische Zwecke bestimmt den dringenden Bedarf an der Entwicklung des therapeutischen Klonens in unserem Land.
Schlüsselwörter: therapeutisches Klonen, somatische Zellen, Kerntransplantation, embryonale Stammzellen.
Die Übersicht konzentriert sich auf das therapeutische Klonen, das die eigentliche biomedizinische Richtung in der Ersatzzelltherapie darstellt. Therapeutisches Klonen ist ein äußerst universeller Ansatz zur Erzeugung patientenspezifischer embryonaler Stammzelllinien (ESC) mit unbegrenztem Potenzial zur Unterstützung und Wiederherstellung der menschlichen Gesundheit. Es werden auch alternative Ansätze und Tendenzen zur Erzeugung menschlicher ESCs diskutiert, die jedoch im Gegensatz zum therapeutischen Klonen allesamt noch nicht zur klinischen Anwendung geführt haben. Der einzigartige Wert von ESC für medizinische Zwecke erfordert die Entwicklung des therapeutischen Klonens in unserem Land.
Schlüsselwörter: therapeutisches Klonen, somatische Zellen, Kerntransfer, embryonale Stammzellen.
Einführung
Die Grundlage für die Entstehung eines der vielversprechendsten biomedizinischen Trends in der Zellersatztherapie – des therapeutischen Klonens – waren zwei wichtige Entdeckungen des späten 20. Jahrhunderts. Dabei geht es erstens um die Schaffung eines geklonten Schafs Dolly und zweitens um die Produktion embryonaler Stammzellen (ESCs) aus menschlichen Blastozysten und Urkeimzellen. Im ersten Fall wurde für Säugetiere überzeugend gezeigt, dass, wenn der Kern einer somatischen Zelle eines erwachsenen Organismus in eine entkernte Eizelle eingeführt wird, der Kern einer solchen Zelle unter dem Einfluss des Zytoplasmas der Eizelle umprogrammiert wird und ist in der Lage, die Entwicklung eines Embryos (Klons) hervorzurufen, dessen Genom mit dem Genom des Organismus – des Spenders der Kerne – identisch ist. Im zweiten Fall wird gezeigt, wie menschliche ESCs gewonnen und kultiviert werden können. Die Kombination dieser beiden wichtigen Errungenschaften schafft die grundsätzliche Möglichkeit, patientenspezifische ESC-Linien und auf ihrer Grundlage in einer bestimmten Richtung bestimmte Vorläuferzellen (z. B. Zellen der hämatopoetischen Reihe) zu erhalten, die im Wesentlichen die sein werden Zellen des Patienten selbst und vollständig mit ihnen immunkompatibel. Dies ist die Hauptbedeutung und Das Hauptziel Therapeut
Tic-Klonen. Derzeit sind Stammzellen aus Nabelschnurblut und adulte Stammzellen die Hauptquellen für die direkte Gewinnung von Stammzellen für biomedizinische Arbeiten. Beide Quellen haben gravierende Einschränkungen: Nabelschnurblut-Stammzellen sind nur für das Neugeborene autogen, und der Empfang von Stammzellen vom Patienten selbst ist für ihn unsicher. Darüber hinaus besteht allgemeiner Konsens darüber, dass das Differenzierungspotenzial dieser Zellen geringer ist als das von ESCs. Offensichtlich ist die Klontechnologie die universellste und zuverlässigste Quelle zur Gewinnung menschlicher Stammzellen (SC).
Voraussichtlicher therapeutischer Bedarf
Klonen
Man kann mit Sicherheit sagen, dass der vielversprechende Bedarf an therapeutischem Klonen unbegrenzt ist, da dieser Ansatz es ermöglicht, etwas zu schaffen eigene Bank SK-Linien. Da sich diese Zellen schnell vermehren, können sie in beliebiger Menge gewonnen werden. Ein Mensch verfügt im Wesentlichen über einen unbegrenzten Vorrat an eigenen Stamm- und Vorläuferzellen unterschiedlicher Bestimmung.
Email: [email protected]
Wenn wir uns auf moderne Vorstellungen über die große Rolle des natürlichen Stammzellenpools, der mit zunehmendem Alter stark abnimmt, für das normale Funktionieren des menschlichen Körpers stützen, dann ergeben sich daraus enorme Möglichkeiten des therapeutischen Klonens für die Erhaltung und Wiederherstellung der menschlichen Gesundheit während seines Lebens , bei der Überwindung verschiedener Krankheiten und bei der Verlängerung seines aktiven Alters. Die Lebenschancen jedes einzelnen Menschen werden enorm bereichert.
Eine Reihe von Ländern haben inzwischen Gesetze erlassen, die die Forschung mit menschlichen ES erlauben, obwohl die moralischen und ethischen Fragen, die mit der Verwendung menschlicher Embryonen für diesen Zweck verbunden sind, immer noch die hitzigste öffentliche Debatte in der Geschichte der biomedizinischen Wissenschaft auslösen. Typischerweise werden in der reproduktiven Praxis etwa 24 Eizellen von jeder Klientin gewonnen und dann nur zwei bis vier Embryonen für die Einnistung verwendet, in der Hoffnung, dass sich einer von ihnen während der Schwangerschaft normal entwickelt. Viele Embryonen bleiben danach übrig künstliche Befruchtung werden in jedem Fall vernichtet, auch nach jahrelanger Lagerung in Kryobanken. Derzeit stehen weniger als 3 % dieser Embryonen für die Forschung zur Verfügung. Gleichzeitig zeigte eine spezielle Analyse in den USA, Kanada, England, Australien und anderen Ländern, dass die überwiegende Mehrheit der Patientinnen in Reproduktionszentren eine Spende der verbleibenden Eizellen und Embryonen vorziehen würde wissenschaftliche Forschung, auch für den Erhalt von Versicherungskarten.
Vor Kurzem, im März 2009, wurde die Forschung mit menschlichen Embryonen und ESCs für biomedizinische Zwecke in den Vereinigten Staaten mit der Durchführung entsprechender klinischer Studien gesetzlich erlaubt, obwohl Experimente in dieser Richtung tatsächlich bereits 2006 an der Harvard University begannen. Auch in Australien wurden Multimillionen-Dollar-Projekte zur Herstellung geklonter menschlicher Embryonen zur Gewinnung hESCs gestartet. Angesichts dieser Tatsachen besteht kein Zweifel daran, dass das therapeutische Klonen bald weltweit zu einem führenden Trend in der Zellersatztherapie und der biomedizinischen Praxis werden wird. Der einzigartige Wert von ESCs für medizinische Zwecke bestimmt den dringenden Bedarf an der Entwicklung des therapeutischen Klonens in unserem Land. Es liegt auf der Hand, dass die gesetzliche Erlaubnis in Russland, solche Forschungsarbeiten innerhalb bestimmter strenger ethischer Rahmenbedingungen durchzuführen, mittlerweile das wichtigste und dringendste Bedürfnis ist. Es sollte beachtet werden, dass das therapeutische Klonen von Menschen und das reproduktive Klonen in ihren Zielen grundlegend unterschiedliche Richtungen sind, und natürlich sollte das reproduktive Klonen von Menschen aus grundlegenden biologischen Gründen strengstens verboten werden, ganz zu schweigen von den komplexen ethischen, rechtlichen und sozialen Problemen, die sich daraus ergeben.
Weltweite Entwicklungstrends
therapeutisches Klonen
Das enorme Potenzial therapeutischer Klontechnologien wurde bisher in Tiermodellen nachgewiesen. Die ersten Arbeiten zum therapeutischen Klonen wurden im Jahr 2000 veröffentlicht und an Mäusen durchgeführt. Die Arbeit zeigte, dass ESC-Linien geklonter Embryonen aus Zellen mit den gleichen pluripotenten Eigenschaften wie normale Zellen bestehen
ESC. Dann erschienen Dutzende solcher Arbeiten und es wurden erfolgreiche Versuche unternommen, mithilfe der Klontechnologie die bei Versuchstieren bestehenden Pathologien, insbesondere die kombinierte Immunschwäche, zu korrigieren. Damit wurden die ernsthaften Möglichkeiten aufgezeigt, therapeutisches Klonen mit Gentherapie zur erfolgreichen Behandlung verschiedener genetischer Krankheiten zu kombinieren.
Bisher stellen grundlegende wissenschaftliche und technologische Aspekte keine Hindernisse für das therapeutische Klonen dar [14–17]. Und obwohl es weltweit bereits etwa 500 Linien menschlicher ESCs gibt, wurde keine einzige davon mithilfe von Klonierungstechnologien – der Methode der Kerntransplantation – gewonnen. Zwei aufsehenerregende Veröffentlichungen im Science-Magazin im Jahr 2004 und
Die von südkoreanischen Wissenschaftlern im Jahr 2005 durchgeführte Untersuchung einzelner ESC-Linien für 11 schwerkranke Patienten erwies sich als unzuverlässig. Es gibt einen Bericht über die Gewinnung einer patientenspezifischen Linie aus aktivierten parthenogenetischen menschlichen Eizellen, die histokompatible Stammzellen enthalten, für eine Eizellenspenderin – eine potenzielle Patientin, bei deren Behandlung bereits autogene Zellen ohne Immunabstoßungsreaktion eingesetzt werden können. Eine weitere Errungenschaft ist die Herstellung geklonter menschlicher Embryonen mit Fibroblastenkernen, die sich bis zum Blastozystenstadium entwickelt haben, aus denen jedoch keine ESC-Linien erzeugt wurden.
Alternative Ansätze zur Beschaffung
patientenspezifische ESC-Leitungen
Gleichzeitig sucht die Welt aktiv nach alternativen Möglichkeiten, patientenspezifische ESC-Linien für biomedizinische Zwecke zu erhalten. Eine Möglichkeit besteht darin, menschliche Körperzellkerne in tierische Eizellen zu verpflanzen. Das schnell wachsende Interesse am therapeutischen Klonen zur Behandlung verschiedener Krankheiten erfordert die Produktion von ESCs in großen Mengen. Doch selbst unter gesetzlich günstigen Bedingungen wird die Zahl der menschlichen Eizellen und Embryonen dafür immer sehr begrenzt sein und ihre Herstellung wird teuer sein. Der Mangel an menschlichen Eizellen, die für Forschungszwecke benötigt werden, kann durch den Einsatz tierischer Eizellen ausgeglichen werden, die leichter verfügbar sind. Hybride heteroplasmatische Embryonen mit dem menschlichen Genom und gemischtem menschlichem und tierischem Zytoplasma stellen ein attraktives und praktisches Modellsystem zur Lösung vieler grundlegender und praktischer Probleme des therapeutischen Klonens dar. Bei der Durchführung von Forschungsarbeiten ist es strengstens verboten, die resultierenden Hybridembryonen in die Gebärmutter einer Person oder eines Tieres zu implantieren und sie über einen längeren Zeitraum (mehr als 14 Tage) in vitro zu züchten.
Die erste erfolgreiche Arbeit in dieser Richtung stammt von einer Gruppe chinesischer Wissenschaftler, die mithilfe der Methode der Übertragung von Kernen menschlicher Körperzellen (Fibroblasten) in entkernte Eizellen von Kaninchen hybride rekonstruierte Embryonen und anschließend ESC-Linien erhielten. Eine sorgfältige Analyse zeigte, dass diese ESCs phänotypisch den normalen menschlichen ESCs ähneln, einschließlich der Fähigkeit, verschiedene zelluläre Differenzierungen zu durchlaufen. Somit war es möglich, menschliche Stammzelllinien ohne Beteiligung menschlicher Eizellen zu gewinnen. Dieselben Forscher übertrugen dann menschliche Fibroblastenkerne in entkernte Rinderoozyten und zeigten dies
Zelltransplantation und Tissue Engineering Band IV, Nr. 2, 2009
dass in solchen Hybriden eine Neuprogrammierung menschlicher Zellkerne mit entsprechender Aktivierung der embryonalen Genexpression beobachtet wird. Hybridembryonen entwickelten sich bis zu einem späten Präimplantationsstadium, was für die zukünftige Generation von ESCs wichtig ist.
Die Durchführung ähnlicher Studien war in England erlaubt, aber alle Versuche, die Arbeit chinesischer Wissenschaftler zu wiederholen, blieben erfolglos: Es war nicht möglich, die Entwicklung derselben rekonstruierten hybriden Mensch-Tier-Embryonen bis zum Stadium der Produktion von Blastozysten und ESCs durch interspezifische Kerntransplantation zu erreichen . Ähnliche Versuche einer artübergreifenden Zellkerntransplantation beim Menschen in den Vereinigten Staaten blieben ebenfalls erfolglos. Basierend auf einer großen Reihe von Experimenten zum Transfer von Kernen menschlicher Körperzellen (Cumulus) in Eizellen von Menschen und verschiedenen Tieren: Kühen, Kaninchen und Mäusen wurde gezeigt, dass bei Mensch-Tier-Hybriden die entsprechende Neuprogrammierung von Kernen nicht erreicht wird , wie bei geklonten menschlichen Embryonen, bei denen das Genexpressionsmuster fast identisch mit dem normaler menschlicher Embryonen war. Besonders kritisch ist, dass den Hybridembryonen die Expression von Pluripotenzgenen fehlte, die für die Produktion von SCs notwendig sind.
Einer Reihe von Forschern zufolge können Defekte bei der Entwicklung von Mensch-Tier-Hybriden nicht nur mit einer unzureichenden Neuprogrammierung des epigenetischen Status menschlicher Körperkerne, sondern auch mit einer völligen Inkompatibilität des menschlichen Kerngenoms und des tierischen Mitochondriengenoms verbunden sein. Rekonstruierte Hybridembryonen überleben nur kurze Zeit aufgrund menschlicher Mitochondrien, da die Kerne menschlicher Körperzellen normalerweise zusammen mit dem Zytoplasma in die Eizellen des Tieres übertragen werden. Basierend auf all diesen Daten wurde daher der Schluss gezogen, dass tierische Eizellen nicht als Empfänger menschlicher Zellkerne geeignet sind und die Gewinnung menschlicher ES aus solchen Embryonen praktisch unmöglich ist.
Ein weiterer Ansatz zur Schaffung patientenspezifischer pluripotenter Stammzellen besteht darin, die Dedifferenzierung somatischer Zellen mithilfe von ESCs selbst zu induzieren, wie durch somatische Hybridisierung zunächst in Mäusen und dann mit menschlichen ESCs gezeigt wurde. Wenn Stammzellen mit somatischen Zellen fusioniert werden, stellen sie Faktoren bereit, die für die epigenetische Neuprogrammierung des Genoms somatischer Zellen mit der entsprechenden Induktion pluripotenter Eigenschaften und Merkmale erforderlich sind. Die Möglichkeit der Neuprogrammierung der Kerne somatischer Zellen mithilfe von ESC-Extrakt wurde nachgewiesen und es wurden Versuche unternommen, HSC-Chromosomen selektiv zu eliminieren. Allerdings ist die Entfernung aller Chromosomen immer noch technisch schwierig zu erreichen, und die in Betracht gezogene Methode zur Gewinnung von Stammzellen ist es im Allgemeinen auch weit davon entfernt, in die therapeutische Praxis umgesetzt zu werden.
Der vielversprechendste alternative Ansatz zur Generierung patientenspezifischer Linien aus somatischen Zellen für biomedizinische Zwecke ist die Generierung von HSC-ähnlichen Zellen oder induzierten pluripotenten Linien (HSC 0RB). Dies ist eine neue Forschungsrichtung in der Zellersatztherapie, die mit der Arbeit japanischer Wissenschaftler begann
2006 an Mäusen, um Fibroblasten in einen pluripotenten Status umzuprogrammieren. Bald zeigte sich die Möglichkeit einer solchen Transformation.
mation für menschliche Fibroblasten. Die genetische Modifikation von Fibroblasten wurde durch retrovirale Transfektion von vier wichtigen Pluripotenzfaktoren durchgeführt: Ocb3/4, Box2, KH4, c-Myc, und die anschließende Expression dieser Gene induzierte die Neuprogrammierung somatischer Zellen mit einer Rückkehr in den pluripotenten Zustand. Obwohl die Wirksamkeit dieses Ansatzes sehr gering war und auch bekannt ist, dass der Einsatz viraler Vektoren zur Malignität von RB-Zellen führen kann, sorgten diese Arbeiten für Aufsehen. Es folgte eine ganze Reihe von Studien mit Induktionsfaktoren und es wurde aktiv nach anderen Möglichkeiten gesucht, Gene in Körperzellen einzuführen (ohne auf Retroviren zurückzugreifen) und gleichzeitig die Genomveränderung zu minimieren. Infolgedessen wurde die Möglichkeit bei Mäusen gezeigt auf sichere Weise Zellreprogrammierung mithilfe von Transposons und nur einem Faktor K1!4.
Es ist jedoch verfrüht, !RB-Zellen als adäquaten alternativen Ersatz für ESCs für die regenerative Therapie in Betracht zu ziehen. Für biomedizinische Zwecke ist es notwendig, die eigenen Gene der Zellen neu zu programmieren, anstatt neue Kopien hinzuzufügen, und nur therapeutische Klontechnologien bieten eine einzigartige Möglichkeit für eine solche Neuprogrammierung somatischer Zellkerne. Die Reversibilität des Genexpressionsprogramms unter dem Einfluss des Zytoplasmas der Eizelle und die Rückkehr zum Muster der embryonalen Expression in somatischen Spenderkernen ermöglichen es uns derzeit, rekonstruierte menschliche Embryonen als Hauptquelle für die Gewinnung patientenspezifischer ESC-Linien zu betrachten.
Der Stand der Therapieforschung
Klonen in Russland
Trotz des Booms über das große Potenzial von ESCs bei der Behandlung verschiedener Krankheiten wird in Russland praktisch immer noch nicht an therapeutischem Klonen gearbeitet. Dies ist in erster Linie auf den Mangel zurückzuführen Rechtsrahmen zur Durchführung von Forschungsarbeiten mit menschlichen Eizellen und Embryonen. Mit der Verabschiedung solcher Gesetze besteht für Russland eine echte Chance, das therapeutische Klonen sehr schnell zu entwickeln. Unser Land verfügt über wirksame Zelltechnologien zur Gewinnung rekonstruierter Embryonen mittels Kerntransplantation. Im Grunde die Grundlagen moderne Technologien Der Kerntransfer somatischer Zellen, die Kombination von Mikrochirurgie und Elektrofusion wurden hier erstmals in den 80er Jahren des letzten Jahrhunderts entwickelt. Es gibt auch wirksame Technologien zur Gewinnung menschlicher ESC-Linien.
Es ist möglich, die Aufgaben des therapeutischen Klonens auf der Grundlage von Reproduktionszentren umzusetzen, die neben ihrem unmittelbaren Zweck auch Zentren zur Gewinnung von ESC-Linien werden können, und zwar zunächst direkt für Patientinnen dieses Zentrums und deren Mitglieder Familien. Es ist zu erwarten, dass mit der Entwicklung therapeutischer Technologien der Erwerb eigener ESCs für jeden Menschen möglich wird. Es ist eine enge Zusammenarbeit zwischen Reproduktionszentren und relevanten Forschungslabors erforderlich, die sich auf die Lösung grundlegender Probleme und die Entwicklung neuer Technologien konzentrieren. Ähnliche Technologien umfassen die Rekonstruktion von Embryonen mithilfe nicht-invasiver optischer Laser-Mikromanipulationstechniken zum Zweck des therapeutischen Klonens und Ersetzens
Zelltransplantation und Tissue Engineering Band IV, 1U< 2, 2009
Zelltherapie. Die Entwicklung solcher Techniken wird zur Entstehung einer neuen Klasse von Mikromanipulationsgeräten führen, die verschiedene optische Laser-Mikrowerkzeuge (optische Pinzetten, Laserskalpell usw.) mit computergestützter Steuerung kombinieren.
Es ist zu erwarten, dass Russland bei entsprechender konsequenter wissenschaftlicher und organisatorischer Arbeit zur Entwicklung des therapeutischen Klonens in unserem Land in absehbarer Zeit ein ausländisches Niveau in diesem Bereich der biomedizinischen Forschung erreichen kann.
LITERATUR:
1. Wilmut I., Schneider A.E., Chirr J. et al. Lebensfähige Nachkommen, die aus fötalen und erwachsenen Säugetierzellen stammen. Natur. 1ВВУ; 385: BIG-Z.
2. Thomson J.A., Itskovitz-Eldor J., Shapiro S.S. et al. Aus menschlichen Blastozysten gewonnene embryonale Stammzelllinien. Wissenschaft. 1BB8; 282: 1145-U.
3. Shamblott M.J., Axelman J., Wang S. et al. Gewinnung pluripotenter Stammzellen aus kultivierten menschlichen Urkeimzellen. Proz. Natl. Acad. Wissenschaft. USA. 1ВВ8; B5: 13726-31.
4. He Q., Li J., Bettiol E., Jaconi M.E. Embryonale Stammzellen: Neue mögliche Therapie für degenerative Erkrankungen älterer Menschen. J. Gerontol. Ein Biol. Wissenschaft. Med. Wissenschaft. 2GG3; 5B: 27B-87.
5. de Wert G., Mummery C. Menschliche embryonale Stammzellen: Forschung, Ethik und Politik. Summen. Reproduktion. 2GG3; 18: 672-82.
B. Hoffman D.I., Zellman G.L., Fair C.C. et al. Kryokonservierte Embryonen in den Vereinigten Staaten und ihre Verfügbarkeit für Forschungszwecke. Fruchtbar. Steril. 2GG3; 7B: 106W-E.
W. Lyerly A.D., Faden R.R. Embryonische Stammzellen. Bereitschaft, eingefrorene Embryonen für die Stammzellenforschung zu spenden. Wissenschaft. 2GG7; 317:46-7.
B. Nelson E., Mykitiuk R., Nisker J. et al. Einverständniserklärung zur Spende von Embryonen für Forschungszwecke. J. Obstet. Gynäkologie. Dürfen. 2GGB; 30[B]: 824-36.
V. Hug K. Motivation, überschüssige Embryonen für die Stammzellenforschung zu spenden oder nicht: Literaturübersicht. Fruchtbar. Steril. 2GGB; 8B: 263-77.
1G. Provoost V., Pennings G., De Sutter P. et al. „Unfruchtbarkeitspatienten“-Überzeugungen über ihre Embryonen und ihre Dispositionspräferenzen. Hum. Reprod. 200B; 24: 8B6-B05.
11. Hayden E.C. Obama hebt Stammzellenverbot auf. Die Durchführungsverordnung des Präsidenten wird es der US-Forschung an menschlichen embryonalen Stammzellen endlich ermöglichen, zu gedeihen. Natur. 200V; 458: 130.
12. Munsie M.J., Michalska A.E., O'Brien C.M. et al. Isolierung pluripotenter embryonaler Stammzellen aus umprogrammierten somatischen Zellkernen erwachsener Mäuse. Curr. Biol. 2000; 10: B8B-B2.
13. Rideout W.M. 3. Hochedlinder K., Kyba M. et al. Korrektur eines genetischen Defekts durch Kerntransplantation und kombinierte Zell- und Gentherapie. Zelle. 2002; 10B: 17-27.
14.Wobus A M., Boheler K.R. Embryonale Stammzellen: Perspektiven für Entwicklungsbiologie und Zelltherapie. Physiol. Rev. 2005; 85:63578.
15. Trounson A. Die Produktion und gezielte Differenzierung menschlicher embryonaler Stammzellen. Endokr. Rev. 2006; 27: 2 GB – 1 V.
16. Hochedlinger K., Jaenisch R. Kerntransplantation, embryonale Stammzellen und das Potenzial für Zelltherapie. N.Engl. J. von Med. 2003; Z4V[Z]: 275-86.
1HE. Sviridova-Chaylakhyan T.A., Chailakhyan L.M. Rekonstruktion von Mäuseembryonen als adäquates Modell zur Entwicklung der Grundlagen für therapeutisches Klonen. DAN. 2005; 404[Z]: 422 - 4.
18. Hwang W.S., Ryu Y.J., Park J.H. et al. Hinweise auf eine pluripotente menschliche embryonale Stammzelllinie, die aus einer geklonten Blastozyste stammt. Wissenschaft. 2004; 303: 166B-74.
1B. Hwang W.S., Roh S.I., Lee B.C. et al. Patientenspezifische embryonale Stammzellen aus menschlichen SCNT-Blastozysten. Wissenschaft. 2GG5; 308:1777-83.
20. Revazova E.S., Turovets N.A., Kochetkova O.D. et al. Patientenspezifische Stammzelllinien, die aus humanen parthenogenetischen Blastozysten stammen. Klonen und Stammzellen. 2007; E[H]: 4Z2-E.
21. French A.J., Adams C.A., Anderson L.S. et al. Entwicklung menschlicher geklonter Blastozysten nach somatischem Zellkerntransfer mit erwachsenen Fibroblasten. Stammzellen. 2008; 26: 485-VZ.
22. Chen Y., He Z.X., Liu A. et al. Embryonale Stammzelle, die durch Kerntransfer menschlicher Körperkerne in Eizellen von Kaninchen entsteht. Zellauflösung 2003; 13: 251-63.
23. Li F., Cao H., Zhang Q. et al. Aktivierung der humanen embryonalen Genexpression in zytoplasmatischen Hybridembryonen, die zwischen Rinderoozyten und menschlichen Fibroblasten konstruiert wurden. Klonen von Stammzellen. 2008; 10: 2В7-З06.
24. Jingjuan, J., Tonghang, G., Xianhong, T. et al. Experimentelles Klonen von Embryonen durch Kerntransfer zwischen Mensch und Kaninchen.Zool. Res. 2005; 26: 416-21.
25. Vogel, G. Stammzellen: ethische Eizellen, zu einem Preis erhältlich. Wissenschaft. 2006; 313:155.
26. Chung Y., Bischof C.E., Treff N.R. et al. Neuprogrammierung menschlicher Körperzellen mithilfe menschlicher und tierischer Eizellen. Klonen von Stammzellen. 200V; 11. Im Druck. http://www.liebertonline.com/doi/abs/10.108B/clo.200B.0004.
27. John J.S., Lovell-Badge R. Zytoplasmatische Hybridembryonen von Mensch und Tier, Mitochondrien und eine lebhafte Debatte. Nat. Zellbiol. 2007;
Â[Â]: Â88-Â2.
28. Bowles E. J., Lee J. H., Alberio R. et al. Gegensätzliche Auswirkungen von In-vitro-Fertilisation und Kerntransfer auf die Expression von mtDNA-Replikationsfaktoren. Genetik. 2007; 176: 1511-26.
2B. Miller R.A., Ruddle F.H. Pluripotentes Teratokarzinom – Hybride somatischer Thymuszellen. Zelle. 1B76; B: 45-55.
30. Tada M., Takahama Y., Abe K. et al. Kernreprogrammierung somatischer Zellen durch In-vitro-Hybridisierung mit ES-Zellen. Curr. Biol. 2001; 11: 1553-8.
31. Cowan C.A., Atienza J., Melton D.A., Eggan K. Kernreprogrammierung somatischer Zellen nach Fusion mit menschlichen embryonalen Stammzellen. Wissenschaft. 2005; Z0V: 1Z6V-7Z.
32. Yu J., Vodyanik M.A., He P., Slukvin I.I., J.A. Thomson. Menschliche embryonale Stammzellen programmieren myeloische Vorläufer nach der Zell-Zell-Fusion neu. Stammzellen. 2006; 24: 168-76.
33. Do J.T., Scholer H.R. Kerne embryonaler Stammzellen programmieren somatische Zellen neu. Stammzellen. 2004; 22:Â41-Â.
34. Strelchenko N., Kukharenko V., Shkumatov A. et al. Neuprogrammierung menschlicher Körperzellen durch embryonale Stammzellzytoplasten. Reproduktion. Biomed. Online. 2006; 12:107-11.
35. Taranger C.K., Noer A., Sorensen A.L. et al. Induktion von Dedifferenzierung, genomweiter Transkriptionsprogrammierung und epigenetischer Reprogrammierung durch Extrakte aus Karzinom- und embryonalen Stammzellen. Mol. Biol. Zelle. 2005; 16: 5У1В-З5.
36. Matsumura H., Tada M., Otsuji T. et al. Gezielte Chromosomeneliminierung aus ES-somatischen Hybridzellen. Nat. Methoden. 2007; 4:23-5.
37. Matsumura H, Tada T. Zellfusionsvermittelte nukleare Neuprogrammierung somatischer Zellen. Reproduktion. Biomed. Online. 2008; 16:51-6.
38. Takahashi K., Yamanaka S. Induktion pluripotenter Stammzellen aus embryonalen und adulten Fibroblastenkulturen von Mäusen durch definierte Faktoren. Zelle. 2006; 126: 663-76.
ZV. Nakagawa M., Koyanagi M., Tanabe K. et al. Erzeugung induzierter pluripotenter Stammzellen ohne Myc aus Maus- und menschlichen Fibroblasten. Nat. Biotechnologie. 2008; 26: 101-6.
40. Yamanaka S. Strategien und neue Entwicklungen bei der Erzeugung patientenspezifischer pluripotenter Stammzellen. Zellstammzelle. 2007; 1: ZV-4V.
41. Zaehres H., Scholer H.R. Induktion der Pluripotenz: von der Maus zum Menschen. Zelle. 2007; 131:834-5.
42. Nishikawa S.I., Goldstein R.A., Nierras C.R. Das Versprechen menschlicher induzierter pluripotenter Stammzellen für Forschung und Therapie. Nat. Rev. Mol. Zellbiol. 2008; V[V]: U25-V.
43. Lowry W.E., Richter L., Yachechko R. et al. Erzeugung humaninduzierter pluripotenter Stammzellen aus dermalen Fibroblasten. Proz. Natl. Acad. Wissenschaft. U S A. 2008; 105:2BB3-B.
44. Park I.H., Zhao R., West J.A. et al. Umprogrammierung menschlicher Körperzellen zur Pluripotenz mit definierten Faktoren. Natur 2GGB; 451: 141-6.
45. Huangfu D., Osafune K., Maehr R. et al. Induktion pluripotenter Stammzellen aus primären menschlichen Fibroblasten nur mit Oct4 und Sox2. Nat. Biotechnologie. 2008; 26: 126B-75.
46. Aasen T., Raya A., Barrero M.J. et al. Effiziente und schnelle Erzeugung induzierter pluripotenter Stammzellen aus menschlichen Keratinozyten. Nat. Biotechnologie. 2008; 26: 1276-84.
47. Kim J. B., Zaehres H., Wu G. et al. Pluripotente Stammzellen, die aus adulten neuralen Stammzellen durch Reprogrammierung mit zwei Faktoren induziert werden. Natur. 2008; 454: 646 - 50.
48. Feng B., Jiang J., Kraus P. et al. Umprogrammierung von Fibroblasten in induzierte pluripotente Stammzellen mit dem Orphan-Nuclear-Rezeptor Esrrb. Nat. Zellbiol. 200V; 11: 1ВУ - 203.
4B. Kaji K., Norrby K., Paca A. et al. Virusfreie Induktion der Pluripotenz und anschließende Entfernung von Reprogrammierungsfaktoren. Natur. 200V; Im Druck. http://www.nature.com/nature/journal/vaop/ncurrent/abs/nature07864.html.
50. Liu S.V. iPS-Zellen: eine kritischere Überprüfung. Stammzellen-Entw. 2008; 17: ZV1-U.
51. Chailakhyan L.M., Sviridova-Chailakhyan T.A. Zellulartechnik. Wissenschaft in Russland. 2001; 2:10-5.
52. Kiselev S.L., Volchkov P., Filonenko E. et al. Molekular- und Zellbiologie menschlicher embryonaler Stammzelllinien. Molekulare Medizin. 2006; 2:6-11.
53. Karmenyan A., Shakhbazyan A., Sviridova-Chailakhyan T. et al. Einrichtung eines Pikosekunden-Infrarotlasers zur Mikromanipulation früher Säugetierembryonen. In: Inst. of Biophotonics, National Yang-Ming University, Herausgeber. LALS-2GGB. Tagungsband der Internationalen Konferenz zu Laseranwendungen in den Biowissenschaften; 2008 4.–6. Dezember; Taiwan, Taipeh; 2008: 184.
Das Klonen von Lebewesen ist zweifellos der wichtigste technologische und grundlegendste Durchbruch in der Reproduktionsbiologie am Ende des 21. Jahrhunderts. Darüber hinaus können neue Technologien, die immer mehr ihren fantastischen Charakter verlieren, unsere Welt radikal verändern. Oder vielleicht, wie unsere Experten sagten, könnte es sich nur um eine von vielen sogenannten riskanten Technologien handeln. Wissenschaftler glauben, dass dieses Dilemma im Laufe der weiteren wissenschaftlichen Entwicklung des Phänomens sowohl rechtlich als auch ethisch gerechtfertigter moralischer Entscheidungen, die die Menschheit treffen wird, gelöst werden wird, um festzustellen, ob Eingriffe in das menschliche Leben moralisch und rechtlich akzeptabel oder inakzeptabel sind. Das „therapeutische“ Klonen von Menschen ist in der Tat eine legale Möglichkeit, das Verbot des Klonens von Menschen zu umgehen. Wir sprechen von der Schaffung früher Embryonen – einer Art Spendergewebebank für bestimmte Personen. Damit nutzt das amerikanische Unternehmen Advanced Cell Technology Inc. gab im November 2001 das erfolgreiche Klonen eines menschlichen Embryos bekannt. Für das Experiment verwendeten die Wissenschaftler insgesamt 17 weibliche Eier: Nachdem sie ihnen die Kerne entnommen hatten, fügten sie an ihrer Stelle Kerne ein, die aus erwachsenen Hautzellen entlehnt waren. Die drei Eier begannen den normalen Prozess des Wachstums und der Teilung. Als die Embryonen jeweils aus 6 Zellen bestanden, unterbrachen Wissenschaftler ihre weitere Entwicklung, um die entstandenen Zellen für weitere Forschungen zu nutzen. Viele sind von der Aussage überzeugt, dass das menschliche Leben erst dann einen einzigartigen, inhärenten Wert erhält, wenn der Mensch ein Individuum wird. Es gibt einen anderen ähnlichen Standpunkt, der den menschlichen Embryo vom Standpunkt des Wachstums und der Entwicklung aus betrachtet: Der moralische Wert des intrauterinen Lebens nimmt mit dem Verlauf der Schwangerschaft zu und erreicht in seinen späteren Stadien (oder zum Zeitpunkt der Geburt) einen universellen Wert menschliche Ebene. Es ist offensichtlich, dass sich in Übereinstimmung mit biologischen Daten das Bewusstsein, die Denkfähigkeit und die Sinnesfähigkeit in späteren Stadien entwickeln. Der „Implantationsansatz“ erscheint auf den ersten Blick vernünftig. In bestimmten Situationen liegt ein Schwangerschaftsabbruch im öffentlichen Interesse; Schließlich ist es beängstigend zu glauben, dass man Embryonen, die während Experimenten entstanden sind, ob mutiert oder geklont, zum Leben erwecken kann. Zur Rechtfertigung des therapeutischen Klonens werden theologische und utilitaristische Argumente herangezogen. Es wird vorgeschlagen, dass die Gesellschaft gegen die offensichtlichste Gefahr versichert werden sollte: die Einnistung eines geklonten Embryos und damit die Entstehung von Klonkindern. Allerdings sollten Behandlungen für Diabetes, Parkinson-Krankheit, Alzheimer-Krankheit, Krebs, Herzerkrankungen, Arthritis, Verbrennungen und Rückenmarkserkrankungen erlaubt sein. Die Ethik kann das therapeutische Klonen von Menschen nicht rechtfertigen. Erstens kann man keinen Embryo erzeugen, nur damit andere ihn nutzen können. Wenn sich solche Experimente als erfolgreich erweisen, wird außerdem der Bedarf an Embryonen zur Deckung des menschlichen Bedarfs steigen. Darüber hinaus müssen experimentelle Embryonen erzeugt werden, um festzustellen, ob sie einen medizinischen Nutzen haben. Dies gilt sowohl für wissenschaftliche Experimente als auch für die Forschung höchste Qualität. Vorversuche an Tieren sollten fruchtbare und vielversprechende Ergebnisse liefern. Wenn zur Erreichung des Ziels eine Methode eingesetzt wird, die keine Experimente am Menschen erfordert, sollten solche Experimente nicht durchgeführt werden. Bisher werden alle geklonten Tiere entweder mit genetischen Anomalien geboren oder sind nicht in der Lage, gesunde Nachkommen zu zeugen, darüber streiten sich Biologen mögliche Gründe Dies auf den Seiten des Science-Magazins. Mitarbeiter zweier namhafter amerikanischer Forschungszentren untersuchten anhand von Mäusen, was beim Klonen genau im Körper gestört wird. Es stellte sich heraus, dass die DNA der geklonten Mäuse verändert war und nicht ganz dem Normal entsprach. Einige der Gene „schalten sich nicht ein“, wie Wissenschaftler sagen. Es ist zu beachten, dass Stammzellen, die tatsächlich Gegenstand des Interesses von Wissenschaftlern sind, die sich mit der Forschung auf dem Gebiet des therapeutischen Klonens befassen, nur isoliert werden können von einem Embryo, der in seiner Entwicklung das Blastozystenstadium erreicht hat (ungefähr hundert Zellen). ACT-Experten sagen jedoch, dass sich die Affenembryonen, die sie in einem anderen Experiment erzeugt hatten, zum Blastozystenstadium entwickelten. Stammzellen wurden aus Embryonen isoliert und durch ihre Spezialisierung in Neuronen umgewandelt. Berichten zufolge sind diese Neuronen in der Lage, Dopamin und Serotonin zu produzieren, zwei lebenswichtige Hormone, die vom Gehirn produziert werden. In einem Interview mit CNN sagte ACT-Präsident Dr. Michael West, sein Unternehmen sei nicht daran interessiert, Menschen zu klonen, und es habe keinen Menschen geschaffen Embryo für Fortpflanzungszwecke. Ziele. „Wir wollen einfach nur kranken Menschen helfen, die Hilfe brauchen, und das ist die Aufgabe unseres gesamten Zentrums.“
Das ist interessant:
Elektrophorese im Polyacrylamidgel. westlicher Fleck
Die PAGG-Elektrophorese wird verwendet, um Proteine nach Molekulargewicht unter dem Einfluss von zu trennen elektrischer Strom. Als Standardprobe werden Markerproteine mit Molekularmassen von 11-170 kDa verwendet. Um die untersuchten Proteine zu trennen...
Evolutionslehre von J. Lamarck
Im Jahr 1809 wurde die Philosophie der Zoologie des französischen Wissenschaftlers Jean Baptiste Pierre Antoine de Monet Lamarck (1744-1829) veröffentlicht. Diese Arbeit war der erste Versuch, eine Theorie der Evolution der Arten zu erstellen. Es stellte sich als erfolglos heraus. La...
Nekrose
N. ist die häufigste unspezifische Form des Zelltods. Es kann durch schwere Zellschäden infolge von direktem Trauma, Strahlung, toxischen Stoffen, Hypoxie, Zelllyse verursacht werden, die durch ... verursacht wird.