Acide sulfurique. Soufre rhombique
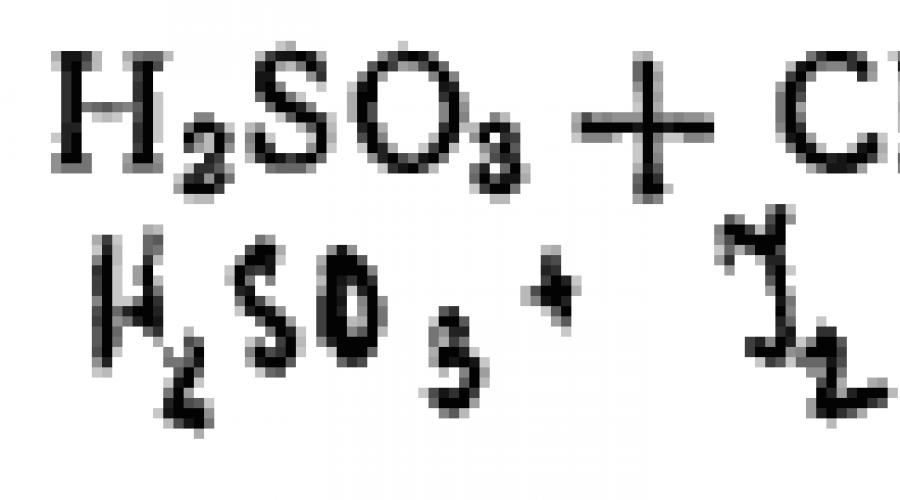
Lire aussi
Le dioxyde de soufre (dioxyde) SO 2 se forme lorsque le soufre est brûlé dans l'air ou l'oxygène. Il est également obtenu par calcination à l'air (« brûlage ») de sulfures métalliques, comme la pyrite de fer :
Selon cette réaction, le dioxyde de soufre est généralement obtenu dans l'industrie (pour d'autres méthodes industrielles d'obtention de SO 2, voir 9 § 131).
Le dioxyde de soufre est un gaz incolore ("dioxyde de soufre") avec une odeur piquante de soufre chaud. Il se condense assez facilement en un liquide incolore bouillant à -10,0°C. Lorsque le SO 2 liquide s'évapore, il y a une forte baisse de température (jusqu'à -50°C).
Le dioxyde de soufre est très soluble dans l'eau (environ 40 volumes dans 1 volume d'eau à 20°C) ; dans ce cas, une réaction partielle avec l'eau se produit et de l'acide sulfureux se forme :
Ainsi, le dioxyde de soufre est l'anhydride de l'acide sulfureux. Lorsqu'il est chauffé, la solubilité du SO 2 diminue et l'équilibre se déplace vers la gauche ; progressivement tout le dioxyde de soufre est à nouveau libéré de la solution.
La molécule de SO 2 est construite de la même manière que la molécule d'ozone. Les noyaux de ses atomes constitutifs forment un triangle isocèle :
Ici, l'atome de soufre, comme l'atome d'oxygène central dans la molécule d'ozone, est à l'état d'hybridation sp 2 et l'angle OSO est proche de 120°. L'orbitale pz de l'atome de soufre, orientée perpendiculairement au plan de la molécule, ne participe pas à l'hybridation. En raison de cette orbitale et des orbitales p z d'atomes d'oxygène orientées de manière similaire, une liaison à trois centres est formée; la paire d'électrons qui la réalise appartient aux trois atomes de la molécule.
Le dioxyde de soufre est utilisé pour produire de l'acide sulfurique, et aussi (en quantité beaucoup plus faible) pour blanchir la paille, la laine, la soie et comme désinfectant (pour tuer les moisissures dans les caves, les caves, les tonneaux de vin, les cuves de fermentation).
L'acide sulfureux H 2 SO 3 est un composé très fragile. Il n'est connu que dans les solutions aqueuses. Lorsqu'on essaie d'isoler l'acide sulfureux, il se décompose en SO 2 et en eau. Par exemple, lorsque l'acide sulfurique concentré agit sur le sulfite de sodium, au lieu de l'acide sulfureux, du dioxyde de soufre est libéré :
Une solution d'acide sulfureux doit être protégée de l'accès à l'air, sinon elle, absorbant l'oxygène de l'air, s'oxyde lentement en acide sulfurique :
L'acide sulfurique est un bon réducteur. Par exemple, les halogènes libres sont réduits par celui-ci en halogénures d'hydrogène :
![]()
Cependant, lorsqu'il interagit avec des agents réducteurs forts, l'acide sulfureux peut jouer le rôle d'agent oxydant. Ainsi, sa réaction avec le sulfure d'hydrogène se déroule essentiellement selon l'équation :

Étant dibasique (K 1 ? 2 10 -2 , K 2 = 6,3 10 -8), l'acide sulfureux forme deux séries de sels. Ses sels moyens sont appelés sulfites, acides - hydrosulfites.
Comme l'acide, les sulfites et les hydrosulfites sont des agents réducteurs. Lorsqu'ils sont oxydés, on obtient des sels d'acide sulfurique.
Les sulfites des métaux les plus actifs se décomposent lors de la calcination avec formation de sulfures et de sulfates (auto-oxydation - réaction d'auto-guérison) :

Les sulfites de potassium et de sodium sont utilisés pour blanchir certains matériaux, dans l'industrie textile lors de la teinture des tissus et en photographie. Une solution de Ca (HSO 3) 2 (ce sel n'existe qu'en solution) est utilisée pour transformer le bois en pâte dite au sulfite, à partir de laquelle le papier est ensuite obtenu.
| <<< Назад
|
Transférer >>> |
Composés soufrés (1U). acide sulfureux
Dans les tétrahalogénures SHal 4, les oxohalogénures SOI Ial 2 et le dioxyde S0 2, l'acide sulfureux 1I 2 S0 3 soufre présente un état d'oxydation de +4. Dans tous ces composés, ainsi que dans leurs complexes anioniques correspondants, l'atome de soufre possède une paire indivise d'électrons. En fonction du nombre de nars électroniques a-liants et non-liants, la forme des molécules de ces composés passe d'un tétraèdre déformé (SHal 4) à une forme angulaire (S0 9) en passant par la forme d'une pyramide trigonale (SOHal 2 et SO3). Les composés S(IV) ont propriétés acides, qui se manifeste dans les réactions d'interaction avec l'eau :
Oxyde de soufre (1U) Le S0 2 , ou dioxyde de soufre, est formé par la combustion du soufre dans l'air ou l'oxygène, ainsi que par la calcination de sulfures, comme la pyrite : 
L'oxydation de la pyrite est à la base du procédé industriel d'obtention du SO 2 . La molécule S0 2 est construite de manière similaire à la molécule Oe et a la structure triangle isocèle avec un atome de soufre au sommet. Longueur Connexions SO est de 0,143 nm et l'angle de liaison est de 119,5° :
L'atome de soufre est dans le 5/? 2 - hybridation. L'orbitale p est orientée perpendiculairement au plan de la molécule et ne participe pas à l'hybridation (Fig. 25.2). En raison de cela et d'autres orbitales p d'atomes d'oxygène orientées de manière similaire, une liaison n à trois centres est formée.

Riz. 25.2.
À conditions normales l'oxyde de soufre (IV) est un gaz incolore avec une odeur piquante caractéristique. Dissolvons bien dans l'eau. Les solutions aqueuses sont acides, car S0 2, en interaction avec l'eau, forme de l'acide sulfureux H 2 S0 3. La réaction est réversible :

Un trait caractéristique de S0 2 est sa dualité redox. Cela s'explique par le fait que dans SO. ; le soufre a un état d'oxydation de +4, et donc il peut, en donnant deux électrons, être oxydé en S (VI), et en recevant quatre électrons, il peut être réduit en S. La manifestation de ces propriétés et d'autres dépend de la nature du composant réactif. Ainsi, avec des agents oxydants puissants, le SO 2 se comporte comme un agent réducteur typique. Par exemple, les halogènes sont réduits en halogénures d'hydrogène correspondants, et S(IV) se transforme généralement en S(VI) :
En présence d'agents réducteurs forts, le S0 2 se comporte comme un agent oxydant :
Il se caractérise également par une réaction de dismutation :
SQ, est oxyde d'acide, facilement soluble dans l'eau (1 volume de H 2 0 dissout 40 volumes de S0 2). Une solution aqueuse de SO v est acide et est appelée acide sulfureux. Habituellement, la majeure partie du S0 2 dissous dans l'eau est en solution sous forme hydratée de S0 2 azH 2 0, et seule une petite partie de S0 2 interagit avec l'eau selon le schéma
L'acide sulfureux, en tant que dibasique, forme deux types de sels: moyen - sulfites (Na 2 S0 3) et acide - hydrosulfites (NaHS0 3). H 2 S0 3 existe sous deux formes tautomères (Fig. 25.3).

Riz. 25.3.Structure des formes tautomères H 2 S0 3
Puisque le soufre dans l'acide sulfureux a un état d'oxydation de +4, il présente, comme S0 2, les propriétés à la fois d'un agent oxydant et d'un agent réducteur, comme déjà mentionné, donc l'acide sulfureux duplique complètement les propriétés de S0 9 dans l'oxydo-réduction réactions.
Les sels de H 2 S0 3 (sulfites) ont les propriétés à la fois d'agents oxydants et réducteurs. Ainsi, l'ion SO 2 passe facilement dans l'ion SO 2, montrant de fortes propriétés réductrices, par conséquent, dans les solutions, les sulfites sont progressivement oxydés par l'oxygène moléculaire, se transformant en sels d'acide sulfurique :

En présence d'agents réducteurs forts, les sulfites se comportent comme des agents oxydants. Sous un fort chauffage, les sulfites des métaux les plus actifs se décomposent à 600°C pour former des sels H2SO^ et H2S, c'est-à-dire une disproportion se produit.
Parmi les sels d'acide sulfureux, seuls les sels des 5 éléments du groupe I, ainsi que les hydrosulfites du type Me 2+ (HS0 3) 2 sont dissous.
Le H 2 S0 3 étant un acide faible, l'action des acides sur les sulfites et les hydrosulfites se traduit par la libération de S0 2 qui est habituellement utilisé pour obtenir du S0 2 en laboratoire :
Les sulfites solubles dans l'eau sont facilement hydrolysés, ce qui entraîne une augmentation de la concentration des ions OH dans la solution :
Lors du passage de S0 2 dans des solutions aqueuses d'hydrosulfites, il se forme des pyrosulfites :

Si une solution de Na 2 S0 3 est bouillie avec de la poudre de soufre, du thiosulfate de sodium se forme. Dans les thiosulfates, les atomes de soufre sont en deux divers degrés oxydation - +6 et -2 : 
L'ion thiosulfate résultant correspond à l'acide H 2 S 2 0 3, appelé acide thiosulfurique. L'acide libre est instable dans des conditions normales et se décompose facilement :

Les propriétés des thiosulfates sont dues à la présence de et en eux, de plus
la présence de S détermine les propriétés réductrices de l'ion S 2 0 3 _ :
Des agents oxydants plus faibles oxydent le thiosulfate de sodium en sels d'acide tétrathionique. Un exemple est l'interaction avec l'iode :
Cette réaction est largement utilisée en chimie analytique, car elle est à la base de l'une des méthodes les plus importantes d'analyse volumétrique, appelée iodométrie.
thiosulfates métaux alcalins produits dans l'industrie à grande échelle. Parmi eux valeur la plus élevée contient du thiosulfate de sodium Na 2 S 2 0 3, qui est utilisé en médecine comme antidote contre l'empoisonnement aux halogènes et au cyanure. L'action de ce médicament repose sur sa capacité à libérer du soufre qui, par exemple, avec les ions cyanure CN forme un ion rhodanure moins toxique SCN :
Le médicament peut également être utilisé en cas d'intoxication par des composés As, Pb, Hg, car des sulfures non toxiques se forment dans ce cas. Na 2 S 2 0 3 est utilisé pour les maladies allergiques, l'arthrite, la névralgie. Une réaction caractéristique de Na 2 S 2 0 3 est son interaction avec AgN0 3 : un précipité se forme couleur blanche Ag. ; S. ; 0 3 , qui au fil du temps sous l'influence de la lumière et de l'humidité vire au noir avec la libération d'Ag 2 S :

Ces réactions sont utilisées pour la détection qualitative de l'ion thiosulfate.
Le chlorure de thionyle SOCl 2 est obtenu en faisant réagir S0 2 avec PC1 5 :
La molécule SOCl 2 a une structure pyramidale (Fig. 25.4). Les liaisons avec le soufre sont formées par un ensemble d'orbitales, qui peuvent être très grossièrement considérées comme $/? 3 - hybride. L'un d'eux est occupé par une seule paire d'électrons, donc SOCl 2 peut présenter les propriétés d'une base de Lyois faible.

Riz. 25.4.
S () C1 2 - liquide fumant incolore à odeur piquante, s'hydrolyse en présence de traces d'humidité :
Les composés volatils formés au cours de la réaction sont facilement éliminés. Par conséquent, SOCl 2 est souvent utilisé pour obtenir des chlorures anhydres :
SOCl 2 est largement utilisé comme agent de chloration en synthèse organique.
DÉFINITION
anhydre acide sulfurique est un liquide lourd et visqueux qui est facilement miscible à l'eau dans n'importe quelle proportion : l'interaction est caractérisée par un effet exothermique exceptionnellement important (~880 kJ/mol à dilution infinie) et peut conduire à une ébullition explosive et à des éclaboussures du mélange si l'eau est ajouté à l'acide; c'est pourquoi il est si important de toujours utiliser l'ordre inverse dans la préparation des solutions et d'ajouter l'acide à l'eau, lentement et en agitant.
Certaines propriétés physiques de l'acide sulfurique sont données dans le tableau.
Le H 2 SO 4 anhydre est un merveilleux composé avec une permittivité et une conductivité électrique très élevée, qui est due à l'autodissociation ionique (autoprotolyse) du composé, ainsi qu'au mécanisme de conduction relais-race avec transfert de protons, qui assure le flux courant électriqueà travers un liquide visqueux avec un grand nombre de liaisons hydrogène.
Tableau 1. Propriétés physiques acide sulfurique.
Obtenir de l'acide sulfurique
Acide sulfurique- le produit chimique industriel le plus important et le moins cher produit en grand volume acides dans n'importe quel pays du monde.
L'acide sulfurique concentré ("huile de vitriol") a d'abord été obtenu en chauffant du "vitriol vert" FeSO 4 × nH 2 O et passé dans en grand nombre pour obtenir Na 2 SO 4 et NaCl.
À processus moderne Pour la production d'acide sulfurique, un catalyseur constitué d'oxyde de vanadium (V) avec l'ajout de sulfate de potassium sur un support de dioxyde de silicium ou de kieselguhr est utilisé. Le dioxyde de soufre SO 2 est obtenu en brûlant du soufre pur ou en grillant du minerai sulfuré (principalement de la pyrite ou des minerais de Cu, Ni et Zn) lors de l'extraction de ces métaux. Ensuite, le SO 2 est oxydé en trioxyde, puis l'acide sulfurique est obtenu par dissolution dans l'eau :
S + O 2 → SO 2 (ΔH 0 - 297 kJ / mol);
SO 2 + ½ O 2 → SO 3 (ΔH 0 - 9,8 kJ / mol);
SO 3 + H 2 O → H 2 SO 4 (ΔH 0 - 130 kJ / mol).
Propriétés chimiques de l'acide sulfurique
L'acide sulfurique est un acide dibasique fort. Dans un premier temps, dans des solutions peu concentrées, il se dissocie presque totalement :
H 2 SO 4 ↔H + + HSO 4 -.
Dissociation au deuxième étage
HSO 4 - ↔H + + SO 4 2-
progresse dans une moindre mesure. La constante de dissociation de l'acide sulfurique dans la deuxième étape, exprimée en termes d'activité ionique, K 2 = 10 -2.
En tant qu'acide dibasique, l'acide sulfurique forme deux séries de sels : moyen et acide. Les sels moyens de l'acide sulfurique sont appelés sulfates et les sels acides sont appelés hydrosulfates.
L'acide sulfurique absorbe avidement la vapeur d'eau et est donc souvent utilisé pour sécher les gaz. La capacité d'absorption de l'eau explique également la carbonisation de nombreuses substances organiques, notamment celles appartenant à la classe des glucides (fibres, sucre, etc.), lorsqu'elles sont exposées à l'acide sulfurique concentré. L'acide sulfurique élimine l'hydrogène et l'oxygène des glucides, qui forment de l'eau, et le carbone est libéré sous forme de charbon.
L'acide sulfurique concentré, particulièrement chaud, est un agent oxydant vigoureux. Il oxyde HI et HBr (mais pas HCl) en halogènes libres, le charbon en CO 2 , le soufre en SO 2 . Ces réactions sont exprimées par les équations :
8HI + H 2 SO 4 \u003d 4I 2 + H 2 S + 4H 2 O;
2HBr + H 2 SO 4 \u003d Br 2 + SO 2 + 2H 2 O;
C + 2H 2 SO 4 \u003d CO 2 + 2SO 2 + 2H 2 O;
S + 2H 2 SO 4 \u003d 3SO 2 + 2H 2 O.
L'interaction de l'acide sulfurique avec les métaux se déroule différemment selon sa concentration. L'acide sulfurique dilué s'oxyde avec son ion hydrogène. Par conséquent, il n'interagit qu'avec les métaux qui se trouvent dans la série de tensions uniquement jusqu'à l'hydrogène, par exemple :
Zn + H 2 SO 4 \u003d ZnSO 4 + H 2.
Cependant, le plomb ne se dissout pas dans l'acide dilué car le sel de PbSO 4 résultant est insoluble.
L'acide sulfurique concentré est un agent oxydant dû au soufre (VI). Il oxyde les métaux dans la série de tension jusqu'à et y compris l'argent. Les produits de sa réduction peuvent être différents selon l'activité du métal et les conditions (concentration en acide, température). Lors de l'interaction avec des métaux peu actifs, tels que le cuivre, l'acide est réduit en SO 2 :
Cu + 2H 2 SO 4 \u003d CuSO 4 + SO 2 + 2H 2 O.
Lorsqu'ils interagissent avec des métaux plus actifs, les produits de réduction peuvent être à la fois du dioxyde et du soufre libre et du sulfure d'hydrogène. Par exemple, lors de l'interaction avec le zinc, des réactions peuvent se produire :
Zn + 2H 2 SO 4 \u003d ZnSO 4 + SO 2 + 2H 2 O;
3Zn + 4H 2 SO 4 = 3ZnSO 4 + S↓ + 4H 2 O;
4Zn + 5H 2 SO 4 \u003d 4ZnSO 4 + H 2 S + 4H 2 O.
L'utilisation de l'acide sulfurique
L'utilisation de l'acide sulfurique varie d'un pays à l'autre et d'une décennie à l'autre. Ainsi, par exemple, aux États-Unis, le principal domaine de consommation de H 2 SO 4 est la production d'engrais (70%), suivi de la production chimique, de la métallurgie, du raffinage du pétrole (~ 5% dans chaque domaine). Au Royaume-Uni, la répartition de la consommation par industrie est différente : seuls 30 % du H 2 SO 4 produit sont utilisés dans la production d'engrais, mais 18 % vont aux peintures, pigments et intermédiaires de teinture, 16 % à la production chimique, 12 % savonner et détergents, 10 % pour la production de fibres naturelles et artificielles et 2,5 % pour la métallurgie.
Exemples de résolution de problèmes
EXEMPLE 1
| Exercer | Déterminer la masse d'acide sulfurique pouvant être obtenue à partir d'une tonne de pyrite si le rendement en oxyde de soufre (IV) dans la réaction de torréfaction est de 90 % et en oxyde de soufre (VI) dans l'oxydation catalytique du soufre (IV) est de 95 % du théorique. |
| La solution | Écrivons l'équation de réaction pour la cuisson de la pyrite : 4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2. Calculez la quantité de substance pyrite: n(FeS 2) = m(FeS 2) / M(FeS 2); M (FeS 2) \u003d Ar (Fe) + 2 × Ar (S) \u003d 56 + 2 × 32 \u003d 120 g / mol; n (FeS 2) \u003d 1000 kg / 120 \u003d 8,33 kmol. Étant donné que dans l'équation de réaction, le coefficient du dioxyde de soufre est deux fois plus grand que le coefficient du FeS 2, la quantité théoriquement possible de substance d'oxyde de soufre (IV) est : n (SO 2) théor \u003d 2 × n (FeS 2) \u003d 2 × 8,33 \u003d 16,66 kmol. Et pratiquement la quantité de mole d'oxyde de soufre (IV) obtenue est de : n (SO 2) pratique \u003d η × n (SO 2) théorie ou \u003d 0,9 × 16,66 \u003d 15 kmol. Écrivons l'équation de réaction pour l'oxydation de l'oxyde de soufre (IV) en oxyde de soufre (VI): 2SO 2 + O 2 \u003d 2SO 3. La quantité théoriquement possible de substance d'oxyde de soufre (VI) est : n(SO 3) théorie ou \u003d n (SO 2) pratique \u003d 15 kmol. Et pratiquement la quantité de mole d'oxyde de soufre (VI) obtenue est de : n(SO 3) pratique \u003d η × n (SO 3) théorie ou \u003d 0,5 × 15 \u003d 14,25 kmol. Nous écrivons l'équation de réaction pour la production d'acide sulfurique : SO 3 + H 2 O \u003d H 2 SO 4. Trouvez la quantité de substance acide sulfurique: n (H 2 SO 4) \u003d n (SO 3) pratique \u003d 14,25 kmol. Le rendement de la réaction est de 100 %. La masse d'acide sulfurique vaut : m (H 2 SO 4) \u003d n (H 2 SO 4) × M (H 2 SO 4); M(H 2 SO 4) = 2×Ar(H) + Ar(S) + 4×Ar(O) = 2×1 + 32 + 4×16 = 98 g/mol ; m (H 2 SO 4) \u003d 14,25 × 98 \u003d 1397 kg. |
| Réponse | La masse d'acide sulfurique est de 1397 kg |
acide sulfureux- acide inorganique dibasique instable de force moyenne. Correspond à l'état d'oxydation du soufre +4. Formule chimique .
Propriétés chimiques
Acide de force moyenne :
N'existe qu'en solutions aqueuses diluées (non isolées à l'état libre) :
Les solutions de H 2 SO 3 ont toujours une forte odeur spécifique de SO 2 non lié chimiquement par l'eau.
Comme le dioxyde de soufre, l'acide sulfureux et ses sels sont de puissants réducteurs :
Lorsqu'il interagit avec des agents réducteurs encore plus puissants, il peut jouer le rôle d'agent oxydant :
Réaction qualitative aux ions sulfite - décoloration d'une solution de permanganate de potassium :
Application
L'acide sulfureux et ses sels sont utilisés comme agents réducteurs pour le blanchiment de la laine, de la soie et d'autres matériaux qui ne supportent pas le blanchiment avec des agents oxydants puissants (chlore). L'acide sulfurique est utilisé dans la conservation des fruits et légumes. L'hydrosulfite de calcium (liqueur de sulfite, Ca (HSO 3) 2) est utilisé pour transformer le bois en cellulose dite au sulfite (une solution d'hydrosulfite de calcium dissout la lignine, une substance qui lie les fibres de cellulose, à la suite de quoi les fibres sont séparées les unes des autres autre ; le bois ainsi traité est utilisé pour recevoir du papier).
Donnez votre avis sur l'article "Acide sulfureux"
Littérature
- Encyclopédie chimique / Ed. : Knunyants I.L. et autres - M.: Encyclopédie soviétique, 1995. - V. 4 (Pol-Three). - 639 p. - ISBN 5-82270-092-4.
Un extrait caractérisant l'acide sulfureux
- À présent. - Es-tu prête, maman ?- Il suffit d'épingler le courant.
"Ne le fais pas sans moi", a crié Natasha: "tu ne pourras pas!"
- Ouais, dix.
Il fut décidé d'être au bal à dix heures et demie, et Natasha devait encore s'habiller et passer au Jardin de Tauride.
Après avoir fini ses cheveux, Natasha, en jupe courte, sous laquelle des chaussures de bal étaient visibles, et dans le chemisier de sa mère, a couru vers Sonya, l'a examinée puis a couru vers sa mère. Tournant la tête, elle épingla le courant, et, ayant à peine le temps d'embrasser ses cheveux gris, elle courut de nouveau vers les filles qui ourlaient sa jupe.
L'étui était derrière la jupe de Natasha, qui était trop longue ; il était ourlé par deux filles, mordant les fils à la hâte. Une troisième, des épingles aux lèvres et aux dents, courut de la comtesse à Sonya ; le quatrième tenait toute la robe enfumée haut la main.
- Mavrusha, plutôt, colombe!
- Donnez-moi un dé à coudre de là, jeune fille.
– Sera-ce bientôt ? - dit le comte en entrant par derrière la porte. « Voici les esprits. Peronskaya attendait déjà.
"C'est prêt, jeune fille", dit la bonne, soulevant une robe fumée ourlée avec deux doigts et soufflant et secouant quelque chose, exprimant par ce geste la conscience de la légèreté et de la pureté de ce qu'elle tenait.
Natasha a commencé à mettre une robe.
« Allons, allons, ne pars pas, papa », cria-t-elle à son père qui ouvrit la porte, toujours sous le voile d'une jupe qui lui couvrait tout le visage. Sonya a fermé la porte. Une minute plus tard, le comte a été autorisé à entrer. Il était en habit bleu, bas et chaussures, parfumé et pommade.
- Oh, papa, tu es si bon, ma belle ! - dit Natasha, debout au milieu de la pièce et redressant les plis de fumée.
"Excusez-moi, jeune fille, excusez-moi", dit la fille en s'agenouillant, en tirant sur sa robe et en tournant les épingles d'un côté à l'autre de sa bouche.
- Votre volonté ! - Sonya cria de désespoir dans sa voix, en regardant la robe de Natasha, - ta volonté, encore longtemps !
Natasha s'écarta pour regarder autour d'elle dans la glace à vinaigrette. La robe était longue.
"Par Dieu, madame, rien n'est long", a déclaré Mavrusha, qui rampait sur le sol après la jeune femme.
"Eh bien, c'est long, alors nous allons le balayer, nous le balayerons dans une minute", a déclaré Dunyasha résolue, sortant une aiguille d'un mouchoir sur sa poitrine et se remettant au travail sur le sol.
A ce moment, timidement, d'un pas tranquille, la comtesse entra dans sa toque et sa robe de velours.
- Ouah! ma beauté! cria le comte, mieux que vous tous ! Il voulut la serrer dans ses bras, mais elle s'éloigna en rougissant pour ne pas reculer.
"Maman, plus du côté du courant," dit Natasha. - Je vais le couper, et je me suis précipité en avant, et les filles qui ourlaient, qui n'ont pas eu le temps de se précipiter après elle, ont arraché un morceau de fumée.
- Mon Dieu! Qu'est-ce que c'est? Je ne la blâme pas...
"Rien, je remarque, vous ne verrez rien", a déclaré Dunyasha.
- Beauté, ma chérie ! - dit la nounou qui est entrée par derrière la porte. - Et Sonyushka, eh bien, les beautés! ...
A onze heures et quart, nous montâmes enfin dans les voitures et partîmes. Mais encore fallait-il s'arrêter au Jardin de Tauride.
Peronskaya était déjà prête. Malgré sa vieillesse et sa laideur, exactement la même chose s'est produite avec elle qu'avec les Rostov, mais pas avec une telle hâte (pour elle, c'était une chose habituelle), mais son vieux corps laid était également parfumé, lavé, poudré, aussi soigneusement lavé derrière les oreilles. , et même, et tout comme chez les Rostov, la vieille fille admirait avec enthousiasme la tenue de sa maîtresse lorsqu'elle entra dans le salon dans une robe jaune avec un chiffre. Peronskaya a fait l'éloge des toilettes des Rostov.
Les Rostov ont fait l'éloge de son goût et de sa tenue vestimentaire et, prenant soin de leurs cheveux et de leurs robes, à onze heures, ils sont montés dans les voitures et sont partis.
Natasha n'avait pas eu un instant de liberté depuis le matin de ce jour-là, et n'avait jamais eu le temps de penser à ce qui l'attendait.
Dans l'air humide et froid, dans l'obscurité exiguë et incomplète de la calèche qui se balance, elle imagine pour la première fois avec vivacité ce qui l'attend là-bas, au bal, dans les salles illuminées - musique, fleurs, danses, souverain, tous les brillants jeunesse de Saint-Pétersbourg. Ce qui l'attendait était si merveilleux qu'elle n'y croyait même pas : c'était tellement incompatible avec l'impression de froid, d'encombrement et d'obscurité de la voiture. Elle ne comprit tout ce qui l'attendait que lorsque, après avoir longé le drap rouge de l'entrée, elle entra dans le couloir, enleva son manteau de fourrure et marcha à côté de Sonya devant sa mère entre les fleurs le long des escaliers illuminés. Ce n'est qu'alors qu'elle se rappela comment elle devait se comporter au bal et essaya d'adopter cette manière majestueuse qu'elle jugeait nécessaire pour une fille au bal. Mais heureusement pour elle, elle sentait que ses yeux s'écarquillaient : elle ne voyait rien clairement, son pouls battait cent fois par minute, et le sang se mettait à battre dans son cœur. Elle ne pouvait adopter la manière qui l'eût rendue ridicule, et elle marchait, mourant d'excitation et ne cherchant de toutes ses forces que de la cacher. Et c'était la manière même qui lui allait le plus. Devant et derrière eux, parlant à voix basse et aussi en robe de bal, les invités entrèrent. Les miroirs de l'escalier reflétaient les dames en blanc, bleu, robes roses, avec diamants et perles sur mains ouvertes et cous.
Acide sulfurique H 2 SO 4 est l'un des acides dibasiques forts. A l'état dilué, il oxyde presque tous les métaux sauf l'or et le platine. Réagit violemment avec les non-métaux et matière organique, transformant certains d'entre eux en charbon. Lors de la préparation d'une solution d'acide sulfurique, il faut toujours l'ajouter à l'eau, et non l'inverse, pour éviter les éclaboussures d'acide et l'eau bouillante. A 10 °C, il durcit, formant une masse vitreuse transparente. Lorsqu'il est chauffé, l'acide sulfurique à 100 % perd facilement de l'anhydride sulfurique (trioxyde de soufre SO 3) jusqu'à ce que sa concentration soit de 98 %. C'est dans cet état qu'il est généralement utilisé dans les laboratoires. A l'état concentré (anhydre), l'acide sulfurique est un liquide incolore, fumant dans l'air (à cause des vapeurs), huileux avec une odeur caractéristique (point d'ébullition = 338°C). C'est un oxydant très puissant. Cette substance a toutes les propriétés des acides :
Propriétés chimiques acide sulfurique
H 2 SO 4 + Fe → FeSO 4 + H 2;
2H 2 SO 4 + Cu → CuSO 4 + SO 2 + 2H 2 O - dans ce cas, l'acide est concentré.
H2SO4 + CuO → CuSO4 + H2O
La solution résultante de couleur bleue- CuSO 4 - solution vitriol bleu. L'acide sulfurique est aussi appelé huile de vitriol, puisque le vitriol se forme lors des réactions avec les métaux et leurs oxydes. Par exemple, lors d'une réaction chimique avec du fer (Fe), une solution vert clair de sulfate ferreux se forme.
Réaction chimique avec des bases et des alcalis (ou réaction de neutralisation)
H2SO4 + 2NaOH → Na2SO4 + 2H2O
acide sulfureux(ou plus exactement, une solution de dioxyde de soufre dans l'eau) forme deux types de sels : sulfites et hydrosulfites. Ces sels sont des agents réducteurs.
H 2 SO 4 + NaOH → NaHSO 3 + H 2 O - cette réaction se déroule avec un excès acide sulfureux
H 2 SO 4 + 2NaOH → Na 2 SO 3 + 2H 2 O - et cette réaction se déroule avec un excès d'hydroxyde de sodium
acide sulfureux a un effet blanchissant. Tout le monde sait ça action similaire a aussi de l'eau chlorée. Mais la différence réside dans le fait que, contrairement au chlore, le dioxyde de soufre ne détruit pas les colorants, mais forme avec eux des composés chimiques incolores !
En plus du principal propriétés des acides acide sulfureux capable de décolorer une solution de permanganate de potassium selon l'équation suivante :
5H 2 SO 3 + 2KMnO 4 → 2 H 2 SO 4 + 2MnSO 4 + K 2 SO 4 + H 2 O
Dans cette réaction, une solution rose pâle se forme, constituée de sulfates de potassium et de manganèse. La couleur est due au sulfate de manganèse.
acide sulfureux capable de décolorer le brome
H 2 SO 3 + Br 2 + H 2 O → H 2 SO 4 + 2HBr
Dans cette réaction, une solution se forme, constituée immédiatement de 2 acides forts : sulfurique et brome.
Si vous stockez de l'acide sulfureux en présence d'air, cette solution s'oxyde et se transforme en acide sulfurique.
2H 2 SO 3 + O 2 → 2H 2 SO 2