Réseau cristallin ionique. Types de réseaux cristallins
Lire aussi
La plupart des substances se caractérisent par la capacité, selon les conditions, d'être dans l'un des trois états d'agrégation : solide, liquide ou gazeux.
Par exemple, l'eau à pression normale dans la plage de température de 0 à 100 o C est un liquide, à des températures supérieures à 100 o C, elle ne peut exister qu'à l'état gazeux et à des températures inférieures à 0 o C, c'est un solide.
Les substances à l'état solide font la distinction entre amorphe et cristallin.
Une caractéristique des substances amorphes est l'absence de point de fusion clair: leur fluidité augmente progressivement avec l'augmentation de la température. Les substances amorphes comprennent des composés tels que la cire, la paraffine, la plupart des plastiques, le verre, etc.
Néanmoins, les substances cristallines ont un point de fusion spécifique, c'est-à-dire une substance à structure cristalline passe d'un état solide à un état liquide non pas progressivement, mais brusquement, lorsqu'une température spécifique est atteinte. Des exemples de substances cristallines comprennent le sel de table, le sucre, la glace.
La différence dans les propriétés physiques des solides amorphes et cristallins est principalement due aux caractéristiques structurelles de ces substances. Quelle est la différence entre une substance à l'état amorphe et cristallin, la façon la plus simple de comprendre est de l'illustration suivante :
Comme vous pouvez le voir, dans une substance amorphe, contrairement à une substance cristalline, il n'y a pas d'ordre dans l'arrangement des particules. Si, dans une substance cristalline, on relie mentalement deux atomes proches l'un de l'autre par une ligne droite, alors on peut constater que les mêmes particules se trouveront sur cette ligne à des intervalles strictement définis :
Ainsi, dans le cas de substances cristallines, on peut parler d'un tel concept de réseau cristallin.
réseau cristallin appelé un cadre spatial reliant les points de l'espace dans lesquels il y a des particules qui forment un cristal.
Les points de l'espace où se trouvent les particules qui forment le cristal sont appelés nœuds de réseau .
Selon les particules qui se trouvent dans les nœuds du réseau cristallin, il y a : moléculaire, atomique, ionique et réseau cristallin métallique .
en nœuds réseau cristallin moléculaire
Le réseau cristallin de la glace comme exemple de réseau moléculaireil existe des molécules au sein desquelles les atomes sont liés par de fortes liaisons covalentes, mais les molécules elles-mêmes sont maintenues proches les unes des autres par de faibles forces intermoléculaires. En raison de ces faibles interactions intermoléculaires, les cristaux à réseau moléculaire sont fragiles. Ces substances diffèrent des substances ayant d'autres types de structure par des points de fusion et d'ébullition nettement inférieurs, ne conduisent pas électricité, peut ou non se dissoudre dans divers solvants. Les solutions de tels composés peuvent ou non conduire l'électricité, selon la classe du composé. Les composés à réseau cristallin moléculaire comprennent de nombreuses substances simples - des non-métaux (H 2 durci, O 2, Cl 2, soufre rhombique S 8, phosphore blanc P 4), ainsi que de nombreuses substances complexes - composés hydrogènes de non-métaux, acides, oxydes de non-métaux, la plupart matière organique. Il convient de noter que si la substance est à l'état gazeux ou liquide, il est inapproprié de parler de réseau cristallin moléculaire: il est plus correct d'utiliser le terme - le type de structure moléculaire.
Le réseau cristallin du diamant comme exemple de réseau atomiqueen nœuds réseau cristallin atomique
il y a des atomes. Dans ce cas, tous les nœuds d'un tel réseau cristallin sont "réticulés" les uns aux autres au moyen de liaisons covalentes fortes en un seul cristal. En fait, un tel cristal est une molécule géante. En raison de caractéristiques structurelles, toutes les substances avec un réseau cristallin atomique sont solides, ont des points de fusion élevés, sont chimiquement inactives, insolubles dans l'eau ou les solvants organiques, et leurs masses fondues ne conduisent pas le courant électrique. Il convient de rappeler que les substances à structure de type atomique à partir de substances simples comprennent le bore B, le carbone C (diamant et graphite), le silicium Si, à partir de substances complexes - dioxyde de silicium SiO 2 (quartz), carbure de silicium SiC, nitrure de bore BN.
Pour les substances avec réseau cristallin ionique
sur les sites du réseau se trouvent des ions liés les uns aux autres par des liaisons ioniques.
Les liaisons ioniques étant suffisamment fortes, les substances à réseau ionique ont une dureté et un caractère réfractaire relativement élevés. Le plus souvent, ils sont solubles dans l'eau et leurs solutions, comme la fonte, conduisent l'électricité.
Les substances à réseau cristallin de type ionique comprennent les sels métalliques et d'ammonium (NH 4 +), les bases, les oxydes métalliques. Un véritable signe de la structure ionique d'une substance est la présence dans sa composition d'atomes d'un métal typique et d'un non-métal.
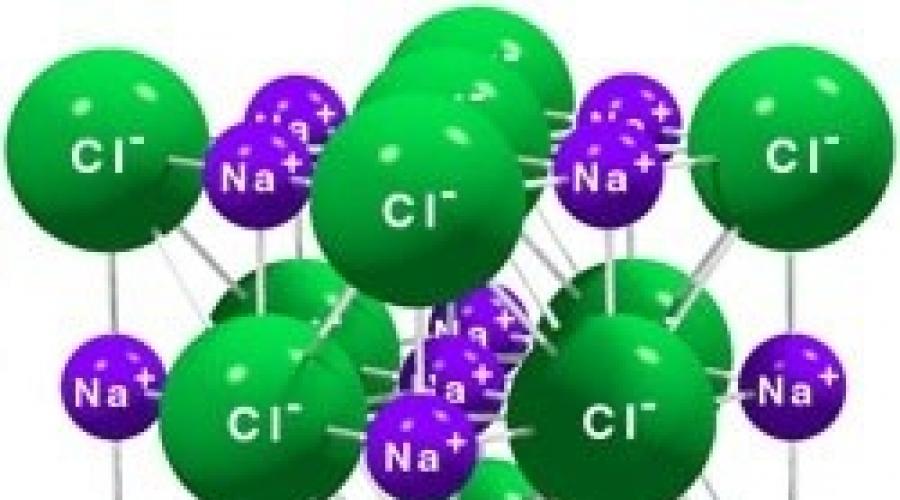
 Le réseau cristallin du chlorure de sodium comme exemple de réseau ionique
Le réseau cristallin du chlorure de sodium comme exemple de réseau ionique
observé dans les cristaux de métaux libres, par exemple le sodium Na, le fer Fe, le magnésium Mg, etc. Dans le cas d'un réseau cristallin métallique, des cations et des atomes métalliques sont situés à ses nœuds, entre lesquels les électrons se déplacent. Dans ce cas, les électrons en mouvement se fixent périodiquement aux cations, neutralisant ainsi leur charge, et les atomes de métal neutre individuels « libèrent » à la place certains de leurs électrons, se transformant à leur tour en cations. En fait, les électrons "libres" n'appartiennent pas à des atomes individuels, mais à l'ensemble du cristal.
De telles caractéristiques structurelles conduisent au fait que les métaux conduisent bien la chaleur et le courant électrique, ont souvent une ductilité élevée (ductilité).
La dispersion des valeurs des températures de fusion des métaux est très importante. Ainsi, par exemple, le point de fusion du mercure est d'environ moins 39 o C (liquide dans conditions normales) et tungstène - 3422 °C. Il convient de noter que dans des conditions normales, tous les métaux sauf le mercure sont des solides.
Une substance, comme vous le savez, peut exister sous trois états d'agrégation : gazeux, liquide et solide (Fig. 70). Par exemple, l'oxygène, qui dans des conditions normales est un gaz, à une température de -194 ° C se transforme en liquide couleur bleue, et à une température de -218,8 ° C, il durcit en une masse ressemblant à de la neige, constituée de cristaux bleus.
Riz. 70.
États agrégés de l'eau
Les solides sont divisés en cristallins et amorphes.
Les substances amorphes n'ont pas de point de fusion clair - lorsqu'elles sont chauffées, elles se ramollissent progressivement et deviennent fluides. Les substances amorphes comprennent la plupart des plastiques (par exemple, le polyéthylène), la cire, le chocolat, la pâte à modeler, diverses résines et les gommes à mâcher (Fig. 71).

Riz. 71.
Substances et matériaux amorphes
Les substances cristallines sont caractérisées emplacement correct leurs particules constitutives en des points strictement définis de l'espace. Lorsque ces points sont reliés par des lignes droites, un cadre spatial se forme, appelé réseau cristallin. Les points où se trouvent les particules de cristal sont appelés nœuds de réseau.
Aux nœuds d'un réseau cristallin imaginaire, il peut y avoir des ions monoatomiques, des atomes, des molécules. Ces particules oscillent. Avec une augmentation de la température, la plage de ces oscillations augmente, ce qui, en règle générale, conduit à une dilatation thermique des corps.
Selon le type de particules situées aux nœuds du réseau cristallin et la nature de la connexion entre elles, on distingue quatre types de réseaux cristallins : ionique, atomique, moléculaire et métallique (tableau 6).
Tableau 6
La position des éléments dans le système périodique de D. I. Mendeleev et les types de réseaux cristallins de leurs substances simples

Les substances simples formées d'éléments non répertoriés dans le tableau ont un réseau métallique.
Les réseaux cristallins ioniques sont appelés, dans les nœuds desquels il y a des ions. Ils sont formés de substances à liaison ionique, qui peuvent être associées à la fois à des ions simples Na +, Cl - et à des ions complexes, OH -. Par conséquent, les réseaux cristallins ioniques ont des sels, des bases (alcalis), certains oxydes. Par exemple, un cristal de chlorure de sodium est construit à partir d'une alternance d'ions positifs Na + et négatifs Cl -, formant un réseau en forme de cube (Fig. 72). Les liaisons entre les ions dans un tel cristal sont très fortes. Par conséquent, les substances à réseau ionique ont une dureté et une résistance relativement élevées, elles sont réfractaires et non volatiles.

Riz. 72.
Réseau cristallin ionique (chlorure de sodium)
Les réseaux atomiques sont appelés réseaux cristallins, dans les nœuds desquels se trouvent des atomes individuels. Dans de tels réseaux, les atomes sont reliés entre eux par des liaisons covalentes très fortes.

Riz. 73.
Réseau cristallin atomique (diamant)
Ce type de réseau cristallin a un diamant (Fig. 73) - l'une des modifications allotropiques du carbone. Les diamants taillés et polis sont appelés brillants. Ils sont largement utilisés en joaillerie (Fig. 74).

Riz. 74.
Deux couronnes impériales avec diamants :
a - la couronne de l'Empire britannique; b - Grande Couronne Impériale de l'Empire Russe
Les substances à réseau cristallin atomique comprennent le bore cristallin, le silicium et le germanium, ainsi que des substances complexes, telles que la silice, le quartz, le sable, le cristal de roche, qui comprennent l'oxyde de silicium (IV) SiO 2 (Fig. 75).

Riz. 75.
Réseau cristallin atomique (oxyde de silicium (IV))
La plupart des substances à réseau cristallin atomique ont des points de fusion très élevés (par exemple, pour le diamant, il est supérieur à 3500 ° C, pour le silicium - 1415 ° C, pour la silice - 1728 ° C), ils sont solides et durs, pratiquement insolubles.
Les réseaux moléculaires sont appelés réseaux cristallins, aux nœuds desquels se trouvent les molécules. Les liaisons chimiques dans ces molécules peuvent être à la fois polaires covalentes (chlorure d'hydrogène HCl, eau H 2 0) et non polaires covalentes (azote N 2, ozone 0 3). Malgré le fait que les atomes à l'intérieur des molécules sont liés par des liaisons covalentes très fortes, il existe de faibles forces d'attraction intermoléculaire entre les molécules elles-mêmes. Par conséquent, les substances avec des réseaux cristallins moléculaires ont une faible dureté, des points de fusion bas et sont volatiles.
Des exemples de substances à réseaux cristallins moléculaires sont l'eau solide - la glace, le monoxyde de carbone solide (IV) C) 2 - la «glace sèche» (Fig. 76), le chlorure d'hydrogène solide HCl et le sulfure d'hydrogène H 2 S, des substances simples solides formées par un - (gaz rares: hélium, néon, argon, krypton), deux- (hydrogène H 2, oxygène O 2, chlore Cl 2, azote N 2, iode 1 2), trois- (ozone O 3), quatre- (blanc phosphore P 4 ), molécules à huit atomes (soufre S 7). La plupart des composés organiques solides ont des réseaux cristallins moléculaires (naphtalène, glucose, sucre).

Riz. 76.
Réseau cristallin moléculaire ( gaz carbonique)
Les substances avec une liaison métallique ont des réseaux cristallins métalliques (Fig. 77). Aux nœuds de ces réseaux, il y a des atomes et des ions (soit des atomes, soit des ions, dans lesquels les atomes métalliques se transforment facilement, donnant leurs électrons externes pour un usage courant). Tel structure interne les métaux déterminent leur caractéristique propriétés physiques: malléabilité, plasticité, conductivité électrique et thermique, éclat métallique.

Riz. 77.
Treillis cristallin métallique (fer)
Expérience de laboratoire n ° 13
Connaissance de la collection de substances avec différents types de réseau cristallin. Réalisation de modèles de réseaux cristallins
- Examinez la collection d'échantillons de substances qui vous a été remise. Notez leurs formules, caractérisez les propriétés physiques et, sur la base de celles-ci, déterminez le type de réseau cristallin.
Assemblez un modèle de l'un des réseaux cristallins.
Pour les substances ayant une structure moléculaire, la loi de constance de composition découverte par le chimiste français J. L. Proust (1799-1803) est valable. Cette loi est actuellement formulée comme suit :
La loi de Proust est l'une des lois fondamentales de la chimie. Cependant, pour les substances de structure non moléculaire, par exemple ionique, cette loi n'est pas toujours vraie.
Mots clés et expressions
- États solides, liquides et gazeux de la matière.
- Solides : amorphes et cristallins.
- Réseaux cristallins : ionique, atomique, moléculaire et métallique.
- Propriétés physiques des substances avec divers types réseaux cristallins.
- La loi de constance de composition.
Travailler avec l'ordinateur
- Consultez la demande électronique. Étudiez le matériel de la leçon et complétez les tâches suggérées.
- Recherchez sur Internet des adresses e-mail qui peuvent servir de sources supplémentaires révélant le contenu des mots-clés et des phrases du paragraphe. Offrez à l'enseignant votre aide pour préparer une nouvelle leçon - faites un rapport sur les mots et phrases clés du paragraphe suivant.
Questions et tâches
- Dans quel état d'agrégation sera l'oxygène à -205°C ?
- Rappelez-vous le travail d'A. Belyaev "Le vendeur d'air" et caractérisez les propriétés de l'oxygène solide à l'aide de sa description donnée dans le livre.
- De quel type de substance (cristalline ou amorphe) sont les plastiques ? Quelles propriétés des plastiques sous-tendent leurs applications industrielles ?
- De quel type de réseau cristallin de diamant s'agit-il ? Énumérez les propriétés physiques d'un diamant.
- Quel type de réseau cristallin est l'iode ? Énumérez les propriétés physiques de l'iode.
- Pourquoi le point de fusion des métaux varie-t-il dans une très large gamme ? Pour préparer une réponse à cette question, utilisez de la documentation supplémentaire.
- Pourquoi un produit en silicone se brise-t-il lors d'un impact, alors qu'un produit en plomb ne fait que s'aplatir ? Dans lequel de ces cas la destruction d'une liaison chimique se produit-elle et dans lequel ne se produit-elle pas ? Pourquoi?
La plupart des solides sont cristallins. Cellule de cristal est construit à partir d'unités structurelles identiques répétitives, individuelles pour chaque cristal. Cette unité structurale est appelée la "cellule élémentaire". En d'autres termes, le réseau cristallin sert de reflet de la structure spatiale d'un solide.
Les réseaux cristallins peuvent être classés de différentes manières.
JE. Selon la symétrie des cristaux les réseaux sont classés en cubiques, tétragonaux, rhombiques, hexagonaux.
Cette classification est pratique pour estimer les propriétés optiques des cristaux, ainsi que leur activité catalytique.
II. Par la nature des particules situés aux nœuds du réseau et par type de liaison chimique les distinguer réseaux cristallins atomiques, moléculaires, ioniques et métalliques. Le type de liaison dans un cristal détermine la différence de dureté, la solubilité dans l'eau, l'amplitude de la chaleur de dissolution et de la chaleur de fusion et la conductivité électrique.
Une caractéristique importante le cristal est énergie du réseau cristallin, kJ/mol – l'énergie nécessaire pour détruire un cristal donné.
réseau moléculaire
cristaux moléculaires sont constitués de molécules maintenues à certaines positions du réseau cristallin par des liaisons intermoléculaires faibles (forces de van der Waals) ou des liaisons hydrogène. Ces réseaux sont caractéristiques des substances à liaisons covalentes.
Il y a beaucoup de substances avec un réseau moléculaire. Il s'agit d'un grand nombre de composés organiques (sucre, naphtalène, etc.), d'eau cristalline (glace), de dioxyde de carbone solide ("glace sèche"), d'halogénures d'hydrogène solides, d'iode, de gaz solides, y compris nobles,
L'énergie minimale du réseau cristallin pour les substances à molécules non polaires et faiblement polaires (CH 4, CO 2, etc.).
Les réseaux formés par des molécules plus polaires ont également une énergie de réseau cristallin plus élevée. Les réseaux avec des substances qui forment des liaisons hydrogène (H 2 O, NH 3) ont l'énergie la plus élevée.
En raison de la faible interaction entre les molécules, ces substances sont volatiles, fusibles, ont une faible dureté, ne conduisent pas de courant électrique (diélectriques) et ont une faible conductivité thermique.
réseau atomique
en nœuds réseau cristallin atomique il y a des atomes d'un ou de différents éléments liés par des liaisons covalentes le long des trois axes. Tel cristaux, qui sont aussi appelés covalent sont relativement peu nombreux.
Des exemples de cristaux de ce type sont le diamant, le silicium, le germanium, l'étain, ainsi que des cristaux de substances complexes telles que le nitrure de bore, le nitrure d'aluminium, le quartz, le carbure de silicium. Toutes ces substances ont un réseau en forme de diamant.
L'énergie du réseau cristallin dans de telles substances coïncide pratiquement avec l'énergie de la liaison chimique (200 - 500 kJ/mol). Cela détermine également leurs propriétés physiques : dureté élevée, point de fusion et point d'ébullition.
Les propriétés électriquement conductrices de ces cristaux sont variées : le diamant, le quartz, le nitrure de bore sont des diélectriques ; silicium, germanium - semi-conducteurs ; l'étain gris métallisé conduit bien l'électricité.
Dans les cristaux à réseau cristallin atomique, il est impossible de distinguer une unité structurelle distincte. L'ensemble du monocristal est une molécule géante.
Réseau ionique
en nœuds réseau ionique les ions positifs et négatifs alternent, entre lesquels agissent les forces électrostatiques. Les cristaux ioniques forment des composés avec des liaisons ioniques, par exemple, le chlorure de sodium NaCl, le fluorure de potassium et KF, etc. Les composés ioniques peuvent également inclure des ions complexes, par exemple, NO 3 - , SO 4 2 - .
Les cristaux ioniques sont également une molécule géante dans laquelle chaque ion est fortement affecté par tous les autres ions.
L'énergie du réseau cristallin ionique peut atteindre des valeurs importantes. Ainsi, E (NaCl) \u003d 770 kJ / mol et E (BeO) \u003d 4530 kJ / mol.
Les cristaux ioniques ont des points de fusion et d'ébullition élevés et une résistance élevée, mais ils sont cassants. Beaucoup d'entre eux sont de mauvais conducteurs d'électricité. température ambiante(une vingtaine d'ordres de grandeur inférieure à celle des métaux), mais avec l'augmentation de la température, on observe une augmentation de la conductivité électrique.
grille en métal
cristaux métalliques donner des exemples des structures cristallines les plus simples.
Les ions métalliques dans le réseau d'un cristal métallique peuvent être approximativement considérés comme des sphères. Dans les métaux solides, ces billes sont garnies avec une densité maximale, comme l'indique la densité importante de la plupart des métaux (de 0,97 g/cm3 pour le sodium, 8,92 g/cm3 pour le cuivre, à 19,30 g/cm3 pour le tungstène et l'or). Le garnissage le plus dense de boules dans une couche est le garnissage hexagonal, dans lequel chaque boule est entourée de six autres boules (dans le même plan). Les centres de trois boules adjacentes forment un triangle équilatéral.
Des propriétés des métaux telles que la ductilité et la ductilité élevées indiquent l'absence de rigidité dans les réseaux métalliques: leurs plans se déplacent assez facilement l'un par rapport à l'autre.
Les électrons de Valence participent à la formation de liaisons avec tous les atomes, se déplacent librement dans tout le volume d'un morceau de métal. Ceci est indiqué par des valeurs élevées de conductivité électrique et de conductivité thermique.
Selon l'énergie du réseau cristallin, les métaux occupent une position intermédiaire entre les cristaux moléculaires et covalents. L'énergie du réseau cristallin vaut :
Ainsi, les propriétés physiques des solides dépendent essentiellement du type de liaison chimique et de la structure.
Structure et propriétés des solides
| Les caractéristiques | cristaux | |||
| métal | Ionique | Moléculaire | Nucléaire | |
| Exemples | K, Al, Cr, Fe | NaCl, KNO3 | I 2, naphtalène | diamant, quartz |
| Particules structurelles | Ions positifs et électrons mobiles | Cations et anions | molécules | atomes |
| Type de liaison chimique | métal | Ionique | Dans les molécules - covalentes; entre molécules - forces de van der Waals et liaisons hydrogène | Entre atomes - covalent |
| température de fusion | haute | haute | bas | Très haut |
| point d'ébullition | haute | haute | bas | Très haut |
| Propriétés mécaniques | Dur, malléable, malléable | dur, cassant | Mou, tendre | Très dur |
| Conductivité électrique | Bons conducteurs | Sous forme solide - diélectriques; en fusion ou en solution - conducteurs | Diélectriques | Diélectriques (sauf graphite) |
| Solubilité | ||||
| dans l'eau | insoluble | Soluble | insoluble | insoluble |
| dans des solvants non polaires | insoluble | insoluble | Soluble | insoluble |
(Toutes les définitions, formules, graphiques et équations de réactions sont données sous la notice.)
Thèmes du codeur USE : Substances de structure moléculaire et non moléculaire. Type de réseau cristallin. La dépendance des propriétés des substances sur leur composition et leur structure.
Théorie cinétique moléculaire
Toutes les molécules sont constituées de les plus petites particules- atomes. Tous les atomes actuellement découverts sont rassemblés dans le tableau périodique.
Atome est la plus petite particule chimiquement indivisible d'une substance qui la retient Propriétés chimiques. Les atomes se connectent les uns aux autres liaisons chimiques. Nous avons précédemment considéré A. Assurez-vous d'étudier la théorie sur le sujet : Types de liaisons chimiques, avant d'étudier cet article !
Voyons maintenant comment les particules peuvent se combiner dans la matière.
Selon l'emplacement des particules les unes par rapport aux autres, les propriétés des substances qu'elles forment peuvent varier considérablement. Donc, si les particules sont éloignées les unes des autres loin(la distance entre les particules est bien supérieure à la taille des particules elles-mêmes), elles n'interagissent pratiquement pas entre elles, elles se déplacent de manière aléatoire et continue dans l'espace, alors on a affaire à gaz .
Si les particules se trouvent proche l'un à l'autre, mais chaotiquement, plus intéragir ensemble, faire des mouvements oscillatoires intenses dans une position, mais peut sauter à une autre position, alors c'est un modèle de la structure liquides .
Si les particules se trouvent proche les uns aux autres, mais plus ordonné, et interagir davantage entre eux, mais se déplacent uniquement dans une position d'équilibre, pratiquement sans passer à d'autres position, nous avons affaire à solide .

La plupart des produits chimiques et mélanges connus peuvent exister à l'état solide, liquide et gazeux. L'exemple le plus simple est l'eau. À conditions normales elle est liquide, à 0 o C il gèle - il passe d'un état liquide à solide, et à 100 ° C, il bout - entre dans phase gazeuse- vapeur d'eau. Dans le même temps, de nombreuses substances dans des conditions normales sont des gaz, des liquides ou des solides. Par exemple, l'air, un mélange d'azote et d'oxygène, est un gaz dans des conditions normales. Mais à haute pression et à basse température, l'azote et l'oxygène se condensent et passent en phase liquide. L'azote liquide est activement utilisé dans l'industrie. Parfois isolé plasma, aussi bien que cristaux liquides, en tant que phases distinctes.

De nombreuses propriétés de substances individuelles et de mélanges s'expliquent par arrangement mutuel particules dans l'espace les unes par rapport aux autres !
Cet article considère propriétés des solides, en fonction de leur structure. Propriétés physiques de base des solides : point de fusion, conductivité électrique, conductivité thermique, résistance mécanique, plasticité, etc.
Température de fusion est la température à laquelle une substance passe de solide à liquide et vice versa.

est la capacité d'une substance à se déformer sans se rompre.

Conductivité électrique est la capacité d'une substance à conduire le courant.
Le courant est le mouvement ordonné des particules chargées. Ainsi, le courant ne peut être conduit que par des substances dans lesquelles il y a particules chargées en mouvement. Selon la capacité à conduire le courant, les substances sont divisées en conducteurs et diélectriques. Les conducteurs sont des substances qui peuvent conduire le courant (c'est-à-dire contenir des particules chargées mobiles). Les diélectriques sont des substances qui ne conduisent pratiquement pas de courant.

Dans un solide, les particules d'une substance peuvent être localisées chaotiquement, ou plus ordonné sur. Si les particules d'un solide sont situées dans l'espace chaotiquement, la substance est appelée amorphe. Exemples de substances amorphes - charbon, mica verre.

Si les particules d'un solide sont disposées dans l'espace de manière ordonnée, c'est-à-dire forment des structures géométriques tridimensionnelles répétitives, une telle substance est appelée cristal, et la structure elle-même réseau cristallin . La plupart des substances que nous connaissons sont des cristaux. Les particules elles-mêmes se trouvent dans nœuds réseau cristallin.
Les substances cristallines se distinguent notamment par type de liaison chimique entre les particules dans un cristal - atomique, moléculaire, métallique, ionique ; selon la forme géométrique de la cellule la plus simple du réseau cristallin - cubique, hexagonale, etc.
En fonction de la type de particules formant un réseau cristallin , distinguer structure cristalline atomique, moléculaire, ionique et métallique .
Réseau cristallin atomique

Un réseau cristallin atomique se forme lorsqu'il y a atomes. Les atomes sont connectés les uns aux autres liaisons chimiques covalentes. En conséquence, un tel réseau cristallin sera très durable, il n'est pas facile de le détruire. Un réseau cristallin atomique peut être formé par des atomes de valence élevée, c'est-à-dire avec un grand nombre de liaisons avec des atomes voisins (4 ou plus). En règle générale, ce sont des non-métaux: substances simples - silicium, bore, carbone (modifications allotropiques du diamant, graphite), et leurs composés (borocarbone, oxyde de silicium (IV), etc..). Puisqu'une liaison chimique principalement covalente se produit entre les non-métaux, électrons libres(ainsi que d'autres particules chargées) dans des substances à réseau cristallin atomique dans la plupart des cas non. Par conséquent, ces substances sont généralement conduisent très mal l'électricité, c'est-à-dire sont des diélectriques. Ce sont des schémas généraux, dont il existe un certain nombre d'exceptions.

Communication entre particules dans les cristaux atomiques : .
Aux noeuds du cristal avec structure cristalline atomique disposée atomes.
État des phases cristaux atomiques dans des conditions normales : en règle générale, solides.
Substances, qui forment des cristaux atomiques à l'état solide :
- Substances simples haute valence (situé au milieu du tableau périodique): bore, carbone, silicium, etc.
- Substances complexes formées par ces non-métaux : silice (oxyde de silicium, sable de quartz) SiO 2 ; carbure de silicium (corindon) SiC; carbure de bore, nitrure de bore, etc.
Propriétés physiques des substances à réseau cristallin atomique :
— force;
- caractère réfractaire (point de fusion élevé) ;
- faible conductivité électrique ;
- faible conductivité thermique ;
— inertie chimique (substances inactives) ;
- insolubilité dans les solvants.

Réseau cristallin moléculaire est un treillis dont les noeuds sont molécules. retenir les molécules dans le cristal forces faibles d'attraction intermoléculaire (forces de van der Waals, liaisons hydrogène ou attraction électrostatique). En conséquence, un tel réseau cristallin, en règle générale, assez facile à détruire. Substances à réseau cristallin moléculaire - fragile, fragile. Plus la force d'attraction entre les molécules est grande, plus le point de fusion de la substance est élevé. En règle générale, les points de fusion des substances à réseau cristallin moléculaire ne dépassent pas 200-300K. Par conséquent, dans des conditions normales, la plupart des substances à réseau cristallin moléculaire existent sous la forme gaz ou liquides. Le réseau cristallin moléculaire, en règle générale, est formé sous forme solide par des acides, des oxydes de non-métaux, d'autres composés binaires de non-métaux, des substances simples qui forment des molécules stables (oxygène O 2, azote N 2, eau H 2 O , etc.), substances organiques. En règle générale, ce sont des substances avec une liaison polaire covalente (rarement non polaire). Car les électrons sont impliqués dans des liaisons chimiques, des substances à réseau cristallin moléculaire - diélectriques, mauvais conducteurs de chaleur.

Communication entre particules en cristaux moléculaires : m forces d'attraction intermoléculaires, électrostatiques ou intermoléculaires.
Aux noeuds du cristal à structure cristalline moléculaire disposée molécules.
État des phases cristaux moléculaires dans des conditions normales : gaz, liquides et solides.
Substances, formant à l'état solide cristaux moléculaires:
- Substances non métalliques simples qui forment de petites molécules fortes (O 2 , N 2 , H 2 , S 8 et autres);
- Substances complexes (composés de non-métaux) avec des liaisons polaires covalentes (à l'exception des oxydes de silicium et de bore, composés de silicium et de carbone) - eau H 2 O, oxyde de soufre SO 3, etc.
- Gaz rares monoatomiques (hélium, néon, argon, krypton et etc.);
- La plupart des substances organiques qui n'ont pas de liaisons ioniques — méthane CH 4, benzène C 6 H 6, etc.
Propriétés physiques substances à réseau cristallin moléculaire :
- fusibilité (bas point de fusion) :
haute compressibilité ;
- les cristaux moléculaires sous forme solide, ainsi que dans les solutions et les masses fondues, ne conduisent pas le courant ;
- état de phase dans des conditions normales - gaz, liquides, solides ;
— forte volatilité ;
- faible dureté.
Réseau cristallin ionique

S'il y a des particules chargées aux nœuds du cristal - des ions, nous pouvons en parler réseau cristallin ionique . En règle générale, les cristaux ioniques alternent ions positifs(cations) et ions négatifs(anions), donc les particules dans le cristal sont retenues forces d'attraction électrostatique . Selon le type de cristal et le type d'ions qui forment le cristal, ces substances peuvent être assez fort et dur. A l'état solide, il n'y a, en règle générale, aucune particule chargée mobile dans les cristaux ioniques. Mais lorsque le cristal est dissous ou fondu, les ions sont libérés et peuvent se déplacer sous l'action d'un champ électrique extérieur. Ceux. conduire uniquement des solutions ou des fondus actuels cristaux ioniques. Le réseau cristallin ionique est caractéristique des substances avec liaison chimique ionique. Exemples ces substances sel NaCl carbonate de calcium- CaCO 3, etc. Le réseau cristallin ionique, en règle générale, est formé en phase solide sels, bases, ainsi que des oxydes métalliques et des composés binaires de métaux et de non-métaux.

Communication entre particules dans les cristaux ioniques : .
Aux noeuds du cristal avec un réseau ionique des ions.
État des phases cristaux ioniques dans des conditions normales : généralement solides.
Substances chimiques avec un réseau cristallin ionique :
- Sels (organiques et inorganiques), y compris les sels d'ammonium (par exemple, chlorure d'ammonium NH4Cl);
- terrains;
- oxydes métalliques;
- Composés binaires contenant des métaux et des non-métaux.
Propriétés physiques des substances à structure cristalline ionique :
- point de fusion élevé (réfractaire) ;
- solutions et fondus de cristaux ioniques - conducteurs de courant ;
- la plupart des composés sont solubles dans les solvants polaires (eau) ;
- état de phase solide dans la plupart des composés dans des conditions normales.

Et, enfin, les métaux se caractérisent par un type particulier de structure spatiale - réseau cristallin métallique, ce qui est dû liaison chimique métallique . Les atomes métalliques retiennent assez faiblement les électrons de valence. Dans un cristal formé par un métal, les processus suivants se produisent simultanément : certains atomes donnent des électrons et deviennent des ions chargés positivement; ces les électrons se déplacent au hasard dans le cristal; certains électrons sont attirés par les ions. Ces processus se produisent simultanément et de manière aléatoire. De cette façon, les ions apparaissent , comme dans la formation d'une liaison ionique, et des électrons communs se forment comme dans la formation d'une liaison covalente. Les électrons libres se déplacent de manière aléatoire et continue dans tout le volume du cristal, comme un gaz. C'est pourquoi on les appelle parfois gaz d'électrons ". En raison de la présence un grand nombre particules chargées mobiles métaux conduire l'électricité, la chaleur. Le point de fusion des métaux varie considérablement. Les métaux sont également caractérisés éclat métallique particulier, malléabilité, c'est à dire. la capacité de changer de forme sans destruction sous de fortes contraintes mécaniques, tk. les liaisons chimiques ne sont pas rompues.

Communication entre particules : .
Aux noeuds du cristal avec grille métallique ions et atomes métalliques.
État des phases métaux dans des conditions normales : généralement solides(exception - mercure, liquide dans des conditions normales).
Substances chimiques avec un réseau cristallin métallique - substances simples - métaux.
Propriétés physiques des substances à réseau cristallin métallique :
– haute conductivité thermique et électrique;
- malléabilité et plasticité ;
- lustre métallique;
— les métaux sont généralement insolubles dans les solvants ;
La plupart des métaux sont des solides dans des conditions normales.
Comparaison des propriétés des substances avec différents réseaux cristallins
Le type de réseau cristallin (ou l'absence de réseau cristallin) permet d'évaluer les propriétés physiques de base d'une substance. Pour une comparaison approximative des propriétés physiques typiques des composés avec différents réseaux cristallins, il est très pratique d'utiliser des produits chimiques avec propriétés caractéristiques . Pour un réseau moléculaire, par exemple, gaz carbonique, pour le réseau cristallin atomique - diamant, pour le métal - cuivre, et pour le réseau cristallin ionique - sel, chlorure de sodium NaCl.

Tableau récapitulatif sur les structures des substances simples formées éléments chimiques des sous-groupes principaux du tableau périodique (les éléments des sous-groupes secondaires sont des métaux, ils ont donc un réseau cristallin métallique).

Le tableau final de la relation des propriétés des substances avec la structure:

La structure de la matière.
Ce ne sont pas des atomes ou des molécules individuels qui entrent dans les interactions chimiques, mais des substances.
Notre tâche est de se familiariser avec la structure de la matière.
À basses températures pour les substances à l'état solide stable.
☼ La substance la plus dure dans la nature est le diamant. Il est considéré comme le roi de toutes les pierres précieuses et pierres précieuses. Et son nom même signifie en grec "indestructible". Les diamants ont longtemps été considérés comme des pierres miraculeuses. On croyait qu'une personne portant des diamants ne connaissait pas les maladies de l'estomac, le poison ne l'affectait pas, il conservait sa mémoire et sa bonne humeur jusqu'à un âge avancé, jouissait de la faveur royale.
☼ Un diamant soumis au traitement des bijoux - taille, polissage, s'appelle un diamant.
Lors de la fusion, à la suite de vibrations thermiques, l'ordre des particules est violé, elles deviennent mobiles, tandis que la nature de la liaison chimique n'est pas violée. Ainsi, il n'y a pas de différences fondamentales entre les états solide et liquide.
La fluidité apparaît dans le liquide (c'est-à-dire la capacité de prendre la forme d'un récipient).
cristaux liquides.
Les cristaux liquides sont ouverts dans fin XIX siècle, mais étudié au cours des 20-25 dernières années. De nombreux appareils d'affichage technologie moderne, par exemple certains Montre numérique, mini-ordinateurs, fonctionnant sur cristaux liquides.
En général, les mots "cristaux liquides" ne sonnent pas moins inhabituels que "glace chaude". Cependant, en fait, la glace peut aussi être chaude, car. à des pressions supérieures à 10 000 atm. la glace d'eau fond à des températures supérieures à 2000 C. La combinaison inhabituelle de "cristaux liquides" est que l'état liquide indique la mobilité de la structure et que le cristal assume un ordre strict.
Si une substance est constituée de molécules polyatomiques de forme allongée ou lamellaire et ayant une structure asymétrique, alors lorsqu'elle fond, ces molécules sont orientées d'une certaine manière les unes par rapport aux autres (leurs axes longs sont parallèles). Dans ce cas, les molécules peuvent se déplacer librement parallèlement à elles-mêmes, c'est-à-dire le système acquiert la fluidité caractéristique d'un liquide. Dans le même temps, le système conserve une structure ordonnée qui détermine les propriétés caractéristiques des cristaux.
La grande mobilité d'une telle structure permet de la contrôler par de très faibles influences (thermiques, électriques, etc.), c'est-à-dire modifier délibérément les propriétés d'une substance, y compris les propriétés optiques, avec très peu d'énergie, qui est utilisée dans la technologie moderne.
Types de réseaux cristallins.
Toute substance chimique est formée d'un grand nombre de particules identiques qui sont interconnectées.
Aux basses températures, lorsque le mouvement thermique est entravé, les particules sont strictement orientées dans l'espace et forment un réseau cristallin.
Cellule de cristal est une structure avec une disposition géométriquement correcte des particules dans l'espace.
Dans le réseau cristallin lui-même, les nœuds et l'espace internodal sont distingués.
La même substance, selon les conditions (p, t, ...) existe sous différentes formes cristallines (c'est-à-dire qu'elles ont des réseaux cristallins différents) - des modifications allotropiques qui diffèrent par leurs propriétés.
Par exemple, quatre modifications du carbone sont connues - graphite, diamant, carbyne et lonsdaleite.
☼ La quatrième variété de carbone cristallin « lonsdaleite » est peu connue. Il a été trouvé dans des météorites et obtenu artificiellement, et sa structure est toujours à l'étude.
☼ Suie, coke, charbon attribuée aux polymères amorphes du carbone. Cependant, on sait maintenant qu'il s'agit également de substances cristallines.
☼ Soit dit en passant, des particules noires brillantes ont été trouvées dans la suie, qu'ils ont appelées "carbone miroir". Le carbone miroir est chimiquement inerte, résistant à la chaleur, imperméable aux gaz et aux liquides, a une surface lisse et une compatibilité absolue avec les tissus vivants.
☼ Le nom de graphite vient du "graffito" italien - j'écris, je dessine. Le graphite est un cristal gris foncé avec un léger éclat métallique, a un réseau en couches. Des couches séparées d'atomes dans un cristal de graphite, relativement faiblement liées les unes aux autres, sont facilement séparées les unes des autres.
TYPES DE TREILLIS DE CRISTAL



Propriétés des substances avec différents réseaux cristallins (tableau)
Si la vitesse de croissance des cristaux est faible lors du refroidissement, un état vitreux (amorphe) se forme.
La relation entre la position d'un élément dans le système périodique et le réseau cristallin de sa substance simple.
Entre la position de l'élément dans système périodique et le réseau cristallin de sa substance simple correspondante, il existe une relation étroite.

Les substances simples des éléments restants ont un réseau cristallin métallique.
FIXATION
Étudiez le matériel de cours, répondez par écrit aux questions suivantes dans votre cahier :
- Qu'est-ce qu'un réseau cristallin ?
- Quels types de réseaux cristallins existent ?
- Décrire chaque type de réseau cristallin selon le plan :
Qu'y a-t-il dans les nœuds du réseau cristallin, unité structurelle → Le type de liaison chimique entre les particules du nœud → Les forces d'interaction entre les particules du cristal → Propriétés physiques dues au réseau cristallin → État d'agrégation substances dans des conditions normales → Exemples
Effectuez les tâches sur ce sujet :
- Quel type de réseau cristallin ont les substances suivantes largement utilisées dans la vie quotidienne : l'eau, acide acétique(CH3 COOH), sucre (C12 H22 O11), engrais potassique (KCl), sable de rivière (SiO2) - point de fusion 1710 0C, ammoniaque (NH3), sel de table ? Faites une conclusion générale : quelles propriétés d'une substance peuvent déterminer le type de son réseau cristallin ?
Selon les formules des substances données: SiC, CS2, NaBr, C2 H2 - déterminez le type de réseau cristallin (ionique, moléculaire) de chaque composé et, sur cette base, décrivez les propriétés physiques de chacune des quatre substances.
Entraîneur numéro 1. "Grilles de cristal"
Entraîneur numéro 2. "Tâches de test"
Test (contrôle de soi):
1) Substances ayant un réseau cristallin moléculaire, en règle générale :
un). réfractaire et très soluble dans l'eau
b). fusible et volatil
dans). Solide et électriquement conducteur
G). Thermoconducteur et plastique
2) La notion de "molécule" ne s'applique pas à l'unité structurale d'une substance :
b). oxygène
dans). diamant
3) Le réseau cristallin atomique est caractéristique de :
un). aluminium et graphite
b). soufre et iode
dans). oxyde de silicium et chlorure de sodium
G). diamant et bore
4) Si une substance est très soluble dans l'eau, a un point de fusion élevé, est électriquement conductrice, alors son réseau cristallin :
MAIS). moléculaire
b). nucléaire
dans). ionique
G). métallique