La fonction des protéines est assurée par la myosine d'actine. Mécanismes moléculaires de la contraction musculaire
Lire aussi
BIOCHIMIE DU SPORT
Structure et fonction de la fibre musculaire
Il existe 3 types de tissus musculaires:
Squelette strié ;
Cardiaque striée ;
Lisse.
Fonctions du tissu musculaire.
Tissu squelettique strié - représente environ 40 % du poids corporel total.
Ses fonctions :
dynamique;
statique;
récepteur (par exemple, propriocepteurs dans les tendons - fibres musculaires intrafusales (fusiformes));
dépôt - eau, minéraux, oxygène, glycogène, phosphates;
thermorégulation;
réactions émotionnelles.
Tissu musculaire cardiaque strié.
La fonction principale est l'injection.
Muscles lisses - forme la paroi des organes creux et des vaisseaux sanguins.
Ses fonctions : - maintient la pression dans les organes creux ; - maintient la valeur de la tension artérielle ;
Fournit la promotion du contenu à travers le tractus gastro-intestinal, les uretères.
La composition chimique du tissu musculaire
La composition chimique du tissu musculaire est très complexe et change sous l'influence de divers facteurs. La composition chimique moyenne d'un tissu musculaire bien préparé est la suivante : eau - 70 à 75 % de la masse tissulaire ; protéines - 18-22%; lipides - 0,5-3,5%; extraits azotés - 1,0-1,7%; extraits sans azote - 0,7-1,4%; minéraux - 1,0-1,5 %.
Environ 80% du résidu sec du tissu musculaire sont des protéines dont les propriétés déterminent largement les propriétés de ce tissu.
Les myofibrilles sont les éléments contractiles d'une fibre musculaire. Structure fine des myofibrilles
Les myofibrilles sont des fibres fines (leur diamètre est de 1 à 2 microns, leur longueur est de 2 à 2,5 microns), contenant 2 types de protéines contractiles (protofibrilles) : des filaments d'actine fins et des filaments de myosine deux fois plus épais. Ils sont disposés de telle sorte qu'il y ait 6 filaments d'actine autour des filaments de myosine et 3 filaments de myosine autour de chaque filament d'actine. Les myofibrilles sont séparées par des membranes Z en sections séparées - les sarcomères, dans la partie médiane desquels se trouvent principalement des filaments de myosine, les filaments d'aactine sont attachés aux membranes Z sur les côtés du sarcomère. (La capacité différente de l'actine et de la myosine à réfracter la lumière crée une apparence striée dans un muscle au repos dans un microscope optique).
Les filaments d'actine représentent environ 20 % du poids sec des myofibrilles. L'actine se compose de deux formes de protéine : 1) une forme globulaire - sous la forme de molécules sphériques et 2) des molécules de tronomyosine en forme de bâtonnet tordues sous la forme d'hélices à double brin en une longue chaîne. Tout au long de ce double filament d'actine, chaque spire contient 14 molécules d'actine globulaire (7 molécules de part et d'autre), comme un fil avec des perles, ainsi que des centres de liaison pour les ions Ca2+. Ces centres contiennent une protéine spéciale (troponine), qui est impliquée dans la formation de la liaison entre l'actine et la myosine.
La myosine est composée de filaments protéiques parallèles (cette partie est la soi-disant méromyosine légère). Aux deux extrémités, il y a des cols s'étendant sur les côtés avec des épaississements - des têtes (cette partie est de la méromyosine lourde), grâce à quoi des ponts transversaux se forment entre la myosine et l'actine.
Propriétés physicochimiques et l'organisation structurale des protéines contractiles (myosine et actine). Tropomyosine et troponine.
Les protéines myofibrillaires comprennent les protéines contractiles myosine, actine et actomyosine, ainsi que les protéines régulatrices tropomyosine, troponine et actines alpha et bêta. Les protéines myofibrillaires assurent la fonction contractile des muscles.
La myosine est l'une des principales protéines contractiles des muscles, représentant environ 55 % des protéines musculaires totales. Il est constitué de filaments épais (filaments) de myofibrilles. Le poids moléculaire de cette protéine est d'environ 470 000. Dans la molécule de myosine, on distingue une longue partie fibrillaire et des structures globulaires (têtes). La partie fibrillaire de la molécule de myosine a une structure en double hélice. La molécule contient six sous-unités : deux chaînes polypeptidiques lourdes (poids moléculaire 200 000) et quatre chaînes légères (poids moléculaire 1 500-2 700) situées dans la partie globulaire. La fonction principale de la partie fibrillaire de la molécule de myosine est la capacité de former des faisceaux bien ordonnés de filaments de myosine ou de protofibrilles épaisses. Le centre actif de l'ATPase et le centre de liaison à l'actine sont situés sur les têtes de la molécule de myosine, ils assurent donc l'hydrolyse de l'ATP et l'interaction avec les filaments d'actine.
L'actine est la deuxième protéine musculaire contractile qui forme la base des filaments minces. Ses deux formes sont connues - l'actine G globulaire et l'actine F fibrillaire. L'actine globulaire est une protéine sphérique d'un poids moléculaire de 42 000. Elle représente environ 25 % de la masse protéique musculaire totale. En présence de cations magnésium, l'actine subit une polymérisation non covalente pour former un filament hélicoïdal insoluble appelé F-actine. Les deux formes d'actine n'ont pas d'activité enzymatique. Chaque molécule de G-actine est capable de se lier à un ion calcium, qui joue rôle important dans le déclenchement de la contraction. De plus, une molécule de G-actine lie étroitement une molécule d'ATP ou d'ADP. La liaison de l'ATP par la G-actine s'accompagne généralement de sa polymérisation avec formation de F-actine et du clivage simultané de l'ATP en ADP et en phosphate. L'ADP reste lié à l'actine fibrillaire.
La tropomyosine est une protéine structurale du filament d'actine, qui est une molécule allongée sous la forme d'un brin. Ses deux chaînes polypeptidiques semblent s'enrouler autour de filaments d'actine. Aux extrémités de chaque molécule de tropomyosine se trouvent des protéines du système des troponines, dont la présence est caractéristique des muscles striés.
La troponine est protéine régulatrice filament d'actine. Il se compose de trois sous-unités : TnT, Tnl et TnC. La troponine T (TnT) lie ces protéines à la tropomyosine. La troponine I (Tnl) bloque (inhibe) l'interaction de l'actine avec la myosine. La troponine C (TnC) est une protéine liant le calcium dont la structure et la fonction sont similaires à la protéine calmoduline naturelle. La troponine C, comme la calmoduline, lie quatre ions calcium par molécule de protéine et a un poids moléculaire de 17 000. En présence de calcium, la conformation de la troponine C change, ce qui entraîne une modification de la position de Tn par rapport à l'actine, en tant que résultat duquel le centre d'interaction actine-myosine s'ouvre.
Ainsi, le mince filament de la myofibrille striée est constitué de F-actine, de tropomyosine et de trois composants de troponine. En plus de ces protéines, la protéine actine est impliquée dans la contraction musculaire. On le trouve dans la zone de la ligne Z, à laquelle sont attachées les extrémités des molécules d'actine F de filaments minces de myofibrilles.
Les principales protéines musculaires sont l'actine et la myosine.
La masse des fibrilles musculaires est constituée d'eau (75%) et de protéines (plus de 20%). Les principaux représentants des protéines musculaires sont l'actine et la myosine, parmi lesquelles la myosine représente 55 %.
Cette protéine (MM 460 kDa) a la forme d'un hexamère asymétrique. La molécule de myosine a une partie allongée, constituée de deux spirales enroulées l'une sur l'autre. Chaque hélice a une tête globulaire à une extrémité. L'hexamère (6 sous-unités) comprend une paire de chaînes lourdes (MM 200 kDa) et deux paires de chaînes légères (MM 15-27 kDa). Les chaînes lourdes consistent en un domaine C-terminal a-hélicoïdal à extension linéaire (1300 résidus d'acides aminés) et un domaine N-terminal globulaire (environ 800 résidus d'acides aminés). Deux domaines a-hélicoïdaux appartenant à deux chaînes lourdes forment ensemble une structure superenroulée stable avec deux têtes globulaires (Fig. 17.8).
Une molécule complète de myosine contient également 4 chaînes polypeptidiques relativement petites (MM 16-24 kDa), qui sont associées à des têtes globulaires. Contrairement à l'actine, la myosine Muscle squelettique a une activité enzymatique et catalyse l'hydrolyse de l'ATP en se liant à la F-actine. Toutes les chaînes légères se lient au Ca 2+ , sont phosphorylées par une kinase spéciale et, en général, participent à la régulation de l'activité de la myosine ATPase.
Fig.17.8. Représentation schématique de la structure des filaments épais. La configuration spatiale de la myosine est montrée.
Il existe plusieurs régions fonctionnellement importantes dans la molécule de myosine. Non loin du milieu de la zone superenroulée linéaire, il existe un endroit où la molécule est clivée sous l'action de la trypsine. Cette enzyme coupe en quelque sorte la molécule en 2 parties : l'une contient des têtes globulaires et une partie de la zone superenroulée ; l'autre consiste en la partie restante de la zone superenroulée du côté de l'extrémité C-terminale. La partie contenant la tête était appelée « mérimyosine lourde » (MM 350 kDa). Le fragment C-terminal est appelé "meromyosine légère" (MM 125 kDa).
L'importance du lieu d'action de la trypsine sur la molécule de myosine réside dans le fait qu'il coïncide étonnamment avec le lieu dans la molécule de myosine qui fonctionne comme une sorte de charnière, convertissant l'énergie chimique de l'ATP en un phénomène purement mécanique de contraction- relaxation. Un autre site important qui joue un rôle similaire est soumis à l'action d'une autre enzyme protéolytique - la papaïne. La papaïne coupe la molécule de myosine très près des têtes globulaires. Deux fragments sont obtenus, et c'est celui où se trouve la tête qui présente une activité ATPase.
Des filaments épais se forment à partir de la myosine. Le filament épais est constitué d'environ 400 molécules de myosine, 200 de chaque côté de la ligne M. Ces molécules sont maintenues ensemble par la protéine C (la protéine "clip"), la protéine de la lignée M et l'interaction hydrophobe entre elles. En un point localisé au site d'action de la trypsine, la méromyosine lourde s'écarte de l'axe principal du filament épais, formant angle vif. De ce fait, la tête se rapproche étroitement de l'actine des filaments minces localisés dans l'espace entre les filaments épais. L'événement moléculaire le plus important précédant la contraction musculaire est la liaison régulée des têtes de myosine à l'actine en filaments fins. Par la suite, il y a un changement rapide dans la conformation de la myosine autour des points "charnières" particuliers déjà mentionnés, et l'actine liée se déplace dans la direction de la ligne M.
La part de l'actine dans la masse totale des protéines musculaires est de 25 %. C'est une protéine monomère globulaire avec un MM de 43 kDa, appelée G-actine. En présence d'ions magnésium et de la concentration physiologique d'ions en solution, la G-actine polymérise pour former un fil insoluble, appelé F-actine (Fig. 17.9). Deux polymères de F-actine sont enroulés l'un sur l'autre sous la forme d'une spirale. C'est ainsi que se forme la structure de base d'un fil fin. La fibre d'actine F a une épaisseur de 6-7 nm et une structure répétitive avec une fréquence de 35,5 nm. Ni la G- ni la F-actine n'ont d'activité catalytique.
Riz. 17.9. Structure de la F-actine
Chaque sous-unité G-actine possède un site de liaison ATP/ADP qui participe à la polymérisation du filament fin. Une fois la polymérisation terminée, le fil fin est recouvert et stabilisé par une protéine - la b-actinine. En plus du site de liaison des nucléotides, chaque molécule de G-actine possède un site de liaison de haute affinité pour la tête de myosine. La régulation de son travail dans les muscles squelettiques et cardiaques est effectuée par des protéines supplémentaires d'un fil fin. Ainsi, des protéines supplémentaires contrôlent le cycle contractile.
La composition protéique du tissu musculaire est très complexe. Il a été étudié par de nombreux scientifiques depuis longtemps. Le fondateur de la biochimie domestique, A. Ya. Danilevsky, étudiant les protéines du tissu musculaire, a donné une idée correcte du rôle physiologique d'un certain nombre de protéines et de l'importance de la myosine protéique contractile contenue dans les myofibrilles.
Plus tard, la myosine a été étudiée par V. A. Engelgardt, I. I. Ivanov et d'autres scientifiques soviétiques. Une grande contribution à l'étude de la contraction musculaire a été apportée par le scientifique hongrois Szent-Jorgyi. Un autre scientifique hongrois, Straub, a découvert la protéine musculaire actine.
L'étude du tissu musculaire devrait commencer par les protéines, car elles représentent environ 80 % du résidu sec du tissu musculaire. Conformément à la structure morphologique de la fibre musculaire, les protéines sont réparties comme suit :
D'après le diagramme ci-dessus, on peut voir que la composition protéique du tissu musculaire est très diversifiée. Le sarcoplasme contient quatre protéines : le myogène, la myoalbumine, la globuline X et la myoglobine. Les myofibrilles contiennent un complexe d'actine et de myosine appelé actomyosine. Toutes les protéines du sarcoplasme sont appelées intracellulaires et les protéines du sarcolemme sont appelées extracellulaires.Les noyaux contiennent des nucléoprotéines, le sarcolemme contient du collagène et de l'élastine. Si nous tenons compte du fait que dans le tissu musculaire, il existe encore une quantité importante d'enzymes diverses et que chacune d'elles est une protéine spéciale, la composition protéique du tissu musculaire s'avère encore plus complexe.
Myosine
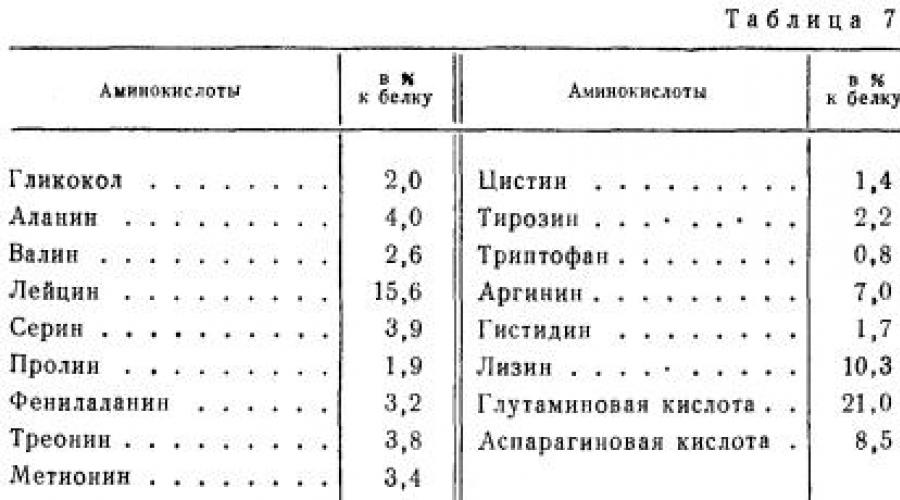
La myosine est la principale protéine du tissu musculaire. Il représente près de la moitié de toutes les protéines musculaires et se trouve dans les muscles de tous les mammifères, oiseaux et poissons. Par la valeur nutritionnelle c'est une protéine complète. En tableau. 7 montre la composition en acides aminés de la myosine bovine.

La myosine a été étudiée en détail par des biochimistes soviétiques, qui ont découvert qu'il ne s'agit pas seulement d'une protéine structurelle du tissu musculaire, c'est-à-dire d'une protéine impliquée dans la construction d'une cellule, mais aussi d'une enzyme, l'adénosine triphosphatase, qui catalyse la réaction d'hydrolyse de l'ATP. Cela produit de l'ADP (acide adénosine diphosphorique) et de l'acide phosphorique et libère une grande quantité d'énergie utilisée dans le travail musculaire.
La myosine a été obtenue sous forme cristalline pure. Masse moléculaire son très grand, environ 1,5 million.La myosine cristalline en l'absence totale de sels est parfaitement soluble dans l'eau. Ho, il suffit d'ajouter une quantité insignifiante de sel à l'eau, par exemple du chlorure de sodium, car il perd complètement sa capacité à se dissoudre et la dissolution se produit déjà à une concentration de chlorure de sodium d'environ 1%. Cependant, vis-à-vis des sels, tels que le sulfate d'ammonium, la myosine se comporte comme une globuline typique.
Lors de l'extraction des protéines de viande avec de l'eau, la myosine ne passe pas en solution. Lors du traitement de la viande avec des solutions salines, on le trouve dans l'extrait de sel. Lorsque la solution saline de myosine est diluée avec de l'eau, la concentration en sel diminue et la myosine commence à précipiter. La myosine est relarguée à saturation complète avec du chlorure de sodium et du sulfate de magnésium (le relargage se fait avec du sel cristallin, sinon il est impossible d'atteindre une saturation complète).
Le point isoélectrique de la myosine est à pH 5,4-5,5.
La myosine a la capacité de nouer des liens spéciaux avec diverses substances, principalement avec des protéines, avec formation de complexes. Un rôle particulier dans l'activité des muscles est joué par le complexe de la myosine avec l'actine - actomyosine.
actine et actomyosine
La protéine actine peut exister sous deux formes : fibrillaire et globulaire. Dans le muscle au repos, l'actine est sous forme fibrillaire ; avec la contraction musculaire, il devient globuleux. Grande importance dans cette transformation ont l'acide adénosine triphosphorique et ses sels.
Le tissu musculaire contient 12 à 15 % d'actine. Il passe en solution lors d'une extraction prolongée avec des solutions salines ; avec une extraction à court terme, il reste dans le stroma. Le poids moléculaire de l'actine est d'environ 75 000.
Lorsque des solutions d'actine et de myosine sont mélangées, un complexe se forme, appelé actomyosine, à partir duquel les myofibrilles sont principalement construites. Ce complexe est très visqueux, capable de se contracter fortement à certaines concentrations d'ions potassium et magnésium (0,05 m KCl > et 0,001 m MgCl2) en présence d'adénosine triphosphate. À des concentrations de sel plus élevées (KCl 0,6 M), l'actomyosine se décompose en actine et en myosine lorsque de l'ATP est ajouté. La viscosité de la solution est nettement réduite.
Selon Szent Giorgi, la contraction de l'actomyosine sous l'action de l'ATP sous-tend la contraction d'un muscle vivant.
L'actomyosine, en tant que véritable globuline, est insoluble dans l'eau. Lors du traitement de la viande avec des solutions salines, l'actomyosine à teneur indéterminée en actine passe dans la solution, en fonction de la durée de l'extraction.
Globuline X
Le tissu musculaire contient environ 20% de globuline X de la quantité totale de protéines. C'est une globuline typique, c'est-à-dire qu'elle ne se dissout pas dans l'eau, mais se dissout dans des solutions salines de concentration moyenne; précipite à partir de solutions à demi saturation avec du sulfate d'ammonium (1 volume de solution protéique et 1 volume de solution saturée de sulfate d'ammonium), du chlorure de sodium à pleine saturation.
Myogène
Le tissu musculaire contient environ 20% de myogène de la quantité totale de protéines. Il ne peut pas être attribué aux albumines ou globulines typiques, car il se dissout dans l'eau, n'est pas suffisamment relargué avec du chlorure de sodium et du sulfate de magnésium lorsqu'il est saturé (sel cristallin), en même temps il est précipité avec du sulfate d'ammonium à 2/3 saturation ( 1 volume de solution de protéines et 2 volumes de solution saturée de sulfate d'ammonium). Cette protéine a été obtenue sous forme cristalline. Le poids moléculaire du myogène est de 150 000.
V. A. Engelgardt a découvert dans le myogène la capacité de catalyser l'une des réactions les plus importantes se produisant dans le processus de glycolyse du tissu musculaire. Cette découverte a été la première à montrer que les protéines structurales, c'est-à-dire les protéines impliquées dans la construction des tissus, peuvent avoir une activité enzymatique.
Myoalbumine
Le tissu musculaire contient environ 1 à 2 % de myoalbumine par rapport à la quantité totale de protéines. C'est une albumine typique, c'est-à-dire qu'elle se dissout dans l'eau, ne précipite pas avec du chlorure de sodium lorsqu'elle est saturée, mais précipite avec du sulfate d'ammonium.
Myoglobine
La myoglobine est une protéine chromoprotéique complexe d'un poids moléculaire de 16 900. Lors de l'hydrolyse, elle se décompose en protéine globine et en groupe hème non protéique. La myoglobine colore les muscles en rouge ; elle diffère de l'hémoglobine par sa partie protéique ; ils ont le même groupe prothétique.
Lorsqu'il est oxydé, l'hème passe dans l'hématine, et en présence de d'acide chlorhydrique- en gémeaux. Par la teneur en hémine, on peut juger de la quantité de myoglobine dans le tissu musculaire.
Le contenu de l'hémine dans les muscles du grand bétail varie de 42 à 60 mg pour 100 g de tissu ; dans les muscles des porcs, c'est beaucoup moins - de 22 à 42 mg pour 100 g de tissu, ils sont donc moins colorés.
La myoglobine, comme les pigments sanguins, a un spectre d'absorption caractéristique.
Le principe de l'obtention des spectres d'absorption des substances colorées, notamment des pigments de viande et de sang, est que l'énergie lumineuse traversant une solution pigmentaire est absorbée par cette solution. Dans ce cas, il se produit ce que l'on appelle l'absorption (absorption) de la lumière, qui peut être détectée avec un spectroscope.
Les bandes d'absorption caractéristiques des tissus musculaires et des pigments sanguins vont de 400 à 700 microns. Dans cet intervalle, les ondes sont perçues par notre œil, et nous pouvons voir des bandes sombres dans le spectre à travers le spectroscope, résultant de l'absorption de la lumière avec une certaine longueur d'onde.

L'absorption de la lumière par des substances colorées peut être quantifiée avec un spectrophotomètre. Les résultats obtenus sont généralement exprimés graphiquement. Dans ce cas, la longueur d'onde de la lumière est tracée le long de l'axe des abscisses et le pourcentage de lumière qui a traversé la solution le long de l'axe des ordonnées. Moins la lumière passait, plus elle était absorbée par sa substance colorée. La transmission totale de la lumière par la solution est prise égale à 100 %.
Sur la fig. la figure 10 montre l'absorption (absorption) de la lumière par une solution d'oxymyoglobine ; il montre que l'oxymyoglobine a deux bandes d'absorption caractéristiques prononcées dans la région visible du spectre, c'est-à-dire deux régions dans lesquelles elle transmet le moins de lumière et, par conséquent, absorbe le plus de lumière. Les maxima de ces sections sont à deux longueurs d'onde ; λ 585 mmk et λ 545 mmk,
Sur la fig. La figure 11 montre la courbe spectrophotométrique de l'oxyhémoglobine pour comparaison.
La myoglobine a une plus grande capacité à se lier à l'oxygène que l'hémoglobine sanguine. La myoglobine fournit de l'oxygène aux tissus musculaires. Les muscles qui travaillent contiennent plus de myoglobine, car l'oxydation s'y déroule plus intensément. On sait que les muscles des jambes sont plus fortement colorés que le muscle dorsal ; les muscles des bœufs de travail sont également plus fortement colorés que ceux des animaux qui ne travaillent pas. Ceci est particulièrement visible chez les oiseaux, muscles pectoraux qui, étant non fonctionnels, ne sont presque pas peints.
collagène et élastine
Le collagène et l'élastine sont des protéines du tissu conjonctif insolubles dans l'eau et les solutions salines. Ils forment le sarcolemme - la coque la plus fine de la fibre musculaire.
Nucléoprotéines
Les nucléoprotéines sont des protéines qui composent le noyau cellulaire. caractéristique leur capacité à se dissoudre dans des solutions d'alcalis faibles. Cela est dû au fait que leur molécule contient un groupement prosthétique qui a des propriétés acides.
Séparation des protéines musculaires
Lorsque le tissu musculaire est traité avec des solutions salines de concentration moyenne, ses protéines peuvent être divisées en protéines stromales et protéines plasmatiques. Le stroma est compris comme la base structurelle du tissu musculaire, insoluble dans une solution saline, qui se compose principalement de protéines sarcolemmiques (voir schéma).

La solubilité des protéines intracellulaires du tissu musculaire est différente. Par exemple, l'actomyosine et la globuline X ne se dissolvent pas dans l'eau et sont plus facilement précipitées à partir de solutions salines par le sulfate d'ammonium et le chlorure de sodium que le myogène. Le myogène se dissout dans l'eau comme la myoalbumine, mais en diffère par le relargage.
La solubilité des protéines du tissu musculaire dans des solutions salines à réaction neutre et leur sédimentation sont présentées dans le tableau. huit.

Pendant le salage, la cuisson et d'autres types de transformation technologique de la viande, il y a une perte de substances protéiques. Les valeurs des pertes de protéines sont dues à leur solubilité et à leur sédimentation différentes.
Connaissant les propriétés des protéines, il est possible de choisir les conditions dans lesquelles les pertes seront les moins importantes. Par conséquent, étudier propriétés spécifiées les protéines doivent faire l'objet d'une attention particulière.
L'étude composition chimique myofibrilles ont montré que les filaments épais et fins ne sont composés que de protéines.
Les filaments épais sont constitués de protéines myosine. La myosine est une protéine d'un poids moléculaire d'environ 500 kDa, contenant deux chaînes polypeptidiques très longues. Ces chaînes forment une double hélice, mais à une extrémité, ces fils divergent et forment une formation sphérique - une tête globulaire. Par conséquent, deux parties se distinguent dans la molécule de myosine - une tête globulaire et une queue. Le filament épais contient environ 300 molécules de myosine et 18 molécules de myosine se trouvent sur la section transversale du filament épais. Les molécules de myosine dans les filaments épais s'entrelacent avec leurs queues et leurs têtes dépassent du filament épais dans une spirale régulière. Il existe deux sites importants (centres) dans les têtes de myosine. L'un d'eux catalyse le clivage hydrolytique de l'ATP, c'est-à-dire correspond au site actif de l'enzyme. L'activité ATPase de la myosine a été découverte pour la première fois par les biochimistes russes Engelhardt et Lyubimova. La deuxième section de la tête de myosine assure la connexion des filaments épais avec la protéine des filaments fins lors de la contraction musculaire - actine. Les filaments fins sont constitués de trois protéines : actine, troponine et tropomyosine.
La protéine principale des filaments minces - actine. L'actine est une protéine globulaire d'un poids moléculaire de 42 kDa. Cette protéine a deux propriétés importantes. Tout d'abord, il montre haute capacitéà la polymérisation pour former de longues chaînes appelées actine fibrillaire(peut être comparé à un collier de perles). Deuxièmement, comme déjà noté, l'actine peut se connecter aux têtes de myosine, ce qui conduit à la formation de ponts transversaux, ou adhérences, entre les filaments minces et épais.
La base d'un fil fin est une double hélice de deux chaînes d'actine fibrillaire, contenant environ 300 molécules d'actine globulaire (comme deux brins de billes torsadées en double hélice, chaque bille correspond à de l'actine globulaire).
Une autre protéine de filaments fins - tropomyosine a aussi la forme double hélice, mais cette hélice est formée de chaînes polypeptidiques et est beaucoup plus petite que la double hélice d'actine. La tropomyosine est située dans le sillon de la double hélice de l'actine fibrillaire.
La troisième protéine de filaments minces - troponine- se fixe à la tropomyosine et fixe sa position dans le sillon d'actine, ce qui bloque l'interaction des têtes de myosine avec les molécules d'actine globulaire de filaments fins.
5. Méthodes technologiques pour accélérer la maturation de la viande
Après la fin de la vie de l'animal (synthèse), un ensemble de changements se produit dans la viande, qui sont influencés par les enzymes. L'auto-désintégration des tissus commence sous l'action des enzymes des tissus eux-mêmes. Ce processus est appelé autolyse. Dans ce cas, les tissus musculaires, conjonctifs et adipeux subissent des modifications. Les modifications du tissu musculaire pendant le stockage affectent la qualité de la viande.
Au cours de la vie d'un animal, la fonction principale du tissu musculaire est motrice, à la suite de quoi l'énergie chimique est convertie en énergie mécanique. Ces transformations complexes se produisent par des processus biochimiques, physiologiques, physiques et thermodynamiques.
L'aspect biochimique s'exprime dans la modification des myofibrilles de protéines, principalement la myosine et l'actine (80 % des protéines). Lors de la contraction, l'actine fibrillaire se combine avec la myosine. Un complexe d'actomyosine fort est formé, dans lequel il y a 2-3 molécules d'actine par molécule de myosine.
Le mécanisme énergétique de la contraction consiste à modifier l'énergie libre formée lors de la dégradation de l'ATP. L'activité ATP est possédée par la protéine myosine, qui se combine avec l'actine lors de la dégradation de l'ATP, formant un complexe actinomyosine, c'est-à-dire le processus de durcissement a lieu. Dans ce cas, la myosine n'est pas seulement une protéine, mais à sa manière une enzyme.
La phase de maturation correcte de la viande se caractérise par une dégradation intense du glycogène musculaire et une accumulation d'acide lactique, ainsi qu'une modification de sa composition chimique, mais la rigueur est incluse dans le processus d'autolyse.
Un trait caractéristique de la rigueur de la rigueur est une diminution de la capacité de rétention d'eau du tissu musculaire, à la suite de quoi il y a toujours une séparation du jus musculaire. Par signes extérieurs la viande raidie a une plus grande élasticité, pendant le traitement thermique - une rigidité excessive, et en raison d'une diminution de la capacité de rétention d'humidité, elle devient moins juteuse. A l'état de raideur, les muscles sont moins sensibles à l'action des enzymes protéométiques et la viande est moins digeste.
En raison de l'accumulation d'acides lactique, phosphorique et autres dans la viande, la concentration d'ions hydrogène augmente, à la suite de quoi, à la fin de la rigueur, le pH diminue à 5,8-5,7, et parfois même plus bas. Dans un environnement acide, la dégradation de l'ATP et de l'acide phosphorique entraîne une accumulation partielle de phosphore inorganique.
La phase de maturation détermine en grande partie l'intensité du déroulement des processus physico-colloïdes et des modifications microstructurales des fibres musculaires. À la suite d'un ensemble de raisons (l'action des enzymes protéométiques, la formation de produits de désintégration autolytique, un environnement acide), la dégradation des fibres musculaires se produit. Une carie profonde indique déjà une autolyse profonde, qui est plus souvent observée avec la détérioration de la viande. Dans la phase de transition en douceur de la rigidité à la maturation, la viande se ramollit, se détend, la tendreté apparaît, ce qui signifie que les sucs digestifs pénètrent librement dans le sarcoplasme, ce qui améliore la digestibilité et la digestibilité de la viande.
La tendreté des tissus de la viande, où il y a beaucoup de tissu conjonctif, est faible et la viande des jeunes animaux est plus tendre que celle des vieux.
Avec une augmentation de la température (jusqu'à 30 0 C), ainsi qu'avec un vieillissement prolongé de la viande (plus de 20-26 jours) à des températures positives basses (2-4 0 C), le processus de maturation enzymatique s'approfondit tellement que la quantité de la dégradation des protéines dans la viande augmente sensiblement les petits peptides et les acides aminés libres. À ce stade, la viande acquiert une couleur brune, la quantité d'amine et d'azote ammoniacal augmente, une décomposition hydrolytique notable des graisses se produit, ce qui affecte négativement ses propriétés nutritionnelles et la présentation de la viande.
Pour accélérer la maturation de la viande, ce qui améliore sa qualité, diverses méthodes de transformation sont utilisées, notamment l'utilisation d'enzymes et d'antibiotiques.
Des études ont également montré que le traitement de surface de la viande (par immersion dans une solution ou par pulvérisation de poudre) ne donne pas un effet suffisant.
De bons résultats sont obtenus par la fermentation de la viande, réalisée simultanément après réduction par sublimation.
Une préparation enzymatique est ajoutée aux aliments en conserve pour obtenir des produits de meilleure qualité. Il est proposé d'ajouter des préparations aux saucisses de qualité inférieure.
La viande traitée avec des préparations enzymatiques doit être apparence, la couleur, l'arôme ne diffèrent pas des non-enzymatiques, mais par le goût - être plus doux, sans goût amer causé par les produits de dégradation profonde des protéines par les enzymes.