Enciclopedia școlară. Entropie
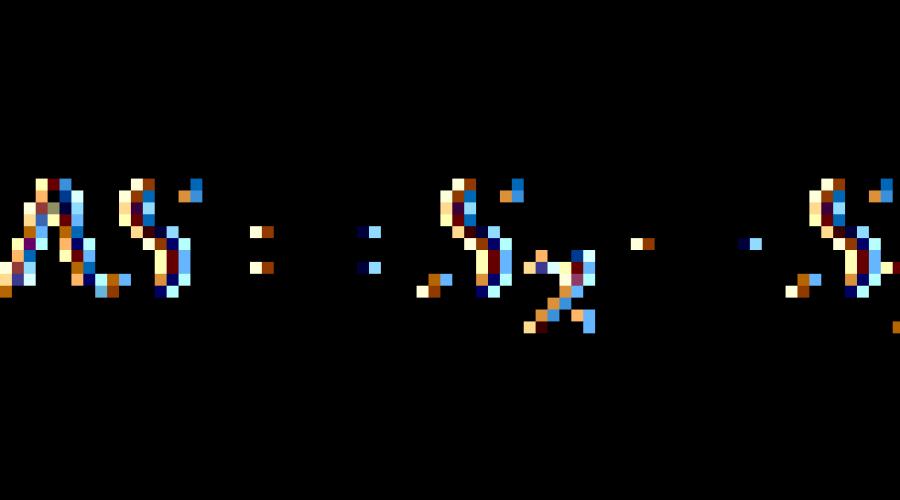
Citeste si
§6 Entropie
De obicei, orice proces în care un sistem trece de la o stare la alta se desfășoară în așa fel încât este imposibil să se efectueze acest proces în direcția opusă, astfel încât sistemul să treacă prin aceleași stări intermediare fără modificări în corpurile înconjurătoare. Acest lucru se datorează faptului că o parte din energie este disipată în proces, de exemplu, datorită frecării, radiațiilor și așa mai departe. Aproape toate procesele din natură sunt ireversibile. În orice proces, ceva energie se pierde. Pentru a caracteriza disiparea energiei se introduce conceptul de entropie. ( Valoarea entropiei caracterizează starea termică a sistemului și determină probabilitatea implementării acestei stări a corpului. Cu cât o stare dată este mai probabilă, cu atât entropia este mai mare.) Toate procese naturaleînsoţită de o creştere a entropiei. Entropia rămâne constantă doar în cazul unui proces reversibil idealizat care are loc într-un sistem închis, adică într-un sistem în care nu există schimb de energie cu corpurile exterioare acestui sistem.
Entropia și semnificația ei termodinamică:
Entropie- aceasta este o astfel de funcție a stării sistemului, a cărei modificare infinitezimală într-un proces reversibil este egală cu raportul dintre cantitatea infinit de căldură introdusă în acest proces și temperatura la care a fost introdusă.
Într-un proces final reversibil, modificarea entropiei poate fi calculată folosind formula:
![]()
unde integrala este luată de la starea inițială 1 a sistemului până la starea finală 2.
Deoarece entropia este o funcție de stare, atunci proprietatea integraleieste independența sa față de forma conturului (calea) de-a lungul căruia este calculată, prin urmare, integrala este determinată numai de stările inițiale și finale ale sistemului.
- În orice proces reversibil de modificare a entropiei este 0
(1)
- Termodinamica demonstrează căSsistemul care face un ciclu ireversibil crește
Δ S> 0 (2)
Expresiile (1) și (2) se aplică numai sistemelor închise, dacă sistemul schimbă căldură cu Mediul extern, apoi eSse poate comporta în orice fel.
Relațiile (1) și (2) pot fi reprezentate ca inegalitatea Clausius
∆S ≥ 0
acestea. entropia unui sistem închis poate fie să crească (în cazul proceselor ireversibile) fie să rămână constantă (în cazul proceselor reversibile).
Dacă sistemul face o tranziție de echilibru de la starea 1 la starea 2, atunci entropia se modifică
![]()
Unde dUȘi δAscris pentru un anumit proces. Conform acestei formule, ΔSse determină până la o constantă aditivă. sens fizic nu are entropia în sine, ci diferența de entropii. Să aflăm modificarea entropiei în procesele unui gaz ideal.
![]()
acestea. modificări de entropieS Δ S 1→2 a unui gaz ideal în timpul trecerii lui de la starea 1 la starea 2 nu depinde de tipul procesului.
Deoarece pentru un proces adiabatic δQ = 0, atunci ∆ S= 0 => S= const , adică un proces adiabatic reversibil are loc la entropie constantă. Prin urmare, se numește izoentropic.
Într-un proces izoterm (T= const ; T 1 = T 2 : )
![]()
Într-un proces izocor (V= const ; V 1 = V 2 ; )
![]()
Entropia are proprietatea aditivității: entropia sistemului este egală cu suma entropiilor corpurilor incluse în sistem.S = S 1 + S 2 + S 3 + ... Diferența calitativă dintre mișcarea termică a moleculelor și alte forme de mișcare este aleatorietatea, dezordinea acesteia. Prin urmare, pentru a caracteriza mișcarea termică, este necesar să se introducă o măsură cantitativă a gradului de tulburare moleculară. Dacă luăm în considerare orice stare macroscopică dată a unui corp cu anumite valori medii ale parametrilor, atunci este altceva decât o schimbare continuă a microstărilor apropiate care diferă unele de altele în distribuția moleculelor în părți diferite volumul și energia distribuită între molecule. Numărul acestor microstări în continuă schimbare caracterizează gradul de tulburare a stării macroscopice a întregului sistem,wse numește probabilitatea termodinamică a unei microstări date. Probabilitatea termodinamicăwstările sistemului este numărul de moduri în care poate fi realizată o anumită stare a unui sistem macroscopic sau numărul de microstări care implementează o anumită microstare (w≥ 1 și probabilitate matematică ≤ 1 ).
Am convenit să luăm logaritmul probabilității sale, luat cu semnul minus, ca măsură a neașteptății unui eveniment: neașteptarea stării este egală cu =-
Potrivit lui Boltzmann, entropiaSsistemele și probabilitatea termodinamică sunt legate după cum urmează:
Unde - constanta Boltzmann (![]() ). Astfel, entropia este determinată de logaritmul numărului de stări cu care poate fi realizată o anumită microstare. Entropia poate fi considerată ca o măsură a probabilității stării sistemului t/d. Formula Boltzmann ne permite să dăm entropiei următoarea interpretare statistică. Entropia este o măsură a dezordinei unui sistem. Într-adevăr, cu cât este mai mare numărul de microstări care realizează o anumită microstare, cu atât este mai mare entropia. În starea de echilibru a sistemului - cea mai probabilă stare a sistemului - numărul de microstări este maxim, în timp ce entropia este de asemenea maximă.
). Astfel, entropia este determinată de logaritmul numărului de stări cu care poate fi realizată o anumită microstare. Entropia poate fi considerată ca o măsură a probabilității stării sistemului t/d. Formula Boltzmann ne permite să dăm entropiei următoarea interpretare statistică. Entropia este o măsură a dezordinei unui sistem. Într-adevăr, cu cât este mai mare numărul de microstări care realizează o anumită microstare, cu atât este mai mare entropia. În starea de echilibru a sistemului - cea mai probabilă stare a sistemului - numărul de microstări este maxim, în timp ce entropia este de asemenea maximă.
Deoarece procesele reale sunt ireversibile, atunci se poate argumenta că toate procesele dintr-un sistem închis duc la o creștere a entropiei sale - principiul creșterii entropiei. În interpretarea statistică a entropiei, aceasta înseamnă că procesele dintr-un sistem închis merg în direcția creșterii numărului de microstări, cu alte cuvinte, de la stări mai puțin probabile la cele mai probabile, până când probabilitatea stării devine maximă.
§7 A doua lege a termodinamicii
Prima lege a termodinamicii, care exprimă legea conservării energiei și transformării energiei, nu permite stabilirea direcției fluxului proceselor t/d. În plus, este posibil să ne imaginăm un set de procese care nu se contraziceuînceputul m/d, în care energia este stocată, dar în natură nu sunt realizate. Formulări posibile ale celui de-al doilea început t/d:
1) legea creșterii entropiei unui sistem închis în timpul proceselor ireversibile: orice proces ireversibil într-un sistem închis are loc în așa fel încât entropia sistemului crește ΔS≥ 0 (proces ireversibil) 2) ΔS≥ 0 (S= 0 pentru reversibil și ΔS≥ 0 pentru proces ireversibil)
În procesele care au loc într-un sistem închis, entropia nu scade.
2) Din formula Boltzmann S = , prin urmare, o creștere a entropiei înseamnă o tranziție a sistemului de la o stare mai puțin probabilă la una mai probabilă.
3) Potrivit lui Kelvin: un proces circular nu este posibil, al cărui singur rezultat este conversia căldurii primite de la încălzitor în lucru echivalent cu acesta.
4) Potrivit lui Clausius: un proces circular nu este posibil, al cărui singur rezultat este transferul de căldură de la un corp mai puțin încălzit la unul mai încălzit.
Pentru a descrie sistemele t/d la 0 K, se folosește teorema Nernst-Planck (a treia lege a lui t/d): entropia tuturor corpurilor aflate în echilibru tinde spre zero pe măsură ce temperatura se apropie de 0 K
Din teoremă Nernst-Planck urmează căC p= C v = 0 la 0 LA
§8 Maşini termice şi frigorifice.
Ciclul Carnot și eficiența acestuia
Din formularea celei de-a doua legi a lui t / d în conformitate cu Kelvin, rezultă că o mașină de mișcare perpetuă de al doilea fel este imposibilă. (O mașină cu mișcare perpetuă este un motor care funcționează periodic care funcționează prin răcirea unei surse de căldură.)
 Termostat- acesta este un sistem t/d care poate face schimb de căldură cu corpurile fără a modifica temperatura.
Termostat- acesta este un sistem t/d care poate face schimb de căldură cu corpurile fără a modifica temperatura.
Principiul de funcționare al unui motor termic: de la un termostat cu o temperatură T 1 - încălzitor, cantitatea de căldură este luată pe cicluQ 1 , si termostat cu temperatura T 2 (T 2 < T 1) - frigider, cantitatea de căldură transferată pe cicluQ 2 , în timp ce lucrați A = Q 1 - Q 2
 Proces sau ciclu circular este procesul prin care sistemul, după ce trece printr-o serie de stări, revine la starea inițială. Pe diagrama de stare, ciclul este reprezentat printr-o curbă închisă. Ciclul efectuat de un gaz ideal poate fi împărțit în procese de expansiune (1-2) și compresie (2-1), lucrul de expansiune este pozitiv A 1-2 > 0, deoareceV 2
>
V 1
, lucrul de compresie este negativ A 1-2 < 0, т.к.
V 2
<
V 1
. Prin urmare, munca efectuată de gaz pe ciclu este determinată de aria acoperită de curba închisă 1-2-1. Dacă munca pozitivă este efectuată într-un ciclu (ciclul este în sensul acelor de ceasornic), atunci ciclul se numește direct, dacă este un ciclu invers (ciclul are loc în sens invers acelor de ceasornic).
Proces sau ciclu circular este procesul prin care sistemul, după ce trece printr-o serie de stări, revine la starea inițială. Pe diagrama de stare, ciclul este reprezentat printr-o curbă închisă. Ciclul efectuat de un gaz ideal poate fi împărțit în procese de expansiune (1-2) și compresie (2-1), lucrul de expansiune este pozitiv A 1-2 > 0, deoareceV 2
>
V 1
, lucrul de compresie este negativ A 1-2 < 0, т.к.
V 2
<
V 1
. Prin urmare, munca efectuată de gaz pe ciclu este determinată de aria acoperită de curba închisă 1-2-1. Dacă munca pozitivă este efectuată într-un ciclu (ciclul este în sensul acelor de ceasornic), atunci ciclul se numește direct, dacă este un ciclu invers (ciclul are loc în sens invers acelor de ceasornic).
ciclu direct utilizat la motoarele termice – motoare care funcționează periodic care efectuează lucrări datorită căldurii primite din exterior. Ciclul invers este utilizat în mașini frigorifice- instalatii care functioneaza periodic, in care, datorita muncii fortelor exterioare, caldura este transferata catre un corp cu temperatura mai mare.
Ca rezultat al procesului circular, sistemul revine la starea inițială și, prin urmare, modificarea totală a energiei interne este zero. ApoiІ începe t/d pentru proces circular
Q= Δ U+ A= A,
Adică munca efectuată pe ciclu este egală cu cantitatea de căldură primită din exterior, dar
Q= Q 1 - Q 2
Q 1 - cantitate căldură primită de sistem,
Q 2 - cantitate căldură degajată de sistem.
Eficiență termică pentru un proces circular este egal cu raportul dintre munca efectuată de sistem și cantitatea de căldură furnizată sistemului:
![]()
Pentru η = 1, condițiaQ 2 = 0, adică motorul termic trebuie să aibă o singură sursă de căldurăQ 1 , dar aceasta contrazice a doua lege a lui t/d.
Procesul este inversul a ceea ce se întâmplă în motor termic, folosit la mașina frigorifică.
 De la termostat cu temperatura T 2 se ia cantitatea de căldurăQ 2
si transmis la termostat cu temperaturaT 1
, cantitatea de căldurăQ 1
.
De la termostat cu temperatura T 2 se ia cantitatea de căldurăQ 2
si transmis la termostat cu temperaturaT 1
, cantitatea de căldurăQ 1
.
Q= Q 2 - Q 1 < 0, следовательно A< 0.
Fără a lucra, este imposibil să iei căldură de la un corp mai puțin încălzit și să o dai unuia mai fierbinte.
Pe baza celei de-a doua legi a lui t/d, Carnot a dedus o teoremă.
Teorema lui Carnot: a tuturor motoarelor termice care funcționează periodic cu aceleași temperaturi ale încălzitorului ( T 1) și frigidere ( T 2), cea mai mare eficiență. au mașini reversibile. K.P.D. masini reversibile pentru egal T 1 și T 2 sunt egale și nu depind de natura fluidului de lucru.
Un corp de lucru este un corp care efectuează un proces circular și schimbă energie cu alte corpuri.
Ciclul Carnot este cel mai economic ciclu reversibil, format din 2 izoterme și 2 adiabați.
 1-2-expansiune izotermă la T 1 încălzitor; căldura este furnizată gazuluiQ 1
si munca este facuta
1-2-expansiune izotermă la T 1 încălzitor; căldura este furnizată gazuluiQ 1
si munca este facuta![]()
2-3 - adiabat. expansiune, gazul funcționeazăA 2-3 >0 peste corpurile externe.
3-4 compresie izotermă la T 2 frigidere; se ia calduraQ 2
si munca este facuta![]() ;
;
Compresie 4-1-adiabatică, se lucrează pe gaz A 4-1 <0 внешними телами.
Într-un proces izotermU= const , deci Q 1 = A 12
![]() 1
1
Cu expansiune adiabaticăQ 2-3 = 0, iar gazul funcționează A 23 realizat cu energie internă A 23 = - U
![]()
Cantitatea de căldurăQ 2 , dat de gaz la frigider în timpul compresiei izoterme este egal cu munca de compresie A 3-4
![]() 2
2
Lucrări de compresie adiabatică
![]()
Lucrare realizată într-un proces circular
A = A 12 + A 23 + A 34 + A 41 = Q 1 + A 23 - Q 2 - A 23 = Q 1 - Q 2
și este egală cu aria curbei 1-2-3-4-1.
Eficiență termică Ciclul Carnot
![]()
Din ecuația adiabatică pentru procesele 2-3 și 3-4 obținem
Apoi ![]()
![]()
acestea. eficienţă Ciclul Carnot este determinat doar de temperaturile încălzitorului și răcitorului. Pentru a crește eficiența trebuie să măresc diferența T 1 - T 2 .
******************************************************* ******************************************************
Termodinamica (greacă θέρμη - „căldură”, δύναμις – „forță”) este o ramură a fizicii care studiază cele mai generale proprietăți ale sistemelor macroscopice și metodele de transfer și transformare a energiei în astfel de sisteme.
În termodinamică se studiază stări și procese, pentru descrierea cărora poate fi introdus conceptul de temperatură. Termodinamica (T.) este o știință fenomenologică bazată pe generalizări ale faptelor experimentale. Procesele care au loc în sisteme termodinamice ax sunt descrise prin mărimi macroscopice (temperatură, presiune, concentrații de componente), care sunt introduse pentru a descrie sisteme formate dintr-un număr mare de particule și nu sunt aplicabile moleculelor și atomilor individuali, spre deosebire, de exemplu, de cantitățile introduse. în mecanică sau electrodinamică.
Termodinamica fenomenologică modernă este o teorie riguroasă dezvoltată pe baza mai multor postulate. Cu toate acestea, legătura acestor postulate cu proprietățile și legile interacțiunii particulelor, din care sunt construite sistemele termodinamice, este dată de fizica statistică. Fizica statistică face posibilă, de asemenea, clarificarea limitelor de aplicabilitate ale termodinamicii.
Legile termodinamicii sunt de natură generală și nu depind de detaliile specifice ale structurii materiei la nivel atomic. Prin urmare, termodinamica este aplicată cu succes într-o gamă largă de probleme de știință și tehnologie, cum ar fi energia, ingineria termică, tranzițiile de fază, reacțiile chimice, fenomenele de transport și chiar găurile negre. Termodinamica este importantă pentru diverse domenii ale fizicii și chimiei, ingineriei chimice, ingineriei aerospațiale, ingineriei mecanice, biologiei celulare, ingineriei biomedicale, știința materialelor și își găsește aplicația chiar și în domenii precum economie.
Ani importanți în istoria termodinamicii
- Originea termodinamicii ca știință este asociată cu numele lui G. Galilei, care a introdus conceptul de temperatură și a conceput primul dispozitiv care răspunde la schimbările de temperatură. mediu inconjurator (1597).
- Curând G. D. Fahrenheit (G. D. Fahrenheit, 1714), R. Reaumur (R. Reaumur, 1730) și A. Celsius (A. Celsius, 1742) au creat scale de temperatură în conformitate cu acest principiu.
- J. Black a introdus deja în 1757 conceptele de căldură latentă de fuziune și capacitate de căldură (1770). Și Wilke (J. Wilcke, 1772) a introdus definiția unei calorii ca fiind cantitatea de căldură necesară pentru a încălzi 1 g de apă cu 1 °C.
- Lavoisier (A. Lavoisier) și Laplace (P. Laplace) în 1780 au proiectat un calorimetru (vezi Calorimetrie) și au determinat pentru prima dată experimental ritmul. capacitatea termică a unui număr de substanţe.
- În 1824, N. L, S. Carnot a publicat o lucrare dedicată studiului principiilor de funcționare a motoarelor termice.
- B. Clapeyron a introdus o reprezentare grafică a proceselor termodinamice și a dezvoltat metoda ciclurilor infinitezimale (1834).
- G. Helmholtz a remarcat natura universală a legii conservării energiei (1847). Ulterior, R. Clausius și W. Thomson (Kelvin; W. Thomson) au dezvoltat sistematic aparatul teoretic al termodinamicii, care s-a bazat pe prima lege a termodinamicii și pe cea de-a doua lege a termodinamicii.
- Dezvoltarea legii a 2-a l-a condus pe Clausius la definirea entropiei (1854) și formularea legii creșterii entropiei (1865).
- Începând cu lucrările lui J. W. Gibbs (1873), care a propus metoda potențialelor termodinamice, a fost dezvoltată teoria echilibrului termodinamic.
- La etajul 2. secolul al 19-lea au fost efectuate studii ale gazelor reale. Un rol deosebit l-au jucat experimentele lui T. Andrews, care a descoperit primul punctul critic al sistemului lichid-vapori (1861), existența acestuia fiind prezisă de D. I. Mendeleev (1860).
- Până la sfârșitul secolului al XIX-lea S-au făcut progrese mari în obținerea temperaturilor scăzute, în urma cărora s-au lichefiat O2, N2 și H2.
- În 1902, Gibbs a publicat o lucrare în care toate relațiile termodinamice de bază au fost obținute în cadrul fizicii statistice.
- Relația dintre cinetică proprietățile corpului și termodinamica acestuia. caracteristici a fost stabilit de L. Onsager (L. Onsager, 1931).
- În secolul al XX-lea a investigat intens termodinamica solidelor, precum și a lichidelor cuantice și a cristalelor lichide, în care au loc diverse tranziții de fază.
- LD Landau (1935-37) a dezvoltat o teorie generală a tranzițiilor de fază bazată pe conceptul de rupere spontană a simetriei.
Secțiuni de termodinamică
Termodinamica fenomenologică modernă este de obicei împărțită în termodinamică de echilibru (sau clasică), care studiază sistemele și procesele termodinamice de echilibru în astfel de sisteme și termodinamica de neechilibru, care studiază procesele de neechilibru în sisteme în care abaterea de la echilibrul termodinamic este relativ mică și permite totuși o termodinamică. Descriere.

Termodinamică de echilibru (sau clasică).
În termodinamica de echilibru, sunt introduse variabile precum energia internă, temperatura, entropia și potențialul chimic. Toți se numesc parametri (cantități) termodinamici. Termodinamica clasică studiază conexiunile parametrilor termodinamici între ei și cu mărimi fizice introduse în considerare în alte ramuri ale fizicii, de exemplu, cu un câmp gravitațional sau electromagnetic care acționează asupra unui sistem. Reacțiile chimice și tranzițiile de fază sunt de asemenea incluse în tema termodinamicii clasice. Totuși, studiul sistemelor termodinamice, în care transformările chimice joacă un rol esențial, face obiectul termodinamicii chimice, iar ingineria termică se ocupă de aplicații tehnice.

Termodinamica clasică include următoarele secțiuni:
- principiile termodinamicii (uneori numite și legi sau axiome)
- ecuații de stare și proprietăți ale sistemelor termodinamice simple (gaz ideal, gaz real, dielectrici și magneți etc.)
- procese de echilibru cu sisteme simple, cicluri termodinamice
- procesele de neechilibru și legea entropiei nedescrescătoare
- fazele termodinamice și tranzițiile de fază
În plus, termodinamica modernă include și următoarele domenii:
- o formulare matematică riguroasă a termodinamicii bazată pe analiză convexă
- termodinamică neextensivă
În sistemele care nu sunt într-o stare de echilibru termodinamic, de exemplu, într-un gaz în mișcare, se poate folosi aproximarea echilibrului local, în care se presupune că relațiile termodinamice de echilibru sunt satisfăcute local în fiecare punct al sistemului.
Termodinamica de neechilibru
În termodinamica de neechilibru, variabilele sunt considerate locale nu numai în spațiu, ci și în timp, adică timpul poate fi inclus în mod explicit în formulele sale. Rețineți că lucrarea clasică a lui Fourier „The Analytical Theory of Heat” (1822) dedicată problemelor conducerii căldurii a fost înaintea nu numai apariției termodinamicii de neechilibru, ci și lucrării lui Carnot „Reflecții asupra forței motrice a focului și pe mașini capabile să dezvolte această forță” (1824), care este considerată a fi punctul de plecare în istoria termodinamicii clasice.
Concepte de bază ale termodinamicii
Sistem termodinamic- un corp sau un grup de corpuri care se află în interacțiune, izolat mental sau efectiv de mediu.
sistem omogen- un sistem în cadrul căruia nu există suprafețe care separă părți ale sistemului (faze) care diferă ca proprietăți.
sistem eterogen- un sistem în cadrul căruia există suprafețe care separă părți ale sistemului care diferă ca proprietăți.
Fază- un set de părți omogene ale unui sistem eterogen, identice ca proprietăți fizice și chimice, separate de alte părți ale sistemului prin interfețe vizibile.
Izolat sistem Un sistem care nu face schimb de materie sau energie cu mediul său.
Închis sistem- un sistem care face schimb de energie cu mediul, dar nu face schimb de materie.
deschis sistem- un sistem care face schimb de materie și energie cu mediul înconjurător.
Totalitatea tuturor proprietăților fizice și chimice ale unui sistem îl caracterizează. stare termodinamică. Toate mărimile care caracterizează orice proprietate macroscopică a sistemului luat în considerare sunt parametrii de stare. S-a stabilit experimental că pentru a caracteriza în mod unic acest sistem este necesar să se utilizeze un anumit număr de parametri numiți independent; toți ceilalți parametri sunt considerați funcții ale parametrilor independenți. Parametrii măsurabili direct, cum ar fi temperatura, presiunea, concentrația etc., sunt de obicei aleși ca parametri de stare independenți. Orice modificare a stării termodinamice a sistemului (modificări în cel puțin un parametru de stare) este proces termodinamic.
Proces reversibil- un proces care permite sistemului să revină la starea inițială fără a lăsa modificări în mediu.
proces de echilibru- un proces în care sistemul trece printr-o serie continuă de stări de echilibru.
Energie este o măsură a capacității sistemului de a lucra; o măsură calitativă generală a mișcării și interacțiunii materiei. Energia este o proprietate inerentă a materiei. Faceți distincția între energia potențială, datorită poziției corpului în câmpul anumitor forțe, și energia cinetică, datorită modificării poziției corpului în spațiu.
Energia internă a sistemului este suma energiilor cinetice și potențiale ale tuturor particulelor care alcătuiesc sistemul. De asemenea, este posibil să se definească energia internă a unui sistem ca fiind energia sa totală minus energia cinetică și potențială a sistemului ca întreg.
Forme de transfer de energie
Formele de transfer de energie de la un sistem la altul pot fi împărțite în două grupe.
- Primul grup include o singură formă de tranziție a mișcării prin ciocniri haotice ale moleculelor a două corpuri alăturate, adică. prin conducție (și în același timp prin radiație). Măsura mișcării transmise în acest mod este căldura. Căldura este o formă de transfer de energie prin mișcarea dezordonată a moleculelor.
- Al doilea grup include diferite forme de tranziție de mișcare, a căror caracteristică comună este mișcarea maselor, acoperind un număr foarte mare de molecule (adică, mase macroscopice), sub acțiunea oricăror forțe. Astfel sunt ridicarea corpurilor într-un câmp gravitațional, trecerea unei anumite cantități de electricitate de la un potențial electrostatic mai mare la unul mai mic, dilatarea unui gaz sub presiune etc. O măsură comună a mișcării transmise prin astfel de metode este munca - o formă de transfer de energie prin mișcarea ordonată a particulelor.
Căldura și munca caracterizează calitativ și cantitativ două forme diferite de transmitere a mișcării dintr-o anumită parte a lumii materiale la alta. Căldura și munca nu pot fi conținute într-un corp. Căldura și munca apar numai atunci când are loc un proces și caracterizează doar procesul. În condiții statice, căldura și munca nu există. Diferența dintre căldură și muncă, luată ca punct de plecare de termodinamică, și opoziția căldurii față de muncă are sens numai pentru corpurile formate din multe molecule, deoarece pentru o moleculă sau pentru un set de câteva molecule, conceptele de căldură și muncă își pierd sensul. Prin urmare, termodinamica ia în considerare numai corpurile formate dintr-un număr mare de molecule, adică. așa-numitele sisteme macroscopice.

Trei legi ale termodinamicii
Principiile termodinamicii sunt un set de postulate care stau la baza termodinamicii. Aceste prevederi au fost stabilite ca urmare a cercetării științifice și au fost dovedite experimental. Ele sunt acceptate ca postulate astfel încât termodinamica să poată fi construită axiomatic.
Necesitatea principiilor termodinamicii este legată de faptul că termodinamica descrie parametrii macroscopici ai sistemelor fără presupuneri specifice privind structura microscopică a acestora. Fizica statistică se ocupă de problemele structurii interne.
Legile termodinamicii sunt independente, adică niciuna dintre ele nu poate fi derivată din alte principii. Analogii celor trei legi ale lui Newton din mecanică sunt cele trei principii din termodinamică, care leagă conceptele de „căldură” și „muncă”:
- Legea zero a termodinamicii vorbește despre echilibrul termodinamic.
- Prima lege a termodinamicii se referă la conservarea energiei.
- A doua lege a termodinamicii este despre fluxurile de căldură.
- A treia lege a termodinamicii este despre inaccesibilitatea zeroului absolut.
Legea generală (zero) a termodinamicii
Legea generală (zero) a termodinamicii afirmă că două corpuri sunt în echilibru termic dacă pot transfera căldură unul altuia, dar acest lucru nu se întâmplă.
Este ușor de ghicit că două corpuri nu își transferă căldură unul altuia dacă temperaturile lor sunt egale. De exemplu, dacă măsurați temperatura unui corp uman cu un termometru (la sfârșitul măsurării, temperatura unei persoane și temperatura termometrului vor fi egale), apoi, cu același termometru, măsurați temperatura a apei din baie și se dovedește că ambele temperaturi sunt aceleași (există echilibru termic al unei persoane cu termometru și al unui termometru cu apă), putem spune că o persoană se află în echilibru termic cu apa din baie.
Din cele de mai sus, putem formula legea zero a termodinamicii astfel: două corpuri care sunt în echilibru termic cu un al treilea sunt, de asemenea, în echilibru termic unul cu celălalt.
Din punct de vedere fizic, legea zero a termodinamicii stabilește punctul de plecare, deoarece, între două corpuri care au aceeași temperatură, nu există flux de căldură. Cu alte cuvinte, putem spune că temperatura nu este altceva decât un indicator al echilibrului termic.

Prima lege a termodinamicii
Prima lege a termodinamicii este legea conservării energiei termice, care afirmă că energia nu dispare fără urmă.
Sistemul poate absorbi sau elibera energia termică Q, în timp ce sistemul efectuează lucru W asupra corpurilor din jur (sau corpurile înconjurătoare efectuează lucru asupra sistemului), în timp ce energia internă a sistemului, care avea valoarea inițială Uini, va fi egal cu Ucon:
Uend-Ustart = ΔU = Q-W
Energia termică, munca și energia internă determină energia totală a sistemului, care este o constantă. Dacă sistemul transferă (preia) o anumită cantitate de energie termică Q, în absența muncii, cantitatea de energie internă a sistemului U va crește (scădea) cu Q.
A doua lege a termodinamicii
A doua lege a termodinamicii spune că energia termică poate curge doar într-o singură direcție - de la un corp cu o temperatură mai mare la un corp cu o temperatură mai scăzută, dar nu invers.
A treia lege a termodinamicii
A treia lege a termodinamicii afirmă că orice proces constând dintr-un număr finit de etape nu va permite atingerea temperaturii zero absolut (deși poate fi abordată semnificativ).
Prima lege a termodinamicii este una dintre cele trei legi de bază ale termodinamicii, care este legea conservării energiei pentru sistemele în care procesele termice sunt esențiale.
Conform primei legi a termodinamicii, un sistem termodinamic (de exemplu, aburul într-un motor termic) poate lucra numai datorită energiei sale interne sau oricăror surse externe de energie.
Prima lege a termodinamicii explică imposibilitatea existenței unei mașini cu mișcare perpetuă de primul fel, care să lucreze fără a extrage energie din nicio sursă.
Esența primei legi a termodinamicii este următoarea:
Când un sistem termodinamic este informat despre o anumită cantitate de căldură Q, în cazul general, energia internă a sistemului DU se modifică și sistemul efectuează munca A:
Ecuația (4), care exprimă prima lege a termodinamicii, este definiția modificării energiei interne a sistemului (DU), deoarece Q și A sunt mărimi măsurabile independent.
Energia internă a sistemului U poate fi găsită, în special, măsurând activitatea sistemului într-un proces adiabatic (adică la Q \u003d 0): Și iadul \u003d - DU, care determină U până la un aditiv. constanta U 0:
U = U + U 0 (5)
Prima lege a termodinamicii afirmă că U este o funcție a stării sistemului, adică fiecare stare a unui sistem termodinamic este caracterizată de o anumită valoare a lui U, indiferent de modul în care sistemul este adus în această stare (în timp ce valorile de Q și A depind de procesul care a condus la schimbarea stării sistemului). Când se studiază proprietățile termodinamice ale sistemelor fizice, prima lege a termodinamicii este de obicei utilizată împreună cu cea de-a doua lege a termodinamicii.
3. A doua lege a termodinamicii
A doua lege a termodinamicii este legea conform căreia procesele macroscopice care se desfășoară la o rată finită sunt ireversibile.
Spre deosebire de procesele reversibile mecanice sau electrodinamice ideale (fără pierderi), procesele reale asociate cu transferul de căldură la o diferență finită de temperatură (adică, curgerea cu o viteză finită) sunt însoțite de diferite pierderi: frecare, difuzie a gazelor, expansiune a gazelor într-un gol, eliberare. de căldură Joule etc.
Prin urmare, aceste procese sunt ireversibile, adică pot continua spontan într-o singură direcție.
A doua lege a termodinamicii a apărut istoric în analiza funcționării motoarelor termice.
Însuși numele „A doua lege a termodinamicii” și prima sa formulare (1850) îi aparțin lui R. Clausius: „... este imposibil un proces în care căldura s-ar transfera spontan de la corpurile mai reci la corpurile mai fierbinți”.
Mai mult, un astfel de proces este imposibil în principiu: nici prin transfer direct de căldură de la corpurile mai reci la cele mai calde, nici prin intermediul oricăror dispozitive fără utilizarea altor procese.
În 1851, fizicianul englez W. Thomson a dat o formulare diferită a celei de-a doua legi a termodinamicii: „Procesele sunt imposibile în natură, singura consecință a cărora ar fi ridicarea unei sarcini produse prin răcirea unui rezervor termic”.
După cum puteți vedea, ambele formulări de mai sus ale celei de-a doua legi a termodinamicii sunt aproape aceleași.
Aceasta implică imposibilitatea implementării unui motor de al 2-lea fel, adică. motor fără pierderi de energie din cauza frecării și a altor pierderi aferente.
În plus, de aici rezultă că toate procesele reale care au loc în lumea materială în sisteme deschise sunt ireversibile.
În termodinamica modernă, a doua lege a termodinamicii sistemelor izolate este formulată într-un mod unic și cel mai general ca legea creșterii unei funcții speciale a stării sistemului, pe care Clausius a numit-o entropie (S).
Semnificația fizică a entropiei este că, în cazul în care un sistem material este în echilibru termodinamic complet, particulele elementare care alcătuiesc acest sistem sunt într-o stare necontrolată și efectuează diverse mișcări haotice aleatorii. În principiu, se poate determina numărul total al acestor stări posibile. Parametrul care caracterizează numărul total al acestor stări este entropia.
Să ne uităm la asta cu un exemplu simplu.
Fie un sistem izolat format din două corpuri „1” și „2” cu temperaturi diferite T 1 >T 2 . Corpul „1” emite o anumită cantitate de căldură Q, iar corpul „2” o primește. În acest caz, există un flux de căldură de la corpul „1” către corpul „2”. Pe măsură ce temperaturile se egalizează, numărul total de particule elementare ale corpurilor „1” și „2”, care se află în echilibru termic, crește. Pe măsură ce acest număr de particule crește, crește și entropia. Și de îndată ce echilibrul termic complet al corpurilor „1” și „2” ajunge, entropia își va atinge valoarea maximă.
Astfel, într-un sistem închis, entropia S fie crește, fie rămâne neschimbată pentru orice proces real, adică modificarea entropiei dS ³ 0. Semnul egal din această formulă are loc numai pentru procesele reversibile. Într-o stare de echilibru, când entropia unui sistem închis atinge maximul, nu sunt posibile procese macroscopice într-un astfel de sistem, conform celei de-a doua legi a termodinamicii.
Rezultă că entropia este o mărime fizică care caracterizează cantitativ trăsăturile structurii moleculare a unui sistem, de care depind transformările energetice din acesta.
Relația entropiei cu structura moleculară a sistemului a fost explicată pentru prima dată de L. Boltzmann în 1887. El a stabilit sensul statistic al entropiei (formula 1.6). Potrivit lui Boltzmann (ordinea mare are o probabilitate relativ scăzută)
unde k este constanta Boltzmann, P este ponderea statistică.
k = 1,37 10-23 J/K.
Greutatea statistică P este proporțională cu numărul de stări microscopice posibile ale elementelor unui sistem macroscopic (de exemplu, diferite distribuții de coordonate și momente ale moleculelor de gaz corespunzătoare unei anumite valori a energiei, presiunii și altor parametri termodinamici ai gazului). ), adică caracterizează o posibilă discrepanță între descrierea microscopică a unei macrostari.
Pentru un sistem izolat, probabilitatea termodinamică W a unei macrostari date este proporțională cu greutatea sa statistică și este determinată de entropia sistemului:
W = exp(S/k). (7)
Astfel, legea creșterii entropiei are o natură probabilistică statistic și exprimă tendința constantă a sistemului de a trece la o stare mai probabilă. Rezultă de aici că starea cea mai probabilă realizabilă pentru sistem este aceea în care evenimentele care au loc simultan în sistem sunt compensate reciproc statistic.
Starea maximă probabilă a macrosistemului este starea de echilibru, pe care o poate atinge, în principiu, într-o perioadă de timp suficient de lungă.
După cum sa menționat mai sus, entropia este o cantitate aditivă, adică este proporțională cu numărul de particule din sistem. Prin urmare, pentru sistemele cu un număr mare de particule, chiar și cea mai mică modificare relativă a entropiei pe particulă își schimbă semnificativ valoarea absolută; o modificare a entropiei, care se află în exponentul din ecuația (7), duce la o modificare a probabilității unei macrostări date W de un număr mare de ori.
Acesta este motivul pentru care, pentru un sistem cu un număr mare de particule, consecințele celei de-a doua legi a termodinamicii nu sunt practic probabiliste, ci de încredere. Procesele extrem de puțin probabile, însoțite de orice scădere vizibilă a entropiei, necesită timpi de așteptare atât de mari încât implementarea lor este practic imposibilă. În același timp, părți mici ale sistemului care conțin un număr mic de particule experimentează fluctuații continue însoțite de doar o mică schimbare absolută a entropiei. Valorile medii ale frecvenței și mărimii acestor fluctuații sunt o consecință la fel de fiabilă a termodinamicii statistice ca și a doua lege a termodinamicii în sine.
Aplicarea literală a celei de-a doua legi a termodinamicii asupra Universului în ansamblu, care l-a condus pe Clausius la concluzia greșită despre inevitabilitatea „morții termice a Universului”, este ilegală, deoarece în principiu sisteme absolut izolate nu pot exista în natură. După cum se va arăta mai jos, în secțiunea de termodinamică de neechilibru, procesele care au loc în sisteme deschise se supun altor legi și au alte proprietăți.
Formularea celui de-al doilea început. Iată cele mai cunoscute două formulări:
1. Este imposibil un proces, al cărui singur rezultat ar fi efectuarea muncii datorită căldurii preluate din rezervorul de căldură la o temperatură constantă (formularea lui Thomson). Aceeași formulare, dar exprimată cu alte cuvinte, afirmă imposibilitatea de a crea mașină cu mișcare perpetuă de al doilea fel (adică producerea de muncă datorită energiei interne a rezervorului termic).
2. Este imposibil un proces, al cărui singur rezultat ar fi transferul de energie de la un corp mai rece la unul mai fierbinte (formularea lui Clausius).
Formulările lui Thomson și Clausius sunt echivalente.
teorema lui Carnot. Ciclul Carnot este un ciclu în care fluidul de lucru primește căldură doar dintr-un rezervor la o temperatură constantă (încălzitor), și o cedează doar unui rezervor la temperatură constantă (frigider). Teorema lui Carnot afirmă că eficiența unui ciclu Carnot arbitrar nu poate depăși eficiența
ciclul Carnot reversibil care funcționează în același mod Rezultă imediat că eficiența ciclului Carnot reversibil depinde numai de și și nu depinde de natura fluidului de lucru.
Vom arăta în in termeni generali cum se demonstrează teorema lui Carnot. Să presupunem că eficiența unei mașini reversibile este mai mică decât cea a uneia ireversibile. Să selectăm volumul corpului de lucru al mașinii reversibile, astfel încât acesta să facă același lucru pe ciclu ca și cel ireversibil. Ținând cont de (15), inegalitatea pentru eficiență ia forma în care avem Lasă mașina reversibilă să funcționeze în reversul astfel încât munca unei mașini ireversibile este consumată de una reversibilă. În timpul ciclului mașinii combinate, munca sa va fi egală cu zero, iar încălzitorul va primi energie preluată în întregime de la frigider. Am ajuns la o contradicție cu formularea lui Clausius.
Deoarece cunoaștem eficiența uneia dintre mașinile Carnot - gaz (16), atunci teorema lui Carnot poate fi scrisă după cum urmează:
unde egalitatea corespunde unui ciclu Carnot reversibil.
Scala de temperatură termodinamică. Teorema lui Carnot ne permite să definim o scară de temperatură care nu depinde de proprietățile unor corpuri specifice. Raportul de temperatură a două corpuri este determinat prin atașarea unei mașini Carnot reversibile; deoarece raportul depinde numai de temperaturile lor, se poate lua egal cu raportul temperaturilor termodinamice: După cum se poate vedea din (17), raportul temperaturilor termodinamice este egal cu raportul temperaturile gazelor(în zona în care este definită scara de gaz).
A doua lege: calculul energiei interne. A doua lege a termodinamicii ne permite să derivăm o relație importantă pentru energia internă a unui sistem simplu, care nu poate fi obținută în cadrul primei legi:
![]()
Să arătăm cum se poate obține (18) din teorema lui Carnot. Luați în considerare un ciclu Carnot reversibil (infinit) mic și descrieți-l în coordonate. Lucrarea sistemului pe ciclu, egală cu aria unui paralelogram mic (Fig. 14), nu se va schimba atunci când bucățile de adiabat sunt înlocuite cu segmente verticale, a căror lungime este egală cu Înmulțirea cu înălțimea, obţinem Căldura obţinută pe izoterma superioară, egală cu Din teorema lui Carnot și ecuația (17) avem
de unde obținem (18).

Să prezentăm câteva aplicații ale formulei (18).
1) Energia internă a unui gaz ideal. Să substituim în (18) ecuația de stare . Ca urmare, obținem de ex. Energia internă a unui gaz ideal este independentă de volum.
2) Energia internă a gazului van der Waals. După ce am exprimat presiunea din ecuația de stare (3) și înlocuind în (18), ajungem la formula
![]()
În plus, avem
acestea. nu depinde de volum. În intervalul de temperatură în care depinde slab de T, se poate scrie
A doua lege a termodinamicii determină direcția proceselor termice reale care au loc la o rată finită.
Al doilea start(a doua lege) termodinamica Are mai multe formulări . De exemplu, orice actiune, legate de conversia energiei(adică odată cu trecerea energiei de la o formă la alta), nu poate avea loc fără pierderea sa sub formă de căldură disipată în mediu. În mai mult vedere generala aceasta înseamnă că procesele de transformare (transformare) energiei se pot produce spontan numai cu condiția ca energia să treacă de la o formă concentrată (ordonată) la o formă împrăștiată (dezordonată).
O alta definiție a doua lege a termodinamicii este direct legată de Principiul Clausius : un proces în care nu are loc nicio schimbare, cu excepția transferului de căldură de la un corp fierbinte la unul rece, este ireversibil, adică căldura nu se poate transfera spontan de la un corp mai rece la unul mai fierbinte. în care o astfel de redistribuire a energiei în sistem caracterizat prin valoare , numit entropie , care, în funcție de starea unui sistem termodinamic (o funcție cu diferenţial total), a fost introdus pentru prima dată în 1865 an de Clausius. Entropie - este o măsură a disipării ireversibile a energiei. Entropia este cu atât mai mare, cu atât mai multă energie este disipată ireversibil sub formă de căldură.
Astfel, deja din aceste formulări ale celei de-a doua legi a termodinamicii, putem concluziona că orice sistem , ale căror proprietăți se modifică în timp, lupta pentru o stare de echilibru in care entropia sistemului ia valoarea maximă. Din cauza asta a doua lege a termodinamicii sună adesea legea creșterii entropiei , și ea însăși entropie (Cum cantitate fizica sau ca concept fizic) considera ca măsură a tulburării interne a unui sistem fizico-chimic .
Cu alte cuvinte, entropie – funcția de stat, caracterizarea direcţiei de curgere a proceselor spontane într-un sistem termodinamic închis. Într-o stare de echilibru, entropia unui sistem închis atinge maximul său și nu sunt posibile procese macroscopice într-un astfel de sistem. Entropia maximă corespunde haosului complet .
Cel mai adesea, tranziția unui sistem de la o stare la alta se caracterizează prin valoare absolută entropie S , iar modificarea sa ∆ S , care este egal cu raportul dintre modificarea cantității de căldură (admisă sistemului sau îndepărtată din acesta) la temperatura absolută sisteme: ∆ S= ∆Q/T, J/grad. Acesta este așa-numitul entropia termodinamică .
În plus, entropia are și o semnificație statistică. În timpul trecerii de la o macrostare la alta, entropia statistică crește și ea, deoarece o astfel de tranziție este întotdeauna însoțită de un număr mare de microstări, iar starea de echilibru (la care tinde sistemul) este caracterizată de numărul maxim de microstări.
În legătură cu conceptul de entropie în termodinamică sens nou dobândește conceptul de timp. În mecanica clasică nu se ia în considerare direcția timpului și starea sistem mecanic poate fi determinată atât în trecut, cât și în viitor. În termodinamică, timpul apare sub forma unui proces ireversibil de creștere a entropiei într-un sistem. Adică, cu cât entropia este mai mare, cu atât perioada de timp a trecut sistemul în dezvoltarea sa.
In afara de asta, pentru a înțelege semnificația fizică a entropiei trebuie avut în vedere faptul că există patru clase de sisteme termodinamice în natură :
A) sisteme izolate sau închise(în timpul tranziției unor astfel de sisteme de la o stare la alta, nu există transfer de energie, materie și informații peste granițele sistemului);
b) sisteme adiabatice(numai schimbul de căldură cu mediul este absent);
V) sisteme închise(schimb energie cu sistemele vecine, dar nu materie) (de exemplu, nava spatiala);
G) sisteme deschise(schimb materie, energie si informatii cu mediul). În aceste sisteme, datorită sosirii energiei din exterior, pot apărea structuri disipative cu entropie mult mai mică.
Pentru sistemele deschise, entropia scade. Acesta din urmă se referă în primul rând sisteme biologice, adică organisme vii, care sunt sisteme deschise de neechilibru. Astfel de sisteme sunt caracterizate de gradienți în concentrația de substanțe chimice, temperatură, presiune și alte cantități fizico-chimice. Utilizarea conceptelor de termodinamică modernă, adică de neechilibru, ne permite să descriem comportamentul sistemelor deschise, adică reale. Astfel de sisteme fac întotdeauna schimb de energie, materie și informații cu mediul lor. Mai mult, astfel de procese de schimb sunt tipice nu numai pentru sistemele fizice sau biologice, ci și pentru sistemele socio-economice, culturale, istorice și umanitare, deoarece procesele care au loc în ele sunt, de regulă, ireversibile.
A treia lege a termodinamicii (a treia lege a termodinamicii) este asociată cu conceptul de „zero absolut”. Sensul fizic al acestei legi, arătat în teorema termică a lui W. Nernst (fizician german), constă în imposibilitatea fundamentală de a atinge zero absolut (-273,16ºС), la care mișcarea termică de translație a moleculelor ar trebui să se oprească, iar entropia. va înceta să mai depindă de parametrii stării fizice a sistemului (în special, de la modificările energiei termice). Teorema lui Nernst se aplică numai stărilor de echilibru termodinamic ale sistemelor.
Cu alte cuvinte, teoremei Nernst i se poate da următoarea formulare: când se apropie de zero absolut, creșterea entropiei∆S tinde spre o limită finală bine definită, independentă de valorile pe care le iau toți parametrii care caracterizează starea sistemului(de exemplu, volum, presiune, starea de agregare etc.).
Înțelegeți esența teoremei lui Nernst poate porni exemplul următor. Pe măsură ce temperatura gazului scade, va avea loc condensarea acestuia și entropia sistemului va scădea, deoarece moleculele sunt mai ordonate. Odată cu o scădere suplimentară a temperaturii, va avea loc cristalizarea lichidului, însoțită de o mai mare ordonare a aranjamentului moleculelor și, în consecință, o scădere și mai mare a entropiei. La temperatura zero absolut, toată mișcarea termică încetează, dezordinea dispare, numărul de microstări posibile scade la unu și entropia se apropie de zero.
4. Conceptul de autoorganizare. Autoorganizare în sisteme deschise.
Conceptul " sinergie” a fost propus în 1973 de către fizicianul german Hermann Haken pentru a indica direcția, numit explora legile generale ale auto-organizarii - fenomenul acţiunii coordonate a elementelor unui sistem complex fără o acţiune de control din exterior. Sinergetice (tradus din greacă - comun, de acord, contribuind) - direcție științifică studiu legături între elementele structurii(subsisteme), care se formează în sisteme deschise (biologic, fizico-chimic, geologic și geografic etc.) datorită intensivă(streaming) schimb de materie, energie și informații cu mediul în condiţii de neechilibru. În astfel de sisteme se observă comportamentul coordonat al subsistemelor, în urma căruia gradul de ordine crește (entropia scade), adică se dezvoltă procesul de autoorganizare.
Echilibruexistă o stare de repaus și simetrie, A asimetrie Oportunitati la mișcare și la starea de neechilibru .
Contribuție semnificativă la teoria auto-organizării sistemelor contribuit de un fizician belgian de origine rusă I.R. Prigogine (1917-2003). A arătat că în sisteme disipative (sisteme în care are loc împrăștierea entropiei) în cursul proceselor ireversibile de neechilibru, apar formațiuni ordonate, care au fost denumite de el structuri disipative.
autoorganizare- Acest proces apariție spontană ordine şi organizare din dezordine(haos) în sistemele deschise de neechilibru. Abateri aleatorii ale parametrilor sistemului de la echilibru ( fluctuatii) juca foarte mult rol importantîn funcţionarea şi existenţa sistemului. Datorită creșterea fluctuațiilor la absorbția energiei din mediu sistem ajunge la unele condiție critică Și intră într-o nouă stare stabilă Cu Mai mult nivel inalt dificultăți Și Ordin comparativ cu precedentul. Sistemul, auto-organizându-se într-o nouă stare staționară, își reduce entropia, își „descărcează” excesul, care crește datorită proceselor interne, în mediu.
Ieșit din haos structura ordonata (atractor , sau structură disipativă) este rezultatul competiției setul de stări posibile încorporate în sistem. Ca urmare a competiției, există o selecție spontană a structurii celei mai adaptative în condițiile predominante.
Sinergetica se bazează pe termodinamica proceselor de neechilibru, teoria proceselor aleatorii, teoria oscilațiilor și undelor neliniare.
Synergetics are în vedere apariția și dezvoltarea sistemelor. Distinge trei tipuri de sisteme: 1) închis, care nu fac schimb cu sistemele vecine (sau cu mediul) nici materie, nici energie, nici informatie; 2) închis , care schimbă energie cu sistemele vecine, dar nu materie (de exemplu, o navă spațială); 3) deschis, care schimbă atât materie cât și energie cu sistemele învecinate. Aproape toate sistemele naturale (ecologice) sunt de tip deschis.
Existenta sistemelor de necrezut fără conexiuni. Acestea din urmă sunt împărțite în direct și invers. Drept numi asta conexiune , pentru care un element ( A) acționează asupra altuia ( ÎN) fără răspuns. La părere element ÎN răspunde la acțiunea elementului A. Feedback-ul este atât pozitiv, cât și negativ.
Părere duce la întărirea procesului într-o singură direcție. Un exemplu al acțiunii sale este mlaștinarea teritoriului (de exemplu, după defrișare). Procesîncepe act V O singura directie: cresterea umiditatii - epuizarea oxigenului - incetinirea descompunerii reziduuri vegetale- acumularea de turbă - intensificarea în continuare a aglomerației cu apă.
Feedback negativ acţionează în aşa fel încât ca răspuns la o creştere a acţiunii elementului A forța opusă a elementului crește B. O astfel de conexiune permite sistemului să rămână într-o stare echilibru dinamic stabil. Acesta este cel mai comun și vedere importantă conexiuni în sistemele naturale. În primul rând, stabilitatea și stabilitatea ecosistemelor se bazează pe ele.
O proprietate importantă a sistemelor este aparitie (tradus din engleză - apariția, apariția unuia nou). Această proprietate constă în faptul că proprietățile sistemului în ansamblu nu sunt o simplă sumă a proprietăților părților sau elementelor sale constitutive, ci interconexiunile diferitelor legături ale sistemului determină noua sa calitate.
Abordarea sinergică a luării în considerare a sistemelor se bazează pe trei concepte: dezechilibru, deschidere Și neliniaritate .
Dezechilibru(instabilitate) – starea sistemului, la care are loc o modificare a parametrilor săi macroscopici, adică compoziția, structura, comportamentul.
Deschidere -capacitatea sistemului schimbă constant materie, energie, informații cu mediul înconjurător și au atât „surse” - zone de reaprovizionare cu energie din mediu, cât și zone de dispersie, „scurgere”.
neliniaritate -proprietatea sistemului să rămână în diverse stări staţionare corespunzătoare diverselor legi admisibile de comportament ale acestui sistem.
ÎN sisteme neliniare dezvoltarea se desfășoară conform legilor neliniare, ducând la multivarianța căilor de alegere și a alternativelor de ieșire din starea de instabilitate. ÎN sisteme neliniare procesele pot fi caracter de prag ascuțit când, cu o schimbare treptată a condiţiilor externe, se observă trecerea lor bruscă la o altă calitate. În același timp, vechile structuri sunt distruse, trecând la structuri calitativ noi.