Schullexikon. Entropie
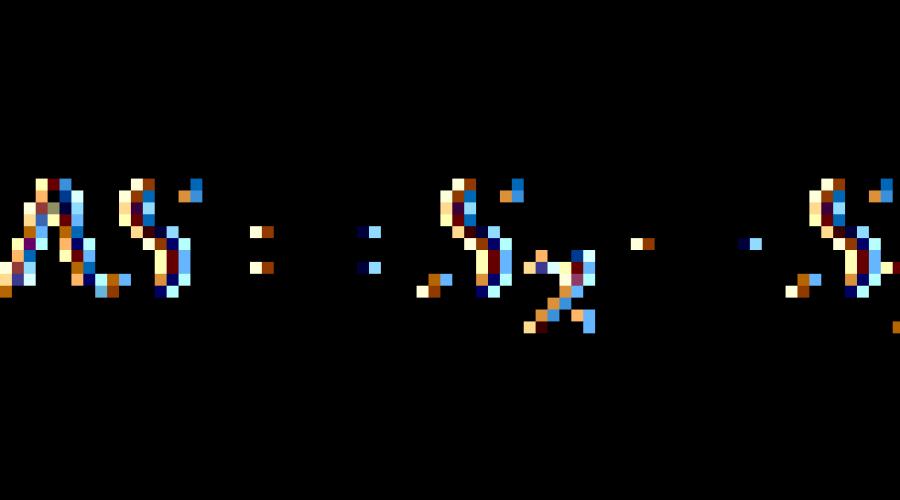
§6 Entropie
Typischerweise verläuft jeder Prozess, bei dem ein System von einem Zustand in einen anderen übergeht, so, dass es unmöglich ist, diesen Prozess in die entgegengesetzte Richtung durchzuführen, sodass das System dieselben Zwischenzustände durchläuft, ohne dass Änderungen in den umgebenden Körpern auftreten . Dies liegt daran, dass dabei ein Teil der Energie verloren geht, beispielsweise durch Reibung, Strahlung usw. Somit. Fast alle Prozesse in der Natur sind irreversibel. Bei jedem Prozess geht etwas Energie verloren. Zur Charakterisierung der Energiedissipation wird das Konzept der Entropie eingeführt. ( Der Entropiewert charakterisiert den thermischen Zustand des Systems und bestimmt die Wahrscheinlichkeit der Umsetzung eines bestimmten Zustands des Körpers. Je wahrscheinlicher ein gegebener Zustand ist, desto größer ist die Entropie.) Alle natürliche Prozesse begleitet von einem Anstieg der Entropie. Die Entropie bleibt nur dann konstant, wenn ein idealisierter reversibler Prozess in einem geschlossenen System abläuft, also in einem System, in dem kein Energieaustausch mit Körpern außerhalb dieses Systems stattfindet.
Entropie und ihre thermodynamische Bedeutung:
Entropie- Dies ist eine Funktion des Zustands des Systems, dessen infinitesimale Änderung in einem reversiblen Prozess gleich dem Verhältnis der in diesem Prozess eingebrachten infinitesimalen Wärmemenge zur Temperatur ist, bei der sie eingebracht wurde.
In einem abschließenden reversiblen Prozess kann die Entropieänderung mit der Formel berechnet werden:
![]()
wobei das Integral vom Anfangszustand 1 des Systems zum Endzustand 2 genommen wird.
Da die Entropie eine Funktion des Zustands ist, ist die Eigenschaft das Integralist seine Unabhängigkeit von der Form der Kontur (Pfad), entlang derer es berechnet wird; daher wird das Integral nur durch den Anfangs- und Endzustand des Systems bestimmt.
- Bei jedem reversiblen Prozess beträgt die Entropieänderung 0
(1)
- In der Thermodynamik ist das bewiesenSDas System befindet sich in einem irreversiblen Kreislauf
Δ S> 0 (2)
Die Ausdrücke (1) und (2) beziehen sich nur auf geschlossene Systeme, wenn das System jedoch Wärme mit ihnen austauscht Außenumgebung, dann sieSkann sich auf jede erdenkliche Weise verhalten.
Die Beziehungen (1) und (2) können als Clausius-Ungleichung dargestellt werden
ΔS ≥ 0
diese. Die Entropie eines geschlossenen Systems kann entweder zunehmen (bei irreversiblen Prozessen) oder konstant bleiben (bei reversiblen Prozessen).
Wenn das System einen Gleichgewichtsübergang von Zustand 1 in Zustand 2 vollzieht, ändert sich die Entropie
![]()
Wo du Und δAwird für einen bestimmten Prozess geschrieben. Nach dieser Formel ΔSbis auf eine additive Konstante bestimmt. Physikalische Bedeutung Es ist nicht die Entropie selbst, die den Unterschied ausmacht, sondern der Unterschied zwischen den Entropien. Lassen Sie uns die Entropieänderung in idealen Gasprozessen ermitteln.
![]()
diese. EntropieänderungenS Δ S 1→2 eines idealen Gases beim Übergang vom Zustand 1 in den Zustand 2 hängt nicht von der Art des Prozesses ab.
Weil für einen adiabatischen Prozess δQ = 0, dann Δ S= 0 => S= konst , das heißt, ein adiabatischer reversibler Prozess findet bei konstanter Entropie statt. Deshalb heißt es isentrop.
In einem isothermen Prozess (T= const ; T 1 = T 2 : )
![]()
In einem isochoren Prozess (V= const ; V 1 = V 2 ; )
![]()
Entropie hat die Eigenschaft der Additivität: Die Entropie eines Systems ist gleich der Summe der Entropien der im System enthaltenen Körper.S = S 1 + S 2 + S 3 + ... Der qualitative Unterschied zwischen der thermischen Bewegung von Molekülen und anderen Bewegungsformen ist ihre Zufälligkeit und Unordnung. Um die thermische Bewegung zu charakterisieren, ist es daher notwendig, ein quantitatives Maß für den Grad der molekularen Störung einzuführen. Wenn wir einen bestimmten makroskopischen Zustand eines Körpers mit bestimmten Durchschnittswerten von Parametern betrachten, dann handelt es sich um etwas anderes als eine kontinuierliche Änderung nahe beieinander liegender Mikrozustände, die sich in der Verteilung der Moleküle voneinander unterscheiden verschiedene Teile Volumen und Energie, die zwischen Molekülen verteilt sind. Die Anzahl dieser sich ständig verändernden Mikrozustände charakterisiert den Grad der Unordnung des makroskopischen Zustands des gesamten Systems.wwird die thermodynamische Wahrscheinlichkeit eines gegebenen Mikrozustands genannt. Thermodynamische WahrscheinlichkeitwDer Zustand eines Systems ist die Anzahl der Möglichkeiten, auf denen ein bestimmter Zustand eines makroskopischen Systems realisiert werden kann, oder die Anzahl der Mikrozustände, die einen bestimmten Mikrozustand implementieren (w≥ 1, und mathematische Wahrscheinlichkeit ≤ 1 ).
Als Maß für die Überraschung eines Ereignisses wurde vereinbart, den Logarithmus seiner Wahrscheinlichkeit mit einem Minuszeichen zu nehmen: Die Überraschung des Staates ist gleich =-
Nach Boltzmann EntropieSSysteme und thermodynamische Wahrscheinlichkeit hängen wie folgt miteinander zusammen:
Wo - Boltzmann-Konstante (![]() ). Somit wird die Entropie durch den Logarithmus der Anzahl der Zustände bestimmt, mit deren Hilfe ein bestimmter Mikrozustand realisiert werden kann. Die Entropie kann als Maß für die Zustandswahrscheinlichkeit des t/d-Systems betrachtet werden. Die Formel von Boltzmann ermöglicht es uns, der Entropie die folgende statistische Interpretation zu geben. Entropie ist ein Maß für die Unordnung eines Systems. Tatsächlich ist die Entropie umso größer, je größer die Anzahl der Mikrozustände ist, die einen bestimmten Mikrozustand realisieren. Im Gleichgewichtszustand des Systems – dem wahrscheinlichsten Zustand des Systems – ist die Anzahl der Mikrozustände maximal, und auch die Entropie ist maximal.
). Somit wird die Entropie durch den Logarithmus der Anzahl der Zustände bestimmt, mit deren Hilfe ein bestimmter Mikrozustand realisiert werden kann. Die Entropie kann als Maß für die Zustandswahrscheinlichkeit des t/d-Systems betrachtet werden. Die Formel von Boltzmann ermöglicht es uns, der Entropie die folgende statistische Interpretation zu geben. Entropie ist ein Maß für die Unordnung eines Systems. Tatsächlich ist die Entropie umso größer, je größer die Anzahl der Mikrozustände ist, die einen bestimmten Mikrozustand realisieren. Im Gleichgewichtszustand des Systems – dem wahrscheinlichsten Zustand des Systems – ist die Anzahl der Mikrozustände maximal, und auch die Entropie ist maximal.
Weil Reale Prozesse sind irreversibel, dann kann argumentiert werden, dass alle Prozesse in einem geschlossenen System zu einer Erhöhung seiner Entropie führen – dem Prinzip der zunehmenden Entropie. In der statistischen Interpretation der Entropie bedeutet dies, dass Prozesse in einem geschlossenen System in Richtung einer zunehmenden Anzahl von Mikrozuständen ablaufen, also von weniger wahrscheinlichen Zuständen zu wahrscheinlicheren, bis die Wahrscheinlichkeit des Zustands maximal wird.
§7 Zweiter Hauptsatz der Thermodynamik
Der erste Hauptsatz der Thermodynamik, der den Energieerhaltungssatz und die Energieumwandlung zum Ausdruck bringt, erlaubt uns nicht, die Richtung des Flusses von t/d-Prozessen festzulegen. Darüber hinaus kann man sich viele Prozesse vorstellen, die sich nicht widersprechenICHzum Anfang t/d, in dem Energie erhalten bleibt, aber in der Natur werden sie nicht realisiert. Mögliche Formulierungen des zweiten beginnenden t/d:
1) das Gesetz der zunehmenden Entropie eines geschlossenen Systems bei irreversiblen Prozessen: Jeder irreversible Prozess in einem geschlossenen System läuft so ab, dass die Entropie des Systems um Δ zunimmtS≥ 0 (irreversibler Prozess) 2) ΔS≥ 0 (S= 0 für reversibel und ΔS≥ 0 für einen irreversiblen Prozess)
Bei Prozessen, die in einem geschlossenen System ablaufen, nimmt die Entropie nicht ab.
2) Aus Boltzmanns Formel S = , Daher bedeutet eine Zunahme der Entropie einen Übergang des Systems von einem weniger wahrscheinlichen Zustand in einen wahrscheinlicheren.
3) Nach Kelvin: Ein Kreislaufprozess ist nicht möglich, dessen einziges Ergebnis die Umwandlung der von der Heizung aufgenommenen Wärme in dieser entsprechende Arbeit ist.
4) Nach Clausius: Ein Kreislaufprozess ist nicht möglich, dessen einziges Ergebnis die Übertragung von Wärme von einem weniger erhitzten Körper auf einen stärker erhitzten Körper ist.
Um t/d-Systeme bei 0 K zu beschreiben, wird das Nernst-Planck-Theorem (drittes Gesetz von t/d) verwendet: Die Entropie aller Körper im Gleichgewichtszustand tendiert gegen Null, wenn sich die Temperatur 0 K nähert
Aus dem Satz Nernst-Planck folgt darausC p = C v = 0 bei 0 ZU
§8 Wärme- und Kältemaschinen.
Carnot-Zyklus und seine Effizienz
Aus der Formulierung des zweiten Gesetzes von t/d nach Kelvin folgt, dass ein Perpetuum mobile zweiter Art unmöglich ist. (Ein Perpetuum mobile ist ein periodisch arbeitender Motor, der Arbeit verrichtet, indem er eine Wärmequelle kühlt.)
 Thermostat ist ein T/D-System, das Wärme mit Körpern austauschen kann, ohne die Temperatur zu ändern.
Thermostat ist ein T/D-System, das Wärme mit Körpern austauschen kann, ohne die Temperatur zu ändern.
Funktionsprinzip einer Wärmekraftmaschine: von einem Thermostat mit Temperatur T 1 - Heizung, die Wärmemenge wird pro Zyklus abgeführtQ 1 , und der Thermostat mit Temperatur T 2 (T 2 < T 1) - an den Kühlschrank wird die Wärmemenge pro Zyklus übertragenQ 2 , während die Arbeit erledigt ist A = Q 1 - Q 2
 Kreisprozess oder Kreislauf ist ein Prozess, bei dem ein System, nachdem es eine Reihe von Zuständen durchlaufen hat, in seinen ursprünglichen Zustand zurückkehrt. In einem Zustandsdiagramm wird ein Zyklus als geschlossene Kurve dargestellt. Der Kreislauf eines idealen Gases kann in Expansions- (1-2) und Kompressionsprozesse (2-1) unterteilt werden, die Expansionsarbeit ist positiv A 1-2 > 0, weilV 2
>
V 1
, die Kompressionsarbeit ist negativ A 1-2 < 0, т.к.
V 2
<
V 1
. Folglich wird die vom Gas pro Zyklus geleistete Arbeit durch die von der geschlossenen Kurve 1-2-1 abgedeckte Fläche bestimmt. Wenn während eines Zyklus positive Arbeit geleistet wird (Zyklus im Uhrzeigersinn), dann wird der Zyklus vorwärts genannt, wenn es sich um einen Rückwärtszyklus handelt (der Zyklus läuft gegen den Uhrzeigersinn ab).
Kreisprozess oder Kreislauf ist ein Prozess, bei dem ein System, nachdem es eine Reihe von Zuständen durchlaufen hat, in seinen ursprünglichen Zustand zurückkehrt. In einem Zustandsdiagramm wird ein Zyklus als geschlossene Kurve dargestellt. Der Kreislauf eines idealen Gases kann in Expansions- (1-2) und Kompressionsprozesse (2-1) unterteilt werden, die Expansionsarbeit ist positiv A 1-2 > 0, weilV 2
>
V 1
, die Kompressionsarbeit ist negativ A 1-2 < 0, т.к.
V 2
<
V 1
. Folglich wird die vom Gas pro Zyklus geleistete Arbeit durch die von der geschlossenen Kurve 1-2-1 abgedeckte Fläche bestimmt. Wenn während eines Zyklus positive Arbeit geleistet wird (Zyklus im Uhrzeigersinn), dann wird der Zyklus vorwärts genannt, wenn es sich um einen Rückwärtszyklus handelt (der Zyklus läuft gegen den Uhrzeigersinn ab).
Direkter Zyklus Wird in Wärmekraftmaschinen verwendet – periodisch arbeitende Motoren, die ihre Arbeit mit der von außen aufgenommenen Wärme verrichten. Der umgekehrte Zyklus wird in verwendet Kühlmaschinen- periodisch betriebene Anlagen, bei denen durch die Einwirkung äußerer Kräfte Wärme auf einen Körper mit höherer Temperatur übertragen wird.
Durch den Kreislaufprozess kehrt das System in seinen ursprünglichen Zustand zurück und daher ist die Gesamtänderung der inneren Energie Null. DannІ Start t/d für Kreisprozess
Q= Δ U+ A= A,
Das heißt, die pro Zyklus geleistete Arbeit entspricht der von außen aufgenommenen Wärmemenge, aber
Q= Q 1 - Q 2
Q 1 - Menge vom System aufgenommene Wärme,
Q 2 - Menge die vom System abgegebene Wärme.
Thermischen Wirkungsgrad für einen Kreisprozess ist gleich dem Verhältnis der vom System geleisteten Arbeit zur dem System zugeführten Wärmemenge:
![]()
Für η = 1 muss die Bedingung erfüllt seinQ 2 = 0, d.h. Eine Wärmekraftmaschine muss eine Wärmequelle habenQ 1 , aber das widerspricht dem zweiten Hauptsatz von t/d.
Der Prozess ist das Gegenteil von dem, was in passiert Wärmekraftmaschine, verwendet in Kühlmaschinen.
 Vom Thermostat mit Temperatur T 2 Die Wärmemenge wird abgeführtQ 2
und wird mit der Temperatur an den Thermostat übermitteltT 1
, WärmemengeQ 1
.
Vom Thermostat mit Temperatur T 2 Die Wärmemenge wird abgeführtQ 2
und wird mit der Temperatur an den Thermostat übermitteltT 1
, WärmemengeQ 1
.
Q= Q 2 - Q 1 < 0, следовательно A< 0.
Ohne Arbeit ist es unmöglich, einem weniger erhitzten Körper Wärme zu entziehen und sie an einen stärker erhitzten Körper abzugeben.
Basierend auf dem zweiten Gesetz von t/d leitete Carnot einen Satz ab.
Satz von Carnot: aus allen periodisch betriebenen Wärmekraftmaschinen mit gleichen Heiztemperaturen ( T 1) und Kühlschränke ( T 2), höchste Effizienz. über reversible Maschinen verfügen. Effizienz reversible Maschinen mit gleich T 1 und T 2 sind gleich und hängen nicht von der Art des Arbeitsmediums ab.
Ein Arbeitskörper ist ein Körper, der einen Kreislaufprozess durchführt und Energie mit anderen Körpern austauscht.
Der Carnot-Zyklus ist ein reversibler, höchst ökonomischer Zyklus, bestehend aus 2 Isothermen und 2 Adiabaten.
 1-2 isotherme Expansion bei T 1 Heizung; Dem Gas wird Wärme zugeführtQ 1
und die Arbeit ist erledigt
1-2 isotherme Expansion bei T 1 Heizung; Dem Gas wird Wärme zugeführtQ 1
und die Arbeit ist erledigt![]()
2-3 - Adiabat. Expansion, Gas funktioniertA 2-3 >0 über externe Körper.
3-4 isotherme Kompression bei T 2 Kühlschränke; Wärme wird abgeführtQ 2
und die Arbeit ist erledigt![]() ;
;
Bei der 4-1-adiabatischen Kompression wird am Gas gearbeitet Ein 4-1 <0 внешними телами.
In einem isothermen ProzessU= const, also Q 1 = A 12
![]() 1
1
Während der adiabatischen ExpansionQ 2-3 = 0 und Gasarbeit A 23 erreicht durch innere Energie A 23 = - U
![]()
WärmemengeQ 2 , die das Gas während der isothermen Kompression an den Kühlschrank abgibt, ist gleich der Kompressionsarbeit A 3-4
![]() 2
2
Adiabatische Kompressionsarbeit
![]()
Arbeit, die als Ergebnis eines zirkulären Prozesses geleistet wird
A = A 12 + A 23 + A 34 + A 41 = Q 1 + A 23 - Q 2 - A 23 = Q 1 - Q 2
und ist gleich der Fläche der Kurve 1-2-3-4-1.
Thermischen Wirkungsgrad Carnot-Zyklus
![]()
Aus der adiabatischen Gleichung für die Prozesse 2-3 und 3-4 erhalten wir
Dann ![]()
![]()
diese. Effizienz Der Carnot-Zyklus wird nur durch die Temperaturen der Heizung und des Kühlschranks bestimmt. Zur Effizienzsteigerung muss den Unterschied vergrößern T 1 - T 2 .
******************************************************* ******************************************************
Die Thermodynamik (griechisch θέρμη – „Wärme“, δύναμις – „Kraft“) ist ein Zweig der Physik, der die allgemeinsten Eigenschaften makroskopischer Systeme sowie Methoden der Energieübertragung und -umwandlung in solchen Systemen untersucht.
In der Thermodynamik werden Zustände und Prozesse untersucht, zu deren Beschreibung der Begriff der Temperatur eingeführt werden kann. Thermodynamik (T.) ist eine phänomenologische Wissenschaft, die auf Verallgemeinerungen experimenteller Fakten basiert. Prozesse, die in auftreten thermodynamische Systeme ah, werden durch makroskopische Größen (Temperatur, Druck, Konzentrationen von Komponenten) beschrieben, die zur Beschreibung von Systemen eingeführt werden, die aus einer großen Anzahl von Teilchen bestehen, und nicht auf einzelne Moleküle und Atome anwendbar sind, anders als beispielsweise die in eingeführten Größen Mechanik oder Elektrodynamik.
Die moderne phänomenologische Thermodynamik ist eine strenge Theorie, die auf der Grundlage mehrerer Postulate entwickelt wurde. Der Zusammenhang dieser Postulate mit den Eigenschaften und Wechselwirkungsgesetzen von Teilchen, aus denen thermodynamische Systeme aufgebaut sind, ist jedoch durch die statistische Physik gegeben. Die statistische Physik ermöglicht es auch, die Grenzen der Anwendbarkeit der Thermodynamik zu klären.
Die Gesetze der Thermodynamik sind allgemeiner Natur und hängen nicht von spezifischen Details der Struktur der Materie auf atomarer Ebene ab. Daher wird die Thermodynamik in einem breiten Spektrum wissenschaftlicher und technischer Fragestellungen erfolgreich angewendet, beispielsweise in den Bereichen Energie, Wärmetechnik, Phasenübergänge, chemische Reaktionen, Transportphänomene und sogar Schwarze Löcher. Die Thermodynamik ist für eine Vielzahl von Bereichen der Physik und Chemie, der chemischen Technologie, der Luft- und Raumfahrttechnik, des Maschinenbaus, der Zellbiologie, der biomedizinischen Technik und der Materialwissenschaften wichtig und findet sogar in Bereichen wie der Wirtschaftswissenschaft Anwendung.
Wichtige Jahre in der Geschichte der Thermodynamik
- Der Ursprung der Thermodynamik als Wissenschaft ist mit dem Namen G. Galilei verbunden, der das Konzept der Temperatur einführte und das erste Gerät entwarf, das auf Temperaturänderungen reagierte Umfeld (1597).
- Bald erstellten G. D. Fahrenheit (1714), R. Reaumur (1730) und A. Celsius (1742) Temperaturskalen nach diesem Prinzip.
- J. Black führte bereits 1757 die Konzepte der latenten Fusionswärme und der Wärmekapazität ein (1770). Und Wilcke (J. Wilcke, 1772) führte die Definition von Kalorien als der Wärmemenge ein, die erforderlich ist, um 1 g Wasser um 1 °C zu erhitzen.
- Lavoisier (A. Lavoisier) und Laplace (P. Laplace) entwarfen 1780 ein Kalorimeter (siehe Kalorimetrie) und bestimmten erstmals experimentell die Schwebung. Wärmekapazität einer Reihe von Stoffen.
- Im Jahr 1824 veröffentlichte S. Carnot (N. L, S. Carnot) ein Werk, das sich mit der Untersuchung der Funktionsprinzipien von Wärmekraftmaschinen befasste.
- B. Clapeyron führte eine grafische Darstellung thermodynamischer Prozesse ein und entwickelte die Methode der Infinitesimalzyklen (1834).
- G. Helmholtz bemerkte die universelle Natur des Energieerhaltungssatzes (1847). Anschließend entwickelten R. Clausius und W. Thomson (Kelvin; W. Thomson) systematisch den theoretischen Apparat der Thermodynamik, der auf dem ersten Hauptsatz der Thermodynamik und dem zweiten Hauptsatz der Thermodynamik basiert.
- Die Entwicklung des 2. Prinzips führte Clausius zur Definition der Entropie (1854) und zur Formulierung des Gesetzes der zunehmenden Entropie (1865).
- Ausgehend von der Arbeit von J. W. Gibbs (1873), der die Methode der thermodynamischen Potentiale vorschlug, wurde die Theorie des thermodynamischen Gleichgewichts entwickelt.
- In der 2. Hälfte. 19. Jahrhundert Es wurden Untersuchungen realer Gase durchgeführt. Eine besondere Rolle spielten die Experimente von T. Andrews, der erstmals den kritischen Punkt des Flüssigkeits-Dampf-Systems entdeckte (1861), seine Existenz wurde von D. I. Mendeleev (1860) vorhergesagt.
- Bis zum Ende des 19. Jahrhunderts. Große Fortschritte wurden bei der Erzielung niedriger Temperaturen gemacht, wodurch O2, N2 und H2 verflüssigt wurden.
- Im Jahr 1902 veröffentlichte Gibbs eine Arbeit, in der alle grundlegenden thermodynamischen Beziehungen im Rahmen der statistischen Physik ermittelt wurden.
- Der Zusammenhang zwischen Kinetik Eigenschaften des Körpers und seine Thermodynamik. Merkmale wurden von L. Onsager festgestellt (L. Onsager, 1931).
- Im 20. Jahrhundert beschäftigte sich intensiv mit der Thermodynamik von Festkörpern sowie Quantenflüssigkeiten und Flüssigkristallen, in denen vielfältige Phasenübergänge stattfinden.
- L. D. Landau (1935-37) entwickelte eine allgemeine Theorie von Phasenübergängen, die auf dem Konzept der spontanen Symmetriebrechung basierte.
Abschnitte der Thermodynamik
Die moderne phänomenologische Thermodynamik wird normalerweise in die Gleichgewichts- (oder klassische) Thermodynamik unterteilt, die thermodynamische Gleichgewichtssysteme und Prozesse in solchen Systemen untersucht, und die Nichtgleichgewichts-Thermodynamik, die Nichtgleichgewichtsprozesse in Systemen untersucht, in denen die Abweichung vom thermodynamischen Gleichgewicht relativ gering ist und dennoch eine Thermodynamik zulässt Beschreibung.

Gleichgewichts- (oder klassische) Thermodynamik
In der Gleichgewichtsthermodynamik werden Variablen wie innere Energie, Temperatur, Entropie und chemisches Potential eingeführt. Sie alle werden thermodynamische Parameter (Größen) genannt. Die klassische Thermodynamik untersucht die Beziehungen thermodynamischer Parameter untereinander und mit physikalischen Größen, die in anderen Bereichen der Physik berücksichtigt werden, beispielsweise mit dem auf das System einwirkenden Gravitations- oder elektromagnetischen Feld. Auch chemische Reaktionen und Phasenübergänge werden in das Studium der klassischen Thermodynamik einbezogen. Die Untersuchung thermodynamischer Systeme, in denen chemische Umwandlungen eine wesentliche Rolle spielen, ist jedoch Gegenstand der chemischen Thermodynamik und die Wärmetechnik befasst sich mit technischen Anwendungen.

Die klassische Thermodynamik umfasst die folgenden Abschnitte:
- Prinzipien der Thermodynamik (manchmal auch Gesetze oder Axiome genannt)
- Zustandsgleichungen und Eigenschaften einfacher thermodynamischer Systeme (ideales Gas, reales Gas, Dielektrika und Magnete usw.)
- Gleichgewichtsprozesse mit einfachen Systemen, thermodynamische Kreisläufe
- Nichtgleichgewichtsprozesse und das Gesetz der nicht abnehmenden Entropie
- thermodynamische Phasen und Phasenübergänge
Darüber hinaus umfasst die moderne Thermodynamik auch folgende Gebiete:
- eine strenge mathematische Formulierung der Thermodynamik basierend auf der konvexen Analyse
- nicht-extensive Thermodynamik
In Systemen, die sich nicht in einem thermodynamischen Gleichgewichtszustand befinden, beispielsweise in einem bewegten Gas, kann die lokale Gleichgewichtsnäherung verwendet werden, bei der davon ausgegangen wird, dass die thermodynamischen Gleichgewichtsbeziehungen an jedem Punkt des Systems lokal erfüllt sind.
Nichtgleichgewichts-Thermodynamik
In der Nichtgleichgewichtsthermodynamik werden Variablen nicht nur im Raum, sondern auch in der Zeit als lokal betrachtet, das heißt, die Zeit kann explizit in ihre Formeln eingehen. Beachten wir, dass Fouriers klassisches Werk „Analytical Theory of Heat“ (1822), das sich den Fragen der Wärmeleitfähigkeit widmet, nicht nur der Entstehung der Nichtgleichgewichtsthermodynamik, sondern auch Carnots Werk „Reflections on the Driving Force of Fire and on“ voraus war Maschinen, die diese Kraft entwickeln können“ (1824), was allgemein als Ausgangspunkt in der Geschichte der klassischen Thermodynamik gilt.
Grundbegriffe der Thermodynamik
Thermodynamisches System- ein Körper oder eine Gruppe von Körpern, die geistig oder tatsächlich von der Umwelt isoliert interagieren.
Homogenes System– ein System, in dem es keine Oberflächen gibt, die Teile des Systems (Phasen) mit unterschiedlichen Eigenschaften trennen.
Heterogenes System- ein System, in dem es Oberflächen gibt, die Teile des Systems mit unterschiedlichen Eigenschaften trennen.
Phase– eine Reihe homogener Teile eines heterogenen Systems mit identischen physikalischen und chemischen Eigenschaften, die durch sichtbare Grenzflächen von anderen Teilen des Systems getrennt sind.
Isoliert System- ein System, das weder Materie noch Energie mit der Umwelt austauscht.
Geschlossen System- ein System, das Energie mit der Umwelt austauscht, aber keine Materie.
Offen System- ein System, das sowohl Materie als auch Energie mit der Umwelt austauscht.
Die Gesamtheit aller physikalischen und chemischen Eigenschaften eines Systems charakterisiert dieses thermodynamischer Zustand. Alle Größen, die eine makroskopische Eigenschaft des betrachteten Systems charakterisieren, sind Statusparameter. Es wurde experimentell festgestellt, dass zur eindeutigen Charakterisierung eines bestimmten Systems die Verwendung einer bestimmten Anzahl aufgerufener Parameter erforderlich ist unabhängig; alle anderen Parameter werden als Funktionen unabhängiger Parameter betrachtet. Als unabhängige Zustandsparameter werden üblicherweise direkt messbare Parameter wie Temperatur, Druck, Konzentration etc. gewählt. Jede Änderung des thermodynamischen Zustands eines Systems (Änderung mindestens eines Zustandsparameters) ist thermodynamischer Prozess.
Reversibler Prozess- ein Prozess, der es dem System ermöglicht, in seinen ursprünglichen Zustand zurückzukehren, ohne dass Änderungen in der Umgebung verbleiben.
Gleichgewichtsprozess– ein Prozess, bei dem ein System eine kontinuierliche Reihe von Gleichgewichtszuständen durchläuft.
Energie– ein Maß für die Arbeitsfähigkeit des Systems; ein allgemeines qualitatives Maß für die Bewegung und Wechselwirkung von Materie. Energie ist eine integrale Eigenschaft der Materie. Man unterscheidet zwischen potentieller Energie, die durch die Position eines Körpers in einem bestimmten Kräftefeld entsteht, und kinetischer Energie, die durch eine Änderung der Position des Körpers im Raum entsteht.
Innere Energie des Systems– die Summe der kinetischen und potentiellen Energie aller Teilchen, aus denen das System besteht. Sie können die innere Energie eines Systems auch als seine Gesamtenergie abzüglich der kinetischen und potentiellen Energie des Systems als Ganzes definieren.
Formen der Energiewende
Formen der Energieübertragung von einem System auf ein anderes können in zwei Gruppen eingeteilt werden.
- Die erste Gruppe umfasst nur eine Form des Bewegungsübergangs durch chaotische Kollisionen von Molekülen zweier sich berührender Körper, d.h. durch Wärmeleitung (und gleichzeitig durch Strahlung). Das Maß für die so übertragene Bewegung ist Wärme. Wärme ist eine Form der Energieübertragung durch die ungeordnete Bewegung von Molekülen.
- Die zweite Gruppe umfasst verschiedene Formen des Bewegungsübergangs, deren gemeinsames Merkmal die Bewegung von Massen ist, die eine sehr große Anzahl von Molekülen (d. h. makroskopische Massen) unter dem Einfluss beliebiger Kräfte umfassen. Dies sind das Anheben von Körpern in einem Gravitationsfeld, der Übergang einer bestimmten Elektrizitätsmenge von einem höheren elektrostatischen Potential zu einem kleineren, die Ausdehnung eines Gases unter Druck usw. Das allgemeine Maß für die durch solche Methoden übertragene Bewegung ist Arbeit - eine Form der Energieübertragung durch die geordnete Bewegung von Teilchen.
Wärme und Arbeit charakterisieren qualitativ und quantitativ zwei unterschiedliche Formen der Bewegungsübertragung von einem bestimmten Teil der materiellen Welt auf einen anderen. Wärme und Arbeit können nicht im Körper zurückgehalten werden. Wärme und Arbeit entstehen nur, wenn ein Prozess stattfindet, und charakterisieren nur den Prozess. Unter statischen Bedingungen gibt es weder Wärme noch Arbeit. Der von der Thermodynamik als Ausgangspunkt akzeptierte Unterschied zwischen Wärme und Arbeit und der Gegensatz von Wärme und Arbeit sind nur für Körper sinnvoll, die aus vielen Molekülen bestehen, weil Für ein Molekül oder für eine Ansammlung weniger Moleküle verlieren die Begriffe Wärme und Arbeit ihre Bedeutung. Daher betrachtet die Thermodynamik nur Körper, die aus einer großen Anzahl von Molekülen bestehen, d.h. sogenannte makroskopische Systeme.

Drei Prinzipien der Thermodynamik
Die Prinzipien der Thermodynamik sind eine Reihe von Postulaten, die der Thermodynamik zugrunde liegen. Diese Bestimmungen wurden als Ergebnis wissenschaftlicher Forschung festgelegt und experimentell nachgewiesen. Sie werden als Postulate akzeptiert, damit die Thermodynamik axiomatisch konstruiert werden kann.
Die Notwendigkeit der Prinzipien der Thermodynamik ergibt sich aus der Tatsache, dass die Thermodynamik die makroskopischen Parameter von Systemen ohne spezifische Annahmen hinsichtlich ihrer mikroskopischen Struktur beschreibt. Die statistische Physik befasst sich mit Fragen der inneren Struktur.
Die Prinzipien der Thermodynamik sind unabhängig, das heißt, keines von ihnen kann aus den anderen Prinzipien abgeleitet werden. Analoga zu den drei Newtonschen Gesetzen der Mechanik sind die drei Prinzipien der Thermodynamik, die die Konzepte „Wärme“ und „Arbeit“ verbinden:
- Der Nullsatz der Thermodynamik spricht vom thermodynamischen Gleichgewicht.
- Im ersten Hauptsatz der Thermodynamik geht es um die Energieerhaltung.
- Im zweiten Hauptsatz der Thermodynamik geht es um Wärmeströme.
- Im dritten Hauptsatz der Thermodynamik geht es um die Unerreichbarkeit des absoluten Nullpunkts.
Allgemeines (Null-)Gesetz der Thermodynamik
Das allgemeine (Null-)Gesetz der Thermodynamik besagt, dass sich zwei Körper in einem thermischen Gleichgewichtszustand befinden, wenn sie Wärme aufeinander übertragen können, dies geschieht jedoch nicht.
Es ist nicht schwer zu erraten, dass zwei Körper keine Wärme aneinander übertragen, wenn ihre Temperaturen gleich sind. Wenn Sie beispielsweise die Temperatur eines menschlichen Körpers mit einem Thermometer messen (am Ende der Messung sind die Temperatur der Person und die Temperatur des Thermometers gleich) und dann mit demselben Thermometer die Temperatur messen des Wassers im Badezimmer, und es stellt sich heraus, dass beide Temperaturen übereinstimmen (es besteht ein thermisches Gleichgewicht zwischen der Person und dem Thermometer und einem Thermometer mit Wasser), können wir sagen, dass sich eine Person im thermischen Gleichgewicht mit dem Wasser in der Badewanne befindet.
Aus dem oben Gesagten können wir das Nullgesetz der Thermodynamik wie folgt formulieren: Zwei Körper, die mit einem dritten im thermischen Gleichgewicht stehen, stehen auch untereinander im thermischen Gleichgewicht.
Aus physikalischer Sicht stellt das Nullgesetz der Thermodynamik den Bezugspunkt dar, da zwischen zwei Körpern mit gleicher Temperatur kein Wärmefluss stattfindet. Mit anderen Worten können wir sagen, dass die Temperatur nichts anderes als ein Indikator für das thermische Gleichgewicht ist.

Erster Hauptsatz der Thermodynamik
Der erste Hauptsatz der Thermodynamik ist der Erhaltungssatz der thermischen Energie, der besagt, dass Energie nicht spurlos verschwindet.
Das System kann Wärmeenergie Q entweder absorbieren oder abgeben, während das System Arbeit W an den umgebenden Körpern verrichtet (oder die umgebenden Körper Arbeit am System verrichten), und die innere Energie des Systems, die den Anfangswert Unitit hatte, beträgt gleich Uend:
Uend-Ustart = ΔU = Q-W
Wärmeenergie, Arbeit und innere Energie bestimmen die Gesamtenergie des Systems, die einen konstanten Wert darstellt. Wenn eine bestimmte Menge an Wärmeenergie Q auf das System übertragen (abgeführt) wird, nimmt die Menge an innerer Energie des Systems U ohne Arbeit um Q zu (ab).
Zweiter Hauptsatz der Thermodynamik
Der zweite Hauptsatz der Thermodynamik besagt, dass sich Wärmeenergie nur in eine Richtung bewegen kann – von einem Körper mit höherer Temperatur zu einem Körper mit niedrigerer Temperatur, nicht jedoch umgekehrt.
Dritter Hauptsatz der Thermodynamik
Der dritte Hauptsatz der Thermodynamik besagt, dass ein Prozess, der aus einer endlichen Anzahl von Stufen besteht, es nicht zulässt, die Temperatur des absoluten Nullpunkts zu erreichen (obwohl dieser deutlich angenähert werden kann).
Der erste Hauptsatz der Thermodynamik ist einer der drei Grundsätze der Thermodynamik, der Energieerhaltungssatz für Systeme, in denen thermische Prozesse wesentlich sind.
Nach dem ersten Hauptsatz der Thermodynamik kann ein thermodynamisches System (z. B. Dampf in einer Wärmekraftmaschine) nur aufgrund seiner inneren Energie oder externer Energiequellen Arbeit leisten.
Der erste Hauptsatz der Thermodynamik erklärt die Unmöglichkeit der Existenz eines Perpetuum mobile der 1. Art, das Arbeit verrichten würde, ohne Energie aus irgendeiner Quelle zu beziehen.
Der Kern des ersten Hauptsatzes der Thermodynamik lautet wie folgt:
Wenn eine bestimmte Wärmemenge Q an ein thermodynamisches System übertragen wird, ändert sich im Allgemeinen die innere Energie des Systems DU und das System verrichtet die Arbeit A:
Gleichung (4), die den ersten Hauptsatz der Thermodynamik ausdrückt, ist eine Definition der Änderung der inneren Energie des Systems (DU), da Q und A unabhängig voneinander gemessene Größen sind.
Die innere Energie des Systems U kann insbesondere durch Messung der Arbeit des Systems in einem adiabatischen Prozess (also bei Q = 0) ermittelt werden: Und ad = - DU, das U bis zu einer additiven Konstante U bestimmt 0:
U = U + U 0 (5)
Der erste Hauptsatz der Thermodynamik besagt, dass U eine Funktion des Zustands des Systems ist, d. h. jeder Zustand eines thermodynamischen Systems ist durch einen bestimmten Wert von U gekennzeichnet, unabhängig davon, wie das System in diesen Zustand gebracht wurde (während die Werte von Fragen und Antworten hängen von dem Prozess ab, der zur Änderung des Systemzustands geführt hat). Bei der Untersuchung der thermodynamischen Eigenschaften physikalischer Systeme wird der erste Hauptsatz der Thermodynamik üblicherweise in Verbindung mit dem zweiten Hauptsatz der Thermodynamik angewendet.
3. Zweiter Hauptsatz der Thermodynamik
Der zweite Hauptsatz der Thermodynamik ist das Gesetz, nach dem makroskopische Prozesse, die mit endlicher Geschwindigkeit ablaufen, irreversibel sind.
Im Gegensatz zu idealen (verlustfreien) mechanischen oder elektrodynamischen reversiblen Prozessen gehen reale Prozesse, die mit der Wärmeübertragung bei einer endlichen Temperaturdifferenz (d. h. Strömung mit endlicher Geschwindigkeit) verbunden sind, mit verschiedenen Verlusten einher: Reibung, Gasdiffusion, Ausdehnung von Gasen in den Hohlraum, Freisetzung von Joule-Wärme usw.
Daher sind diese Prozesse irreversibel, das heißt, sie können spontan nur in eine Richtung ablaufen.
Der zweite Hauptsatz der Thermodynamik entstand historisch bei der Analyse des Betriebs von Wärmekraftmaschinen.
Der Name „Der Zweite Hauptsatz der Thermodynamik“ und seine erste Formulierung (1850) stammen von R. Clausius: „... ein Prozess, bei dem Wärme spontan von kälteren Körpern auf heißere Körper übertragen würde, ist unmöglich.“
Darüber hinaus ist ein solcher Prozess grundsätzlich unmöglich: weder durch direkte Wärmeübertragung von kälteren Körpern auf wärmere, noch mit Hilfe irgendwelcher Geräte ohne den Einsatz anderer Prozesse.
Im Jahr 1851 formulierte der englische Physiker W. Thomson den zweiten Hauptsatz der Thermodynamik anders: „In der Natur sind Prozesse unmöglich, deren einzige Folge das Anheben einer Last wäre, die durch die Kühlung eines Wärmespeichers entsteht.“
Wie Sie sehen, sind beide oben genannten Formulierungen des zweiten Hauptsatzes der Thermodynamik nahezu gleich.
Dies impliziert die Unmöglichkeit, einen Typ-2-Motor zu implementieren, d. h. Motor ohne Energieverlust durch Reibung und andere damit verbundene Verluste.
Darüber hinaus folgt daraus, dass alle realen Prozesse, die in der materiellen Welt in offenen Systemen ablaufen, irreversibel sind.
In der modernen Thermodynamik wird der zweite Hauptsatz der Thermodynamik isolierter Systeme auf eine einzige und allgemeinste Weise als Gesetz der Zunahme einer speziellen Funktion des Zustands des Systems formuliert, die Clausius Entropie (S) nannte.
Die physikalische Bedeutung von Entropie besteht darin, dass sich die Elementarteilchen, aus denen dieses System besteht, in einem unkontrollierbaren Zustand befinden und verschiedene zufällige chaotische Bewegungen ausführen, wenn sich ein Materialsystem im vollständigen thermodynamischen Gleichgewicht befindet. Grundsätzlich ist es möglich, die Gesamtzahl dieser verschiedenen Staaten zu ermitteln. Der Parameter, der die Gesamtzahl dieser Zustände charakterisiert, ist die Entropie.
Schauen wir uns das anhand eines einfachen Beispiels an.
Angenommen, ein isoliertes System bestehe aus zwei Körpern „1“ und „2“ mit ungleichen Temperaturen T 1 > T 2. Körper „1“ gibt eine bestimmte Wärmemenge Q ab und Körper „2“ empfängt sie. In diesem Fall findet ein Wärmefluss vom Körper „1“ zum Körper „2“ statt. Mit dem Temperaturausgleich steigt die Gesamtzahl der Elementarteilchen der Körper „1“ und „2“, die sich im thermischen Gleichgewicht befinden. Mit zunehmender Teilchenzahl steigt auch die Entropie. Und sobald ein vollständiges thermisches Gleichgewicht der Körper „1“ und „2“ eintritt, erreicht die Entropie ihren Maximalwert.
Somit nimmt in einem geschlossenen System die Entropie S für jeden realen Prozess entweder zu oder bleibt unverändert, d. h. die Entropieänderung dS ³ 0. Das Gleichheitszeichen in dieser Formel kommt nur für reversible Prozesse vor. Im Gleichgewichtszustand, wenn die Entropie eines geschlossenen Systems ihr Maximum erreicht, sind nach dem zweiten Hauptsatz der Thermodynamik keine makroskopischen Prozesse in einem solchen System möglich.
Daraus folgt, dass Entropie eine physikalische Größe ist, die die Merkmale der molekularen Struktur eines Systems quantitativ charakterisiert, von denen Energieumwandlungen in ihm abhängen.
Der Zusammenhang zwischen Entropie und der molekularen Struktur eines Systems wurde erstmals 1887 von L. Boltzmann erklärt. Er begründete die statistische Bedeutung der Entropie (Formel 1.6). Laut Boltzmann (hohe Ordnung hat relativ geringe Wahrscheinlichkeit)
Dabei ist k die Boltzmann-Konstante und P das statistische Gewicht.
k = 1,37·10 -23 J/K.
Das statistische Gewicht P ist proportional zur Anzahl möglicher mikroskopischer Zustände der Elemente eines makroskopischen Systems (z. B. verschiedene Verteilungen von Koordinatenwerten und Impulsen von Gasmolekülen, die einem bestimmten Wert von Energie, Druck und anderen thermodynamischen Parametern entsprechen). das Gas), d. h. es charakterisiert die mögliche Inkonsistenz der mikroskopischen Beschreibung des Makrozustands.
Für ein isoliertes System ist die thermodynamische Wahrscheinlichkeit W eines gegebenen Makrozustands proportional zu seinem statistischen Gewicht und wird durch die Entropie des Systems bestimmt:
W = exp(S/k). (7)
Somit ist das Gesetz der zunehmenden Entropie statistisch-probabilistischer Natur und drückt die ständige Tendenz des Systems aus, in einen wahrscheinlicheren Zustand überzugehen. Daraus folgt, dass der wahrscheinlichste für das System erreichbare Zustand derjenige ist, in dem sich gleichzeitig im System auftretende Ereignisse statistisch gegenseitig kompensieren.
Der höchstwahrscheinliche Zustand eines Makrosystems ist ein Gleichgewichtszustand, den es prinzipiell in einem ausreichend großen Zeitraum erreichen kann.
Wie oben erwähnt, ist die Entropie eine additive Größe, das heißt, sie ist proportional zur Anzahl der Teilchen im System. Daher ändert bei Systemen mit einer großen Anzahl von Teilchen selbst die unbedeutendste relative Änderung der Entropie pro Teilchen ihren absoluten Wert erheblich; Eine Änderung der Entropie, die im Exponenten in Gleichung (7) enthalten ist, führt zu einer Änderung der Wahrscheinlichkeit eines bestimmten Makrozustands W um ein Vielfaches.
Diese Tatsache ist der Grund dafür, dass für ein System mit einer großen Anzahl von Teilchen die Konsequenzen des zweiten Hauptsatzes der Thermodynamik praktisch keinen probabilistischen, sondern einen zuverlässigen Charakter haben. Extrem unwahrscheinliche Prozesse, die mit einer spürbaren Abnahme der Entropie einhergehen, erfordern so enorme Wartezeiten, dass ihre Umsetzung praktisch unmöglich ist. Gleichzeitig unterliegen kleine Teile des Systems, die eine kleine Anzahl von Teilchen enthalten, kontinuierlichen Schwankungen, begleitet von nur einer geringen absoluten Änderung der Entropie. Die Durchschnittswerte der Häufigkeit und Größe dieser Schwankungen sind eine ebenso zuverlässige Folge der statistischen Thermodynamik wie der zweite Hauptsatz der Thermodynamik selbst.
Die wörtliche Anwendung des zweiten Hauptsatzes der Thermodynamik auf das Universum als Ganzes, die Clausius zu der falschen Schlussfolgerung über die Unvermeidlichkeit des „thermischen Todes des Universums“ führte, ist illegal, da absolut isolierte Systeme in der Natur grundsätzlich nicht existieren können. Wie später im Abschnitt der Nichtgleichgewichtsthermodynamik gezeigt wird, gehorchen in offenen Systemen ablaufende Prozesse unterschiedlichen Gesetzen und haben unterschiedliche Eigenschaften.
Formulierung des zweiten Prinzips. Hier die beiden bekanntesten Formulierungen:
1. Ein Prozess ist unmöglich, dessen einziges Ergebnis die Verrichtung von Arbeit aufgrund der dem Wärmespeicher entnommenen Wärme bei konstanter Temperatur wäre (Thomsons Formulierung). Die gleiche Formulierung, aber mit anderen Worten ausgedrückt, behauptet die Unmöglichkeit des Schaffens Perpetuum Mobile der zweiten Art (d. h. Arbeit aufgrund der inneren Energie des Wärmespeichers erzeugen).
2. Ein Prozess ist unmöglich, dessen einziges Ergebnis die Übertragung von Energie von einem kälteren Körper auf einen heißeren wäre (Formulierung von Clausius).
Die Formulierungen von Thomson und Clausius sind äquivalent.
Satz von Carnot. Ein Carnot-Kreisprozess ist ein Kreisprozess, bei dem das Arbeitsmedium Wärme nur von einem Speicher mit konstanter Temperatur (Heizung) aufnimmt und diese nur an einen Speicher mit konstanter Temperatur (Kühlschrank) abgibt. Der Satz von Carnot besagt, dass die Effizienz eines beliebigen Carnot-Zyklus die Effizienz nicht überschreiten kann
Der reversible Carnot-Zyklus arbeitet gleichzeitig. Daraus folgt unmittelbar, dass die Effizienz eines reversiblen Carnot-Zyklus nur von der Art des Arbeitsmediums und nicht von dieser abhängt.
Wir führen Sie herein allgemeiner Überblick Wie kann man den Satz von Carnot beweisen? Nehmen wir an, dass der Wirkungsgrad einer reversiblen Maschine geringer ist als der einer irreversiblen. Wählen wir das Volumen des Arbeitsmediums einer reversiblen Maschine so, dass sie pro Zyklus die gleiche Arbeit verrichtet wie eine irreversible Maschine. Unter Berücksichtigung von (15) nimmt die Ungleichung für den Wirkungsgrad die Form an, in der wir die reversible Maschine einsetzen Rückseite so dass die Arbeit einer irreversiblen Maschine von einer reversiblen Maschine verbraucht wird. Während des Zyklus der kombinierten Maschine ist ihre Arbeit Null und die Heizung erhält die gesamte Energie aus dem Kühlschrank. Wir sind mit der Formulierung von Clausius auf einen Widerspruch gestoßen.
Da wir den Wirkungsgrad einer der Carnot-Maschinen kennen – Gas (16), kann der Satz von Carnot wie folgt geschrieben werden:
wobei die Gleichheit einem reversiblen Carnot-Zyklus entspricht.
Thermodynamische Temperaturskala. Der Satz von Carnot ermöglicht es uns, eine Temperaturskala zu bestimmen, die nicht von den Eigenschaften bestimmter Körper abhängt. Das Temperaturverhältnis zweier Körper wird bestimmt, indem man an ihnen eine reversible Carnot-Maschine anbringt; Da das Verhältnis nur von ihren Temperaturen abhängt, kann es gleich dem Verhältnis der thermodynamischen Temperaturen angenommen werden: Wie aus (17) ersichtlich ist, ist das Verhältnis der thermodynamischen Temperaturen gleich dem Verhältnis Gastemperaturen(im Bereich, in dem die Gasskala definiert ist).
Zweites Prinzip: Berechnung der inneren Energie. Mit dem zweiten Hauptsatz der Thermodynamik lässt sich eine wichtige Beziehung für die innere Energie eines einfachen Systems ableiten, die im Rahmen des ersten Hauptsatzes nicht ermittelt werden kann:
![]()
Lassen Sie uns zeigen, wie (18) aus dem Satz von Carnot erhalten werden kann. Betrachten Sie einen (unendlich) kleinen invertierbaren Carnot-Kreis und stellen Sie ihn in Koordinaten dar. Die Arbeit des Systems pro Zyklus, die der Fläche eines kleinen Parallelogramms entspricht (Abb. 14), ändert sich nicht, wenn Adiabatstücke durch vertikale Segmente ersetzt werden, deren Länge mit der Höhe multipliziert wird. Wir erhalten Wärme Der auf der oberen Isotherme erhaltene Wert ist gleich dem Wert, bei dem (8) für den Zuwachs bei konstanter Temperatur verwendet wird. Aus Carnots Theorem und Gleichung (17) haben wir
woraus wir (18) erhalten.

Lassen Sie uns mehrere Anwendungen der Formel (18) vorstellen.
1) Innere Energie eines idealen Gases. Setzen wir die Zustandsgleichung in (18) ein. Als Ergebnis erhalten wir z.B. Die innere Energie eines idealen Gases ist nicht vom Volumen abhängig.
2) Innere Energie von Van-der-Waals-Gas. Wenn wir den Druck aus der Zustandsgleichung (3) ausdrücken und ihn in (18) einsetzen, erhalten wir die Formel
![]()
Darüber hinaus haben wir
diese. kommt nicht auf die Lautstärke an. In dem Temperaturbereich, in dem es schwach von T abhängt, können wir schreiben
Der zweite Hauptsatz der Thermodynamik bestimmt die Richtung realer thermischer Prozesse, die mit endlicher Geschwindigkeit ablaufen.
Zweiter Anfang(Zweiter Hauptsatz) Thermodynamik Es hat mehrere Formulierungen . Zum Beispiel, irgendeine Aktion, im Zusammenhang mit der Energieumwandlung(das heißt, mit dem Übergang der Energie von einer Form in eine andere), kann nicht erfolgen, ohne dass sie in Form von Wärme an die Umgebung verloren geht. In mehr Gesamtansicht Dies bedeutet, dass die Prozesse der Energieumwandlung (Transformation) nur unter der Bedingung spontan ablaufen können, dass die Energie von einer konzentrierten (geordneten) Form in eine dispergierte (ungeordnete) Form übergeht.
Ein anderer Definition Der zweite Hauptsatz der Thermodynamik steht in direktem Zusammenhang mit Clausius-Prinzip : Ein Prozess, bei dem außer der Übertragung von Wärme von einem heißen Körper auf einen kalten Körper keine Veränderung stattfindet, ist irreversibel, d. h. Wärme kann nicht spontan von einem kälteren Körper auf einen heißeren übertragen werden. Dabei eine solche Umverteilung der Energie im System durch die Größe gekennzeichnet , angerufen Entropie , die als Funktion des Zustands eines thermodynamischen Systems (eine Funktion mit einem totalen Differential) erstmals eingeführt wurde 1865 Jahr genau von Clausius. Entropie – Es ist ein Maß für die irreversible Energiedissipation. Je größer die Energiemenge ist, die irreversibel als Wärme abgegeben wird, desto größer ist die Entropie.
Aus diesen Formulierungen des zweiten Hauptsatzes der Thermodynamik können wir also schließen jedes System , deren Eigenschaften sich im Laufe der Zeit ändern, strebt nach einem Gleichgewichtszustand, indem Entropie des Systems nimmt den Maximalwert an. Deswegen Zweiter Hauptsatz der Thermodynamik rufe oft an Gesetz der zunehmenden Entropie , und sie selbst Entropie (Wie physikalische Größe oder als physikalisches Konzept) sind am Überlegen als Maß für die innere Störung eines physikalisch-chemischen Systems .
Mit anderen Worten, Entropie – Zustandsfunktion Charakterisierung der Richtung spontaner Prozesse in einem geschlossenen thermodynamischen System. Im Gleichgewichtszustand erreicht die Entropie eines geschlossenen Systems ihr Maximum und in einem solchen System sind keine makroskopischen Prozesse möglich. Maximale Entropie entspricht völligem Chaos .
Am häufigsten ist der Übergang eines Systems von einem Zustand in einen anderen nicht charakterisiert Absolutwert Entropie S , und seine Änderung ∆ S , was dem Verhältnis der Änderung der Wärmemenge (an das System übermittelt oder daraus abgeführt) zu entspricht Absolute Temperatur Systeme: ∆ S= ∆Q/T J/Grad. Dies ist das sogenannte thermodynamische Entropie .
Darüber hinaus hat die Entropie auch eine statistische Bedeutung. Beim Übergang von einem Makrozustand in einen anderen nimmt auch die statistische Entropie zu, da ein solcher Übergang immer von einer großen Anzahl von Mikrozuständen begleitet wird und der Gleichgewichtszustand (zu dem das System tendiert) durch die maximale Anzahl von Mikrozuständen gekennzeichnet ist.
Im Zusammenhang mit dem Entropiebegriff in der Thermodynamik neue Bedeutung erwirbt den Begriff der Zeit. In der klassischen Mechanik werden Zeitrichtung und Zustand nicht berücksichtigt Mechanisches System kann sowohl in der Vergangenheit als auch in der Zukunft bestimmt werden. In der Thermodynamik erscheint die Zeit in Form eines irreversiblen Prozesses zunehmender Entropie in einem System. Das heißt, je größer die Entropie, desto länger ist die Zeitspanne, die das System in seiner Entwicklung verstrichen hat.
Außerdem, die physikalische Bedeutung der Entropie zu verstehen das muss man bedenken In der Natur gibt es vier Klassen thermodynamischer Systeme :
A) isolierte oder geschlossene Systeme(beim Übergang solcher Systeme von einem Zustand in einen anderen findet keine Übertragung von Energie, Materie und Information über die Systemgrenzen hinweg statt);
B) adiabatische Systeme(es findet lediglich kein Wärmeaustausch mit der Umgebung statt);
V) geschlossene Systeme(Energie, aber keine Materie, mit benachbarten Systemen austauschen) (z. B. Raumschiff);
G) offene Systeme(Austausch von Materie, Energie und Informationen mit der Umwelt). In diesen Systemen können durch den Energieeintrag von außen dissipative Strukturen mit deutlich geringerer Entropie entstehen.
Bei offenen Systemen nimmt die Entropie ab. Letzteres betrifft in erster Linie biologische Systeme, also lebende Organismen, die offene Nichtgleichgewichtssysteme sind. Solche Systeme zeichnen sich durch Gradienten in der Konzentration von Chemikalien, der Temperatur, dem Druck und anderen physikalisch-chemischen Größen aus. Die Verwendung der Konzepte der modernen, also der Nichtgleichgewichts-Thermodynamik, ermöglicht es, das Verhalten offener, also realer Systeme zu beschreiben. Solche Systeme tauschen ständig Energie, Materie und Informationen mit ihrer Umgebung aus. Darüber hinaus sind solche Stoffwechselprozesse nicht nur für physikalische oder biologische Systeme, sondern auch für sozioökonomische, kulturelle, historische und humanitäre Systeme charakteristisch, da die in ihnen ablaufenden Prozesse in der Regel irreversibel sind.
Der dritte Hauptsatz der Thermodynamik (dritter Hauptsatz der Thermodynamik) ist mit dem Konzept des „absoluten Nullpunkts“ verbunden. Die physikalische Bedeutung dieses Gesetzes, das im thermischen Theorem von W. Nernst (deutscher Physiker) dargestellt ist, ist die grundsätzliche Unmöglichkeit, den absoluten Nullpunkt (-273,16 °C) zu erreichen, bei dem die translatorische thermische Bewegung der Moleküle aufhören sollte und die Entropie aufhören würde von den Parametern des physikalischen Zustands des Systems abhängen ( insbesondere von Änderungen der Wärmeenergie). Der Satz von Nernst gilt nur für thermodynamische Gleichgewichtszustände von Systemen.
Mit anderen Worten: Der Satz von Nernst kann wie folgt formuliert werden: bei Annäherung an den absoluten Nullpunkt das Entropieinkrement∆S tendiert zu einer genau definierten Endgrenze, unabhängig von den Werten aller Parameter, die den Zustand des Systems charakterisieren(zum Beispiel Volumen, Druck, Aggregatzustand usw.).
Verstehen Sie die Essenz des Satzes von Nernst möglich bei das folgende Beispiel. Wenn die Temperatur des Gases sinkt, kommt es zu seiner Kondensation und die Entropie des Systems nimmt ab, da die Moleküle geordneter angeordnet sind. Bei einem weiteren Temperaturabfall kommt es zur Kristallisation der Flüssigkeit, begleitet von einer größeren Ordnung in der Anordnung der Moleküle und damit zu einer noch stärkeren Abnahme der Entropie. Bei der absoluten Nulltemperatur hört jede thermische Bewegung auf, die Unordnung verschwindet, die Anzahl möglicher Mikrozustände sinkt auf eins und die Entropie nähert sich Null.
4. Das Konzept der Selbstorganisation. Selbstorganisation in offenen Systemen.
Konzept " Synergetik“ wurde 1973 vom deutschen Physiker Hermann vorgeschlagen Haken um die Richtung anzuzeigen, angerufen Erkunden Sie die allgemeinen Gesetze der Selbstorganisation – das Phänomen der koordinierten Aktion von Elementen eines komplexen Systems ohne externe Kontrolleinwirkung. Synergetik (übersetzt aus dem Griechischen – gemeinsam, koordiniert, erleichternd) – wissenschaftliche Ausrichtung studieren Verbindungen zwischen Strukturelementen(Subsysteme), die gebildet werden in offenen Systemen (biologisch, physikalisch-chemisch, geologisch-geographisch usw.) Dank intensiv(Streaming) Austausch von Materie, Energie und Informationen mit der Umwelt unter Nichtgleichgewichtsbedingungen. In solchen Systemen wird ein koordiniertes Verhalten von Subsystemen beobachtet, wodurch der Ordnungsgrad zunimmt (Entropie abnimmt), also der Prozess der Selbstorganisation entsteht.
GleichgewichtEs herrscht ein Zustand des Friedens und der Symmetrie, A Asymmetrie führt zu Bewegung und Ungleichgewichtszustand .
Bedeutender Beitrag zur Theorie der Selbstorganisation von Systemen beigesteuert von einem belgischen Physiker russischer Herkunft I.R. Prigogine (1917-2003). Das hat er gezeigt dissipative Systeme (Systeme, in denen Entropiedissipation stattfindet) Im Zuge irreversibler Nichtgleichgewichtsprozesse entstehen geordnete Formationen, die er nannte dissipative Strukturen.
Selbstorganisation- Das Verfahren spontanes Auftreten Ordnung und Organisation aus der Unordnung(Chaos) in offenen Nichtgleichgewichtssystemen. Zufällige Abweichungen der Systemparameter vom Gleichgewicht ( Schwankungen) sie spielen sehr wichtige Rolle in der Funktionsweise und Existenz des Systems. Auf Kosten der Zunahme der Schwankungen bei der Aufnahme von Energie aus der Umgebung System erreicht einige kritischer Zustand Und geht in einen neuen stabilen Zustand über Mit mehr hohes Level Schwierigkeiten Und Befehl im Vergleich zum Vorgänger. Das System, das sich in einem neuen stationären Zustand selbstorganisiert, reduziert seine Entropie; es „schüttet“ sozusagen seinen Überschuss, der durch interne Prozesse zunimmt, in die Umgebung aus.
Aus dem Chaos hervorgehen geordnete Struktur (Attraktor oder dissipative Struktur) ist Ergebnis des Wettbewerbs Mengen aller möglichen Zustände, die in das System eingebettet sind. Durch den Wettbewerb kommt es zu einer spontanen Auswahl der unter den aktuellen Bedingungen anpassungsfähigsten Struktur.
Synergetik basiert zur Thermodynamik von Nichtgleichgewichtsprozessen, zur Theorie zufälliger Prozesse, zur Theorie nichtlinearer Schwingungen und Wellen.
Synergetik untersucht die Entstehung und Entwicklung von Systemen. Unterscheiden drei Arten von Systemen: 1) geschlossen, die keine Materie, Energie oder Informationen mit benachbarten Systemen (oder mit der Umwelt) austauschen; 2) geschlossen die mit benachbarten Systemen (z. B. einem Raumschiff) Energie, aber keine Materie austauschen; 3) offen, die sowohl Materie als auch Energie mit benachbarten Systemen austauschen. Fast alle natürlichen (ökologischen) Systeme sind vom offenen Typ.
Existenz von Systemen undenkbar keine Verbindungen. Letztere werden in direkt und invers unterteilt. Gerade sie nennen das Verbindung , in dem ein Element ( A) wirkt auf einen anderen ( IN) ohne Antwort. Bei Rückmeldung Element IN reagiert auf die Aktion des Elements A. Feedback kann positiv oder negativ sein.
Positives Feedback führt zu einer Intensivierung des Prozesses in eine Richtung. Ein Beispiel für seine Wirkung ist die Staunässe eines Gebiets (z. B. nach der Abholzung). Verfahren beginnt Akt V eine Richtung: Anstieg der Feuchtigkeit – Sauerstoffmangel – Verlangsamung der Zersetzung Pflanzenreste– Ansammlung von Torf – weitere Intensivierung der Staunässe.
Feedback negatives Feedback wirkt so, dass es als Reaktion auf die erhöhte Wirkung des Elements reagiert A die entgegengesetzt gerichtete Kraft des Elements nimmt zu B. Diese Verbindung ermöglicht es dem System, im Zustand zu bleiben stabiles dynamisches Gleichgewicht. Dies ist die häufigste und wichtige Ansicht Verbindungen in natürlichen Systemen. Sie sind in erster Linie die Grundlage für die Nachhaltigkeit und Stabilität von Ökosystemen.
Eine wichtige Eigenschaft von Systemen Ist Entstehung (übersetzt aus dem Englischen – Entstehung, Erscheinung von etwas Neuem). Diese Eigenschaft liegt darin, dass die Eigenschaften des Systems als Ganzes nicht eine einfache Summe der Eigenschaften seiner Bestandteile oder Elemente sind, sondern die Wechselbeziehungen der verschiedenen Glieder des Systems seine neue Qualität bestimmen.
Der synergetische Ansatz zur Systembetrachtung basiert auf drei Konzepte: Ungleichgewicht, Offenheit Und Nichtlinearität .
Ungleichgewicht(Instabilität) – Zustand des Systems, bei dem eine Änderung seiner makroskopischen Parameter auftritt, dh Zusammensetzung, Struktur, Verhalten.
Offenheit –Systemfähigkeit tauschen ständig Materie, Energie und Informationen mit der Umwelt aus und verfügen über beide „Quellen“ – Zonen der Wiederauffüllung von Energie aus der Umwelt und Zonen der Dissipation, „Senke“.
Nichtlinearität –Eigenschaft des Systems bleiben in verschiedenen stationären Zuständen, die unterschiedlichen zulässigen Verhaltensgesetzen dieses Systems entsprechen.
IN nichtlineare Systeme Die Entwicklung verläuft nach nichtlinearen Gesetzen und führt zu einer multivariaten Wahl von Pfaden und Alternativen zum Verlassen des Zustands der Instabilität. IN nichtlineare Systeme Prozesse können verschleißen Charakter mit scharfer Schwelle wenn bei einer allmählichen Änderung der äußeren Bedingungen ein abrupter Übergang zu einer anderen Qualität beobachtet wird. Gleichzeitig werden alte Strukturen zerstört und es entstehen qualitativ neue Strukturen.