Основные молекулярно-кинетической теории, уравнения и формулы. Основные положения молекулярно-кинетической теории
ОПРЕДЕЛЕНИЕ
Уравнение, положенное в основу молекулярно-кинетической теории, связывает макроскопические величины, описывающие (например, давление) с параметрами его молекул (их и скоростями). Это уравнение имеет вид:
Здесь – масса газовой молекулы, – концентрация таких частичек в единице объема, – усреднённый квадрат скорости молекул.
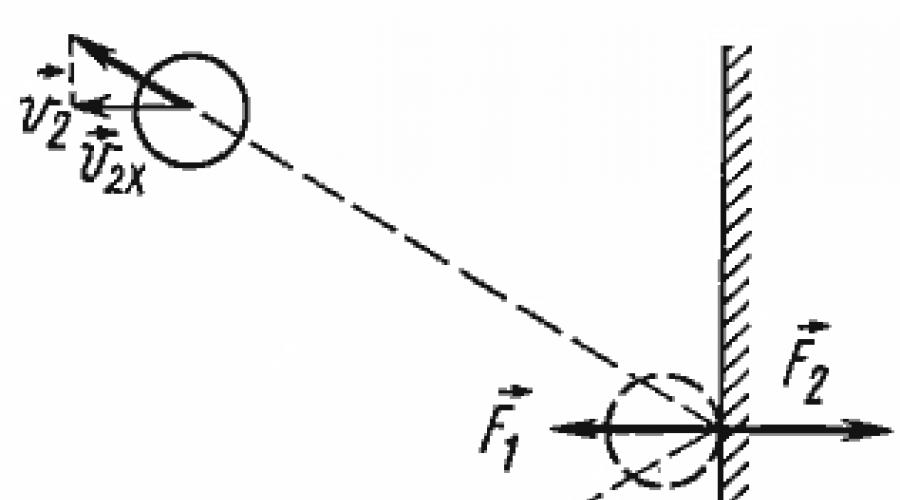
Основное уравнение МКТ наглядно объясняет, каким образом идеальный газ создает на окружающие его стенки сосуда. Молекулы все время ударяются о стенку, воздействуя на нее с некоторой силой F. Тут следует вспомнить : когда молекула ударяется о предмет, на нее действует сила -F, вследствие чего молекула «отбивается» от стенки. При этом мы считаем соударения молекул со стенкой абсолютно упругими: механическая энергия молекул и стенки полностью сохраняется, не переходя во . Это значит, что при соударениях изменяются только молекул, а нагревания молекул и стенки не происходит.

Зная, что соударение со стенкой было упругим, мы можем предсказать, как изменится скорость молекулы после столкновения. Модуль скорости останется таким же, как и до соударения, а направление движения изменится на противоположное относительно оси Ох (считаем, что Ох – это та ось, которая перпендикулярна стенке).
Молекул газа очень много, движутся они хаотично и о стенку ударяются часто. Найдя геометрическую сумму сил, с которой каждая молекула воздействует на стенку, мы узнаём силу давления газа. Чтобы усреднить скорости молекул, необходимо использовать статистические методы. Именно поэтому в основном уравнении МКТ используют усредненный квадрат скорости молекул , а не квадрат усредненной скорости : усредненная скорость хаотично движущихся молекул равна нулю, и в этом случае никакого давления мы бы не получили.
Теперь ясен физический смысл уравнения: чем больше молекул содержится в объеме, чем они тяжелее и чем быстрее движутся – тем большее давление они создают на стенки сосуда.
Основное уравнение МКТ для модели идеального газа
Следует заметить, что основное уравнение МКТ выводилось для модели идеального газа с соответствующими допущениями:
- Соударения молекул с окружающими объектами абсолютно упругие. Для реальных же газов это не совсем так; часть молекул всё-таки переходит во внутреннюю энергию молекул и стенки.
- Силами взаимодействия между молекулами можно пренебречь. Если же реальный газ находится при высоком давлении и сравнительно низкой температуре, эти силы становятся весьма существенными.
- Молекулы считаем материальными точками, пренебрегая их размером. Однако размеры молекул реальных газов влияют на расстояние между самими молекулами и стенкой.
- И, наконец, основное уравнение МКТ рассматривает однородный газ – а в действительности мы часто имеем дело со смесями газов. Как, например, .
Однако для разреженных газов это уравнение дает очень точные результаты. Кроме того, многие реальные газы в условиях комнатной температуры и при давлении, близком к атмосферному, весьма напоминают по свойствам идеальный газ.
Как известно из законов , кинетическая энергия любого тела или частицы . Заменив произведение массы каждой из частичек и квадрата их скорости в записанном нами уравнении, мы можем представить его в виде:
Также кинетическая энергия газовых молекул выражается формулой , что нередко используется в задачах. Здесь k – это постоянная Больцмана, устанавливающая связь между температурой и энергией. k=1,38 10 -23 Дж/К.
Основное уравнение МКТ лежит в основе термодинамики. Также оно используется на практике в космонавтике, криогенике и нейтронной физике.
Примеры решения задач
ПРИМЕР 1
| Задание | Определить скорость движения частиц воздуха в нормальных условиях. |
| Решение | Используем основное уравнение МКТ, считая воздух однородным газом. Так как воздух на самом деле – это смесь газов, то и решение задачи не будет абсолютно точным.
Давление газа:
Можем заметить, что произведение – это газа, так как n – концентрация молекул воздуха (величина, обратная объему), а m – масса молекулы. Тогда предыдущее уравнение примет вид: В нормальных условиях давление равно 10 5 Па, плотность воздуха 1,29кг/м 3 – эти данные можно взять из справочной литературы. Из предыдущего выражения получим молекул воздуха:
|
| Ответ | м/с |
ПРИМЕР 2
| Задание | Определить концентрацию молекул однородного газа при температуре 300 К и 1 МПа. Газ считать идеальным. |
| Решение | Решение задачи начнём с основного уравнения МКТ: |
Нас окружают разнообразные предметы. Мы можем увидеть, что это либо твердые тела, либо жидкости, либо газы. Возникает масса вопросов обо всем, что нас окружает. Ответы на многие вопросы дает молекулярно-кинетическая теория .
Молекулярно-кинетическая теория – это совокупность воззрений, используемых для описания наблюдаемых и измеряемых свойств вещества на основе изучения свойств атомов и молекул данного вещества, их взаимодействия и движения.
Основные положения молекулярно-кинетической теории
Все тела состоят из частиц – атомов, молекул, ионов.
Все частицы находятся в непрерывном хаотическом тепловом движении.
Между частицами любого тела существуют силы взаимодействия – притяжения и отталкивания.
Таким образом, в молекулярно-кинетической теории объектом исследования является система, состоящая из большого количества частиц – макросистема . Для объяснения поведения такой системы законы механики не применимы. Поэтому основным методом исследования является статистический метод изучения свойств вещества.
Для объяснения и предсказания явлений важно знать основные характеристики молекул :
- Размеры

Оценка размера молекулы может быть сделана как размер кубика a в котором содержится одна молекула, исходя из плотности твердых или жидких веществ и массы одной молекулы:

- Масса молекул
Отношение массы вещества m к числу молекул N в данном веществе:
- Относительная молекулярная масса
Отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода:
- Количество вещества
Количество вещества равно отношению числа частиц N в теле (атомов – в атомарном веществе, молекул – в молекулярном) к числу молекул в одном моле веществаN А:

- Постоянная Авогадро
Количество молекул, содержащихся в 1 моль вещества.
- Молярная масса
Молярной массой вещества называют массу вещества, взятого в количестве 1 моля.
В Международной системе единиц молярная масса вещества выражается в кг/моль .
- Взаимодействие (количественно на основе опытов)

Для взаимодействия молекул характерно одновременно и притяжение, и отталкивание: на расстояниях r
Молекулярно-кинетическая теория дает возможность понять, почему вещество может находиться в газообразном, жидком и твердом состояниях. С точки зрения МКТ агрегатные состояния различаются по значению среднего расстояния между молекулами и характеру движения молекул друг относительно друга .
Основные положения молекулярно-кинетической теории неоднократно подтверждались различными физическими экспериментами. Например, исследованием:
А) Диффузии
Б) Броуновского движения
Краткие итоги
Молекулярно-кинетическая теория объясняет строение и свойства тел на основе движения и взаимодействия атомов, молекул и ионов. В основе МКТ лежат три положения , которые полностью подтверждены экспериментально и теоретически:
1) все тела состоят из частиц – молекул, атомов, ионов;
2) частицы находятся в непрерывном хаотическом тепловом движении;
3) между частицами любого тела существуют силы взаимодействия – притяжения и отталкивания.
Молекулярное строение вещества подтверждается непосредственным наблюдением молекул в электронных микроскопах, а также растворением твердых веществ в жидкостях, сжимаемостью и проницаемостью вещества. Тепловое движение – броуновским движением и диффузией. Наличие межмолекулярного взаимодействия прочностью и упругостью твердых тел, поверхностным натяжением жидкостей.
Опорный конспект к уроку:

Вопросы для самоконтроля по блоку «Основные положения молекулярно-кинетической теории и их опытное обоснование»
- Сформулируйте основные положения молекулярно-кинетической теории.
- Какие наблюдения и эксперименты подтверждают основные положения молекулярно-кинетической теории?
- Что такое молекула? атом?
- Что называют относительной молекулярной массой? Какая формула выражает это понятие?
- Что называют количеством вещества? Какая формула выражает это понятие? Какова единица количества вещества?
- Что называют постоянной Авогадро?
- Что такое молярная масса вещества? Какая формула выражает смысл этого понятия? Какова единица молярной массы?
- Какова природа межмолекулярных сил?
- Какими свойствами обладают силы молекулярного взаимодействия?
- Как силы взаимодействия зависят от расстояния между ними?
- Опишите характер движения молекул в газах, жидкостях и твердых телах.
- Каков характер упаковки частиц у газов, жидкостей и твердых тел?
- Каково среднее расстояние между молекулами у газов, жидкостей и твердых тел?
- Перечислите основные свойства газов, жидкостей, твердых тел.
- Что называют броуновским движением?
- О чем свидетельствует броуновское движение?
- Что называют диффузией? Приведите примеры диффузии в газах, жидкостях и твердых телах.
- 18. Как зависит скорость диффузии от температуры тел?
МКТ - это просто!
«Ничто не существует, кроме атомов и пустого пространства …» - Демокрит
«Любое тело может делиться до бесконечности» - Аристотель
Основные положения молекулярно-кинетической теории (МКТ)
Цель МКТ
- это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.
Макроскопические тела
- это большие тела, состоящие из огромного числа молекул.
Тепловые явления
- явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Подтверждение МКТ:
1. экспериментальное
- механическое дробление вещества; растворение вещества в воде; сжатие и расширение газов; испарение; деформация тел; диффузия; опыт Бригмана: в сосуд заливается масло, сверху на масло давит поршень, при давлении 10 000 атм масло начинает просачиваться сквозь стенки стального сосуда;
Диффузия; броуновское движение частиц в жидкости под ударами молекул;
Плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
2. прямое
- фотографирование, определение размеров частиц.
Броуновское движение
Броуновское движение - это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
- открыто английским ботаником Р. Броуном в 1827 г.
- дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
- экспериментально подтверждено французским физиком Ж. Перреном.
Масса и размеры молекул
Размеры частиц
Диаметр любого атома составляет около см.

Число молекул в веществе
где V - объем вещества, Vo - объем одной молекулы
Масса одной молекулы
где m - масса вещества,
N - число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Условно принято считать за 1 а.е.м. :
Относительная молекулярная масса вещества
Для удобства расчетов вводится величина - относительная молекулярная масса вещества.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.

где числитель - это масса молекулы, а знаменатель - 1/12 массы атома углерода
Это величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента

где числитель - это масса атома, а знаменатель - 1/12 массы атома углерода
Величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Другой способ определения относительной молекулярной массы вещества
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
Относительную атомную массу любого химического элемента берем из таблицы Менделеева!)
Количество вещества
Количество вещества (ν) определяет относительное число молекул в теле.
где N - число молекул в теле, а Na - постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль - это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Запомни!
В 1 моле любого вещества содержится одинаковое число атомов или молекул!
Но!
Одинаковые количества вещества для разных веществ имеют разную массу!
Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро или постоянной Авогадро:
Молярная масса
Молярная масса (M) - это масса вещества, взятого в одном моле, или иначе - это масса одного моля вещества.
Масса молекулы
- постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.
Формулы для решения задач
Эти формулы получаются в результате подстановки вышерассмотренных формул.
Масса любого количества вещества
Основные положения молекулярно-кинетической теории.
Молекулярно-кинетическая теория (МКТ) занимается изучением свойств веществ, основываясь при этом на представлениях о частицах вещества.
МКТ базируется на трех основных положениях:
1. Все вещества состоят из частиц - молекул, атомов и ионов.
2. Частицы вещества беспрерывно и беспорядочно движутся.
3. Частицы вещества взаимодействуют друг с другом.
Беспорядочное (хаотичное) движение атомов и молекул в веществе называют тепловым движением, потому что скорость движения частиц увеличивается с ростом температуры. Экспериментальным подтверждением непрерывного движения атомов и молекул в веществе является броуновское движение и диффузия.
Частицы вещества.
Все вещества и тела в природе состоят из атомов и молекул - групп атомов. Такие большие тела называются макроскопическими. Атомы и молекулы относятся к микроскопическим телам. Современные приборы (ионные проекторы, туннельные микроскопы) позволяют видеть изображения отдельных атомов и молекул.
Основа строения вещества - атомы. Атомы тоже имеют сложную структуру, они состоят из элементарных частиц - протонов, нейтронов, входящих в состав ядра атома, электронов, а также других элементарных частиц.
Атомы могут объединяться в молекулы, а могут быть вещества, состоящие только из атомов. Атомы в целом электронейтральны. Атомы, имеющие избыток или недостаток электронов называются ионами. Бывают положительные и отрицательные ионы.
На иллюстрации показаны примеры разных веществ, имеющих строение соответственно в виде атомов, молекул и ионов.
Силы взаимодействия между молекулами.
На очень малых расстояниях между молекулами действуют силы отталкивания. Благодаря этому молекулы не проникают друг в друга и куски вещества никогда не сжимаются до размеров одной молекулы. Молекула - это сложная система, состоящая из отдельных заряженных частиц: электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, но между ними на малых расстояниях действуют значительные электрические силы: происходит взаимодействие электронов и атомных ядер соседних молекул. Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия практически не сказываются. Силы между электрически нейтральными молекулами являются короткодействующими. На расстояниях, превышающих 2 - 3 диаметра молекул, действуют силы притяжения. По мере уменьшения расстояния между молекулами сила притяжения сначала увеличивается, а затем начинает убывать и убывает до нуля, когда расстояние между двумя молекулами становится равным сумме радиусов молекул. При дальнейшем уменьшении расстояния электронные оболочки атомов начинают перекрываться, и между молекулами возникают быстро нарастающие силы отталкивания.
|
|
|
Идеальный газ. Основное уравнение МКТ.
Известно, что частицы в газах, в отличие от жидкостей и твердых тел, располагаются друг относительно друга на расстояниях, существенно превышающих их собственные размеры. В этом случае взаимодействие между молекулами пренебрежимо мало и кинетическая энергия молекул много больше энергии межмолекулярного взаимодействия. Для выяснения наиболее общих свойств, присущих всем газам, используют упрощенную модель реальных газов - идеальный газ. Основные отличия идеального газа от реального газа:
1. Частицы идеального газа - сферические тела очень малых размеров, практически материальные точки.
2. Между частицами отсутствуют силы межмолекулярного взаимодействия.
3. Соударения частиц являются абсолютно упругими.
Реальные разреженные газы действительно ведут себя подобно идеальному газу. Воспользуемся моделью идеального газа для объяснения происхождения давления газа. Вследствие теплового движения, частицы газа время от времени ударяются о стенки сосуда. При каждом ударе молекулы действуют на стенку сосуда с некоторой силой. Складываясь друг с другом, силы ударов отдельных частиц образуют некоторую силу давления, постоянно действующую на стенку. Понятно, что чем больше частиц содержится в сосуде, тем чаще они будут ударяться о стенку сосуда, и тем большей будет сила давления, а значит и давление. Чем быстрее движутся частицы, тем сильнее они ударяют в стенку сосуда. Мысленно представим себе простейший опыт: катящийся мяч ударяется о стенку. Если мяч катится медленно, то он при ударе подействует на стенку с меньшей силой, чем если бы он двигался быстро. Чем больше масса частицы, тем больше сила удара. Чем быстрее движутся частицы, тем чаще они ударяются о стенки сосуда. Итак, сила, с которой молекулы действуют на стенку сосуда, прямо пропорциональна числу молекул, содержащихся в единице объема (это число называется концентрацией молекул и обозначается n), массе молекулы m o
, среднему квадрату их скоростей и площади стенки сосуда. В результате получаем: давление газа прямо пропорционально концентрации частиц, массе частицы и квадрату скорости частицы (или их кинетической энергии). Зависимость давления идеального газа от концентрации и от средней кинетической энергии частиц выражается основным уравнением молекулярно-кинетической теории идеального газа. Мы получили основное уравнение МКТ идеального газа из общих соображений, но его можно строго вывести, опираясь на законы классической механики. Приведем одну из форм записи основного уравнения МКТ:
P=(1/3)· n· m o
· V 2
.
Молекулярная физика – раздел физики, в котором изучаются физические свойства тел в различных агрегатных состояниях на основе рассмотрения их молекулярного строения, силы взаимодействия между частицами, образующими тела и характеры теплового движения этих частиц.
Многочисленные исследования, проведенные этими учеными позволили сформулироватьосновные положения молекулярно-кинетической теории – МКТ.
МКТ объясняет строение и свойства тел на основе закономерностей движения и взаимодействия молекул, из которых состоят тела.
В основе МКТ лежат три важных положения, подтвержденные экспериментально и теоретически.
- Все тела состоят из мельчайших частиц – атомов, молекул, в состав которых входят еще более мелкие элементарные частицы (электроны, протоны, нейтроны). Строение любого вещества дискретно (прерывисто).
- Атомы и молекулы вещества всегда находятся в непрерывном хаотическом движении.
- Между частицами любого вещества существуют силы взаимодействия – притяжения и отталкивания. Природа этих сил электромагнитная.
Эти положения подтверждаются опытным путем.
Опытное обоснование 1 положения.
Все тела состоят из мельчайших частиц. Во-первых, об этом говорит возможность деления вещества (все тела можно разделить на части).
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение .
Оно было открыто английским ботаником Р. Броуном (1827 г.). В 1827 году англ. ботаник Броун, изучая внутреннее строение растений с помощью микроскопа обнаружил, что частички твердого вещества в жидкой среде совершают непрерывное хаотическое движение.
Тепловое движение взвешенных в жидкости (или газе) частиц получило название броуновского движения.
Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую. Теория броуновского движения была создана А. Эйнштейном (1905 г.). Экспериментально теория Эйнштейна была подтверждена в опытах французского физика Ж. Перрена (1908–1911 гг.).
Причиной броуновского движения является непрерывное хаотическое движение молекул жидкости или газа, которые, беспорядочно ударяясь со всех сторон о частичку, приводят её в движение. Причина броуновского движения частицы в том, что удары молекул о неё не компенсируются. Значит броуновское движение является еще и опытным обоснованием 2 положения МКТ.
Непрерывное движение молекул любого вещества (твердого, жидкого, газообразного) подтверждается многочисленными опытами по диффузии.
Диффузией называют явление самопроизвольного проникновения молекул одного вещества в промежутки между молекулами другого. Т.е. это самопроизвольное перемешивание веществ.
Если пахучее вещество (духи) внести в помещение, то через некоторое время запах этого вещества распространится по всему помещению. Это свидетельствует о том, что молекулы одного вещества без воздействия внешних сил проникают в другое. Диффузия наблюдается и в жидкостях, и в твердых телах.
При изучении строения вещества было установлено, что между молекулами одновременно действуют силы притяжения и отталкивания, называемые молекулярными силами. Это силы электромагнитной природы.
Способность твердых тел сопротивляться растяжению, особые свойства поверхности жидкости приводят к выводу, что между молекулами действуют силы притяжения .
Малая сжимаемость весьма плотных газов и особенно жидкостей и твердых тел означает, что между молекулами существуют силы отталкивания .
Эти силы действуют одновременно. Если бы этого не было, то тела не были бы устойчивыми: либо разлетелись бы на частицы, либо слипались.
Межмолекулярное взаимодействие – это взаимодействие электрически нейтральных молекул и атомов.
Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы представляют собой сложные пространственные структуры, содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания. Зависимости результирующей силы F и потенциальной энергии E p взаимодействия между молекулами от расстояния между их центрами качественно изображены на рисунке. При некотором расстоянии r = r 0 сила взаимодействия обращается в нуль. Это расстояние условно можно принять за диаметр молекулы. Потенциальная энергия взаимодействия при r = r 0 минимальна. Чтобы удалить друг от друга две молекулы, находящиеся на расстоянии r 0 , нужно сообщить им дополнительную энергию E 0 . Величина E 0 называется глубиной потенциальной ямы или энергией связи .
Между электронами одной молекулы и ядрами другой действуют силы притяжения, которые условно принято считать отрицательными (нижняя часть графика). Одновременно между электронами молекул и их ядрами действуют силы отталкивания, которые условно считают положительными (верхняя часть графика). На расстоянии равном размеру молекул результирующая сила равна нулю, т.е. силы притяжения уравновешивают силы отталкивания. Это наиболее устойчивое расположение молекул. При увеличении расстояния притяжение превосходит силу отталкивания, при уменьшении расстояния между молекулами – наоборот.
Атомы и молекулы взаимодействуют и значит обладают потенциальной энергией .
Атомы и молекулы находятся в постоянном движении, и значит, обладают кинетической энергией.
Масса и размеры молекул
Большинство веществ состоит из молекул, поэтому для объяснения свойств макроскопических объектов, объяснения и предсказания явлений важно знать основные характеристики молекул.
Молекулой называют наименьшую устойчивую частицу данного вещества, обладающую его основными химическими свойствами.
Молекула состоит из ещё более мелких частиц – атомов, которые в свою очередь, состоят из электронов и ядер.
Атомом называют наименьшую частицу данного химического элемента.
Размеры молекул очень малы.
Порядок величины диаметра молекулы 1*10 - 8 см = 1*10 - 10 м
Порядок величины объёма молекулы 1*10 - 20 м 3
О том что размеры молекул малы можно судить и из опыта. В 1 л (м 3) чистой воды разведем 1 м 3 зеленых чернил, тете разбавим чернила в 1 000 000 раз. Увидим, что раствор имеет зеленую окраску и вместе с тем однороден. Это говорит о том, что даже при разбавлении в 1 000 000 раз в воде находится большое количество молекул красящего вещества. Этот опыт показывает, как малы размеры молекул.
В 1 см 3 воды содержится 3,7*10 -8 молекул.
Порядок величины массы молекул 1*10 -23 г = 1*10 -26 кг
В молекулярной физике принято характеризовать массы атомов и молекул не их абсолютными значениями (в кг), а относительными безразмерными величинами относительной атомной массой и относительной молекулярной массой.
По международному соглашению в качестве единичной атомной массы m 0 принимается 1/12 массы изотопа углерода 12 С (m 0С):
m 0 =1/12 m 0С =1,66 *10 -27
Относительную молекулярную массу можно определить, если абсолютное значение массы молекулы (m мол в кг) разделить на единичную атомную массу.
M 0 = m мол / 1/12 m 0С
Относительная молекулярная (атомарная) масса вещества (из таблицы Менделеева)
7 14 N Азот M 0 N = 14 M 0 N 2 = 28
Относительное число атомов или молекул, содержащихся в веществе характеризуется физической величиной, называемой количеством вещества.
Количество вещества ע – это отношение числа молекул (атомов) N в донном макроскопическом теле к числу молекул в 0,012 кг углерода N A
Количество вещества выражают в молях
Один моль – это количество вещества, в котором столько же молекул (атомов), сколько атомов содержится в 0,012 кг углерода.
Моль любого вещества содержит одинаковое число молекул. Это число называют постоянной Авогадро N A =6, 02 * 10 23 моль -1
Масса одного моля вещества называется молярной массой.
Число молекул в данной массе вещества: ![]()
Масса вещества (любого количества вещества):
Определение молярной массы: ![]()
Видеоресурс: Масса молекул. Количество вещества.
{youtube}bfPw9aZJVqk&list=PLhOzgnnk_5jyM6NXfLniX5sX3rZTrpoea&index=18{/youtube}
Понятие температуры – одно из важнейших в молекулярной физике.
Температура - это физическая величина, которая характеризует степень нагретости тел.
Беспорядочное хаотическое движение молекул называется тепловым движением .
Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах средняя кинетическая энергия молекулы может оказаться небольшой. В этом случае молекулы конденсируются в жидкое или твердое вещество; при этом среднее расстояние между молекулами будет приблизительно равно диаметру молекулы. При повышении температуры средняя кинетическая энергия молекулы становится больше, молекулы разлетаются, и образуется газообразное вещество.
Понятие температуры тесно связано с понятием теплового равновесия. Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты .
Рассмотрим пример. Если положить нагретый металл на лед, то лед начнет плавится, а металл – охлаждаться до тех пор, пока температуры тел не станут одинаковыми. При контакте между двумя телами разной температуры происходит теплообмен, в результате которого энергия металла уменьшается, а энергия льда увеличивается.
Энергия при теплообмене всегда передается от тела с более высокой температурой к телу с более низкой температурой. В конце концов, наступает состояние системы тел, при котором теплообмен между телами системы будет отсутствовать. Такое состояние называют тепловым равновесием .
Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными.
Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии. Возможность введения понятия температуры следует из опыта и носит название нулевого закона термодинамики.
Тела, находящиеся в тепловом равновесии, имеют одинаковые температуры.
Для измерения температур чаще всего используют свойство жидкости изменять объем при нагревании (и охлаждении).
Прибор, с помощью которого измеряется температура, называется термометр.
Для создания термометра необходимо выбрать термометрическое вещество (например, ртуть, спирт) и термометрическую величину, характеризующую свойство вещества (например, длина ртутного или спиртового столбика). В различных конструкциях термометров используются разнообразные физические свойства вещества (например, изменение линейных размеров твердых тел или изменение электрического сопротивления проводников при нагревании). Термометры должны быть откалиброваны. Для этого их приводят в тепловой контакт с телами, температуры которых считаются заданными. Чаще всего используют простые природные системы, в которых температура остается неизменной, несмотря на теплообмен с окружающей средой – это смесь льда и воды и смесь воды и пара при кипении при нормальном атмосферном давлении.
Обыкновенный жидкостный термометр состоит из небольшого стеклянного резервуара, к которому присоединена стеклянная трубка с узким внутренним каналом. Резервуар и часть трубки наполнены ртутью. Температуру среды, в которую погружен термометр определяют по положению верхнего уровня ртути в трубке. Деления на шкале условились наносить следующим образом. Цифру 0 ставят в том месте шкалы, где устанавливается уровень столбика жидкости, когда термометр опущен в тающий снег (лед), цифру 100 – в том месте, где устанавливается уровень столбика жидкости, когда термометр погружен в пары воды, кипящей при нормальном давлении (10 5 Па). Расстояние между этими отметками делят на 100 равных частей, называемых градусами. Такой способ деления шкалы введен Цельсием. Градус по шкале Цельсия обозначают ºС.

По температурной шкале Цельсия точке плавления льда приписывается температура 0 °С, а точке кипения воды – 100 °С. Изменение длины столба жидкости в капиллярах термометра на одну сотую длины между отметками 0 °С и 100 °С принимается равным 1 °С.
В ряде стран (США) широко используется шкала Фаренгейта (T F), в которой температура замерзающей воды принимается равной 32 °F, а температура кипения воды равной 212 °F. Следовательно,
![]()
Ртутные термометры применяют для измерения температуры в области от -30 ºС до +800 ºС. Наряду с жидкостными ртутными и спиртовыми термометрами применяются электрические и газовые термометры.
Электрический термометр – термосопротивление – в нем используется зависимость сопротивления металла от температуры.
Особое место в физике занимают газовые термометр , в которых термометрическим веществом является разреженный газ (гелий, воздух) в сосуде неизменного объема (V = const), а термометрической величиной – давление газа p . Опыт показывает, что давление газа (при V = const) растет с ростом температуры, измеренной по шкале Цельсия.

Чтобы проградуировать газовый термометр постоянного объема, можно измерить давление при двух значениях температуры (например, 0 °C и 100 °C), нанести точки p 0 и p 100 на график, а затем провести между ними прямую линию. Используя полученный таким образом калибровочный график, можно определять температуры, соответствующие другим значениям давления.

Газовые термометры громоздки и неудобны для практического применения: они используются в качестве прецизионного стандарта для калибровки других термометров.
Показания термометров, заполненных различными термометрическими телами, обычно несколько различаются. Чтобы точное определение температуры не зависело от вещества, заполняющего термометр, вводится термодинамическая шкала температур.
Чтобы её ввести, рассмотрим, как зависит давление газа от температуры, когда его масса и объём остаются постоянными.
Термодинамическая шкала температур. Абсолютный нуль.
Возьмем закрытый сосуд с газом, и будем нагревать его, первоначально поместив в тающий лед. Температуру газа t определим с помощью термометра, а давление p манометром. С увеличением температуры газа его давление будет возрастать. Такую зависимость нашел французский физик Шарль. График зависимости p от t, построенный на основании такого опыта, имеет вид прямой линии.

Если продолжить график в область низких давлений, можно определить некоторую «гипотетическую» температуру, при которой давление газа стало бы равным нулю. Опыт показывает, что эта температура равна –273,15 °С и не зависит от свойств газа. Невозможно на опыте получить путем охлаждения газ в состоянии с нулевым давлением, так как при очень низких температурах все газы переходят в жидкие или твердые состояния. Давление идеального газа определяется ударами хаотически движущихся молекул о стенки сосуда. Значит, уменьшение давления при охлаждении газа объясняется уменьшением средней энергии поступательного движения молекул газа Е; давление газа будет равно нулю, когда станет равна нулю энергия поступательного движения молекул.
Английский физик У. Кельвин (Томсон) выдвинул идею о том, что полученное значение абсолютного нуля соответствует прекращению поступательного движения молекул всех веществ. Температуры ниже абсолютного нуля в природе быть не может. Это предельная температура при которой давление идеального газа равно нулю.
Температуру, при которой должно прекратиться поступательное движение молекул, называют абсолютным нулем (или нулем Кельвина).
Кельвин в 1848 г. предложил использовать точку нулевого давления газа для построения новой температурной шкалы – термодинамической шкалы температур (шкала Кельвина ). За начало отсчета по этой шкале принята температура абсолютного нуля.
В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой К.
Размер градуса кельвина определяют так, чтобы он совпадал с градусом Цельсия, т.е 1К соответствует 1ºС.

Температура, отсчитанная по термодинамической шкале температур, обозначается Т. Её называют абсолютной температурой или термодинамической температурой .
Температурная шкала Кельвина называется абсолютной шкалой температур . Она оказывается наиболее удобной при построении физических теорий.
Кроме точки нулевого давления газа, которая называется абсолютным нулем температуры , достаточно принять еще одну фиксированную опорную точку. В шкале Кельвина в качестве такой точки используется температура тройной точки воды (0,01 °С), в которой в тепловом равновесии находятся все три фазы – лед, вода и пар. По шкале Кельвина температура тройной точки принимается равной 273,16 К.
Связь между абсолютной температурой и температурой по шкале Цельсия выражается формулой Т = 273,16 + t , где t – температура в градусах Цельсия.
Чаще пользуются приближенной формулой Т = 273 + t и t = Т – 273
Абсолютная температура не может быть отрицательной.
Температура газа – мера средней кинетической энергии движения молекул.
В опытах Шарлем была найдена зависимость p от t. Эта же зависимость будет и между р и Т: т.е. между р и Т прямопропорциональная зависимость .
С одной стороны, давление газа прямопропорционально его температуре, с другой стороны, мы уже знаем, что давление газа прямопропорционально средней кинетической энергии поступательного движения молекул Е (p = 2/3*E*n). Значит, Е прямопропорциональна Т.
Немецкий ученый Больцман предложил ввести коэффициент пропорциональности (3/2)k в зависимость Е от Т
Е = (3/2) k Т
Из этой формулы следует, что среднее значение кинетической энергии поступательного движения молекул не зависит от природы газа, а определяется только его температурой.
Так как Е = m*v 2 /2, то m*v 2 /2 = (3/2)kТ
откуда средняя квадратичная скорость молекул газа
Постоянная величина k называется постоянная Больцмана.
В СИ она имеет значение k = 1,38*10 -23 Дж/К
Если подставить значение Е в формулу p = 2/3*E*n , то получим p = 2/3*(3/2)kТ* n, сократив, получим p = n * k *Т
Давление газа не зависит от его природы, а определяется только концентрацией молекул n и температурой газа Т.
Соотношение p = 2/3*E*n устанавливает связь между микроскопическими (значения определяются с помощью расчетов) и макроскопическими (значения можно определить по показаниям приборов) параметрами газа, поэтому его принято называть основным уравнением молекулярно – кинетической теории газов .



