Rețea cristalină ionică. Tipuri de rețele cristaline
Citeste si
Majoritatea substantelor se caracterizeaza prin capacitatea, in functie de conditii, de a se afla in una din cele trei stari de agregare: solida, lichida sau gazoasa.
De exemplu, apa la presiune normală în intervalul de temperatură 0-100 o C este un lichid, la temperaturi peste 100 o C nu poate exista decât în stare gazoasă, iar la temperaturi sub 0 o C este un solid.
Substanțele în stare solidă disting între amorfe și cristaline.
O trăsătură caracteristică a substanțelor amorfe este absența unui punct de topire clar: fluiditatea lor crește treptat odată cu creșterea temperaturii. Substanțele amorfe includ compuși precum ceara, parafina, majoritatea materialelor plastice, sticla etc.
Cu toate acestea, substanțele cristaline au un punct de topire specific, adică. o substanță cu structură cristalină trece de la starea solidă la starea lichidă nu treptat, ci brusc, când se atinge o anumită temperatură. Exemple de substanțe cristaline includ sarea de masă, zahărul, gheața.
Diferența dintre proprietățile fizice ale solidelor amorfe și cristaline se datorează în primul rând caracteristicilor structurale ale acestor substanțe. Care este diferența dintre o substanță în stare amorfă și cea cristalină, cel mai ușor mod de a înțelege este din următoarea ilustrație:
După cum puteți vedea, într-o substanță amorfă, spre deosebire de una cristalină, nu există o ordine în aranjarea particulelor. Dacă, într-o substanță cristalină, se conectează mental doi atomi aproape unul de altul printr-o linie dreaptă, atunci se poate constata că aceleași particule se vor afla pe această linie la intervale strict definite:
Astfel, în cazul substanțelor cristaline, se poate vorbi de un astfel de concept ca o rețea cristalină.
rețea cristalină numit cadru spațial care leagă punctele spațiului în care există particule care formează un cristal.
Se numesc punctele din spațiu unde se află particulele care formează cristalul noduri de zăbrele .
În funcție de particulele care se află în nodurile rețelei cristaline, există: moleculară, atomică, ionică Și rețea cristalină metalică .
în noduri rețea cristalină moleculară
Rețeaua cristalină a gheții ca exemplu de rețea molecularăexistă molecule în care atomii sunt legați prin legături covalente puternice, dar moleculele înseși sunt ținute una lângă cealaltă de forțe intermoleculare slabe. Datorită unor astfel de interacțiuni intermoleculare slabe, cristalele cu o rețea moleculară sunt fragile. Astfel de substanțe diferă de substanțele cu alte tipuri de structură prin puncte de topire și de fierbere semnificativ mai mici, nu conduc. electricitate, se poate dizolva sau nu în diverși solvenți. Soluțiile unor astfel de compuși pot conduce sau nu electricitatea, în funcție de clasa compusului. Compușii cu o rețea cristalină moleculară includ multe substanțe simple - nemetale (H 2 întărit, O 2, Cl 2, sulf rombic S 8, fosfor alb P 4), precum și multe substanțe complexe - compuși cu hidrogen ai nemetalelor, acizi, oxizi ai nemetalelor, majoritatea materie organică. Trebuie remarcat faptul că, dacă substanța este în stare gazoasă sau lichidă, este nepotrivit să vorbim despre rețeaua cristalină moleculară: este mai corect să folosim termenul - tipul molecular de structură.
Rețeaua cristalină a diamantului ca exemplu de rețea atomicăîn noduri rețea cristalină atomică
sunt atomi. În acest caz, toate nodurile unei astfel de rețele cristaline sunt „reticulate” între ele prin intermediul unor legături covalente puternice într-un singur cristal. De fapt, un astfel de cristal este o moleculă gigantică. Datorită caracteristicilor structurale, toate substanțele cu o rețea cristalină atomică sunt solide, au puncte de topire ridicate, sunt inactive din punct de vedere chimic, insolubile în apă sau în solvenți organici, iar topiturile lor nu conduc curentul electric. Trebuie amintit că substanțele cu structură de tip atomic din substanțe simple includ bor B, carbon C (diamant și grafit), siliciu Si, din substanțe complexe - dioxid de siliciu SiO 2 (cuart), carbură de siliciu SiC, nitrură de bor BN.
Pentru substanţele cu rețea cristalină ionică
la locurile de rețea sunt ioni legați între ei prin legături ionice.
Deoarece legăturile ionice sunt suficient de puternice, substanțele cu o rețea ionică au o duritate și o refractare relativ ridicată. Cel mai adesea, sunt solubile în apă, iar soluțiile lor, precum topiturile, conduc electricitatea.
Substanțele cu rețea cristalină de tip ionic includ săruri de metal și amoniu (NH 4 +), baze, oxizi de metal. Un adevărat semn al structurii ionice a unei substanțe este prezența în compoziția sa a ambilor atomi ai unui metal tipic și a nemetalului.
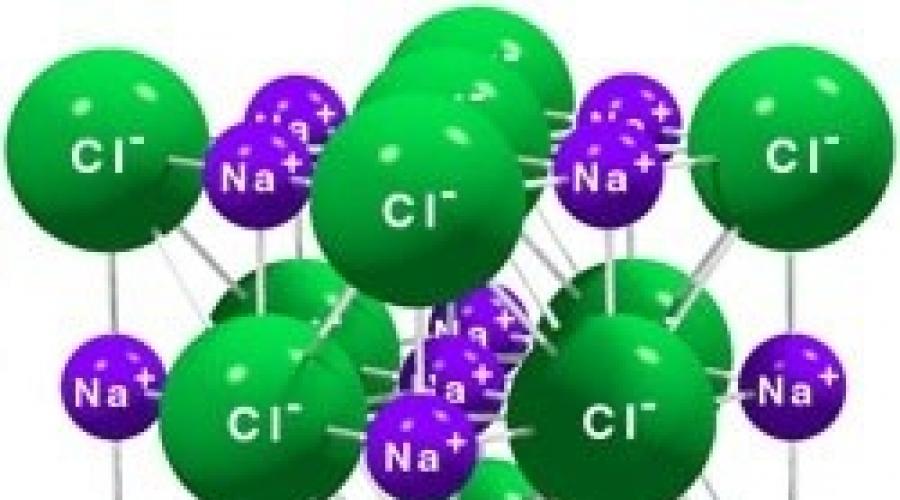
 Rețeaua cristalină a clorurii de sodiu ca exemplu de rețea ionică
Rețeaua cristalină a clorurii de sodiu ca exemplu de rețea ionică
observat în cristale de metale libere, de exemplu, sodiu Na, fier Fe, magneziu Mg etc. În cazul unei rețele cristaline metalice, la nodurile sale se află cationii și atomii de metal, între care se mișcă electronii. În acest caz, electronii în mișcare se atașează periodic de cationi, neutralizându-le astfel sarcina, iar atomii de metal neutri individuali „eliberează” în schimb o parte dintre electronii lor, transformându-se, la rândul lor, în cationi. De fapt, electronii „liberi” nu aparțin atomilor individuali, ci întregului cristal.
Astfel de caracteristici structurale duc la faptul că metalele conduc bine căldura și curentul electric, adesea au o ductilitate ridicată (ductilitate).
Difuzarea în valorile temperaturilor de topire a metalelor este foarte mare. Deci, de exemplu, punctul de topire al mercurului este de aproximativ minus 39 o C (lichid în conditii normale), și tungsten - 3422 °C. Trebuie remarcat faptul că, în condiții normale, toate metalele, cu excepția mercurului, sunt solide.
O substanță, după cum știți, poate exista în trei stări de agregare: gazoasă, lichidă și solidă (Fig. 70). De exemplu, oxigenul, care în condiții normale este un gaz, la o temperatură de -194 ° C se transformă într-un lichid culoarea albastra, iar la o temperatură de -218,8 ° C se întărește într-o masă asemănătoare zăpezii, constând din cristale albastre.
Orez. 70.
Stari agregate ale apei
Solidele sunt împărțite în cristaline și amorfe.
Substanțele amorfe nu au un punct de topire clar - atunci când sunt încălzite, se înmoaie treptat și devin fluide. Substanțele amorfe includ majoritatea materialelor plastice (de exemplu, polietilena), ceară, ciocolată, plastilină, diverse rășini și gume de mestecat (Fig. 71).

Orez. 71.
Substanțe și materiale amorfe
Sunt caracterizate substanțele cristaline locația corectă particulele lor constitutive în puncte strict definite din spațiu. Când aceste puncte sunt conectate prin linii drepte, se formează un cadru spațial, numit rețea cristalină. Punctele în care sunt localizate particulele de cristal se numesc noduri de rețea.
La nodurile unei rețele cristaline imaginare pot exista ioni monoatomici, atomi, molecule. Aceste particule oscilează. Odată cu creșterea temperaturii, intervalul acestor oscilații crește, ceea ce, de regulă, duce la dilatarea termică a corpurilor.
În funcție de tipul de particule situate la nodurile rețelei cristaline și de natura conexiunii dintre acestea, se disting patru tipuri de rețele cristaline: ionice, atomice, moleculare și metalice (Tabelul 6).
Tabelul 6
Poziția elementelor în sistemul periodic al lui D. I. Mendeleev și tipurile de rețele cristaline ale substanțelor lor simple

Substanțele simple formate din elemente care nu sunt enumerate în tabel au o rețea metalică.
Se numesc rețele cristaline ionice, în nodurile cărora se află ioni. Sunt formate din substanțe cu legătură ionică, care pot fi asociate atât cu ionii simpli Na +, Cl -, cât și cu cei complecși, OH -. În consecință, rețelele cristaline ionice au săruri, baze (alcaline), unii oxizi. De exemplu, un cristal de clorură de sodiu este construit din ioni pozitivi alternativi de Na + și negativi Cl -, formând o rețea în formă de cub (Fig. 72). Legăturile dintre ionii dintr-un astfel de cristal sunt foarte puternice. Prin urmare, substanțele cu o rețea ionică au o duritate și o rezistență relativ ridicată, sunt refractare și nevolatile.

Orez. 72.
Rețea cristalină ionică (clorură de sodiu)
Rețelele atomice se numesc rețele cristaline, în nodurile cărora se află atomi individuali. În astfel de rețele, atomii sunt interconectați prin legături covalente foarte puternice.

Orez. 73.
Rețea cristalină atomică (diamant)
Acest tip de rețea cristalină are un diamant (Fig. 73) - una dintre modificările alotropice ale carbonului. Diamantele tăiate și lustruite sunt numite strălucitoare. Sunt utilizate pe scară largă în bijuterii (Fig. 74).

Orez. 74.
Două coroane imperiale cu diamante:
a - coroana Imperiului Britanic; b - Marea Coroană Imperială a Imperiului Rus
Substanțele cu o rețea cristalină atomică includ bor cristalin, siliciu și germaniu, precum și substanțe complexe, cum ar fi silice, cuarț, nisip, cristal de rocă, care includ oxid de siliciu (IV) SiO 2 (Fig. 75).

Orez. 75.
Rețea cristalină atomică (oxid de siliciu (IV))
Majoritatea substanțelor cu rețea cristalină atomică au puncte de topire foarte mari (de exemplu, pentru diamant este peste 3500 ° C, pentru siliciu - 1415 ° C, pentru silice - 1728 ° C), sunt puternice și dure, practic insolubile.
Rețelele moleculare sunt numite rețele cristaline, la nodurile cărora se află moleculele. Legăturile chimice din aceste molecule pot fi atât polare covalente (acid clorhidric HCl, apă H 2 0), cât și nepolare covalente (azot N 2, ozon 0 3). În ciuda faptului că atomii din molecule sunt legați de legături covalente foarte puternice, există forțe slabe de atracție intermoleculară între molecule înseși. Prin urmare, substanțele cu rețele de cristal moleculare au duritate scăzută, puncte de topire scăzute și sunt volatile.
Exemple de substanțe cu rețele cristaline moleculare sunt apă solidă - gheață, monoxid de carbon solid (IV) C) 2 - „gheață carbonică” (Fig. 76), acid clorhidric solid HCl și hidrogen sulfurat H 2 S, substanțe simple simple formate una- (gaze nobile: heliu, neon, argon, cripton, hidrogen C2-, azot, clorură de hidrogen C2-oxi, clorură de hidrogen C2-), N2, iod 1 2), molecule trei (ozon O 3), patru (fosfor alb P 4), opt atomice (sulf S 7). Majoritatea compușilor organici solizi au rețele moleculare cristaline (naftalină, glucoză, zahăr).

Orez. 76.
Rețea cristalină moleculară ( dioxid de carbon)
Substanțele cu o legătură metalică au rețele cristaline metalice (Fig. 77). La nodurile unor astfel de rețele sunt atomi și ioni (fie atomi, fie ioni, în care atomii de metal se transformă ușor, dându-și electronii exteriori pentru uz comun). Astfel de structura interna metalele determină caracteristica lor proprietăți fizice: maleabilitate, plasticitate, conductivitate electrică și termică, luciu metalic.

Orez. 77.
Rețea cristalină metalică (fier)
Experimentul de laborator nr. 13
Cunoașterea colecției de substanțe cu diferite tipuri de rețele cristaline. Realizarea modelelor de rețele cristaline
- Examinați colecția de mostre de substanțe care vi se oferă. Notează-le formulele, caracterizează proprietățile fizice și, pe baza lor, determină tipul rețelei cristaline.
Asamblați un model al uneia dintre rețelele cristaline.
Pentru substanţele cu structură moleculară este valabilă legea constanţei compoziţiei descoperită de chimistul francez J. L. Proust (1799-1803). Această lege este formulată în prezent după cum urmează:
Legea lui Proust este una dintre legile fundamentale ale chimiei. Cu toate acestea, pentru substanțele cu o structură nemoleculară, de exemplu, ionică, această lege nu este întotdeauna adevărată.
Cuvinte cheie și expresii
- Starile solide, lichide si gazoase ale materiei.
- Solide: amorfe și cristaline.
- Rețele cristaline: ionice, atomice, moleculare și metalice.
- Proprietățile fizice ale substanțelor cu tipuri variate rețele cristaline.
- Legea constanței compoziției.
Lucrați cu computerul
- Consultați aplicația electronică. Studiați materialul lecției și finalizați sarcinile propuse.
- Căutați pe Internet adrese de e-mail care pot servi ca surse suplimentare care dezvăluie conținutul cuvintelor cheie și frazelor din paragraf. Oferă profesorului ajutorul tău în pregătirea unei noi lecții - întocmește un raport asupra cuvintelor și expresiilor cheie din următorul paragraf.
Întrebări și sarcini
- În ce stare de agregare va fi oxigenul la -205 ° C?
- Amintiți-vă de lucrarea lui A. Belyaev „Vânzătorul de aer” și caracterizați proprietățile oxigenului solid folosind descrierea acestuia dată în carte.
- Ce tip de substanță (cristalină sau amorfă) sunt plasticele? Ce proprietăți ale materialelor plastice stau la baza aplicațiilor lor industriale?
- Ce tip de rețea cristalină de diamant este? Enumerați proprietățile fizice ale unui diamant.
- Ce tip de rețea cristalină este iodul? Enumerați proprietățile fizice ale iodului.
- De ce punctul de topire al metalelor variază într-un interval foarte larg? Pentru a pregăti un răspuns la această întrebare, folosiți literatură suplimentară.
- De ce un produs din siliciu se rupe în bucăți la impact, în timp ce un produs din plumb doar se aplatizează? În care dintre aceste cazuri are loc distrugerea unei legături chimice și în care nu? De ce?
Majoritatea solidelor sunt cristaline. Celulă de cristal este construit din unități structurale identice repetate, individuale pentru fiecare cristal. Această unitate structurală se numește „celula elementară”. Cu alte cuvinte, rețeaua cristalină servește ca o reflectare a structurii spațiale a unui solid.
Rețelele cristaline pot fi clasificate în diferite moduri.
eu. După simetria cristalelor rețelele sunt clasificate în cubic, tetragonal, rombic, hexagonal.
Această clasificare este convenabilă pentru estimarea proprietăților optice ale cristalelor, precum și a activității lor catalitice.
II. După natura particulelor situate la nodurile de rețea și după tipul de legătură chimică distinge între ele rețele cristaline atomice, moleculare, ionice și metalice. Tipul de legătură dintr-un cristal determină diferența de duritate, solubilitatea în apă, mărimea căldurii de dizolvare și a căldurii de fuziune și conductivitatea electrică.
O caracteristică importantă cristalul este energia rețelei cristaline, kJ/mol – energia necesară pentru a distruge un anumit cristal.
rețea moleculară
cristale moleculare constau din molecule menținute în anumite poziții ale rețelei cristaline prin legături intermoleculare slabe (forțe van der Waals) sau legături de hidrogen. Aceste rețele sunt caracteristice substanțelor cu legături covalente.
Există o mulțime de substanțe cu o rețea moleculară. Acestea sunt un număr mare de compuși organici (zahăr, naftalină etc.), apă cristalină (gheață), dioxid de carbon solid („gheață uscată”), halogenuri de hidrogen solide, iod, gaze solide, inclusiv cele nobile,
Energia minimă a rețelei cristaline pentru substanțe cu molecule nepolare și cu polaritate scăzută (CH 4, CO 2 etc.).
Rețelele formate din mai multe molecule polare au, de asemenea, o energie mai mare a rețelei cristaline. Rețelele cu substanțe care formează legături de hidrogen (H 2 O, NH 3) au cea mai mare energie.
Datorită interacțiunii slabe dintre molecule, aceste substanțe sunt volatile, fuzibile, au duritate scăzută, nu conduc curentul electric (dielectrici) și au conductivitate termică scăzută.
rețea atomică
în noduri rețea cristalină atomică există atomi ai unuia sau mai multor elemente legați prin legături covalente de-a lungul tuturor celor trei axe. Astfel de cristale, care se mai numesc covalent sunt relativ putine.
Exemple de cristale de acest tip sunt diamantul, siliciul, germaniul, staniul, precum și cristalele de substanțe complexe precum nitrura de bor, nitrura de aluminiu, cuarțul, carbura de siliciu. Toate aceste substanțe au o rețea asemănătoare unui diamant.
Energia rețelei cristaline din astfel de substanțe coincide practic cu energia legăturii chimice (200 - 500 kJ/mol). Acest lucru determină și proprietățile lor fizice: duritate ridicată, punctul de topire și punctul de fierbere.
Proprietățile conductoare electric ale acestor cristale sunt variate: diamantul, cuarțul, nitrura de bor sunt dielectrice; siliciu, germaniu - semiconductori; staniul gri metalic conduce bine electricitatea.
În cristalele cu o rețea cristalină atomică, este imposibil să se evidențieze o unitate structurală separată. Întregul singur cristal este o moleculă gigantică.
Rețea ionică
în noduri rețea ionică alternează ionii pozitivi și negativi, între care acționează forțele electrostatice. Cristalele ionice formează compuşi cu legături ionice, de exemplu, clorură de sodiu NaCI, fluorură de potasiu şi KF, etc. Compuşii ionici pot include, de asemenea, ioni complecşi, de exemplu, NO3-, SO42-.
Cristalele ionice sunt, de asemenea, o moleculă gigantică în care fiecare ion este puternic afectat de toți ceilalți ioni.
Energia rețelei cristaline ionice poate atinge valori semnificative. Deci, E (NaCl) \u003d 770 kJ / mol și E (BeO) \u003d 4530 kJ / mol.
Cristalele ionice au puncte de topire și de fierbere ridicate și rezistență ridicată, dar sunt fragile. Multe dintre ele sunt conducătoare slabe de electricitate. temperatura camerei(cu aproximativ douăzeci de ordine de mărime mai mică decât cea a metalelor), dar odată cu creșterea temperaturii se observă o creștere a conductibilității electrice.
grătar metalic
cristale metalice dați exemple ale celor mai simple structuri cristaline.
Ionii metalici din rețeaua unui cristal metalic pot fi considerați aproximativ ca sfere. În metalele solide, aceste bile sunt împachetate cu densitatea maximă, așa cum indică densitatea semnificativă a majorității metalelor (de la 0,97 g/cm3 pentru sodiu, 8,92 g/cm3 pentru cupru, până la 19,30 g/cm3 pentru wolfram și aur). Cel mai dens pachet de bile dintr-un strat este împachetarea hexagonală, în care fiecare bilă este înconjurată de alte șase bile (în același plan). Centrele oricăror trei bile adiacente formează un triunghi echilateral.
Asemenea proprietăți ale metalelor precum ductilitatea ridicată și ductilitatea indică absența rigidității în rețelele metalice: planurile lor se deplasează destul de ușor unul față de celălalt.
Electronii de valență participă la formarea legăturilor cu toți atomii, se mișcă liber în întregul volum al unei bucăți de metal. Acest lucru este indicat de valorile ridicate ale conductibilității electrice și ale conductibilității termice.
Conform energiei rețelei cristaline, metalele ocupă o poziție intermediară între cristalele moleculare și cele covalente. Energia rețelei cristaline este:
Astfel, proprietățile fizice ale solidelor depind în mod esențial de tipul de legătură chimică și de structura.
Structura și proprietățile solidelor
| Caracteristici | cristale | |||
| metal | ionic | Molecular | Nuclear | |
| Exemple | K, Al, Cr, Fe | NaCI, KNO3 | I 2, naftalină | diamant, cuarț |
| Particule structurale | Ioni pozitivi și electroni mobili | Cationi și anioni | molecule | atomi |
| Tipul de legătură chimică | metal | ionic | În molecule - covalent; între molecule – forțele van der Waals și legăturile de hidrogen | Între atomi - covalent |
| temperatură de topire | înalt | înalt | scăzut | Foarte inalt |
| Punct de fierbere | înalt | înalt | scăzut | Foarte inalt |
| Proprietăți mecanice | Dur, maleabil, maleabil | tare, casant | Moale | Foarte greu |
| Conductivitate electrică | Buni conductori | În formă solidă - dielectrice; în topitură sau soluţie - conductoare | Dielectrice | Dielectrici (cu excepția grafitului) |
| Solubilitate | ||||
| in apa | insolubil | Solubil | insolubil | insolubil |
| în solvenţi nepolari | insolubil | insolubil | Solubil | insolubil |
(Toate definițiile, formulele, graficele și ecuațiile reacțiilor sunt date sub înregistrare.)
Subiecte ale codificatorului USE: Substanțe cu structură moleculară și nemoleculară. Tip de rețea cristalină. Dependența proprietăților substanțelor de compoziția și structura lor.
Teoria cinetică moleculară
Toate moleculele sunt formate din cele mai mici particule- atomi. Toți atomii descoperiți în prezent sunt colectați în tabelul periodic.
Atom este cea mai mică particulă indivizibilă din punct de vedere chimic a unei substanțe care o reține Proprietăți chimice. Atomii se conectează între ei legături chimice. Am luat în considerare anterior a. Asigurați-vă că studiați teoria pe tema: Tipuri de legături chimice, înainte de a studia acest articol!
Acum să ne uităm la modul în care particulele se pot combina în materie.
În funcție de locația particulelor unele față de altele, proprietățile substanțelor pe care le formează pot varia foarte mult. Deci, dacă particulele sunt situate unele față de altele departe(distanța dintre particule este mult mai mare decât dimensiunea particulelor în sine), practic nu interacționează între ele, se mișcă aleatoriu și continuu în spațiu, atunci avem de-a face cu gaz .
Dacă particulele sunt localizate închide unul altuia, dar haotic, Mai mult interacționează între ele, faceți mișcări oscilatorii intense într-o poziție, dar puteți sări într-o altă poziție, atunci acesta este un model al structurii lichide .
Dacă particulele sunt localizate închide unul la altul, dar mai mult ordonat, Și interacționează mai multîntre ele, dar se deplasează doar într-o poziție de echilibru, practic fără a se deplasa în alta poziție, avem de-a face solid .

Cele mai cunoscute substanțe chimice și amestecuri pot exista în stare solidă, lichidă și gazoasă. Cel mai simplu exemplu este apă. La conditii normale ea lichid, la 0 o C îngheață - trece din stare lichidă în solid, iar la 100 ° C fierbe - intră fază gazoasă- vapor de apă. În același timp, multe substanțe în condiții normale sunt gaze, lichide sau solide. De exemplu, aerul, un amestec de azot și oxigen, este un gaz în condiții normale. Dar la presiune ridicata iar temperatura scăzută, azotul și oxigenul se condensează și trec în faza lichidă. Azotul lichid este utilizat activ în industrie. Uneori izolat plasmă, și cristale lichide, ca faze separate.

Multe proprietăți ale substanțelor și amestecurilor individuale sunt explicate prin aranjament reciproc particulele din spațiu unele față de altele!
Acest articol ia în considerare proprietățile solidelor, în funcție de structura lor. Proprietățile fizice de bază ale solidelor: punct de topire, conductivitate electrică, conductivitate termică, rezistență mecanică, plasticitate etc.
Temperatură de topire este temperatura la care o substanță trece din solid în lichid și invers.

este capacitatea unei substanțe de a se deforma fără a se rupe.

Conductivitate electrică este capacitatea unei substanțe de a conduce curentul.
Curentul este mișcarea ordonată a particulelor încărcate. Astfel, curentul poate fi condus doar de substanțele în care există mișcarea particulelor încărcate. În funcție de capacitatea de a conduce curentul, substanțele sunt împărțite în conductori și dielectrici. Conductorii sunt substanțe care pot conduce curentul (adică conțin particule mobile încărcate). Dielectricii sunt substanțe care practic nu conduc curentul.

Într-un solid, particulele unei substanțe pot fi localizate haotic, sau mai ordonat O. Dacă particulele unui solid sunt situate în spațiu haotic, substanța se numește amorf. Exemple de substanțe amorfe - carbune, sticla mica.

Dacă particulele unui solid sunt aranjate în spațiu într-o manieră ordonată, i.e. formează structuri geometrice tridimensionale repetate, se numește o astfel de substanță cristal, și structura în sine rețea cristalină . Majoritatea substanțelor cunoscute de noi sunt cristale. Particulele în sine sunt localizate în noduri rețea cristalină.
Substanțele cristaline se disting, în special, prin tip de legătură chimică între particule într-un cristal - atomic, molecular, metalic, ionic; după forma geometrică a celei mai simple celule a rețelei cristaline - cubică, hexagonală etc.
Depinzând de tip de particule care formează o rețea cristalină , distinge structură cristalină atomică, moleculară, ionică și metalică .
Rețea cristalină atomică

O rețea cristalină atomică se formează atunci când există atomi. Atomii sunt legați între ei legături chimice covalente. În consecință, o astfel de rețea cristalină va fi foarte durabil, nu este ușor să-l distrugi. O rețea cristalină atomică poate fi formată din atomi cu o valență mare, adică cu un număr mare de legături cu atomi vecini (4 sau mai mulți). De regulă, acestea sunt nemetale: substanțe simple - siliciu, bor, carbon (modificări alotropice ale diamantului, grafitului) și compușii acestora (borocarbon, oxid de siliciu (IV) etc..). Deoarece între nemetale are loc o legătură chimică predominant covalentă, electroni liberi(precum și alte particule încărcate) în substanțe cu o rețea cristalină atomică în cele mai multe cazuri nu. Prin urmare, aceste substanțe sunt de obicei conduc electricitatea foarte slab, adică sunt dielectrici. Acestea sunt modele generale, dintre care există o serie de excepții.

Comunicarea între particule în cristale atomice: .
La nodurile cristalului cu structura cristalina atomica dispusa atomi.
Stare de fază cristale atomice în condiții normale: de regulă, solide.
Substanțe, care formează cristale atomice în stare solidă:
- Substanțe simple valență ridicată (situat în mijlocul tabelului periodic): bor, carbon, siliciu etc.
- Substanțe complexe formate din aceste nemetale: silice (oxid de siliciu, nisip de cuarț) SiO2; carbură de siliciu (corindon) SiC; carbură de bor, nitrură de bor etc.
Proprietățile fizice ale substanțelor cu o rețea cristalină atomică:
— putere;
- refractaritate (punct de topire ridicat);
- conductivitate electrică scăzută;
- conductivitate termică scăzută;
— inerție chimică (substanțe inactive);
- insolubilitate în solvenți.

Rețea cristalină moleculară este o rețea ale cărei noduri sunt molecule. ține moleculele în cristal forțe slabe de atracție intermoleculară (forțele van der Waals, legături de hidrogen sau atracție electrostatică). În consecință, o astfel de rețea cristalină, de regulă, destul de usor de distrus. Substanțe cu o rețea cristalină moleculară - fragil, fragil. Cu cât este mai mare forța de atracție între molecule, cu atât este mai mare punctul de topire al substanței. De regulă, punctele de topire ale substanțelor cu o rețea cristalină moleculară nu sunt mai mari de 200-300K. Prin urmare, în condiții normale, majoritatea substanțelor cu o rețea cristalină moleculară există sub formă gaze sau lichide. Rețeaua cristalină moleculară, de regulă, este formată în formă solidă din acizi, oxizi ai nemetalelor, alți compuși binari ai nemetalelor, substanțe simple care formează molecule stabile (oxigen O 2, azot N 2, apă H 2 O etc.), substanțe organice. De regulă, acestea sunt substanțe cu o legătură polară covalentă (rar nepolară). Deoarece electronii sunt implicați în legături chimice, substanțe cu o rețea cristalină moleculară - dielectrici, conductoare slabe de căldură.

Comunicarea între particule în cristale moleculare: m forțe de atracție intermoleculare, electrostatice sau intermoleculare.
La nodurile cristalului cu structura cristalina moleculara dispusa molecule.
Stare de fază cristale moleculare în condiții normale: gaze, lichide și solide.
Substanțe, formându-se în stare solidă cristale moleculare:
- Substanțe simple nemetalice care formează molecule mici și puternice (O2, N2, H2, S8 etc.);
- Substanțe complexe (compuși ai nemetalelor) cu legături polare covalente (cu excepția oxizilor de siliciu și bor, compuși de siliciu și carbon) - apă H 2 O, oxid de sulf SO 3 etc.
- Gaze rare monoatomice (heliu, neon, argon, cripton si etc.);
- Majoritatea substanțelor organice care nu au legături ionice — metan CH4, benzen C6H6 etc.
Proprietăți fizice substanțe cu o rețea cristalină moleculară:
- fuzibilitate (punct de topire scăzut):
— compresibilitate ridicată;
- cristalele moleculare în formă solidă, precum și în soluții și topituri, nu conduc curentul;
- stare de fază în condiții normale - gaze, lichide, solide;
— volatilitate ridicată;
- duritate scăzută.
Rețea cristalină ionică

Dacă există particule încărcate la nodurile cristalului - ionii, putem vorbi despre rețea cristalină ionică . De regulă, cu cristale ionice alternează ionii pozitivi(cationi) și ioni negativi(anioni), astfel încât particulele din cristal sunt reținute forțele de atracție electrostatică . În funcție de tipul de cristal și de tipul de ioni care formează cristalul, astfel de substanțe pot fi destul de puternic și dur. În stare solidă, nu există, de regulă, particule încărcate mobile în cristalele ionice. Dar când cristalul este dizolvat sau topit, ionii sunt eliberați și se pot deplasa sub acțiunea unui câmp electric extern. Acestea. conduce curentul numai solutii sau topituri cristale ionice. Rețeaua cristalină ionică este caracteristică substanțelor cu legătură chimică ionică. Exemple asemenea substanțe sare NaCl carbonat de calciu- CaCO 3 etc. Rețeaua cristalină ionică, de regulă, se formează în fază solidă săruri, baze, precum și oxizi metalici și compuși binari ai metalelor și nemetalelor.

Comunicarea între particule în cristale ionice: .
La nodurile cristalului cu o rețea ionică ionii.
Stare de fază cristale ionice în condiţii normale: de obicei solide.
Substanțe chimice cu o rețea cristalină ionică:
- Săruri (organice și anorganice), inclusiv săruri de amoniu (De exemplu, Clorură de amoniu NH4CI);
- motive;
- oxizi metalici;
- Compuși binari care conțin metale și nemetale.
Proprietățile fizice ale substanțelor cu structură cristalină ionică:
- punct de topire ridicat (refractar);
- solutii si topituri de cristale ionice - conductori de curent;
- majoritatea compușilor sunt solubili în solvenți polari (apă);
- stare în fază solidă în majoritatea compuşilor în condiţii normale.

Și, în sfârșit, metalele sunt caracterizate de un tip special de structură spațială - rețea cristalină metalică, care se datorează legătură chimică metalică . Atomii de metal rețin electronii de valență destul de slab. Într-un cristal format dintr-un metal, următoarele procese au loc simultan: unii atomi donează electroni și devin ioni încărcați pozitiv; aceste electronii se mișcă aleatoriu în cristal; unii dintre electroni sunt atrași de ioni. Aceste procese au loc simultan și aleatoriu. Prin urmare, apar ioni , ca în formarea unei legături ionice, și se formează electroni comuni ca la formarea unei legături covalente. Electronii liberi se mișcă aleatoriu și continuu pe tot volumul cristalului, ca un gaz. Prin urmare, uneori sunt numite gaz de electroni ". Datorită prezenței un numar mare particule mobile încărcate metale conduc electricitatea, căldura. Punctul de topire al metalelor variază foarte mult. Metalele sunt de asemenea caracterizate luciu metalic deosebit, maleabilitate, adică capacitatea de a-și schimba forma fără distrugere în condiții mecanice puternice, tk. legăturile chimice nu sunt rupte.

Comunicarea între particule : .
La nodurile cristalului cu gratar metalic ioni și atomi de metal.
Stare de fază metale în condiții normale: de obicei solide(excepție - mercur, lichid în condiții normale).
Substanțe chimice cu o rețea cristalină metalică - substanțe simple – metale.
Proprietățile fizice ale substanțelor cu o rețea cristalină metalică:
– conductivitate termică și electrică ridicată;
- maleabilitatea si plasticitatea;
- luciu metalic;
— metalele sunt în general insolubile în solvenți;
Majoritatea metalelor sunt solide în condiții normale.
Compararea proprietăților substanțelor cu diferite rețele cristaline
Tipul de rețea cristalină (sau absența rețelei cristaline) face posibilă evaluarea proprietăților fizice de bază ale unei substanțe. Pentru o comparație aproximativă a proprietăților fizice tipice ale compușilor cu diferite rețele cristaline, este foarte convenabil să se utilizeze substanțe chimice cu proprietăți caracteristice . Pentru o rețea moleculară, de exemplu, dioxid de carbon, pentru rețeaua cristalină atomică - diamant, pentru metal - cupru, iar pentru rețeaua cristalină ionică - sare, clorura de sodiu NaCl.

Tabel rezumativ privind structurile substanțelor simple formate elemente chimice din subgrupele principale ale tabelului periodic (elementele subgrupurilor secundare sunt metale, prin urmare, au o rețea cristalină metalică).

Tabelul final al relației dintre proprietățile substanțelor cu structura:

Structura materiei.
Nu atomii sau moleculele individuali intră în interacțiuni chimice, ci substanțele.
Sarcina noastră este să ne familiarizăm cu structura materiei.
La temperaturi scăzute pentru substanţe în stare solidă stabilă.
☼ Cea mai dură substanță din natură este diamantul. Este considerat regele tuturor pietrelor prețioase și pietre pretioase. Și chiar numele său înseamnă în greacă „indestructibil”. Diamantele au fost de multă vreme considerate pietre miraculoase. Se credea că o persoană care poartă diamante nu cunoaște bolile de stomac, otrava nu-l afectează, își păstrează memoria și starea de spirit veselă până la bătrânețe, se bucură de favoarea regală.
☼ Un diamant supus prelucrarii de bijuterii – taiere, lustruire, se numeste diamant.
În timpul topirii, ca urmare a vibrațiilor termice, ordinea particulelor este încălcată, acestea devin mobile, în timp ce natura legăturii chimice nu este încălcată. Astfel, nu există diferențe fundamentale între starea solidă și starea lichidă.
Fluiditatea apare în lichid (adică capacitatea de a lua forma unui vas).
cristale lichide.
Cristalele lichide sunt deschise înăuntru sfârşitul XIX-lea secol, dar studiat în ultimii 20-25 de ani. Multe dispozitive de afișare tehnologie moderna, de exemplu unii Ceas digital, minicalculatoare, rulează pe cristale lichide.
În general, cuvintele „cristale lichide” nu sună mai puțin neobișnuit decât „gheață fierbinte”. Cu toate acestea, de fapt, gheața poate fi și fierbinte, deoarece. la presiuni de peste 10.000 atm. Gheața de apă se topește la temperaturi peste 2000 C. Combinația neobișnuită de „cristale lichide” este că starea lichidă indică mobilitatea structurii, iar cristalul își asumă o ordine strictă.
Dacă o substanță constă din molecule poliatomice de formă alungită sau lamelară și având o structură asimetrică, atunci atunci când se topește, aceste molecule sunt orientate într-un anumit fel unele față de altele (axele lor lungi sunt paralele). În acest caz, moleculele se pot mișca liber paralel cu ele însele, adică. sistemul capătă fluiditatea caracteristică unui lichid. În același timp, sistemul păstrează o structură ordonată care determină proprietățile caracteristice cristalelor.
Mobilitatea ridicată a unei astfel de structuri face posibilă controlul acesteia prin influențe foarte slabe (termice, electrice etc.), adică. schimba intenționat proprietățile unei substanțe, inclusiv cele optice, cu foarte puțină energie, care este folosită în tehnologia modernă.
Tipuri de rețele cristaline.
Orice substanță chimică este formată dintr-un număr mare de particule identice care sunt interconectate.
La temperaturi scăzute, când mișcarea termică este împiedicată, particulele sunt strict orientate în spațiu și formează o rețea cristalină.
Celulă de cristal este o structură cu o aranjare geometrică corectă a particulelor în spațiu.
În rețeaua cristalină în sine se disting nodurile și spațiul internodal.
Aceeași substanță, în funcție de condiții (p, t, ...) există în diferite forme cristaline (adică au rețele cristaline diferite) - modificări alotrope care diferă în proprietăți.
De exemplu, sunt cunoscute patru modificări ale carbonului - grafit, diamant, carbyne și lonsdaleit.
☼ A patra varietate de carbon cristalin „lonsdaleit” este puțin cunoscută. A fost găsit în meteoriți și obținut artificial, iar structura sa este încă în studiu.
☼ Funingine, cola, cărbune atribuite polimerilor amorfi ai carbonului. Cu toate acestea, acum a devenit cunoscut faptul că acestea sunt și substanțe cristaline.
☼ Apropo, în funingine s-au găsit particule negre strălucitoare, pe care le-au numit „carbon oglindă”. Carbonul oglindă este inert chimic, rezistent la căldură, impermeabil la gaze și lichide, are o suprafață netedă și compatibilitate absolută cu țesuturile vii.
☼ Numele de grafit vine de la italianul „graffito” – scriu, desenez. Grafitul este un cristal gri-închis cu o ușoară strălucire metalică, are o rețea stratificată. Straturi separate de atomi dintr-un cristal de grafit, relativ slab legate între ele, sunt ușor separate unele de altele.
TIPURI DE REȚELE CRISTALICE



Proprietățile substanțelor cu diferite rețele cristaline (tabel)
Dacă rata de creștere a cristalelor este scăzută la răcire, se formează o stare sticloasă (amorfă).
Relația dintre poziția unui element în sistemul periodic și rețeaua cristalină a substanței sale simple.
Între poziția elementului în sistem periodic iar rețeaua cristalină a substanței sale simple corespunzătoare există o relație strânsă.

Substanțele simple ale elementelor rămase au o rețea cristalină metalică.
FIXARE
Studiați materialul de curs, răspundeți în scris la următoarele întrebări în caiet:
- Ce este o rețea cristalină?
- Ce tipuri de rețele cristaline există?
- Descrieți fiecare tip de rețea cristalină conform planului:
Ce este în nodurile rețelei cristaline, unitate structurală → Tipul de legătură chimică dintre particulele nodului → Forțele de interacțiune dintre particulele cristalului → Proprietăți fizice datorate rețelei cristaline → Starea de agregare substanțe în condiții normale → Exemple
Finalizați sarcinile pe acest subiect:
- Ce tip de rețea cristalină au următoarele substanțe utilizate pe scară largă în viața de zi cu zi: apă, acid acetic(CH3 COOH), zahăr (C12 H22 O11), îngrășământ cu potasiu (KCl), nisip de râu (SiO2) - punct de topire 1710 0C, amoniac (NH3), sare de masă? Faceți o concluzie generalizată: ce proprietăți ale unei substanțe pot determina tipul rețelei sale cristaline?
După formulele substanțelor date: SiC, CS2, NaBr, C2 H2 - determinați tipul de rețea cristalină (ionică, moleculară) a fiecărui compus și, pe baza acestuia, descrieți proprietățile fizice ale fiecăreia dintre cele patru substanțe.
Antrenorul numărul 1. „Grele de cristal”
Antrenorul numărul 2. „Sarcini de testare”
Test (autocontrol):
1) Substanțe care au o rețea cristalină moleculară, de regulă:
A). refractar și foarte solubil în apă
b). fuzibil și volatil
V). Solid și conductiv electric
G). Conductiv termic și plastic
2) Conceptul de „moleculă” nu este aplicabil în raport cu unitatea structurală a unei substanțe:
b). oxigen
V). diamant
3) Rețeaua cristalină atomică este caracteristică pentru:
A). aluminiu și grafit
b). sulf și iod
V). oxid de siliciu și clorură de sodiu
G). diamant și bor
4) Dacă o substanță este foarte solubilă în apă, are un punct de topire ridicat, este conductivă electric, atunci rețeaua sa cristalină:
A). molecular
b). nuclear
V). ionic
G). metalic