Функция белков обеспечивается актином миозином. Молекулярные механизмы мышечного сокращения
Читайте также
БИОХИМИЯ СПОРТА
Структура и функции мышечного волокна
Существуют 3 вида мышечной ткани :
Поперечно-полосатая скелетная;
Поперечно-полосатая сердечная;
Гладкая.
Функции мышечной ткани.
Поперечно-полосатая скелетная ткань - составляет примерно 40 % общей массы тела.
Ее функции:
динамическая;
статическая;
рецепторная (например, проприорецепторы в сухожилиях - интрафузальные мышечные волокна (веретеновидные));
депонирующая - вода, минеральные вещества, кислород, гликоген, фосфаты;
терморегуляция;
эмоциональные реакции.
Поперечно-полосатая сердечная мышечная ткань.
Основная функция - нагнетательная.
Гладкая мускулатура - образует стенку полых органов и сосудов.
Ее функции: -поддерживает давление в полых органах; -поддерживает величину кровяного давления;
Обеспечивает продвижение содержимого по желудочнокишечному тракту, мочеточникам.
Химический состав мышечной ткани
Химический состав мышечной ткани очень сложен и изменяется под влиянием различных факторов. Средний химический состав хорошо отпрепарированной мышечной ткани составляет: воды - 70-75 % от массы ткани; белков - 18-22 %; липидов - 0,5-3,5 %; азотистых экстрактивных веществ - 1,0-1,7 %; безазотистых экстрактивных веществ - 0,7-1,4 %; минеральных веществ - 1,0-1,5 %.
Около 80 % сухого остатка мышечной ткани составляют белки, свойства которых в значительной степени определяют свойства этой ткани.
МИОФИБРИЛЛЫ – сократительные элементы мышечного волокна. Тонкая структура миофибрилл
Миофибриллы - это тонкие волокна (диаметр их 1-2 мкм. длина 2-2.5 мкм), содержащие 2 вида сократительных белков (протофибрилл): тонкие нити актина и вдвое более толстые нити миозина. Они расположены таким образом, что вокруг миозиновых нитей находится 6 актиновых нитей, в вокруг каждой актиновой - 3 миозиновых. Миофибриллы разделены Z-мембранами на отдельные участки - саркомеры, в средней части которых расположены преимущественно миозиновые нити, аактиновые нити прикреплены к Z-мембранам по бокам саркомера. (Разная способность актина и миозина преломлять свет создает в состоянии покоя мышцы ее поперечно-полосатый вид в световом микроскопе).
Нити актина составляют около 20% сухого веса миофибрилл. Актин состоит из двух форм белка: 1) глобулярной формы - в виде сферических молекул и 2) палочковидных молекул трономиозина, скрученных в виде двунитчатых спиралей в длинную цепь. На протяжении этой двойной актиновой нити каждый виток содержит по 14 молекул глобулярного актина (по 7 молекул с обеих сторон), наподобие нитки с бусинками, а также центры связывания ионов Са2+. В этих центрах содержится особый белок (тропонин), участвующий в образовании связи актина с миозином.
Миозин составлен из уложенных параллельно белковых нитей (эта часть представляет собой так называемый легкий меромиозин). На обоих концах его имеются отходящие в стороны шейки с утолщениями - головками (эта часть - тяжелый меромиозин), благодаря которым образуются поперечные мостики между миозином и актином.
Физико-химические свойства и структурная организация сократительных белков (миозин и актин). Тропомиозин и тропонин.
Миофибриллярные белки включают сократительные белки миозин, актин и актомиозин, а также регуляторные белки тропомиозин, тропонин и альфа- и бета-актины. Миофибриллярные белки обеспечивают сократительную функцию мышц.
Миозин является одним из основных сократительных белков мышц, составляющий около 55% от общего количества мышечных белков. Из него состоят толстые нити (филаменты) миофибрилл. Молекулярная масса этого белка – около 470 000. В молекуле миозина различают длинную фибриллярную часть и глобулярные структуры (головки). Фибриллярная часть молекулы миозина имеет двуспиральную структуру. В составе молекулы выделяют шесть субъединиц: две тяжелые полипептидные цепи (молекулярная масса 200 000) и четыре легкие цепи (молекулярная масса 1500-2700), расположенные в глобулярной части. Основной функцией фибриллярной части молекулы миозина является способность образовывать хорошо упорядоченные пучки миозиновых филаментов или толстые протофибриллы. На головках молекулы миозина расположены активный центр АТФ-азы и актинсвязывающий центр, поэтому они обеспечивают гидролиз АТФ и взаимодействие с актиновыми филаментами.
Актин – второй сократительный белок мышц, который составляет основу тонких нитей. Известны две его формы – глобулярный G-актин и фибриллярный F-актин. Глобулярный актин – это шарообразный белок с молекулярной массой 42 000. На его долю приходится около 25% общей массы мышечного белка. В присутствии катионов магния актин подвергается нековалентной полимеризации с образованием нерастворимого филамента в виде спирали, получившего название F-актин. Обе формы актина не обладают ферментативной активностью. Каждая молекула G-актина способна связывать один ион кальция, который играет важную роль в инициировании сокращения. Кроме того, молекула G-актина прочно связывает одну молекулу АТФ или АДФ. Связывание АТФ G-актином обычно сопровождается его полимеризацией с образованием F-актина и одновременным расщеплением АТФ до АДФ и фосфата. АДФ остается связанной с фибриллярным актином.
Тропомиозин – это структурный белок актиновой нити, представляющий собой вытянутую в виде тяжа молекулу. Две его полипептидные цепи как бы обвивают актиновые нити. На концах каждой молекулы тропомиозина расположены белки тропониновой системы, наличие которой характерно для поперечно-полосатых мышц.
Тропонин является регуляторным белком актиновой нити. Он состоит из трех субъединиц: ТнТ, Тнl и ТнС. Тропонин Т (ТнТ) обеспечивает связывание этих белков с тропомиозином. Тропонин I (Тнl) блокирует (ингибирует) взаимодействие актина с миозином. Тропонин С (ТнС) – это кальцийсвязывающий белок, структура и функции которого подобны широко распространенному в природе белку кальмодулину. Тропонин С, как и кальмодулин, связывает четыре иона кальция на молекулу белка и имеет молекулярную массу 17 000. В присутствии кальция изменяется конформация тропонина С, что приводит к изменению положения Тн по отношению к актину, в результате чего открывается центр взаимодействия актина с миозином.
Таким образом, тонкий филамент миофибриллы поперечно-полосатой мышцы состоит из F-актина, тропомиозина и трех тропониновых компонентов. Кроме этих белков, в мышечном сокращении участвует белок актин. Обнаруживается он в зоне Z-линии, к которой крепятся концы F-актиновых молекул тонких нитей миофибрилл.
Основными белками мышц являются актин и миозин
Массу мышечных фибрилл составляют вода (75%) и белки (более 20%). Основными представителями мышечных белков являются актин и миозин, среди которых на долю миозина приходится 55%.
Этот белок (ММ 460 кДа) имеет форму асимметричного гексамера. Молекула миозина имеет вытянутую часть, состоящую из двух спиралей, накрученных одна на другую. Каждая спираль имеет на одном конце глобулярную головку. Гексамер (6 субъединиц) включает одну пару тяжелых цепей (ММ 200 кДа) и две пары легких цепей (ММ 15-27 кДа). Тяжелые цепи состоят из линейно вытянутого, a-спирализованного С-концевого домена (1300 аминокислотных остатков) и N-концевого домена глобулярной формы (около 800 аминокислотных остатков). Два a-спирализованных домена, принадлежащих двум тяжелым цепям, образуют вместе устойчивую суперспиральную структуру с двумя глобулярными головками (рис.17.8).
Полная молекула миозина содержит также 4 сравнительно небольших полипептидных цепи (ММ 16-24 кДа), которые связаны с глобулярными головками. В отличие от актина миозин скелетных мышц обладает ферментативной активностью и катализирует гидролиз АТФ, связываясь с F-актином. Все легкие цепи связывают Са 2+ , фосфорилируются с помощью специальной киназы и, в целом, принимают участие в регуляции активности миозиновой АТФ-азы.
Рис.17.8 . Схематическое изображение строения толстых нитей. Показана пространственная конфигурация миозина.
В молекуле миозина имеются несколько важных в функциональном отношении участков. Недалеко от середины линейной суперспирализованной зоны находится место, в котором происходит расщепление молекулы под действием трипсина. Этот фермент как бы разрезает молекулу на 2 части: одна содержит глобулярные головки и некоторую часть суперспирализованной зоны; другая состоит из оставшейся порции суперспирализованной зоны со стороны С-конца. Часть, содержащая головку, получила название "тяжелый меромиозин" (ММ 350 кДа). С-концевой фрагмент называется "легкий меромиозин" (ММ 125 кДа).
Значение места действия трипсина на молекулу миозина заключается в том, что оно удивительно совпадает с тем местом в молекуле миозина, которое работает как своеобразный шарнир, превращая химическую энергию АТФ в чисто механическое явление сокращения - расслабления. Другой важный участок, выполняющий аналогичную роль, подвержен действию ещё одного протеолитического фермента - папаина. Папаин разрезает молекулу миозина очень близко к глобулярным головкам. Получается два фрагмента и именно тот из них, где находится головка, проявляет АТФ-азную активность.
Из миозина образуются толстые нити. Толстая нить состоит, приблизительно, из 400 молекул миозина, по 200 с каждой стороны от М-линии. Эти молекулы удерживаются в связке с помощью С белка ("скрепочного" белка), белка М-линии и гидрофобного взаимодействия между собой. В точке, локализованной в месте действия трипсина, тяжелый меромиозин отклоняется от основной оси толстой нити, образуя острый угол. Благодаря этому головка тесно сближается с актином тонких нитей, локализованных в пространстве между толстыми нитями. Важнейшим молекулярным событием, предшествующим мышечному сокращению, является регулируемое связывание головок миозина с актином тонких нитей. В последующем происходит быстрое изменение конформации миозина вокруг уже упоминавшихся своеобразных "шарнирных" точек, и связанный актин перемещается в направлении М-линии.
Доля актина в общей массе мышечных белков составляет 25%. Это глобулярный белок-мономер с ММ 43 кДа, получивший название G-актин. В присутствии ионов магния и физиологической концентрации ионов в растворе G-актин полимеризуется с образованием нерастворимой нити., которая называется F-актин (рис.17.9). Два F-актиновых полимера накручиваются друг на друга в виде спирали. Так формируется основная структура тонкой нити. Волокно F-актина имеет толщину 6-7 нм и повторяющуюся структуру с периодичностью 35,5 нм. Ни G-, ни F-актин не обладают никакой каталитической активностью.
Рис. 17.9. Структура F-актина
Каждая субъединица G-актина имеет центр связывания АТФ/АДФ, который принимает участие в полимеризации тонкой нити. После окончания полимеризации тонкая нить покрывается и стабилизируется белком - b-актинином. Вдобавок к центру связывания нуклеотидов на каждой молекуле G-актина имеется высокоаффинный центр связывания головки миозина. Регуляцию его работы в скелетной и сердечной мышцах осуществляют дополнительные белки тонкой нити. Таким образом, дополнительные белки контролируют сократительный цикл.
Белковый состав мышечной ткани весьма сложен. Уже с давних пор он изучается многими учеными. Основоположник отечественной биохимии А. Я. Данилевский, исследуя белки мышечной ткани, дал правильное представление о физиологической роли ряда белков и о значении сократительного белка миозина, содержащегося в миофибриллах.
В дальнейшем миозин исследовали В. А. Энгельгардт, И. И. Иванов и другие советские ученые. Большой вклад в изучение мышечного сокращения внес венгерский ученый Сцент-Джордьи. Другой венгерский ученый Штрауб открыл белок мышц актин.
Изучение мышечной ткани следует начинать с белков, так как на их долю приходится около 80% сухого остатка мышечной ткани. В соответствии с морфологической структурой мышечного волокна белки распределяются следующим образом:
Из приведенной схемы видно, что белковый состав мышечной ткани очень разнообразен. В саркоплазме содержится четыре белка: миоген, миоальбумин, глобулин X и миоглобин. В миофибриллах содержится комплекс, состоящий из актина и миозина, называемый актомиозином. Все белки саркоплазмы называются внутриклеточными, а белки сарколеммы - внеклеточными, В ядрах содержатся нуклеопротеиды, в сарколемме - коллаген и эластин. Если учесть, что в мышечной ткани, кроме того, содержится еще значительное количество различных ферментов и каждый из них является особым белком, то белковый состав мышечной ткани оказывается еще более сложным.
Миозин
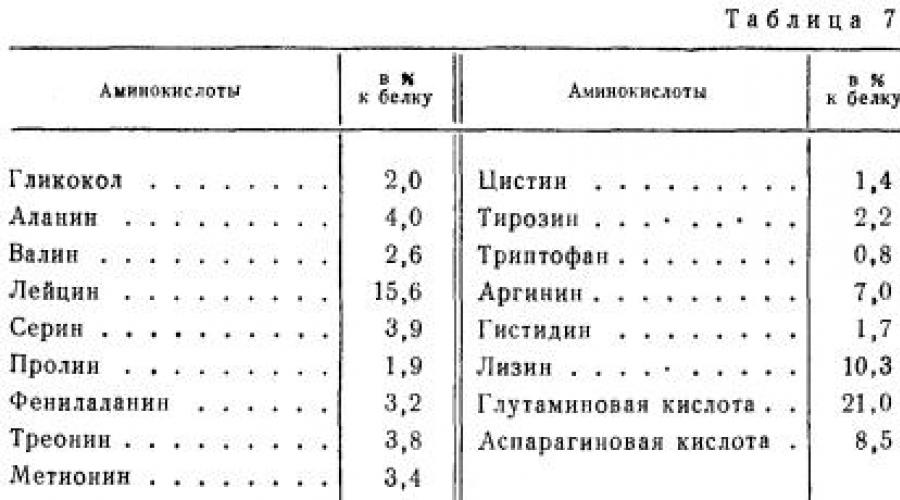
Основным белком мышечной ткани является миозин. Он составляет почти половину всех белков мышечной ткани, причем он встречается в мышцах всех млекопитающих, птиц и рыб. По пищевой ценности он является полноценным белком. В табл. 7 приведен аминокислотный состав миозина быка.

Миозин был детально изучен советскими биохимиками, обнаружившими, что он является не только структурным белком мышечной ткани, т. е. белком, участвующим в построении клетки, но и ферментом - аденозинтрифосфатазой, катализирующей реакцию гидролиза АТФ. При этом образуются АДФ (аденозинди-фосфорная кислота) и фосфорная кислота и выделяется большое количество энергии, используемой при мышечной работе.
Миозин получен в чистом кристаллическом виде. Молекулярный вес его очень большой, примерно 1,5 млн. Кристаллический миозин при полном отсутствии солей прекрасно растворим в воде. Ho достаточно добавить к воде ничтожное количество какой-либо соли, например хлористого натрия, как он полностью теряет способность растворяться и растворение наступает уже при концентрации хлористого натрия около 1%. Однако по отношению к солям, например к сернокислому аммонию, миозин ведет себя как типичный глобулин.
При извлечении белков мяса водой миозин не переходит в раствор. При обработке мяса солевыми растворами он обнаруживается в солевой вытяжке. При разведении водой солевого раствора миозина уменьшается концентрация соли и миозин начинает выпадать в осадок. Миозин высаливается при полном насыщении хлористым натрием и сернокислым магнием (высаливание производят кристаллической солью, иначе добиться полного насыщения невозможно).
Изоэлектрическая точка миозина находится при pH 5,4-5,5.
Миозин обладает свойством вступать в особые связи с различными веществами, в первую очередь с белками, с образованием комплексов. Особую роль в деятельности мышц играет комплекс миозина с актином - актомиозин.
Актин и актомиозин
Белок актин может существовать в двух формах: фибриллярной и глобулярной. В покоящейся мышце актин находится в фибриллярной форме; при мышечном сокращении он переходит в глобулярную. Большое значение в этом превращении имеют аденозинтрифосфорная кислота и соли.
В мышечной ткани содержится 12-15% актина. В раствор он переходит при длительном извлечении солевыми растворами; при кратковременном извлечении он остается в строме. Молекулярный вес актина около 75 000.
При смешивании растворов актина и миозина образуется комплекс, называемый актомиозином, из которого в основном построены миофибриллы. Этот комплекс отличается высокой вязкостью, способен резко сжиматься при определенных концентрациях ионов калия и магния (0,05 м KCl >и 0,001 м MgCl2) в присутствии аденозинтрифосфата. При более высоких концентрациях солей (0,6 м KCl) актомиозин при добавлении АТФ распадается на актин и миозин. Вязкость раствора при этом заметно снижается.
По представлениям Сцент-Джордьи сжатие актомиозина под действием АТФ лежит в основе сокращения живой мышцы.
Актомиозин, как подлинный глобулин, не растворим в воде. При обработке мяса солевыми растворами в раствор переходит актомиозин с неопределенным содержанием актина в зависимости от длительности извлечения.
Глобулин X
В мышечной ткани содержится около 20% глобулина X от всего количества белка. Он является типичным глобулином, т. е. не растворяется в воде, но растворяется в солевых растворах средней концентрации; осаждается из растворов при половине насыщения сернокислым аммонием (1 объем раствора белка и 1 объем насыщенного раствора сернокислого аммония), хлористым натрием при полном насыщении.
Mиоген
В мышечной ткани содержится около 20% миогена от всего количества белка. Его нельзя отнести к типичным альбуминам или глобулинам, так как он растворяется в воде, недостаточно высаливается хлористым натрием и сернокислым магнием при насыщении (кристаллической солью), в то же время осаждается сернокислым аммонием при 2/3 насыщения (1 объем белкового раствора и 2 объема насыщенного раствора сернокислого аммония). Этот белок был получен в кристаллическом виде. Молекулярный вес миогена 150 000.
В. А. Энгельгардт обнаружил у миогена способность катализировать одну из важнейших реакций, протекающих в процессе гликолиза мышечной ткани. Этим открытием впервые было показано, что ферментативной активностью могут обладать структурные белки, т. е. белки, участвующие в построении тканей.
Mиоальбумин
В мышечной ткани содержится около 1-2% миоальбумина от всего количества белка. Он является типичным альбумином, т. е. растворяется в воде, не осаждается хлористым натрием при насыщении, но осаждается сернокислым аммонием.
Mиоглобин
Миоглобин - сложный белок хромопротеид с молекулярным весом 16 900. При гидролизе он распадается на белок глобин и небелковую группу гем. Миоглобин окрашивает мышцы в красный цвет; от гемоглобина он отличается белковой частью; простетическая группа у них одинакова.
При окислении гем переходит в гематин, а в присутствии соляной кислоты - в гемин. По содержанию гемина можно судить о количестве миоглобина в мышечной ткани.
Содержание гемина в мышцах крупного рогатого скота колеблется от 42 до 60 мг на 100 г ткани; в мышцах свиней его значительно меньше - от 22 до 42 мг на 100 г ткани, поэтому они слабее окрашены.
Миоглобин, как и пигменты крови, имеют характерный спектр поглощения.
Принцип получения спектров поглощения окрашенных веществ, в частности пигментов мяса и крови, состоит в том, что световая энергия, проходя через раствор пигмента, поглощается этим раствором. При этом происходит так называемая абсорбция (поглощение) света, которую можно обнаружить спектроскопом.
Характерные полосы поглощения для пигментов мышечной ткани и крови находятся в пределах от 400 до 700 ммк. В этом интервале волны воспринимаются нашим глазом, и мы можем увидеть посредством спектроскопа в спектре темные полосы, получающиеся благодаря абсорбции света с определенной длиной волны.

Поглощение света окрашенными веществами можно определить количественно спектрофотометром. Полученные результаты принято выражать графически. В этом случае по оси абсцисс откладывают длину волны света, а по оси ординат - количество света в процентах, прошедшее через раствор. Чем меньше прошло света, тем больше поглотилось его окрашенным веществом. Полное пропускание света раствором принимается за 100%.
На рис. 10 показано поглощение (абсорбция) света раствором оксимиоглобина; из него видно, что оксимиоглобин имеет две ярко выраженные характерные полосы поглощения в видимой области спектра, т. е. два участка, в которых он меньше всего пропускает света и, следовательно, больше всего поглощает света. Максимумы этих участков находятся при двух длинах волн; λ 585 ммк и λ 545 ммк,
На рис. 11 показана для сравнения спектрофотометрическая кривая оксигемоглобина.
Миоглобин обладает большей способностью связываться с кислородом, чем гемоглобин крови. Посредством миоглобина мышечная ткань снабжается кислородом. В работающих мышцах миоглобина содержится больше, так как в них окисление протекает интенсивнее. Известно, что мышцы ног сильнее окрашены, чем спинная мышца; мышцы работающих волов окрашены также сильнее, чем неработающих животных. Особенно это заметно у птиц, грудные мышцы которых, являясь нерабочими, почти не окрашены.
Коллаген и эластин
Коллаген и эластин - соединительнотканные белки не растворимые в воде и солевых растворах. Они образуют сарколемму - тончайшую оболочку мышечного волокна.
Нуклеопротеиды
Нуклеопротеиды - белки, составляющие клеточное ядро. Характерной особенностью их является способность растворяться в растворах слабых щелочей. Это объясняется тем, что в их молекуле содержится простетическая группа, имеющая кислотные свойства.
Разделение белков мышечной ткани
При обработке мышечной ткани солевыми растворами средней концентрации ее белки можно разделить на белки стромы и белки плазмы. Под стромой понимают не растворимую в солевом растворе структурную основу мышечной ткани, которая состоит главным образом из белков сарколеммы (см. схему).

Растворимость внутриклеточных белков мышечной ткани различна. Например, актомиозин и глобулин X не растворяются в воде и легче осаждаются из солевых растворов сернокислым аммонием и хлористым натрием, чем миоген. Миоген растворяется в воде подобно миоальбумину, но отличается от него по высаливаемости.
Растворимость белков мышечной ткани в растворах солей при нейтральной реакции и их осаждаемость приведены в табл. 8.

При посоле, варке и других видах технологической обработки мяса происходит потеря белковых веществ. Величины потерь белков обусловлены различными растворимостью и осаждаемастью их.
Зная свойства белков, можно подобрать такие условия, при которых потери будут наименьшими. Поэтому на изучение указанных свойств белков должно быть обращено особое внимание.
Изучение химического состава миофибрилл показало, что толстые и тонкие нити состоят только из белков.
Толстые нити состоят из белка миозина. Миозин - белок с молекулярной массой около 500 кДа, содержащий две очень длинные полипептидные цепи. Эти цепи образуют двойную спираль, но на одном конце эти нити расходятся и формируют шаровидное образование - глобулярную головку. Поэтому в молекуле миозина различают две части - глобулярную головку и хвост. В состав толстой нити входит около 300 миозиновых молекул, а на поперечном срезе толстой нити обнаруживается 18 молекул миозина. Миозиновые молекулы в толстых нитях переплетаются своими хвостами, а их головки выступают из толстой нити по правильной спирали. В головках миозина имеются два важных участка (центра). Один из них катализирует гидролитическое расщепление АТФ, т. е. соответствует активному центру фермента. АТФазная активность миозина впервые обнаружена отечественными биохимиками Энгельгардтом и Любимовой. Второй участок головки миозина обеспечивает во время мышечного сокращения связь толстых нитей с белком тонких нитей - актином. Тонкие нити состоят из трех белков: актина, тропонина и тропомиозина.
Основной белок тонких нитей - актин. Актин - глобулярный белок с молекулярной массой 42 кДа. Этот белок обладает двумя важнейшими свойствами. Во-первых, проявляет высокую способность к полимеризации с образованием длинных цепей, называемых фибриллярным актином (можно сравнить с нитью бус). Во-вторых, как уже отмечалось, актин может соединяться с миозиновыми головками, что приводит к образованию между тонкими и толстыми нитями поперечных мостиков, или спаек.
Основой тонкой нити является двойная спираль из двух цепей фибриллярного актина, содержащая около 300 молекул глобулярного актина (как бы две нити бус, закрученные в двойную спираль, каждая бусинка соответствует глобулярному актину).
Еще один белок тонких нитей – тропомиозин – также имеет форму двойной спирали, но эта спираль образована полипептидными цепями и по размеру гораздо меньше двойной спирали актина. Тропомиозин располагается в желобке двойной спирали фибриллярного актина.
Третий белок тонких нитей – тропонин - присоединяется к тропомиозину и фиксирует его положение в желобке актина, при котором блокируется взаимодействие миозиновых головок с молекулами глобулярного актина тонких нитей.
5. Технологические приемы ускорения созревания мяса
После прекращения жизни животного (синтеза) в мясе происходит комплекс изменений, на которые влияют ферменты. Начинается самораспад тканей под действием ферментов самих тканей. Этот процесс называется автолизом. При этом изменению подвергаются мышечные, соединительные и жировые ткани. Изменения в мышечной ткани при хранении влияют на качество мяса.
При жизни животного основной функцией мышечной ткани является двигательная, в результате которой происходит превращение химической энергии в механическую. Эти сложные превращения происходят за счет биохимических, физиологических, физических и термодинамических процессов.
Биохимический аспект выражается в изменении миофибрилл белков, прежде всего миозина и актина (80% белков). При сокращении происходит соединение фибриллярного актина с миозином. Образуется прочный актомиозиновый комплекс, в котором на одну молекулу миозина приходится 2-3 молекулы актина.
Энергетический механизм сокращения заключается в изменении свободной энергии, образующейся при расщеплении АТФ. Активностью АТФ обладает белок миозин, который при распаде АТФ соединяется с актином, образуя актиномиозиновый комплекс, т.е. происходит процесс окоченения. В данном случае миозин является не только белком, но в своем роде ферментом.
Фаза собственного созревания мяса характеризуется интенсивным распадом мышечного гликогена и накоплением молочной кислоты, а также изменением его химического состава, но окоченение входит в процесс автолиза.
Характерной особенностью окоченения является снижение влагоудерживающей способности мышечной ткани, вследствии чего всегда наблюдается отделение мышечного сока. По внешним признакам окоченевшее мясо имеет большую упругость, при тепловой обработке – излишнюю жесткость, а из-за снижения влагаудерживающей способностью становится менее сочным. В состоянии окоченения мышцы менее подвержены действию протеометических ферментов и мясо хуже усваивается.
В результате накопления молочной, фосфорной и других кислот в мясе увеличивается концентрация водородных ионов, вследствии чего к концу окоченения рН снижается до 5,8-5,7, а иногда и ниже. В кислой среде при распаде АТФ и фосфорной кислоты происходит частичное накопление неорганического фосфора.
Фаза созревания во многом определяет интенсивность течения физико-коллоидных процессов и микроструктурных изменений мышечных волокон. В результате комплекса причин (действия протеометических ферментов, образования продуктов автолитического распада, кислой среды) и происходит распад мышечных волокон. Глубокий распад свидетельствует уже о глубоком автолизе, что чаще наблюдается при порче мяса. На фазе же плавного перехода от окоченения к созреванию мясо размягчается, разрыхляется, появляется нежность, а это значит, что пищеварительные соки свободно проникают к саркоплазме, что улучшает переваримость и усвояемость мяса.
Нежность тканей мяса, где много соединительной ткани, невелика, а мясо молодых животных нежнее, чем старых.
При повышении температуры (до 30 0 С), а также при длительной выдержке мяса (свыше 20-26 сут.) при низких плюсовых температурах (2-4 0 С) ферментативный процесс созревания настолько углубляется, что в мясе заметно увеличивается количество распада белков в виде малых пептидов и свободных аминокислот. На этой стадии мясо приобретает коричневую окраску, в нем увеличивается количество аминного и аммиачного азота, происходит заметный гидролитический распад жиров, что отрицательно оказывает влияние на его пищевые свойства и товарный вид мяса.
Для ускорения созревания мяса, способствующего улучшению его качества, используют различные методы обработки, в том числе применяют ферменты, антибиотики.
Исследования также показали, что поверхностная обработка мяса (погружением в раствор или распылением порошка) не дает достаточного эффекта.
Хорошие результаты дает ферментация мяса, проводимая одновременно после сублимационного восстановления.
Ферментативный препарат добавляет в консервы для получения продуктов более высокого качества. Предлагается добавлять препараты в колбасы низших сортов.
Мясо, обработанное ферментативными препаратами, должно по внешнему виду, цвету, аромату не отличаться от неферментативного, а по вкусу – быть более мягким, без горького вкуса, вызываемого продуктами глубокого расщепления белков ферментами.