Analiza funcțională de laborator a compușilor organici. Metode fizico-chimice pentru analiza compușilor organici
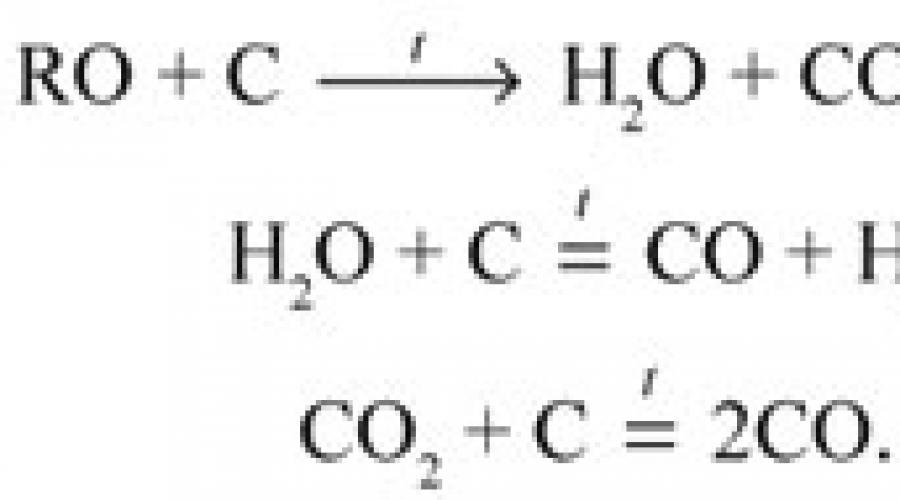
Yu.V. Golubkov,
G.N. Golubkova
Detectarea substanțelor organice
Pentru solicitanții la universități, licee, licee, gimnazii, studenți, precum și profesori de chimie
Continuare. Vezi începutul în Nr. 10/2010
Capitolul II.
Analiza elementară a substanțelor organice și determinarea structurii acestora
Materia organică purificată este supusă analizei calitative și cantitative. Cel mai adesea, compușii organici, pe lângă carbon și hidrogen, conțin oxigen, azot, sulf, halogeni și fosfor.
Analiza calitativă și cantitativă a compușilor organici se bazează pe distrugerea (oxidarea) acestora urmată de determinarea CO 2, H 2 O, N 2, HCl etc. prin metode convenționale.
Analiza elementară a substanțelor organice a început cu determinarea carbonului și hidrogenului, așa că este interesant să privim acest subiect mai detaliat.
§ 7. Determinarea analitică a carbonului și hidrogenului
Esența metodei.
O cantitate cântărită din compusul organic testat este oxidată cu unul sau altul agent oxidant. Oxidul de carbon (IV) se obține cantitativ din carbon, iar apa se obține din hidrogen. Masa acestor produse de ardere (oxidare) este determinată de greutate. Tubul de ardere (oxidare) este umplut astfel încât alte elemente prezente în compusul organic să nu interfereze cu absorbția cantitativă finală a monoxidului de carbon (IV) și a apei în aparatele de absorbție care conțin absorbanți corespunzători.
1) C + O 2 = CO 2,
dioxidul de carbon este absorbit de apa baritică (soluție de hidroxid de bariu Ba(OH)2) și apa de var (soluție de hidroxid de calciu Ca(OH)2), var sodic (un amestec de 83% Ca(OH)2, 5% NaOH și 12 % H2O ) și alte substanțe.
2) H2 + 1/2O2 = H2O,
apa este absorbită de perclorat de magneziu anhidru Mg(Cl04)2 (anhidronă); in ceea ce priveste intensitatea efectului sau de uscare, se apropie de oxidul de fosfor(V), avand fata de acesta din urma avantajul important ca sarea de magneziu care a absorbit apa si topita prin incalzire prelungita la 220 o C in vid poate fi deshidratata si reutilizata. din nou. Se pot folosi și alți absorbanți, de exemplu clorură de calciu (de la acest compus provine denumirea „tub de clorură de calciu”, vezi mai jos).
Echipamente.
Pentru a determina dacă o anumită substanță aparține compușilor organici, este necesar în primul rând să descoperim prezența carbonului în ea. Uneori, acest lucru nu prezintă dificultăți: multe substanțe organice se carbonizează atunci când sunt încălzite, de exemplu. se transformă în cărbune și asta indică prezența carbonului în ele. Dar, într-o serie de cazuri, substanțele care conțin carbon nu se carbonizează atunci când sunt încălzite: de exemplu, dacă încălziți alcool, acesta se va evapora pur și simplu, iar dacă se aprinde, arde fără funingine. Prin urmare, cel mai fiabil mod de a descoperi carbonul într-un compus organic este arderea completă a acestui compus și detectarea prezenței monoxidului de carbon (IV) în produsele de ardere.
Pentru a arde o cantitate cât mai mică de substanță și pentru a nu pierde produsele de combustie gazoasă rezultate, o cantitate mică de materie organică este amestecată cu un agent oxidant și încălzită. În acest scop, nu pot fi utilizaţi agenţi oxidanţi prea activi, deoarece reacţia care apare va îngreuna captarea gazelor emise de aparat. Dacă, de exemplu, amestecați o substanță combustibilă cu un agent oxidant atât de puternic precum cloratul de potasiu KClO 3 (sare Berthollet), atunci, după cum se știe, atunci când amestecul este încălzit, are loc o fulgerare la marginea unei explozii. Prin urmare, în acest caz, se folosesc agenți oxidanți cu activitate scăzută, care acționează doar la o creștere semnificativă a temperaturii, ceea ce permite, prin modificarea temperaturii, reglarea vitezei de oxidare a materiei organice. În arderile organice, oxidul de cupru (II) este de obicei folosit ca agent oxidant.
Pentru definiție calitativă se iau câteva miligrame din substanța de testat și se amestecă cu o cantitate mare (exces) de oxid granular de cupru(II), se toarnă amestecul într-o eprubetă, se închide cu un dop cu tub de evacuare a gazului și se încălzește. Oxidul de cupru(II) este redus de materia organică; Produșii de oxidare ai materiei organice care ies prin tubul de evacuare a gazului sunt direcționați într-un vas cu o soluție saturată de hidroxid de calciu (apă de var). După cum se știe, prezența monoxidului de carbon (IV) este detectată prin turbiditatea apei de var. Dacă substanța de ardere conține hidrogen, apa formată în urma oxidării se depune sub formă de picături de rouă pe părțile reci ale dispozitivului și poate fi astfel detectată.
Pentru a produce cuantificarea carbon și hidrogen, trebuie să absorbiți produsele de ardere rezultate cu ceva, fiecare separat, și să le cântăriți. Principiul de funcționare rămâne același, doar tehnica de execuție se schimbă.
Metoda clasică de ardere, dezvoltată la un moment dat de J. Liebig, este următoarea: substanța arsă nu se amestecă cu oxid de cupru(II), ci se cântărește într-o barcă de porțelan sau platină, care este apoi pusă într-un tub special pt. ardere (fig. 1). Acesta este un tub lung, refractar de sticlă, în care este turnat un strat lung de oxid granular de cupru(II), ținut în loc de două spirale mici din plasă de cupru rulată. Aceste spirale intră în tub cu o ușoară frecare, iar suprafața lor este pre-oxidată. O spirală mai lungă de plasă de cupru oxidat este introdusă în capătul opus al tubului, astfel încât între aceasta și stratul de oxid de cupru (II) să rămână un spațiu mai lung decât o barcă de porțelan cu o substanță suspendată.
Tubul astfel preparat este introdus într-un cuptor cu ardere și, folosind dopuri de cauciuc cu tuburi de sticlă introduse în ele, capetele sale sunt conectate la dispozitive de absorbție precântărite: capătul tubului în care se află stratul de oxid de cupru(II). localizat este conectat la un tub de clorură de calciu (Fig. 2), în care sunt absorbiți vaporii de apă formați în timpul arderii substanței arse, iar după acesta un aparat de potasiu umplut cu o soluție concentrată de hidroxid de potasiu și conceput pentru a absorbi monoxidul de carbon ( IV) este plasat. În fig. Figura 3 prezintă diferitele modele ale aparatelor kali folosite. Capătul opus al tubului de ardere este conectat la gazometre umplute: unul cu aer, celălalt cu oxigen (se folosesc alternativ). Dispozitivele de absorbție sunt, de asemenea, plasate între gazometre și tub pentru a reține umiditatea și monoxidul de carbon (IV) care pot fi conținute în gazele care umple gazometrele.
Metoda de determinare.
Când dispozitivul este asamblat în acest fel, partea din tub care este umplută cu oxid de cupru (II) este încălzită la o căldură roșu închis, apoi spirala de cupru este îndepărtată din partea opusă a tubului, o barcă cu substanța. se introduce și, împingând din nou spirala înăuntru, se închide cu un dop, stabilind comunicarea cu gazometrul umplut cu aer. După aceasta, încep să încălzească spirala lungă și apoi cresc cu atenție temperatura părții tubului în care se află barca cu substanța, trecând foarte încet un curent de aer prin tub.
Substanța din barcă se evaporă parțial și se descompune parțial, formând substanțe volatile. Acești vapori inflamabili, amestecându-se cu aerul, sunt duși de curentul jetului acestuia la ieșirea din tub și, venind în contact cu oxidul de cupru(II) fierbinte, se oxidează, reducând oxidul de cupru(II) la cupru metal. oxidarea are loc prea repede și prea multe dintre produsele sale (acest lucru poate fi judecat după numărul de bule care trec prin aparatul kali) scad temperatura și reduc intensitatea fluxului de aer; în caz contrar, fac invers.
Dacă substanța care este arsă se evaporă în întregime sau se descompune fără a forma cărbune, nu va mai rămâne nimic în barcă la sfârșitul arderii. Dacă în barcă se formează cărbune, această parte a tubului este încălzită mai puternic și, în loc de aer, începe să treacă oxigenul, în care cărbunele arde treptat.
Când arderea este încheiată, aerul este trecut din nou prin tub până când oxigenul care umple tubul și dispozitivele de absorbție este deplasat de aer. Acest lucru trebuie făcut deoarece dispozitivele de absorbție, când au fost cântărite înainte de ardere, au fost umplute cu aer, nu cu oxigen. După aceasta, tubul de clorură de calciu și șublerul sunt cântăriți, permițându-le să atingă temperatura cântarelor. Creșterea în greutate a tubului de clorură de calciu arată cantitatea de apă absorbită, iar creșterea în greutate a tubului de clorură de calciu arată cantitatea de monoxid de carbon absorbită (IV).
Liebig și-a efectuat analizele folosind cărbune: tubul de ardere a fost plasat într-un jgheab și acoperit cu un strat de cărbune aprins. Pentru a scădea temperatura într-un loc al tubului, cărbunele a fost scos; pentru a crește temperatura, a fost umflat cu burdufuri făcute manual. Odată cu introducerea gazului de iluminat în practica de laborator, au început să fie utilizate cuptoare cu un număr mare de arzătoare cu gaz (Fig. 4), a căror flacără este ușor de reglat. În practica modernă, cuptoarele electrice sunt folosite din ce în ce mai des.
Metoda Liebig de analiză organică, denumită altfel analiza elementară(determinarea compoziției elementare a materiei organice) este încă utilizat pe scară largă în laboratoare. Pe lângă această metodă, se folosesc adesea altele. De exemplu, conform metodei Denstedt, arderea se realizează fără oxid de cupru(II); substanța este arsă într-un curent de oxigen în prezența metalului de platină, care acționează ca un catalizator. Acest lucru face posibilă reducerea dimensiunii tubului și reducerea numărului de arzătoare din cuptor.
În ultimii ani s-a răspândit tot mai mult metoda de ardere simplificată a lui G. Ter-Meulen și I. Gesling, care constă în arderea analitului într-un curent de oxigen, folosind ca catalizator oxidul de mangan(IV); Cuptorul in care se realizeaza arderea este de un design foarte simplu si este incalzit de doar doua arzatoare. Această metodă este, de asemenea, convenabilă prin faptul că permite utilizarea unor cantități foarte mici de substanță pentru ardere și este metoda semi-micro.
În prezent în uz micrometode analiză organică. Designul special al microbalanțelor face posibilă cântărirea unor cantități foarte mici de substanță cu o precizie de 0,001 mg. Tubul de ardere și dispozitivele de absorbție au fost reduse și îmbunătățite în consecință.
Metoda originală de microanaliza organică a fost dezvoltată de M.O. Korshun și V.A. Klimova. Esența sa constă în faptul că arderea se realizează într-un tub gol într-un curent de oxigen. O probă de 3–5 mg de substanță este plasată într-o sticlă de cuarț cilindrică, care este introdusă într-un tub de ardere (în poziție orizontală); Prin tub trece un curent de oxigen. Când se încălzește secțiunea tubului în care se află cana cu substanța combustibilă, în interiorul cupei are loc descompunerea și carbonizarea substanței, deoarece oxigenul nu poate circula în interiorul cupei și, prin urmare, nu este în exces. Produsele de descompunere termică a substanței analizate, lăsând paharul într-un tub de ardere încălzit la 850–950 ° C, întâlnesc un mare exces de oxigen și ard complet. Arde și cărbunele rămas în cană. Arderea durează doar 10-15 minute. Astfel, micrometoda lui Korshun și Klimova este o metodă de mare viteză.
Dacă a fost ars A g de substanță, creșterea în greutate a tubului de clorură de calciu – R g (masa de apă formată), iar creșterea în greutate a kaliapparat este R 1 g (masa monoxidului de carbon format (IV), procentul de hidrogen și carbon din substanța de testat se determină după cum urmează. 1/9 din apă în masă este hidrogen, prin urmare, în R g apă conține ( R/9) g hidrogen; pentru a exprima această sumă ca procent, ar trebui să o înmulțiți cu 100 și să o împărțiți în greutate: R 100/(9A)%. Într-o moleculă de monoxid de carbon (IV), 12/44 din masa sa este carbon, prin urmare, această probă conține (12 R 1/44) g carbon sau 12 R 1 100/(44A) %.
Dacă substanța care este arsă era formată din carbon, hidrogen și oxigen, masa acestuia din urmă se află prin diferență (scăzând din 100% suma fracțiilor de masă de hidrogen și carbon ca procent).
La determinarea carbonului și hidrogenului folosind metoda Unterzaucher, analitul este ars peste oxid de cupru (II) într-un curent de aer. Hidrogenul este determinat de cantitatea de H2O eliberată, care este legat cu BaCl2 anhidru, iar carbonul este determinat de cantitatea de CO care se formează atunci când CO2 eliberat este trecut peste cărbune încălzit la 1120 ° C. În acest caz, conținutul de CO este determinat așa cum va fi descris mai jos (a se vedea § 10). Metoda a fost dezvoltată de J. Unterzaucher în 1950.
Literatura descrie mai multe opțiuni pentru proiectarea instrumentală a metodelor de determinare a carbonului și hidrogenului în compușii organici. Să fim atenți la minuțiozitatea metodelor.
§ 8. Determinarea analitică a halogenilor
Halogenul din substanțele organice nu este conținut sub formă de ion, deci nu poate fi precipitat cu nitrat de argint sub formă de AgCl, AgBr sau AgI. Pentru a descoperi prezența unui halogen într-o substanță organică, aceasta din urmă trebuie distrusă și astfel eliberează halogenul sau îl transformă într-un alt compus în care halogenul este ușor de deschis.
Un test calitativ pentru halogen poate fi efectuat după cum urmează: substanța de testat este colectată pe un fir de cupru oxidat sau pe o bucată de oxid de cupru(II) fixată în ochiul unui fir de cupru și pusă la foc; materia organică arde, producând halogenură de cupru, care colorează flacăra verde sau verde-albăstrui. Această metodă de deschidere a unui halogen este cunoscută ca Testele Beilstein. Astfel poți descoperi prezența unui halogen, dar nu poți decide care dintre ele făcea parte din substanța studiată. În plus, reacția nu este selectivă (interfer nitrilii, unii derivați de piridină etc.).
Metode gravimetrice.
Pentru a determina cantitativ halogenul din compușii organici, puteți proceda astfel: o probă din substanța de testat, puțin azotat de argint și câțiva mililitri de acid azotic concentrat sunt plasate într-un tub de sticlă cu pereți groși, sigilat la un capăt. Tubul se etanșează și se încălzește la 280–300 °C într-un cuptor special, după ce a fost introdus în prealabil într-o carcasă metalică, în cazul în care tubul sparge, incapabil să reziste la presiune. În aceste condiții, substanța organică arde (acidul azotic este un agent oxidant), iar în tub se formează clorură, bromură sau iodură de argint, în funcție de ce halogen este inclus în substanța studiată. Presiunea ridicată se dezvoltă în tub datorită formării de monoxid de carbon (IV) și oxizi de azot. Odată răcit, tubul este deschis, precipitatul este îndepărtat, spălat și uscat și cântărit. Acest - metoda „ardere umedă” de L. Carius(1860).
Determinarea cantitativă a halogenului în derivații de halogen solubili în alcool a fost simplificată semnificativ de către A.V. Stepanov (1906). Se adaugă sodiu metalic bucată cu bucată la o soluție de alcool dintr-o porțiune cântărită a derivatului de halogen și se încălzește într-un balon cu reflux. Sub influența hidrogenului deplasat de sodiu din alcool, se formează hidrocarbura și halogenura de hidrogen corespunzătoare, care cu sodiu dă sarea corespunzătoare, de exemplu clorura de sodiu. Astfel, halogenul intră în stare ionică și este determinat prin metode analitice convenționale (gravimetric sau titrimetric).
Când substanțele care conțin halogen sunt arse pentru a determina carbonul și hidrogenul, la capătul tubului de ardere este plasată o spirală din plasă de argint. Scopul spiralei este de a reține halogenul eliberat în timpul arderii substanței, astfel încât acesta, împreună cu monoxidul de carbon (IV), să nu pătrundă în kalyapparat (balon de absorbție) și să nu fie absorbit de alcali.
De metoda „ardere uscată”. substanța este arsă într-un curent de oxigen într-un tub de cuarț al unui dispozitiv special de ardere, iar produsele de descompunere sunt trecute peste contacte de platină încălzite pentru a asigura oxidarea completă.
De metoda de fuziune „bombă”. substanța organică care conține halogenul este topită într-o „bombă” cu un amestec de nitrat de potasiu, peroxid de sodiu și zahăr din trestie (zaharoză). Aceasta produce halogenură de sodiu, care este precipitată cu nitrat de argint și suspendată ca halogenură de argint. „Bomba” folosită pentru fuziune (Fig. 5) constă dintr-o eprubetă metalică cu o adâncime de 25 mm și un diametru interior de 13 mm; este realizat dintr-un aliaj de crom și nichel. Grosimea pereților tubului este de 1,5 mm; are o flanșă lată de 3 mm pe care sunt așezate capacul și garnitura de plumb. Fundul rotund al eprubetei este echipat cu o buclă mică. Capacul „bombă” este fixat ferm cu o clemă în formă de arc cu un șurub bine fixat.
Efectuarea unei analize
Amestecare.Se cântăresc 300 mg dintr-un amestec de nitrat de potasiu și zahăr din trestie (în raport de 3:1) și 1,5 g peroxid de sodiu într-o sticlă de cântărire. O treime din acest amestec este încărcată într-o „bombă” și se adaugă cantitatea adecvată de analit. Apoi se adaugă restul amestecului, se înșurubează strâns capacul „bombei” și se amestecă bine conținutul prin agitare. Această amestecare minuțioasă este foarte importantă pentru a obține o oxidare completă. Atingerea repetată face ca conținutul „bombei” să se colecteze în partea de jos - amestecul de reacție este gata pentru fuziune.
Fuziune. „Bomba” este susținută de capul unei cleme cu șurub cu un clește sau o bucată de sârmă puternică introdusă în orificiul din capul șurubului și este coborâtă treptat cu o treime în partea superioară a flăcării mici incolore. a unui arzător pe gaz (încălzirea ar trebui evitată „bombele” este prea aproape de capac). Fuziunea se termină în 10 s; fuziunea în sine poate fi recunoscută cu ușurință prin scuturarea „bombei”. Teoretic, fuziunea poate fi considerată completă după 10 s specificate, dar se recomandă menținerea „bombei” în flacără pentru încă 5 s pentru a fi sigur de fuziunea completă a întregului amestec de reacție. Apoi „bomba” este răcită cu apă sub robinet.
Răcire și filtrare În primul rând, exteriorul „bombei” este spălat cu apă distilată. Apoi se deschide și interiorul capacului se spală cu apă distilată fierbinte; Apa de spălare este colectată într-un tub de sedimentare. După aceasta, tubul „bombă” este introdus în tubul de sedimentare și se adaugă din nou apă distilată fierbinte, astfel încât să acopere complet tubul „bombă”. Pentru a dizolva complet amestecul de reacție, agitați-l. După ce întregul amestec s-a dizolvat, eprubeta este ridicată cu o sârmă groasă de platină și spălată bine cu apă distilată fierbinte. Apoi eprubeta este luată de buclă cu pense cu vârfuri de platină și spălată în interior cu apă distilată fierbinte, care se toarnă în soluția originală.
DETERMINAREA CLOR. Soluția este răcită într-o baie de gheață și acidulată cu acid azotic concentrat. Soluția acidulată este filtrată într-o altă eprubetă pentru precipitare; La filtrat se adaugă 1 ml de soluție de azotat de argint 5%, se încălzește pe baie de apă și se filtrează precipitatul.
Precipitatul de clorură de argint se usucă până la o greutate constantă și se cântărește, după care se calculează conținutul de clor din substanța analizată.
Determinarea bromului și iodului. Soluția principală și apele de spălare sunt neutralizate în prezența fenolftaleinei cu acid azotic până devin ușor roz. Se adaugă 100 mg de sulfat de hidrazină și amestecul este încălzit pe baie de aburi timp de 15 minute. După ce acest amestec este filtrat într-o altă eprubetă pentru precipitare, se acidifică cu 0,5 ml de acid azotic concentrat, se adaugă 1 ml dintr-o soluție de azotat de argint 5%, totul se încălzește din nou într-o baie de aburi și precipitatul se filtrează, uscate şi cântărite (ca la determinarea clorului).
Metode titrimetrice.
Determinarea clorului și bromului. O substanță organică care conține clor și brom se adaugă în balonul de reacție și se descompune la 115–125 °C cu acid sulfuric concentrat în prezența unui amestec de dicromat de potasiu și dicromat de argint. Arderea se realizează într-un curent de oxigen. Halogenul (X) intră într-un recipient care conține un exces de soluție de hidroxid de sodiu cu o concentrație molară de 0,01 mol/l, la care se adaugă 1 ml de peroxid de hidrogen:
2RX -> X 2 + X CO2+ X H2O (oxidare),
X2 + 2NaOH + H2O2 = 2NaX + O2 + 2H20 (absorbţie).
Un exces de soluție de hidroxid de sodiu se titrează cu o soluție acidă de aceeași concentrație și se calculează procentul de clor sau brom din cantitatea de alcali consumată. Prezența iodului nu interferează cu determinarea, deoarece este oxidat la iod. Această metodă nu este potrivită pentru substanțe volatile sau substanțe care conțin și azot sau sulf.
Determinarea iodului. Materia organică care conține iod este ardă în prezența unui catalizator într-o atmosferă de oxigen; aceasta produce iod, monoxid de carbon (IV) și apă. Iodul este captat și oxidat cu brom pentru a forma acid iod HIO 3, acesta din urmă este redus cu iodură de hidrogen la iod, care se determină iodometric.
Procesul decurge conform următoarelor ecuații:
2RI -> I 2 + X CO2+ X H2O (combustie),
HIO3 + 5HI = 3I2 + 3H2O,
I2 + 2Na2S2O3 = 2NaI + Na2S4O6 (titrare iodometrică).
§ 9. Determinarea analitică a azotului
Determinarea calitativă a azotului. În produsele de ardere a substanțelor organice care conțin azot, acesta din urmă este în stare liberă. Prin urmare, pentru a determina prezența azotului într-un compus organic, este necesară distrugerea acestuia și transformarea azotului într-un compus care poate fi ușor descoperit prin unele reacții calitative.
De exemplu, conform metodei Lassen azotul este detectat astfel: într-un tub de sticlă sigilat la un capăt se calcinează puțin din substanța studiată cu o bucată de potasiu metal; în acest caz, substanța este carbonizată, iar cianura de potasiu se formează din potasiu, carbon și azot conținute în materia organică studiată. Tubul este scufundat într-o cantitate mică de apă, în urma căreia se sparge, iar cianura de potasiu se dizolvă în apă. Soluția este filtrată din fragmente de sticlă și cărbune. La soluția rezultată care conține cianura de potasiu, se adaugă soluții de săruri de fier (II), de exemplu sulfat de fier (II) și săruri de oxid de fier (III), de exemplu clorură de fier (III). Hidroxidul de potasiu conținut în soluție precipită hidroxizi de fier (II) și (III), iar când cianura de potasiu reacţionează cu sărurile de fier (II), se formează hexacianoferrat (II) K4 de potasiu:
6KCN + FeSO4K4 + K2SO4.
După aceasta, se adaugă acid clorhidric (clorhidric), în urma căruia se formează din nou săruri de fier. După dizolvarea hidroxizilor de fier (II) și (III), rămâne un precipitat de albastru prusac format din hexacianoferrat (II) de potasiu și clorură de fier (III) (hexacianoferrat de fier (III) Fe 4 3):
3K 4 + 4FeCl 3 = Fe 4 3 + 12KCl.
Formarea albastrului de Prusia (o sare insolubilă în apă cu o culoare albastră caracteristică) indică conținutul de azot din substanța studiată.
Determinarea cantitativă a azotului (metoda Dumas). Materia organică amestecată cu oxid de cupru(II) este arsă prin trecerea unui curent de dioxid de carbon printr-un tub de ardere; produsele de ardere sunt colectate într-un dispozitiv umplut cu o soluție concentrată de hidroxid de potasiu. Dioxidul de carbon este absorbit, se măsoară volumul de azot liber rămas și apoi se calculează masa acestuia.
Când sunt arse substanțe organice care conțin azot, la capătul tubului de ardere este plasată o spirală redusă de cupru: dacă se formează o cantitate mică de oxizi de azot, aceștia, în contact cu cuprul fierbinte, renunță la oxigen, iar azotul este obtinut in stare libera.
Azotul eliberat este colectat cantitativ într-un contor de azot (vas gradat) peste o soluție de hidroxid de potasiu 50%. Metoda a fost dezvoltată de J.B.A. Dumas în 1831.
Determinarea gazometrică a azotului prin metoda Dumas este aplicabilă compușilor organici care conțin azot sub orice formă și anume: compuși amino-, nitrozo-, azo-, ciano, nitriți de alchil, precum și nitrați și compuși heterociclici care conțin azot.
La determinarea azotului în compuși organici (în principal amine) prin metoda Kjeldahl, analitul se descompune cu H2SO4 concentrat în prezența unui catalizator, de obicei mercur sau sărurile acestuia. În acest caz, după alcalinizare, se izolează amoniacul, care este distilat, absorbit cu o soluție de H 2 SO 4 sau HCl și determinat titrimetric sau colorimetric cu reactivul Nessler - o soluție alcalină de tetraiodomercurat(II) de potasiu dihidrat K 2 [HgI 4 ] 2H 2 O. Uneori, pentru a obține rezultate mai precise, substanța care conține azot este pretratată cu un agent reducător, de exemplu HI. Metoda a fost dezvoltată de I. Kjeldahl în 1883.
Există dispozitive de analiză semi-automate care vă permit să determinați conținutul de azot simultan cu conținutul de carbon și hidrogen.
§ 10. Determinarea analitică a oxigenului
Una dintre primele metode de determinare a oxigenului în compușii organici este reducerea într-un curent de hidrogen (hidrogenarea) la o temperatură de 1120 o C. Aceasta produce apă.
În plus, compușii organici pot fi distruși prin fuziune cu potasiu sau sodiu metalic. În acest caz, oxigenul formează un oxid de metal, care este ușor de detectat. Cu toate acestea, dacă compusul conține simultan oxigen și azot, atunci se poate forma un cianat de metal alcalin, sarea acidului cianic HNCO.
Conform metodei Unterzaucher, un compus organic care conține oxigen este supus pirolizei într-o atmosferă de azot. Produsele gazoase sunt trecute peste cărbune încălzit la 1110 - 1150 °C. În acest caz, se formează oxid de carbon (II), care reacţionează apoi cu oxid de iod solid (V) (anhidridă iodică) I 2 O 5:
5CO + I 2 O 5 = 5CO 2 + I 2.
Iodul eliberat este determinat titrimetric folosind tiosulfat de sodiu Na2S2O3:
2Na2S2O3 + I2 = 2NaI + Na2S4O6.
Această metodă a fost dezvoltată de J. Unterzaucher în 1940.
Unii cercetători preferă să folosească un tub vertical de cuarț în formă de T umplut cu carbon (Figura 6).
Microdeterminarea directă a oxigenului în compuși organici.
Substanța este supusă la descompunere reductivă peste cărbune într-o atmosferă inertă. În acest caz, tot oxigenul se transformă în monoxid de carbon (II):

![]()
M.O. Korshun a avut o mare contribuție la dezvoltarea metodei de microdeterminare a oxigenului și a altor elemente. Ea a propus determinarea gravimetrică a oxigenului pe baza a trei factori:
1) prin pierderea de masă a I 2 O 5 (vezi ecuația anterioară);
2) prin creșterea în greutate a cuprului:
Cu + I = CuI 2;
3) prin creșterea în greutate ascarită*:
CO2 + 2NaOH = Na2CO3 + H2O.
§ 11. Determinarea analitică a sulfului
Materia organică care conține sulf este oxidată prin metoda Carius „ardere umedă”în acid azotic concentrat într-un tub de sticlă cu pereți groși etanș în prezența clorurii de bariu la o temperatură de 280–300 °C. Sulful prezent în substanță este oxidat la acid sulfuric, care reacţionează apoi cu clorura de bariu pentru a forma sulfat de bariu:
H2S04 + BaCI2 = BaS04 + 2HCI.
După răcire, tubul este deschis, precipitatul este îndepărtat, spălat și uscat și cântărit (analiza gravimetrică).
De metoda „ardere uscată”. o substanță organică care conține sulf, dar care nu conține halogeni și azot, este oxidată într-o atmosferă de oxigen în prezența unui catalizator de platină. În acest caz, sulful este transformat în oxizi gazoși, absorbiți de o soluție apoasă de peroxid de hidrogen:
SO2 + SO3 + H2O2 + H2O = 2H2SO4.
Astfel, produsul final al oxidării sulfului este acidul sulfuric, care este titrat cu o soluție de hidroxid de sodiu cu o concentrație molară de 0,01 mol/l (analiza titrimetrică):
H2S04 + 2NaOH = Na2S04 + 2H2O.
§ 12. Determinarea analitică a fosforului și arsenului
Pentru determinarea fosforului, materia organică se descompune fie prin fuziune cu amestecuri solide oxidante, fie prin tratare cu un amestec de peroxid de hidrogen și acid sulfuric concentrat. În acest caz, fosforul găsit în materia organică este transformat în acid ortofosforic, care este apoi determinat în greutate (analiza gravimetrică) sub formă de fosforomolibdat de amoniu, uscat în prealabil cu eter.
Pentru a determina arsenul, materia organică este oxidată în mod similar cu compușii care conțin fosfor. În acest caz, folosesc fie „ardere umedă” (metoda Carius), fie fuziune într-o „bombă”. Acidul arsenic H 3 AsO 4 rezultat este determinat gravimetric (în greutate) sub formă de sare de magneziu a acidului piromezic:
AsO 3- 4 + Mg 2+ + NH 4 + = MgNH 4 AsO 4,
2MgNH4As04Mg2As207 + H20 + 2NH3;
sau iodometric (metoda titrimetrică sau volumetrică):
H 3 AsO 4 + 2HI = H 3 AsO 3 + I 2 + H 2 O,
I 2 + 2Na 2 S 2 O 3 = 2NaI + Na 2 S 4 O 6.
§ 13. Determinarea structurii substanţelor organice
Chimia este un domeniu de cunoaștere științifică și activitate practică care se dezvoltă prin sinteza de noi compuși și crearea de materiale pe baza acestora. Sarcina principală a unui chimist cercetător după sintetizarea unui compus este de a stabili structura moleculei.
Determinarea structurii complete a unei molecule, inclusiv geometrice și electronice, este o sarcină complexă care nu poate fi rezolvată complet. Prin urmare, detaliile structurii moleculare a unui compus mai mult sau mai puțin complex pot fi studiate la nesfârșit, adăugându-le din ce în ce mai multe informații noi.
Să luăm în considerare bazele fizice ale celor mai importante metode de determinare a structurii moleculelor de compuși organici. Aceste metode sunt numite metode de cercetare fizică. De asemenea, metodele chimice de demonstrare a structurii geometrice a unei molecule (structura geometrică) nu și-au pierdut importanța.
La momentul apariției teoriei structurale a lui A.M. Butlerov, adevărul important a fost realizat că structura unei molecule determină toate proprietățile sale chimice, iar din suma proprietăților chimice se poate trage o concluzie corectă despre structura unei molecule. substanţă. Acest adevăr nu și-a pierdut în niciun caz sensul în epoca metodelor de cercetare fizică. Analiza și sinteza rămân constante în chimie; Aceste concepte constituie, după cum știm, baza procesului de gândire, baza oricărei cunoștințe. Sintetizând substanțe din ce în ce mai complexe, chimistul cunoaște dinainte fragmentele inițiale din care se formează structura noului compus. Prin urmare, își asumă structură în avans. După sinteză, nu rămâne decât să demonstrăm. Dacă se determină structura unui compus natural despre care nu există informații, atunci sunt studiate mai întâi proprietățile sale chimice, care ne permit să tragem concluzii despre prezența anumitor elemente structurale. Cel mai important pas aici este analiza chimică - descompunerea unei molecule complexe în fragmente, în „blocuri de construcție” individuale și stabilirea naturii combinației lor în moleculă.
În ultimele decenii, analiza chimică a fost completată analiza spectrală de masă– o metodă fizică bazată pe măsurarea masei particulelor încărcate de materie formate atunci când moleculele complexe sunt bombardate de un flux puternic de electroni. Această metodă este întotdeauna luată în considerare împreună cu metodele de spectroscopie optică. Metodele de mai sus fac posibilă stabilirea prezenței elementelor esențiale individuale ale structurii geometrice (spectroscopie IR, spectroscopie Raman) și electronice (spectroscopie electronică, spectroscopie de rezonanță magnetică nucleară, spectroscopie de rezonanță paramagnetică electronică, spectroscopie electronică cu raze X etc.) a moleculei și pentru a obține o mai bună înțelegere a acesteia complet.
Spectroscopia de rezonanță magnetică nucleară (spectroscopie RMN)– una dintre cele mai moderne metode de studiere a structurii compușilor organici. Pe lângă spectroscopia electronică și vibrațională, metoda RMN, legată de spectroscopia de rezonanță, permite rezolvarea celor mai subtile întrebări ale chimiei structurale, în special, întrebările privind starea electronică a atomilor dintr-o moleculă. Metoda este potrivită pentru studiul moleculelor care conțin atomi cu un număr impar de protoni sau neutroni. Nucleele unor astfel de atomi au un moment magnetic și sunt paramagnetice.
Fundamentele teoretice ale acestor metode de studiere a structurii compușilor organici sunt complexe și sunt discutate în cursurile relevante de învățământ superior.
* Ascaritul este azbest impregnat cu NaOH topit. – Notă ed.
Bazele definiției au fost dezvoltate de F. Pregl. O probă de 3-5 mg de substanță este arsă la o temperatură de 900 °C într-un curent de oxigen purificat din hidrogen, apă și dioxid de carbon. Hidrogenul este purificat din oxigen prin trecerea gazului peste un catalizator de platină la 800 °C. Îndepărtarea completă a dioxidului de carbon și a apei se realizează prin trecerea prin perclorat de magneziu anhidru ( anhidronă) și prin azbest impregnat cu sodă caustică topită ( ascarit).
După tubul de ardere se instalează tuburi cu absorbante: anhidronă și ascarită. Creșterea în greutate a primului absorbant corespunde cantității de apă din care se calculează conținutul de hidrogen dintr-o probă de substanță; creșterea în greutate a celui de-al doilea absorbant dă cantitatea de dioxid de carbon, care este utilizată pentru a determina conținutul de carbon din substanța analizată.
Halogenii și sulful pot fi determinați prin descompunerea substanței conform lui Carius. Halogeni sub formă de halogenură de argint - prin gravitație sau prin titrarea excesului de azotat de argint. Sulful este determinat sub formă de sulfat de bariu. După arderea probei, gazele sunt trecute peste un strat de cupru metal, unde oxizii de azot sunt reduși la azot liber. Azotul este determinat prin metoda volumetrica prin cantitatea de gaz neabsorbit.
Determinarea masei moleculare
Pentru a determina greutatea moleculară a unui compus, se folosesc adesea metode de crioscopie bazate pe legea lui Raoult. Pentru a face acest lucru, determinați punctul de îngheț al solventului și apoi soluția. Diferența este direct proporțională cu numărul de molecule ale substanței dizolvate într-o anumită masă de solvent. Masa moleculară este determinată de formula:
Unde R- greutatea substanței; P - greutatea solventului; K - constantă crioscopică;
În mod similar, în metoda ebulioscopică, greutatea moleculară este determinată prin diferența dintre punctele de fierbere ale unui solvent pur și ale unei soluții.
Pentru compușii cu greutate moleculară mare, metodele descrise mai sus sunt complet inaplicabile. În acest caz, se folosesc trei metode: vâscometrică, osmotică și sedimentare, care, la rândul lor, nu sunt aplicabile substanțelor cu greutate moleculară normală.
În prezent, spectrometria de masă este folosită cel mai adesea pentru a determina masa moleculară a unei substanțe necunoscute.
Metode de izolare a substanțelor individuale
Pentru izolarea compușilor se folosesc următoarele metode fizice: diverse tipuri de distilare - fracționată la presiune atmosferică, în vid, în vid înalt, distilare moleculară, cristalizare, extracție, cromatografie. În plus, există multe metode speciale care țin cont de specificul grupului funcțional.
· Distilarea moleculară . Pentru substanțele care se descompun la punctul de fierbere chiar și în vid înalt, se utilizează „distilarea moleculară”. Principiul său este că sub vid puternic (10 -5 -10 -8 mm Hg) de la suprafața încălzită a substanței topite care urmează să fie distilată, moleculele trec în faza gazoasă la o temperatură mult mai mică decât punctul de fierbere al compusului dat. . Vaporii substanței se condensează apoi pe suprafața rece. Acest lucru face posibilă purificarea substanțelor cu o greutate moleculară relativ mare și o structură fragilă.
· Distilarea cu abur . După cum se știe, o substanță fierbe la o temperatură când presiunea sa de vapori este egală cu presiunea atmosferică. Dacă încălziți două lichide nemiscibile, acestea vor fierbe la o temperatură în care presiunea totală a vaporilor a ambelor lichide este egală cu presiunea atmosferică. Apa este folosită ca al doilea lichid. Astfel, distilarea acestui amestec de lichide poate fi efectuată sub 100°C. Cantitatea ambelor substanțe din distilat este determinată de raportul dintre produsul presiunii de vapori a fiecărei substanțe și greutatea sa moleculară.
· Cristalizare . Recristalizarea este utilizată pentru purificarea solidelor. Metoda se bazează pe faptul că pentru majoritatea compușilor, atunci când soluțiile lor sunt răcite, solubilitatea substanței scade.
· Extracţie . O metodă de separare bazată pe diferența dintre coeficienții de distribuție ai unei substanțe între două lichide nemiscibile.
Cromatografia
Ø Cromatografia – metoda de separare bazată pe diferite viteze de deplasare a zonelor de concentrare a componentelor amestecului studiat în fluxul fazei mobile ( eluent) relativ la faza staționară.
§ După sarcini de rezolvat aloca pregătitoare(separarea cantitativă a substanțelor) și analitic cromatografia (detecția substanțelor și a caracteristicilor cantitative și calitative ale amestecurilor).
§ Conform principiilor separarii cromatografia se împarte în adsorbţie, distributie, schimb de ioniȘi sită.
v Cromatografia de adsorbție . Substanțele care trebuie separate trebuie să difere prin afinitatea lor pentru adsorbantul solid, care este faza staționară. Oxidul de aluminiu și gelul de silice sunt de obicei utilizate ca adsorbanți. Cărbunele activat, sulfatul de bariu, silicatul de magneziu și poliamidele sunt folosite mult mai puțin frecvent.
Capacitatea substanțelor de a fi adsorbite pe un adsorbant polar este determinată în mare măsură de polaritatea lor. Pe baza capacității lor de a fi adsorbite, substanțele cu diferite grupe funcționale pot fi aranjate în următoarea secvență:
RH< ROCH 3 < R-NO 2 < R-N(CH 3) 2 < R-COOCH 3 < R-NH 2 < R-OH < R-CONH 2 < R-COOH.
În ceea ce privește polaritatea și, prin urmare, în ceea ce privește capacitatea de eluare, solvenții eluanți formează următoarea serie:
H 2 O > CH 3 OH > C 2 H 5 OH > CH 3 COCH 3 > CH 3 COOC 2 H 5 > C 2 H 5 OC 2 H 5 > CHCl 3 > CCl 4 > ciclohexan > n-hexan
Eluția se efectuează fie cu un eluent (un amestec de eluanți), fie secvențial cu mai mulți eluenți, trecând de la mai puțin polar la mai polar, fie cu un amestec de doi solvenți (crescând succesiv concentrația celui mai polar).
· Principalele variante ale cromatografiei de adsorbție .
§ Cromatografia de adsorbție pe coloană. Adsorbantul este plasat într-o coloană. Deasupra se aplică mai întâi substanța care trebuie separată, apoi se trece prin eluent, care se deplasează sub influența gravitației sau este pompat sub presiune de o pompă specială.
Separarea substanțelor este monitorizată fie prin metode fizico-chimice (detecție UV, refractometrie), fie prin metode cromatografice analitice.
§ Cromatografia în strat subțire (TLC). Sorbantul este plasat într-un strat subțire pe un substrat de sticlă, aluminiu sau plastic.
Stratul de sorbant poate fi slăbit sau fixat folosind substanțe chimice speciale (amidon, gips). O probă de substanță este aplicată pe fundul plăcii, care este apoi plasată într-o cutie cu un eluent. Solventul se ridică de-a lungul plăcii din cauza forțelor capilare ( ascendent cromatografia), producând separarea. În cazul substanțelor greu de separat, apelați la bidimensionale cromatografia, când substanța este mai întâi eluată într-o direcție, apoi eluția se efectuează într-o direcție perpendiculară.
În condiții moderne, se folosesc de obicei plăci fabricate industrial pentru TLC pregătitoare sau analitice.
· Identificarea și caracterizarea substanțelor. Compușii colorați sunt observați direct în timpul cromatografiei. Substanțele incolore trebuie „identificate” - transformate în compuși colorați.
În funcție de sorbant, fixator și natura substanței separate, se folosesc diferite metode de „detecție”, de exemplu, carbohidrații sunt carbonizați la temperaturi ridicate, inclusiv după pulverizarea cu soluții de acid sulfuric, aminoacizii dau produse colorate după tratamentul cu un soluție de ninhidrin. Pe baza intensității culorii compușilor separați cu reactivi specifici, se apreciază conținutul acestora în amestec.
Pentru a caracteriza substanțele, termenul „ mobilitate cromatografică", care este notat cu Rf, este raportul dintre intervalul zonei substanței și intervalul eluentului.
v Cromatografia de partiție . Această versiune de cromatografie se bazează pe distribuția substanțelor între faza mobilă (gaz, lichid) și faza staționară - lichid ținut pe un purtător solid inert. Cele mai utilizate sunt cromatografia de partiție pe hârtie și cromatografia gaz-lichid.
§ Cromatografia pe hârtie. Baza cromatografiei pe hârtie este distribuția unui amestec de substanțe separate între apa adsorbită pe hârtie și un solvent saturat cu apă. Folosind această metodă, separarea și identificarea aminoacizilor și monozaharidelor a fost realizată cu succes. În prezent, această opțiune de cromatografie și-a pierdut relevanța.
§ Cromatografia gaz-lichid. Aceasta este cromatografia de partiție între o fază lichidă staționară susținută pe un purtător și un gaz (de obicei heliu, azot sau hidrogen).
Pentru a caracteriza substanțele separate, utilizați „ timp de retenție" Acesta este timpul din momentul în care amestecul este introdus în coloană până când iese din coloană și trece substanța printr-un detector adecvat, de exemplu un detector care înregistrează modificările conductivității termice. Această opțiune este una dintre cele mai utilizate metode cromatografice, în special în scopuri analitice.
v Cromatografia cu schimb de ioni . Metoda se bazează pe distribuția substanțelor încărcate (ioni) între fazele mobile și staționare în funcție de afinitatea acestora pentru centrii ionici ai fazei staționare.
După natura schimbătorului de ioni există cationicȘi anionic cromatografia. Apa, soluțiile de acizi și alcaline și soluțiile tampon sunt utilizate pe scară largă ca eluanți. Cele mai comune materiale schimbătoare de ioni sunt schimbătoarele de cationi și schimbătoarele de anioni bazate pe polimeri reticulați care conțin grupări funcționale ionogene, precum și celuloză modificată.
v Cromatografia cu sită (cromatografia pe gel) . O caracteristică distinctivă a cromatografiei pe gel este că în gelurile formate din macromolecule tridimensionale „reticulate” există pori de anumite dimensiuni, în care intră moleculele mai mici ale moleculelor separate și nu intră în cele mai mari. Prin urmare, spre deosebire de cromatografia de adsorbție, în cromatografia pe gel moleculele mai mari trec mai întâi prin coloană, iar cele mici pe urmă. Coloana de separare este umplută cu granule de gel liofil sau hidrofil. Exemple de astfel de materiale cromatografice sunt agenții de gelificare naturali modificați - agar, dextrine, sefadexi (dextrani reticulati) și site sintetice pe bază de poliacrilamidă sau polistiren „reticulat”.
Berzelius J. (1779 1884) – chimist suedez. Cercetarea științifică acoperă toate problemele principale ale chimiei din prima jumătate a secolului al XIX-lea.
Wehler F. (1800-1882) – chimist german. Lucrează în chimie anorganică și organică. Alături de J. Liebig, a stabilit izomeria sărurilor acidului exploziv.
3 Gmelin L. (1788-1853) - chimist german. A publicat cărți de referință despre date experimentale, care au trecut prin mai multe ediții.
Liebig J. (1803-1873) – chimist german. Creator al teoriei radicalilor, fondator al agrochimiei. Studiați acizii organici.
Butlerov A. (1828-1886) - chimist rus, creator al teoriei structurii compușilor organici. Izomeria prezisă a multor compuși.
Gerard S. (1816-1856) – chimist francez. A lucrat pentru Yu. Liebig, a ascultat prelegerile lui J. Dumas. A creat o teorie a tipurilor. Mulți chimiști ruși au studiat cu C. Gerard.
Schorlemmer K. (1834 – 1892) – chimist organic german. A lucrat în domeniul alcanilor și are lucrări despre istoria chimiei.
Lossen V. (1838 - 1905) - chimist german. Principalele lucrări sunt legate de studiul alcaloizilor, au descoperit rearanjarea acizilor hidroxamici.
Carius L. (1829-1875) – chimist german. A dezvoltat o metodă pentru determinarea sulfului, halogenii și alte elemente în compușii organici (1860)
Beilstein F. (1838-1906) – chimist organic rus. Lucrări principale în domeniul sintezei compușilor aromatici. Inițiator și primul compilator al cărții de referință în mai multe volume despre compușii organici (Handbuch der organische Chemie), cunoscut sub numele de Manualul Belstein.
Pregl F. (1869-1930) – chimist german. Fondatorul microanalizei compușilor organici. Premiul Nobel 1923
Raoul F. (1830-1901) – chimist francez. Direcția principală de cercetare este studiul soluțiilor.
ANALIZA SUBSTANȚELOR ORGANICE
(analiza organizațională învechită), calități. și cantități. determinarea componenţei org. in-in si stabilirea structurii lor.
La determinarea calităţilor. alcătuirea org. folosesc o varietate de metode bazate pe chimie. p-tions, însoțite de formarea de produse cu proprietăți caracteristice (culoare, miros, temperaturi de topire etc.), și pe măsurători fizice. și fizico-chimic (cromatografice, spectrale etc.) caracteristici ale compuşilor identificaţi.
Cu cantități, analiza org. se determină cantitatea de reactiv care intră în distribuţie cu org determinată. conn., sau măsurare dif. fizic și fizico-chimic caracteristicile asociate cu numărul de compuși care se determină.
O.v. A. include analiza elementara, grup structural (inclusiv funcțional și stereospecific), analiză moleculară, analiză de fazăȘi analiză structurală.
Din punct de vedere istoric, metodele de analiză elementară a organizației au fost primele care au fost dezvoltate. in-in (A. Lavoisier, sfârşitul secolului al XVIII-lea), pe baza oxidării lor şi gravimetrice, titrimetrice. sau gazometrică determinarea compuşilor simpli formaţi. elemente individuale. Primele metode elementare analiza microchimică(microanaliza) a fost dezvoltat de F. Pregl la început. Secolului 20 Din a 2-a jumătate. Secolului 20 Pentru analiza elementară, metodele automate sunt utilizate pe scară largă. analizoare bazate pe arderea probei analizate org. in-va si gaz cromato-grafic. separarea si determinarea produselor de ardere. Analizorul este echipat cu computer și automat sistem de introducere a probei.
Analiza izotopică a org. scopul este de a determina conținutul de izotopi individuali din ei, precum și de a determina raportul aceleiași org. compuși care conțin diferiți sau combinații ale acestora. În acest scop, se utilizează cel mai adesea spectrometria de masă sau cromatografia multiplă gaz-lichid (de exemplu, la separarea formelor obișnuite și deuterate de metan sau benzen). Naib. cromatografia-spectrometria de masă este eficientă.
Majoritatea metodelor de analiză funcțională se bazează pe interacțiune. funcții individuale grup org. conn. cu reactivi adecvati. Astfel de districte pot fi selective sau limitat selective, adică sunt caracteristice. numai pentru unul sau mai multe. funcţional grupuri.
Cel mai adesea se folosesc soluții asociate cu formarea sau dispariția unor substanțe, baze, agenți oxidanți, agenți reducători, apă, gaze și, mai rar, sedimente și substanțe colorate. Compușii și bazele rezultate determină titrare acido-bazicăîn medii acvatice sau neapoase. Într-un mediu non-apos, potențiometrice separate titrarea compușilor și bazelor de diferite rezistențe atunci când sunt prezente împreună.
În cazul oxido-reducerii. soluții, a căror viteză este mică, se utilizează de obicei titrarea inversă, adică excesul de reactiv este titrat. Despre formarea sau absorbția apei în raioanele org. conn. pe baza definiţiei pluralului. funcţional grupuri folosind reactivul lui Fischer(Vezi si acvametrie).
Metodele bazate pe debite, care sunt însoțite de eliberarea sau absorbția de gaz, sunt rar utilizate, deoarece măsurarea volumului sau presiunii necesită de obicei echipamente voluminoase.
Măsurătorile gravimetrice se bazează pe formarea sedimentelor. metode pentru determinarea unui număr mic de funcţii. grupuri. Compușii ușor solubili utilizați în aceste cazuri sunt, de regulă, metalici. acizi carbonici și sulfonici, săruri org. baze, conexiuni complexe. (inclusiv cele chelate).
Formarea compușilor colorați. adesea destul de specific și vă permite să determinați selectiv funcția. grupuri fotometrice metode. Soluțiile au devenit larg răspândite (în special în microanalize), ducând la formarea de compuși fluorescenți, din cauza sensibilității de determinare a funcției. Grupul în acest caz este destul de mare.
Un tip special de funcțional. analiza ia în considerare metode bazate pe preliminar. se determină interacţiunea substanţei cu reactivii şi determinarea produsului rezultat. De exemplu, aromatice după nitrare poate fi determinată polarografic, iar relația dintre gruparea amino și clorura de naftalen sulfonil poate fi determinată fluorometric.
Mai jos sunt exemple dintre cele mai multe. metode funcționale frecvent utilizate. analiză.
Determinarea hidrogenului activ în alcooli, amine, amide, compuși carbonici și sulfonici, mercaptani și sulfonamide se bazează pe interacțiunile acestora. cu reactivi Grignard (de obicei iodură de metil magneziu; vezi Metoda Cerevitinei)sau cu LiAlH 4 și măsurarea volumului de metan sau respectiv hidrogen eliberat. Activ în acetilenă și omologii acesteia se determină prin soluția cu săruri Ag(I), Hg(I) sau Cu(I) cu ultima titrimetrică. determinarea celor separate.
Conexiuni cu nesaturate legăturile carbon-carbon sunt cel mai adesea bromurate, iodate sau hidrogenate. În primele două cazuri, Br2 sau I2 nereacţionat este determinat iodometric, iar în timpul hidrogenării se măsoară volumul de H2 absorbit. Numărul de legături duble poate fi determinat prin adăugarea de săruri de mercur la ultima. titrarea substanţei eliberate.
La determinarea grupărilor hidroxil, ele folosesc cel mai adesea anhidridă acetică, ftalică sau piromelitică, al cărei exces este titrat. Puteți folosi cloruri acide. Grupările hidroxi din fenoli sunt de obicei titrate cu soluții de bază într-un mediu neapos. Fenolii sunt ușor bromurați și combinați cu săruri de diazoniu, de aceea sunt titrați cu soluții de Br 2 sau săruri de diazoniu, sau se adaugă un amestec bromur-bromat la soluția studiată, excesul se determină iodometric (vezi și reacția lui Falin).
Carbohidrații pot fi determinați prin oxidare cu periodat de sodiu și ulterior. titrarea agentului oxidant în exces sau a compuşilor formaţi. Au fost dezvoltate numeroase. variante ale acestei metode (vezi, de exemplu, reacția Malaprada).
Pentru a determina org. compușii peroxi (inclusiv peroxiacizii) folosesc cel mai adesea interacțiunea lor. cu KI și ulterioare titrarea I2 eliberată cu soluţie de Na2S2O3.
Analiza compușilor alcoxi constă în interacțiune. a substanței analizate cu acid iodhidric pentru a forma ioduri de alchil (vezi. metoda Zeisel). Acestea din urmă sunt determinate prin diferite metode - gravimetric (sub formă de AgI) sau titrimetric (titrare acido-bazică). Compușii carbonului pot fi determinați în mod similar. Pentru a identifica grupările alcoxi C1-C4, iodurile de alchil rezultate sunt transformate în compuși cuaternari de amoniu, care sunt analizați prin cromatografie în strat subțire sau pe hârtie.
Definiția grupărilor epoxidice se bazează pe reacția lor cu acid clorhidric pentru a forma clorhidrine; la finalizarea soluției, excesul de HCI este titrat cu soluție alcalină.
Pentru determinarea compuşilor carbonilici. (aldehide si cetone) max. este adesea folosită oxidarea, adică conversia lor în interacțiune. cu clorhidrat de hidroxilamină; HCl eliberat ca rezultat al reacției este titrat cu o soluție alcalină (punctul final al titrarii este stabilit folosind un indicator sau potențiometric). Există un număr mare de modificări ale acestei metode. Aldehidele pot fi determinate și prin soluția cu bisulfit Na urmată de. titrare acido-bazică. Mai puțin utilizate sunt aldehidele cu ioni Ag +, reacția cu hidrazine și formarea bazelor Schiff.
Chinonele sunt reduse cu clorură de Ti(III) sau sulfat V(II); excesul de agent reducător se determină titrimetric. Chinonele pot fi determinate și iodometric.
Pentru a determina compușii de carbon și sărurile acestora, max. Titrarea acido-bazică în medii neapoase este adesea utilizată.
Au fost dezvoltate un număr mare de metode pentru analiza derivaților de carbon. Anhidridele după hidroliza lor într-o soluție sunt titrate cu soluții alcaline. În cazul analizării unui amestec dintr-un acid și anhidrida acestuia, suma ambelor substanțe se determină prin titrare acido-bazică, apoi anhidrida se amestecă cu morfolina sau anilină și se titraază acizii eliberați. În acest din urmă caz, puteți determina și excesul de bază prin titrare cu soluție de HCI. Halogenurile acide sau amestecurile lor cu compuși se determină în același mod. În acest caz, în loc de soluții cu amine, se folosesc adesea interacțiuni. halogenură acidă cu alcool și ultimul. titrare separată a liberului acidul carbonic și acidul bogat în halogen eliberat cu soluție alcalină.
Determinarea esterilor de carbon se bazează pe hidroliza lor cu o soluție alcalină, excesul este titrat cu o soluție. Cantități mici de esteri sunt de obicei determinate spectrofotometric sub formă de săruri Fe(III) ale acizilor hidroxamici formate în timpul interacțiunii. esteri cu hidroxilamina.
Pentru a determina org care conțin azot. au fost propuse un număr mare de metode. Compușii capabili de reducere (nitro-, nitrozo-, ) se determină titan- sau vanadatometric: se adaugă o soluție în exces de sare Ti(III) sau V(II) și agentul reducător nereacționat este titrat cu o soluție de Fe(III) sare.
Titrarea soluției de ramie (de obicei HClO4) într-un mediu neapos este utilizată pe scară largă în determinare. Această metodă vă permite adesea să determinați separat organizația. și non-org. baze în amestecuri, precum și org. baze de putere variabilă atunci când sunt prezente împreună. Aminele pot fi determinate, ca și derivații hidroxi, prin raportul dintre acilarea lor. Pentru a determina aromatice primare. aminele sunt adesea titrate cu soluție într-un mediu acid, însoțite de formarea unui compus diazoic. O titrare similară a aminelor secundare duce la N-nitrozarea acestora și este, de asemenea, utilizată în analiză. În timpul microanalizei aromatice primare. amine, compușii diazo rezultați sunt de obicei combinați cu componentele azo corespunzătoare și colorantul rezultat este determinat spectrofotometric. În cazul analizării amestecurilor de amine primare, secundare și terțiare, titrarea cu soluție de HClO 4 este utilizată cel mai adesea în mediu neapos al amestecului inițial (toate aminele sunt titrate), amestecul după acetilarea cu anhidridă acetică (numai terțiar). aminele sunt titrate) iar amestecul după tratare cu acetilacetonă sau aldehidă salicilică (se titrează suma aminelor secundare și terțiare).
Pentru a determina sărurile de arildiazoniu cu o soluție a substanței analizate, se titrați porțiunile cântărite ale componentului azo (3-metil-1-fenil-5-pirazolonă, m-fenilendiamină etc.) sau se adaugă o soluție a componentului azo la analizat. soluție, excesul la Roiul este titrat cu soluție de NaNO 2 în mediu acid. În cazul analizei compușilor diazo, se poate folosi și gazometria. analiza bazata pe descompunerea compusului studiat. cu eliberarea de N 2, al cărui volum este măsurat. Uneori, ca și în cazul analizei aminelor, compușii diazo sunt determinați prin combinarea cu ultimele. bogat spectrofotometric. determinarea colorantului rezultat.
Hidrazinele sunt de obicei titrate iodometric. În cazul tiolilor se poate folosi și interacțiunea. acestea cu săruri de argint sau titrare acido-bazică. Org. sulfurile se oxidează cu un amestec de bromură-bromat, excesul se determină titrimetric.
Răspândit pentru calitate. și cantități. funcţional De asemenea, au fost analizate metode selective și destul de sensibile de spectroscopie IR și RMN.
Apariția analizei stereospecifice a org. in-in a 2-a repriza. Secolului 20 asociată cu dezvoltarea cromatografică metode. Pentru a separa enantiomerii, cel mai adesea se realizează o reacție preliminară între substanțele analizate și reactivii optic activi pentru a forma diastereomeri, care sunt apoi separați prin cromatografie gaz-lichid sau lichid de înaltă performanță pe coloane cu faze staționare optic active.
Analiza moleculară a org. in-in fondat ch. arr. privind utilizarea cromatografiei și altele. metode spectrale, care fac posibilă stabilirea structurii org. conexiuni.
Analiza de fază, care permite analiza calitativă și cantitativă a materialelor cristaline. formularele org conexiune, realizată folosind radiografieȘi electronografie. Raze X, analiză structurală vă permite să setați structura structurală a organizației cu mare precizie. v-va, determinați lungimile legăturilor dintre atomi și unghiurile dintre legături.
Metodele de analiză enumerate mai sus se bazează pe determinarea directă a substanțelor analizate sau a derivaților obținuți din acestea. În O. v. A. Metodele indirecte sunt, de asemenea, adesea folosite. Deci, de exemplu, compușii de carbon pot fi izolați din amestecul analizat sub formă de argint puțin solubil sau alte săruri și apoi folosind metoda de absorbție atomică. spectroscopie sau analiză de fluorescență cu raze X pentru a determina cantitatea de metal corespunzător; Pe baza rezultatelor unei astfel de analize, se poate calcula conținutul de dioxid de carbon. În cromatografia lichidă este eficientă utilizarea detectării indirecte a substanţelor separate, în care se adaugă o componentă activă la faza mobilă, formând compuşi uşor detectabili cu produşii de separare sau cu substanţele care se cromatografiază.
Metodele de analiză și echipamentele utilizate depind de sarcina specifică a lui O. v. a.: determinarea ingredientului principal al amestecului, org. sau non-org. impuritati in org. wow, org. impurități în anorganice in-ve sau analiza unui amestec complex multicomponent de in-in.
Metode O. sec. A. utilizat pe scară largă în dezvoltarea tehnologiei industriale. produs de org. produse și în procesul de producție propriu-zis pentru dezvoltarea metodelor de analiză a materiilor prime, auxiliare. în-înăuntru, între. produse în diferite stadii de producție, pentru a controla producția. proces, produse finite, ape uzate și emisii de gaze, pentru a identifica impuritățile din produsele intermediare și finale și pentru a dezvolta analiți. tehnici care asigură cinetica necesară. cercetare. În toate cazurile, este necesar să o alegeți pe cea optimă. opțiuni pentru metodele de analiză și combinațiile acestora în conformitate cu cerințele de viteză, reproductibilitate, precizie etc.
La dezvoltarea unui analit. părți de normativ și tehnic. documentatie pentru materii prime, auxiliare. materialele și produsele finite stabilesc în primul rând numărul minim necesar și suficient de analiți. indicatori. Astfel de indicatori includ punctul de topire, pH-ul, conținutul de bază. substanțe din produs, care se determină printr-o metodă directă (de obicei titrimetric folosind potențiometrie) sau indirect, prin scăderea din masa întregului produs a masei de impurități determinate prin cromatografie. (cel mai des), electrochimic. sau spectrofotometric. metode. Când utilizați funcția analiza pentru a determina principalul itemii aleg de obicei o metodă care implică determinarea acestui articol după funcție. grup format în ultima etapă a primirii acestuia. Dacă este necesar, atunci când substanța analizată este obținută prin sinteză în mai multe etape, aceasta se determină în funcție de diferite funcții. grupuri. Analist. metodele alese pentru analiza materiilor prime si a produselor finite trebuie sa aiba Ch. arr. reproductibilitate și precizie bună.
Metodele analitice utilizate în controlul producției trebuie să fie rapide și continue (de exemplu, metria redox, pHmetria, ). Baza metodelor de monitorizare a proceselor de producție este org. in-in se află adesea definiția unei funcții de dispariție. grup, adică un grup în curs de transformare la o anumită etapă de producție, ceea ce face posibilă înregistrarea cu precizie a sfârșitului etapei corespunzătoare. În acest caz, cromatografia în strat subțire, gaz-lichid, cromatografia lichidă de înaltă performanță, spectrofotometria și electrochimia sunt utilizate pe scară largă. metode, flux-injectare. analiză.
Pentru analiză vor fi intervale. titrimetria este folosită cel mai adesea pentru produsele fabricate și pentru analiza reacțiilor. amestecuri-complex cromatografic. și metode spectrale, inclusiv cromatografie în gaz-spectrometrie de masă, o combinație de cromatografia în gaz cu spectroscopie în infraroșu cu transformată Fourier.
Analiza obiectelor de mediu a căpătat o mare importanță. La elaborarea unor metode adecvate de analiză de bază cerințele pentru acestea sunt sensibilitatea ridicată și identificarea corectă a substanțelor care se determină. Aceste cerințe sunt îndeplinite prin cromatografie gazoasă-spectrometrie de masă folosind două sau mai multe faze staționare.
În clinică analiza (analiza sângelui, urinei, țesuturilor și a altor obiecte pentru conținutul de medicamente, metaboliți, steroizi, aminoacizi etc.) importantă nu este doar sensibilitatea, acuratețea și rapiditatea analizei, ci și reproductibilitatea rezultatelor acesteia. Atunci când această din urmă cerință este critică, se utilizează cromatografie gazoasă-spectrometrie de masă în condiții standard, precum și injecție cu flux de mare debit. analiză și o varietate de metode enzimatice cu selectivitate ridicată.
Lit.: Guben Weil, Metode de chimie organică, vol. 2, Metode de analiză, trad. cu el. Ed. a IV-a, M.. 1963; Cheronis N. D., Ma T. S., Micro- și semi-micro metode de analiză funcțională organică, trans. din engleză, M., 1973; Siggia S.. Hannah J. G., Analiza organică cantitativă pe grupe funcționale, trad. din engleză, M.; 1983. B. eu. Kolokolov.
Enciclopedie chimică. - M.: Enciclopedia Sovietică. Ed. I. L. Knunyants. 1988 .
Vedeți ce este „ANALIZA SUBSTANȚELOR ORGANICE” în alte dicționare:
Analiza apei este o metodă de studiere a proprietăților și calităților apei. Este folosit pentru a determina cantitatea de diferite substanțe din apă care este în contact cu oamenii în scopuri industriale și casnice sau în scopuri științifice. Cuprins 1 Tipuri de apă pentru ... ... Wikipedia
Analiza solului este un ansamblu de operații efectuate pentru a determina compoziția, proprietăți fizico-mecanice, fizico-chimice, chimice, agrochimice și biologice ale solului. Efectuați mecanice (granulometrice), chimice, ... ... Wikipedia
ANALIZA APEI- se realizeaza pentru determinarea calitatii apei si determinarea posibilitatii de utilizare a acesteia pentru alimentarea iazurilor piscicole. A.v. se desfășoară de patru ori pe an: primăvara (în timpul viiturii de primăvară), la mijlocul verii (iulie), toamna (în timpul toamnei... ... Piscicultură de iaz
analiză- ANALIZA (din greaca analiza, descompunere, dezmembrare) este procedura de impartire reala sau mentala a unui obiect, fenomen sau proces, precum si a relatiilor acestora in componente, elemente, proprietati, functii si subsisteme. Procedura... ... Enciclopedia Epistemologiei și Filosofia Științei
Identificarea (detecția) componentelor analizate și în cantități aproximative, evaluarea conținutului acestora în ape și materiale. Ca componente poate fi atomi și ioni, izotopi ai elementelor și nuclizi individuali, molecule, funcționale. grupuri si radicali... Enciclopedie chimică
Determinarea conținutului (masă, concentrație etc.) sau a cantităților. raporturile componentelor din proba analizată. Componentele determinate pot fi. atomi, molecule, izotopi, funcționali. grupuri, faze etc. (vezi Analiza elementară, Moleculară ...... Enciclopedie chimică
Instituția de învățământ „Universitatea de Stat din Brest numită după A.S. Pușkin"
Departamentul de Chimie
LUCRARE DE CURS
Metode de studiere a compușilor organici
Efectuat:
student in anul 5,
Facultatea de Biologie
specialitatea „Biologie. Chimie"
Învățământ cu normă întreagă
Petruchik Irina Alexandrovna
Consilier stiintific:
Borichevski
Alexandru Ivanovici
Brest, 2012
Metode de studiere a compușilor organici
CUPRINS
INTRODUCERE………………………………………………………………………………….. 3
- Clasificarea metodelor de studiere a substanțelor organice………. 4
Cele mai simple metode de studiere a substanțelor organice
2.1.1 Cristalizarea…………………………………………………… ……… 6
2.1.2 Sublimarea…………………………………………………………………. 7
2.1.3 Distilarea………………………………………………………………….. 8
2.1.4 Cromatografia…………………………………………… …. 9-11
2.2 Analiza substanțelor organice…………………………………………….. 12-13
- Metode fizico-chimice pentru studiul substanțelor organice... 14
3.2 Calorimetrie……………………………………………………………………………… 17
3.3 Raze X și difracția electronilor…………………………… 18-19
3.4 Metode de cercetare electrochimică………… 20-21
3.5 Spectroscopie…………………………………………………… …….. 22-27
CONCLUZIE……………………………………………………………………………………. 28
LISTA DE REFERINTE…………………………. 29
INTRODUCERE
Studiul substanțelor organice are ca scop stabilirea structurii substanței, structura sa spațială și orbitalii moleculari caracteristici, studierea interacțiunii atomilor și moleculelor și studierea vitezelor și mecanismelor reacțiilor. Datorită numărului mare de compuși organici diferiți, este imposibil să se dezvolte o singură schemă analitică, așa cum se face adesea în analiza cantitativă anorganică. Și totuși, cercetarea sistematică face posibilă identificarea materiei organice destul de fiabil și rapid.
Stabilirea structurii materiei organice este scopul principal al studiului lor, indiferent de metoda de cercetare. Cu toate acestea, interesele asociate cu studiul unuia sau altui compus organic sunt deja de altă natură. Problemele legate de resursele naturale ale planetei noastre sunt de o importanță deosebită. Știm că sursele de petrol și gaze au o importanță deosebită pentru umanitate, dar sunt limitate. Prin urmare, problema căutării de noi materii prime pentru sinteza organică și petrochimică și producerea artificială a petrolului și gazelor a devenit urgentă. Dar acesta este doar unul dintre motivele pentru studierea materiei organice. Dacă te uiți în jur, toată viața de pe Pământ este chimie organică. În consecință, studiul substanțelor organice este cheia descoperirilor globale în domeniul naturii vii, oportunitatea de a învăța toate procesele vitale, de a găsi modalități de a vindeca multe boli teribile, de a crea noi înșine materie vie etc.
- Clasificarea metodelor de studiere a substanțelor organice.
- cele mai simple metode de studiu: purificarea substantelor organice (cristalizare, sublimare, distilare, cromatografie, filtrare pe gel, electroforeza) si analiza substantelor organice (anale elementare cantitative si calitative);
- metode fizico-chimice: refractometrie, calorimetrie, măsurarea momentelor dipolului electric, radiografia și difracția electronilor, metode electrochimice (polarografie, voltametrie anodică), spectroscopie (fotoelectron, spectroscopie de masă, infraroșu etc.)
Cele mai simple metode de studiere a substanțelor organice
- Purificare organică
Pentru a caracteriza puritatea unei substanțe se folosesc următoarele constante și metode: punctul de topire, temperatura de cristalizare, punctul de fierbere, indicele de refracție a luminii, densitatea, datele spectrelor de absorbție (coeficientul de intensitate de absorbție în spectre electronice și infraroșu), rezonanță magnetică nucleară (RMN). ) date spectrale, spectrometrie de masă, analiză cromatografică, analiză luminiscentă etc.
A obține o substanță pură înseamnă a separa un anumit amestec de substanțe în substanțe individuale și a le purifica până la gradul de puritate dorit. Aici este necesar să se facă distincția între două seturi de metode: metode de separare a amestecului în componente care nu sunt încă pure și metode de purificare finală.
Când vorbim despre puritatea substanțelor chimice, trebuie să fii conștient de faptul că o substanță absolut pură poate fi imaginată doar teoretic. Nu există și nu pot fi substanțe absolut pure. În funcție de metoda de purificare, substanța conține o anumită cantitate de impurități. Metodele convenționale de purificare pot atinge un conținut de substanță principală de 99,9...99,95%. Folosind metode speciale de curățare profundă, este posibilă reducerea conținutului de impurități al substanțelor organice la 10 -3 ....10 -4%
2.1.1 Cristalizarea
Cristalizarea este o metodă clasică de purificare a substanțelor cristaline. Metoda se bazează pe faptul că diferite substanțe au solubilități diferite într-un anumit solvent, iar o scădere a temperaturii (cu rare excepții) duce la o scădere a solubilității substanțelor. Prin filtrarea soluției fierbinți se separă impuritățile insolubile, iar după răcire, substanța este eliberată din soluție sub formă de cristale. Recristalizările repetate reduc de obicei cantitatea de impurități. O variantă a metodei este cristalizarea în topitură. O opțiune specială – topirea zonei – este utilizată pentru purificarea profundă a substanțelor.
De exemplu: trebuie să curățăm acidul salicilic de impurități. Pentru a face acest lucru, luăm o masă pre-cântăritată a acestui acid și calculăm volumul necesar de solvent - apă, pentru a obține o soluție saturată, care poate fi ulterior cristalizată.
2.1.2 Sublimare (sublimare)
Multe substanțe cristaline au capacitatea de a sublima, adică. la trecerea la faza gazoasă, ocolind faza lichidă, urmată de cristalizarea din faza gazoasă. Această metodă vă permite să separați substanțele sublimante de impuritățile nesublimante și să separați un amestec de substanțe cu temperaturi de sublimare sau temperaturi de cristalizare diferite de faza gazoasă (sublimare în gradient). Dacă substanțele sunt greu de sublimat și de descompus la temperaturi ridicate, sublimarea este utilizată în vid sau vid înalt - până la 0,0013 Pa (10 -5 mm Hg; 1 mm Hg = 133,3 Pa). Sublimarea cu vid înalt în diferite versiuni este utilizată pentru curățarea în profunzime.
Purificarea unui solid prin sublimare este posibilă numai dacă presiunea de vapori a acestuia este mai mare decât presiunea de vapori a impurităților. Când presiunea de vapori a solidului se potrivește cu presiunea aplicată, se obțin cele mai bune rezultate.
De exemplu: E-stilbenul este sublimat la o temperatură de 100 o C și o presiune de 20 mm Hg. Artă.
2.1.3 Distilarea (distilarea)
Pentru multe substanțe cu punct de topire scăzut și pentru majoritatea lichidelor, o metodă bună de curățare este
Distilarea fracționată, cu condiția ca diferența de puncte de fierbere a componentelor amestecului să fie suficient de mare și să nu se formeze amestecuri azeotrope. Selectivitatea (eficiența) distilării fracționate poate fi mărită cu dispozitive speciale: condensatoare de reflux, coloane de distilare etc. Pentru substanțele cu punct de fierbere ridicat se utilizează distilare în vid. O variantă a metodei este distilarea sistemelor cu două componente, care se separă la răcire, de exemplu, distilarea cu abur: limonenul (bp 178 o C la 760 mm Hg) este distilat cu apă (bp 100 o C la 760 mm Hg Art. .) la o temperatură de 98 o C. În acest caz, raportul cantitativ în distilat (în grame) de limonen: apă este de 1: 1,54.
2.1.4 Cromatografia
Metodele de separare cromatografică se bazează pe capacitatea diferită a substanțelor de a fi adsorbite pe suprafața sorbantului sau distribuite între două faze nemiscibile (lichid-lichid, lichid-gaz), dintre care o fază (lichid) este situată pe suprafața sorbent. Prin urmare, există diferite tipuri de cromatografie și anume: cromatografia de adsorbție și partiție lichidă, cromatografia în gaz.
Cromatografia de adsorbție lichidă se bazează pe capacitatea diferită a substanțelor de a fi absorbite pe suprafața sorbantului și desorbite la trecerea unui solvent - eluant. Ca absorbanți se folosesc oxid de aluminiu, acid silicic și dioxid de siliciu (silicagel), polizaharide granulare (dextrans) sau alți polimeri, care se umflă într-un solvent, formând un gel granular (cromatografie pe gel).
Cromatografia de partiție cu lichid este un tip de cromatografia de adsorbție în care adsorbantul (purtător) este acoperit cu o peliculă subțire de lichid. Eluentul este de obicei un solvent care nu se amestecă cu lichidul de pe sorbent. Când eluentul este trecut, substanțele sunt distribuite între faza lichidă și eluent. Acest tip de cromatografie este cel mai potrivit pentru separarea substanțelor care sunt foarte solubile în apă sau capabile să formeze săruri solubile în apă. Astfel de substanțe includ zahăr, aminoacizi, mulți coloranți organici, majoritatea alcaloizilor, acizi mono- și policarboxilici, alcooli etc.
Un exemplu de cromatografie lichidă a unui amestec de standarde fosfolipide sintetice (1) și o probă dintr-un extract lipidic brut din membrana celulară a eritrocitelor umane (2) pe o coloană de fază normală atunci când este detectată cu un detector de împrăștiere a luminii laser.NL - neutru lipide; PE – fosfatidiletanolamină; PS – fosfatidilserina; PC – fosfatidilcolină; SM – sfingomielină.
Cromatografia gazoasă este utilizată pentru a separa amestecuri de substanțe lichide și solide gazoase sau foarte volatile. Principiul metodei este similar cu cromatografia lichidă. Amestecul de separat este diluat cu un gaz purtător (H2, N2, He) şi introdus în coloane de adsorbţie. Gazul purtător este atât un solvent, cât și un eluent. Pulberile fine din materiale silicate, care pot fi pure (cromatografia de adsorbție în gaz) sau acoperite cu o peliculă de lichid nevolatil (cromatografia gaz-lichid), sunt utilizate ca adsorbanți. Se folosesc și capilare acoperite în interior cu o peliculă de lichid nevolatil (cromatografie capilară). Gazul purtător desorbește treptat componentele amestecului și îl duce cu el. Prezența substanțelor organice în gazul purtător și cantitatea acestora este detectată cu ajutorul unor detectoare speciale și înregistrată de un înregistrator. În cromatografia preparativă, gazul purtător este apoi trecut prin receptori speciali în care substanțele organice sunt captate prin congelare.
Această metodă poate realiza separarea completă a amestecului. La utilizarea coloanelor de adsorbție de mare putere, metoda este utilizată ca metodă preparativă pentru separarea unor cantități mici de substanțe (1...10 g).
Exemplu de cromatografie gazoasă: analiza de mare viteză a vaporilor explozivi pe o coloană policapilară la o temperatură de 170°C.
O coloană policapilară cu o lungime de numai 22 cm vă permite să detectați și să identificați urme de vapori explozivi în 2,5 minute: 1 - 2,6-dinitrotoluen, 2 - 2,4-dinitrotoluen. 3-2,4,6-trinitrotoluen, 4-3,4,5-trinitrotoluen, 5-2,3,4-trinitrotoluen, 6-hexogen. 7 - tetril.
- Analiza materiei organice
Prima sarcină este determinarea calitativă și cantitativă a compoziției elementare. Apoi, conform datelor analizei elementare, se calculează cea mai simplă formulă rezumativă, se determină greutatea moleculară și se calculează adevărata formulă moleculară brută. În cele din urmă, pasul final este determinarea structurii moleculare. În acest scop se folosesc metode chimice (clivaj gradat, derivare), iar recent sunt folosite din ce în ce mai mult metode fizico-chimice (spectroscopie de masă, analiză cu difracție de raze X, spectroscopie).
Analiza elementară cantitativă și calitativă
Metodele analitice se bazează pe descompunerea completă a materiei organice ca urmare a oxidării sau alte mijloace și determinarea elementelor chimice prin metode cunoscute. Carbonul se determină sub formă de CO 2, hidrogen - sub formă de H 2 O, azot - prin măsurarea volumului de N 2 sau determinarea NH 3 sau NaCN (în funcție de tipul de scindare), halogeni - sub formă de ioni de halogenură, sulf - sub formă de ion sulfat sau sulfură, fosfor adică ion fosfat etc.
Carbonul și hidrogenul se determină calitativ prin încălzire cu CuO:
CnH2n +3nCuO>nCO2+nH2O+3nCu
Iar monoxidul de carbon eliberat este detectat prin trecerea gazului în soluția de Ba(OH) 2, iar apa este detectată vizual pe pereții eprubetei.
Azotul, sulful și halogenii sunt determinați calitativ prin fuziune cu sodiu. NaCN, Na2S și halogenurile de sodiu rezultate sunt detectate în soluție apoasă prin reacții analitice convenționale.
Există probe speciale pentru analiza cantitativă a compușilor organici. Anterior, se foloseau de obicei instalații pentru macroanaliza (proba cântărită 0,2 ... 0,5 g). În zilele noastre, sunt comune diverse aparate pentru microanalize (proba 0,001 ... 0,01 g), pentru ultramicroanalize (proba 10 -5 ... 10 -4 g). Pentru determinarea cantitativă a carbonului și hidrogenului se folosesc dispozitive în care materia organică este arsă într-un curent de oxigen: CO 2 este captat cu o soluție de KOH, iar H 2 O cu un absorbant special și se determină prin cântărire. Pentru cuantificarea azotului, substanța este arsă când este încălzită cu CuO și volumul de gaz eliberat este măsurat într-un azometru peste o soluție de KOH. Halogenii și sulful sunt cuantificați prin arderea probei într-o atmosferă de oxigen, dizolvarea gazelor în apă și titrarea ionilor de halogenură sau sulfat.
Microanalizatoarele automate au fost dezvoltate folosind principiul cromatografiei gazoase, în care se determină simultan carbonul, hidrogenul, azotul și sulful.
Greutatea moleculară a unui compus este de obicei determinată prin spectrometrie de masă.
- Metode fizico-chimice pentru studiul substanțelor organice
- Metode spectrale și alte metode optice;
Metode electrochimice;
Metode cromatografice de analiză.
Un grup de metode electrochimice de analiză, bazate pe măsurarea conductivității electrice, potențialelor și a altor proprietăți, include metode de conductometrie, potențiometrie, voltametrie etc.
Dar pentru a verifica cu exactitate eficiența mai bună a acestor metode și importanța lor practică reală, să luăm în considerare alte metode fizico-chimice pentru comparație.
- Refractometrie
, unde n este indicele de refracție al luminii pentru linia D de sodiu (589 nm); M este greutatea moleculară a substanței; ?? – densitatea.
Refracția moleculară are proprietăți aditive, adică refracția moleculară a unei molecule se poate obține prin însumarea refracțiilor părților constitutive ale moleculei. Astfel de componente sunt legături chimice și un set de legături și atomi. Aceste refracții sunt calculate din studiile multor compuși organici și pot fi găsite în cărțile de referință. De exemplu:
RCH4 = 4RCH-H; RCH3N02 = 3 R C-H +R C-N +R N02
Fenomenul de refracție a luminii este asociat cu polarizabilitatea sistemului electronic de molecule. Sub influența câmpului electromagnetic al luminii, are loc polarizarea moleculelor, în principal a sistemelor lor electronice. Cu cât sistemul electronic al unei molecule este mai mobil, cu atât este mai mare indicele de refracție al luminii și al refracției moleculare.
Studiile de refracție moleculară pot fi utilizate pentru a determina structura unui compus. Astfel, pentru compusul studiat se determină experimental refracția moleculară și se compară cu refracția obținută prin însumarea refracțiilor legăturilor conform formulei structurale propuse. Dacă rezultatele coincid, atunci structura poate fi considerată dovedită; dacă nu, atunci trebuie să căutăm o altă structură. În unele cazuri, se observă o creștere puternică a refracției moleculare în comparație cu cea așteptată (exaltarea refracției). Acest lucru este tipic pentru sistemele cuplate.
Valorile de refracție moleculară ale legăturilor chimice, atomilor, moleculelor și ionilor pot fi utilizate pentru a evalua calitativ polarizabilitatea acestora. Polarizabilitatea unei molecule (ion, legătură) este capacitatea sa de a polariza, adică. la o modificare a poziţiei nucleelor şi a stării norului de electroni sub influenţa unui câmp electric extern. Are loc în principal polarizarea electronică.
3.2 Calorimetrie
Calorimetria este o metodă de studiere a efectelor termice ale reacțiilor chimice și ale proceselor de tranziție de fază (de exemplu, topire, cristalizare, sublimare, condensare). Procesul (reacția) se realizează în aparate speciale - calorimetre și se cuantifică căldura degajată sau absorbită.
Căldura molară de ardere a substanțelor se determină calorimetric. La rândul său, căldura de ardere (W) este utilizată pentru a calcula căldura de formare a unei substanțe E sau entalpia standard de formare? H 0. Căldura de formare a unei substanțe poate fi calculată pe baza elementelor în stare atomică sau din elemente în stare „standard” (carbon sub formă de grafit, hidrogen gazos etc.), și valorile numerice rezultate, desigur, diferă. Când luați în considerare datele tabelare, trebuie să acordați o atenție deosebită acestui lucru. De obicei, căldura de formare a substanțelor pentru un proces este calculată din atomii elementelor și ?H 0 - din elementele în starea „standard”. De exemplu, căldura de formare a hidrocarburilor din atomi:
- nS - ] – W, unde W este căldura de ardere; - căldura de formare a CO 2 (393,5 kJ/mol); - căldura de formare a apei (285,8 kJ/mol); S – căldură de atomizare (sublimare) a carbonului (grafit) (-715 kJ/mol); - căldura de atomizare (disociere) a unei molecule de hidrogen (-436 kJ/mol).
Cu cât căldura de ardere este mai mică, cu atât căldura de formare a compușilor de aceeași compoziție este mai mare.
Această metodă servește în principal la compararea și caracterizarea stabilității și reactivitatii compușilor organici.
3.3 Radiografia și difracția electronilor
Metoda razelor X - analiza difracției cu raze X - se bazează pe difracția razelor X într-un cristal al unei substanțe. Razele X (radiația electromagnetică cu o lungime de undă de 0,1-10 nm) atunci când trec printr-un cristal interacționează cu învelișurile electronice ale atomilor. Ca urmare a acestei interacțiuni, are loc difracția razelor X și se obține un model de difracție pe filmul fotografic - pete sau cercuri. Din modelul de difracție, cu ajutorul unor calcule complexe, se obțin informații despre plasarea moleculelor în celula unitară a unui cristal și despre distanțele dintre atomi și unghiurile dintre legăturile chimice. Cu cât numărul de electroni dintr-un atom este mai mic, cu atât reflexiile razelor X sunt mai slabe. Prin urmare, este foarte dificil să se determine locația atomilor de hidrogen.
Metoda difracției de electroni este similară cu metoda cu raze X și se bazează pe interacțiunea unui flux de electroni cu o substanță. Fluxul de electroni care trece printr-o substanță seamănă cu radiația electromagnetică cu o lungime de undă foarte scurtă și produce un model de difracție. Aceste modele de difracție (modele de difracție a electronilor) pot fi obținute pentru substanțe în stare gazoasă sau pentru pelicule foarte subțiri. Difracția electronilor este cauzată de interacțiunea electronilor cu nucleele atomice.
Aceste metode de analiză structurală fac posibilă determinarea structurii complete a moleculei - distanțe interatomice, unghiuri între legături, i.e. aranjarea spațială exactă a tuturor atomilor unei molecule într-o rețea cristalină sau în stare gazoasă. Structura unor substanțe naturale complexe precum zaharoza, penicilina, stricnina, vitamina B 12, unele proteine (mioglobina) și acizii nucleici a fost determinată folosind analiza de difracție cu raze X.
Din metodele de cercetare cu raze X, s-a constatat că raza covalentă a atomilor în timpul hibridizării sp 2 - și sp variază în funcție de tipul de legătură, de exemplu, în legătura dublă C=C (C sp2 - C sp2), raza covalentă a atomului de carbon C sp2 este mai mică decât în legăturile =C-C (C sp2 - C sp3). În primul caz este de 0,067 nm, în al doilea - 0,076 nm, iar în cazul benzenului - 0,0695 nm, i.e. Lungimea legăturii depinde și de compusul în sine, iar pentru fiecare compus lungimile legăturilor sunt o caracteristică individuală, care poate fi utilă în identificarea unui compus organic specific.
3.4 Metode de cercetare electrochimică
Metodele electrochimice se bazează pe dependența intensității curentului de tensiunea aplicată atunci când curentul trece printr-o soluție în electrolizoare special concepute. Ca urmare, apar curbele curent-tensiune (potenţial). Aceste curbe curent-tensiune caracterizează procesele care au loc pe electrozi. Reducerea electrochimică are loc la caoted, iar oxidarea electrochimică are loc la anod. În funcție de tipul procesului studiat (anodic sau catodic), se folosesc dispozitive care diferă în raportul dintre suprafețele electrozilor, materialul electrodului etc.
Polarografie
Metoda polarografică se bazează pe procese catodice (adăugarea unui electron la o substanță pe un electrod cu picături de mercur). Schema de circuit a unui polarograf este foarte simplă. Constă dintr-un microelectrod de mercur cu picurare, cu o suprafață reînnoită continuu și un electrod de referință (mercur sau alt electrod normal). Zona catodului este semnificativ mai mică decât zona anodului, astfel încât procesele de polarizare a catodului sunt decisive în acest caz. Substanța organică difuzează către catod și acceptă un electron, iar catodul se depolarizează. Depolarizarea catodului începe la un anumit potențial E ext (reducere sau eliberare potențial caracteristic unui anumit depolarizator. Ca urmare, începe electroliza și puterea curentului crește brusc. Odată cu creșterea treptată a tensiunii, o anumită valoare staționară a puterii curentului se stabileste (curent limitator), care nu mai depinde de cresterea tensiunii.
Polarografia poate fi utilizată pentru a caracteriza procesul:
Metoda polarografiei este utilizată pe scară largă pentru a determina concentrația substanțelor în soluții.
Voltametrie anodica
Această metodă se bazează pe procese anodice (oxidarea unui compus organic pe un anod de platină sau grafit). Din punct de vedere experimental, această metodă este similară cu polarografia.
Voltmetria anodică este utilizată pentru studiul proceselor de oxidare:
Metoda este utilizată și pentru determinarea cantitativă a substanțelor din soluții.
3.5 Spectroscopie
Metodele spectroscopice se bazează pe interacțiunea unei substanțe cu radiația electromagnetică, care determină absorbția radiației sau emisia acesteia. Interacțiunea este posibilă într-o gamă foarte largă de unde electromagnetice, începând cu razele? și terminând cu undele radio.
În funcție de regiunea spectrului electromagnetic, se folosesc diverse metode și instrumente experimentale.
Cele mai frecvent utilizate câmpuri de radiații electromagnetice în chimia organică sunt:
- regiunea ultravioletă (UV) și vizibilă a spectrului, unde este absorbită energia necesară pentru a excita electronii din moleculă (un tip de spectroscopie electronică);
- regiunea infraroșu (IR), unde este absorbită energia necesară schimbării stărilor vibraționale ale moleculei (spectroscopie vibrațională);
- regiunea radiațiilor de radiofrecvență, unde energia este cheltuită pentru a reorienta spin-urile nucleelor (spectroscopie de rezonanță magnetică nucleară - RMN).
Metodele spectrale sunt utilizate pentru identificarea și stabilirea structurii compușilor, analiza amestecurilor și, de asemenea, permite monitorizarea progresului transformărilor chimice. Avantajul metodelor spectrale este consumul redus de substanță (1 mg sau mai puțin).
Spectroscopie electronică
Spectrul electronic apare atunci când o substanță absoarbe radiația ultravioletă (lungimi de undă 22-400 nm) și vizibilă (400-800 nm). Nu există nicio diferență fundamentală între aceste părți ale spectrului; ele diferă doar prin aceea că undele cu o lungime de 400-800 nm sunt percepute de ochiul uman și vedem substanța colorată.
Sub influența luminii UV, molecula este excitată, adică. tranziția electronilor la un nivel mai excitat și redistribuirea densității electronilor în moleculă. Electronii care formează legăturile p sunt cel mai greu de excitat; electronii legăturilor p și perechile singure de electroni sunt mai ușor de excitat.
Trimiteți-vă munca bună în baza de cunoștințe este simplu. Utilizați formularul de mai jos
Studenții, studenții absolvenți, tinerii oameni de știință care folosesc baza de cunoștințe în studiile și munca lor vă vor fi foarte recunoscători.
postat pe http://www.allbest.ru/
Caracteristici ale analizei compușilor organici:
Reacțiile cu substanțele organice decurg lent cu formarea de produse intermediare.
Substanțele organice sunt termolabile și se carbonizează atunci când sunt încălzite.
Analiza farmaceutică a substanțelor medicinale organice se bazează pe principiile analizei funcționale și elementare.
Analiza functionala - analiza pe grupe functionale, i.e. atomi, grupuri de atomi sau centre de reacție care determină proprietățile fizice, chimice sau farmacologice ale medicamentelor.
Analiza elementară este utilizată pentru a testa autenticitatea substanțelor medicinale organice care conțin atomi de sulf, azot, fosfor, halogeni, arsen și metale în moleculă. Atomii acestor elemente se găsesc în compușii medicinali organoelementali în stare neionizată; o condiție necesară pentru testarea autenticității lor este mineralizarea prealabilă.
Acestea pot fi substanțe lichide, solide și gazoase. Compușii gazoși și lichizi au în principal un efect narcotic. Efectul este redus de F - Cl - Br - I. Derivații de iod au în principal efect antiseptic. conexiune C-F; C-I; C-Br; C-Cl este covalent, deci pentru analiza farmaceutică se folosesc reacții ionice după mineralizarea substanței.
Autenticitatea preparatelor din hidrocarburi lichide halogenate este determinată de constantele fizice (punctul de fierbere, densitatea, solubilitatea) și prezența halogenului. Cea mai obiectivă metodă este de a stabili autenticitatea prin identitatea spectrelor IR ale medicamentului și a probelor standard.
Pentru a demonstra prezența halogenilor într-o moleculă se utilizează testul Beilstein și diverse metode de mineralizare.
Tabelul 1. Proprietățile compușilor care conțin halogen
|
Chlorethyl Aethylii cloridum (INN Clorura de etil) |
Ftorotan 1,1,1-trifluor-2clor-2-brometan (INN Halothane) |
Bromcampfor 3-brom-1,7,7,trimetilbicicloheptanonă-2 |
|
|
Lichidul este transparent, incolor, ușor volatil, cu un miros deosebit, puțin solubil în apă și miscibil cu alcool și eter în orice raport. |
Lichidul este incolor, transparent, greu, volatil, cu miros caracteristic, ușor solubil în apă, miscibil cu alcool, eter și cloroform. |
Pulbere cristalină albă sau cristale incolore, miros și gust, foarte puțin solubilă în apă, ușor în alcool și cloroform. |
|
|
Bilignostum pro injectionibus Bilignost Acid bis-(2,4,6-triiodo-3-carboxianilid) adipic |
Bromizat 2-bromoizovalerianil-uree |
||
|
Pulbere cristalina alba, gust usor amar, practic insolubila in apa, alcool, cloroform. |
Pulbere cristalină albă sau cristale incolore cu miros specific slab, ușor solubile în apă, solubile în alcool. |
Testul Beilstein
Prezența halogenului este dovedită prin calcinarea substanței în stare solidă pe un fir de cupru. În prezența halogenilor, se formează halogenuri de cupru, care colorează flacăra verde sau albastru-verde.
Halogenii dintr-o moleculă organică sunt legați printr-o legătură covalentă, al cărei grad de rezistență depinde de structura chimică a derivatului de halogen; prin urmare, sunt necesare diferite condiții pentru eliminarea halogenului și transferul acestuia într-o stare ionizată. Ionii de halogenură rezultați sunt detectați prin reacții analitice convenționale.
cloroetil
· Metoda de mineralizare - fierbere cu o soluție alcoolică de alcali (având în vedere punctul de fierbere scăzut, determinarea se efectuează cu un condensator de reflux).
CH3CH2CI+KOH c KCI +C2H5OH
Ionul de clorură rezultat este detectat cu o soluție de azotat de argint prin formarea unui precipitat alb de brânză.
Cl- + AgNO 3 > AgCl + NO 3 -
Ftorotan
· Metoda de mineralizare - fuziune cu sodiu metalic
F3C-CHClBr + 5Na + 4H2O> 3NaF + NaCl + 2NaBr + 2CO2
Ionii de clorură și bromură rezultați sunt detectați printr-o soluție de azotat de argint prin formarea de precipitate albe de brânză și gălbui.
Ionul de fluor este dovedit prin reacții:
Reacție cu o soluție de roșu alizarina și o soluție de nitrat de zirconiu, în prezența F-, culoarea roșie se transformă în galben deschis;
Interacțiunea cu sărurile de calciu solubile (se formează un precipitat alb de fluorură de calciu);
Reacția de decolorare a tiocianatului de fier (roșu).
· Când se adaugă la fluorotan conc. H2SO4, medicamentul se află în stratul inferior.
Bromizat
· Metoda de mineralizare - fierbere cu alcali (hidroliza alcalina in solutie apoasa), apare miros de amoniac:
· Incalzire cu conc. acid sulfuric - miros de acid izovaleric
Bromcampfor
· Metoda de mineralizare folosind metoda de mineralizare prin reducere (cu zinc metalic în mediu alcalin)
Ionul de bromură este determinat prin reacția cu cloramina B.
Bilignost
· Metoda de mineralizare - încălzire cu acid sulfuric concentrat: se remarcă apariţia vaporilor violet de iod molecular.
· Spectroscopie IR - o soluție de 0,001% de medicament într-o soluție de hidroxid de sodiu 0,1 N în intervalul de la 220 la 300 nm are un maxim de absorbție la l = 236 nm.
Iodoform
Metode de mineralizare:
1) piroliza într-o eprubetă uscată, se eliberează vapori de iod violet
4CHI 3 + 5O 2 > 6I 2 + 4CO 2 + 2H 2 O
2) incalzire cu conc. acid sulfuric
2CHI 3 + H 2 SO 4 > 3I 2 + 2CO 2 + 2H 2 O + SO 3
Calitate bună (puritatea hidrocarburilor halogenate).
Calitatea cloretilului și fluorotanului se verifică prin stabilirea acidității sau alcalinității, absenței sau conținutului acceptabil de stabilizatori (timol în fluorotan - 0,01%), impurități organice străine, impurități de clor liber (brom în fluorotan), cloruri, bromuri și non- reziduu volatil.
1) Cloroetil: 1. Determinați punctul de fierbere și densitatea,
2. Impuritate inacceptabilă a alcoolului etilic (reacție de formare a iodoformului)
2) Bilignost: 1. Încălzirea cu kH 2 SO 4 şi formarea vaporilor violet I 2
2. Spectroscopie IR
3) Ftorotan: 1. Spectroscopie IR
2. punctul de fierbere; densitate; indicele de refracție
3. nu ar trebui să existe impurități Cl- și Br-
GF nu prevede determinarea cantitativă a cloretilului, dar poate fi efectuată prin argentometrie sau mercurimetrie.
Metoda de determinare cantitativă este titrarea argentometrică inversă conform lui Volhard după mineralizare (pentru reacție, vezi definiția autenticității).
1. Reacția înainte de titrare:
titrare cu cloroetil medicinal farmaceutic
NaBr + AgNO3 > AgBrv+ NaNO3
2. Reacția de titrare:
AgN03 + NH4SCN > AgSCN v + NH4NO3
3. La punctul de echivalență:
3NH4SCN + Fe(NH4)(S04)2 >
Metoda de determinare cantitativă este titrarea argentometrică conform lui Kolthoff după mineralizare (pentru reacții, vezi definiția autenticității).
1. Reacția înainte de titrare:
3NH 4 SCN + Fe(NH 4)(SO 4) 2 > Fe (SCN) 3 + 2 (NH 4) 2 SO 4
cantitatea exactă roșu maronie
2. Reacția de titrare:
NaBr + AgNO3 > AgBrv+ NaNO3
3. La punctul de echivalență:
AgN03 + NH4SCN > AgSCNv + NH4NO3
albire
Bilignost
Metoda de determinare cantitativă este iodometria indirectă după scindarea oxidativă a bilignost-ului la iod atunci când este încălzit cu o soluție de permanganat de potasiu într-un mediu acid, excesul de permanganat de potasiu este îndepărtat folosind azotat de sodiu și pentru a îndepărta excesul de acid azot, se adaugă o soluție de uree la amestecul.
Titrant - 0,1 mol/l soluție de titsulfat de sodiu, indicator - amidon, la punctul de echivalență se observă dispariția culorii albastre a amidonului.
Schema de reactie:
t; KMn04 +H2S04
RI 6 > 12 IO 3 -
Reacția de eliberare a substituentului:
KIO 3 + 5KI + 3H 2 SO 4 >3I 2 + 3K 2 SO 4 + 3H 2 O
Reacția de titrare:
I 2 +2Na 2 S 2 O 3 > 2NaI+Na 2 S 4 O 6
Iodoform
Metoda de determinare cantitativă este titrarea argentometrică inversă conform lui Volhard după mineralizare.
Mineralizare:
CHI 3 + 3AgNO 3 + H 2 O > 3AgI + 3HNO 3 + CO 2
Reacția de titrare:
AgN03 + NH4SCN > AgSCN v + NH4NO3
La punctul de echivalență:
3NH 4 SCN + Fe(NH 4)(SO 4) 2 > Fe (SCN) 3 v + 2 (NH 4) 2 SO 4
Depozitare
Cloroetil în fiole într-un loc răcoros, întunecat, ftorotan și bilignost în sticle de sticlă portocalie, la loc răcoros, uscat, ferit de lumină. Bromcampforul este depozitat în sticle de sticlă portocalie, într-un loc răcoros și uscat.
Cloretil este folosit pentru anestezie locală, fluorotan pentru anestezie. Bromcampforul este folosit ca sedativ (uneori pentru a opri lactația). Bromizovalul este un hipnotic; bilignost este utilizat ca agent de radiocontrast sub formă de amestec de săruri în soluție.
Literatură
1. Farmacopeea de Stat a URSS / Ministerul Sănătăţii al URSS. - X ed. - M.: Medicină, 1968. - S. 78, 134, 141, 143, 186, 373.537
2. Farmacopeea de stat a URSS Vol. 1. Metode generale de analiză. Materii prime plante medicinale / Ministerul Sănătății al URSS. - Ed. a 11-a, add. - M.: Medicină, 1989. - S. 165-180, 194-199
3. Material de curs.
4. Chimie farmaceutică. În 2 ore: manual / V. G. Belikov - ed. a IV-a, revăzută. si suplimentare - M.: MEDpress-inform, 2007. - P. 178-179, 329-332
5. Ghid pentru clasele de laborator de chimie farmaceutică. Editat de A.P. Arzamastseva, p.152-156.
Postat pe Allbest.ru
Anexa 1
Articole din farmacopee
Bilignost
Acid bis-(2,4,6-triiodo-3-carboxianilid) adipic
C 20 H 14 I 6 N 2 O 6 M. c. 1139,8
Descriere. Pulbere cristalină fină albă sau aproape albă, cu gust ușor amar.
Solubilitate. Practic insolubil în apă, alcool 95%, eter și cloroform, ușor solubil în soluții de alcalii caustici și amoniac.
Autenticitate. 0,001% soluție de medicament în 0,1 N. soluția de sodă caustică în regiunea de la 220 la 300 nm are un maxim de absorbție la o lungime de undă de aproximativ 236 nm.
Când 0,1 g de medicament este încălzit cu 1 ml de acid sulfuric concentrat, se eliberează vapori de iod violet.
Culoarea soluției. 2 g de medicament se dizolvă în 4 ml de 1 N. soluție de hidroxid de sodiu, se filtrează și se spală filtrul cu apă până se obțin 10 ml de filtrat. Culoarea soluției rezultate nu trebuie să fie mai intensă decât standardul nr. 4b sau nr. 4c.
Testați cu peroxid de hidrogen. La 1 ml din soluția rezultată se adaugă 1 ml peroxid de hidrogen; nu ar trebui să apară tulburări în decurs de 10-15 minute.
Compuși cu o grupare amino deschisă. 1 g de medicament este agitat cu 10 ml de acid acetic glacial și filtrat. La 5 ml de filtrat limpede se adaugă 3 picături de 0,1 mol soluție de azotat de sodiu. După 5 minute, culoarea care apare nu trebuie să fie mai intensă decât standardul nr. 2g.
Aciditate. 0,2 g de medicament se agită timp de 1 minut cu apă clocotită (de 4 ori câte 2 ml fiecare) și se filtrează până se obține un filtrat limpede. Titrez filtratele combinate! 0,05 n. soluție de hidroxid de sodiu (indicator de fenolftaleină). Pentru titrare nu trebuie utilizat mai mult de 0,1 ml de 0,05 N. soluție de sodă caustică.
Cloruri. Se agită 2 g de medicament cu 20 ml apă și se filtrează până se obține un filtrat limpede. 5 ml de filtrat, adus la 10 ml cu apă, trebuie să treacă testul pentru cloruri (nu mai mult de 0,004% în preparat).
Fosfor. 1 g de medicament se pune într-un creuzet și se cenuşează până se obține un reziduu alb. La reziduu se adaugă 5 ml de acid azotic diluat și se evaporă la sec, după care reziduul din creuzet se amestecă bine cu 2 ml apă fierbinte și se filtrează într-o eprubetă printr-un filtru mic. Crezetul și filtrul se spală cu 1 ml apă fierbinte, colectând filtratul în aceeași eprubetă, apoi se adaugă 3 ml soluție de molibdat de amoniu și se lasă timp de 15 minute într-o baie la o temperatură de 38-40 °. poate avea o culoare gălbuie, dar trebuie să rămână transparent (nu mai mult de 0,0001% în medicament).
Monoclorură de iod. Se agită 0,2 g de medicament cu 20 ml apă și se filtrează până se obține un filtrat limpede. La 10 ml de filtrat se adaugă 0,5 g de iodură de potasiu, 2 ml de acid clorhidric și 1 ml de cloroform. Stratul de cloroform trebuie să rămână incolor.
Fier. 0,5 g de medicament trebuie să treacă testul pentru fier (nu mai mult de 0,02% în medicament). Comparația se efectuează cu un standard preparat din 3,5 ml soluție standard B și 6,5 ml apă.
Cenușa de sulfat de la 1 g de medicament nu trebuie să depășească 0,1%.
Metale grele. Cenușa sulfatată din 0,5 g de medicament trebuie să treacă testul pentru metale grele (nu mai mult de 0,001% în medicament).
Arsenic. 0,5 g de medicament trebuie să treacă testul pentru arsenic (nu mai mult de 0,0001% în medicament).
Cuantificare. Aproximativ 0,3 g de medicament (cântărit exact) se pun într-un balon cotat de 100 ml, se dizolvă în 5 ml soluție de hidroxid de sodiu, se adaugă apă până la semn și se amestecă. 10 ml din soluția rezultată se pun într-un balon cu o capacitate de 250 ml, se adaugă 5 ml dintr-o soluție 5% de permanganat de potasiu și, cu grijă, de-a lungul pereților balonului, în timp ce se agită, 10 ml acid sulfuric concentrat, 0,5 -1 ml fiecare, se adauga si se lasa 10 minute. Se adauga apoi incet, 1 picatura dupa 2-3 secunde, amestecand puternic. soluție de nitrit de sodiu până când lichidul devine decolorat și dioxidul de mangan se dizolvă. După aceasta, adăugați imediat 10 ml dintr-o soluție de uree 10% și amestecați până când bulele dispar complet, în timp ce spălați nitritul de sodiu de pe pereții balonului. Apoi se adaugă la soluție 100 ml de apă, 10 ml dintr-o soluție de iodură de potasiu proaspăt preparată, iar iodul eliberat este titrat cu 0,1 N. soluție de tiosulfat de sodiu (indicator - amidon).
1 ml 0,1 n. Soluția de tiosulfat de sodiu corespunde la 0,003166 g C 20 H 14 l 6 N 2 0 6, care trebuie să fie de cel puțin 99,0% în preparat.
Depozitare. Lista B. În borcane de sticlă portocalie, ferite de lumină.
agent de contrast cu raze X.
Iodoform
Triiodometan
СНI 3 М.в. 393,73
Descriere. Mici cristale lamelare strălucitoare sau pulbere cristalină fină de culoare galben-lămâie, miros persistent caracteristic ascuțit. Volatil deja la temperaturi obișnuite, este distilat cu vapori de apă. Soluțiile medicamentului se descompun rapid sub influența luminii și a aerului, eliberând iod.
Solubilitate. Practic insolubil în apă, puțin solubil în alcool, solubil în eter și cloroform, ușor solubil în glicerol. uleiuri esentiale si grase.
Autenticitate, 0,1 g de medicament sunt încălzite într-o eprubetă pe flacăra arzătorului; se eliberează vapori de iod violet.
Punct de topire 116--120° (cu descompunere).
Coloranți. 5 g de medicament se agită energic timp de 1 minut cu 50 ml apă și se filtrează. Filtratul trebuie să fie incolor.
Aciditate sau alcalinitate. La 10 ml de filtrat se adaugă 2 picături de soluție de albastru de bromotimol. Culoarea galben-verde care apare ar trebui să devină albastră cu adăugarea a cel mult 0,1 ml de 0,1 N. soluție de sodă caustică sau galbenă prin adăugarea a cel mult 0,05 ml de 0,1 N. soluție de acid clorhidric.
Halogeni. 5 ml din același filtrat, diluat cu apă la 10 ml, trebuie să treacă testul pentru cloruri (nu mai mult de 0,004% în preparat).
Sulfati. 10 ml din același filtrat trebuie să treacă testul pentru sulfați (nu mai mult de 0,01% în preparat).
Cenușa din 0,5 g de medicament nu trebuie să depășească 0,1%.
Cuantificare. Aproximativ 0,2 g de medicament (cântărit exact) se pun într-un balon conic cu o capacitate de 250-300 ml, dizolvat în alcool 25 sau 95%, se adaugă 25 ml de 0,1 N. soluție de azotat de argint, 10 ml acid azotic și reflux într-o baie de apă timp de 30 de minute, ferind balonul de reacție de lumină. Frigiderul se spală cu apă, se adaugă 100 ml apă în balon și excesul de azotat de argint se titrează cu 0,1 N. soluție de tiocianat de amoniu (indicator - alaun feric de amoniu).
În același timp, se efectuează un experiment de control.
1 ml 0,1 n. soluția de azotat de argint corespunde la 0,01312 g de CHI 3, care trebuie să fie de cel puțin 99,0% în preparat.
Depozitare. Într-un recipient bine închis, ferit de lumină, la loc răcoros.
Postat pe Allbest.ru
Documente similare
Conceptul de refracție ca măsură a polarizabilității electronice a atomilor, moleculelor, ionilor. Evaluarea indicelui de refracție pentru identificarea compușilor organici, mineralelor și substanțelor medicinale, a parametrilor chimici ai acestora, analiza cantitativă și structurală.
lucru curs, adăugat 06.05.2011
Operații de bază atunci când se lucrează într-un laborator de chimie organică. Cele mai importante constante fizice. Metode de determinare a structurii compușilor organici. Fundamentele structurii, proprietăților și identificării compușilor organici. Sinteze de compuși organici.
manual de instruire, adăugat 24.06.2015
Studiul fundamentelor teoretice ale metodelor de precipitare a substanțelor medicinale organice și anorganice. Analiza caracteristicilor interacțiunii substanțelor medicamentoase cu indicatorii în metodele de precipitare. Metode orientative pentru determinarea punctului final de titrare.
lucrare curs, adăugată 30.01.2014
Dimerizarea oxidativă a metanului. Mecanismul de activare catalitică a metanului. Prepararea compuşilor organici prin metilare oxidativă. Transformări oxidative ale compușilor organici care conțin o grupare metil în prezența unui catalizator.
disertație, adăugată 10.11.2013
Luarea în considerare a reacțiilor bazate pe formarea de compuși metalici complecși și fără participarea acestora. Conceptul de grupuri funcțional-analitice și analitico-active. Utilizarea compușilor organici ca indicatori în metodele titrimetrice.
lucru curs, adăugat 04/01/2010
Structura chimică - succesiunea conexiunilor atomilor dintr-o moleculă, ordinea interconexiunii lor și influența reciprocă. Legătura atomilor care formează compușii organici; dependența proprietăților substanțelor de tipul atomilor, cantitatea și ordinea de alternanță a acestora.
prezentare, adaugat 12.12.2010
Izomeria este fenomenul existenței unor compuși identici ca compoziție, dar diferiți ca structură și proprietăți. Izomerie interclasă determinată de natura grupului funcțional. Tipuri de izomerie spațială. Tipuri de nomenclatură a compuşilor organici.
prezentare, adaugat 03.12.2017
Metode de bază de predicție a entalpiilor de formare a compușilor organici: metode de mecanică moleculară și metode aditive. Metoda Benson și metoda Tatevsky. Alchilbenzeni și derivații lor funcționali: halobenzeni, polifenili, piridine.
lucrare de curs, adăugată 17.01.2009
Halogenarea compușilor aromatici: mecanism de proces. Calculul indicatorilor pentru mono- și diclorurarea compușilor organici. Consumul de reactiv la randamentul maxim al produsului țintă în reacții complexe. Alegerea unui mecanism de reacție adecvat.
rezumat, adăugat 15.02.2012
Viața ca proces fizic și chimic continuu. Caracteristicile generale ale compușilor naturali. Clasificarea compușilor naturali cu greutate moleculară mică. Criterii de bază pentru clasificarea compușilor organici. Tipuri și proprietăți ale legăturilor, influența reciprocă a atomilor.