Основные химические свойства белков. Функции белков в организме
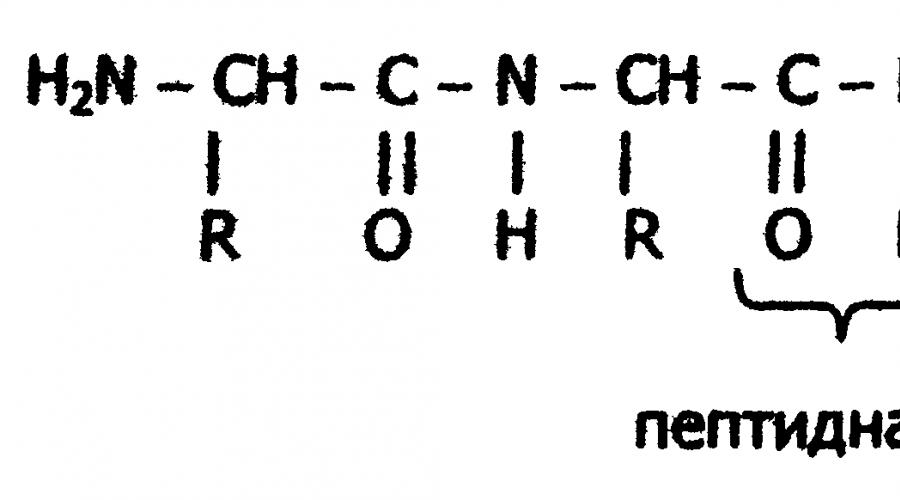
Читайте также
№1. Белки: пептидная связь, их обнаружение.
Белки – макромолекулы линейных полиамидов, образованных а-аминокислотами в результате реакции поликонденсации в биологических объектах.
Белки – это высокомолекулярные соединения, построенные из аминокислот . В создание белков участвует 20 аминокислот. Они связываются между собой в длинные цепи, которые образуют основу белковой молекулы большой молекулярной массы.
Функции белков в организме
Сочетание своеобразных химических и физических свойств белков обеспечивает именно этому классу органических соединений центральную роль в явлениях жизни.
Белки имеют следующие биологические свойства, или осуществляют следующие основные функции в живых организмах:
1. Каталитическая функция белков. Все биологические катализаторы - ферменты являются белками. В настоящее время охарактеризовано тысячи ферментов, многие из них выделены в кристаллической форме. Почти все ферменты - мощные катализаторы, повышающие скорости реакций, по крайней мере, в миллион раз. Эта функция белков является уникальной, не свойственной другим полимерным молекулам.
2. Питательная (резервная функция белков). Это, прежде всего белки, предназначенные для питания развивающегося зародыша: казеин молока, овальбумин яиц, запасные белки семян растений. Ряд других белков, несомненно, используется в организме в качестве источника аминокислот, которые, в свою очередь, являются предшественниками биологически активных веществ, регулирующих процесс обмена веществ.
3. Транспортная функция белков. Транспорт многих небольших молекул и ионов осуществляется специфическими белками. Например, дыхательная функция крови, а именно перенос кислорода, выполняется молекулами гемоглобина - белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови. Ряд других сывороточных белков образует комплексы с жирами, медью, железом, тироксином, витамином А и другими соединениями, обеспечивая их доставку в соответствующие органы.
4. Защитная функция белков. Основную функцию защиты выполняет иммуннологическая система, которая обеспечивает синтез специфических защитных белков - антител - в ответ на поступление в организм бактерий, токсинов или вирусов (антигенов). Антитела связывают антигены, взаимодействуя с ними, и тем самым нейтрализуют их биологическое действие и сохраняют нормальное состояние организма. Свертывание белка плазмы крови - фибриногена - и образование сгустка крови, предохраняющего от потери крови при ранениях - еще один пример защитной функции белков.
5. Сократительная функция белков. В акте мышечного сокращения и расслабления участвует множество белков. Главную роль в этих процессах играют актин и миозин - специфические белки мышечной ткани. Сократительная функция присуща также и белкам субклеточных структур, что обеспечивает тончайшие процессы жизнедеятельности клеток,
6. Структурная функция белков. Белки с такой функцией занимают первое место среди других белков тела человека. Широко распространены такие структурные белки, как коллаген в соединительной ткани; кератин в волосах, ногтях, коже; эластин - в сосудистых стенках и др.
7. Гормональная (регуляторная) функция белков. Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляцииважное место занимают гормоны, вырабатываемые железами внутреннейсекреции. Ряд гормонов представлен белками, или полипептидами, например гормоны гипофиза, поджелудочной железы и др.
Пептидная связь
Формально образование белковой макромолекулы можно представить как реакцию поликонденсации α-аминокислот.
С химической точки зрения белки - это высокомолекулярные азотсодержащие органические соединения (полиамиды), молекулы которых построены из остатков аминокислот. Мономерами белков служат α-аминокислоты, общим признаком которых является наличие карбоксильной группы -СООН и аминогруппы -NH 2 у второго углеродного атома (α-углеродный атом):
Исходя из результатов изучения продуктов гидролиза белков и выдвинутых А.Я. Данилевским идей о роли пептидных связей -CO-NH- в построении белковой молекулы, немецкий ученый Э.Фишер предложил в начале XX века пептидную теорию строения белков. Согласно этой теории, белки представляют собой линейные полимеры α-аминокислот, связанных пептидной связью - полипептиды:

В каждом пептиде один концевой аминокислотный остаток имеет свободную α-аминогруппу (N-конец), а другой - свободную α-карбоксильную группу (С-конец). Структуру пептидов принято изображать, начиная с N-концевой аминокислоты. При этом аминокислотные остатки обозначаются символами. Например: Ala-Tyr-Leu-Ser-Tyr- - Cys. Этой записью обозначен пептид, в котором N-концевой α-аминокислотой яв ляется аланин, а С-концевой - цистеин. При чтении такой записи окончания названий всех кислот, кроме последних меняются на - "ил": аланил-тирозил-лейцил-серил-тирозил- -цистеин. Длина пептидной цепи в пептидах и белках, встречающихся в организме, колеблется от двух до сотен и тысяч аминокислотных остатков.
№2. Классификация простых белков.
К простым (протеинам) относят белки, дающие при гидролизе только аминокислоты.
Протеиноиды ____простые белки животного происхождения, нерастворимые вводе, растворах солей, разбавленных кислотах и щелочах. Выполняют главным образом опорные функции (например, Коллаген, кератин
протамины – положительно заряженные ядерные белки, с молекулярной массой 10-12 kDa. Примерно на 80% состоят из щелочных аминокислот, что дает им возможность взаимодействовать с нуклеиновыми кислотами посредством ионных связей. Принимают участие в регуляции генной активности. Хорошо растворимы в воде;
гистоны – ядерные белки, играющие важную роль в регуляции генной активности. Они найдены во всех эукариотических клетках, и разделены на 5 классов, различающихся по молекулярной массе и аминокислотному. Молекулярная масса гистонов находится в интервале от 11 до 22 kDa, а различия в аминокислотном составе касаются лизина и аргинина, содержание которых варьирует от 11 до 29% и от 2 до 14% соответственно;
проламины – не растворимы в воде, но растворимы в 70% спирте, особенности хим.строения – много пролина, глутаминовой кислоты нет лизина,
глутелины – растворимы в щелочных растворах,
глобулины – белки, не растворимые в воде и в полунасыщенном растворе сернокислого аммония, но растворимые в водных растворах солей, щелочей и кислот. Молекулярная масса – 90-100 kDa;
альбумины – белки животных и растительных тканей, растворим в воде и солевых растворах. Молекулярнаяя масса равна 69 kDa;
склеропротеины – белки опорных тканей животных
В качестве примеров простых белков могут служить фиброин шелка, яичный сывороточный альбумин, пепсин и др.
№3. Способы выделения и осаждения (очистки) белков.





№4. Белки как полиэлектролиты. Изоэлектрическая точка белка.
Белки являются амфотерными полиэлектролитами, т.е. проявляют как кислотные, так и основные свойства. Это обусловлено наличием в молекулах белков аминокислотных радикалов, способных к ионизации, а также свободных α-амино- и α-карбоксильных групп на концах пептидных цепей. Кислотные свойства белку придают кислые аминокислоты (аспарагиновая, глутаминовая), а щелочные свойства - основные аминокислоты (лизин, аргинин, гистидин).
Заряд белковой молекулы зависит от ионизации кислых и основных групп аминокислотных радикалов. В зависимости от соотношения отрицательных и положительных групп молекула белка в целом приобретает суммарный положительный или отрицательный заряд. При подкислении раствора белка степень ионизации анионных групп снижается, а катионных повышается; при подщелачивании - наоборот. При определенном значении рН число положительно и отрицательно заряженных групп становится одинаковым, возникает изоэлектрическое состояние белка (суммарный заряд равен 0). Значение рН, при котором белок находится в изоэлектрическом состоянии, называют изоэлектрической точкой и обозначают pI, аналогично аминокислотам. Для большинства белков pI лежит в пределах 5,5-7,0, что свидетельствует о некотором преобладании в белках кислых аминокислот. Однако есть и щелочные белки, например, сальмин - основной белок из молок семги (pl=12). Кроме того, есть белки, у которых pI имеет очень низкое значение, например, пепсин - фермент желудочного сока (pl=l). В изоэлектрической точке белки очень неустойчивые и легко выпадают в осадок, обладая наименьшей растворимостью.
Если белок не находится в изоэлектрическом состоянии, то в электрическом поле его молекулы будут перемещаться к катоду или аноду, в зависимости от знака суммарного заряда и со скоростью, пропорциональной его величине; в этом заключается сущность метода электрофореза. Этим методом можно разделять белки с различным значением pI.
Белки хотя и обладают свойствами буфера, но емкость их при физиологических значениях рН ограничена. Исключение составляют белки, содержащие много гистидина, так как только радикал гистидина обладает буферными свойствами в интервале рН 6-8. Таких белков очень мало. Например, гемоглобин, содержащий почти 8% гистидина, является мощным внутриклеточным буфером в эритроцитах, поддерживая рН крови на постоянном уровне.
№5. Физико-химические свойства белков.
Белки имеют различные химические, физические и биологические свойства, которые определяются аминокислотным составом и пространственной организацией каждого белка. Химические реакции белков очень разнообразны, они обусловлены наличием NH 2 -, СООН-групп и радикалов различной природы. Это реакции нитрования, ацилирования, алкилирования, этерификации, окисления-восстановления и другие. Белки обладают кислотно-основными, буферными, коллоидными и осмотическими свойствами.
Кислотно-основные свойства белков
Химические свойства. При слабом нагревании водных растворов белков происходит денатурация. При этом образуется осадок.
При нагревании белков с кислотами происходит гидролиз, при этом образуется смесь аминокислот.
Физико-химические свойства белков
Белки имеют высокий молекулярный вес.
Заряд белковой молекулы. Все белки имеют хоть одну свободную -NH и - СООН группы.
Белковые растворы - коллоидные растворы с разными свойствами. Белки бывают кислыми и основными. Кислые белки содержат много глу и асп, у которых есть дополнительные карбоксильные и меньше аминогрупп. В щелочных белках много лиз и арг. Каждая молекула белка в водном растворе окружена гидратной оболочкой, так как у белков за счет аминокислот есть много гидрофильных группировок (-СООН, -ОН, -NH 2 , -SH). В водных растворах белковая молекула имеет заряд. Заряд белка в воде может меняться в зависимости от РН.
Осаждение белков. У белков есть гидратная оболочка, заряд, препятствующий склеиванию. Для осаждения необходимо снять гидратную оболочку и заряд.
1.Гидратация. Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объем увеличивается. Набухание белка сопровождается его частичным растворением. Гидрофильность отдельных белков зависит от их строения. Имеющиеся в составе и расположенные на поверхности белковой макромолекулы гидрофильные амидные (–CO–NH–, пептидная связь), аминные (NH2) и карбоксильные (COOH) группы притягивают к себе молекулы воды, строго ориентируя их на поверхность молекулы. Окружая белковые глобулы гидратная (водная) оболочка препятствует устойчивости растворов белка. В изоэлектрической точке белки обладают наименьшей способностью связывать воду, происходит разрушение гидратной оболочки вокруг белковых молекул, поэтому они соединяются, образуя крупные агрегаты. Агрегация белковых молекул происходит и при их обезвоживании с помощью некоторых органических растворителей, например этило- вого спирта. Это приводит к выпадению белков в осадок. При изменении pH среды макромолекула белка становится заряженной, и его гидратационная способность меняется.
Реакции осаждения делят на два вида.
Высаливание белков: (NH 4)SO 4 - снимается только гидратная оболочка, белок сохраняет все виды своей структуры, все связи, сохраняет нативные свойства. Такие белки можно затем вновь растворить и использовать.
Осаждения с потерей нативных свойств белка - процесс необратимый. С белка снимается гидратная оболочка и заряд, нарушаются различные свойства в белке. Например соли меди, ртути, мышьяка, железа, концентрированные неорганические кислоты - HNO 3 , H 2 SO 4 , HCl, органические кислоты, алкалоиды - танины, йодистая ртуть. Добавление органических растворителей понижает степень гидратации и приводит к осаждению белка. В качестве таких растворителей используют ацетон. Осаждают белки также с помощью солей, например, сульфата аммония. Принцип этого метода основан на том, что при повышении концентрации соли в растворе происходит сжатие ионных атмосфер, образуемых противоионами белка, что способствует сближению их до критического расстояния, на котором межмолекулярные силы ван-дер-ваальсова притяжения перевешивают кулоновские силы отталкивания противоионов. Это приводит к слипанию белковых частиц и их выпадению в осадок.
При кипячении молекулы белков начинают хаотично двигаться, сталкиваются, снимается заряд, уменьшается гидратная оболочка.
Для обнаружения белков в растворе применяются:
цветные реакции;
реакции осаждения.
Методы выделения и очистки белков.
высаливание;
электрофорез;
хроматография: адсорбция, расщепление;
ультрацентрифугирование.
гомогенизация - клетки растираются до однородной массы;
экстракция белков водными или водно-солевыми растворами;
Структурная организация белков.
Первичная структура - определяется последовательностью аминокислот в пептидной цепочке, стабилизируется ковалентными пептидными связями (инсулин, пепсин, химотрипсин).
Вторичная структура - пространственная структура белка. Это либо -спираль, либо -складчатость. Создаются водородные связи.
Третичная структура - глобулярные и фибриллярные белки. Стабилизируют водородные связи, электростатические силы (СОО-, NН3+), гидрофобные силы, сульфидные мостики, определяются первичной структурой. Глобулярные белки - все ферменты, гемоглобин, миоглобин. Фибриллярные белки - коллаген, миозин, актин.
Четвертичная структура - имеется только у некоторых белков. Такие белки построены из нескольких пептидов. Каждый пептид имеет свою первичную, вторичную, третичную структуру, называются протомерами. Несколько протомеров соединяются вместе в одну молекулу. Один протомер не функционирует как белок, а только в соединении с другими протомерами.
Пример: гемоглобин = -глобула + -глобула - переносит О 2 в совокупности, а не по раздельности.
Белок может ренатурировать. Для этого необходимо очень короткое воздействие агентов.

6) Способы обнаружения белков.
Белки – высокомолекулярные биологические полимеры, структурными (мономерными) звеньями которых служат -аминокислоты. Аминокислоты в белках соединены друг с другом пептидной связью,образование которой происходит за счет карбоксильной группы, стоящей у -углеродного атома одной аминокислоты и -аминной группы другой аминокислоты с выделением молекулы воды. Мономерные звенья белков называют остатками аминокислот.
Пептиды, полипептиды и белки отличаются не только количеством, составом но и последовательностью аминокислотных остатков, физико-химическими свойствами и функциями, выполняемыми в организме. Молекулярная масса белков варьирует от 6 тыс. до 1 млн. и более. Химические и физические свойства белков обусловлены химической природой и физико-химическими свойствами радикалов, входящих в них остатков аминокислот. Способы обнаружения и количественного определения белков в биологических объектах и продуктах питания, а также выделения их из тканей и биологических жидкостей основаны на физических и химических свойствах этих соединений.
Белки при взаимодействии с некоторыми химическими веществами дают окрашенные соединения . Образование этих соединений происходит при участии радикалов аминокислот, их специфических групп или пептидных связей. Цветные реакции позволяют установитьналичие белка в биологическом объекте или растворе и доказать присутствиеопределенных аминокислот в белковой молекуле . На основе цветных реакций разработаны некоторые методы количественного определения белков и аминокислот.
Универсальными считают биуретовую и нингидриновую реакции , так как их дают все белки.Ксантопротеиновая реакция, реакция Фоля и др. являются специфическими, так как они обусловлены радикальными группами определенных аминокислот в молекуле белка.
Цветные реакции позволяют установить наличие белка в исследуемом материале и присутствие определенных аминокислот в его молекулах.
Биуретовая реакция . Реакция обусловлена наличием в белках, пептидах, полипептидахпептидных связей , которые в щелочной среде образуют сионами меди (II) комплексные соединения, окрашенные вфиолетовый (с красным или с синим оттенком) цвет . Окраска обусловлена наличием в молекуле не менее двух групп-CO-NH- , связанных непосредственно между собой или при участии атома углерода или азота.
Ионы меди (II) соединяются двумя ионными связями с группами =С─О ˉ и четырьмя координационными связями с атомами азота (=N―).
Итенсивность окраски зависит от количества белка в растворе. Это позволяет использовать данную реакцию для количественного определения белка. Цвет окрашенных растворов зависит от длины полипептидной цепи. Белки дают сине-фиолетовое окрашивание; продукты их гидролиза (поли- и олигопептиды) – красную или розовую окраску. Биуретовую реакцию дают не только белки, пептиды и полипептиды но и биурет (NH 2 -CO-NH-CO-NH 2) , оксамид (NH 2 -CO-CO-NH 2), гистидин.
Образующееся в щелочной среде комплексное соединение меди (II) с пептидными группами имеет следующее строение:


Нингидриновая реакция . В этой реакции растворы белка, полипептидов, пептидов и свободных α-аминокислот при нагревании с нингидрином дают синее, сине-фиолетовое или розово-фиолетовое окрашивание. Окраска в этой реакции развивается за счет α-аминогруппы.


Очень легко реагируют с нингидрином -аминокислоты. Наряду с ними сине-фиолетовый Руэмана образуют также белки, пептиды, первичные амины, аммиак и некоторые другие соединения. Вторичные амины, например пролин и оксипролин, дают желтую окраску.
Нингидриновую реакцию широко используют для обнаружения и количественного определения аминокислот.
Ксантопротеиновая реакция. Эта реакция указывает на наличие в белках остатков ароматических аминокислот – тирозина, фенилаланина, триптофана. Основана на нитровании бензольного кольца радикалов этих аминокислот с образованием нитросоединений, окрашенных в желтый цвет (греческое «Ксантос» – желтый). На примере тирозина эту реакцию можно описать в виде следующих уравнений.
В щелочной среде нитропроизводные аминокислот образуют соли хиноидной структуры, окрашенные в оранжевый цвет. Ксантопротеиновую реакцию дают бензол и его гомологи, фенол и другие ароматические соединения.

Реакции на аминокислоты, содержащие тиоловую группу в восстановленном или окисленном состоянии (цистеин, цистин).
Реакция Фоля. При кипячении со щелочью от цистеина легко отщепляется сера в виде сероводорода, который в щелочной среде образует сульфид натрия:
В связи с этим реакции определения тиолсодержащих аминокислот в растворе подразделяют на два этапа:
Переход серы из органического состояния в неорганическое
Обнаружение серы в растворе
Для выявления сульфида натрия используют ацетат свинца, который при взаимодействии с гидроксидом натрия превращается в его плюмбит:
Pb(CH 3 COO) 2 + 2NaOH Pb(ONa) 2 + 2CH 3 COOH
В результате взаимодействия ионов серы и свинца образуется сульфид свинца черного или бурого цвета:
Na 2 S + Pb (ONa ) 2 + 2 H 2 O PbS (черный осадок) + 4 NaOH
Для определения серусодержащих аминокислот к исследуемому раствору добавляют равный объем гидроксида натрия и несколько капель раствора ацетата свинца. При интенсивном кипячении в течение 3-5 минут жидкость окрашивается в черный цвет.
Наличие цистина может быть определено с помощью этой реакции, так как цистин легко восстанавливается в цистеин.
Реакция Миллона:
Это реакция на аминокислоту тирозин.
Свободные фенольные гидроксилы молекул тирозина при взаимодействии с солями дают соединения ртутной соли нитропроизводного тирозина, окрашенной в розовато-красный цвет:

Реакция Паули на гистидин и тирозин . Реакция Паули позволяет обнаружить в белке аминокислоты гистидин и тирозин, которые образуют с диазобензолсульфоновой кислотой комплексные соединения вишнево-красного цвета. Диазобензолсульфоновая кислота образуется в реакции диазотирования при взаимодействии сульфаниловой кислоты с нитритом натрия в кислой среде:

К исследуемому раствору прибавляют равный объем кислого раствора сульфаниловой кислоты (приготовленного с использованием соляной кислоты) и двойной объем раствора нитрита натрия, тщательно перемешивают и сразу прибавляют соду (карбонат натрия). После перемешивания смесь окрашивается в вишнево-красный цвет при условии наличия гистидина или тирозина в исследуемом растворе.


Реакция Адамкевича-Гопкинса-Коля (Шульца - Распайля) на триптофан (реакция на индоловую группу). Триптофан реагирует в кислой среде с альдегидами, образуя окрашенные продукты конденсации. Реакция протекает за счет взаимодействия индольного кольца триптофана с альдегидом. Известно, что из глиоксиловой кислоты в присутствии серной кислоты образуется формальдегид:
Р астворы,
содержащие триптофан, в присутствии
глиоксиловой и серной кислот дают
красно-фиолетовое окрашивание.
астворы,
содержащие триптофан, в присутствии
глиоксиловой и серной кислот дают
красно-фиолетовое окрашивание.
Глиоксиловая кислота всегда присутствует в небольшом количестве в ледяной уксусной кислоте. Поэтому реакцию можно проводить, используя уксусную кислоту. При этом к исследуемому раствору добавляют равный объем ледяной (концентрированной) уксусной кислоты и осторожно нагревают до растворения осадка.После охлаждения к смеси осторожно по стенке (во избежание смешивания жидкостей) добавляют объем концентрированной серной кислоты, равный добавленному объему глиоксиловой кислоты. Через 5-10 минут на границе раздела двух слоев наблюдают образование красно-фиолетового кольца. Если перемешать слои, содержимое посуды равномерно окрасится в фиолетовый цвет.
К
 онденсация
триптофана с формальдегидом:
онденсация
триптофана с формальдегидом:
Продукт конденсации окисляется до бис-2-триптофанилкарбинола, который в присутствии минеральных кислот образует соли, окрашенные в сине-фиолетовый цвет:


7) Классификация белков. Способы исследования аминокислотного состава.
Строгой номенклатуры и классификации белков до сих пор не существует. Названия белков дают по случайным признакам, чаще всего принимая во внимание источник выделения белка или же учитывая растворимость его в тех или иных растворителях, форму молекулы и др.
Классификация белков проводится по составу, по форме частиц, по растворимости, по аминокислотному составу, по происхождению и т.д.
1. По составу белки делят на две большие группы: простые и сложные белки.
К простым (протеинам) относят белки, дающие при гидролизе только аминокислоты (протеиноиды, протамины, гистоны, проламины, глутелины, глобулины, альбумины). В качестве примеров простых белков могут служить фиброин шелка, яичный сывороточный альбумин, пепсин и др.
К сложным (к протеидам) относят белки, составленные из простого белка и добавочной (простетической) группы небелковой природы. Группу сложных белков делят на несколько подгрупп в зависимости от характера небелкового компонента:
Металлопротеиды, содержащие в своем составе металлы (Fe, Си, Mg и др.), связанные непосредственно с полипептидной цепью;
Фосфопротеиды - содержат остатки фосфорной кислоты, которые сложноэфирными связями присоединены к молекуле белка по месту гидроксильных групп серина, треонина;
Гликопротеиды - их простетическими группами являются углеводы;
Хромопротеиды - состоят из простого белка и связанного с ним окрашенного небелкового соединения, все хромопротеиды биологически очень активны; в качестве простетических групп в них могут быть производные порфирина, изоаллоксазина и каротина;
Липопротеиды - простетическая группа липиды - триглицериды (жиры) и фосфатиды;
Нуклеопротеиды - белки, состоящие из простого белка и соединенной с ним нуклеиновой кислоты. Эти белки играют колоссальную роль в жизнедеятельности организма и будут рассмотрены ниже. Они входят в состав любой клетки, некоторые нуклеопротеиды существуют в природе в виде особых частиц, обладающих патогенной активностью (вирусы).
2. По форме частиц - белки делят на фибриллярные (нитеподобные) и глобулярные (сферические) (см. стр 30).
3. По растворимости и особенностям аминокислотного состава выделяют следующие группы простых белков:
Протеиноиды - белки опорных тканей (костей, хрящей, связок, сухожилий, волос, ногтей, кожи и т.д.). Это в основном фибриллярные белки с большой молекулярной массой (> 150000 Да), нерастворимые в обычных растворителях: воде, солевых и водно-спиртовых смесях. Они растворяются только в специфических растворителях;
Протамины (простейшие белки) - белки, растворимые в воде и содержащие 80-90% аргинина и ограниченный набор (6-8) других аминокислот, представлены в молоках различных рыб. Вследствие высокого содержания аргинина имеют основные свойства, их молекулярная масса сравнительно мала и примерно равна 4000-12000 Да. Они являются белковым компонентом в составе нуклеопротеидов;
Гистоны - хорошо растворимы в воде и разбавленных растворах кислот (0,1Н), отличаются высоким содержанием аминокислот: аргинина, лизина и гистидина (не менее 30%) и поэтому обладают основными свойствами. Эти белки в значительных количествах содержатся в ядрах клеток в составе нуклеопротеидов и играют важную роль в регуляции обмена нуклеиновых кислот. Молекулярная масса гистонов невелика и равна 11000-24000 Да;
Глобулины - белки, нерастворимые в воде и солевых растворах с концентрацией соли более 7%. Глобулины полностью осаждаются при 50%-ном насыщении раствора сульфатом аммония. Эти белки отличаются высоким содержанием глицина (3,5%), их молекулярная масса > 100000 Да. Глобулины - слабокислые или нейтральные белки (р1=6-7,3);
Альбумины - белки, хорошо растворимые в воде и крепких солевых растворах, причем концентрация соли (NH 4) 2 S0 4 не должна превышать 50 % от насыщения. При более высокой концентрации альбумины высаливаются. По сравнению с глобулинами эти белки содержат глицина в три раза меньше и имеют молекулярную массу, равную 40000-70000 Да. Альбумины имеют избыточный отрицательный заряд и кислые свойства (pl=4,7) из-за большого содержания глутаминовой кислоты;
Проламины - группа растительных белков, содержащаяся в клейковине злаковых растений. Они растворимы только в 60-80%-ном водном растворе этилового спирта. Проламины имеют характерный аминокислотный состав: в них много (20-50%) глутаминовой кислоты и пролина (10-15%), в связи с чем они и получили свое название. Их молекулярная масса более 100000 Да;
Глютелины - растительные белки нерастворимые в воде, растворах солей и этаноле, но растворимы в разбавленных (0,1Н) растворах щелочей и кислот. По аминокислотному составу и молекулярной массе сходны с проламинами, но аргинина содержат больше, а пролина меньше.
Способы исследования аминокислотного состава
Под действием ферментов пищеварительных соков белки расщепляются на аминокислоты. Были сделаны два важных вывода: 1) в состав белков входят аминокислоты; 2) методами гидролиза может быть изучен химический, в частности амнокислотный, состав белков.
Для изучения аминокислотного состава белков пользуются сочетанием кислотного (НСl), щелочного [Ва(ОН) 2 ] и, реже, ферментативного гидролиза или одним из них. Установлено, что при гидролизе чистого белка, не содержащего примесей, освобождаются 20 различных α-аминокислот. Все другие открытые в тканях животных, растений и микроорганизмов аминокислоты (более 300) существуют в природе в свободном состоянии либо в виде коротких пептидов или комплексов с другими органическими веществами.
Первый этап в определении первичной структуры белков заключается в качественной и количественной оценке аминокислотного состава данного индивидуального белка. Необходимо помнить, что для исследования нужно иметь определённое количество чистого белка, без примесей других белков или пептидов.
Кислотный гидролиз белка
Для определения аминокислотного состава необходимо провести разрушение всех пептидных связей в белке. Анализируемый белок гидролизуют в 6 мол/л НС1 при температуре около 110 °С в течение 24 ч. В результате такой обработки разрушаются пептидные связи в белке, а в гидролизате присутствуют только свободные аминокислоты. Кроме того, глутамин и аспарагин гидролизуются до глутаминовой и аспарагиновой кислот (т.е. разрывается амидная связь в радикале и от них отщепляется аминогруппа).
Разделение аминокислот с помощью ионообменной хроматографии
Смесь аминокислот, полученных кислотным гидролизом белков, разделяют в колонке с катионообменной смолой. Такая синтетическая смола содержит прочно связанные с ней отрицательно заряженные группы (например, остатки сульфоновой кислоты -SO 3 -), к которым присоединены ионы Na + (рис. 1-4).
В катионообменник вносят смесь аминокислот в кислой среде (рН 3,0), где аминокислоты в основном представляют катионы, т.е. несут положительный заряд. Положительно заряженные аминокислоты присоединяются к отрицательно заряженным частицам смолы. Чем больше суммарный заряд аминокислоты, тем прочнее её связь со смолой. Так, аминокислоты лизин, аргинин и гистидин наиболее прочно связываются с катионообменником, а аспарагиновая и глутаминовая кислоты - наиболее слабо.
Высвобождение аминокислот из колонки осуществляют вымыванием (элюированием) их буферным раствором с увеличивающейся ионной силой (т.е. с увеличением концентрации NaCl) и рН. При увеличении рН аминокислоты теряют протон, в результате уменьшается их положительный заряд, а следовательно и прочность связи с отрицательно заряженными частицами смолы.
Каждая аминокислота выходит из колонки при определённом значении рН и ионной силы. Собирая с нижнего конца колонки раствор (элюат) в виде небольших порций, можно получить фракции, содержащие отдельные аминокислоты.
(подробнее «гидролиз» см вопрос №10)
8) Химические связи в структуре белка.



9) Понятие об иерархии и структурной организации белков. (см. вопрос №12)
10) Гидролиз белка. Химизм реакции (ступенчатость, катализаторы, реагенты, условия протекания реакции) – полное описание гидролиза.
11) Химические превращения белков.
Денатурация и ренатурация
При нагревании растворов белков до 60-80% или при действии реагентов, разрушающих нековалентные связи в белках, происходит разрушение третичной (четвертичной) и вторичной структуры белковой молекулы, она принимает в большей или меньшей степени форму беспорядочного случайного клубка. Этот процесс называют денатурацией. В качестве денатурирующих реагентов могут быть кислоты, щелочи, спирты, фенолы, мочевина, гуанидинхлорид и др. Сущность их действия в том, что они образуют водородные связи с =NH и =СО - группами пептидного остова и с кислотными группами радикалов аминокислот, подменяя собственные внутримолекулярные водородные связи в белке вследствие чего вторичная и третичная структуры изменяются. При денатурации падает растворимость белка, он "свертывается" (например, при варке куриного яйца), утрачивается биологическая активность белка. На этом основано, например, применение водного раствора карболовой кислоты (фенола) в качестве антисептика. В определенных условиях при медленном охлаждении раствора денатурированного белка происходит ренатурация - восстановление исходной (нативной) конформации. Это подтверждает тот факт, что характер укладки пептидной цепи определяется первичной структурой.
Процесс денатурации отдельной белковой молекулы, приводящий к распаду её «жёсткой» трёхмерной структуры, иногда называют плавлением молекулы. Практически любое заметное изменение внешних условий, например, нагревание или существенное изменение pH приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др.
Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Визуально это выглядит, например, как образование «белка» при жарке яиц.
Ренатурация - процесс, обратный денатурации, при котором белки возвращают свою природную структуру. Нужно отметить, что не все белки способны ренатурировать; у большинства белков денатурация необратима. Если при денатурации белка физико-химические изменения связаны с переходом полипептидной цепи из плотно упакованного (упорядоченного) состояния в беспорядочное, то при ренатурации проявляется способность белков к самоорганизации, путь которой предопределён последовательностью аминокислот в полипептидной цепи, то есть её первичной структурой, детерминированной наследственной информацией. В живых клетках данная информация, вероятно, является решающей для преобразования неупорядоченной полипептидной цепи во время или после её биосинтеза на рибосоме в структуру нативной молекулы белка. При нагревании двухцепочечных молекул ДНК до температуры около 100°C водородные связи между основаниями разрываются, и комплементарные цепи расходятся - ДНК денатурирует. Однако при медленном охлаждении комплементарные цепи могут вновь соединяться в регулярную двойную спираль. Эта способность ДНК к ренатурации используется для получения искусственных гибридных молекул ДНК.
Природные белковые тела наделены определенной, строго заданной пространственной конфигурацией и обладают рядом характерных физико-химических и биологических свойств при физиологических значениях температуры и рН среды. Под влиянием различных физических и химических факторов белки подвергаются свертыванию и выпадают в осадок, теряя нативные свойства. Таким образом, под денатурацией следует понимать нарушение общего плана уникальной структуры нативной молекулы белка, преимущественно ее третичной структуры, приводящее к потере характерных для нее свойств (растворимость, электрофоретическая подвижность, биологическая активность и т.д.). Большинство белков денатурирует при нагревании их растворов выше 50–60°С.
Внешние проявления денатурации сводятся к потере растворимости, особенно в изоэлектрической точке, повышению вязкости белковых растворов, увеличению количества свободных функциональных SH-групп и изменению характера рассеивания рентгеновских лучей. Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной). При денатурации белка, вызванной 8М мочевиной или другим агентом, разрушаются в основном нековалентные связи (в частности, гидрофобные взаимодействия и водородные связи). Дисульфидные связи в присутствии восстанавливающего агента меркаптоэтанола разрываются, в то время как пептидные связи самого остова полипептидной цепи не затрагиваются. В этих условиях развертываются глобулы нативных белковых молекул и образуются случайные и беспорядочные структуры (рис.)

Денатурация белковой молекулы (схема).
а - исходное состояние; б - начинающееся обратимое нарушение молекулярной структуры; в - необратимое развертывание полипептидной цепи.

Денатурация и ренатурация рибонуклеазы (по Анфинсену).
а - развертывание (мочевина + меркаптоэтанол); б - повторное свертывание.

1. Гидролиз белков: H+
[− NH2─CH─ CO─NH─CH─CO − ]n +2nH2O → n NH2 − CH − COOH + n NH2 ─ CH ─ COOH
│ │ │ │
Аминокислота 1 аминокислота 2
2. Осаждение белков:
а) обратимое
Белок в растворе ↔ осадок белка. Происходит под действием растворов солей Na+, K+
б) необратимое (денатурация)
При денатурации под действием внешних факторов (температура; механическое воздействие – давление, растирание, встряхивание, ультразвук; действия химических агентов – кислот, щелочей и др.) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы, т.е её нативной пространственной структуры. Первичная структура, а, следовательно, и химический состав белка не меняются.
При денатурации изменяются физические свойства белков: снижается растворимость, теряется биологическая активность. В тоже время увеличивается активность некоторых химических групп, облегчается воздействие на белки протеолитических ферментов, а, следовательно, он легче гидролизуется.
Например, альбумин - яичный белок - при температуре 60-70° осаждается из раствора (свертывается), теряя способность растворяться в воде.
Схема процесса денатурации белка (разрушение третичной и вторичной структур белковых молекул)
3. Горение белков
Белки горят с образованием азота, углекислого газа, воды, а также некоторых других веществ. Горение сопровождается характерным запахом жженых перьев
4. Цветные (качественные) реакции на белки:
а) ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца):
Белок + HNO3 (конц.) → желтое окрашивание
б) биуретовая реакция (на пептидные связи):
Белок + CuSO4 (насыщ) + NaOH (конц) → ярко-фиолетовое окрашивание
в) цистеиновая реакция (на остатки аминокислот, содержащих серу):
Белок + NaOH + Pb(CH3COO)2 → Черное окрашивание
Белки являются основой всего живого на Земле и выполняют в организмах многообразные функции.
Высаливание белков
Высаливанием называется процесс выделения белков из водных растворов нейтральными растворами концентрированных солей щелочных и щелочноземельных металлов. При добавлении больших концентраций солей к раствору белка происходит дегидратация белковых частиц и снятие заряда, при этом белки выпадают в осадок. Степень выпадения белков в осадок зависит от ионной силы раствора осадителя, размера частиц белковой молекулы, величины ее заряда, гидрофильности. Разные белки осаждаются при различных концентрациях солей. Поэтому в осадках, полученных путем постепенного повышения концентрации солей, отдельные белки находятся в различных фракциях. Высаливание белков является обратимым процессом, и после удаления соли белок вновь приобретает природные свойства. Поэтому высаливанием пользуются в клинической практике при разделении белков сыворотки крови, а также при изолировании, очистке различных белков.
Добавляемые анионы и катионы разрушают гидратную белковую оболочку белков, являющуюся одним из факторов устойчивости белковых растворов. Чаще всего применяются растворы сульфатов Na и аммония. Многие белки отличаются по размеру гидратной оболочки и величине заряда. Для каждого белка есть своя зона высаливания. После удаления высаливающего агента белок сохраняет свою биологическую активность и физико-химические свойства. В клинической практике применяется метод высаливания для разделения глобулинов (при добавлении 50% раствора сульфата аммония (NH4)2SO4 выпадает осадок) и альбуминов (при добавлении 100% раствора сульфата аммония (NH4)2SO4 выпадает осадок).
На величину высаливания оказывают влияние:
1) природа и концентрация соли;
2) рН-среды;
3) температура.
Главную роль при этом играют валентности ионов.
12) Особенности организации первичной, вторичной, третичной структуры белка.
В настоящее время экспериментально доказано существование четырёх уровней структурной организации белковой молекулы: первичной, вторичной, третичной и четвертичной структуры.
Белки
– биополимеры, мономерами которых служат α-аминокислоты, связанные между собой пептидными связями.
Выделяют аминокислоты гидрофобные
и гидрофильные
, которые, в свою очередь, делятся на кислые, основные и нейтральные. Особенностью a-аминокислот является их способность взаимодействовать друг с другом с образованием пептидов.
Выделяют:
дипептиды (карнозин и ансерин , локализующиеся в митохондриях; будучи АО, предотвращающие их набухание);
олигопептиды, включающие до 10 аминокислотных остатков. Например: трипептид глутатион служит одним из главных восстановителей в АРЗ, которая регулирует интенсивность ПОЛ. Вазопрессин и окситоцин — гормоны задней доли гипофиза, включают 9 аминокислот.
Существуют полипептид ы и в зависимости от проявляемых ими свойств их относят к различного класса соединениям. Медики считают, если парентеральное введение полипептида вызывает отторжение (аллергическую реакцию), то его следует считать белком ; если же подобного явления не наблюдается, то термин остаётся прежним (полипептид ). Гормон аденогипофиза АКТГ , влияющий на секрецию ГКС в коре надпочечников, относят к полипептидам (39 аминокислот), а инсулин , состоящий из 51 мономера и способный спровоцировать иммунный ответ, — протеин.
Уровни организации белковой молекулы.
Любой полимер стремится принять более энергетически выгодную конформацию, которая удерживается за счёт образования добавочных связей, что осуществляется с помощью группировок радикалов аминокислот. Принято выделять четыре уровня структурной организации протеинов. Первичная структура – последовательность аминокислот в полипептидной цепи, ковалентно связанных пептидными (амидными ) связями, а соседние радикалы находятся под углом 180 0 (транс-форма). Наличие более 2-х десятков различных протеиногенных аминокислот и способность их связываться в разной последовательности и обусловливает многообразие белков в природе и выполнение ими самых различных функций. Первичная структура протеинов отдельного человека генетически заложена и передаётся от родителей с помощью полинуклеотидов ДНК и РНК. В зависимости от природы радикалов и с помощью специальных белков – шаперонов синтезируемая полипептидная цепь укладывается в пространстве – фолдинг белков .
Вторичная структура белка имеет вид спирали либо β-складчатого слоя. Фибриллярные белки (коллаген, эластин) имеют бета-структуру . Чередование спирализованных и аморфных (неупорядоченных) участков позволяет им сближаться и с помощью шаперонов формируют более плотно упакованную молекулу — третичную структуру.
Объединение нескольких полипептидных цепей в пространстве и создание в функциональном отношении макромолекулярного образования формирует четвертичную структуру белка. Такие мицеллы принято называть олиго- или мультимерами , а их компоненты – субъединицами (протомерами ). Белок с четвертичной структурой обладает биологической активностью только при условии, если все субъединицы его связаны между собой.
Таким образом, любой природный протеин характеризуется уникальной организацией, которая и обеспечивает его физико-химические, биологические и физиологические функции.
Физико-химические свойства.
Белки обладают большими размерами и высокой молекулярной массой, которая колеблется от 6000 – 1000000 Дальтон и выше в зависимости от количества аминокислот и числа протомеров. Молекулы их имеют различные формы: фибриллярную – в ней сохраняется вторичная структура; глобулярную – имеющую более высокую организацию; и смешанную. Растворимость белков зависит от размеров и формы молекулы, от природы радикалов аминокислот. Глобулярные белки хорошо растворимы в воде, а фибриллярные или мало- или не растворимы.
Свойства белковых растворов: имеют низкое осмотическое, но высокое онкотическое давление; высокую вязкость; слабую способность к диффузии; часто мутные; опалесцируют (явление Тиндаля ), — всё это используется при выделении, очистке, изучении нативных белков. В основе разделения компонентов биологической смеси лежит их осаждение. Обратимое осаждение называют высаливанием , развивающимся при действии солей щелочных металлов, солей аммония, разбавленных щелочей и кислот. Его используют для получения чистых фракций, сохранивших нативные структуру и свойства.
Степень ионизации белковой молекулы и её стабильность в растворе определяются рН среды. Значение рН раствора, при котором заряд частицы стремится к нулю, называют изоэлектрической точкой . Такие молекулы способны перемещаться в электрическом поле; скорость движения прямо пропорциональна величине заряда и обратно пропорциональна массе глобулы, что лежит в основе электрофореза для разделения белков сыворотки.
Необратимое осаждение — денатурация . Если реагент проникает вглубь мицеллы и разрушает добавочные связи, уложенная компактно нить разворачивается. Сближающиеся молекулы за счёт высвободившихся группировок склеиваются и выпадают в осадок или флотируют и теряют свои биологические свойства. Денатурирующие факторы: физические (температура выше 40 0 , различные виды излучений: рентгеновское, α-, β-, γ, УФЛ); химические (концентрированные кислоты, щёлочи, соли тяжёлых металлов, мочевину, алкалоиды, некоторые лекарства, яды). Денатурация применяется в асептике и антисептике, а также в биохимических исследованиях.
Белки обладают различными свойствами (Табл. 1.1).
Таблица 1.1
Биологические свойства протеинов
| Специфичность | обусловливается уникальным аминокислотным составом каждого белка, что детерминировано генетически и обеспечивает адаптацию организма к изменяющимся условиям внешней среды, но с другой стороны — требует учитывать этот факт при переливании крови, трансплантации органов и тканей. |
| Лигандность | способность радикалов аминокислот образовывать связи с различными по природе веществами (лигандами ): углеводами, липидами, нуклеотидами, минеральными соединениями. Если связь прочная, то этот комплекс, называемый сложным белком , выполняет предназначенные для него функции. |
| Кооперативность | характерна для белков, имеющих четвертичную структуру. Гемоглобин состоит из 4-х протомеров, каждый из которых соединён с гемом, способным связываться с кислородом. Но гем первой субъединицы это делает медленно, а каждый последующий – легче. |
| Полифункциональность | свойство одного белка выполнять самые разные функции. Миозин – сократительный протеин мышц обладает также каталитической активностью, гидролизуя при необходимости АТФ. Вышеназванный гемоглобин тоже способен работать ферментом — каталазой. |
| Комплементарность | Все белки так укладываются в пространстве, что формируются участки, комплементарные другим соединениям, что обеспечивает выполнение различных функций (образование комплексов энзим-субстрат, гормон-рецептор, антиген-антитело. |
Классификация белков
Выделяют простые белки , состоящие только из аминокислот, и сложные , включающие простетическую группу . Простые белки делятся на глобулярные и фибриллярные , а также в зависимости от аминокислотного состава на основные, кислые, нейтральные . Глобулярные основные белки — протамины и гистоны . Имеют низкую молекулярную массу, за счет наличия аргинина и лизина у них резко выражена основность, благодаря «-» заряду, легко взаимодействуют с полианионами нуклеиновых кислот. Гистоны, связываясь с ДНК, помогают компактно укладываться в ядре и регулировать синтез белка. Эта фракция гетерогенна и при взаимодействии друг с другом, образуют нуклеосомы , на которые наматываются нити ДНК.
К кислым глобулярным белкам принадлежат альбумины и глобулины , содержащиеся во внеклеточных жидкостях (плазме крови, ликворе, лимфе, молоке) и отличающиеся по массе и размерам. Альбумины имеют молекулярную массу 40-70 тыс. Д в отличие от глобулинов (свыше 100 тыс.Д). Первые включают глутаминовую кислоту, что создаёт большой «-» заряд и гидратную оболочку, позволяющую иметь высокую стабильность их раствора. Глобулины — менее кислые белки, поэтому легко высаливаются и являются гетерогенными, с помощью электрофореза делятся на фракции. Способны связываться с различными соединениями (гормонами, витаминами, ядами, лекарствами, ионами), обеспечивая их транспорт. С их помощью стабилизируются важные параметры гомеостаза: рН и онкотическое давление. Выделяют также иммуноглобулины (IgA, IgM, IgD, IgE, IgG), которые служат антителами, а также белковые факторы свёртывания крови.
В клинике используют так называемый белковый коэффициент (БК) , представляющий отношение концентрации альбуминов к концентрации глобулинов:
Его величины колеблются в зависимости от патологических процессов.
Фибриллярные белки делят на две группы: растворимые (актин, миозин, фибриноген) и нерастворимые в воде и водно-солевых растворах (белки опорных — коллаген, эластин, ретикулин и покровных — кератин тканей).
В основе классификации сложных белков лежат особенности строения простетической группы. Металлопротеин — ферритин , богатый катионами железа, и локализующийся в клетках системы мононуклеарных фагоцитов (гепатоцитах, спленоцитах, клетках костного мозга), является депо данного металла. Избыток железа приводит к накоплению в тканях – гемосидерина , провоцируя развитие гемосидероза . Металлогликопротеиины — трансферрин и церулоплазмин плазмы крови, служащие транспортными формами ионов железа и меди соответственно, выявлена их антиоксидантная активность. Работа многих ферментов зависит от наличия в молекулах ионов металлов: для ксантиндегидрогеназы — Мо ++ , аргиназы – Mn ++ , а алкогольДГ – Zn ++ .
Фосфопротеины – казеиноген молока, вителлин желтка и овальбумин белка яиц, ихтулин икры рыб. Играют важную роль в развитии зародыша, плода, новорождённого: их аминокислоты необходимы для синтеза собственных белков тканей, а фосфат используется или как звено ФЛ – обязательных структур мембран клеток, или как важнейший компонент макроэргов – источников энергии в генезе различных соединений. За счет фосфорилирования-дефосфорилирования ферменты регулируют свою активность.
В состав нуклеопротеинов входят ДНК и РНК. В качестве апопротеинов выступают гистоны или протамины. Любая хромосома – это комплекс одной молекулы ДНК с многими гистонами. С помощью нуклеосом происходит накручивание нити данного полинуклеотида, что уменьшает его объём.
Гликопротеины включают в свой состав различные углеводы (олигосахариды, ГАГ типа гиалуроновой кислоты, хондроитин-, дерматан-, кератан-, гепарансульфатов). Слизь, богатая гликопротеинами, обладает высокой вязкостью, защищая стенки полых органов от действия раздражителей. Гликопротеины мембран обеспечивают межклеточные контакты, работу рецепторов, в плазмолеммах эритроцитов отвечают за группоспецифичность крови. Антитела (олигосахариды) взаимодействуют с конкретными антигенами. В основе функционирования интерферонов, системы комплемента лежит тот же принцип. Церулоплазмин и трансферрин, транспортирующие в плазме крови ионы меди и железа, являются тоже гликопротеинами. К этому классу белков принадлежат некоторые гормоны аденогипофиза.
Липопротеины в составе простетической группы содержат различные липиды (ТАГ, свободный ХС, его эфиры, ФЛ). Несмотря на присутствие самых различных веществ, принцип строения мицелл ЛП сходен (Рис. 1.1). Внутри данной частицы находится жировая капля, содержащая неполярные липиды: ТАГ и эфиры ХС. Снаружи ядро окружено однослойной мембраной, образованной ФЛ, белком (аполипопротеином) и ХС. Некоторые белки интегральны и не могут быть отделены от липопротеина, а другие способны переноситься от одного комплекса к другому. Полипептидные фрагменты формируют структуру частицы, взаимодействуют с рецепторами на поверхности клеток, определяя, каким тканям он необходим, служат ферментами или их активаторами, модифицирующими ЛП. Методом ультрацентрифугирования выделили следующие типы липопротеинов: ХМ, ЛПОНП, ЛППП, ЛПНП, ЛПВП . Каждый из типов ЛП образуется в разных тканях и обеспечивает транспорт определённых липидов в биологических жидкостях. Молекулы этих протеинов хорошо растворимы в крови, т.к. имеют небольшие размеры и отрицательный заряд на поверхности. Часть ЛП способна легко диффундировать через интиму артерий, питая её. Хиломикроны служат перевозчиками экзогенных липидов, продвигаясь сначала по лимфе, а затем по кровотоку. По мере продвижения ХМ теряют свои липиды, отдавая их клеткам. ЛПОНП служат основными транспортными формами синтезированных в печени липидов, в основном ТАГ, а доставка эндогенного ХС из гепатоцитов к органам и тканям осуществляется ЛПНП . По мере того, как они отдают липиды клеткам–мишеням, плотность их увеличивается (преобразуются в ЛППП ). Катаболическая фаза обмена ХС осуществляется ЛПВП , которые переносят его из тканей в печень, откуда он в составе желчи выводится через ЖКТ из организма.
У хромопротеинов простетической группой может быть вещество, имеющее окраску. Подкласс — гемопротеиды , небелковой частью служит гем . Гемоглобин эритроцитов обеспечивает газообмен, имеет четвертичную структуру, состоит из 4-х разных у эмбриона, плода, ребёнка полипептидных цепей (Раздел IV. Глава 1). В отличие от Hb миоглобин имеет один гем и одну полипептидную цепь, свёрную в глобулу. Сродство миоглобина к кислороду выше, чем у гемоглобина, поэтому он способен принимать газ, депонировать и отдавать митохондриям по мере необходимости. К гемсодержащим белкам относятся каталаза, пероксидаза , являющиеся ферментами АРЗ; цитохромы – компоненты ЭТЦ, отвечающей за основной биоэнергетический процесс в клетках. Среди дегидрогеназ, участников тканевого дыхания, находят флавопротеины – хромопротеины, имеющие жёлтую (flavos — жёлтый) окраску за счёт наличия в них флавоноидов – компонентов ФМН и ФАД. Родопсин – сложный белок, простетической группой которого служит активная форма витамина А – ретинол жёлто-оранжевого цвета. Зрительный пурпур – основное светочувствительное вещество палочек сетчатки глаза, обеспечивает восприятие света в сумерках.
Функции белков
| Структурная
(пластическая) |
Протеины составляют основу клеточных и органоидных мембран, а также составляют основу ткани (коллаген в соединительной ткани). |
| Каталитическая | Все ферменты – белки — биокатализаторы. |
| Регуляторная | Многие гормоны, секретируемые передней долей гипофиза, паращитовидными железами имеют белковую природу. |
| Транспортная | В плазме крови альбумины обеспечивают перенос ВЖК, билирубина. Трансферрин отвечает за доставку катионов железа. |
| Дыхательная | Мицеллы гемоглобина , локализующиеся в эритроцитах, способны связываться с различными газами, в первую очередь, с кислородом, углекислотой, участвуя непосредственно в газообмене. |
| Сократительная | Специфические белки миоцитов (актин и миозин ) — участники сокращения и расслабления. Подобный эффект в момент расхождения хромосом при митозе проявляет протеин цитоскелета тубулин . |
| Защитная | Белковые факторы свёртывания крови защищают организм от неадекватных кровопотерь. Иммунные белки (γ-глобулины, интерферон, протеины системы комплемента) борются с поступающими в организм чужеродными веществами – антигенами . |
| Гомеостатическая | Вне- и внутриклеточные белки могут удерживать на постоянном уровне рН (буферные системы ) и онкотическое давление среды. |
| Рецепторная | Гликопротеины клеточных и органоидных мембран, локализуясь на наружных участках, воспринимают различные сигналы регуляции. |
| Зрительная | Зрительные сигналы в сетчатке принимает белок – родопсин . |
| Питательная | Альбумины и глобулины плазмы крови служат резервами аминокислот |
| Белки хромосом (гистоны, протамины ) участвуют в создании баланса экспрессии и репрессии генетической информации. | |
| Энергетическая | При голодании или патологических процессах, когда нарушается использование углеводов с энергетической целью (при сахарном диабете) усиливается тканевой протеолиз, продукты которого аминокислоты (кетогенные ), распадаясь, служат источниками энергии. |
Классификация белков базируется на их химическом составе. Согласно этой классификации белки бывают простые и сложные . Простые белки состоят только из аминокислот, то есть из одного или нескольких полипептидов. К простым белкам, имеющимся в организме человека, относятся альбумины, глобулины, гистоны, белки опорных тканей.
В молекуле сложного белка, кроме аминокислот, ещё имеется неаминокислотная часть, называемая простетической группой. В зависимости от строения этой группы выделяют такие сложные белки, как фосфопротеиды(содержат фосфорную кислоту), нуклеопротеиды (содержат нуклеиновую кислоту), гликопротеиды (содержат углевод), липопротеиды (содержат липоид) и другие.
Согласно классификации, которая базируется на пространственной форме белков, белки разделяются на фибриллярные и глобулярные.
Фибриллярные белки состоят из спиралей, то есть преимущественно из вторичной структуры. Молекулы глобулярных белков имеют шаровидную и эллипсоидную форму.
Примером фибриллярных белков является коллаген – самый распространенный белок в теле человека. На долю этого белка приходится 25-30% от общего числа белков организма. Коллаген обладает высокой прочностью и эластичностью. Он входит в состав сосудов мышц, сухожилий, хрящей, костей, стенки сосудов.
Примером глобулярных белков являются альбумины и глобулины плазмы крови.
Физико-химические свойства белков.
Одной из главных особенностей белков является их большая молекулярная масса , которая колеблется в диапазоне от 6000 до нескольких миллионов дальтон.
Другим важным физико-химическим свойством белков является их амфотерность, то есть наличие, как кислотных, так и основных свойств. Амфотерность связана с наличием в составе некоторых аминокислот свободных карбоксильных групп, то есть кислотных, и аминогрупп, то есть щелочных. Это приводит к тому, что в кислой среде белки проявляют щелочные свойства, а в щелочной среде – кислотные. Однако при определенных условиях белки проявляют нейтральные свойства. Значение рН, при котором белки проявляют нейтральные свойства, называется изоэлектрической точкой . Изоэлектрическая точка для каждого белка индивидуальна. Белки по этому показателю делят на два больших класса – кислые и щелочные, так как изоэлектрическая точка может быть сдвинута либо в одну, либо в другую сторону.
Еще одно важное свойство белковых молекул – это растворимость. Несмотря на большой размер молекул белки довольно хорошо растворимы в воде. Причем растворы белков в воде весьма устойчивы. Первой причиной растворимости белков является наличие на поверхности молекул белков заряда, благодаря чему белковые молекулы практически не образуют нерастворимые в воде агрегаты. Второй причиной устойчивости белковых растворов является наличие у белковой молекулы гидратной (водной) оболочки. Гидратная оболочка отделяет белки друг от друга.
Третье важное физико-химическое свойство белков – это высаливание, то есть способность выпадать в осадок под действием водоотнимающих средств. Высаливание – процесс обратимый. Эта способность то переходить в раствор, то выходить из него очень важна для проявления многих жизненных свойств.
Наконец, важнейшим свойством белков является его способность к денатурации. Денатурация - это потеря белком нативности. Когда мы делаем яичницу на сковороде, мы получаем необратимую денатурацию белка. Денатурация заключается в постоянном или временном нарушении вторичной и третичной структуры белка., но при этом первичная структура сохраняется. Помимо температуры(выше 50 градусов) денатурацию могут вызвать другие физические факторы: излучении, ультразвук, вибрация, сильные кислоты и щелочи. Денатурация может быть обратимой и необратимой. При небольших воздействиях разрушение вторичной и третичной структур белка происходит незначительное. Поэтому белок при отсутствии денатурирующего воздействия может восстановить свою нативную структуру. Процесс обратный денатурации называется ренатурация. Однако при продолжительном и сильном воздействии ренатурация становится невозможной, а денатурация, таким образом, необратимой.
Прежде чем рассказать про свойства белков, стоит дать краткое определение данному понятию. Это высокомолекулярные органические вещества, которые состоят из соединенных пептидной связью альфа-аминокислот. Белки являются важной частью питания человека и животных, поскольку не все аминокислоты вырабатываются организмом - некоторые поступают именно с едой. Каковы же их свойства и функции?
Амфотерность
Это первая особенность белков. Под амфотерностью подразумевается их способность проявлять как кислотные, так и основные свойства.
Белки в своей структуре имеют несколько видов химических группировок, которые способны ионизировать в растворе Н 2 О. К таковым относятся:
- Карбоксильные остатки. Глутаминовая и аспарагиновая кислоты, если быть точнее.
- Азотсодержащие группы. ε-аминогруппа лизина, аргининовый остаток CNH(NH 2) и имидазольный остаток гетероциклической альфа-аминокислоты под названием гистидин.
У каждого белка имеется такая особенность, как изоэлектрическая точка. Под данным понятием понимают кислотность среды, при которой поверхность или молекула не имеет электрического заряда. При таких условиях сводится к минимуму гидратация и растворимость белка.
Показатель определяется соотношением основных и кислых аминокислотных остатков. В первом случае точка приходится на щелочную область. Во втором - на кислую.

Растворимость
По данному свойству белки подразделяются на небольшую классификацию. Вот какими они бывают:
- Растворимыми . Их называют альбуминами. Они умеренно растворяются в концентрированных соляных растворах и сворачиваются при нагревании. Эта реакция называется денатурацией. Молекулярная масса альбуминов составляет около 65 000. В них нет углеводов. А вещества, которые состоят из альбумина, именуются альбуминоидами. К таковым относится яичный белок, семена растений и сыворотка крови.
- Нерастворимыми . Их называют склеропротеинами. Яркий пример - кератин, фибриллярный белок с механической прочностью, уступающей только хитину. Именно из этого вещества состоят ногти, волосы, рамфотека птичьих клювов и перьев, а также рога носорога. Еще в эту группу белков включены цитокератины. Это структурный материал внутриклеточных филаментов цитоскелета клеток эпителия. Еще к нерастворимым белкам относят фибриллярный белок под названием фиброин.
- Гидрофильными . Они активно взаимодействуют с водой и впитывают ее. К таковым относятся белки межклеточного вещества, ядра и цитоплазмы. В том числе пресловутый фиброин и кератин.
- Гидрофобными . Они отталкивают воду. К ним относятся белки, являющиеся составляющими биологических мембран.

Денатурация
Так называется процесс видоизменения белковой молекулы под воздействием определенных дестабилизирующих факторов. При этом аминокислотная последовательность остается той же. Но белки теряют их естественные свойства (гидрофильность, растворимость и другие).
Стоит отметить, что любое весомое изменение внешних условий способно привести к нарушениям структур белка. Чаще всего денатурацию провоцирует повышение температуры, а также оказываемое на белок воздействие щелочи, сильной кислоты, радиации, соли тяжелых металлов и даже определенных растворителей.
Интересно, что нередко денатурация приводит к тому, что частицы белка агрегатируются в более крупные. Ярким примером является, например, яичница. Всем ведь знакомо, как в процессе жарки белок образуется из прозрачной жидкости.
Еще следует рассказать о таком явлении, как ренатурация. Этот процесс обратен денатурации. Во время него белки возвращаются к природной структуре. И это действительно возможно. Группа химиков из США и Австралии нашла способ, с помощью которого можно ренатурировать сваренное вкрутую яйцо. Уйдет на это всего несколько минут. А потребуется для этого мочевина (диамид угольной кислоты) и центрифугирование.
Структура
О ней необходимо сказать в отдельности, раз речь идет о значении белков. Всего выделяют четыре уровня структурной организации:
- Первичная . Подразумевается последовательность остатков аминокислот в цепи полипептидов. Главная особенность - это консервативные мотивы. Так называются устойчивые сочетания остатков аминокислот. Они есть во многих сложных и простых белках.
- Вторичная . Имеется в виду упорядочивание какого-либо локального фрагмента цепи полипептидов, которое стабилизируют водородные связи.
- Третичная . Так обозначается пространственное строение цепи полипептидов. Состоит данный уровень из некоторых вторичных элементов (их стабилизируют разные типы взаимодействий, где гидрофобные являются важнейшими). Здесь в стабилизации участвуют ионные, водородные, ковалентные связи.
- Четвертичная . Ее еще называют доменной или субъединичной. Данный уровень состоит из взаимного расположения цепей полипептидов в составе цельного белкового комплекса. Интересно, что в состав белков с четвертичной структурой входят не только идентичные, но еще и отличающиеся цепочки полипептидов.
Данное деление было предложено датским биохимиком по имени К. Линдстрем-Ланг. И пусть считается, что оно устарело, пользоваться им все равно продолжают.

Типы строения
Рассказывая про свойства белков, следует также отметить, что эти вещества делятся на три группы в соответствии с типом строения. А именно:
- Фибриллярные белки. Они имеют нитевидную вытянутую структуру и большую молекулярную массу. Большинство из них не растворяется в воде. Структура этих белков стабилизируется взаимодействиями между полипептидными цепями (они состоят как минимум из двух остатков аминокислот). Именно фибриллярные вещества образуют полимер, фибриллы, микротрубочки и микрофиламенты.
- Глобулярные белки. Вид структуры обуславливает их растворимость в воде. А общая форма молекулы отличается сферичностью.
- Мембранные белки. Строение этих веществ имеет интересную особенность. У них есть домены, которые пересекают клеточную мембрану, но их части выступают в цитоплазму и межклеточное окружение. Эти белки играют роль рецепторов - передают сигналы и отвечают за трансмембранную транспортировку питательных веществ. Важно оговориться, что они весьма специфичны. Каждый белок пропускает лишь определенную молекулу или сигнал.
Простые
О них тоже можно рассказать чуть подробнее. Простые белки состоят лишь из цепей полипептидов. К ним относятся:
- Протамин . Ядерный низкомолекулярный белок. Его присутствие является защитой ДНК от действия нуклеаз - ферментов, атакующих нуклеиновые кислоты.
- Гистоны . Сильноосновные простые белки. Они сосредоточены в ядрах клеток растений и животных. Принимают участие в «упаковке» ДНК-нитей в ядре, а еще в таких процессах, как репарация, репликация и транскрипция.
- Альбумины . О них уже говорилось выше. Самые известные альбумины - сывороточный и яичный.
- Глобулин . Участвует в свертывании крови, а также в других иммунных реакциях.
- Проламины . Это запасные белки злаков. Названия у них всегда разные. У пшеницы они именуются птиалинами. У ячменя - гордеинами. У овса - авснинами. Интересно, что проламины делятся на свои классы белков. Их всего две: S-богатые (с содержанием серы) и S-бедные (без нее).

Сложные
Что касательно сложных белков? Они содержат простетические группы или те, в которых нет аминокислот. К ним относятся:
- Гликопротеины . В их состав входят углеводные остатки с ковалентной связью. Эти сложные белки - важнейший структурный компонент клеточных мембран. К ним относятся также многие гормоны. А еще гликопротеины эритроцитовых мембран определяют группу крови.
- Липопротеины . Состоят из липидов (жироподобных веществ) и играют роль «транспорта» данных веществ в крови.
- Металлопротеиды . Эти белки в организме имеют огромное значение, так как без них не протекает обмен железа. В состав их молекул входят ионы металлов. А типичными представителями данного класса являются трансферрин, гемосидерин и ферритин.
- Нуклеопротеиды . Состоят из РКН и ДНК, не имеющих ковалентной связи. Яркий представитель - хроматин. Именно в его составе реализуется генетическая информация, репарируется и реплицируется ДНК.
- Фосфопротеины . Их составляют остатки фосфорной кислоты, связанные ковалентно. В качестве примера можно привести казеин, который изначально содержится в молоке, как соль кальция (в связанном виде).
- Хромопротеиды . У них простое строение: белок и окрашенный компонент, относящийся к простетической группе. Они принимают участие в клеточном дыхании, фотосинтезе, окислительно-восстановительных реакциях и т. д. Также без хромопротеидов не происходит аккумулирование энергии.
Обмен веществ
Выше уже было многое рассказано про физико-химические свойства белков. Об их роли в обмене веществ тоже нужно упомянуть.
Есть аминокислоты, являющиеся незаменимыми, поскольку они не синтезируются живыми организмами. Млекопитающие сами получают их из пищи. В процессе ее переваривания белок разрушается. Начинается этот процесс с денатурации, когда его помещают в кислотную среду. Затем - гидролиз, в котором участвуют ферменты.
Определенные аминокислоты, которые в итоге получает организм, участвуют в процессе синтеза белков, свойства которых необходимы для его полноценного существования. А оставшаяся часть перерабатывается в глюкозу - моносахарид, являющийся одним из основных источников энергии. Белок очень важен в условиях диет или голодания. Если он не будет поступать вместе с едой - организм начнет «есть себя» - перерабатывать собственные белки, особенно мускульные.

Биосинтез
Рассматривая физико-химические свойства белков, нужно заострить внимание и на такой теме, как биосинтез. Эти вещества формируются на основе той информации, которая закодирована в генах. Любой белок - это уникальная последовательность остатков аминокислот, определяемая геном, кодирующим его.
Как это происходит? Ген, кодирующий белок, переносит информацию с ДНК на РНК. Это называется транскрипцией. В большинстве случаев синтез затем происходит на рибосомах - это важнейший органоид живой клетки. Данный процесс именуется трансляцией.
Есть еще так называемый нерибосомный синтез. Его тоже стоит упомянуть, раз речь идет о значении белков. Этот вид синтеза наблюдается у некоторых бактерий и низших грибов. Процесс осуществляется посредством высокомолекулярного белкового комплекса (известен как NRS-синтаза), и рибосомы в этом участия не принимают.
И, конечно же, существует еще химический синтез. С его помощью можно синтезировать короткие белки. Для этого используются методы вроде химического лигирования. Это противоположность пресловутого биосинтеза на рибосомах. Таким же методом удается получить ингибиторы определенных ферментов.
К тому же благодаря химическому синтезу можно вводить в состав белков те остатки аминокислот, которые в обычных веществах не встречаются. Допустим те, у боковых цепей которых есть флюоресцентные метки.
Стоит оговориться, что методы химического синтеза не безупречны. Есть определенные ограничения. Если в белке содержится более 300 остатков, то искусственно синтезированное вещество, скорее всего, получит неправильную структуру. А это отразится на свойствах.

Вещества животного происхождения
Их рассмотрению необходимо уделить особое внимание. Животный белок - это вещество, содержащийся в яйцах, мясе, молочных продуктах, птице, морепродуктах и рыбе. В них имеются все аминокислоты, необходимые организму, в том числе и 9 незаменимых. Вот целый ряд важнейших функций, которые выполняет животный белок:
- Катализ множества химических реакций. Данное вещество запускает их и ускоряет. За это «ответственны» ферментативные белки. Если в организм не будет поступать их достаточное количество, то окисление и восстановление, соединение и разрыв молекулярных связей, а также транспортировка веществ не будут протекать полноценно. Интересно, что лишь малая часть аминокислот вступают в различного рода взаимодействия. И еще меньшее количество (3-4 остатка) непосредственно задействовано в катализе. Все ферменты делят на шесть классов - оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы. Каждый из них отвечает за ту или иную реакцию.
- Формирование цитоскелета, образующего структуру клеток.
- Иммунная, химическая и физическая защита.
- Транспортировка важных компонентов, необходимых для роста и развития клеток.
- Передача электрических импульсов, важных для работы всего организма, поскольку без них невозможно взаимодействие клеток.
И это далеко не все возможные функции. Но даже так понятна значимость данных веществ. Синтез белка в клетках и в организме невозможен, если человек не будет употреблять в пищу его источники. А ими является мясо индейки, говядина, баранина, крольчатина. Еще много белка содержится в яйцах, сметане, йогурте, твороге, молоке. Также активировать синтез белка в клетках организма можно, добавив в свой рацион ветчину, субпродукты, колбасу, тушенку и телятину.
И являются одними из наиболее сложных по строению и составу среди всех органических соединений.
Биологическая роль белков исключительно велика: они составляют основную массу протоплазмы и ядер живых клеток. Белковые вещества находятся во всех растительных и животных организмах. О запасе белков в природе можно судить по общему количеству живого вещества на нашей планете: масса белков составляет примерно 0,01% от массы земной коры, то есть 10 16 тонн.
Белки по по своему элементному составу отличаются от углеводов и жиров: кроме углерода, водорода и кислорода они ещё содержат азот. Кроме того, Постоянной составной частью важнейших белковых соединений является сера, а некоторые белки содержат фосфор, железо и йод.
Свойства белков
1. Разная растворимость в воде. Растворимые белки образуют коллоидные растворы.
2. Гидролиз - под действием растворов минеральных кислот или ферментов происходит разрушение первичной структуры белка и образование смеси аминокислот.
3. Денатурация - частичное или полное разрушения пространственной структуры, присущей данной белковой молекуле. Денатурация происходит под действием:
- - высокой температуры
- - растворов кислот, щелочей и концентрированных растворов солей
- - растворов солей тяжёлых металлов
- - некоторых органических веществ (формальдегида, фенола)
- - радиоактивного излучения
Строение белков
Строение белков начали изучать в 19 веке. В 1888г. русский биохимик А.Я.Данилевский высказал гипотезу о наличии в белках амидной связи . Эта мысль в дальнейшем была развита немецким химиком Э.Фишером и в его работах нашла экспериментальное подтверждение. Он предложил полипептидную теорию строения белка . Согласно этой теории молекула белка состоит из одной длинной цепи или нескольких полипептидных цепей, связанных друг с другом. Такие цепи могут быть различной длины.
Фишером проведена большая экспериментальная работа с полипептидами . Высшие полипептиды, содержащие 15-18 аминокислот, осаждаются из растворов сульфатом аммония (аммиачными квасцами), то есть проявляют свойства, характерные для белков . Было показано, что полипептиды расщепляются теми же ферментами, что и белки, а будучи введёнными в организм животного, подвергаются тем же превращениям, как и белки, а весь их азот выделяется нормально в виде мочевины (карбамида).
Исследования, проведённые в 20 веке, показали, что существует несколько уровней организации белковой молекулы .

В организме человека тысячи различных белков и практически все они построены из стандартного набора 20 аминокислот. Последовательность аминокислотных остатков в молекуле белка называют первичной структурой белка . Свойства белков и их биологические функции определяются последовательностью аминокислот. Работы по выяснению первичной структуры белка впервые были выполнены в Кембриджском университете на примере одного из простейших белков - инсулина . В течение посте 10 лет английский биохимик Ф.Сенгер проводил анализ инсулина . В результате анализа выяснено, что молекула инсулина состоит из двух полипептидных цепей и содержит 51 аминокислотный остаток. Он установил, что инсулин имеет молярную массу 5687 г/моль, а его химический состав отвечает формуле C 254 H 337 N 65 O 75 S 6 . Анализ проводился вручную с использованием ферментов, которые избирательно гидролизуют пептидные связи между определёнными аминокислотными остатками.
В настоящее время большая часть работы по определению первичной структуры белков
автоматизирована. Так была установлена первичная структура фермента лизоцима
.
Тип "укладки" полипептидной цепочки называют вторичной структурой. У большинства белков
полипептидная цепь свёртывается в спираль, напоминающую "растянутую пружину" (называют "А-спираль" или "А-стуктура"). Еще один распространённый тип вторичной структуры - структура складчатого листа (называют "B - структура"). Так, белок шёлка
- фиброин
имеет именно такую структуру. Он состоит из ряда полипептидных цепей, которые располагаются параллельно друг-другу и соединяются посредством водородных связей, большое число которых делает шёлк очень гибким и прочным на разрыв.
При всём этом практически не существует белков, молекулы которых на 100% имеют "А-структуру" или "B - структуру".
 Белок фиброин - белок натурального шёлка
Белок фиброин - белок натурального шёлка
Пространственное положение полипептидной цепи называют третичной структурой белкой. Большинство белков относят к глобулярным, потому что их молекулы свёрнуты в глобулы. Такую форму белок поддерживает благодаря связям между разнорзаряженными ионами (-COO - и -NH 3 + и дисульфидных мостиков. Кроме того, молекула белка свёрнута так, что гидрофобные углеводородные цепи оказываются внутри глобулы, а гидрофильные - снаружи.
Способ объединения нескольких молекул белка в одну макромолекулу называют четвертичной стуктурой белка . Ярким примером такого белка может быть гемоглобин . Было установлено, что, например, для взрослого человека молекула гемоглобина состоит из 4-х отдельных полипептидных цепей и небелковой части - гема.
Свойства белков объясняет их различное строение. Большинство белков аморфно, в спирте, эфире и хлороформе нерастворимо. В воде некоторые белки могут растворяться с образованием коллоидного раствора. Многие белки растворимы в растворах щелочей, некоторые - в растворах солей, а некоторые - в разбавленном спирте. Кристаллическое состояние белов встречается редко: примером могут быть алейроновые зёрна, встречающиеся в клещевине, тыкве, конопле. Кристаллизуется также альбумин куриного яйца и гемоглобин в крови.
Гидролиз белков
При кипячении с кислотами или щелочами, а также под действием ферментов белки распадаются на более простые химические соединения, образуя в конце цепочки превращения смесь A-аминокислот . Такое расщепление называется гидролизом белка . Гидролиз белка имеет большое биологическое значение: попадая в желудок и кишечник животного или человека, белок расщепляется под действием ферментов на аминокислоты. Образовавшиеся аминокислоты в дальнейшем под влиянием ферментов снова образуют белки, но уже характерные для данного организма!
В продуктах гидролиза белков кроме аминокислот были найдены углеводы, фосфорная кислота, пуриновые основания. Под влиянием некоторых факторов например, нагревания,растворов солей, кислот и щелочей, действия радиации, встряхивания, может нарушиться пространственная структура, присущая данной белковой молекуле. Денатурация может носить обратимый или необратимый характер, но в любом случае аминокислотная последовательность, то есть первичная структура, остаётся неизменной. В результате денатурации белок перестаёт выполнять присущие ему биологические функции.
Для белков известны некоторые цветные реакции, характерные для их обнаружения. При нагревании мочевины образуется биурет, который с раствором сульфата меди в присутствии щелочи даёт фиолетовое окрашивание или качественная реакция на белок , которую можно провести дома). Биуретовую реакцию даёт вещества, содержащие амидную группу, а в молекуле белка эта группа присутствует. Ксантопротеиновая реакция заключается в том, что белок от концентрированной азотной кислоты окрашивается в жёлтый цвет. Эта реакция указывает на наличие в белке бензольной группы, которая имеется в таких аминокислотах, как фениланин и тирозин.
При кипячении с водным раствором нитрата ртути и азотистой кислоты, белок даёт красное окрашивание. Эта реакция указывает на наличие в белке тирозина. При отсутствии тирозина красного окрашивания не появляется.