Применение и формулировки второго закона термодинамики. Законы термодинамики и их описание

Читайте также
Согласно закону сохранения энергии в случае определенных процессов, объем используемой энергии остается неизменным. Для того, чтобы объяснить как энергия может превращаться можно обратиться к понятию второй закон термодинамики . Данный закон подтверждает необратимость некоторых явлений в природе и указывает траекторию энергетических изменений внутри определенных процессов. Закон был сформулирован на основе наблюдений за происходящее в природе, что позволило понять сущность и характер протекания определенных явлений. Все законы физики основаны на опытах и наблюдениях и позволили формулировать определенные заявления на основе происходящего в природе.
В качестве основы для второго закона термодинамики стали необратимые и непроизвольные процессы, которые происходят исключительно в одно направление и/или без постороннего внешнего воздействия. Классические примеры таких процессов это старение, смерть. Без того чтобы обобщать, можно обратиться к более простым процессам: духи распространяются очень быстро при распылении, а обратному соединению они не подаются; также легко превратить яйца в омлет, так что обратно в скорлупу их невозможно вернуть.
Закон работает в изолированных системах, но также может восприниматься как рабочим в случае систем, у которых есть возможность получить тепло извне. В подобных системах энтропия будет расти даже быстрее. Показатель энтропии указывает на систему с характером неупорядоченности, то есть сама энтропия и есть мера беспорядка. Высокий показатель энтропии это высокий уровень хаотичности движения частиц внутри системы. Классический пример этого состояния это превращение льда в воду и его невозможность стать снова льдом самостоятельно. В случае превращения воды в лед должно происходить понижение уровня энтропии.

Говоря о том, что такое термодинамика второй закон необходимо вспомнить, что собой представляет первый закон термодинамики . Он олицетворение всех известных процессов в природе и соблюдается с 100% точностью. Все что может противоречить этому закону, в природе не существует. Данный закон ничего не отрицает, но и не утверждает, а в качестве вспомогательного элемента для разъяснения определенных процессов вступает второй закон термодинамики, всем известный в разных формулировках. Невзирая на то, что закон простой, он часто интерпретируется некорректно.
Второй закон термодинамики появился, как необходимость определить направление физических процессов определенные первым законом. В первую очередь необходимо отметить, что разные виды энергии обладают различной способностью перевоплощаться в другую энергию. Существует ограничение, которое не позволяет внутренней энергии стать механической энергии и это разъясняется законами термодинамики.

Второй закон термодинамики в различных формулировках
Существует несколько формулировок данного закона, которые объясняют одну правду различными способами. Первый кто сформулировал его это Р. Клаузиус, после последовали формулировки Томсона, Больцмана, Кельвина. Наличие различных интерпретации данного закона позволяет его понять лучше. Поэтому будет не лишним ознакомиться с каждым из них.
1. Переход тепла от тела с невысокой температурой к другому телу с более высоким уровнем температуры невозможен. (Клаузиус)
2. Любой процесс является невозможным, если для его осуществления должно использоваться тепло взятое от постороннего тела.
(Томсон)
3. Состояние энтропии не может стать меньше в полностью закрытых системах, которые не получают никакую внешнюю энергию.
(Больцман)
4. Периодические процессы, происходящие исключительно за счет теплоты единого источника являются невозможными. Создание вечного теплового двигателя, который совершал бы механические процессы за счет потери тепла любого тела, является невозможным. (Кельвин).
Согласно всем формулировкам можно условно определить, что процессы можно называть необратимыми, если механическая энергия проходит путь модификации во внутренней энергии при наличии процесса трения. Отсутствие параметра трение позволило бы в ином случае получать обратное протекание процессов. Обратные процессы можно считать абстрактными с учетом того, что протекают они, как правило, в присутствии реакции теплообмена и трения.

Второй закон термодинамики формулы
Существуют определенные уравнения, которые помогают рассматривать второй закон термодинамики согласно более конкретным данным. Основное уравнение это уравнение Больцмана, которое позволяет вычислять параметр энтропия.
S = Q/ T
С целью понять, что собой представляет параметр энтропия можно рассмотреть пример с системой, в которой два тела с не одинаковой температурой будут обмениваться теплом, пока температура обоих тел не сравнится. Тепло будет передаваться исключительно от тела с температурой выше к более холодному. Тело, которое отдает тепло, получает пониженный уровень энтропии, только не по тем параметрам, по которым увеличиться энтропия тела, получившее это тепло. Энтропия обеих тел по итогам после процесса передачи тепла будет выше для всей системы. Это указывает, что данная величина стремиться к энному максимуму для всех закрытых систем. Также неопровержимо заявление относительно того, что действие по передаче тепла будет продолжать происходить самопроизвольно, пока будут существовать перепады температуры.
Законы термодинамики называют также ее началами. На самом деле начало термодинамики представляет собой не что иное, как совокупность тех или иных постулатов, которые лежат в основе соответствующего раздела молекулярной физики. Данные положения устанавливали в течение научных исследований. В то же время они были доказаны экспериментальным путем. Почему же законы термодинамики принимают за постулаты? Все дело в том, что таким образом термодинамику можно строить аксиоматическим путем.
Основные законы термодинамики
Немного о структуризации. Законы термодинамики разделяются на четыре группы, каждая из которых имеет определенный смысл. Итак, что могут поведать нам начала термодинамики?
Первое и второе

Первое начало расскажет о том, как применяется закон сохранения энергии по отношению к той или иной термодинамической системе. Второе начало выдвигает некоторые ограничения, которые применяются к направлениям термодинамических процессов. Более конкретно, они запрещают самопроизвольную передачу тепла, совершаемую от менее нагретого к более нагретому телу. Есть у второго закона термодинамики и альтернативное название: закон возрастания энтропии.

Третье и четвертое
Третий закон описывает поведение энтропии вблизи абсолютного температурного нуля. Есть еще одно начало, последнее. Оно носит название “нулевой закон термодинамики”. Смысл его заключается в том, что любая замкнутая система придет к состоянию термодинамического равновесия и из него выйти уже самостоятельно не сможет. При этом ее начальное состояние может быть любым.
Зачем нужны начала термодинамики?
Законы термодинамики были изучены для того, чтобы описывать макроскопические параметры тех или иных систем. При этом конкретные предложения, имеющие связь с микроскопическим устройством, не выдвигаются. Этот вопрос изучается отдельно, но уже другим ответвлением науки - статистической физикой. Законы термодинамики независимы друг от друга. Что это может означать? Это нужно понимать так, что ни одно начало термодинамики из другого вывести невозможно.
Первое начало термодинамики

Как известно, термодинамическая система характеризуется несколькими параметрами, в числе которых есть и внутренняя энергия (обозначается буквой U). Последняя формируется из кинетической энергии, которую имеют все частицы. Это может быть энергия поступательного, а также колебательного и вращательного движения. На этом моменте вспомним о том, что энергия может быть не только кинетической, но и потенциальной. Так вот, в случае идеальных газов потенциальной энергией пренебрегают. Именно поэтому внутренняя энергия U будет складываться исключительно из кинетической энергии движения молекул и зависеть от температуры.

Эта величина - внутренняя энергия - называется иными словами функцией состояния, поскольку она определяется состоянием термодинамической системы. В нашем случае она определяется температурой газа. Следует отметить, что внутренняя энергия не зависит от того, каким был переход в состояние. Допустим, что термодинамическая система совершает круговой процесс (цикл, как его называют в молекулярной физике). Иными словами, система, выйдя из начального состояния, подвергается определенным процессам, но в результате возвращается в первичное состояние. Тогда нетрудно догадаться, что изменение внутренней энергии будет равно 0.
Как изменяется внутренняя энергия?
Изменить внутреннюю энергию идеального газа можно двумя способами. Первый вариант - совершить работу. Второй - сообщить системе то или иное количество теплоты. Логично, что второй способ подразумевает не только сообщение теплоты, но и ее отнятие.
Формулировка первого начала термодинамики
Их (формулировок) может быть несколько, так как все любят говорить по-разному. Но на самом деле суть остается той же. Она сводится к тому, что количество теплоты, которое было подведено к термодинамической системе, расходуется на совершение идеальным газом механической работы и изменение внутренней энергии. Если говорить о формуле или математической записи первого начала термодинамики, то она выглядит следующим образом: dQ = dU + dA.
Все величины, которые входят в состав формулы, могут иметь разные знаки. Ничто не запрещает им быть отрицательными. Допустим, что к системе подводится количество теплоты Q. Тогда газ будет нагреваться. Возрастает температура, а значит, увеличивается и внутренняя энергия газа. То есть и Q, и U будут иметь положительные значения. Но если внутренняя энергия газа увеличивается, он начинает вести себя активнее, расширяться. Следовательно, работа также будет положительной. Можно сказать, что работу совершает сама система, газ.
В случае если у системы забирают определенное количество теплоты, внутренняя энергия уменьшается, а газ сжимается. В таком случае можно говорить уже о том, что работу совершают над системой, а не она сама. Предположим опять, что некоторая термодинамическая система совершает цикл. В таком случае (как уже было сказано ранее) изменение внутренней энергии будет равно 0. Значит, работа, совершаемая газом или над ним, будет численно равна подведенной или отведенной к системе теплоте.
Математическую запись этого следствия называют еще одной формулировкой первого начала термодинамики. Примерно она звучит следующим образом: “В природе невозможно существование двигателя первого рода, то есть, двигателя, который совершал бы работу, превосходящую полученную извне теплоту”.
Второе начало термодинамики
Нетрудно догадаться, что термодинамическое равновесие характерно для системы, в которой макроскопические величины остаются неизменными во времени. Это, конечно же, давление, объем и температура газа. Их неизменность может быть построена на нескольких условиях: на отсутствии теплопроводности, химических реакций, диффузии и других процессов. Если под действием внешних факторов система была выведена из термодинамического равновесия, она к нему со временем вернется. Но если эти факторы будут отсутствовать. Причем произойдет это самопроизвольно.

Мы пойдем немного другим путем, отличным от того, что рекомендуют многие учебники. Для начала ознакомимся со вторым началом термодинамики, а уже потом разберемся, что за величины в него входят, и что они обозначают. Итак, в замкнутой системе при наличии любых протекающих в ней процессов энтропия не убывает. Записывается второе начало термодинамики следующим образом: dS >(=) 0. Здесь знак > будет связан с необратимым процессом, а знак = - с обратимым.
Что же называется в термодинамике обратимым процессом? А это такой процесс, при котором система возвращается (спустя череду каких-то процессов) к своему первоначальному состоянию. Причем в этом случае ни в системе, ни в окружающей среде никаких изменений не остается. Иными словами, обратимый процесс - это такой процесс, для которого возможно возвращение в начальное состояние через промежуточные состояния, идентичные прямому процессу. В молекулярной физике таких процессов очень мало. Например, переход количества теплоты от более нагретого тела к менее нагретому будет необратимым. Аналогично и в случае диффузии двух веществ, а также распространения газа на весь объем.
Энтропия
Энтропия, имеющая место во втором законе термодинамики, равна изменению количества теплоты, деленному на температуру. Формула: dS = dQ/T. Она имеет определенные свойства.
Необратимым называется физический процесс , который может самопроизвольно протекать только в одном определенном направлении.
В обратном направлении такие процессы могут протекать только как одно из звеньев более сложного процесса.
Необратимыми являются практически все процессы, происходящие в природе. Это связано с тем, что в любом реальном процессе часть энергии рассеивается за счет излучения, трения и т. д. Например, тепло, как известно, всегда переходит от более горячего тела к более холодному — это наиболее типичный пример необратимого процесса (хотя обратный переход не противоречит закону сохранения энергии).
Также висящий на легкой нити шарик (маятник) никогда самопроизвольно не увеличит ам-плитуду своих колебаний, наоборот, приведенный однажды в движение посторонней силой, он обязательно, в конце концов, остановится в результате сопротивления воздуха и трения нити о подвес. Таким образом, сообщенная маятнику механическая энергия переходит во внутреннюю энергию хаотического движения молекул (воздуха, материала подвеса).
Математически необратимость механических процессов выражается в том, что уравнение движения макроскопических тел изменяется с изменением знака времени: они не инвариантны при замене t на - t . При этом ускорение и силы, зависящие от расстояний, не изменяют свои знаки. Знак при замене t на - t меняется у скорости . Соответственно знак меняет сила , зависящая от скорости, — сила трения . Именно поэтому при совершении работы силами трения кинетическая энергия тела необратимо переходит во внутреннюю.
Направленность процессов в природе указывает второй закон термодинамики.
Второй закон термодинамики.
Второй закон термодинамики — один из основных законов термодинамики , устанавливающий необратимость реальных термодинамических процессов.
Второй закон термодинамики был сформулирован как закон природы Н. Л. С. Карно в 1824 г., затем У. Томсоном (Кельвином) в 1841 г. и Р. Клаузиусом в 1850 г. Формулировки закона различны, но эквивалентны.
Немецкий ученый Р. Клаузиус формулировал закон так: невозможно перевести теплоту от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или окружающих телах. Это означает, что теплота не может самопроизвольно пере-ходить от более холодного тела к более горячему (принцип Клаузиуса ).
Согласно формулировке Томсона процесс, при котором работа переходит в тепло без каких-либо иных изменений состояния системы, необратим, т. е. невозможно преобразовать в работу все тепло, взятое от тела, не производя никаких других изменений состояния системы (принцип Томсона ).
Второй закон термодинамики. Энтропия.
Второй закон связан с понятием энтропии, являющейся мерой хаоса (или мерой порядка). Второй закон термодинамики гласит, что для вселенной в целом энтропия возрастает.
Существует два классических определения второго закона термодинамики:
Кельвина и Планка
- Клаузиуса
Не существует циклического процесса, который извлекает количество теплоты из резервуара при определенной температуре и полностью превращает эту теплоту в работу. (Невозможно построить периодически действующую машину, которая не производит ничего другого, кроме поднятия груза и охлаждения резервуара теплоты)
Не существует процесса, единственным результатом которого является передача количества теплоты от менее нагретого тела к более нагретому. (Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара)
Оба определения второго закона термодинамики опираются на первый закон термодинамики, утверждающий, что энергия убывает.
Второй закон связан с понятием энтропии (S) .
Энтропия порождается всеми процессами, она связана с потерей системы способности совершать работу. Рост энтропии - стихийный процесс. Если объем и энергия системы постоянны, то любое измение в системе увеличивает энтропию. Если же объем или энергия системы меняются, энтропия системы уменьшается. Однако, энтропия вселенной при этом не уменьшается.
Для того, чтобы энергию можно было использовать, в системе должны быть области с высоким и низким уровнями энергии. Полезная работа производится в результате передачи энергии от области с высоким уровнем энергии к области с низким уровнем энергии.
- 100% энергии не может быть преобразовано в работу
- Энтропия может вырабатываться, но не может быть уничтожена
Эффективность теплового двигателя
Эффективность теплового двигателя, действующего между двумя энергетическими уровнями, определена в пересчете на абсолютные температуры
η = (T h - T c) / T h = 1 - T c / T h
η = эффективность
T c = нижняя граница температуры (K)
Для того, чтобы достичь максимальной эффективности T c должна быть на столько низкой, на сколько это возможно. Чтобы эффект был 100% -м, T c должна равнятся 0 по шкале Kельвина. Практически это невозможно, поэтому эффективность всегда меньше 1 (менее 100%).
- Изменение энтропии > 0
Необратимый процесс - Изменение энтропии= 0
Двусторонний процесс (обратимый) - Изменение энтропии < 0
Невозможный процесс (неосуществимый)
Энтропия определяет относительную способность одной системы влиять на другую. Когда энергия двигается к нижнему энергетическому уровню, где уменьшается возможность влияния на окружающую среду, энтропия увеличивается.
Определение энтропии
Энтропия определяется как:
T = абсолютная температура (K)
Изменение энтропии системы вызвано изменением содержания темпла в ней. Изменение энтропии равно изменению темпла системы деленной на среднюю абсолютную температуру (T a):
Сумма значений (H / T) для каждого полного цикла Карно равна 0. Это происходит из-за того, что каждому положительному H противостоит отрицательное значение H.
- Тепловой цикл Карно
Цикл Карно— идеальный термодинамический цикл.
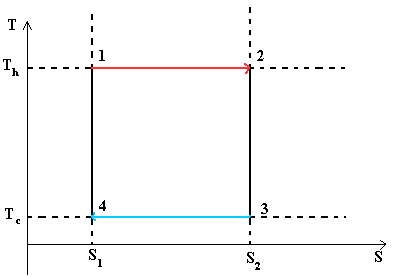
В тепловом двигателе, газ (реверсивно) нагревается (reversibly heated), а затем охлаждается. Модель цика следующая: Положение 1 --() --> Положение 2 --() --> Положение 3 --(изотермическое сжатие) --> Положение 4 --(адиабатическое сжатие) --> Положение 1
Положение 1 - Положение 2: Изотермическое расширение
Изотермическое расширение. В начале процесса рабочее тело имеет температуру T h , то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты Q H . При этом объём рабочего тела увеличивается. Q H =∫Tds=T h (S 2 -S 1) =T h ΔS
Положение 2 - Положение 3: Адиабатическое расширение
Адиабатическое (изоэнтропическое) расширение. Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
Положение 3 - Положение 4: Изотермическое сжатие
Изотермическое сжатие. Рабочее тело, имеющее к тому времени температуру T c , приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты Q c . Q c =T c (S 2 -S 1)=T c ΔS
Положение 4 - Положение 1: Адиабатическое сжатие
Адиабатическое (изоэнтропическое) сжатие. Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия.
Поэтому цикл Карно удобно представить в координатах T и S (температура и энтропия).
Законы термодинамики были определены эмперическим путем (эксперементально). Второй закон термодинамики - это обощение экспериментов, связанных с энтропией. Известно, что dS системы плюс dS окружающей среды равно или больше 0.
- Энтропия адиабатически изолированной системы не меняется!
Пример - Энтропия при нагревании воды
Процесс нагревания 1 кг воды от 0 до 100 o C (273 до 373 K)
При 0 o C = 0 кДж/кг (удельная - на единицу массы)
При 100 o C = 419 кДж/кг
Изменение удельной энтропии:
dS = dH / T a
= ((419 кДж/кг) - (0 кДж/кг)) / ((273 К + 373 К)/2)
= 1.297 кДж/кг*К
Пример - Энтропия при испарении воды
Процесс превращения 1 кг воды при 100 o C (373 K) в насыщенный пар при 100 o C (373 K) при нормальных условиях.
Удельная энтальпия пара при 100 o C (373 K) до испарения = 0 кДж/кг
100 o C (373 K) при испарении = 2 258 кДж/кг
Изменение удельной энтропии:
dS = dH / T a
= (2 258 - 0) / ((373 + 373)/2)
= 6.054 кДж/кг*К
Полное изменение удельной энтропии испарения воды - это сумма удельной энтропии воды (при 0 o C) плюс удельная энтропия пара (при температуре 100 o C).
Министерство образования и науки Российской Федерации
Государственной образовательное учреждение высшего профессионального образования
Ивановский государственный химико-технологический университет
Кафедра Технологии пищевых продуктов и биотехнологии (ТППиБТ)
Реферат
по дисциплине «Техническая термодинамика и теплотехника»
II -ой закон термодинамики или «Тепловая смерть Вселенной»
Выполнил:
студент 3 курса
Ивлев Павел Андреевич
Руководитель:
к т н, доцент, кафедры ПиАХТ
Маркичев Николай Аркадьевич
Иваново 2010 г.
Введение__________________________________________________________________ 3
Часть 1. Второй закон термодинамики.
1.1. Второй закон термодинамики. Характеристика и формулировка._______________4
Часть 2. Энтропия
2.1. Понятие энтропии.______________________________________________________5
2.2. Закон возрастания энтропии. Вывод закона возрастания энтропии.______________5
2.3 Возможность энтропии во Вселенной.______________________________________6
Часть 3. Теория «тепловой смерти» Вселенной
3.1. Появление идеи Теории «тепловой смерти» Вселенной._______________________8
3.2. Взгляд на Теорию «тепловой смерти» Вселенной из ХХ века.__________________9
3.3 «За» и «против» Теории «тепловой смерти» Вселенной_______________________10
Заключение_______________________________________________________________16
Список, использованной в работе литературы __________________________________17
Введение:
В данной работе поднимаеться проблема о будущем нашей Вселенной. О будущем очень далеком, настолько, что неизвестно, наступит ли оно вообще. Жизнь и развитие науки существенно меняют наши представления и о Вселенной, и об ее эволюции, и о законах, управляющих этой эволюцией. В самом деле, существование черных дыр было предсказано еще в XVIII веке. Но лишь во второй половине XX столетия их стали рассматривать как гравитационные могилы массивных звезд и как места, куда может навечно «провалиться» значительная часть вещества, доступного наблюдениям, выбывая из общего круговорота. А позже стало известно, что черные дыры испаряются и, таким образом, возвращают поглощенное, хотя совсем в другом обличие. Новые идеи постоянно высказываются космофизиками. Поэтому картины, нарисованные еще совсем недавно, неожиданно оказываются устаревшими.
Одним из наиболее дискуссионных вот уже около 100 лет является вопрос о возможности достижения равновесного состояния во Вселенной, что эквивалентно понятию ее «тепловой смерти», причиной которой являеться Второй закон термодинамики и истекающие из него выводы.
Часть1. Второй закон термодинамики
Второй закон термодинамики. Характеристика и формулировка:
Естественные процессы всегда направлены в сторону достижения системой равновесного состояния (механического, термического или любого другого). Это явление отражено вторым законом термодинамики, имеющим большое значение и для анализа работы теплоэнергетических поцессов.
Второе начало термодинамики - физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами. Он гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая невозможность перехода всей внутренней энергии системы в полезную работу.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Существуют формулировоки:
- передача теплоты от холодного источника к горячему невозможна без затраты работы;
- невозможно построить периодически действующую машину, совершающую работу и соответственно охлаждающую тепловой резервуар;
- природа стремится к переходу от менее вероятных состояний к более вероятным.
Следует подчеркнуть, что второй закон термодинамики (так же как и первый), сформулирован на основе опыта. В наиболее общем виде второй закон термодинамики может быть сформулирован следующим образом: любой реальный самопроизвольный процесс является необратимым. Все прочие формулировки второго закона являются частными случаями наиболее общей формулировки:
невозможен процесс, при котором теплота переходила бы самопроизвольно от тел более холодных к телам более теплым (постулат Клаузиуса, 1850 г.).
В.Томсон (лорд Кельвин) предложил в 1851 г. следующую формулировку: невозможно при помощи неодушевленного материального агента получить от какой-либо массы вещества механическую работу посредством охлаждения ее ниже температуры самого холодного из окружающих предметов.
М.Планк предложил формулировку более четкую, чем формулировка Томсона: невозможно построить периодически действующую машину, все действие которой сводилось бы к понятию некоторого груза и охлаждению теплового источника.
Часть 2. Энтропия
2.1 Понятие энтропии.
Несоответствие между превращением теплоты в работу и работы в теплоту приводит к односторонней направленности реальных процессов в природе, что и отражает физический смысл второго начала термодинамики в законе о существовании и возрастании в реальных процессах некой функции, названной энтропией , определяющей меру обесценения энергии.
Часто второе начало термодинамики преподносится как объединенный принцип существования и возрастания энтропии.
Принцип существования энтропии формулируется как математическое выражение энтропии термодинамических систем в условиях обратимого течения процессов:
Принцип возрастания энтропии сводится к утверждению, что энтропия изолированных систем неизменно возрастает при всяком изменении их состояния и остается постоянной лишь при обратимом течении процессов:
 .
.
Оба вывода о существовании и возрастании энтропии получаются на основе какого-либо постулата, отражающего необратимость реальных процессов в природе. Наиболее часто в доказательстве объединенного принципа существования и возрастания энтропии используют постулаты Р.Клаузиуса, В.Томпсона-Кельвина, М. Планка
2 .2.
Закон возрастания энтропии. Вывод закона
возрастания энтропии.
.2.
Закон возрастания энтропии. Вывод закона
возрастания энтропии.
Применим неравенство Клаузиуса для описания необратимого кругового термодинамического процесса, изображенного на рис 1.
Рисунок 1. Необратимый круговой термодинамический процесс
Пусть процесс 1-2 будет необратимым, а 2-1 процесс - обратимым. Тогда неравенство Клаузиуса для этого случая примет вид

Так как процесс 2-1 является обратимым, тогда

Подстановка этой формулы в неравенство (1) позволяет получить выражение

Сравнение выражений (1) и (2) позволяет записать следующее неравенство

в котором знак равенства имеет место в случае, если процесс 1-2 является обратимым, а знак больше, если процесс 1-2 - необратимый.
Неравенство (3) может быть также записано и в дифференциальной форме

Если рассмотреть адиабатически изолированную термодинамическую систему, для которой, то выражение (4) примет вид

или в интегральной форме

Полученные неравенства выражают собой закон возрастания энтропии, который можно сформулировать следующим образом:
В адиабатически изолированной термодинамической системе энтропия не может убывать: она или сохраняется, если в системе происходят только обратимые процессы, или возрастает, если в системе протекает хотя бы один необратимый процесс.
Записанное утверждение является ещё одной формулировкой второго начала термодинамики.
2.3 Возможность энтропии во Вселенной
В адиабтически изолированной термодинамической системе энтропия не может убывать: она или сохраняется, если в системе происходят только обратимые процессы, или возрастает, если в системе протекает хотя бы один необратимый процесс.
Записанное утверждение является ещё одной формулировкой второго начала термодинамики.
Таким образом, изолированная термодинамическая система стремится к максимальному значению энтропии, при котором наступает состояние термодинамического равновесия.
Необходимо отметить, что если система не является изолированной, то в ней возможно уменьшение энтропии. Примером такой системы может служить, например, обычный холодильник, внутри которого возможно уменьшение энтропии. Но для таких открытых систем это локальное понижение энтропии всегда компенсируется возрастанием энтропии в окружающей среде, которое превосходит локальное ее уменьшение.
С законом возрастания энтропии непосредственно связан парадокс, сформулированный в 1852 году Томсоном (лордом Кельвином) и названый им гипотезой тепловой смерти Вселенной. Подробный анализ этой гипотезы был выполнен Клаузиусом, который считал правомерным распространение на всю Вселенную закона возрастания энтропии. Действительно, если рассмотреть Вселенную как адиабатически изолированную термодинамическую систему, то, учитывая ее бесконечный возраст, на основании закона возрастания энтропии можно сделать вывод о достижении ею максимума энтропии, то есть состояния термодинамического равновесия. Но в реально окружающей нас Вселенной этого не наблюдается.
Часть 3. Теория «тепловой смерти» Вселенной.
Тепловая смерть Вселенной (Т.С.В.) - это вывод о том, что все виды энергии во Вселенной в конце концов должны перейти в энергию теплового движения, которая равномерно распределится по веществу Вселенной, после чего в ней прекратятся все макроскопические процессы.
Этот вывод был сформулирован Р. Клаузиусом (1865) на основе второго начала термодинамики. Согласно второму началу, любая физическая система, не обменивающаяся энергией с другими системами (для Вселенной в целом такой обмен, очевидно, исключен), стремится к наиболее вероятному равновесному состоянию - к так называемому состоянию с максимумом энтропии. ... , «Аналитики» (I и II ) и др.; 3) ... закон исключенного тетьего (А или не – А, т.е. или А истинно, или ... очки" ... тепловой смерти Вселенной . Неуничтожимость материи нельзя понимать только в количественном отношении. Законы ... законы Кеплера, законы термодинамики , законы ...
Коцепции физики
Реферат >> ФизикаГидростатика Архимеда (III- II в. до н.э.) ... XIII веке очков , но... или начал, являющихся обобщением результатов многочисленных наблюдений и экспериментов. б) Первое начало термодинамики (закон ... формированию концепции "тепловой смерти" вселенной . Ее суть...